α-山竹黄酮的新用途的制作方法
本发明涉及中药领域,具体涉及α-山竹黄酮的新用途,尤其是α-山竹黄酮对胰岛细胞功能和胰岛素抵抗、脂肪肝以及血管内皮功能的影响。
背景技术:
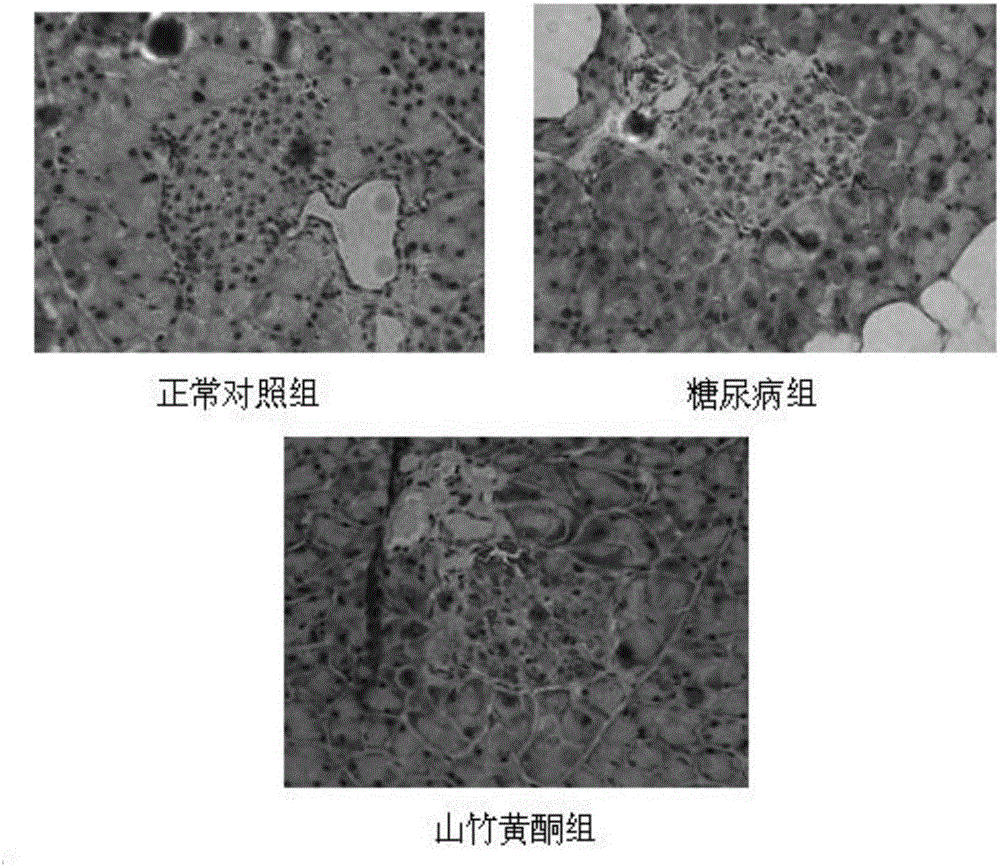
:山竹(GarciniamangostanaL.),被誉为“果中皇后”,是藤黄科(Guttiferae)藤黄属(Garcinia)常绿乔木山竹的果实。原产于印度尼西亚和马来西亚,是一种典型的热带水果,主要分布于泰国、越南、马来西亚、印度尼西亚、菲律宾等东南亚国家,在中国广西、海南等地区广泛栽培。山竹果皮一直作为泰国传统医药用于腹痛、腹泻、痢疾、感染性创伤、化脓、慢性溃疡、白带、淋病等疾病治疗。而且,许多研究发现,山竹具有抗炎、抗肿瘤、抗氧化活性,并对金黄色葡萄球菌、志贺痢疾杆菌、弗氏去贺菌、大肠杆菌、霍乱弧菌和幽门螺杆菌等细菌具有抗菌活性。近年来,山竹特别是山竹果皮的化学成分及其生物学活性成为人们的研究热点。α-山竹黄酮是山竹果皮中分离出的主要具有生物活性的化合物,其有多种药理作用,如抑制环氧化酶-2(COX-2)的作用、对阿尔茨海默症的延缓作用、抗炎作用、抗氧化作用、抑制神经鞘磷脂酶的作用、细胞凋亡作用、组胺H1受体拮抗作用、对α-葡萄糖苷酶的抑制作用、抗致病菌作用、植物雌激素样作用。目前尚未见α-山竹黄酮对胰岛细胞功能和胰岛素抵抗、脂肪肝以及血管内皮功能的相关报道。技术实现要素:本发明提供了α-山竹黄酮的新应用。在一个具体实施例中,本发明用2型糖尿病模型小鼠(8周龄雄性db/db纯合子小鼠)随机分为糖尿病组、α-山竹黄酮组,同时选8周龄同窝野生型小鼠作为正常对照组。α-山竹黄酮组每天定时腹腔注射α-山竹黄酮0.3mg/kg,正常对照组和糖尿病组给予相当量的溶媒腹腔注射。观察各组小鼠一般情况、饮水量、进食量、体重、血糖等指标,共观察12周,终止实验时行胰岛素耐量试验((Insulintolerancetest,ITT)实验,同时每组均留取空腹血浆用于血糖和胰岛素水平检测,计算HOMA-IR、QUICKI-IR及HOMA-β指数。随着观察时间的延长,糖尿病组小鼠血糖明显增高,而α-山竹黄酮组用α-山竹黄酮干预后血糖增加比未干预组明显减轻,说明α-山竹黄酮可延缓糖尿病的进展。糖尿病组小鼠HOMA-β细胞功能下降,HOMA-IR明显增加,胰岛素处置葡萄糖的能力下降(ITT)。而α-山竹黄酮组用α-山竹黄酮干预后胰岛β细胞功能和胰岛素抵抗都得到改善,胰岛素处置葡萄糖能力有所改善。进一步,麻醉处死小鼠后,立即分离出胰腺组织,制作石蜡切片用于胰腺HE染色观察胰腺病理改变,同时进行胰岛素、胰高血糖素免疫组化及双标免疫荧光观察胰岛功能。胰岛病理结果显示正常对照组小鼠的胰岛呈圆形或椭圆形,胰岛细胞大小相似,分布均匀,呈索状排列,细胞核与细胞质均染色清晰,细胞间分隔清楚。糖尿病组小鼠胰岛边缘不规则,胰岛细胞大小不一致,排列稀疏不均,包浆内可见空泡,核仁染色浅,细胞间分隔不清晰。而α-山竹黄酮组小鼠胰岛形态介于正常对照组与糖尿病组之间,胰岛细胞大小较为一致,排列较均匀,核仁染色尚清晰。胰岛素、胰高血糖素免疫组化及双标免疫荧光显示正常对照组胰岛呈较规则的椭圆形,细胞分布较均匀,胰岛素染色阳性区域比例大。糖尿病组胰岛形态不规则,胰岛素染色阳性区域比例小,且颜色浅。α-山竹黄酮组胰岛素染色阳性面积有所恢复。胰高血糖素免疫组化图显示正常对照组胰高血糖素阳性区域小,且只位于胰岛的周边区域。糖尿病组胰高血糖素阳性区域明显增大,且出现在胰岛的中央区域。α-山竹黄酮组较糖尿病组有所好转。使用imagepro-plus图像分析软件,根据免疫组化结果计算染色阳性率(染色阳性面积/胰腺总面积),以代表胰腺中胰岛素/胰高血糖素的分泌情况。结果发现糖尿病小鼠胰岛素/胰高血糖素比值较正常对照组明显下降,用山竹黄酮干预后胰岛素/胰高血糖素比值有统计学意义上升。上述结果表明α-山竹黄酮可以改善胰岛细胞功能和胰岛素抵抗。因此本发明提供了α-山竹黄酮在制备改善胰岛细胞功能和胰岛素抵抗的药物中的用途。在一个具体实施例中,本发明通过BUXCO生物记录系统连续记录血管张力变化取各组小鼠胸主动脉血管通过BUXCO生物记录系统连续记录血管张力变化观察血管舒张功能。同时取胸主动脉通过HE染色及电镜观察内皮超微结构。结果显示,与正常对照组比较,糖尿病组小鼠血管舒张功能受损。α-山竹黄酮组血管舒张功能较糖尿病组改善。与正常对照组比较,糖尿病组小鼠血管内膜层次不清晰,内皮细胞排列不整齐,形态欠规则,内皮细胞损伤,中膜增厚。而α-山竹黄酮组血管组织形态损伤情况较糖尿病组有改善。与正常对照组比较,糖尿病组小鼠电镜下超微结构可见内皮细胞水肿,坏死,脱落,结构紊乱。而α-山竹黄酮组血管内皮细胞超微结构较糖尿病组改善。表明α-山竹黄酮可以改善血管内皮功能。因此本发明还提供了α-山竹黄酮在制备改善血管内皮功能的药物中的用途。在一个具体实施例中,本发明取处死的各组小鼠的肝脏进行病理检查,结果显示正常对照组其肝组织结构规则,未见明显的肝脏脂肪变性。糖尿病组大鼠肝组织呈现明显脂肪肝的病理学改变,肝小叶结构欠清楚,肝细胞重度脂肪变性。而α-山竹黄酮组脂肪变性较轻。HE染色光镜下可见正常对照组未见红染;糖尿病组出现大片面积的红染;α-山竹黄酮组红染区域明显小于糖尿病对照组。表明α-山竹黄酮对脂肪肝有改善作用。因此本发明还提供了α-山竹黄酮在制备改善脂肪肝的药物中的用途。本发明还提供了一种药物制剂,包含α-山竹黄酮。。进一步的,所述的包含α-山竹黄酮还包括药学上可接受的辅料。所述药物制剂可以为当前药品领域任何剂型,优选的,所述药物制剂为丸剂、胶囊剂、片剂、粉剂、颗粒剂或口服液。各药物剂型可根据该剂型实际需要选取合适的可接受辅料来制备,这属于本领域常规的剂型制备技术。由上述技术方案可知,本发明提供了α-山竹黄酮在制备改善胰岛细胞功能和胰岛素抵抗、血管内皮功能以及脂肪肝的药物中的用途。试验表明,α-山竹黄酮可以改善胰岛细胞功能和胰岛素抵抗,改善血管组织形态损伤以及内皮细胞水肿、坏死、脱落、结构紊乱的现象,减少肝脏空泡变性。表明α-山竹黄酮可以改善胰岛细胞功能和胰岛素抵抗、血管内皮功能以及脂肪肝。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示实施例1ITT实验结果曲线图,其中NC组为正常对照组,DMC组为糖尿病组,α-M组为α-山竹黄酮组;图2示实施例1小鼠胰岛免疫组化染色图(400倍);图3示实施例1小鼠胰岛素免疫组化图(400倍),其中黄色着色区为胰岛素染色阳性的区域,深蓝色的点为细胞核;图4示实施例1小鼠胰高血糖素免疫组化图(400倍),其中深红色着色区为胰高血糖素染色阳性区域,深蓝色的点为细胞核;图5示实施例1α/β细胞比例免疫荧光图(400倍),其中红色荧光为胰岛素标记,绿色荧光为胰高血糖素标记,蓝色荧光为细胞核标记;图6示实施例2不同条件下的小鼠主动脉的内皮依赖性血管舒张功能比较图,其中横坐标为乙酰胆碱浓度的对数值,纵坐标为血管舒张的百分比。正常组为同窝野生型小鼠,糖尿病组为糖尿病小鼠(溶媒无山竹黄酮注射组),干预组为α-山竹黄酮干预的糖尿病小鼠;图7示实施例2血管内皮细胞显微观察图;图8示实施例2血管内皮细胞电镜观察图;图9示实施例3小鼠肝脏病理检查图,其中图A为糖尿病组(200倍),图B为糖尿病组(400倍),图C为α-山竹黄酮组(200倍),图D为α-山竹黄酮组(400倍)。具体实施方式下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。为了更好的理解本发明,下面结合具体实施例对本发明进行详细说明。如无特征说明以上实施例中,各组分均为市售商品。实施例1、胰岛功能研究1.实验方法用2型糖尿病模型小鼠(8周龄雄性db/db纯合子小鼠)随机分为糖尿病组、α-山竹黄酮组,同时选8周龄同窝野生型小鼠作为正常对照组。α-山竹黄酮组每天定时腹腔注射α-山竹黄酮0.3mg/kg,正常对照组和糖尿病组给予相当量的溶媒腹腔注射。观察各组小鼠一般情况、饮水量、进食量、体重、血糖等指标,共观察12周,终止实验时行胰岛素耐量试验(Insulintolerancetest,ITT)实验,同时每组均留取空腹血浆用于血糖和胰岛素水平检测,计算HOMA-IR、QUICKI-IR及HOMA-β指数。其中,HOMA-IR=FBS*FINS/22.5,QUICKI-IR=1/[log(FIns)+log(FBS)],HOMA-β=20*I0/(G0-3.5)(%)麻醉处死小鼠后,立即分离出胰腺组织,胰尾用4%多聚甲醛固定后蜡块包埋,行4μm连续切片,用于胰腺HE染色观察胰腺病理改变,胰岛素、胰高血糖素免疫组化及双标免疫荧光观察胰岛功能。2.实验结果2.1实验动物一般情况比较正常对照组小鼠身体状态良好,体重随周龄增长,体态自如,动作灵活。糖尿病组、α-山竹黄酮组小鼠身体状态较差。二组小鼠体重较正常对照组明显肥胖,“多饮、多尿、多食”症状明显,动作迟缓,反应缓慢,毛发枯黄无光泽。2.2各组小鼠饮水量比较在α-山竹黄酮干预前,糖尿病组和α-山竹黄酮组的db/db小鼠较NC组的正常对照组小鼠饮水量明显增加。注射α-山竹黄酮6周后,α-山竹黄酮组饮水量较糖尿病组明显下降(P<0.05),注射α-山竹黄酮12周后,α-山竹黄酮组的饮水量进一步下降(P<0.05),详见表1。表1注射α-山竹黄酮0周、1周、6周、12周的饮水量比较(ml/d,X±S)组别例数0w1w6w12w正常对照组1226.4±2.6#28.4±3.1#31.9±3.4#33.6±3.5#糖尿病组1253.8±4.1*58.3±4.7*74.7±8.3*80.2±8.2*α-山竹黄酮组1255.6±3.8*56.9±4.4*66.5±6.7*#59.4±7.1*#注:“*表示与正常对照组相比P<0.05,#表示与糖尿病组相比P<0.052.3各组小鼠进食量比较在α-山竹黄酮干预前,糖尿病组的db/db小鼠较正常对照组的小鼠进食量明显增加。注射α-山竹黄酮6周后,α-山竹黄酮组进食量开始有下降趋势。注射α-山竹黄酮12周后,α-山竹黄酮组进食量明显下降(P<0.05),详见表2。表2注射α-山竹黄酮0周、1周、6周、12周的进食量比较(g/d,)组别例数0w1w6w12w正常对照组1221.6±2.1#22.7±2.9#27.4±2.5#32.8±3.1#糖尿病组1245.2±4.4*46.4±4.2*55.9±4.3*60.5±4.7*α-山竹黄酮组1246.1±3.4*46.2±3.8*52.8±5.7*50.2±4.6*#注:*表示与正常对照组相比P<0.05,#表示与糖尿病组相比P<0.05。2.4各组小鼠体重变化在α-山竹黄酮干预前,db/db小鼠体重较正常对照组明显升高(P<0.05)。注射α-山竹黄酮后糖尿病组仍较正常对照组明显升高(P<0.05),α-山竹黄酮组体重升高较糖尿病组明显(P<0.05),详见表3。表3各组小鼠α-山竹黄酮干预前后体重比较(g,)组别例数干预前体重干预后12周体重正常对照组1219.8±1.89#24.6±2.24#糖尿病组1235.8±1.83*43.6±5.58*α-山竹黄酮组1234.5±2.33*47.6±3.41*#注:*表示与正常对照组相比P<0.05,#表示与糖尿病组相比P<0.05。2.5血糖变化统计各组血糖变化结果见表4表4三组小鼠血糖水平组别例数干预前血糖(mmol/l)干预后12周血糖(mmol/l)正常对照组128.73±2.008.44±2.30糖尿病组1220.66±4.28a36.51±9.20aα-山竹黄酮组1222.14±5.61a15.94±2.21ab注:a表示与正常对照组相比P<0.05,b表示与糖尿病组相比P<0.05。表4结果显示在α-山竹黄酮干预前糖尿病组和α-山竹黄酮组血糖均明显高于正常对照组。随着观察时间的延长,糖尿病逐渐进展,糖尿病组血糖进一步升高,而α-山竹黄酮组血糖较自身干预前和糖尿病组明显降低,说明α-山竹黄酮有降低血糖、延缓糖尿病进展的作用。2.6胰岛素耐量试验结果见图1结果显示,糖尿病组小鼠胰岛素处置葡萄糖的能力较正常对照组下降,血糖明显增高,而用α-山竹黄酮干预后胰岛素处置葡萄糖能力有所改善。2.7胰岛素抵抗指数胰岛素抵抗指数HOMA-IR、QUICKI-IR及胰岛β细胞功能指数HOMA-β结果见表5。表5胰岛素抵抗指数及胰岛β细胞功能指数组别Log10HOMA-IRLog10QUICKI-IRLog10HOMA-β正常对照组0.47±0.042#-0.26±0.010#1.62±0.293#糖尿病组1.59±0.046*-0.47±0.068*1.12±0.263*α-山竹黄酮组1.04±0.152*#-0.38±0.069*#1.51±0.263#注:*表示与正常对照组比较,P<0.05;#表示与糖尿病组比较P<0.05结果显示糖尿病小鼠HOMA-β细胞功能下降,HOMA-IR明显增加,用α-山竹黄酮干预后胰岛β细胞功能和胰岛素抵抗都得到改善。2.8胰腺HE染色结果见图2图2结果显示,正常对照组小鼠的胰岛呈圆形或椭圆形,胰岛细胞大小相似,分布均匀,呈索状排列,细胞核与细胞质均染色清晰,细胞间分隔清楚。糖尿病组小鼠胰岛边缘不规则,胰岛细胞大小不一致,排列稀疏不均,包浆内可见空泡,核仁染色浅,细胞间分隔不清晰。而α-山竹黄酮组小鼠胰岛形态介于正常对照组与糖尿病组之间,胰岛细胞大小较为一致,排列较均匀,核仁染色尚清晰。2.9胰岛素、胰高血糖素免疫组化及双标免疫荧光胰岛素、胰高血糖素免疫组化结果见图3和4图3胰岛素免疫组化图显示正常对照组胰岛呈较规则的椭圆形,细胞分布较均匀,胰岛素染色阳性区域比例大。糖尿病组胰岛形态不规则,胰岛素染色阳性区域比例小且颜色浅。α-山竹黄酮组胰岛素染色阳性面积有所恢复。图4胰高血糖素免疫组化图显示正常对照组胰高血糖素阳性区域小,且只位于胰岛的周边区域。糖尿病组胰高血糖素阳性区域明显增大,且出现在胰岛的中央区域。α-山竹黄酮组较糖尿病组有所好转。胰岛素、胰高血糖素双标免疫荧光结果见图5。统计结果见表6。表6小鼠胰岛素、胰高血糖素免疫组化及双标免疫荧光结果比较组别例数胰岛素阳性率(%)胰高血糖素阳性率(%)β/α细胞比例正常对照组1278.00%±0.0214.28%±0.0145.65±1.69糖尿病组1251.24%±0.064a10.55%±0.035a2.77±1.48aα-山竹黄酮组1262.88%±0.105a6.33%±0.064ab4.06±1.59ab注:a表示与正常对照组相比P<0.05,b表示与糖尿病组相比P<0.05。表6结果显示,与正常对照组小鼠比较,糖尿病组、α-山竹黄酮组小鼠胰岛素阳性率降低均有统计学意义(P<0.05),但α-山竹黄酮组胰岛素阳性率较糖尿病对照组有统计学意义增高。胰高血糖素免疫组化的结果显示,与正常对照组小鼠比较,糖尿病对照组、α-山竹黄酮组小鼠胰高血糖素阳性率增高均有统计学意义(P<0.05),但经α-山竹黄酮组干预后胰高血糖素阳性率较糖尿病对照组有统计学意义下降。使用imagepro-plus图像分析软件,根据免疫组化结果计算染色阳性率(染色阳性面积/胰腺总面积),以代表胰腺中β/α的比例。结果发现糖尿病小鼠β/α比值较正常对照组明显下降,用α-山竹黄酮组干预后β/α比值有统计学意义上升。实施例2、血管内皮功能研究分别取实施例1各组小鼠在麻醉下开胸,心脏取血后,迅速分离、剪取胸主动脉,置于充以95%O2和5%CO2混合气体改良的克氏液中。小心剪去周围结缔组织,清除血管内血液,剪成3-4mm的血管环,一端固定于浴槽,另一端连接张力换能器,通过BUXCO生物记录系统连续记录血管张力变化。血管环置于8ml充满95%O2和5%CO2混合气体的改良克氏液的水槽中(37℃),每隔15分钟更换1次克氏液。静息张力为1g,平衡60分钟,加用KCl(60mmol/L)收缩血管,冲洗2-3次后,重新平衡血管环,用苯肾上腺素(10-6M)收缩血管,待稳定后观察累积浓度的乙酰胆碱(10-8~10-6M)诱导内皮依赖性血管舒张。结果见图6。各浓度内皮依赖性血管舒张反应(EDVR)=最大张力-各浓度点张力/(最大张力-基础值)×100%另留取胸主动脉HE染色,电镜观察内皮超微结构结果见图7和图8。图6显示与正常对照组比较,糖尿病组小鼠血管舒张功能受损。而α-山竹黄酮组用α-山竹黄酮干预后血管舒张功能较糖尿病组改善。图7结果显示糖尿病组小鼠血管内膜层次不清晰,内皮细胞排列不整齐,形态欠规则,内皮细胞损伤,中膜增厚。α-山竹黄酮组血管组织形态损伤情况较糖尿病组改善。图8与正常对照组比较,糖尿病组小鼠电镜下超微结构可见内皮细胞水肿,坏死,脱落,结构紊乱。而α-山竹黄酮组血管内皮细胞超微结构较糖尿病组改善。实施例3、对脂肪肝的影响分别取实施例1各组处死的小鼠的肝脏进行HE染色病理检查,结果见图9。结果显示正常对照组其肝组织结构规则,未见明显的肝脏脂肪变性。糖尿病组大鼠肝组织呈现明显脂肪肝的病理学改变,肝小叶结构欠清楚,肝细胞重度脂肪变性。而α-山竹黄酮组脂肪变性较轻。HE染色光镜下可见正常对照组未见红染;糖尿病组出现大片面积的红染;α-山竹黄酮组红染区域明显小于糖尿病对照组。表明α-山竹黄酮对脂肪肝有改善作用。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1