一种天然单萜类莰复合酯的用途的制作方法
本发明涉及一种单萜类莰复合酯,尤其是涉及一种天然单萜类莰复合酯的用途。
背景技术:
化合物Tschimganine,是一种可以从伞形科阿魏属植物Ferula tschimganica的根部提取出来的单萜类莰复合酯,分子式为C18H24O4,结构式如下:
有报道表明,Tschimganine具有对金黄色葡萄球菌(Staphylococcus aureus 209)、大肠杆菌(Escherichia coli WF+)和白色念珠菌(Candida albicans 562)具有抗菌功能。其它Tschimganine化合物的功能有待继续探索(Trusheva B,Todorov I,Ninova M,Najdenski H,Daneshmand A,Bankova V.Antibacterial mono-and sesquiterpene esters of benzoic acids from Iranian propolis.Chem Cent J.2010;4:8)。
糖尿病、胰岛素抵抗、肥胖症、高血脂、心血管疾病、肝损伤、肝硬化、炎症、肿瘤、肾病等疾病严重危害人类的健康和生命,发现治疗这些疾病的新药将具有重要的社会价值和巨大的经济价值。
技术实现要素:
本发明的目的在于提供一种天然单萜类莰复合酯的用途。
所述天然单萜类莰复合酯为化合物Tschimganine,分子式为C18H24O4,结构式如下:
所述Tschimganine可在制备预防和治疗糖尿病、胰岛素抵抗疾病、肥胖症、脂肪肝、肝硬化、高血脂、心血管疾病、肝损伤、高血糖症、高甘油三酯血症、炎症、肿瘤、肾病的药物或保健品中应用。
所述肝损伤可以包括但不限于由于服用有肝损伤副作用药物引起的肝损伤、由于酒精引起的急性肝损伤、由酒精性脂肪肝引起的肝损伤、免疫性或化学性因素引起的肝损伤、病毒感染引起的肝损伤;所述有肝损伤副作用药物包括但不限于以对乙酰氨基酚为主要活性成分的药物。
所述糖尿病可以包括但不限于具有高血糖症状的糖尿病。
所述胰岛素抵抗疾病可以包括但不限于具有高胰岛素血症的胰岛素抵抗疾病。
所述肥胖症可以包括但不限于具有高血脂、高血糖症状的肥胖症。
所述脂肪肝可以包括但不限于非酒精性脂肪肝和/或具有高血脂症状的脂肪肝。
所述肝硬化可以包括但不限于具有肝脏胶原过度沉积和肝纤维化表现的肝硬化。
所述心血管疾病可以包括但不限于具有高血糖、高甘油三酯血症和高自由脂肪酸血症的心血管疾病。
所述炎症可以包括但不限于由于服用有炎症反应副作用药物所引起的炎症、由于酒精引起的急性肝炎、由酒精性脂肪肝引起的肝炎、由非酒精性脂肪肝引起的肝炎、病毒性肝炎、由细菌引起的炎症、由于糖尿病或肥胖症并发症引起的肝炎或肾炎,所述有炎症反应副作用药物包括但不限于对乙酰氨基酚为主要活性成分的药物。
所述肿瘤可以包括但不限于直结肠癌、前列腺癌、宫颈癌、肝癌、乳腺癌、白血病。
所述肾病可以包括但不限于有血尿素氮水平异常表现的肾脏疾病、各种肾实质性病变、尿毒症;所述肾实质性病变可以包括但不限于肾小球肾炎、间质性肾炎、急慢性肾功能衰竭、肾内占位性和破坏性病变等肾实质性病变。
所述Tschimganine可作为活性成份与其它药物或制药中可以接受的赋形剂/或给药载体混合后组成的药物组合物。
所述预防和治疗糖尿病、胰岛素抵抗疾病、肥胖症、脂肪肝、肝硬化、高血脂、心血管疾病、肝损伤、高血糖症、高甘油三酯血症、炎症、肿瘤、肾病的药物可采用口服型制剂或注射型制剂,所述口服型制剂可采用片剂、丸剂、胶囊、冲剂或糖浆等;所述注射型制剂可采用注射液或冻干粉针剂型等。
本发明利用肝损伤模型小鼠证明Tschimganine的肝脏保护和修复功能。本发明给C57B6/J小鼠腹腔注射Tschimganine,然后注射过量对乙酰氨基酚(N-acetyl-para-aminophenol,缩写 为APAP)引起肝损伤,24h后检测结果。结果表明,在对照组表现出严重肝损伤的情况下,注射了Tschimganine的实验组小鼠肝脏形态和肝功能未表现明显损伤现象。表明Tschimganine在肝损伤方面具有优秀的治疗和预防功能。
实验证明,Tschimganine在治疗糖尿病、胰岛素抵抗、肥胖症、脂肪肝、高血脂、心血管疾病等疾病方面的作用。利用高脂饲料喂养的糖尿病、肥胖症模型小鼠,腹腔注射Tschimganine一定时间后,检测代谢相关指标。结果表明,相比空白对照,Tschimganine处理的模型小鼠血清中葡萄糖、胰岛素、甘油三酯和自由脂肪酸的水平明显降低,药物处理的模型小鼠肝脏组织中与这些代谢相关的基因表达水平表明Tschimganine是通过调节这些代谢相关基因来调节这些代谢指标的。表明Tschimganine在治疗糖尿病、胰岛素抵抗、高血糖、肥胖症、脂肪肝、高血脂、心血管疾病等代谢性疾病方面具有良好疗效。
实验证明,在小鼠模型上证明Tschimganine在炎症方面的治疗作用。利用不同模型小鼠,检测Tschimganine处理后小鼠肝脏、肾脏、脂肪等组织中炎症因子的水平,结果表明,在模型小鼠中,相比空白对照处理的小鼠,腹腔注射了Tschimganine的小鼠组织中炎症因子的基因表达水平显著降低。在APAP诱导的肝损伤小鼠模型试验结果也表明Tschimganine能抑制由化学药物引起的炎症。表明Tschimganine在炎症治疗方面具有很好的功能。
实验证明,Tschimganine在抑制肿瘤细胞生长的作用。用Tschimganine处理肿瘤细胞后,检测肿瘤细胞的存活率。结果表明,用Tschimganine处理过的多种肿瘤细胞在96h的存活率明显低于空白对照处理的细胞。并且随着药物浓度的增加,抑制肿瘤细胞生长的效果越显著。表明Tschimganine在治疗肿瘤方面的功效。
实验证明,Tschimganine在肾脏功能上的作用。血尿素氮是肾功能主要指标之一,血尿素氮过高,预示各种肾实质性病变,如肾小球肾炎、间质性肾炎、急慢性肾功能衰竭、肾内占位性和破坏性病变以及尿毒症等。小鼠实验结果显示Tschimganine具有降低血尿素氮水平的作用,表明Tschimganine具有治疗肾脏疾病和保护肾脏功能的作用。
实验证明,Tschimganine能下调肝脏中肝纤维化的标志基因的表达,能减缓肝脏炎症反应,降低肝纤维化标志基因表达,能有效消除肝脏中胶原的积累,表明Tschimganine对肝硬化的治疗功能。
Tschimganine是从植物中提取的天然产物,迄今为止未见任何有关其在制药方面的报道。因此本发明给出Tschimganine在肝损伤、糖尿病、胰岛素抵抗、肥胖症、脂肪肝、肝硬化、高血脂、炎症、肿瘤、肾病等疾病方面具有治疗功能,都是关于Tschimganine在制备治疗这些疾病的药物制剂中的新功能。具有很好的创新性。
Tschimganine最初是从伞形科阿魏属植物中提取出来的天然产物,已经是商业化的产品,容易获得药物原材料。肝损伤、糖尿病、胰岛素抗性、肥胖症、脂肪肝、高血脂、心血管疾病、炎症、肿瘤、肾病等疾病是影响人类健康和生命的重大疾病,因此,本发明给出这种已经商业化的化合物Tschimganine在制备治疗这些重大疾病的药物制剂方面的实用功能,具有重要的社会价值和巨大的经济价值。
在一些实施方案中,本发明所述方法中的化合物可配制成药物组合物在一些给药方案中应用。本发明药物的组合物可包含所述化合物自身和其给药可用的盐或给药载体。这样的组合物还可选择性地包含其它治疗剂。
“给药载体”一词指可与本发明化合物一起用于病人且不破坏其药理学活性的无毒药物载体。上述药物组合物中的可用给药载体包括但不限于:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白如人血清白蛋白,缓冲介质如磷酸盐,甘氨酸,山梨酸,山梨酸钾,饱和植物脂肪酸的部分甘油酯混合物,水,盐或电解质如硫酸鱼精蛋白,磷酸氢二钠,磷酸氢钾,氯化钠,锌盐,胶体二氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素制剂,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜡,聚乙烯-聚氧丙烯嵌段聚合物,羊毛脂和自乳化药物递送系统如α生育酚、聚乙二醇1000琥珀酸酯,或其它类似的聚合物递送模式。
本发明所用的“代谢性疾病”指与代谢相关的任何疾病或紊乱症。例如,代谢疾病包括但不限于:高血糖症、胰岛素抵抗、高脂血症、高胆固醇血症、糖尿病、肥胖症、代谢综合征、代谢紊乱及相关疾病、肝脏的疾病(肝疾病)、脂肪肝疾病(肝脂质沉着症)、非酒精性脂肪肝疾病、肝炎、非酒精性脂肪性肝炎、肝硬化、肝纤维化、慢性和急性肝功能衰竭、胆汁性肝硬化、原发性硬化性胆管炎、胆汁淤积、胆石动脉粥样硬化、炎症、癌症,以及上述疾病的的共发症。
在某些仅以此处所述化合物作为其活性成分的药物组合物中,其给药方法还可包括用其他的药剂或疗法对所述受试者进行治疗。这样的药剂疗法包括但不限于:贫血症治疗,糖尿病疗法,高血压治疗,胆固醇疗法,神经药物,调节心血管功能的药物,调节炎症、免疫功能、血细胞生成的药物;激素和拮抗剂,影响胃肠功能、微生物疾病的化学治疗药物,和/或肿瘤疾病的化学治疗。
某些药剂或疗法可与本发明所述化合物进行联合给药,如基质金属蛋白酶抑制剂、脂氧合酶抑制剂、细胞因子拮抗剂、免疫抑制剂、细胞因子、生长因子、免疫调节剂、前列腺素或抗血管过度增生化合物。
本发明所用术语“组合”及其相关词汇依次对应的是治疗剂与本发明化合物是同时或按顺 序施用的。例如,所述某化合物可以同时或相继与另一治疗剂在单一单位剂型中施用。因此,本发明提供一种单一单位剂型,包含所述化合物、一种额外的治疗剂。在许多给药方案中,当患者或个体同时暴露于两种或更多药剂时,如果患者或个体在某个特定靶组织或样本(例如,在脑部,在血清等)同时显示出所用试剂的相关治疗效果,通常认为它们是以“组合”的形式发挥作用的。
如若这些化组合物是本发明化合物的药学可用盐制品,那用到的盐应优先来自无机或有机酸和碱。酸性盐包括:乙酸盐、己二酸盐、藻酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、草酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸、甲苯磺酸盐和十一酸盐。碱盐包括铵盐、碱金属盐(如钠和钾盐)、碱土金属盐(如钙和镁盐)与有机碱盐(如二环己基胺盐、N-甲基-D-葡糖胺盐、或带有氨基酸如精氨酸、赖氨酸等的盐)。
本发明所述化合物组合物还可包括,依赖所需制剂的、可药用的无毒载体或稀释剂。通常将其定义为配制动物或人用的药物组合物的媒介物。应选择合适的稀释剂从而不影响组合物的生物学活性。这样的稀释剂有:蒸馏水、生理磷酸缓冲盐溶液、林格氏溶液、葡萄糖溶液和Hank氏溶液。此外,药物组合物或制剂还可包括其他载体、佐剂、或无毒的非治疗性非免疫原性的稳定剂等。
本发明所述化合物组合物还可包括,润湿剂、乳化剂和润滑剂,如十二烷基硫酸钠和硬脂酸镁,以及着色剂、释放剂、包衣剂、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可存在于组合物中。可药用的抗氧化剂包括:水溶性抗氧化剂,如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等;油溶性抗氧化剂,如抗坏血酸棕榈酸酯、丁基化羟基苯甲醚(BHA)、丁基羟基甲苯(BHT)、卵磷脂、棓酸丙酯、α-生育酚等;和金属螯合剂,如柠檬酸、乙二胺四乙酸(EDTA)、山梨醇、酒石酸、磷酸等。
本发明的药物组合物可配制成固体或液体的形式。包括以下适合的给药形式:(1)口服给药,如灌药剂(水性或非水性溶液或悬浮液),片剂,颊、舌下和全身吸收剂,大丸剂,散剂,颗粒剂,舌下用的糊剂;(2)肠胃外给药,制备为无菌溶液或悬浮液或持续释放剂,通过皮下、肌内、静脉内或硬膜外注射;(3)局部应用,如乳膏,软膏,用于皮肤、肺或口腔的释放受控贴剂或喷雾剂;(4)直肠内给药,如作为乳剂或泡沫;(5)其他:舌下含服,眼 用,经皮或经鼻、肺和其它粘膜摄入。
所述化合物的药物组合物的制备方法包括用任意工序将本发明化合物与载体或多种辅助成分组合。通常情况下,可将本发明化合物与载体(液体载体、细碎固体载体或两者均有)均匀紧密地组合制备,且根据需要将产物赋形。
某些情况中,可通过减缓药物从皮下或肌肉注慢吸收的速度以延长药效。可以通过制备水溶性差的结晶或无定形物质的液体悬浮液来实现这一目的。药物的吸收速率取决于其溶解速度,其溶解速率又可能取决于晶体大小和结晶形式。或者,通过将药物溶解或悬浮于油性载体中以延迟胃肠外给药吸收。
可通过将所述化合物与微囊基质中可生物降解的聚合物(如聚丙交酯-聚乙交酯)结合制成其可注射药物储库剂型。根据药物与聚合物的比例及所用特定聚合物的性质,可控制药物释放的速率。其它可生物降解的聚合物包括聚原酸酯和聚酸酐。也可通过将药物包埋在脂质体或微乳中,以制备与身体组织相容的可注射药物储库剂型。
本发明的药物成分可以任意口服可接受剂型口服给药,剂型包括但不限于:胶囊,片剂,以及水悬浮液和溶液。对于口服片剂而言,其常用包膜有乳糖和玉米淀粉,通常还会加入润滑剂,如硬脂酸镁。对于口服胶囊制剂而言,可用的稀释剂包括乳糖和干燥的玉米淀粉。当以水悬浮液和溶液及丙二醇制剂口服给药时,药物活性成分与乳化剂和悬浮剂结合。如有需要,可加入某些甜味剂和/或调味剂和/或着色剂。
本发明描述的适合口服给药的剂型可以是胶囊剂,扁囊剂,丸剂,片剂,锭剂(通常用蔗糖和阿拉伯胶或黄蓍胶作为矫味物质),粉剂,颗粒剂,或溶于水性或非水性液体中制成溶液或悬浮液,或作为油包水或水包油液体乳剂,或作为酏剂或糖浆,或作为软锭剂(使用惰性基质,如明胶和甘油或蔗糖和阿拉伯胶)和/或漱口等方式。各种剂型含有预定量的本发明化合物作为其活性成分之一。本发明所述的化合物也可以大丸剂、药糖剂或糊剂使用。
本发明化合物口服给药的液体剂型包括可药用的的乳剂、微乳剂、溶液、悬浮液、糖浆和酏剂。除活性成分外,液体剂型还可含有在本领域中通常使用的惰性稀释剂,诸如水或其它溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯醇、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油类(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃醇、聚乙二醇和脂肪酸酯山梨糖醇,以及它们的混合物。
当本发明的药物组合物对目标治疗区域或器官通过局部施用更易起效时,即可选择这种给药方式。为了局部施用于皮肤,可将活性组分悬浮或溶解在给药载体中,再将此药物组合物配制成软膏剂。本发明化合物的局部给药载体包括但不限于:矿物油、液体石油、白石油、 丙二醇、聚氧乙烯聚氧丙烯化合物、乳化蜡和水。或者,可将活性化合物悬浮或溶解于载体中,再将该药物组合物制成适当的洗剂或霜剂,这类载体包括但不限于:矿物油、脱水山梨醇单硬脂酸酯、聚山梨醇酯60、鲸蜡酯、鲸蜡硬脂醇、2-辛基十二烷醇、苯甲醇和水。本发明的药物组合物还可通过制成直肠栓剂或适当的灌肠制剂局部应用于下肠道。本发明还包括将化合物制备成局部给药透皮贴剂。
可通过将本发明的药物成分制成气雾剂或吸入剂给药。这样的药剂可根据制药配方领域中广泛应用的技术制备,也将其制备为盐水溶液。这类现有技术常使用苄醇或其它适当的防腐剂、碳氟化合物和/或其他增溶剂或分散剂、吸收促进剂以提高其生物利用率。
透皮贴剂的额外优势是实现本发明化合物对机体的受控递送。可将该化合物溶解或分散在适当的介质中制作这种剂型。可以用吸收增强剂增加皮肤对化合物的吸收。也可通过采用速率控制膜或者将化合物分散于聚合物基质或凝胶中的方式,实现化合物通过皮肤速率的控制。
附图说明
图1为小鼠肝脏切片HE染色表明Tschimganine能修复APAP诱导的肝损伤。
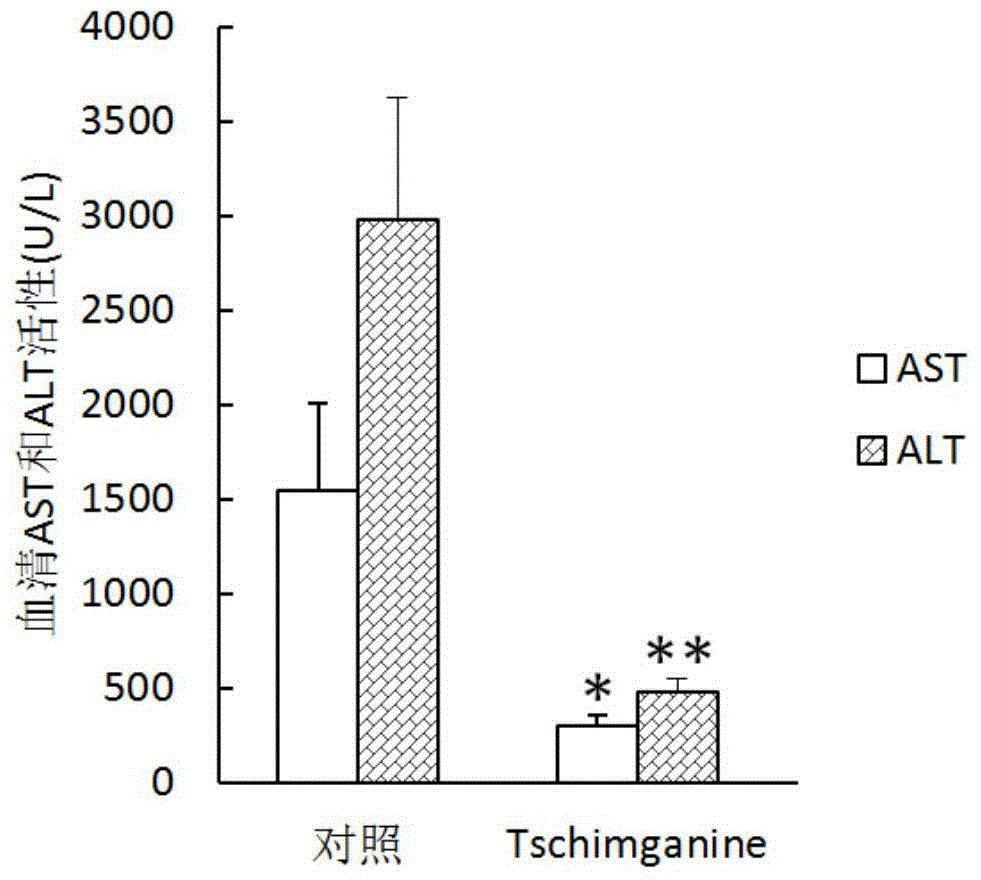
图2为Tschimganine处理能降低APAP诱导肝损伤的小鼠血清中的AST和ALT活性。
图3为Tschimganine处理能降低APAP诱导肝损伤的小鼠血清中LDH活性。
图4为Tschimganine处理能提高APAP诱导肝损伤的小鼠肝脏中GSH水平。
图5为Tschimganine处理能调节APAP诱导肝损伤的小鼠中与肝修复相关的基因表达水平。
图6为Tschimganine处理能降低KK-Ay小鼠血清葡萄糖水平。
图7为Tschimganine处理能降低KK-Ay小鼠血清自由脂肪酸水平。
图8为Tschimganine处理能降低KK-Ay小鼠血清甘油三酯水平。
图9为Tschimganine处理能降低KK-Ay小鼠肝脏组织中脂肪的积累。
图10为Tschimganine处理能调节KK-Ay小鼠肝脏中糖脂代谢相关基因的表达水平。
图11为Tschimganine处理能降低db/db小鼠血清葡萄糖水平。
图12为Tschimganine处理能降低db/db小鼠血清胰岛素水平。
图13为Tschimganine处理能下调db/db小鼠血尿素氮水平。
图14为Tschimganine能抑制小鼠肝脏由于APAP引起的炎症反应。
图15为Tschimganine处理能抑制db/db小鼠白色脂肪组织中炎症因子的水平。
图16为Tschimganine处理能抑制KK-Ay小鼠肾脏组织中炎症因子的水平。
图17为Tschimganine处理能降低人结直肠腺癌细胞HCT15细胞的存活率。
图18为Tschimganine处理能降低人前列腺癌细胞LNCaP细胞的存活率。
图19为Tschimganine处理能降低人宫颈癌细胞Hela细胞的存活率。
图20为Tschimganine处理能降低人肝癌细胞HepG2细胞的存活率。
图21为Tschimganine处理能降低人乳腺癌细胞MCF-7细胞的存活率。
图22为Tschimganine处理能降低小鼠单核巨噬细胞白血病细胞Raw264.7细胞的存活率。
图23为Tschimganine能下调肝脏中肝纤维化标志基因的表达。
图24为Masson染色显示Tschimganine能减少小鼠肝脏胶原沉积。
在图1~16和23中,*表示p<0.05,**表示p<0.01,***表示p<0.001。
具体实施方式
实施例一:Tschimganine的肝脏保护和修复功能试验。
试验方法:过量服用APAP致小鼠急性药物性肝损伤模型是研究保肝药物常用的模型之一,APAP是通过活性氧或活性氮引起药物性肝损伤的典型代表物。APAP过量使用会引起肝脏活性氧增多,过量消耗体内还原态物质如GSH导致体内GSH水平下降,谷草转氨酶AST、谷丙转氨酶ALT和乳酸脱氢酶LDH等活性上升,导致肝脏组织炎症或坏死。本实施例即采用该模型检测Tschimganine对APAP诱导形成肝损伤的保护和修复功能。
用一年大的C57B6/J野生型小鼠,在厦门大学实验动物中心SPF级别动物房,用常规饲料喂养,自由饮水。Tschimganine用DMSO高浓度溶解,再用40%HBC(2-hydroxypropyl-β-cyclodextrin)配置成工作浓度,使DMSO浓度为10%,并且使腹腔注射100μl Tschimganine溶液最终工作浓度为20mg/kg(药物/小鼠体重)。空白对照组直接用等量的DMSO稀释在40%HBC溶液。每天上午9点注射,每日一次,注射5天后,在第五天下午3点给小鼠注射500mg/kg(药物/小鼠体重)用PBS新鲜溶解配制的APAP。24h后处死小鼠,取部分肝脏组织用多聚甲醛固定,石蜡包埋,切片,HE染色。部分肝脏组织液氮冻存,Trizol试剂提取RNA,反转录成cDNA后,用天根生化科技有限公司的RealMasterMix(SYBR Green I)试剂盒进行实时荧光定量PCR反应,检测肝脏组织中GCLM、GSTa4、GPX1、UGT1A1、SULT1A1等肝脏修复相关基因的表达。部分肝脏组织液氮冻存,用于检测组织中还原型谷胱甘肽GSH水平。取血清,用于检测血清中谷草转氨酶AST、谷丙转氨酶ALT和乳酸脱氢酶LDH活性。
所有实施例中对照组与药物处理组之间的差异用student’s t-test来分析。
试验结果:肝脏切片HE染色结果如图1,空白对照组病理切片可见肝小叶内细胞浸润明显,呈空泡状和坏死灶,小叶内和汇管区有大量炎性细胞浸润,细胞浑浊,核固缩或已溶解破碎,肝细胞索模糊。与空白对照组明显严重的肝损伤相比,注射了Tschimganine的小鼠肝脏形态显示基本正常(图1)。使用了Tschimganine的小鼠血清中AST和ALT活性(如图2)和LDH活性(图3)显著低于空白对照组中APAP引起的高活性。Tschimganine处理组小鼠的肝脏组织中还原性物质GSH水平也显著高于空白对照组(图4)。肝脏组织中与肝损伤相关的基因表达水平结果也表明,Tschimganine能上调与外源毒性物质代谢密切相关的功能基因GCLM、GSTa4、GPX1、UGT1A1和SULT1A1的表达水平(如图5),表明Tschimganine能通过外源性药物代谢相关基因的表达调控从而调节保护和修复肝脏功能。
结论:本实施例表明Tschimganine在肝损伤方面具有很好的保护和修复功能。
实施例二:Tschimganine在治疗糖尿病、肥胖症、脂肪肝、高血脂、心血管疾病等疾病方面的作用。
试验方法:KK-Ay小鼠(KK/Upj-Ay/J)是中度肥胖、中度糖尿病动物模型,八周龄高血糖、高胰岛素、高血脂、葡萄糖耐受不良、肝脏组织脂肪过量积累等症状,其糖尿病由胰岛素抵抗引起(Ⅱ型糖尿病小鼠)。本实施例利用KK-Ay小鼠试验Tschimganine对代谢性疾病的治疗功能。
利用高脂饲料(Research Diets,D12492)喂养的8-10周龄的雄性KK-Ay小鼠,腹腔注射如实施例一中所述方法配备的Tschimganine溶液,使腹腔注射100μl Tschimganine溶液最终工作浓度分别为20mg/kg(药物/小鼠体重)。每日注射一次,第14天注射后禁食6h,收集小鼠肝组织,液氮冻存,Trizol试剂提取RNA,反转录成cDNA后,用天根生化科技有限公司的RealMasterMix(SYBR Green I)试剂盒进行实时荧光定量PCR反应,检测肝脏组织中SREBP1c、CHREBP、FDFT1、G6PC和GK等糖脂代谢相关基因的表达。
取肝脏组织冰冻切片,用于油红染色。油红染色方法:肝脏组织在异戊烷中,在液氮中快速冷冻,嵌入最佳切削温度,在低温恒温器上切削。
油红燃料配制:油红O 0.5g,异丙醇(含量98%以上)100ml,24h 60℃烘箱中,充分溶解后作为储存液。临用时取染色原液6ml,加蒸馏水4ml,稀释,静置5~10min后过滤,此液保存不能超过1~2h。
冰冻切片10um厚,10%多聚甲醛固定10~15min后按常规方法油红染脂肪,苏木精淡染核。
收集小鼠血清,用于检测血清中糖脂代谢的相关指标,包括血清葡萄糖、自由脂肪酸和甘油三酯的水平,分别用以下试剂盒,按照说明书所述方法检测:葡萄糖测定试剂盒-氧化酶法(北京普利莱基因技术有限公司)、自由脂肪酸(Bioassay Systems,美国)、甘油三酯(北京普利莱基因技术有限公司)。
试验结果:相比空白对照,Tschimganine处理的KK-Ay小鼠血清中葡萄糖(图6)、自由脂肪酸(图7)和甘油三酯(图8)的水平显著降低,表明Tschimganine在糖尿病、肥胖症、高血脂以及与高血脂密切相关的心血管疾病中的治疗功能。
油红O为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织内甘油三酯等中性脂肪着色。在日常病理诊断和科研工作中,显示组织内的脂肪常采用油红O进行染色。本实施例油红染色结果表明,Tschimganine处理的KK-Ay小鼠肝脏组织中脂肪积累明显好转(图9),表明Tschimganine对脂肪肝有良好疗效。
Tschimganine处理的KK-Ay小鼠肝脏组织中与糖脂合成相关的基因SREBP1c、CHREBP、FDFT1、G6PC和GK表达水平被下调(图10),表明Tschimganine是通过下调糖脂合成相关基因的表达来调节这些代谢指标的。
结论:Tschimganine在治疗糖尿病、肥胖症、脂肪肝、高血脂等代谢性疾病方面具有良好疗效。
血液中血糖水平和血甘油三酯的水平过高,是心血管疾病的警戒指标,这些指标水平过高反映出机体患心血管疾病的风险极高。因此本实施例中Tschimganine处理能显著下调血糖和血甘油三酯水平,表明Tschimganine在心血管疾病中具有治疗作用。
实施例三:Tschimganine可以增加胰岛素敏感性。
试验方法:db/db小鼠(品系名称BKS.Cg-Dock7m+/+Leprdb/Jnju)属Ⅱ型糖尿病模型,有胰岛素不敏感的病症。动物在一个月时开始贪食及发胖,继而产生高血糖、高血胰岛素等症状。
本实施例利用10周龄左右的模型小鼠db/db,利用高脂饲料(Research Diets,D12492)喂养,按实施例一所述方法注射Tschimganine,使腹腔注射100μl Tschimganine溶液最终工作浓度分别为10mg/kg(药物/小鼠体重)。每天上午9点注射,每日一次,注射7天后,禁食6h后处死小鼠,眼球取血,制备血清,分别用糖-氧化酶法(北京普利莱基因技术有限公司)和小鼠超敏胰岛素试剂盒(Crystal Chem.Inc.,美国)检测血清中葡萄糖和胰岛素水平。
试验结果:相比空白对照组小鼠,Tschimganine处理的小鼠血清葡萄糖水平明显降低(图11),血清胰岛素的水平也显著降低(图12),表明Tschimganine能通过增强机体胰岛素敏感 性来达到降低血糖的效果。
结论:Tschimganine可以增加机体的胰岛素敏感性,对胰岛素抗性的疾病有疗效。
实施例四:Tschimganine在药物引起的炎症反应中的治疗作用。
试验方法:炎症因子是在炎症过程中由细胞产生和分泌参与炎症反应的物质,是反应炎症的标志物。本实施例利用如实施例一处理的一年大的C57B6/J野生型小鼠肝脏组织,用Trizol试剂提取RNA,反转录成cDNA后,用天根生化科技有限公司的RealMasterMix(SYBR Green I)试剂盒进行实时荧光定量PCR反应,检测小鼠肝脏组织中iNOS、TGFβ、IL-1β、TNFα和MIP1a炎症因子的表达水平。
试验结果:如图14,相比空白对照,Tschimganine处理过的小鼠肝脏组织中,iNOS、TGFβ、IL-1β、TNFα和MIP1a等多种炎症因子的表达水平都显著下调。
结论:Tschimganine能抑制由化学药物引起的炎症反应。
实施例五:Tschimganine能抑制糖尿病并发症中的炎症反应。
试验方法:Ⅱ型糖尿病患者不仅容易发生在肥胖症人群,而且多数患者还伴有慢性炎症,包括肾脏炎症。
本实施例利用实施例三中处理的db/db小鼠,取附睾脂肪垫白色脂肪组织,Trizol试剂提取RNA,反转录成cDNA后,用天根生化科技有限公司的RealMasterMix(SYBR Green I)试剂盒进行实时荧光定量PCR反应,检测白色脂肪组织中iNOS、TNFα、IFNγ和IL-6炎症因子的表达水平。
本实施例还检测了实施例二中处理的KK-Ay小鼠的肾脏组织中iNOS、TNFα、COX2、TGFβ、IL-1β和IFNγ等炎症因子的表达水平。
试验结果:相比空白对照组,在db/db小鼠中,腹腔注射了Tschimganine的小鼠脂肪组织中iNOS、TNFα、IFNγ和IL-6等多种炎症因子表达水平显著下调(图15)。在KK-Ay小鼠中,Tschimganine处理过的小鼠肾脏组织中iNOS、TNFα、COX2、TGFβ、IL-1β和IFNγ等多种炎症因子的表达水平显著下调(图16),表明Tschimganine可以抑制糖尿病并发症中的炎症反应。
结论:Tschimganine在炎症治疗方面具有疗效。
实施例六:Tschimganine能抑制肿瘤细胞生长。
试验方法:MTT法是一种检测细胞存活和生长的方法。该方法已广泛用于大规模的抗肿瘤药物筛选。它的特点是灵敏度高、经济。本实施例利用MTT法,用含10%胎牛血清的DMEM培养基培养各种人的肿瘤细胞,包括人结肠癌细胞HCT116细胞、人结直肠腺癌细胞HCT15 细胞、人前列腺癌细胞LNCaP细胞、人宫颈癌细胞Hela细胞、人肝细胞癌细胞HepG2细胞、人乳腺癌细胞MCF7细胞和小鼠单核巨噬细胞白血病细胞Raw264.7细胞,用工作浓度为10μM、20μM、30μM、40μM、50μM的Tschimganine分别处理细胞96h后,用MTT法检测细胞存活率。
试验结果:结果如图17~22,在人结肠癌细胞HCT116细胞、人结直肠腺癌细胞HCT15细胞、人前列腺癌细胞LNCaP细胞、人宫颈癌细胞Hela细胞、人肝细胞癌细胞HepG2细胞、人乳腺癌细胞MCF7细胞和小鼠单核巨噬细胞白血病细胞Raw264.7细胞中,用Tschimganine处理过的肿瘤细胞在96h的存活率明显低于空白对照处理的细胞。并且随着Tschimganine浓度的越大,抑制肿瘤细胞生长的效果越显著。表明Tschimganine对这些癌细胞的生长都有抑制功能。
结论:Tschimganine在结肠癌、直肠腺癌、前列腺癌、宫颈癌细胞、肝细胞癌、乳腺癌和白血病治疗方面具有功效。
实施例七:Tschimganine在治疗肾脏疾病中的作用
试验方法:肾脏为排泄尿素的主要器官,尿素从肾小球滤过后在各段小管均可重吸收,肾小管内尿流速越快,重吸收就越少。当肾功能损害时,肾小球滤过率下降,滤过率下降到正常的50%以下时,血尿素氮的浓度迅速升高。各种肾实质性病变,如肾小球肾炎、间质性肾炎、急慢性肾功能衰竭、肾内占位性和破坏性病变均可使血尿素氮增高。因此,血尿素氮是肾功能主要指标之一。血尿素氮升高也可作为尿毒症诊断指标之一。
慢性肾脏疾病是糖尿病的并发症之一。本实施例用实施例四中处理的db/db小鼠血清,用南京建成科技有限公司的尿素氮(BUN)测试盒(脲酶法,C013-2)按说明书测血清中尿素氮的水平。
本实施例还包含了实施例二中处理的KK-Ay小鼠的肾脏组织中炎症因子的表达水平。
试验结果:相比空白对照组,Tschimganine处理的小鼠血尿素氮的水平显著下调(图13)。Tschimganine处理的小鼠肾脏组织中炎症因子水平显著下调(图16)。表明Tschimganine对肾脏功能的维护和肾病包括肾脏炎症方面的治疗效果。
结论:Tschimganine在出现血尿素氮水平升高的各种肾实质性病变,如肾小球肾炎、间质性肾炎、急慢性肾功能衰竭、肾内占位性和破坏性病变,以及尿毒症等肾脏疾病中具有疗效。Tschimganine还对肾脏炎症有疗效。
实施例八:Tschimganine对肝硬化的功效。
试验方法:脂肪肝是肝脏中过多积累脂肪导致的一种肝病。过多脂肪长期积蓄于肝脏, 将影响肝脏血液和氧的供应及肝脏自身代谢,会逐渐造成大量肝脏细胞肿胀、炎症浸润及变性坏死,一旦有纤维增生及假小叶形成,就会成为肝硬化,大大增加患肝癌的危险。肝硬化患者肝脏组织中各种胶原含量都有增加。因此本实施例通过Masson氏染色法鉴定Tschimganine处理是否能减轻肝脏有脂肪过量积累的小鼠肝脏组织中胶原沉积的症状,并通过荧光定量PCR方法检测胶原蛋白的表达水平。
方法一:
实时荧光定量PCR:将实施例三中小鼠部分肝脏组织液氮冻存,Trizol试剂提取肝脏组织RNA,Takara公司的反转录试剂盒反转录成cDNA后,用天根生化科技有限公司的RealMasterMix(SYBR Green I)试剂盒进行实时荧光定量PCR反应,Bio-rad公司的CFX96荧光定量PCR仪进行反应。检测肝脏组织中肝胶原和纤维化相关基因的表达。
方法二:
Masson氏染色法师用于显示组织中纤维的染色方法之一,是胶原纤维染色权威而经典的技术方法。Masson氏染色方法是根据不同组织和细胞的空隙和大小不同,因而组织的渗透性不同,其中胶原纤维相对来说结构疏松,渗透性高,能让苯胺蓝(蓝色)这种大分子的染料进入着色,而组织中红细胞、肌纤维部分的空隙较小,因而苯胺蓝不能进入着色。该方法能区分组织中胶原纤维的存在和积累程度。广泛用于结缔组织、肌肉组织和胶原蛋白的研究等。本染色方法操作简捷,性能稳定,显色清晰。
本实施例采用南京建成科技有限公司的快速Masson染液试剂盒(货号D026),按照该试剂盒说明书,对实施例三中处理的小鼠肝脏进行Masson染色,染色结果为:胶原纤维呈蓝色,胞浆、肌肉、纤维素、神经胶质呈红色,胞核蓝紫色。
试验结果:荧光定量PCR结果显示(如图23),肝纤维化的标志基因α1(I)collagen、TIMP1、α-SMA和MCP-1基因在Tschimganine处理的小鼠肝脏中的表达水平明显低于对照组。
在Masson染色结果中可以看出(参见图24),对照组的肝脏切片中,可以看到血管处有明显的着色蓝色的胶原蛋白沉积,而Tschimganine处理的小鼠肝脏切片中的血管则无明显的胶原沉积蓝色表现。
结论:结合前面所述实施例中结果,Tschimganine能减缓肝脏细胞和组织的炎症反应,能减少肝脏组织脂肪积累,Tschimganine还能降低肝纤维化标志基因表达,有效消除肝脏中胶原的积累,因而Tschimganine能预防和治疗肝硬化疾病。
- 还没有人留言评论。精彩留言会获得点赞!