一种治疗慢性乙型肝炎和肝脏的纤维化的小干扰RNA药物的制作方法
本发明属于生物技术发明领域,本发明涉及小干扰RNA药物,是由重组病毒AAV介导表达的19bp shRNA,在体外细胞株上具有显著抗病毒活性,在体内也具有显著的抗HBV活性和抗纤维化生成的作用。
背景技术:
HBV感染是人类急性和慢性肝炎的主要病因,据估计,全球有3.5亿乙肝病毒携带者,每年有超过100万人死于HBV相关的肝衰竭、晚期纤维化(Cirrhosis)和肝癌(Hepatocellular carcinoma,HCC)。慢性携带者发展成HBV相关疾病的风险为15-25%。HCC占癌症死亡的第三位,HBV是造成HCC的主要致病因子。我国更是乙型肝炎的高发区,人群中的流行率高达60%,其中10%会发展为慢性感染。大多数人感染HBV可以成功诱发免疫应答清除病毒,导致终身免疫,然而新生儿或儿童通常转变为慢性感染。慢性感染的一个重要标志是病毒和宿主的免疫系统间复杂的和动态的相互作用,通常慢性感染者只能诱发较弱的CTL和B细胞应答,这是由于循环系统中存在极高水平的病毒抗原将其消耗所致,尤其是高水平的HBsAg。循环系统中的病毒抗原的显著降低,扩增和激活与HBV反应的淋巴细胞,病人就可以积累足够的免疫应答,产生HBV特异的中和抗体,造成血清学转换。
目前慢性乙型肝炎的预防和治疗,有很大进展,但问题依然严重。HBV感染仍然是一个具有挑战性的问题,治疗方案种类少且疗效有限。目前有7种药物,包括免疫调节类药物(IFN和PEG-IFN)和5中核苷酸类似物,前者通过免疫调节在转录后抑制病毒的复制,但只有大概10%的病人有效,且副反应明显;后者在复制水平发挥作用,疗效有所改善,但需要长期用药且产生耐药突变株和停药后病毒重新被激活等副作用。即使使用不同的药物组合进行治疗,疗效还是很有限,有一定的副作用,不能完全治愈,因为它们不是从宿主中根除病毒,只是抑制病毒的复制,在停止治疗后病毒血症还会复发。使问题更复杂的是延长治疗时间会产生逃逸突变株,会对目前使用的药物产生抗性。
RNA干扰:RNA干扰(RNA interference,RNAi)现象是一种进化上保守的抵御转基因或外来病毒侵犯的防御机制,同时也能调节分化、发育、免疫应答并与肿瘤的发生相关,该过程通过包含19-23bp核苷酸双链的小干扰RNA(siRNA)指导序列特异性降解mRNA来实现。近年来RNAi技术在抗病毒治疗领域的研究是一项非常热门的话题,在培养的哺乳动物细胞上RNAi被证明可以有效地降低人类致病病毒的感染和复制,包括HBV。考虑到它高效的序列特异性基因沉默效应,RNAi被认为是一种非常有潜力的治疗人类病毒感染的方法。在针对HBV的研究中,有几个研究小组报道,在HBV的高压水柱(hydrodynamic)注射复制模型中,共注射化学合成的siRNAs或表达HBV小发夹RNAs(small hairpin RNAs,shRNAs)的表达质粒载体,可以有效地抑制HBV基因的表达和复制。但是化学合成的siRNA存在成本高、不稳定、体内传输困难,进入细胞后容易被降解,在细胞内的RNAi效应持续时间短等缺点,即使是质粒表达载体也同样存在传输困难,疗效持续时间短且缺乏靶向性等缺陷。因而需要研发新的传输方式,病毒载体为我们提供了一个契机。
腺相关病毒(Adeno-associated virus,AAV):AAV是一种无致病性人类细小病毒科(parvoviridae)成员,病毒基因组为单链DNA,病毒衣壳为二十面条立体对称,直径为25nm,基因组长约为5kb,包含两个开放读码框架,左边开放读码框架编码复制蛋白,右边开放读码框架编码结构蛋白。AAV是一种依赖细小病毒(dependovirus),它的生产性感染依赖腺病毒等辅助病毒(或者某些单纯疱疹病毒)的共感染,在缺乏辅助病毒时,AAV通过整合到宿主的染色体基因组建立潜伏感染状态。重组病毒AAV载体的生产只需要基因组两端145bp的末端重复序列和反式提供其他的病毒因子。AAV由于其无致病性、能介导外源基因在体内长期表达、组织嗜性范围广、可以感染分裂细胞和非分裂细胞以及低免疫原性等特点,从建立了第一个AAV的感染性克隆开始,重组AAV(rAAV)载体被广泛应用到基因治疗研究,并被用于临床前/临床试验,尝试着治疗多种疾病。到目前为止发现了12种基因型和数百种变异体,为体内不同组织的基因治疗提供了良好的选择。RNAi药物ARC-520:美国生物技术公司Arrowhead乙肝RNAi药物ARC-520,是一种基于RNA干扰(RNAi)的药物,开发用于治疗慢性乙肝型肝炎,具有功能性治愈乙肝的潜力。其原理是通过RNA干扰作用来封闭乙肝病毒某些蛋白的表达,导致病毒无法增殖,然后再利用人体免疫系统对剩余病毒进行清除,实现免疫清洁状态(immune clearant state),特征为乙肝表面抗原(HBsAg)血清学转阴以及部分病人出现血清学转换。目前处于II期临床实验阶段。
目前对HBV感染的治疗主要是两种干扰素和五种核苷酸类似物,疗效有限且有较重的副作用。干扰素治疗只有10%的人群有效,核苷酸类似物疗效稍好,需要长期用药,容易产生耐药突变,停药后容易复发。因此需要研发更为有效的抗病毒药物,能够持续抑制HBV的复制,并抑制其相关的综合征。
技术实现要素:
本发明提供一种治疗慢性乙型肝炎和肝脏的纤维化的小干扰RNA药物,命名为:AAV-shRNA,AAV-shRNA是腺相关病毒介导的针对HBV可以靶向到人肝脏的小干扰RNA药物,在HepG2.2.15(一种整合HBV基因组的细胞株)抗病毒实验表明,在蛋白、RNA和DNA水平上具有显著的抗病毒效应;在HBV的慢性感染模型上的疗效实验结果表明,可以显著降低血液中HBsAg、HBeAg、HBV基因组DNA;在小鼠的肝脏纤维化模型中显著降低纤维化的程度,可以将肝脏的病理变化改善到接近正常的水平。
本发明提供一种抑制HBV复制和肝脏纤维化的小干扰RNA药物,其为一种重组病毒,由小干扰RNA制备而成,所述小干扰RNA的核苷酸序列见序列表中序列1。本发明所述小干扰RNA药物,由表达载体pAAV-shRNA制备而成,所述表达载体是将序列1的互补引物克隆到pSC-H1-empty载体中,然后将该表达盒克隆到含有AAV2末端重复序列的SSV-9载体中得到,其核苷酸序列见序列列表中的序列2。
本发明所述小干扰RNA药物,是将序列1的互补引物克隆到pSC-H1-empty载体中,然后将该表达盒克隆到含有AAV2末端重复序列的SSV-9载体中,得到序列2的表达载体,随后使用三质粒共转染法在293T细胞中包装为重组病毒,将细胞破碎,提取纯化后得到重组病毒。
本发明权利要求3所述小干扰RNA药物,所述序列1的互补引物核苷酸序列见序列列表中的序列3。
本发明所述小干扰RNA药物,其中所述小干扰RNA序列是在siRNA Target Finder上设计19bp的小干扰RNA,合成后在HepG2.2.15上筛选得到。
本发明所述的小干扰RNA药物,在体外具有抗HBV复制作用。
本发明所述的小干扰RNA药物,在体内具有抗HBV复制作用。
本发明所述的小干扰RNA药物,具有抑制小鼠肝脏的纤维化发生的作用。
本发明还提供一种小干扰RNA,其核苷酸序列见序列表中序列1。
本发明进一步提供一种表达载体pAAV-shRNA,其核苷酸序列见序列列表中的序列2。
本发明所述的小干扰RNA药物,在使用时可以制备成任何一种可作用于动物体的药物制剂组合物,如通过注射方式使用。
以下为对本发明名称术语的解释:
pSC-H1-empty载体:用于表达shRNA的载体,由H1启动子启动表达。
SSV-9载体:含有AAV2全基因组的质粒载体。
三质粒共转染法:利用质粒pXX68,pXR8(或者pXR2),pSSV9-HBV1.2(pSC-H1-shRNA)转染293T细胞制备重组病毒。
293T细胞:293T细胞是由293细胞派生,表达SV40大T抗原的人肾上皮细胞系,被广泛应用于瞬时转染以过表达各种目标蛋白,或是用于包装病毒。
siRNA Target Finder:Ambion公司开发的siRNA靶点设计工具。
HepG2.2.15:该细胞株是染色体基因组整合有2个头尾相连的HBV DNA全基因HepG2细胞,可在体外无性繁殖,能够长期稳定的向培养上清中分泌HBsAg,HBeAg和完整的Dane颗粒,而且还能产生大量的复制中间体,是体外筛选抗HBV药物的良好模型。
为了验证本发明的AAV-shRNA的抗病毒效果,我们首先在整合有HBV 2倍基因组的HepG2.2.15细胞株上验证其体外抗病毒效果,详细步骤见实施例2。将细胞接种到6孔板上,感染AAV-shRNA,不同时间点收集上清和细胞,提取上清和细胞中的全基因组DNA,用Q-PCR法检测其中的HBV基因组DNA的浓度。提取细胞中的mRNA,RT-qPCR法检测HBV的mRNA浓度。使用ELISA法检测细胞上清中的HBsAg的浓度。DNA、RNA、Pr水平实验表明,AAV-shRNA可以将上清中的HBV的DNA和mRNA下调90%以上,可以将HBsAg的浓度下调到接近检测不到的水平,表明该AAV-shRNA在体外具有显著的抗HBV作用。抗病毒效果见图2。
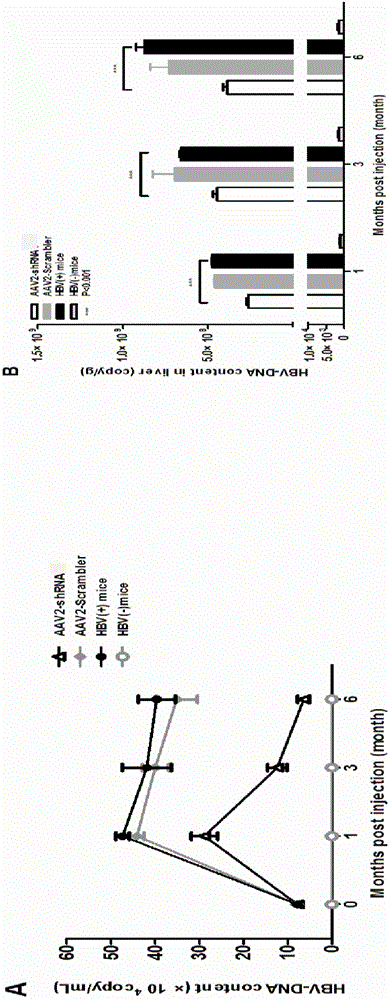
为了验证体内抗HBV作用,按照我们以前的研究结果建立HBV的持续性感染模型(Ye Lei,etal,PLOS One,2015)。将AAV8-HBV1.2尾静脉注射C57BL/6小鼠,小鼠肝脏呈现HBV持续性感染并伴随肝脏的纤维化发生。建立模型之后,尾静脉注射AAV-shRNA,不同时间点采集小鼠的血清和肝脏组织。按照体外的实验方法检,使用Q-PCR和RT-QPCR法检测血清中和肝脏HBV的基因组DNA浓度和RNA浓度,如图3所示,血清中HBV基因组DNA浓度下降10倍以上,肝脏中HBV基因组DNA也显著降低,肝脏中HBV的mRNA也下降10倍以上。ELISA的实验表明,血清中HBsAg下调10倍,HBeAg下调50%左右。
由于我们的小鼠模型能够诱导小鼠肝脏的纤维化生成,为了验证AAV-shRNA对纤维化生成的影响,我将小鼠的肝脏切片后,进行免疫组化。实验过程见实施例4。Masson染色和Sirus red染色表明,正常小鼠肝脏组织结构和肝细胞的形态结构都正常,而模型小鼠和对照组的肝脏组织结构都破坏严重,大量的肝脏细胞肿胀坏死,肝细胞排列紊乱,锁状结构不清,肝窦狭窄,肝细胞间kupffer细胞明显增生,有胶原蛋白明显沉积(图4)和明显的胶原纤维生成(图5),可以认定为重度纤维化生成。而AAV-shRNA的治疗组,只见到较少的胶原沉积和胶原纤维生成,和对照组相比,肝脏组织和细胞结构的形态学具有明显的改善,只能认定为轻度纤维化。
总之,本发明筛选到一个小干扰RNA,构建了pAAV-shRNA载体,用AAV包装成重组病毒,在体外和体内都有显著的抗HBV作用,而且还有明显的抗肝脏的纤维化生成效果。
本发明和现有技术相比,主要优点在于:
1.可以介导shRNA在体内长期表达;
2.靶向HBV基因组的AAV2-shRNA可以有效抑制HBV复制、转录及蛋白表达;
3.治疗性AAV2-shRNA长期表达可以明显改善肝组织纤维化。
附图说明
图1 AAV表达盒示意图。HBV特异性表达盒
图2 AAV2-shRNA体外抑制HBV复制、转录和HBsAg表达。不同剂量AAV2-shRNA感染HepG2.2.15细胞,不同时间点收获培养上清和细胞,从DNA水平,RNA水平,蛋白水平测定其抗病毒效果。DNA水平:培养上清中HBV DNA累积量变化(A),细胞中HBV DNA含量变化(B);RNA水平:细胞中HBV cDNA含量变化(C);蛋白水平:培养上清中HBsAg累积量变化(D)。Mock:PBS替代AAV2-shRNA实验;Scrambler:AAV2-scrambler替代AAV2-shRNA实验,scrambler序列为与HBV DNA不相关的无用序列;MOI=103:感染剂量为103,MOI=104:感染剂量为104,MOI=105:感染剂量为105;P<0.001:差异极显著;ns:差异不显著。每个实验设置3个平行,每个平行测量三次,结果以平均值±标准差表示。
图3 AAV2-shRNA体内有效抑制HBV复制、转录和表达。AAV8-1.2HBV注射小鼠建模1个月后,尾静脉注射AAV2-shRNA(剂量均为1×1011copy/只),同时以AAV8-1.2HBV注射小鼠作为阳性对照HBV(+)mice,以正常小鼠作为阴性对照HBV(-)mice。注射后各时间点取样,分别测量血清中HBV DNA含量变化(A);肝组织中HBV DNA含量变化(B);利用RT-qPCR方法测定肝组织中HBV cDNA含量(C);美国雅培化学发光法测定量血清中HBsAg(D)和HBeAg(E)表达量;P<0.001差异极显著,每组结果以4只小鼠测量值的平均值±标准差表示。
图4 Masson染色观察AAV2-shRNA药物治疗改善胶原增生及胶原纤维定量。AAV8-1.2HBV注射小鼠1个月后,尾静脉注射AAV2-shRNA剂量均为1×1011copy/只),同时以AAV8-1.2HBV注射小鼠作为阳性对照(HBV(+)mice),以正常小鼠作为阴性对照(HBV(-)mice),药物治疗1个月,3个月,6个月处死小鼠,取肝组织进行Masson染色观察(A);每组取10张Masson染色图片,利用Image proplus软件定量分析肝组织中胶原纤维百分含量,结果以平均值±标准差表示,P<0.001差异显著(B)。
图5 Sirus Red染色观察AAV2-shRNA药物治疗改善胶原增生及胶原纤维定量。AAV8-1.2HBV注射小鼠1个月后,尾静脉注射AAV2-shRNA剂量均为1×1011copy/只),同时以AAV8-1.2HBV注射小鼠作为阳性对照(HBV(+)mice),以正常小鼠作为阴性对照(HBV(-)mice),药物治疗1个月,3个月,6个月处死小鼠,取肝组织进行Sirus Red染色,偏光显微镜下观察(A);每组取10张Masson染色图片,利用Image pro plus软件定量分析肝组织中胶原纤维百分含量,结果以平均值±标准差表示,P<0.001差异显著(B)。
具体实施方式
以下通过实施例进一步说明本发明。
实施例1重组载体构建及重组病毒包装
将寡核苷酸(即本发明小干扰RNA对应的DNA互补引物,见序列表中序列3和序列4,由申请人根据小干扰RNA序列合成得到)退火后形成双链片段克隆到线性化载体pSC-H1-empty载体中,获得重组质粒pSC-H1-shRNA(图1)。简要操作过程如下:
退火寡核苷酸
用DNase free和RNase free无菌水溶解寡核苷酸,使其终浓度为3mg/mL。具体计算公式如下:
获得终浓度为X mg/mL的寡核苷酸溶液需要的用水量=(寡核苷酸质量μg×10-3)/终浓度(X mg/mL)
获得终浓度为3mg/mL的寡核苷酸溶液,需要加入水的量=(μg oligos×10-3)/3订购量为5OD=33μg×5=165μg,加入水的量=165×10-3/3=0.055mL=55μl。当稀释寡核苷酸时候,可以先配置10mg/mL的储备液,用的时候稀释成3mg/mL的工作浓度。退火后的寡核苷酸命名为oligo-f/r。反应体系如下:
反应程序如下:
退火后的寡核苷酸立即用于连接,或者暂时4℃保存,如果需长期保存,-20℃冻存。
线性化质粒载体pSC-H1-empty
用限制性内切酶BglII和HindⅢ双酶切表达质粒pSC-H1-empty,反应体系如下:双酶切反应体系(BglⅡ/HindⅢ)
37℃酶切过夜,使质粒载体pSC-H1-empty线性化。经1%琼脂糖凝胶电泳(电压90V,电泳时间30min)后,胶回收试剂盒回收线性质粒载体pSC-H1-empty备用。并测量线性化质粒浓度,使其浓度在0.2-0.5mg/mL之间。测定OD260下质粒浓度(1A260OD=50μg/mL dsDNA)。
重组pSC-H1-shRNA质粒表达载体的获得
将退火后的寡核苷酸与线性化质粒载体pSC-H1-empty相连,连接反应体系如下:
16℃连接过夜,次日将连接产物转化E.coli DH10B感受态细胞,并涂布于含氨苄的抗性LB平板上,37℃培养16h以上观察结果。当观察到有可挑取白色菌落时,随机挑取多个白色菌落,分别与3mL含氨苄(100μg/mL)的LB培养基37℃,180rpm振荡培养16h以上,直到观察菌液变浑浊即可。将浑浊菌液分别提取质粒并酶切鉴定。连接成功的阳性重组质粒,BglII酶切位点消失,因此用BglII酶切重组质粒,质粒不能被线性化,可以用于筛选阳性重组子。详细步骤同第一部分分子克隆技术。用BglⅡ和HindⅢ分别对重组克隆进行单酶切鉴定,重组克隆单酶切鉴定反应体系如下:
单酶切鉴定反应体系(BglII)
37℃酶切2h以上,跑1%琼脂糖电泳,如果重组质粒没被线性化,说明插入成功,此重组克隆贮存备用。
单酶切鉴定反应体系(HindⅢ)
37℃酶切2小时以上,跑1%琼脂糖电泳,如果重组质粒HindⅢ酶切被线性化,说明插入成功,重组子为阳性重组子,备用测序(如图1所示)。将储备的测序克隆送Invitrogen公司测序,测序正确的克隆用于后续实验病毒包装。
重组病毒获得及qPCR定量重组病毒AAV2-shRNA
用三质粒共转染技术制备AAV2-shRNA,转染试剂为PEI,所用质粒为pSC-H1-shRNA,pXR2,pXX680(Xiao,X,JV,1998),使用氯化铯密度梯度离心纯化,使用qPCR法检测制备病毒的滴度。
Q-PCR引物如下:
上游引物q-shRNA-f:ACATCACTCAAAGCACCC;
下游引物q-shRNA-r::AACGATAGAGCCTCCACAG。
利用公式(6.02x1023拷贝数/摩尔)x(浓度g/ml)/(MW g/mol)=copies/ml[平均分子量:dsDNA=(碱基数)x(660道尔顿/碱基)ssDNA=(碱基数)x(330道尔顿/碱基)ssRNA=(碱基数)x(340道尔顿/碱基)]计算质粒pSC-H1-shRNA拷贝数和所需稀释倍数。经过梯度稀释使质粒pSC-H1-shRNA的浓度分别为103-109copy/μL,每次实验标准曲线和样本均设置3个平行。qPCR反应体系及程序如下:
PCR反应程序
病毒效价计算公式如下:
病毒效价(copy/mL)=qPCR结果×稀释倍数
实施例2体外抗病毒实验
2.1重组腺相关病毒AAV2-shRNA感染HepG2.2.15
(1)以4×105细胞/孔的密度将HepG2.2.15细胞接种于六孔板中,每个孔中加入2mL培养基,培养至汇合度为70%左右,进行感染。培养基组份:高糖DMEM+10%FBS+1%双抗+G418(200μg/mL);
(2)感染前,吸出六孔板孔内培养基,用PBS洗涤细胞2-3次(1mL PBS/孔)。分别加入MOI=103,MOI=104,MOI=105的病毒(病毒用PBS配置为等体积500μL),37℃,5%CO2,培养3小时后。吸出病毒液,每孔加入2mL完全培养基继续培养,24h后收获上清,并将新鲜的培养基2mL加入到六孔板中,继续培养。随后每隔24h吸取上清并加入新鲜培养基直至7天,收获的上清液贮存备用。
(3)分别于3天,7天收获六孔板内细胞备用。首先弃去培养上清液,用PBS洗涤细胞1次,加入500μL的0.05%的胰酶,消化1min后,拍打六孔板使细胞脱壁,加入600μL培养基终止消化,1000rpm离心5min后弃去上清液,将沉淀细胞-80℃冻存备用。
2.2DNA水平验证重组腺相关病毒AAV2-shRNA抗HBV效果
利用Qiagen公司DNeasy试剂盒提取培养上清和收获细胞中的DNA。上清样本使用量为200μL,样本细胞数<5×106细胞/孔;qPCR定量HBV DNA方法同第一部分,质粒标准品用pSSV9-1.2HBV,引物序列为q-1.2HBV-f:GCGGGCGTTTTATCATCTTCCTC;下游引物q-1.2HBV-r:GAAAGCCCTACGAACCACTGAAC。qPCR反应体系及程序同实施例1。模板更换为所提取的培养细胞DNA。
2.3RNA水平验证重组腺相关病毒AAV2-shRNA抗HBV效果(细胞样本)
使用Qiagen公司RNeasy试剂盒提取培养细胞中总RNA,逆转录合成cDNA(First Strand cDNA Synthesis Kit),利用q-PCR方法定量HBV-cDNA含量,所用引物及程序同实施例2.2。
2.4蛋白水平验证重组腺相关病毒AAV2-shRNA抗HBV效果
利用Elisa方法检测培养上清中HBsAg含量(按说明书操作,方法略)。
如图2所示,以不同剂量AAV2-shRNA感染HepG2.2.15首先在DNA水平(复制水平)上验证抗病毒效果,分别测定培养上清液及培养细胞内HBV DNA含量变化,结果如图2(A和B)所示,感染剂量为MOI=103,MOI=104,MOI=105实验组与Mock组(PBS替代AAV2-shRNA)和Scrambler组(AAV2-scrambler替代AAV2-shRNA)相比较,实验组均能降低培养上清液及细胞中HBV DNA累积含量,第7天,MOI=105实验组培养上清液和细胞中HBV DNA抑制率分别可达94%和90%,抑制效果极显著(P<0.001);但是比较MOI=104和MOI=105实验组在培养上清和细胞中HBV DNA抑制率均没显著差异,说明当达到一定感染剂量(本实验为MOI=104),继续增加感染剂量并不能增加抗病毒效果。同时Scrambler组和Mock组结果均呈增长趋势,说明细胞可以正常生长,利用腺相关病毒介导shRNA感染不会对HepG2.2.15细胞造成毒副作用。
在RNA水平(转录水平)进行验证,结果如图2C所示:实验组不同剂量AAV2-shRNA感染HepG2.2.15均呈现极强抑制效果,抑制率可达90%以上。各感染剂量实验组之间没有显著差异,说明所设计的shRNA在RNA水平上能极强的抑制HBV RNAs转录,所设计的shRNA作用直接靶位为HBV RNA。
进一步在蛋白水平(表达水平)进行验证,测量培养上清中HBsAg累积量变化可知(见图2D),同RNA水平一致,实验组不同剂量AAV2-shRNA对于HBsAg抑制效果无显著差异,这也说明实验所用shRNA作用靶位为HBV S区与实验设计位点相符。
实施例3体内抗病毒实验
按1×1011copy/只的剂量将AAV2-shRNA尾静脉注射建模1个月的高嗜肝性AAV8-1.2HBV乙型肝炎慢性感染小鼠模型来构建治疗模型,在各时间点取血清样本和组织样本,测量各指标进行治疗模型的评估。
具体方案如下:将AAV8-1.2HBV用PBS稀释为2×1011copy/200μL PBS,即:每只C57BL/6小鼠注射体积为200μL病毒,病毒剂量为2×1011copy/只;将成功注射的小鼠,放回鼠笼继续饲养,饲养条件为25℃,湿度30%-60%,每天给予12h光照,12小时黑暗。在建模1个月时,取小鼠血液检测HBV DNA,HBsAg和HBeAg含量,三者皆为阳性的小鼠作为高嗜肝性AAV8-1.2HBV乙型肝炎慢性感染小鼠模型。此时尾静脉注射1×1011copy/只的剂量的AAV2-shRNA建立治疗模型,随后治疗小鼠模型继续饲养,到所需时间点取血,或者处死模型小鼠取所需组织。AAV2-shRNA小鼠治疗模型建模1个月,3个月,6月,对模型小鼠取血及肝组织样本。组织采集方法如下(1)当模型小鼠到所需时间点时,处死小鼠,剪开小鼠腹腔,找到下腔静脉,并剪开下腔静脉,然后打开小鼠胸腔,找到小鼠心脏并用装有预冷PBS的注射器从小鼠左心尖刺入进行PBS灌注,此时可见血液从下腔静脉流出,直到流出的液体变为无色停止灌注;(2)灌注结束后,迅速摘取小鼠的肝组织,将摘取的组织放置于冰上预冷的PBS中,洗去表面残余血液;(3)将各组织分装于1.5mL离心管内,-80℃冻存或部分分装于10%福尔马林溶液中固定备用,每次取分装的组织进行后续实验。
按照实施案例2.2和2.3方法和程序,提取小鼠血液和组织中HBV DNA和HBV RNA,并进行qPCR定量。利用美国雅培化学发光乙肝定量检测试剂盒和美国雅培I2000化学发光免疫分析仪检测小鼠血液中HBsAg和HBeAg含量。
如图3A所示,注射治疗性AAV2-shRNA后,与阳性对照HBV(+)小鼠相比,血清中HBV DNA含量明显下降,6个月的时候AAV2-shRNA实验组对HBV DNA抑制率可达90%以上,AAV2-shRNA实验组可以将血清中HBV DNA含量降低约1个数量级以上;小鼠肝组织内AAV2-shRNA实验组对HBV DNA抑制率也达到47.85%(图3B)。同时我们还检测了肝组织中HBV mRNAs含量变化,如图3C所示AAV2-shRNA注射后6个月,实验组AAV2-shRNA对于HBV mRNAs抑制率达到95%,说明AAV2-shRNA可以体内持续抑制HBV RNAs转录长达6个月,HBV RNAs是shRNA的直接靶位,RNAi具有高效和特异性。
实施例4抗纤维化实验
利用Masson染色和Sirus Red染色对小鼠肝脏纤维化情况进行观察。具体方案如下:
Masson染色:
(1)组织固定于Bouin氏液或Zenker氏液,流水冲洗过夜,常规脱水包埋;
(2)切片脱蜡至水;
(3)Weigert铁苏木素(Weigert铁苏木素A液、B液等比例混合液)染5min,流水稍洗;
(4)1%盐酸酒精分化,流水冲洗数分钟;
(5)丽春红酸性品红染液染10min,流水稍冲洗;
(6)磷钼酸溶液处理约1min,不用水洗直接用苯胺蓝染液复染5min;
(7)1%冰醋酸处理1min,95%酒精脱水多次;
(8)无水乙醇脱水,二甲苯透明,中性树胶封固。
Sirus Red染色:
(1)中性甲醛液固定组织,石蜡切片,常规脱蜡至水。
(2)天青石蓝液染5-10min。
(3)蒸馏水洗3次。
(4)天狼星红饱和苦昧酸浓染15-30min
(5)无水乙醇直接分化与脱水。
(6)二甲苯透明,中性树胶封固。
如图4(Masson stain)和图5(Sirus Red stain)所示,AAV2-shRNA注射组Masson染色和天狼猩红染色显示胶原纤维明显要少于阳性对照组,同时用image pro plus软件进行分析,AAV2-shRNA治疗组可以抑制胶原增生达40%。
- 还没有人留言评论。精彩留言会获得点赞!