一种抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜及其制备方法和应用与流程
本发明属于医用钛材料改性技术领域,具体涉及一种抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜及其制备方法和应用。
背景技术:
近年来各类生物医学材料的研究应用飞速发展。钛及钛合金凭借优良的生物相容性能、耐腐蚀性等成为目前广泛应用于口腔科、骨科等专业领域的种植体材料。但是纯钛种植体存在生物惰性,骨结合能力仍有不足。进行钛种植体表面改性,优化种植体表面性能,影响种植体周围的生物学效应,最终提升界面的骨结合能力,一直是近年来生物医学材料的研究热点之一。
钛种植体表面改性涂层的构建方法繁多,包括喷砂处理法、等离子喷涂法、微弧氧化法等。其中利用层层自组装(layer-by-layer self assembly,LBL)技术制备聚电解质多层膜(polyelectrolyte multilayer films,PEM)方法因简单易行、条件温和、通用性强、组装膜性能高度可调等优点获得青睐。该技术利用聚电解质分子间静电相互作用,将基材于荷相反电荷的功能分子或纳米粒子溶液中交替浸涂,即可实现构建具有预期性能,如适宜表面化学、形貌、力学和降解性能、载治疗药物且具有预定释放行为等的生物活性表面涂层。但在种植体的植入操作过程中,术者通常对种植体施加20~55Ncm扭矩,种植体表面与机体组织间存在机械摩擦力,易导致种植体表面涂层脱落。适宜的膜基结合强度是保证膜在植入时不受干扰或破坏,在植入后稳定发挥功能的基本前提。目前膜-种植体间多通过离子键、氢键等连接,膜基结合力弱且不稳定,需采用共价键或多重复合连接等来改善。
技术实现要素:
本发明的第一个目的在于提供一种抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜的制备方法,该制备方法工艺简洁,经济实用。
本发明的目的还在于提供利用上述制备方法获得的抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜,该生物活性膜与钛基底稳定结合,抗植入机械破坏能力强,力学性能可调,能促骨结合。
本发明的最后一个目的在于提供上述抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜在医用钛植入材料表面生物改性中的应用。
本发明的第一个目的是通过以下技术方案来实现的:一种抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜的制备方法,包括以下步骤:
(1)儿茶酚化脂多糖胺纳米囊泡CNP制备
选取脂多糖胺溶于磷酸盐缓冲液溶液中,配制脂多糖胺磷酸盐纳米囊泡NP溶液,在脂多糖胺磷酸盐纳米囊泡NP溶液中加入3,4-二羟基苯基丙酸和碳二亚胺,调节好反应溶液的pH值进行持续搅拌反应,将反应后溶液经透析、冻干处理,获得儿茶酚化脂多糖胺纳米囊泡CNP固体;
(2)儿茶酚化透明质酸CHA制备
避光条件下将透明质酸溶于磷酸盐缓冲液溶液中制得透明质酸溶液,在透明质酸溶液中加入碳二亚胺和多巴胺,调节好反应溶液的pH值进行持续搅拌反应,将反应后溶液经透析、冻干处理,得儿茶酚化透明质酸CHA固体;
(3)聚电解质液配制
将步骤(1)中制得的儿茶酚化脂多糖胺纳米囊泡CNP固体溶于Tris-HCl水溶液中,得儿茶酚化脂多糖胺纳米囊泡CNP溶液,将步骤(2)中制得的儿茶酚化透明质酸CHA固体溶于Tris-HCl水溶液中,得儿茶酚化透明质酸CHA溶液,将脂多糖胺溶于氯化钠水溶液中,得脂多糖胺纳米囊泡NP溶液;
(4)聚电解质膜的层层自组装过程:
4.1引发层构建:选取钛种植体,完全浸入儿茶酚化脂多糖胺纳米囊泡CNP溶液中浸泡后取出,再浸入Tris-HCl水溶液中浸泡后取出吹干,获得Ti-CNP;
4.2阴离子层构建:将步骤(4.1)获得的Ti-CNP浸入儿茶酚化透明质酸CHA溶液中浸泡后取出,再浸入Tris-HCl水溶液中浸泡后取出吹干,获得Ti-CNP-CHA;
4.3阳离子层构建:将步骤(4.2)获得的Ti-CNP-CHA完全浸入脂多糖胺纳米囊泡NP溶液中浸泡后取出,再浸入氯化钠水溶液中浸泡后取出吹干,获得Ti-CNP-(CHA-NP)1;
4.4钛表面儿茶酚化聚电解质膜的构建:以步骤(4.2)和(4.3)步骤为一个循环,重复进行多次,获得抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜,该生物活性膜的结构为Ti-CNP-(CHA/NP)n,简称为儿茶酚化聚电解质多层膜cPEM,其中n为自然数。
本发明将生物活性PEM聚电解质多层膜PEM儿茶酚化,利用儿茶酚基团和钛表面及膜内形成配位键、氢键、共价键、离子键等各种连接,实现膜-钛基表面的稳定结合,调控膜的力学性能,最终达到促进骨结合的目的。
在上述抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜的制备方法中:
步骤(1)中儿茶酚化脂多糖胺纳米囊泡CNP,其中CNP是catechol functionalized lipopolysaccharide-amine nanopolymersomes的简写。
步骤(1)中脂多糖胺LPSA的来源,可参阅本发明申请人早期申报的专利一种脂多糖胺阳离子聚合物及其制备方法和应用,申请号为201210008056.2。
步骤(1)中和步骤(3)中的纳米囊泡,其英文名称为nanopolymersomes,可简称NP。
步骤(1)中所述脂多糖胺和3,4-二羟基苯基丙酸的质量比优选为1:0.1~3,所述3,4-二羟基苯基丙酸和碳二亚胺的质量比优选为1:2~4。
步骤(1)中调节好反应溶液的pH值持续搅拌反应时,pH值优选为4.5~7.5,反应温度优选为4℃~室温,反应压力优选为常压,持续搅拌反应时间优选为4~12h。
步骤(2)中儿茶酚化透明质酸CHA,其中CHA是catechol functionalized hyaluronic acid的简称。
步骤(2)中所述透明质酸和碳二亚胺的质量比优选为2~4:1,所述透明质酸和多巴胺的质量比优选为1:0.4~4。
步骤(2)中调节好反应溶液的pH值持续搅拌反应时,pH值优选为4.5~7.5,反应温度优选为4℃~室温,反应压力优选为常压,持续搅拌反应时间优选为4~12h。
步骤(1)~(2)中透析采用透析袋,透析袋的截留分子量为3500Da,透析时间≥48h。
步骤(3)中儿茶酚化脂多糖胺纳米囊泡CNP溶液、儿茶酚化透明质酸CHA溶液和脂多糖胺纳米囊泡溶液的浓度相同,其浓度范围优选为1~5mg/mL,更佳为1mg/mL。
步骤(4.1)中选取钛种植体,完全浸入CNP溶液中浸泡5min以上(更佳为5~20min)后取出,再浸入Tris-HCl水溶液中浸泡5min以上(更佳为5~15min)后取出吹干。
步骤(4.2)中将步骤(1)获得的Ti-CNP浸入CHA溶液中浸泡5min以上(更佳为5~20min)后取出,再浸入Tris-HCl水溶液中浸泡5min以上(更佳为5~15min)后取出吹干。
步骤(4.3)中将步骤(2)中获得的Ti-CNP-CHA完全浸入脂多糖胺纳米囊泡溶液中浸泡5min以上(更佳为5~20min)后取出,再浸入Tris-HCl水溶液中浸泡5min以上(更佳为5~15min)后取出吹干。
步骤(4.4)中以步骤(4.2)和(4.3)步骤为一个循环,重复进行3次,获得抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜,该生物活性膜的结构为Ti-CNP-(CHA/NP)3。
本发明的第二个目的是通过以下技术方案来实现的:采用上述制备方法制得的抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜。
本发明的最后一个目的是通过以下技术方案来实现的:上述抗植入机械破坏、力学性能可调的钛种植体表面生物活性膜在医用钛植入材料表面生物改性中的应用。
本发明方法是通过氢键和配位键作用力在纯钛表面引入牢固结合的引发层—儿茶酚化脂多糖胺纳米囊泡层。然后主要以静电作用力、儿茶酚和氨基的化学反应、氢键等为成膜驱动力,通过阳离子聚电解质脂多糖胺纳米囊泡和阴离子聚电解质儿茶酚化透明质酸的交替沉积制备儿茶酚化聚电解质多层膜结构。
本发明对膜物理化学结构和细胞生物学效应进行表征,模拟其在临床种植体植入过程中抗机械破坏的能力及体外细胞生物学响应。结果表明,该膜具有与钛种植体结合稳定(45mN)、模拟骨植入后钛表面膜留存面积>80%、提升MSCs黏附增殖分化能力1倍以上、安全实用、成本低等优点,可单独应用或作为基因载体、药物载体应用于医用钛植入材料表面生物改性。
本发明具有以下优点:
(1)本发明将儿茶酚基团成功接枝于脂多糖胺纳米囊泡,利用儿茶酚化囊泡上的儿茶酚基团与钛表面形成类共价键结合,从而获得结合稳定、耐机械摩擦、具有较大比表面积、单层均匀铺展的纳米囊泡引发层;
(2)本发明聚电解质膜结构通过阴阳离子交替浸渍的方式构建,工艺简单、经济实用;
(3)本发明膜结构内所含CNP和脂多糖胺纳米囊泡为中空纳米结构,可以在构膜时单独使用或携带基因、药物等使用。
附图说明
图1是实施例1中获得儿茶酚化的脂多糖胺纳米囊泡CNP的反应示意图;
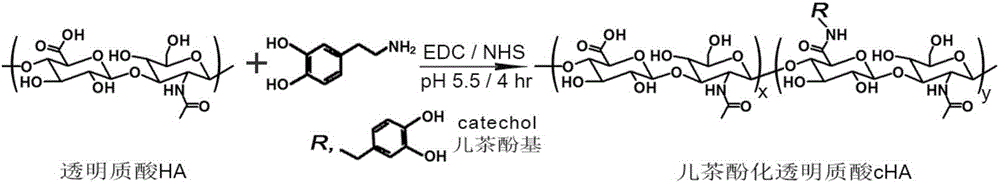
图2是实施例1中多巴胺的儿茶酚基团接枝到透明质酸合成CHA的反应示意图;
图3是实施例1中脂多糖胺纳米囊泡(A)、儿茶酚化脂多糖胺纳米囊泡(B)透射电镜图;
图4是实施例1中钛表面cPEM组装过程表面形貌的原子力显微镜观察;其中A:镀钛芯片表面形貌;B:CNP引发层表面形貌;C:cPEM膜0.5个循环(Ti-CNP-CHA)时表面形貌;D:cPEM膜1个循环[Ti-CNP-(CHA/NP)1]时表面形貌;E:cPEM膜2个循环[Ti-CNP-(CHA/NP)2]时表面形貌;F:cPEM膜3个循环[Ti-CNP-(CHA/NP)3]时表面形貌;
图5是实施例1中MSCs细胞黏附cPEM和纯钛空白对照表面15min后黏附率对比,其中cPEM表面细胞15min黏附率为86%,空白对照组为50%;
图6是实施例1中MSCs细胞在纯钛上培养1h时的激光共聚焦显微镜观察图像,MSCs细胞的肌动蛋白采用鬼笔环肽染色,其中(A)低倍(×100倍),(B)高倍(×400倍);
图7是实施例1中MSCs细胞在cPEM上培养1h时的激光共聚焦显微镜观察图像,MSCs的肌动蛋白采用鬼笔环肽染色,其中(A)低倍(×100倍)(B)高倍(×400倍);
图8是实施例2中模拟临床植入时力学环境,将Ti-cPEM植入牛骨前(A)后(B)沿纵轴逐层扫描的激光共聚焦图像;
图9是实施例2中模拟临床植入时力学环境,将Ti-cPEM植入牛骨前(A)后(B)的激光共聚焦扫描Ti-cPEM图像;
图10是实施例2中扫描电子显微镜观察聚电解质多层膜改性Ti前(A)后(B) 表面形貌,其中A:抛光钛表面;B:Ti-CNP-(CHA/NP)3;
图11是实施例2中Ti-cPEM改性前后的钛钉植入牛骨后表面形貌(扫描电镜图),其中A:纯钛钉;B:Ti-cPEM钉;C:纯钛钉的局部放大,D:Ti-cPEM钉的局部放大。
具体实施方式
下面将结合具体的实施方式进一步说明本发明,但本发明要求保护的范围并不局限于下列实施方式。
平均分子量为60K的透明质酸为柳州盛强生物科技公司购得。多巴胺(分子量153)为美国Sigma公司购得。碳二亚胺(EDC)(分子量191)为美国Aladdin公司购得。3,4-二羟基苯基丙酸(分子量182)为上海物竞公司购得。钛棒为医用纯钛,英国Goodfellow公司购得。钛种植体型号023-6510,长10mm,直径4.8mm,购于江苏创英科技公司。
实施例1
本实施例提供的抗植入机械破坏的钛种植体表面生物活性膜的制备方法,包括以下步骤:
(1)儿茶酚化脂多糖胺纳米囊泡CNP(catechol functionalized lipopolysaccharide-amine nanopolymersomes)固体制备
以碳二亚胺(EDC)为偶联剂,通过脂多糖胺LPSA纳米囊泡表面的伯胺基团与3,4-二羟基苯基丙酸(DHPP)中羧基发生缩合反应,获得儿茶酚化的脂多糖胺纳米囊泡CNP,反应示意图如图1中所述。
具体步骤如下:
以申请人前期合成的脂多糖胺(lipopolysaccharide-amine,LPSA)(申请号200910193876.1)为反应原料,以磷酸盐缓冲液(phosphate buffer saline,PBS)为溶剂,配制1mg/mL的脂多糖胺LPSA磷酸盐纳米囊泡(lipopolysaccharide-amine nanopolymersome,NP)溶液100mL,用1mol/L的NaOH和HCl调节溶液pH=5.5,依次加入0.05g 3,4-二羟基苯基丙酸(3,4-dihydroxyphenyl propionic acid)和0.1g碳二亚胺(1-ethyl-3-(3-dimethyl aminopropyl)carbodiimide hydrochloride,EDC),维持溶液pH=5.5,常温常压下持续搅拌4h,将反应后溶液转移到透析袋(透析袋截留分子量为3500Da)透析48h,冻干机中冻干,获得CNP固体;
脂多糖胺纳米囊泡(图3中A)、儿茶酚化脂多糖胺纳米囊泡(图3中B)透射电镜图如图3中所示,从图3中可以看出,脂多糖胺纳米囊泡和CNP为中空纳米结构。
(2)儿茶酚化透明质酸CHA(catechol functionalized hyaluronic acid)固体制备
利用透明质酸HA的羧基与多巴胺DA的氨基发生缩合反应脱水生成酰胺键,使多巴胺的儿茶酚基团接枝到透明质酸合成CHA,反应示意图如图2中所示。
具体步骤如下:
避光条件下将1g透明质酸(hyaluronic acid,HA)溶解于100mL磷酸盐缓冲液(phosphate buffer saline,PBS)(pH=5.5,pH调节均使用1mol/L的NaOH和HCl),依次加入0.50g碳二亚胺(1-ethyl-3-(3-dimethyl aminopropyl)carbodiimide hydrochloride,EDC)、0.45g多巴胺(dopamine,DA),维持溶液pH=5.5,常温常压下持续搅拌4h,将反应后溶液转移至透析袋(截留分子量3500Dalton)透析48h,转移至冻干机内冻干,获得具备不同儿茶酚接枝率的CHA固体,室温密闭保存。
(3)聚电解质液配制
分别配制下面的溶液:
配制含0.15mol/L NaCl的去离子水溶液;
配制含10mmol/L Tris-HCl的去离子水溶液;
以含0.15mol/L NaCl的去离子水为溶剂,配制1mg/mL脂多糖胺纳米囊泡溶液;
以含10mmol/L Tris-HCl的去离子水为溶剂,配制1mg/mL CHA溶液;
以含10mmol/L Tris-HCl的去离子水为溶剂,配制1mg/mL CNP溶液。
(4)聚电解质膜的层层自组装过程:
4.1引发层构建
首先将钛种植体完全浸入CNP溶液10min,在钛表面通过配位键和氢键作用形成CNP阳离子引发层,然后小心取出钛片浸入清洗液10mmol/L Tris-HCl溶液,浸泡5min取出,氮气吹干,获得Ti-CNP;
其中,钛种植体为钛片,钛片是将钛棒(钛棒为医用纯钛,英国Goodfellow公司购得)切割为直径10mm、厚2mm的圆形钛片,依次使用500、1000、1500、2000目砂纸逐级打磨抛光。丙酮、无水乙醇、去离子水依次超声清洗15min,氮气吹干,高温灭菌备用。
4.2阴离子层构建
将Ti-CNP片浸入CHA溶液10min取出,使钛表面形成CHA阴离子层,然后再浸入清洗液10mmol/L Tris-HCl溶液,浸泡5min取出,氮气吹干,获得Ti-CNP-CHA。
4.3阳离子层构建
将Ti-CNP-CHA完全浸入脂多糖胺纳米囊泡溶液10min,在钛表面形成脂多糖胺纳米囊泡阳离子层,使用清洗液0.15mol/L的NaCl溶液浸泡5min,氮气吹干,获得Ti-CNP-(CHA-NP)1,其中“1”表示钛片依次浸泡在CHA和NP溶液中形成的1个循环。
4.4钛表面儿茶酚化聚电解质膜的构建
以步骤(4.2)和步骤(4.3)为一个循环,进行3循环,获得钛表面儿茶酚化聚电解质膜,构建的膜表达式定义为Ti-CNP-(CHA/NP)3,简化为Ti-cPEM。
采用上述获得的Ti-cPEM进行试验,结果如下:
每组取试件5个,临界点干燥,利用激光共聚焦仪测量试件表面粗糙度Ra值,每个试件任取4个测试点,结果为136±30nm。
利用压痕划痕仪进行划痕实验,测量试件表面聚电解质膜与钛基底间结合能力,实验中使用Berkovich划痕压头(规格半径≤20nm,角度35.26°),每个试件任取4个测试点,结果44.99±12.5mN。
Ti-cPEM膜表面形貌观察:
钛表面cPEM组装过程表面形貌的原子力显微镜观察如图4中所示,其中A:镀钛芯片表面形貌;B:CNP引发层表面形貌,CNP均匀散在分布,颗粒大小均一,呈类球形;C:cPEM膜0.5循环(Ti-CNP-CHA)时表面形貌;D:cPEM膜1个循环[Ti-CNP-(CHA/NP)1]时表面形貌;E:cPEM膜2循环[Ti-CNP-(CHA/NP)2]时表面形貌;F:cPEM膜3个循环[Ti-CNP-(CHA/NP)3]时表面形貌。C~F可见膜表面粒子逐渐聚集、连接成片。
利用原子力显微镜观察在镀钛芯片(QCM用)表面组装过程中聚电解质膜cPEM形貌变化,可见组装引发层CNP后,表面吸附一层均匀、散在分布的类球形纳米粒子。进一步组装透明质酸后,表面变化不明显,局部可见较大直径的纳米颗粒聚集。组装第1个循环后(图D),芯片表面形貌出现显著变化,纳米颗粒聚集,聚集体直径大于5μm,芯片表面膜覆盖率接近50%,随着组装层数的增加,纳米粒子进一步增加,并逐渐连接成片,覆盖芯片表面,局部可见致密大聚集体。
采用全骨髓培养法培养大鼠MSCs,MSCs细胞传至第三代用于后续实验。以纯钛为空白对照组。检测细胞15min黏附率。结果如图5所示,显示cPEM表面细胞15min黏附率达86%,空白对照组仅为50%。
利用激光共聚焦显微镜观察MSCs细胞黏附1h时的肌动蛋白微丝铺展情况如图6-7所示。其中图6-图7中A图为低倍(×100倍)、B图为高倍(×400倍),由图6中可见,纯钛表面细胞未完全伸展,胞体内微丝不清晰,由图7可见cPEM组试件表面细胞呈多边形,细胞轮廓清晰,微丝丰富,可见丝状伪足向试件表面铺展。
检测表面MSCs细胞24h增殖能力显示MSCs增殖分化能力提升100%。对MSCs进行成骨诱导,发现7d时MSCs细胞碱性磷酸酶(alkaline phosphatase,ALP)活性提升140%,21d细胞钙结节量增加104%。
实施例2
与实施例1不同的是,实施例2膜构建是在钛种植体上制备,钛种植体型号023-6510,长10mm,直径4.8mm,购于江苏创英科技公司。
将实施例1中的脂多糖胺纳米囊泡溶液更换成绿色荧光标记的脂多糖胺纳米囊泡溶液,按实施例1的步骤在钛种植体表面构建绿色荧光标记的儿茶酚化聚电解质膜,然后进行如下试验。
其中绿色荧光标记的脂多糖胺纳米囊泡溶液的制备方法如下:
以含0.15mol/L NaCl的去离子水为溶剂,配制1mg/mL绿色荧光标记的脂多糖胺纳米囊泡溶液,其中绿色荧光标记的脂多糖胺纳米囊泡制备步骤如下:
分别配制1mg/mL脂多糖胺纳米囊泡/水溶液、2mg/mL异硫氰酸荧光素FITC/0.1mol/L硼酸盐缓冲液溶液(pH8.5),然后将2种溶液等体积混合,室温下避光搅拌反应,4小时后停止反应,将反应混合物用透析袋(截留分子量3500Dalton)透析24小时,再过滤、冻干即得绿色荧光标记的脂多糖胺纳米囊泡溶液。注意,凡是与FITC有关的操作均应避光。
膜抗植入机械破坏的临床模拟实验。牛肋骨去除肋骨表面软组织,选择总厚度>1cm,骨皮质1~2mm厚度,含松质骨部分作为植入点。麻花钻22#1500r/min打孔10mm深,后逐级更换为28#、35#、42#扩孔至孔径4.2mm。使用42#麻花钻进一步扩大骨皮质部分至约4.8mm。取下麻花钻,更换为连接携带器及种植体,按照30Nm扭矩植入种植体。植入深度达10mm停止植入,静置1min,缓慢旋出,浸泡在1ml生理盐水中洗去表面残渣,置于EP管4度避光保存。300μL生理盐水冲洗种植窝,收集冲洗后的生理盐水4度保存,以供后续检测。将试验后种植体进行激光共聚焦扫描,对比植入前后种植体表面绿色荧光强度及范围,观察膜是否被破环。
结果如图8-9所示,图8是模拟临床植入力学环境,将Ti-cPEM钛钉植入牛骨前(A)后(B)的激光共聚焦逐层扫描照片(沿钛钉纵轴扫描),图8中可见,植入前Ti-cPEM钉各层面荧光显色完整,膜覆盖均匀;植入后各层面荧光大面积存留,局部有少量脱色。
图9是模拟临床植入力学环境,将Ti-cPEM钛钉植入牛骨前(A)后(B)底面激光共聚焦扫描照片。由图9中可见,植入前Ti-cPEM钉底面膜层荧光显色完整,膜覆盖较均匀,植入后大部分膜层存留,仅有少量局部剥脱。说明儿茶酚化的cPEM改性膜与钛基底结合牢固,基本能耐受临床植入时的机械破坏,为植入后改性膜发挥其生物活性提供了必要条件。
图10是钛改性前后表面扫描电镜照片,其中A图为抛光钛表面;B图为Ti-CNP-(CHA/NP)3(其中CNP中氨基、CHA中羧基被儿茶酚取代的摩尔百分比分别为40%、30%,与实施例1中相同)。由图8中可见,抛光钛表面较粗糙,抛光划痕可见,而组装聚电解质多层膜后,样品表面变得更光滑,且质地均一。
图11是cPEM改性前后的钛钉植入牛骨后表面形貌(扫描电镜图)。其中A:纯钛钉;B:Ti-cPEM钉;C:纯钛钉的局部放大,D:Ti-cPEM钉的局部放大。A图和B图中可见,植入后的种植体表面粘附部分组织块,局部可见种植体表面划痕,cPEM覆膜种植体表面粘附组织块稍多于纯钛表面;C图可见纯钛种植体表面划痕清晰,D图可见聚电解质膜覆盖大部分表面,膜脱落较少,划痕较轻微,划痕印迹模糊。
实施例3
钛表面儿茶酚化聚电解质生物活性膜的制备如下:
(1)儿茶酚化脂多糖胺纳米囊泡CNP固体制备
以申请人前期合成的脂多糖胺(lipopolysaccharide-amine,LPSA)(申请号200910193876.1)为反应原料,以磷酸盐缓冲液(phosphate buffer saline,PBS)为溶剂,配制1mg/mL的脂多糖胺磷酸盐纳米囊(NP)溶液100mL,使用1mol/L的NaOH和HCl调节pH至4.75,依次加入0.1g 3,4-二羟基苯基丙酸(3,4-dihydroxyphenyl propionic acid)和0.2g碳二亚胺(1-ethyl-3-(3-dimethyl aminopropyl)carbodiimide hydrochloride,EDC),维持溶液pH=4.75,4℃常压持续搅拌12h,将反应后溶液转移到透析袋(截留分子量3500Dalton)透析48h,冻干机中冻干,获得儿茶酚取代度为56%(接枝率)的儿茶酚化脂多糖胺纳米囊泡CNP固体。
(2)CHA固体制备
将1g透明质酸(hyaluronic acid,HA)溶解于100mL磷酸盐缓冲液(phosphate buffer saline,PBS)(pH=5.5,pH调节均使用1mol/L的NaOH和HCl),依次加入0.50g碳二亚胺(1-ethyl-3-(3-dimethyl aminopropyl)carbodiimide hydrochloride,EDC)、0.92g多巴胺(dopamine),维持溶液pH=5.5,4℃常压下持续搅拌12h,然后将反应溶液转移至透析袋(截留分子量3500Dalton)透析48h、再转移至冻干机内冻干,获得儿茶酚接枝率为19%的cHA固体,室温密闭保存。
后续(3)、(4)、(5)步骤同实施例1,获得儿茶酚化聚电解质多层膜改性钛种植体后,继续进行细胞及牛骨植入实验等,结果类似实施例1。
上面列举一部分具体实施例对本发明进行说明,有必要在此指出的是上下具体实施例只用于对本发明作进一步的说明,不代表对本发明保护范围的限制。其他人根据本发明作出的一些非本质的修改和调整仍属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!