负载有药物的纳米粒载体温敏凝胶复合系统及其制备方法与流程
本发明属于医药技术领域,更具体涉及一种负载有药物或基因的纳米粒载体温敏凝胶复合系统及其制备方法。
背景技术:
膝骨关节炎(OA)是以关节软骨的破坏和骨质增生为特点的最常见的慢性骨关节病,是导致老年人关节疼痛及功能障碍的主要原因之一。据世界卫生组织统计,50岁以上的人群中,OA的发病率为50%,55岁以上的人群中,发病率为80%,因此OA又被称为人类的“下半生疾病”,已成为仅次于心血管疾病的第2号杀手。OA导致的疼痛和功能障碍将影响患者的生活质量并给家庭和社会带来极大的经济负担。因此研发有效的治疗OA方案具有很重要的意义和社会价值。
骨与骨之间连接的地方称为关节,关节的主要结构包括关节面、关节腔和关节囊三部分。关节腔内含有少量滑膜液,使关节保持湿润和滑润。此外,关节腔并不是一个封闭的空间,里面的滑液不停的置换更新(2h或小于2h)流入滑膜内衬下面的淋巴管。这也导致小分子药物从关节腔内被快速清除,缩短了药物在局部的作用时间。关节囊分为内、外两层,外层为厚而坚韧的纤维层,内层为滑膜层。滑膜层允许分子量小于10000的物质自由通过,这也造成了关节内的药物迅速渗漏进入血液循环引起全身吸收,存在严重的毒副反应。
目前OA的治疗目的在于缓解症状,改善关节功能,避免或减少关节畸形,减慢病情进展及修复受损关节。治疗OA的方法较多,主要包括手术、药物和辅助治疗三种。治疗OA的药物主要包括一般镇痛药、非甾体类抗炎药、激素类药物、中药、营养物质和玻璃酸钠(SH)等。常用的给药途径包括口服、局部外用和关节腔注射。关节腔给药可以在降低全身毒性的情况下使高剂量的药物到达关节腔,直接将药物输送至炎症部位,改变药物在体内的分布模式,避开药物在体内转运中的生理屏障,以最小的药量发挥最大的药效。因此,关节腔注射给药能有效的降低药物用量,减轻毒副作用;可显著地控制病情进展,有效改善关节功能,充分提高患者的生活质量。
申请号为201510043498.4的中国发明专利,公开了一种多细胞因子序贯缓释微球-水凝胶复合系统及其制备方法。制备的复合系统能够持续缓释3种生长因子,并聚集干细胞于软骨损伤部位,以提高关节软骨损伤的修复效果。但是存在细胞因子在长期释放过程中的稳定性问题。同样地,申请号为201510453601.2的中国发明专利公开了一种治疗骨关节炎的细胞制剂及其制备方法。该细胞制剂主要由间充质干细胞、经过诱导分化的干细胞、富含血小板血浆以及他们的分散介质组成,用于炎症的缓解和损伤的修复。但是这种细胞制剂在实际临床应用中的长期安全性有待进一步研究。
技术实现要素:
本发明的目的是提供一种可负载药物的纳米粒载体温敏凝胶复合系统的制备方法。
根据本发明的一个方面,提供了一种负载有药物的纳米粒载体温敏凝胶复合系统的制备方法,包括如下步骤:
准备纳米粒载体,纳米粒载体为末端为氨基或羟基的聚酰胺-胺型树状大分子;
通过共价键合的方式将药物分子与聚酰胺-胺型树状大分子末端的氨基或羟基连接,制得负载有药物的聚酰胺-胺型树状大分子聚合物;
制备水凝胶,水凝胶为PLGA-PEG-PLGA共聚物,PLGA为丙交酯-乙交酯共聚物,PEG为聚乙二醇聚合物;
将PLGA-PEG-PLGA共聚物置于溶剂中制得共聚物溶液;
在搅拌下,将负载有药物的聚酰胺-胺型树状大分子聚合物加入共聚物溶液中,继续搅拌得负载有药物分子的纳米粒载体水凝胶复合系统。
在一些实施方式中,丙交酯与乙交酯的摩尔比为4-6:1。
在一些实施方式中,聚乙二醇聚合物的数均分子量为1500。
在一些实施方式中,聚乙二醇聚合物占PLGA-PEG-PLGA共聚物的质量百分数为28%-35%。
在一些实施方式中,纳米粒载体与水凝胶的质量体积百分比为0.5%-5%。
在一些实施方式中,药物分子选自镇痛剂、非甾体类抗炎药、激素类药物及刺激骨髓间充质干细胞分化为软骨细胞小分子药物中的一种。
在一些实施方式中,溶剂选自注射用水或生理盐水。
在一些实施方式中,共聚物溶液的浓度为18-30wt%。
其有益效果为:本发明首先将药物与纳米载体相连,在将负载有药物的那你离载体包覆于水凝胶中,得到负载有药物的纳米粒载体水凝胶系统,此系统具有双重缓释的作用,并刺激滑膜间充质细胞发育为软骨细胞,减缓软骨损伤部位炎症,提高关节软骨损伤修复进程。
本发明的水凝胶PLGA-PEG-PLGA嵌段共聚物在低温、低浓度条件下以液体的形态存在,当负载有药物或基因的系统进入关节时,由于环境温度升高达到临界胶束温度以上,水凝胶浓度也达到临界聚集浓度以上时,溶液会迅速发生相转变,在给药部位形成半固体凝胶态,这些凝胶可填充于关节组织的间隙,使得给药部位药物滞留时间延长,从而延缓药物的释放,有利于维持局部的药物浓度,适用于患者的关节治疗;
本发明的LGA-PEG-PLGA嵌段共聚物水凝胶是以具有两个端羟基的聚乙二醇作为引发物,对环化的丙交酯和乙交酯进行开环聚合,一步反应就可以得到,并且产物的纯化在水中进行,操作简单安全;
本发明的聚酰胺-胺型树枝状大分子能物理包埋或化学结合小分子药物,其表面的官能团还能连接多种对机体某些器官、组织和细胞有特异性相互作用的靶向配基,从而将包封或者偶联的药物带到病变部位实现主动靶向治疗;PLGA-PEG-PLGA嵌段共聚物水凝胶中的聚乙二醇具有优良的亲水性,且无毒,无免疫原性;PEG不仅可降低负载有药物或基因的聚酰胺-胺型树枝状大分子的毒性,提高其安全性,而且可进一步提高其分子量和亲水性,从而减少滑膜巨噬细胞的摄取及药物的渗漏,提高其稳定性,延长关节腔中的滞留时间,提高疗效。
附图说明
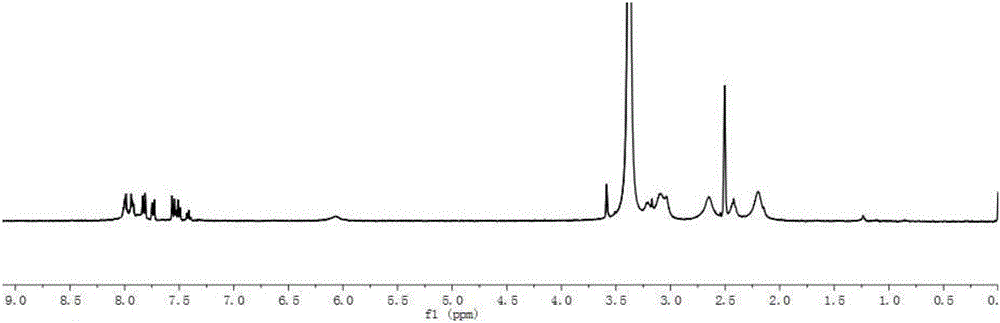
图1为Kartogenin(KGN)的1HNMR图。
图2是本发明实施例1制得的负载有Kartogenin(KGN)的聚酰胺-胺型树状大分子(PAMAM)聚合物的1H NMR图;
图3是本发明实施例1制得的PLGA-PEG-PLGA嵌段共聚物的1H NMR图;
图4是本发明实施例1制得的PLGA-PEG-PLGA凝胶溶液的相转变温度图和储能模量变化图;
图5本发明实施例1的负载有KGN的纳米粒载体温敏凝胶复合系统的体外释放曲线图。
具体实施方式
骨髓间质干细胞(BMSCs)的分离和培养
Wistar大鼠腹腔注射麻醉后脱颈处死,酒精浸泡大鼠15-20min;无菌取双后肢,放入体积分数75%的乙醇浸泡5min;清除下肢肌肉,从膝关节断离股骨。剪开股骨两端,用10ml注射器吸取含体积分数10%胎牛血清的DMEM/F12培养液冲洗骨髓腔,收集骨髓冲洗液,制成单细胞悬液,200目筛网滤过后以1×108/L接种于75cm2培养瓶中,37℃、体积分数5%CO2培养箱中培养。72h首次更换培养液,去除未贴壁细胞,以后每2d换液1次。当细胞铺满整个培养瓶底面积的80%-90%时,传代培养。之后,细胞长满瓶底2/3时即可再次传代扩增,利用差速贴壁法分离纯化MSCs。
KGN的合成及表征
邻苯二甲酸酐(1.05equiv)溶解在无水氯仿/四氢呋喃(3:1)中,然后加入相应量的(1equiv)的4-胺基联苯。混合液室温搅拌2~3h,旋蒸除去有机溶剂,得到kartogenin粗品。所得粗品溶于适量乙酸乙酯中,饱和盐水清洗(×2),硫酸钠干燥,有机溶剂减压浓缩,硅胶柱纯化,如图1所示,1H NMR表征合成产物。
反应式如下:
实施例1
负载有Kartogenin(KGN)的聚酰胺-胺型树状大分子(PAMAM)聚合物即PAMAM-NH2-KGN的制备
Kartogenin和三乙胺溶于4mL二甲基甲酰胺(DMF)中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC.HCl),氮气保护,室温避光反应1h,然后加入N-羟基琥珀酰亚胺(NHS),相同条件下继续反应12h,最后加入PAMAM-NH2(Molar ratio,KGN与PAMAM的摩尔比为25:1)继续反应24h。反应结束后用水透析除去DMF,超滤浓缩后葡聚糖G25凝胶柱纯化,收集先流出的大分子部分,再次超滤浓缩,冷冻干燥得固体即PAMAM-NH2-KGN。图1为合成产物的1H NMR表征。如图1所示,7.3-8.3ppm为KGN的特征质子峰,2.25ppm为PAMAM的特征质子峰。
PLGA-PEG-PLGA嵌段共聚物的合成及表征
聚乙二醇(PEG)在异辛酸亚锡催化作用下与乙交酯、D,L-丙交酯开环聚合反应生成透明粘稠胶体,PEG与(D,L-丙交酯+乙交酯)的重量比为1:2.3,D,L-丙交酯与乙交酯的摩尔比为1:5,PEG重量为1g,D,L-丙交酯的重量2.05g,乙交酯的重量约为0.25,冻干得PLGA-PEG-PLGA嵌段共聚物。所制备的PLGA-PEG-PLGA嵌段共聚物为略带粘稠的、淡黄色的、透明胶状物。
反应式如下:
图2为PLGA-PEG-PLGA嵌段共聚物的1H NMR表征。如图2所示,a-1.55ppm峰是乳酸中甲基-CH3的质子峰,b-3.60ppm是聚乙二醇主链中重复单元亚甲基-CH2的质子峰,c-4.36ppm是乙二醇与乙交酯(或丙交酯)所连亚甲基-CH2的质子峰,聚乙二醇中靠近PLGA嵌段的两个亚甲基-CH2的质子峰位于d-4.80ppm。e-5.20ppm是乳酸中次甲基-CH的质子峰。
不同浓度的PLGA-PEG-PLGA凝胶溶液相转变温度测定
聚合物凝胶的相转变温度采用的是试管倒置法。制备一系列浓度的PLGA-PEG-PLGA共聚物水溶液,取1mL将其加入直径为10mm的玻璃瓶中,将玻璃瓶放在4℃冰箱去除气泡,恒温24h,取出后置于恒温的20℃水浴中,每摄氏度下稳定15min,取出倒置180°,30s内看玻璃瓶底的凝胶是否流动,每次升温1℃,然后重复以上步骤,直到凝胶30s内不发生流动现象,我们就说共聚物发生了sol-gel的相转变,则此时温度为相转变温度。
负载有KGN药物分子的纳米粒载体温敏凝胶复合系统即KGN/PLGA-PEG-PLGA的制备
将2g上述PLGA-PEG-PLGA共聚物置于10ml溶剂中制得共聚物溶液;
在搅拌下,将0.2g上述PAMAM-NH2-KGN加入共聚物溶液中,继续搅拌得负载有KGN药物分子的纳米凝胶复合系统即KGN/PLGA-PEG-PLGA。
PLGA-PEG-PLGA凝胶溶液的相转变温度和储能模量变化如图4所示。
KGN/PLGA-PEG-PLGA复合系统的体外释放实验
步骤1:空白温敏凝胶的制备
精密称量2g上述PLGA-PEG-PLGA共聚物适量于烧杯中,加入10ml的蒸馏水,于4℃冰箱中保存至凝胶充分的溶胀,然后不断搅拌直至共聚物溶解、分散均匀,得到略带黄色透明的PLGA-PEG-PLGA共聚物温敏凝胶溶液即空白温敏凝胶。
步骤2:KGN/PLGA-PEG-PLGA温敏凝胶的体外释放
选用pH7.4的磷酸缓冲液作为体外释放介质,由于周期较长,故加入0.02%叠氮钠作为防腐剂。
在底部内径为10mm的具塞玻璃管中加入上述KGN/PLGA-PEG-PLGA复合物的水溶液,然后放入37±1℃的恒温水浴摇床中(35stocks/min)。首先,水浴中放置10min而使其成为凝胶。然后加入pH7.4的磷酸盐缓冲溶液6mL,其中含有0.02%叠氮钠。每次取样3mL,同时加入相同温度体积的新鲜缓冲溶液以达到漏槽条件。以不载药的水凝胶作为空白参照,同时在相同时间点间隔取样。紫外分光光度法测定KGN在最大吸收波长处的吸光度值,空白参照用来校正降解产物对于紫外测试的干扰。实验结果如图3所示,PLGA-PEG-PLGA温敏凝胶对KGN的释放起到明显的缓释作用。
以上所述的仅是本发明的一些实施方式。对于本领域普通技术人员来讲,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!