干扰素调节因子2结合蛋白2在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种干扰素调节因子2结合蛋白2(Interferonregulatoryfactor2bindingprotein2,IRF2BP2)作为靶基因在制备预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物中应用。
背景技术:
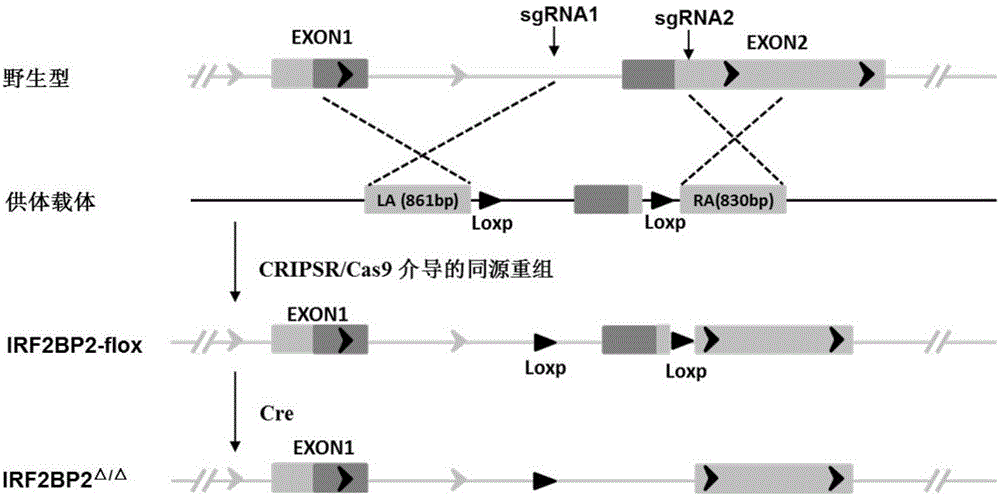
:糖尿病是一组以血葡萄糖水平增高为特征的慢性代谢性疾病,其患病率正随着人类生活水平的提高、生活方式的改变、人口老龄化以及早期筛查率的提高而急剧增加,逐渐成为继恶性肿瘤和心血管疾病之后第三大严重威胁人类健康的世界性公共卫生问题。目前我国20岁以上人群糖尿病的患病率为10.3~12.8%,而糖尿病前期的患病率更是高达14.7%。1980年开展的人口糖尿病调查发现其患病率仅为0.67%;1994年糖尿病普查发现患病率上升至2.28%;1996年对人口的糖尿病抽样调查显示患病率为3.62%;2002年的调查发现我国城市糖尿病患病率约为4.5%,农村为1.8%;2010年人口糖尿病调查显示其患病率已高达9.65%[1]。总之,目前中国糖尿病患者总数高居世界第一的事实已经不容争辩,并且世界卫生组织预测至2025年全球糖尿病患者将突破1.3亿大军,而用于这部分疾病管理的费用将占医疗总开支的40%[2],将为人类社会带来极其沉重的负担。世界卫生组织(1999年)依据糖尿病病因及发病机制将其分为Ⅰ型糖尿病、Ⅱ型糖尿病、妊娠糖尿病和特殊类型糖尿病,其中Ⅱ型糖尿病约占糖尿病总数的90%。Ⅱ型糖尿病的发病机制目前尚不清楚,胰岛素抵抗与胰岛素β细胞功能障碍被认为是其发病的重要机制。Ⅱ型糖尿病的多种慢性并发症如糖尿病肾病、糖尿病视网膜病变、糖尿病相关的心脑血管疾病以及“糖尿病足”已得到人们的充分认识,也是其致死致残的主要原因。此外,糖尿病与非酒精性脂肪肝病(nonalcoholicfattyliverdisease,NAFLD)之间的联系也得到了广泛关注,非酒精性脂肪肝是一种与肥胖和Ⅱ型糖尿病相互影响的临床综合征。NAFLD确切的发病机制至今尚未阐明,其中胰岛素抵抗及其相关代谢紊乱在NAFLD的发生发展过程中具有重要作用。研究显示,NAFLD是Ⅱ型糖尿病发病率和死亡率的主要促进因素,因而研究Ⅱ型糖尿病与NAFLD之间的关系以及防治Ⅱ型糖尿病的慢性并发症显得尤为重要。IRF2BP2是一种属于IRF2BP家族的转录因子。IRF2BP家族包括IRF2BP1、IRF2BP2和IRF2BPL三个成员,其中IRF2BP2包括两种选择性剪接亚型IRF2BP2A和IRF2BP2B。IRF2BP2包含一个大约64个氨基酸组成的N末端锌指结构域(Zincfingerdomain)和一个大约82个氨基酸组成的C末端指环结构域(RINGfingerdomain),二者是IRF2BP2蛋白的保守结构域,在众多细胞病理生理活动中发挥重要作用。IRF2BP2最早通过酵母双杂交系统筛选作为IRF2的转录因子共同作用因子被鉴定[3]。研究表明,IRF2BP2作为p53的靶基因通过染色质免疫共沉淀实验(ChromatinImmunoprecipitationAssay)得到了验证,同时IRF2BP2能够作为p53的转录共抑制因子,抑制p53下游的基因如p21和BAX的表达,从而在细胞周期、细胞分化及细胞凋亡等生物过程中发挥重要作用[4];IRF2BP2与NFAT1结合形成转录因子复合物,抑制NFAT1下游基因的初始转录及增强子活化性转录[5];当心肌和骨骼肌处于缺血状态时,IRF2BP2作为VGLL4(Vestigial-like4)的共激活因子,促进VEGFA(VascularendothelialgrowthfactorA)表达进而在血管再生中发挥重要作用[6];在小鼠动脉粥样硬化模型中,IRF2BP2与MEF2(Myocyteenhancerfactor2)互相作用共同促进KLF2(Kruppel-likefactor2)的表达,进而抑制巨噬细胞向M1型极化和促进胆固醇代谢平衡[7];IRF2BP2能够与其家族中的另两个成员IRF2BP1和IRF2BPL结合,三者共同形成转录因子复合物,抑制乳腺癌细胞的凋亡[8]。最近研究发现,IRF2BP2与ETO2(Eight-twenty-one2)相互结合形成转录共抑制因子,在红细胞的分化发育过程中作用显著[9]。除此之外,IRF2BP2基因分别与CDX1和BCL1/JH等基因形成融合基因在间叶细胞软骨肉瘤和多发性骨髓瘤中发挥作用[10,11]。参考文献:[1]廖涌.中国糖尿病的流行病学现状及展望[J].重庆医科大学学报,2015,40(7).[2]FaragYM,GaballaMR.Diabesity:anoverviewofarisingepidemic[J].NephrolDialTransplant,2011,26(1):28-35.[3]ChildsKS,GoodbournS.Identificationofnovelco-repressormoleculesforInterferonRegulatoryFactor-2[J].NucleicAcidsRes,2003,31(12):3016-3026.[4]KoeppelM,vanHeeringenSJ,SmeenkL,etal.Thenovelp53targetgeneIRF2BP2participatesincellsurvivalduringthep53stressresponse[J].NucleicAcidsRes,2009,37(2):322-335.[5]CarneiroFR,Ramalho-OliveiraR,MognolGP,etal.Interferonregulatoryfactor2bindingprotein2isanewNFAT1partnerandrepressesitstranscriptionalactivity[J].MolCellBiol,2011,31(14):2889-2901.[6]TengAC,KuraitisD,DeekeSA,etal.IRF2BP2isaskeletalandcardiacmuscle-enrichedischemia-inducibleactivatorofVEGFAexpression[J].FASEBJ,2010,24(12):4825-4834.[7]ChenHH,KeyhanianK,ZhouX,etal.IRF2BP2ReducesMacrophageInflammationandSusceptibilitytoAtherosclerosis[J].CircRes,2015,117(8):671-683.[8]YeungKT,DasS,ZhangJ,etal.AnoveltranscriptioncomplexthatselectivelymodulatesapoptosisofbreastcancercellsthroughregulationofFASTKD2[J].MolCellBiol,2011,31(11):2287-2298.[9]StadhoudersR,CicoA,StephenT,etal.Controlofdevelopmentallyprimederythroidgenesbycombinatorialco-repressoractions[J].NatCommun,2015,6:8893.[10]NyquistKB,PanagopoulosI,ThorsenJ,etal.Whole-transcriptomesequencingidentifiesnovelIRF2BP2-CDX1fusiongenebroughtaboutbytranslocationt(1;5)(q42;q32)inmesenchymalchondrosarcoma[J].PLoSOne,2012,7(11):e49705.[11]NiIB,ChingNC,MengCK,etal.Translocationt(11;14)(q13;q32)andgenomicimbalancesinmulti-ethnicmultiplemyelomapatients:aMalaysianstudy[J].HematolRep,2012,4(3):e19。技术实现要素:为解决上述现有技术的缺陷和不足,本发明的目的在于提供一种IRF2BP2基因的表达与脂肪肝和Ⅱ型糖尿病之间的相互关系,提供一个用于治疗脂肪肝和Ⅱ型糖尿病的靶基因IRF2BP2的新用途,进而将IRF2BP2基因应用于脂肪肝和Ⅱ型糖尿病的治疗。本发明的目的通过下述技术方案实现:本发明以基因敲除工具鼠(Alb-cre)与IRF2BP2肝细胞特异性基因敲除小鼠(IRF2BP2Δ/Δ)为实验对象,通过高脂饮食(Highfatdiet)诱导的肥胖小鼠模型(dietinducedobesity,DIO)研究IRF2BP2基因的功能,结果发现与Alb-cre小鼠相比,IRF2BP2Δ/Δ小鼠表现出肥胖,其体重及空腹血糖水平明显高于高脂饲料饲养的Alb-cre小鼠,进一步通过腹腔注射葡萄糖耐量实验发现肝细胞特异性IRF2BP2基因敲除小鼠对葡萄糖的耐受能力明显减弱。小鼠肝脏重量及肝脏/体重比以及病理染色结果等均表明高脂饮食诱导后IRF2BP2Δ/Δ小鼠脂肪肝病变更严重,脂质蓄积显著增加。以上这些结果表明肝细胞特异性IRF2BP2基因敲除会加剧脂肪肝和Ⅱ型糖尿病的发生,IRF2BP2基因能够抑制脂肪肝和Ⅱ型糖尿病。本发明人的研究证明了:在高脂饮食诱导的脂肪肝和Ⅱ型糖尿病模型中,IRF2BP2具有抑制肥胖,减少肝脏脂质蓄积,保护肝脏功能;降低血糖,增强葡糖耐受能力。针对IRF2BP2的上述功能,提供IRF2BP2作为药物靶标在筛选保护肝脏及维持糖代谢稳态的药物中的应用。针对IRF2BP2的上述功能,提供IRF2BP2作为药物靶标在筛选预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物中的应用。以上药物是指能够促进IRF2BP2基因表达的药物。本发明相对于现有技术具有如下的优点及效果:(1)本发明发现IRF2BP2基因的新功能,即IRF2BP2基因具有能够保护脂肪肝和Ⅱ型糖尿病疾病的作用。(2)基于IRF2BP2在保护脂肪肝和Ⅱ型糖尿病疾病中的作用,其可以用于制备预防、缓解和/或治疗脂肪肝和/或Ⅱ型糖尿病的药物。附图说明图1是肝细胞特异性IRF2BP2基因敲除小鼠的构建策略图。图2是Alb-cre和IRF2BP2Δ/Δ小鼠的体重、空腹血糖结果图;A为小鼠体重结果图,B为空腹血糖水平统计图(*:p<0.05vsAlb-creNC组,**:p<0.01vsAlb-creNC组,#:p<0.05vsAlb-creHFD组,##:p<0.01vsAlb-creHFD组)。图3是Alb-cre和IRF2BP2Δ/Δ小鼠通过腹腔注射葡萄糖耐量实验结果图;A为通过腹腔注射葡萄糖后不同时间点小鼠血糖水平统计图,B为各组小鼠糖耐量曲线下面积(areaunderthecurve,AUC)比较图(**:p<0.01vsAlb-creNC组,##:p<0.01vsAlb-creHFD组)。图4是Alb-cre和IRF2BP2Δ/Δ小鼠肝脏重量、肝脏重/体重比图;A为肝脏重量、B为肝脏重量与体重比值统计柱状图(##:p<0.01vsAlb-creHFD组)。图5是Alb-cre和IRF2BP2Δ/Δ小鼠肝脏组织HE和油红O染色图。具体实施方式通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。实验用动物及饲养:实验动物种属,性别,周龄及来源:C57BL/6小鼠、IRF2BP2肝脏特异性基因敲除(IRF2BP2Δ/Δ)小鼠和肝细胞特异性表达的Cre转基因小鼠Alb-Cre(购自TheJacksonLaboratory,货号003574),雄性,8周龄。C57BL/6小鼠购自北京华阜康生物科技有限公司,IRF2BP2肝脏特异性基因敲除小鼠由IRF2BP2-flox小鼠Alb-Cre杂交得到,构建策略见图1。肝脏特异性IRF2BP2基因敲除小鼠的构建:根据基因信息,利用CRISPRDesign(网址:http://crispr.mit.edu/)分别在内含子1和外显子2的非编码区中各设计一个CRISPR的打靶位点。靶序列分别为:IRF2BP2sgRNA1:GGGTTGATAGGCAGCGACACGGGGIRF2BP2sgRNA2:GGCTATATTTTTTTTGACGACAAAAGG此外还设计了一个用于同源修复的供体质粒(DonorVector),它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。(1)打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4DNA连接酶连入经过限制性内切酶处理过的pUC57-sgRNA载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。(2)条件性敲除骨架载体pBluescriptSK(+)-2loxp的构建:分别合成4条寡聚单链核苷酸序列:loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT,loxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA,loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescriptIISK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescriptSK(+)-2loxp。(3)供体载体的构建:根据引物设计原则,设计如下引物(表1)用于扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。扩增得到的产物连接入经表1中3对限制性内切酶依次酶切的pBluescriptSK(+)-2loxp载体中,得到DonorVector。表1构建供体载体所需引物序列及对应酶切位点引物名称引物序列酶切位点IRF2BP2LA-FCCGCTCGAGCCAACGGGTTCTCCAAACTGXhoIIRF2BP2LA-RATGGACGTCGTCGCTGCCTATCAACCCAatIIIRF2BP2M-FCCGGAATTCACGGGGTTTTCCTTTCCEcoRIIRF2BP2M-RGGCGATATCGTCGTCAAAAAAAATATAGAAACACEcoRVIRF2BP2RA-FCGACGCGTAAAAGGTATGTACTTTAAGGCATTTTCMluIIRF2BP2RA-RATAAGAATGCGGCCGCTGCAGTAAGCACTCGTCACANotI(4)打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体(pST1374-Cas9)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7mMESSAGEmMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscript™Kit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasyMicroKit(Qiagen,217084)进行纯化。(5)IRF2BP2-flox条件性敲除小鼠的制作将上述成熟的mRNA产物与供体载体一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得IRF2BP2-flox纯合小鼠。(6)肝细胞特异性IRF2BP2基因敲除小鼠的制作将上述IRF2BP2-flox小鼠与肝脏特异性Alb-Cre转基因小鼠交配,筛选得到IRF2BP2flox/flox/Alb-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到肝细胞特异性IRF2BP2基因敲除小鼠。实验动物饲料配方:高脂饲料(Highfatdiet,HFD)(购自北京华阜康生物科技有限公司,货号D12942):热量百分比:蛋白质20%,碳水化合物20%,脂肪60%;总的热量质量比5.24kcal/g。低脂饲料(Normalchow,NC)(购自北京华阜康生物科技有限公司,货号D12450B):热量百分比:蛋白质20%,碳水化合物70%,脂肪10%;总的热量质量比3.85kcal/g。动物饲养及环境条件:所有的实验小鼠均饲养在武汉大学动物实验中心SPF级动物房。每12小时交替照明,温度24±2℃,湿度40%-70%,小鼠自由饮水进食。【实施例1】小鼠脂肪肝和Ⅱ型糖尿病模型(dietinducedobesity,DIO)获得(1)实验动物分组:选用8周龄,雄性,Alb-cre小鼠和IRF2BP2Δ/Δ小鼠,分别给与两种特殊饲料D12942高脂饲料(Highfatdiet,HFD)和D12450B低脂饲料(Normalchow,NC)饲养,即Alb-creNC组,IRF2BP2Δ/ΔNC组,Alb-creHFD组,IRF2BP2Δ/ΔHFD组共4个组别。(2)模型通过高脂饲料诱导操作流程:采用Alb-cre和IRF2BP2Δ/Δ小鼠,建立DIO模型,进行表型相关分析,明确IRF2BP2基因对脂肪肝和Ⅱ型糖尿病发挥的作用。选用8周龄,雄性,Alb-cre小鼠和IRF2BP2Δ/Δ小鼠,分别给与两种特殊饲料D12942高脂饲料(Highfatdiet,HFD)和D12450B低脂饲料(Normalchow,NC)饲养,即Alb-creNC组,IRF2BP2Δ/ΔNC组,Alb-creHFD组,IRF2BP2Δ/ΔHFD组共4个组别。每周均详细记录小鼠摄食量,小鼠空腹体重和空腹血糖每隔2周检测1次。实验第10周,进行腹腔注射葡萄糖实验(IPGTT),以评价小鼠机体对葡萄糖耐受能力。第12周终末取材,取出小鼠肝脏拍照,然后一部分置于甲醛溶液中固定或O.C.T冰冻切片包埋剂(TissueFreezingMedium)包埋作为病理分析用。【实施例2】小鼠体重、血糖水平测定(1)小鼠空腹体重检测a.体重检测①禁食:上午8:00将待实验小鼠禁食(不禁水),下午2:00开始实验操作。②称重:分别在第0周、2周、4周、6周、8周、10周、12周称重,将一塑料小桶放在动态电子天平上,抓起小鼠,放入称量小桶中,测量体重记录数据b.空腹血糖水平检测实验将所有待实验的小鼠从上午8:00至下午2:00间禁食(不禁水),即禁食6小时后开始实验操作。①血糖仪准备:检查血糖仪(美国强生公司,ONETOUCH)电池,按右侧开关,将试纸正确放入左侧插槽,屏幕显示与血糖试纸条的相对应代码,随后显示滴血图案,提示血糖仪器处于待测状态。②固定小鼠:右手抓鼠尾,左手持一块毛巾,将毛巾对折,用拇指和食指捏住毛巾对折处,将鼠头部和身体包入手掌内的毛巾,拇指和食指在将鼠尾根部固定。③剪尾:使用眼科剪刀迅速在距鼠尾末端0.1-0.2cm处将鼠尾剪下,待血滴自行流出。④血糖检测:将血糖仪试纸边缘轻触血滴,血液浸入试纸,血糖仪倒计时5秒显示读数。Ⅱ型糖尿病损伤严重程度的评估指标主要包括体重、血糖等水平,体重、血糖变化结果如图2所示,Alb-cre小鼠在给与HFD饲料饲养后,从第2周开始体重明显高于其NC饲料组,给与IRF2BP2Δ/Δ小鼠12周的HFD饲料和NC饲料饲养后,从第2周开始HFD组的IRF2BP2Δ/Δ小鼠体重明显高于HFD组的Alb-cre小鼠体重,一直持续到第12周(见图2A);经空腹血糖检测发现在HFD组的小鼠从第2周、4周、6周、8周、10周、12周的空腹血糖水平明显比相应NC对照组升高,且HFD组的IRF2BP2Δ/Δ小鼠空腹血糖水平也明显高于Alb-cre小鼠空腹血糖水平(见图2B)。表明肝细胞特异性IRF2BP2基因敲除后显著影响了小鼠在HFD饲养状态下的糖代谢稳态,IRF2BP2基因能显著提高小鼠的糖代谢稳态,表明IRF2BP2在高脂诱导引起的Ⅱ型糖尿病中起到重要作用。【实施例3】葡萄糖耐量实验(intraperitonealglucosetolerancetest,IPGTT)实验第10周,进行腹腔注射葡萄糖实验(IPGTT),以评价小鼠机体对糖耐受能力。(1)在测血糖之前,先测量小鼠的空腹体重,根据10μL/g计算葡萄糖的注射体积。(2)先检测进行葡萄糖注射前即0分钟时空腹血糖水平,在检测完毕后迅速经腹腔注射葡萄糖液。(3)腹腔注射操作方法:①固定小鼠;抓起小鼠,左手的小指和无名指抓小鼠的尾巴,另三手指抓住小鼠的颈部,使小鼠的头部向下,将小鼠腹部充分暴露。②进针定位及注射:从腹部一侧进针右手持注射器,将尖端与小鼠腹部成45°的夹角,进针,回抽,注射时针头在腹部皮下穿行小段距离,穿过腹部中线后在腹部另一侧进入腹腔,注射药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。(4)分别于腹腔注射后15、30、60、120分钟时间点剪去尾部测小鼠血糖值,并记录血糖数值和检测时间。进一步通过腹腔注射葡萄糖耐量实验(intraperitonealglucosetolerancetests,IPGTT)来评估各组小鼠对葡萄糖的处理能力,在实验第10周,通过注射1.0g/kg体重的葡萄糖后,HFD组的Alb-cre小鼠和IRF2BP2Δ/Δ小鼠血糖水平在15分钟时间点剧增达到峰值,随着时间推移,两组小鼠血糖水平稍微下降,但仍处于高于空腹血糖水平(0分钟时血糖),Alb-cre小鼠在2小时时恢复至空腹血糖水平,且IRF2BP2Δ/Δ小鼠血糖水平从0分钟至2小时一直处于高于Alb-cre小鼠的血糖水平(图3A)。比较各组小鼠血糖曲线下面积(areaunderthecurve,AUC),发现Alb-cre小鼠HFD组的AUC显著高于NC组,IRF2BP2Δ/ΔHFD组的AUC显著大于Alb-creHFD组的AUC(图3B),表明IRF2BP2对维持糖代谢稳态具有强大的调控能力。【实施例4】肝脏大体外观及肝脏组织脂质成分测定(1)终末肝脏组织取材a.小鼠称重后,迅速使用颈椎脱臼法将其处死。仰卧位固定小鼠,用蒸馏水将小鼠胸部,腹部毛发润湿。b.用镊子钳夹小鼠腹部正中皮肤,沿腹部正中向头部剪开皮肤至剑突下,向尾端剪开皮肤,逐层暴露皮下筋膜,肌肉等,打开腹腔,充分暴露各脏器。c.迅速找到并取下小鼠的肝脏,将取下的肝脏标本置于灭菌纱布上,拭干肝脏表面上残留血液,将肝脏置于无菌培养器皿中,迅速拍照,称重。d.石蜡标本:切取部分肝脏置于10%中性福尔马林中固定。冰冻标本:切取部分肝脏,置于有OCT的锡纸模具中包埋,放在干冰上冰冻固定。(2)肝脏组织处理及病理染色相关实验a.肝脏脱水,透明,浸蜡切取10%中性福尔马林中固定好的部分肝叶组织于标记的包埋框内,在小流量流水下冲洗30分钟以上。按照以下流程在机器上设置程序,①脱水:75%酒精(45分钟)→75%酒精(45分钟)→85%酒精(45分钟)→85%酒精(45分钟)→95%酒精(45分钟)→95%酒精(45分钟)→无水酒精(1小时)→无水酒精(1小时);②透明:二甲苯(1小时)→二甲苯(1小时);③浸腊(65℃):石蜡(1小时)→石蜡(1小时)。待组织冲洗完毕后,将包含组织的包埋框装进机器篮筐内,启动上述程序。上述程序完成后,取出盛放组织的包埋框,送病理室包埋组织,同时清洗机器备用。b.肝脏组织切片使用切片机切片(切片厚度5μm)。c.肝脏组织苏木素-伊红(HE)染色将肝脏组织石蜡切片放入65℃烘箱(30分钟)→二甲苯中(5分钟×3次)→100%酒精(1分钟)→90%酒精(1分钟)→70%酒精(1分钟)→蒸馏水洗→苏木素(5分钟)→自来水洗去切片上的浮色→1%盐酸酒精(1至3秒)→自来水洗数下→Scott液(碳酸氢钠0.35g,硫酸镁2g,蒸馏水100mL)(1分钟)→自来水洗数下→伊红(1分钟)→蒸馏水洗去切片上的浮色→70%酒精一下→90%酒精一下→100%酒精(30秒×3次)→二甲苯(2分钟×3次)→在二甲苯未干时封片,拍照。d.肝脏组织油红O染色①将冰冻肝脏组织切片在通风橱中风干30分钟,4%多聚甲醛固定10分钟。置于双蒸水中洗10分钟,以除去组织表明的多聚甲醛。②以60%异丙醇处理1分钟。③用油红O(公司sigma,货号O0625,浓度0.5克/100mL100%异丙醇)染色30分钟。之后以60%异丙醇漂洗1分钟×3次,直至背景干净。用Mayer’s苏木素染液(5滴)淡染细胞核。水漂洗,稀碳酸锂水溶液中促蓝,充分水洗,水洗至细胞核蓝化。用甘油明胶封片,拍照。肝脏大体外观结果见图4所示,HFD组的IRF2BP2Δ/Δ小鼠无论肝脏重量还是肝脏重量与小鼠本身体重比值均较HFD组的Alb-cre小鼠高(如图4)。进一步通过组织切片,进行HE和油红O染色,显微镜下观察各组小鼠肝脏组织在高脂饮食饲养条件下发生了显著的病理改变。通过肝脏HE染色,可以观察到在HFD饲养条件下,Alb-cre小鼠和IRF2BP2Δ/Δ小鼠肝脏组织均有脂肪沉积,Alb-cre组小鼠的肝细胞发生脂肪变性、空泡化且融合连成片状,肝脏细胞形态几乎完全破坏,而IRF2BP2Δ/Δ组小鼠的肝细胞形态变化更为严重(如图5上)。通过肝脏油红O染色来检测肝组织中脂质,可以发现在HFD组的Alb-cre小鼠的肝门静脉周围呈大片红色,提示有大量的脂质沉积,而在HFD组的IRF2BP2Δ/Δ小鼠的肝门静脉周围的脂质沉积更显著(如图5下)。这些结果说明肝细胞特异性IRF2BP2基因敲除小鼠的脂肪肝明显恶化。上述结果显示IRF2BP2Δ/Δ小鼠在HFD的诱导下发生的脂肪肝病变和Ⅱ型糖尿病显著加重。这些结果表明IRF2BP2基因对改善Ⅱ型糖尿病和脂肪肝具有显著的作用。本发明结果说明IRF2BP2基因在脂肪肝和Ⅱ型糖尿病疾病模型中有着重要的保护作用。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。SEQUENCELISTING<110>武汉大学<120>干扰素调节因子2结合蛋白2在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用<160>8<170>PatentInversion3.3<210>1<211>24<212>DNA<213>IRF2BP2sgRNA1<400>1gggttgataggcagcgacacgggg24<210>2<211>27<212>DNA<213>IRF2BP2sgRNA2<400>2ggctatattttttttgacgacaaaagg27<210>3<211>29<212>DNA<213>IRF2BP2LA-F<400>3ccgctcgagccaacgggttctccaaactg29<210>4<211>27<212>DNA<213>IRF2BP2LA-R<400>4atggacgtcgtcgctgcctatcaaccc27<210>5<211>26<212>DNA<213>IRF2BP2M-F<400>5ccggaattcacggggttttcctttcc26<210>6<211>34<212>DNA<213>IRF2BP2M-R<400>6ggcgatatcgtcgtcaaaaaaaatatagaaacac34<210>7<211>35<212>DNA<213>IRF2BP2RA-F<400>7cgacgcgtaaaaggtatgtactttaaggcattttc35<210>8<211>36<212>DNA<213>IRF2BP2RA-R<400>8ataagaatgcggccgctgcagtaagcactcgtcaca36当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 干扰素调节因子8(irf8)在脑卒中疾病中的应用的制作方法
- 通过抑制干扰素相关发育调节因子1(ifrd1)的天然反义转录物而治疗ifrd1相关疾病的制作方法
- 通过抑制干扰素调节因子8(irf8)的天然反义转录物而治疗irf8相关疾病的制作方法
- 干扰素调节因子4基因在治疗动脉粥样硬化中的应用的制作方法
- 干扰素调节因子1基因在治疗动脉粥样硬化中的应用的制作方法
- 重组人干扰素调节因子4结合蛋白表达体系及制备方法与应用的制作方法
- 干扰素调节因子9(irf9)及其抑制剂在冠状动脉粥样硬化性心脏病中的应用的制作方法
- 分析活检样品中干扰素调节因子-1特异性核糖核酸以诊断癌症,癌变前状态的方法
- 在致瘤性诊断中的干扰素调节因子1和2的制作方法
- 一种新的多肽——干扰素调节因子10.34和编码这种多肽的多核苷酸的制作方法