用于诊断和治疗肾脏疾病的SLIT‑ROBO信号的制作方法
相关申请的交叉引用
根据美国法典第35部分第119(e)条,本申请要求美国临时专利申请序列号61/583379、申请日为2012年1月5日的专利申请的优先权,其内容通过引用整体并入这里。
技术领域
本发明涉及慢性肾脏疾病和蛋白尿的治疗方法,以及慢性肾脏疾病的诊断方法,和在慢性肾脏疾病和蛋白尿进程中监测治疗效果的方法。
政府支持
本发明获得了美国国立卫生研究院颁布的合同号DK078226号的政府支持。政府对本发明具有一定的权利。
技术实现要素:
本发明提供治疗慢性肾脏疾病和蛋白尿的新方法,以及诊断慢性肾脏疾病的新方法和在慢性肾脏疾病和蛋白尿进程中监测治疗效果的新方法,这在部分上是基于发明人发现的SLIT-ROBO信号通路在调节肾脏足细胞F-肌动蛋白细胞骨架和足突结构中新的和意想不到的作用。
因此,在一些方面,本发明提供治疗有需要的受治疗者的慢性肾脏疾病的方法,该方法包括将治疗有效量的含有ROBO2抑制剂的组合物给予患有或具有患慢性肾脏疾病风险的受治疗者。
在一些方面,本发明还提供降低有需要受治疗者的蛋白尿的方法,该方法包括将治疗有效量的含有ROBO2抑制剂的组合物给予患有或具有患蛋白尿风险的受治疗者。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,特异性于ROBO2的反义分子(antisense molecule),特异性于ROBO2的短干扰RNA(siRNA),ROBO2小分子抑制剂,ROBO2抑制性多肽,或ROBO2的结构类似物。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或两者的结合。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂是特异性的Ig1SLIT结合域,Ig1和Ig2S LIT结合域,Nck胞内结合域,或上述任意组合。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制性多肽是显性失活ROBO2融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,患有或具有患慢性肾脏疾病的受治疗者患有糖尿病肾病和高血压。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,该方法进一步包括将额外的治疗剂给予受治疗者。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,该额外治疗剂为血管紧张素转换酶抑制剂(ACE)或血管紧张素II受体拮抗剂(ARB)。
在一些方面,本发明还提供方法,该方法包括:
a.分析来自受治疗者的生物测试样本以确定ROBO2多肽或编码ROBO2多肽的RNA的表达水平;
b.确定生物测试样本中ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平是否高于参考阈值水平;以及
c.对需要处理或治疗慢性肾脏疾病的受治疗者进行诊断。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,分析ROBO2多肽的表达水平采用特异性于ROBO2多肽的抗体或其抗原结合段进行。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,分析编码ROBO2多肽的RNA的表达水平采用PCR或杂交分析进行。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,生物测试样本为肾脏活组织切片、尿、血液、血清样本或来自于尿样的颗粒化细胞。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高20%。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高两个标准差。
在一些方面,本发明还提供分析方法,包括:
a.将从受治疗者分离的生物测试样本与检测ROBO2多肽或编码ROBO2多肽的RNA的试剂接触;以及
b.测量ROBO2多肽的水平或编码ROBO2多肽的RNA的水平;
其中,相对于正常生物样本,所述ROBO2多肽或所述编码ROBO2多肽的RNA的水平增强的,鉴定受治疗者患有慢性肾脏疾病和/或处于慢性肾脏疾病或蛋白尿的进程中。
在这些分析方法和这里描述的所有这些分析方法的一些具体实施方式中,检测ROBO2多肽的表达水平采用特异性于ROBO2多肽的抗体或其抗原结合段进行。
在这些分析方法和这里描述的所有这些分析方法的一些具体实施方式中,检测编码ROBO2多肽的RNA的表达水平采用PCR或杂交分析进行。
在这些分析方法和这里描述的所有这些分析方法的一些具体实施方式中,生物测试样本为肾脏活组织切片、尿、血液、血清样本或来自于尿样颗粒化细胞。
在这些分析方法和这里描述的所有这些分析方法的具体实施方式中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高20%。
在这些分析方法和这里描述的所有这些分析方法的具体实施方式中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高两个标准差。
在这些分析方法和这里描述的所有这些分析方法的一些具体实施方式中,受治疗者已经被诊断为患有糖尿病或高血压。
在一些方面,本发明提供确定受治疗者是否具有患慢性肾脏疾病或蛋白尿的风险,或确定受治疗者是否患有慢性肾脏疾病的系统,该系统包括:
a.确定模块,其配置用以确定受治疗者生物样本中ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平;
b.比较模块,其配置用以接收通过确定模块确定的所述ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平,并进行至少一次分析以确定ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平是否大于预先确定的参考水平,进而提供重新取回内容;以及
c.显示模块,其用于显示基于来自所述比较模块输出数据的内容,其中,该内容包括ROBO2多肽或RNA的表达水平或比率大于预先确定的参考水平或比率的指示性信号,或ROBO2的水平或表达比率不大于参考水平或预先确定的比率的指示性信号。
在这些系统和这里描述的所有这些系统的一些具体实施方式中,显示在显示模块上的内容进一步包括推荐受治疗者接收具体的治疗方案的指示性信号。
在一些方面,本发明提供确定受治疗者是否具有患慢性肾脏疾病或蛋白尿的风险,或确定受治疗者是否患有慢性肾脏疾病的系统,该系统包括:
a.确定模块,其配置用以接收来自受治疗者的至少一个测试样本,病对至少一个测试样本进行至少一次分析以确定以下情况中的一种情况的存在或不存在:
i.ROBO2的表达比率大于预先确定比率,或
ii.ROBO2的表达水平大于预先确定水平;
b.存储设备,其设置用以储存来自所述确定模块输出的数据;以及
c.显示模块,其用于显示基于来自所述确定模块输出数据的内容,其中,该内容包括ROBO2的表达比率大于预先确定比率或ROBO2的水平大于预先确定水平的指示性信号,或ROBO2的表达比率不大于预先确定比率或不大于预先确定水平的指示性信号。
在这些系统和这里描述的所有这些系统的一些具体实施方式中,在显示模块上显示的内容进一步包括推荐受治疗者接收具体治疗方案的指示性信号。
在一些方面,本发明还提供治疗具有患慢性肾脏疾病或蛋白尿风险的人类受治疗者的方法,该方法包括给予处理或治疗用以预防人类受治疗者慢性肾脏疾病或蛋白尿的发生,这些人类受治疗者被确定为ROBO2蛋白水平高于参考阈值水平。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2蛋白的水平至少比参考水平高20%。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2蛋白的水平至少比参考水平高两个标准差。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,预防慢性肾脏疾病或蛋白尿发生的处理或治疗包括ROBO2抑制剂。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,特异性于ROBO2的反义分子,特异性于ROBO2的短干扰RNA(siRNA),ROBO2小分子抑制剂,ROBO2抑制性多肽,或ROBO2结构类似物。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或两者的结合。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制剂是特异性于Ig1SLIT的结合域,Ig1和Ig2SLIT结合域,Nck胞内结合域,或上述任意组合。
在这些方法和这里描述的所有这些方法的一些具体实施方式中,ROBO2抑制性多肽是显性失活ROBO2融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
在一些方面,本发明还提供ROBO2抑制剂在治疗慢性肾脏疾病中的应用,和ROBO2抑制剂在治疗蛋白尿中应用。
在这些用途和这里描述的所有这些用途的一些具体实施方式中,ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,特异性于ROBO2的反义分子,特异性于ROBO2的短干扰RNA(siRNA),ROBO2小分子抑制剂,ROBO2抑制性多肽,或ROBO2结构类似物。
在这些用途和这里描述的所有这些用途的一些具体实施方式中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或两者的结合。
在这些用途和这里描述的所有这些用途的一些具体实施方式中,ROBO2抑制剂是特异性的Ig1SLIT结合域,Ig1和Ig2SLIT结合域,Nck胞内结合域,或上述任意组合。
在这些用途和这里描述的所有这些用途的一些具体实施方式中,ROBO2抑制性多肽是显性失活ROBO2融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
在这些用途和这里描述的所有这些用途的一些具体实施方式中,慢性肾脏疾病和蛋白尿由糖尿病肾病或高血压引起的。
在这些方面或这里描述的所有这些方面的一些具体实施方式中,ROBO2是指人类ROBO2,其具有氨基酸序列SEQ ID NO:1,通过mRNA序列SEQ ID NO:2编码。
定义
为了方便起见,这里收集了说明书、实施例和所附权利要求书中使用的某些术语。除非另有说明或上下文暗示,否则下述术语和短语包括下述提供的含义。除非另有明确说明或从上下文可以明确看出,否则下述术语和短语不排除其所在领域已经获得的含义。提供这些定义是为了帮助描述具体实施方式,并不是为了限制所要求保护的发明,因为发明的范围只由权利要求书限定。除另有定义外,这里使用的所有技术术语或科学术语具有与其所在技术领域的技术人员通常理解相同的含义。
这里使用的术语“包含(comprising)”或“包含(comprises)”用于涉及的组合物、方法及其各自组分,这些组分是本发明必要的,然而还开放地含有非指明的成分,无论是否必需。
这里使用的术语“基本包含……”是指给定的具体实施方式所需要的那些成分。该术语允许附加成分的存在,这些附加成分的存在对发明具体实施方式的基本的和新的或功能性的特征不会有实质性的影响。
术语“由……组成(consisting of)”是指这里描述的组合物、方法及其各自组分,其中不包括未记载在说明书具体实施方式中的任何组分。
在说明书和所附权利要求书中,使用的单数形式“一(a)”、“一(an)”和“该(the)”包括复数形式,除非上下文明确规定。因此,例如,“该方法”是指包括一种或多种方法,和/或这里描述的该类型的多个步骤和/或在阅读公开内容等后对本领域技术人员是显而易见的方法。
除了操作实施例中的或某处另有说明外,在此使用的表达材料成分的量或反应条件的所有数字,在任何情况下应当理解为被术语“约”修饰。当术语“约”与百分比结合使用时,可以指±10%,±5%,或±1%。
除非在此另有定义,使用的与本申请相关的科学术语和技术术语具有的含义是这些公开内容所述技术领域的普通技术人员通常理解的含义。应当理解的是,发明并不局限于在此描述的具体的方法、方案和试剂等等,而且这些可以改变。在此采用的术语的目的仅是为了描述具体实施方式,而不是为了限制本发明的范围,本发明的范围只由权利要求书限定。免疫学和分子生物学中普通术语的定义可在下列文献中找到:默克研究实验室2006年出版的《默克诊疗手册(第18版)》(ISBN 0-911910-18-2)(The Merck Manual of Diagnosis and Therapy,18th Edition,published by Merck Research Laboratories,2006(ISBN 0-911910-18-2));Robert S.Porter等(编写)、布莱克韦尔科学有限公司1994年出版的《分子生物学百科全书》(ISBN 0-632-02182-9)(Robert S.Porter et al.(eds.),The Encyclopedia of Molecular Biology,published by Blackwell Science Ltd.,1994(ISBN0-632-02182-9));和Robert A.Meyers(编写)、VCH出版公司1995年出版的《分子生物学与生物技术:综合性案头参考》(ISBN 1-56081-569-8)(Robert A.Meyers(ed.),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,published by VCH Publishers,Inc.,1995(ISBN 1-56081-569-8));爱思唯尔2006年出版、Werner Luttmann编著的《免疫学》(Immunology by Werner Luttmann,published by Elsevier,2006)。分子生物学中普通术语的定义可在下列文献中找到:Benjamin Lewin,琼斯&巴特利特出版社2007年出版的《基因IX》(ISBN-13:9780763740634)(Benjamin Lewin,Genes IX,published by Jones&Bartlett Publishing,2007(ISBN-13:9780763740634));Kendrew等(编写),布莱克韦尔科学有限公司1994年出版的《分子生物学百科全书》(ISBN 0-632-02182-9)(Kendrew et al.(eds.),The Encyclopedia of Molecular Biology,published by Blackwell Science Ltd.,1994(ISBN 0-632-02182-9));和Robert A.Meyers(编写),马尼亚蒂斯等,《分子克隆:实验指南》,冷泉港实验室出版社,冷泉港,纽约,美国(1982)(Robert A.Meyers(ed.),Maniatis et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,USA(1982));Sambrook等,《分子克隆:实验指南(第2版)》,冷泉港实验室出版社,冷泉港,纽约,美国(1989)(Sambrook et al.,Molecular Cloning:A Laboratory Manual(2ed.),Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,USA(1989));Davis等,《分子生物学的基本方法》,爱思唯尔科学出版公司,纽约,美国(1986)(Davis et al.,Basic Methods in Molecular Biology,Elsevier Science Publishing,Inc.,New York,USA(1986));或《酶学方法:分子克隆技术指南》第152卷,S.L.Berger和A.R.Kimmerl编写,学术出版公司,圣地亚哥,美国(1987)(Methods in Enzymology:Guide to Molecular Cloning Techniques Vol.152,S.L.Berger and A.R.Kimmerl Eds.,Academic Press Inc.,San Diego,USA(1987));《现代分子生物学实验技术(CPMB)》(Fred M.Ausubel等主编,John Wiley和Sons出版公司)(Current Protocols in Molecular Biology(CPMB)(Fred M.Ausubel,et al.ed.,John Wiley and Sons,Inc.)),《现代蛋白科学实验技术(CPPS)》(John E.Coligan等主编,John Wiley和Sons出版公司)(Current Protocols in Protein Science(CPPS)(John E.Coligan,et.al.,ed.,John Wiley and Sons,Inc.)),和《现代免疫学实验技术(CPI)》((John E.Coligan等主编,John Wiley和Sons出版公司)(Current Protocols in Immunology(CPI)(John E.Coligan,et.al.,ed.John Wiley and Sons,Inc.)),在此通过整体引用将其全部并入本文。
应当理解的是,下面的详细描述和下述实施例只是示例性的,并不被认为限制本发明的范围。对本领域普通技术人员显而易见的公开的具体实施方式的各种变化和改进,可以在不脱离本发明的精神和范围内做出。进一步地,出于描述和公开的目的,在此通过引用明确并入了所有专利、专利申请和经鉴定的出版物,例如,这些出版物中描述的可能与本发明结合使用。这些出版物被单独提供,因为它们在本申请的申请日之前公开。在这方面,没有什么应该可解释为对发明人无权凭借在先发明或任何其它原因而先于这些公开的承认。关于日期的所有声明或关于这些文件内容的陈述是基于申请人可获得的信息,不构成关于日期和这些文件内容正确性的任何承认。
附图说明
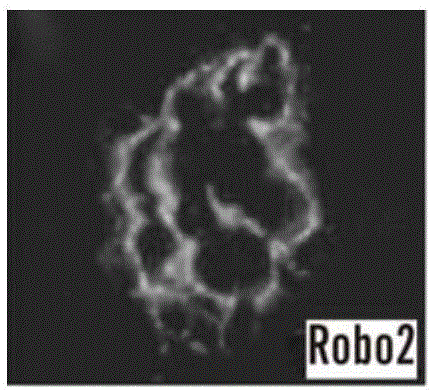
图1A-1R显示了ROBO2表达和定位于足细胞的基底细胞表面。在(图1A-1Q):中所有免疫染色于600X放大倍率下在小鼠E16.5天进行(如图5A-5M显示的成年小鼠肾小球免疫染色)。(图1A-1C):ROBO2与足细胞裂孔隔膜蛋白nephrin共定位。(图1D-1F)ROBO2与足细胞裂孔隔膜蛋白podocin共定位。(图1G-1I):ROBO2与肾小球中衔接蛋白Nck共定位。(图1J-1L):ROBO2表达在与肾小球基底膜巢蛋白(nidogen)相邻的基底足细胞表面。(图1M-1O):ROBO2不与肾小球内皮细胞蛋白标志物血小板内皮细胞粘附分子1(Pecam1)共定位。(图1P):(图1L)中框出的扩大区域表示ROBO2主要表达在与肾小球基底膜标记物巢蛋白(nidogen)相邻的足细胞(P)的基底细胞表面(箭头)。ROBO2在足细胞的顶端和侧面的细胞表面(箭头)弱表达。(图1Q):ROBO2主要表达在足细胞(P)基底细胞表面(箭头),在顶端和侧面的细胞表面(箭头)弱表达。(图1R):免疫胶体金电子显微镜显示在3周龄小鼠足细胞的足突(FP)中的金色部分(gold partials)(箭头)与ROBO2抗体共轭的位置。GBM:肾小球基底膜。放大倍率50,000X。也参见于图5A-5M。
图2A-2J显示了ROBO2与衔接蛋白Nck相互作用,且与肾脏蛋白形成复合物。(图2A):酵母双杂交分析表明ROBO2胞内域(ROBO2-ICD)和Nck1之间有正的相互作用.LacZ报告子(reporter)(X-gal):+++,酵母转暗;++,转亮;-,在24小时内呈白色。Leu报告子(-Leu):+,酵母长成;-,酵母未生长。CC,细胞质保守区。数字表示全长蛋白中的残基位置。(图2B):酵母双杂交分析表明Nck1的前两个SH3域对于其与ROBO2-ICD相互作用是必需的。(图2C):酵母双杂交分析显示了介导ROBO2和Nck1相互作用的潜在结合域。该序列是ROBO2中Nck1的潜在结合域。富含脯氨酸的区域突出显示。(图2D):ROBO2和Nck的共沉淀。从his-myc-ROBO2转染的细胞(在通道1和通道2用)中收集通道5的细胞溶解物;从his-myc-ROBO2-ΔNBD转染细胞(在通道3和通道4用)中收集通道6的细胞溶解物。(图2E):ROBO2、Nck和Nephrin的共沉淀。(图2F):与(图2E)相似的共沉淀,除了使用his-myc-Nephrin进行捕获(pull down)代替his-myc-ROBO2。(图2G):肾脏内源性Robo2,Nck,和肾脏蛋白(Nephrin)的免疫共沉淀。(图2H):与(图2G)相似的分析,除了用小鼠抗肾脏蛋白(Nephrin)抗体制备沉淀物。(I)Slit2促进了ROBO2-Nck-Nephrin复合物的形成。His-myc-ROBO2,Nephrin,和Fyn在用Slit2条件培养液培养液(通道1,3)或对照条件培养液培养液(通道2,4)刺激的HEK细胞中表达。(图2J):(图2I)的强度量化(intensity quantification)。数据表示为平均值±SEM;n=7,Student氏配对t-检验,与对照组成相比,*P<0.05,**P<0.01。另请参见图6A-6F’。
图3A-3G显示了Slit2-ROBO2信号抑制Nephrin介导的肌动蛋白的聚合。(图3A):CD16/7-NCD在Hek细胞中与ROBO2共表达,其在Slit2条件培养液培养液(Slit)或对照条件培养液培养液(CTL)存在下用抗-CD16抗体和罗丹明结合的抗-IgG抗体处理。然后将细胞固定并用FITC结合的鬼笔环肽染色以显示F-肌动蛋白。比例尺,5μm。NCD:肾脏蛋白(Nephrin)细胞质域。(图3B):与(图3A)相似的分析,除了CD16/7-NCD被CD16/7-HA替换和用作对照分析。(图3C):每个组中,具有F-肌动蛋白尾巴的细胞占具有CD16/7簇的总细胞的百分比被定量。数据表示为平均值±SEM,*P<0.01,n=5。(图3D):Slit2条件培养液培养液刺激(通道1和3)或对照条件培养液培养液(通道2和4)后,(图3A)中CD16/7-NCD被抗-CD16抗体免疫沉淀。注意通道1中减少的F-肌动蛋白。CD16/7-HA用作阴性对照。(图3E):(图3D)的强度量化。数据表示为平均值±SEM;Student氏配对t-检验,与对照组相比,n=4,*P<0.05。(图3F):使用抗-Nephrin抗体对来自于ROBO2敲除的纯合子(ROBO2-/-),杂合子(ROBO2+/-),和野生型(ROBO2+/+)小鼠肾脏的Nephrin的免疫沉淀。注意通道3中增加的F-肌动蛋白。(图3G):(图3F)的强度量化。数据表示为平均值±SEM;ANOVA分析,与野生型和杂合子相比,n=4,*P<0.05。另请参见图7A-7C。
图4A-4W显示了ROBO2纯合缺失(homozygous null)、ROBO2足细胞特异性敲除、和ROBO2和Nphs1双基因敲除小鼠的足细胞结构表型。(图4A和4B):新生儿肾脏的代表图像显示野生型(图4A)和ROBO2纯合缺失的小鼠(图4B)中足细胞体(箭头)和肾小囊(箭头)。(图4C和图4D):(图4A和4B)的高倍率放大图像显示新生儿肾脏的足细胞足突(箭头)。比例尺,1μm。(图4E和4F):3周的肾脏在低倍放大镜下的代表图像显示与年龄匹配的对照(图4E)相比,ROBO2纯合缺失小鼠(图4F)的足细胞细胞体(箭头)。(图4G和4H):(图4E和4F)的更高倍率图像显示3周的ROBO2纯合缺失小鼠(图4H)的无序的较短的曲折的足突(箭头),与年龄匹配的对照中有序的拉链般的足突(图4G)进行对比。比例尺:2μm。(图4I和4J):代表性的透射电子显微镜图像(放大倍率5000倍)描述一月龄ROBO2足细胞特异性基因敲除小鼠和正常表型对照组(图4I)中的局灶节段性足细胞足突消失(focal foot process effacement)(图4J中箭头)。简称:gc:肾小球毛细血管;us:肾小囊腔。(图4K和4L):高倍的透射电子显微镜图像(40000倍)显示两个月龄ROBO2足细胞特异性突变小鼠具有与对照组(图4K)相比更广泛的足细胞足突(图4L中箭头)。简称:fp:足细胞足突;GBM:肾小球基底膜。(图4M):一月龄Robo2del5/flox、TgNphs2-Cre+足细胞特异性敲除小鼠(ROBO2KO)和野生型同窝小鼠对照(WT)的足细胞足突宽度的定量。数据表示为平均值±SEM,n=333,*P<0.01。(图4N):酶联免疫吸附分析尿的斑点显示在Robo2del5/flox、NPHS2-Cre+(KO)成年小鼠中白蛋白/肌酐比值与对照组野生型(WT)相比升高。数据表示为平均值±SEM,n=20,*P<0.01。(图4O):蛋白印迹分析表明尿液中存在白蛋白;将各孔中加入1μl尿液,用0.2μg白蛋白作阳性对照。WT,三个野生型同窝小鼠;ROBO2KO,三个独立的Robo2del5/flox;Nphs2-Cre+小鼠。(图4P和4Q):扫描电子显微镜的代表图像显示破坏的趾状突的足细胞足突,其类似于Nphs1-/-单纯合新生小鼠肾脏的杂乱的细胞突起(箭头)。比例尺:1μm。(图4R和4S):来自于Nphs1-/-Robo2-/-双纯合新生小鼠的肾小球显示恢复的趾状突的足突(箭头),表明通过敲除ROBO2减少Nephrin缺失表型。(图4T和4U):来自于ROBO2-/-单纯合新生小鼠的肾小球显示不规则的和更宽广的足突而形成广泛趾状突模式(箭头)。(图4V和4W):具有正常整齐趾状突模式的足突(箭头)的新生野生型小鼠的肾小球。还参见图8A-8Z和表1-4。
图5A-5M显示ROBO2在发育中和成熟的肾小球中的表达。(图5A和5B):原位杂交分析显示ROBO2转录物在E16.5的正在发育的肾小球(箭头)中表达。放大倍数:60X(图5A)和200X(图5B)。(图5C-5F):免疫组织化学(IHC)研究揭示ROBO2在E14.5到E17.5的正在发育的肾小球中表达。放大倍率:600X。(图5G):IHC显示ROBO2在5周龄的成年小鼠肾小球中特异性表达(图5G)。DAPI标记肾脏的细胞核。放大倍率:400X。(图5H):5周龄肾脏的IHC共定位染色表明ROBO2在具有足细胞标志物WT1的肾小球中共表达。放大倍率:600X。(图5I和5K):ROBO2和WT1在E16.5的小鼠肾小球中共表达。(图5L和5M):5周龄肾脏的IHC共定位染色表明ROBO2在具有肾小球系膜细胞标记物Pdgfrb(图5L)和内皮细胞标记物Pecam1(图5M)的肾小球中共表达。放大倍率:600X。
图6A-6F’显示了ROBO2与Nck相互作用,并形成含有Nephrin的复合物,其是通过Slit2的刺激而增强。(图6A):ROBO2和含有内源性Nck的Nephrin的免疫共沉淀。ROBO2、Nephrin和Fyn在Hek细胞中表达,并通过Slit2刺激。内源性Nck由抗-Nck抗体免疫沉淀。以小鼠IgG作为对照。含有Nephrin的复合物的形成通过Slit2和Fyn表达增强。(图6B和6C):Slit2通过免疫过氧化物酶染色而在新生小鼠肾小球中表达(图6B),并且在肾小球中与足细胞标记物突触极蛋白(Synaptopodin)共表达(图6C)。放大倍率:600X。(图6D和图6D'):在Slit2存在下,CD16/7-NCD与ROBO2在Hek细胞中共表达,用抗-CD16抗体和罗丹明结合的抗-IgG抗体处理,然后固定并用抗-ROBO2抗体染色。CD16/7-NCD簇与ROBO2共定位(图6D)、但在对照的CD16/7-HA簇(图6D')中观察到未共区域化的CD16/7-NCD簇。比例尺:5μm。NCD:Nephrin细胞质区。(图6E-6E’):ROBO2中Nck结合域(NBD)的缺失损害了其在Slit2存在下与CD16/7-NCD的共定位。CD16/7-NCD簇与ROBO2共定位(图6E)、但在ROBO2-ΔNBD簇中观察到未共区域化的CD16/7-NCD簇(图6E')。比例尺:5μm。(图6F和6F'):Slit2的刺激增强了CD16/7-NCD和ROBO2在Hek细胞中的共定位。CD16/7-NCD簇与ROBO2在Slit2存在下共定位(图6F),但不在对照条件培养液培养液共定位(图6F')。比例尺:5μm。
图7A-7C显示在Robo2中Nck结合域(NBD)的缺失折中了Slit2-ROBO2对Nephrin诱导的肌动蛋白聚合的抑制。(图7A):CD16/7-NCD和ROBO2在Hek细胞中共表达,与抗-CD16抗体和罗丹明结合的抗-IgG抗体在Slit2条件培养液培养液(Slit2)或对照条件培养液培养液(CTL)存在下聚集。然后将细胞固定,并用FITC结合的鬼笔环肽染色,以显示F-肌动蛋白纤维。CD16/7-NCD和F-肌动蛋白纤维的簇通过共聚焦显微镜检查得到的。比例尺,5μm。NCD:Nephrin细胞质区。(图7B):CD16/7-NCD和ROBO2-ΔNBD在Hek细胞中共表达。比例尺,5μm。NBD:Nck结合域。(图7C):在每组中,具有F-肌动蛋白尾巴的细胞占具有CD16/7-NCD簇的总细胞的百分比被定量化。数据表示为平均值±SEM,ANOVA.分析*p=1.436x10-5,**p=6.32x10-5,n=5。
图8A-8Z显示在ROBO2纯合缺失、ROBO2足细胞特异性敲除、ROBO2和Nphs1双敲除小鼠中肾小球的表型,和ROBO2-Nephrin信号的拟建模式。(图8A-8F):透射电子显微镜分析新生的(NB)Robo2del5/del5突变小鼠肾脏中肾小球的超微结构。(图8A,8C,8E):在低倍率(图8A,2200X),中倍率(图8C,15500X)和高倍率(图8E,52000X)下的新生杂合的ROBO2对照小鼠的肾小球超微结构。(图8B,8D,8F):在低倍率(图8B,2200X),中倍率(图8D,15500X)和高倍率(图8F,52000X)下新生杂合的ROBO2(-/-)(即Robo2del5/del5)的突变小鼠的肾小球超微结构。箭头表示局灶节段性足细胞足突消失。简称:gc:肾小球毛细血管;us:肾小囊腔;GBM:肾小球基底膜。(图8G-8N):在ROBO2特异性敲除小鼠中异常的足细胞足突模式。(图8G-8J):来自于一月龄Robo2del5/flox、Nphs2-Cre+足细胞特异性敲除小鼠和年龄匹配的Robo2flox/+对照小鼠的肾小球的代表的扫描电子显微镜图像。在一月龄ROBO2足细胞特异性敲除小鼠中发现趾状突足细胞足突的轻度不规则(图8K和8N)。当七个月大时,Robo2足细胞特异性敲除小鼠发生明显不规则的足突(图8L和8N)。比例尺:10微米(图8G,8H,8K,8L,放大倍率2000X)和2微米(图8I,8J,8M,8N,放大倍率13000X)。(图8O-8T):Robo2足细胞特异性敲除小鼠的肾小球形态。(图8O-8R)希夫氏高碘酸(PAS)染色显示2月龄和6月龄Robo2足细胞特异性敲除小鼠的肾小球的系膜基质扩张(图8P,8R),对照为年龄匹配的小鼠(图8O,8Q)。(图8S):肾小球的定量分析表明12月龄Robo2足细胞特异性敲除小鼠(MU)的肾小球系膜基质扩张,与年龄匹配的野生型(WT)对照相比。数据表示为平均值±SEM,n=5,*P<0.01。(T):Robo2足细胞特异性敲除不影响足细胞的数量。使用WT-1染色鉴定足细胞。计算4个一年龄Robo2del5/flox、TgNphs2-Cre+足细胞特异性敲除小鼠(MU)中的每个肾小球横截面的足细胞数量,对照为4个年龄匹配的野生型小鼠(WT)。数据表示为平均值±SEM,p=0.645,t-检验;突变体:n=165肾小球;对照:n=166肾小球。(图8U-8Y):Robo2和Nphs1双敲除小鼠中肾小球的表型。(图8U):H&E染色显示在Nphs1-/-单纯合新生小鼠中肾小球具有膨胀鲍曼腔(星号)的特性,放大倍率400倍。(图8V):Robo2-/-单纯合新生小鼠的肾小球显示没有鲍曼腔的膨胀,放大倍率400倍。(图8W):在Robo2-/-、Nphs1-/-双纯合新生小鼠中显示、正常没有鲍曼腔膨胀(箭头)的肾小球样貌,其表明Nphs1-/-肾小球表型的减轻,放大倍率400倍。(图8X):作为对照的年龄匹配的野生型新生小鼠的正常肾脏和肾小球的H&E染色,放大倍率400倍。(图8Y):新生小鼠中具有膨胀鲍曼腔的肾小球的定量分析表明Robo2-/-、Nphs1-/-双纯合中具有膨胀表型鲍曼腔特性的肾小球显著减少,对照为ROBO2-/-单个纯合(Robo2+/-、Nphs1-/-)。数据表示为平均值±SEM,*p<0.01。(图8Z):Slit2-Robo2信号对Nephrin的抑制效应以影响足细胞足突结构的模型:在生理条件下(例如,在足突发育期间),Nephrin细胞内磷酸化酪氨酸结构域(YDxV-P)通过其与SH2结构域的相互作用结合Nck。反过来,Nck通过其SH3结构域与细胞骨架调节器结合,以促进肌动蛋白聚合。Slit2与Robo2结合,用以增加Robo2胞内域与Nck的SH3结构域的相互作用,这可防止Nck结合至细胞骨架调节器,并导致对Nephrin诱导的肌动蛋白聚合的抑制。在足细胞发育为正常足突结构期间可维持均衡的肌动蛋白聚合。在没有Slit2-Robo2信号(例如,当Robo2被敲除时)时,Robo2对Nephrin诱导聚合的抑制作用消失。Nck的SH3结构域可与下游的细胞骨架调节器相互作用,以增加肌动蛋白聚合,其可以解释在Robo2突变小鼠中足细胞足突结构的改变。简称:Ig:免疫球蛋白域;FN3:纤连蛋白3型结构域;SH2:Src同源2结构域;SH3:Src同源3结构域;CC0、CC1、CC2、CC3:细胞质保守区0、1、2、3。
具体实施方式
以前已经证明Robo2是推进导向暗号Slit(repulsive guidance cue Slit)的细胞表面受体,并参与神经系统的轴突导向和神经元迁移。Nephrin是一种足细胞狭缝隔膜蛋白,其在肾脏的肾小球过滤屏障中起作用。在此我们证明Robo2在足细胞基面上表达,例如小鼠足细胞,并与Nephrin共定位。生物化学研究表明,通过衔接蛋白Nck,Robo2与Nephrin在肾脏中形成复合物。与Nephrin促进肌动蛋白聚合的作用形成对照,在此我们显示了Slit2-Robo2信号抑制Nephrin诱导的肌动蛋白聚合。例如,与Nephrin相关联的F-肌动蛋白的数量在Robo2敲除小鼠中增加,其形成改变的足细胞足突结构及微蛋白尿。遗传相互作用的研究进一步揭示Robo2缺失减轻Nephrin缺失小鼠的异常足细胞表型。在此提供的结果显示Robo2信号作为Nephrin的负调节因子以影响足细胞足突结构。
另外,已经证明,患有膀胱输尿管返流(VUR)的病人有染色体易位,其可破坏ROBO2基因,并产生可终止SLIT2-ROBO2信号通路的显性失活ROBO2融合蛋白。通常地,VUR是一种尿液从膀胱逆流至输尿管和肾脏的疾病,VUR患者可出现反流性肾病,这个状态伴有严重蛋白尿。已经显示,由VUR患者产生的显性失活ROBO2融合蛋白封闭SLIT2-ROBO2信号通路,并保护患者免于反流性肾病和蛋白尿,从而确认并进一步支持发明人的结果,该结果是在以SLIT2-ROBO2信号通路为目标治疗慢性肾脏疾病产生的治疗价值的动物模型中得到的。
正常肾脏中,三层的肾小球毛细血管壁包含网状内皮细胞、基底膜和足细胞其限制了血浆蛋白的渗透性。足细胞是专门的上皮细胞,其延伸初级和次级突触以覆盖肾小球基底膜的外表面。相邻足细胞中富含肌动蛋白的趾状突的次级突触或足突,通过半渗透狭缝隔膜桥连建立了过滤缝,从而形成蛋白渗透的最终屏障。鉴于足细胞狭缝隔膜蛋白如Nephrin和其它的基因突变性与蛋白尿肾脏疾病的遗传形式相关(特里格瓦松(Tryggvason)等,2006)(Tryggvason et al.,2006),构成狭缝隔膜蛋白和与狭缝隔膜蛋白相关的蛋白不只是简单的结构屏障,这已经是明显的。这些蛋白形成一种均衡的信号网络,其通过与F-肌动蛋白细胞骨相互作用可影响足细胞足突结构和功能(福勒等,2007;琼斯Jones等,2006;维尔马等,2006)(Faul et al.,2007;Jones et al.,2006;Verma et al.,2006)。
迂回(roundabout)(Robo)家族蛋白,Robo1、Robo2、Robo3和Robo4,是分泌性配体Slit(secreted ligand Slit)的细胞表面受体(迪克逊(Dickson)和Gilestro,2006)(Dickson and Gilestro,2006)。最初发现,Slit1、Slit2和Slit3在神经系统发育过程中是作为轴突导向和神经元迁移的推进导向暗号(关(Guan)和饶(Rao),2003)(Guan and Rao,2003)。跨膜蛋白Robo含有五个Ig基序,三个III型纤连蛋白(FNIII),在其胞外域中重复(迪克逊(Dickson)和Gilestro,2006)(Dickson and Gilestro,2006)。虽然这两种免疫球蛋白(Ig)基序1和2与Slit相互作用,Robo的第一Ig1基序是Slit的主要结合位点(迪克逊(Dickson)和Gilestro,2006)(Dickson and Gilestro,2006)。Robo的胞内域有四个细胞质保守(CC)序列,名为CC0,CC1,CC2和CC3(伯肖(Bashaw)等,2000;基德(Kidd)等,1998;漠尔洛(Morlot)等,2007,艾伦(Zallen)等,1998)(Bashaw et al.,2000;Kidd et al.,1998;Morlot et al.,2007;Zallen et al.,1998)。CC0和CC1含有酪氨酸,而CC2和CC3是富含脯氨酸的延伸。Slit-Robo信号的推进活性抑制肌动蛋白的聚合(关(Guan)和饶(Rao),2003)(Guan and Rao,2003)或者诱导的F-肌动蛋白解聚(派珀(Piper)等,2006)(Piper et al.,2006)。
Slit-Robo信号在早期肾脏感应和输尿管萌芽生长过程中也起着至关重要的作用。缺少Slit2或Robo2的小鼠突变体生长出多余的输尿管芽,从而产生广谱的尿路表型,包括双肾、输尿管膀胱畸形连接和肾积水(Grieshammer等,2004;陆(Lu)等,2007)(Grieshammer et al.,2004;Lu et al.2007)。人类ROBO2的破坏引起肾脏和尿路的先天异常(CAKUT),膀胱输尿管返流(VUR)患者已经确定有Robo2点突变(陆(Lu)等,2007)(Lu et al.,2007)。我们最近的研究表明,Robo2对正常输尿管口的形成和是维持有效的抗返流机制身至关重要的(王(Wang)等人,2011)(Wang et al.,2011)。
在此我们证明,Robo2是在肾脏中肾小球足细胞基底表面表达的新型足细胞蛋白,并与Nephrin和podocin共定位。Robo2直接与衔接蛋白Nck SH3域相互作用,并与Nephrin形成复合物。鉴于Robo2敲除小鼠长出的改变的足细胞足突,Robo2的缺失减轻了Nephrin缺失小鼠的足突结构的畸形。在此描述的这些结果表明,Robo2信号作为Nephrin信号的负调节器以影响足细胞足突结构。另外,如本文所证明的,业已发现,患者产生的显性失活ROBO2融合蛋白封闭Slit2-Robo2信号通路,保护患者免于返流性肾病和蛋白尿,从而确认并进一步支持发明人的结果,该结果在以SLIT2-ROBO2信号通路为目标治疗慢性肾脏疾病产生的治疗价值的动物模型中得到的。
因此,在一些方面,在此提供治疗有需要的受治疗者慢性肾脏疾病的方法,这样的方法包括将治疗有效量的含有Slit2-ROBO2信号通路抑制剂的组合物给予患有或具有患慢性肾脏疾病风险的受治疗者。
在一些方面,在此还提供降低有需要受治疗者蛋白尿的方法,该方法包括将治疗有效量的含有Slit2-ROBO2信号通路抑制剂的组合物给予患有或具有患蛋白尿风险的受治疗者。
在另一些方面,在此还提供预防或促进预防治疗有需要的受治疗者的肾脏疾病的方法,该方法包括将治疗有效量的含有Slit2-ROBO2信号通路抑制剂的组合物给予受治疗者,以预防或促进预防治疗受治疗者的肾脏疾病。
在一些方面,在此还提供在有需要受治疗者中减轻肾脏疾病影响、降低肾脏疾病严重性、降低肾脏疾病发展的可能性和/或减慢肾脏疾病进程的方法。
如在此所用,“ROBO2”是指具有如下氨基酸序列的多肽:MARRHERVTRRMWTWAPGLLMMTVVFWGHQGNGQGQGSRLRQEDFPPRIVEHPSDVIVSKGEPTTLNCKAEGRPTPTIEWYKDGERVETDKDDPRSHRMLLPSGSLFFLRIVHGRRSKPDEGSYVCVARNYLGEAVSRNASLEVALLRDDFRQNPTDVVVAAGEPAILECQPPRGHPEPTIYWKKDKVRIDDKEERISIRGGKLMISNTRKSDAGMYTCVGTNMVGERDSDPAELTVFERPTFLRRPINQVVLEEEAVEFRCQVQGDPQPTVRWKKDDADLPRGRYDIKDDYTLRIKKTMSTDEGTYMCIAENRVGKMEASATLTVRAPPQFVVRPRDQIVAQGRTVTFPCETKGNPQPAVFWQKEGSQNLLFPNQPQQPNSRCSVSPTGDLTITNIQRSDAGYYICQALTVAGSILAKAQLEVTDVLTDRPPPIILQGPANQTLAVDGTALLKCKATGDPLPVISWLKEGFTFPGRDPRATIQEQGTLQIKNLRISDTGTYTCVATSSSGETSWSAVLDVTESGATISKNYDLSDLPGPPSKPQVTDVTKNSVTLSWQPGTPGTLPASAYIIEAFSQSVSNSWQTVANHVKTTLYTVRGLRPNTIYLFMVRAINPQGLSDPSPMSDPVRTQDISPPAQGVDHRQVQKELGDVLVRLHNPVVLTPTTVQVTWTVDRQPQFIQGYRVMYRQTSGLQATSSWQNLDAKVPTERSAVLVNLKKGVTYEIKVRPYFNEFQGMDSESKTVRTTEEAPSAPPQSVTVLTVGSYNSTSISVSWDPPPPDHQNGIIQEYKIWCLGNETRFHINKTVDAAIRSVIIGGLFPGIQYRVEVAASTSAGVGVKSEPQPIIIGRRNEVVITENNNSITEQITDVVKQPAFIAGIGGACWVILMGFSIWLYWRRKKRKGLSNYAVTFQRGDGGLMSNGSRPGLLNAGDPSYPWLADSWPATSLPVNNSNSGPNEIGNFGRGDVLPPVPGQGDKTATMLSDGAIYSSIDFTTKTSYNSSSQITQATPYATTQILHSNSIHELAVDLPDPQWKSSIQQKTDLMGFGYSLPDQNKGNNGGKGGKKKKNKNSSKPQKNNGSTWANVPLPPPPVQPLPGTELEHYAVEQQENGYDSDSWCPPLPVQTYLHQGLEDELEEDDDRVPTPPVRGVASSPAISFGQQSTATLTPSPREEMQPMLQAHLDELTRAYQFDIAKQTWHIQSNNQPPQPPVPPLGYVSGALISDLETDVADDDADDEEEALEIPRPLRALDQTPGSSMDNLDSSVTGKAFTSSQRPRPTSPFSTDSNTSAALSQSQRPRPTKKHKGGRMDQQPALPHRREGMTDEEALVPYSKPSFPSPGGHSSSGTASSKGSTGPRKTEVLRAGHQRNASDLLDIGYMGSNSQGQFTGEL(智人迂回家族同族体2亚型ROBO2a;SEQ ID NO:1),例如通过NP-001122401.1描述的和通过NM-001128929.2(SEQ ID NO:2)编码;或MSLLMFTQLLLCGFLYVRVDGSRLRQEDFPPRIVEHPSDVIVSKGEPTTLNCKAEGRPTPTIEWYKDGERVETDKDDPRSHRMLLPSGSLFFLRIVHGRRSKPDEGSYVCVARNYLGEAVSRNASLEVALLRDDFRQNPTDVVVAAGEPAILECQPPRGHPEPTIYWKKDKVRIDDKEERISIRGGKLMISNTRKSDAGMYTCVGTNMVGERDSDPAELTVFERPTFLRRPINQVVLEEEAVEFRCQVQGDPQPTVRWKKDDADLPRGRYDIKDDYTLRIKKTMSTDEGTYMCIAENRVGKMEASATLTVRAPPQFVVRPRDQIVAQGRTVTFPCETKGNPQPAVFWQKEGSQNLLFPNQPQQPNSRCSVSPTGDLTITNIQRSDAGYYICQALTVAGSILAKAQLEVTDVLTDRPPPIILQGPANQTLAVDGTALLKCKATGDPLPVISWLKEGFTFPGRDPRATIQEQGTLQIKNLRISDTGTYTCVATSSSGETSWSAVLDVTESGATISKNYDLSDLPGPPSKPQVTDVTKNSVTLSWQPGTPGTLPASAYIIEAFSQSVSNSWQTVANHVKTTLYTVRGLRPNTIYLFMVRAINPQGLSDPSPMSDPVRTQDISPPAQGVDHRQVQKELGDVLVRLHNPVVLTPTTVQVTWTVDRQPQFIQGYRVMYRQTSGLQATSSWQNLDAKVPTERSAVLVNLKKGVTYEIKVRPYFNEFQGMDSESKTVRTTEEAPSAPPQSVTVLTVGSYNSTSISVSWDPPPPDHQNGIIQEYKIWCLGNETRFHINKTVDAAIRSVIIGGLFPGIQYRVEVAASTSAGVGVKSEPQPIIIGRRNEVVITENNNSITEQITDVVKQPAFIAGIGGACWVILMGFSIWLYWRRKKRKGLSNYAVTFQRGDGGLMSNGSRPGLLNAGDPSYPWLADSWPATSLPVNNSNSGPNEIGNFGRGDVLPPVPGQGDKTATMLSDGAIYSSIDFTTKTSYNSSSQITQATPYATTQILHSNSIHELAVDLPDPQWKSSIQQKTDLMGFGYSLPDQNKGNNGGKGGKKKKNKNSSKPQKNNGSTWANVPLPPPPVQPLPGTELEHYAVEQQENGYDSDSWCPPLPVQTYLHQGLEDELEEDDDRVPTPPVRGVASSPAISFGQQSTATLTPSPREEMQPMLQAHLDELTRAYQFDIAKQTWHIQSNNQPPQPPVPPLGYVSGALISDLETDVADDDADDEEEALEIPRPLRALDQTPGSSMDNLDSSVTGKAFTSSQRPRPTSPFSTDSNTSAALSQSQRPRPTKKHKGGRMDQQPALPHRREGMTDEEALVPYSKPSFPSPGGHSSSGTASSKGSTGPRKTEVLRAGHQRNASDLLDIGYMGSNSQGQFTGEL(智人同族体2亚型ROBO2b;SEQ ID NO:3),例如通过NP_002933.1描述和通过NM_002942.4(SEQ ID NO:4)编码的,以及与任何自然发生的等位基因,接合变体及其处理后的形式一起。代表性地,ROBO2是指人类ROBO2。ROBO2基因在黑猩猩、猕猴、狗、奶牛、小鼠、大鼠、鸡、斑马鱼、果蝇、蚊子和线虫中是保守的。ROBO2特定的残基被称为,例如“ROBO2(30)”。
ROBO2的特定结构域也可以通过这些术语被提及。包含5个免疫球蛋白基序和3个III型纤连蛋白(FNIII)重复序列的N-端或“ROBO2的胞外域”,例如,可被称为SEQ ID NO:1的ROBO2(46-848)或SEQ ID NO:3的ROBO2(30-832)。与Slit2相互作用的免疫球蛋白(Ig)基序1和2,或“Ig SLIT结合域”可被称为SEQ ID NO:1分别的ROBO2(46-145)和ROBO2(151-237),和SEQ ID NO:3分别的ROBO2(30-129)和Robo2(135-221)。同样地,在此描述的包括“Nck胞内结合域”的“胞内域”,其包括4个细胞内富含脯氨酸基序,可被称为SEQ ID NO:3的ROBO2(881-1378)。
在此使用的术语“ROBO2抑制剂”、“ROBO2拮抗剂”、“ROBO2抑制剂药剂”和“ROBO2拮抗剂药剂”是指具有显著封闭、抑制、降低或妨碍ROBO2(哺乳动物,如人类ROBO2)的体外、原位和/或体内生物活性的分子或药剂,所述生物活性包括由ROBO2信号介导的下游通路的活性,例如ROBO2与衔接蛋白Nck的相互作用和/或与Nephrin形成的复合物,介导的Nephrin介导的肌动蛋白聚合的抑制的SLIT2-ROBO-2,和/或诱导ROBO2的细胞应答。在此使用的关于ROBO2抑制剂的术语“药剂”,意思是任何化合物或物质,例如但不限于,小分子、核酸、多肽、肽、药物、离子等。“药剂”可为任何化学的、实体、或部分,包括但不限于,合成的和自然产生的蛋白实体和非蛋白实体。在此描述的方面的一些具体实施方式中,药剂为核酸、核酸类似物、蛋白质、抗体、肽、适体、核酸低聚物、氨基酸或碳水化合物,以及包括但不限于,蛋白质、寡核苷酸、核酶、脱氧核酶(DNAzymes)、糖蛋白、反义RNA、小干扰RNA(siRNAs)、脂蛋白、适体以及上述的变型和组合。可以知道,在此描述的用于治疗组合物和方法的化合物具有期望的活性和/或性质,或采用本领域普通技术人员知道的筛选方法可以从各种化合物的化合物可库中进行选择。
在此描述的各种方面和具体实施方式预期使用的示例性ROBO2抑制剂包括,但不限于,与ROBO2特异性结合的抗ROBO2抗体或其抗原结合片段;定向编码ROBO2的核酸的反义分子(例如,ROBO2a或ROBO2b或两者);定向编码ROBO2的核酸的短干扰RNA(“siRNA”)(例如,ROBO2a或ROBO2b或两者);结合到ROBO2并且抑制/降低/封闭ROBO2介导信号的RNA或DNA适体;ROBO2结构类似物;和可溶性ROBO2蛋白质,抑制多肽,如显性失活的多肽,或其融合多肽。在此描述的这些方面和所有这些方面的一些具体实施方式中,ROBO2抑制剂(例如抗体或其抗原结合片段)与ROBO2结合(物理上与其相互作用),以下游的ROBO2信号为目标,和/或抑制(减少)ROBO2合成、产生或释放。在此描述的这些方面和所有这些方面的一些具体实施方式中,ROBO2抑制剂结合和抑制其与SLIT蛋白配体,如SLIT2的结合。在此描述的这些方面和所有这些方面的一些具体实施方式中,ROBO2抑制剂特异性地减少或消除一种或多种ROBO2亚型的表达(例如转录或转化)。
在此使用的ROBO2抑制剂或拮抗剂能够降低在细胞(例如足细胞)中ROBO2的活性和/或表达至少5%,至少10%,至少15%,至少20%,至少25%,至少30%,至少35%,至少40%,至少45%,至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%,至少98%,至少99%,或更多,与没有ROBO2抑制剂存在的活性或表达水平相比。
因此,在此描述的组合物和方法的一些具体实施方式中,Robo2抑制剂抑制Robo2介导的信号传导。在在此描述的组合物和方法的一些具体实施方式中,Robo2抑制剂以与衔接蛋白Nck相互作用的Robo2为目标和/或与Nephrin、Nephrin介导肌动蛋白聚合的SLIT2-Robo-2介导的抑制剂、和/或对Robo2细胞反应的诱导的络合生成。
在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点,例如抗体或其抗原结合片段,是针对ROBO2配体的相互作用位点,例如SLIT2配体相互作用位点。在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点,例如抗体或其抗原结合片段,是针对ROBO2适配体结合位点,例如Nck相互作用位点或包括四个ROBO2的细胞内富含脯氨酸基序的NCK胞内结合域。在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点是针对配体相互作用位点附近的一个位点目标,以便于为受体(例如ROBO2)和其配体(例如SLIT2)的相互作用提供空间障碍。通过与ROBO2配体相互作用位点结合,在此描述的ROBO2抑制剂可减少或抑制ROBO2的活性或表达,以及下游ROBO2信号结果(例如ROBO2与衔接蛋白Nck相互作用和/或与Nephrin形成复合物,介导Nephrin介导的肌动蛋白聚合的SLIT2-ROBO-2的抑制,和/或对ROBO2细胞应答的诱导)。例如,在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点封闭或靶向于ROBO2上至少Ig1,并优选Ig1和Ig2位点,即,例如各自SEQ ID NO:1的BO2(46-145)和ROBO2(151-237),以及各自SEQ ID NO:3的ROBO2(30-129)和ROBO2(135-221)。在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点封闭或靶向于含有Nck胞内结合域的ROBO2胞内域,即SEQ ID NO:3的ROBO2(818-1378)。在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂的结合位点封闭或靶向于含有四个ROBO2的细胞内富含脯氨酸基序的ROBO2Nck胞内结合域。这可由本领域已知的多种方式完成,例如抗体和其抗原结合片段,抑制剂RNA,等,以及如在此描述的。因此,在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂是抗体或其抗原结合片段,其与ROBO2选择性结合或与其物理上相互作用。在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂是抗体或其抗原结合片段,其与ROBO2结合并抑制和/或封闭和/或阻止与Nck的相互作用和/或与Nephrin复合物的生成。在此描述的组合物和方法的一些具体实施方式中,抗体或其抗原结合片段与ROBO2的Ig SLIT结合域结合。在此描述的组合物和方法的一些具体实施方式中,抗体或其抗原结合片段与ROBO2的Ig 1SLIT结合域结合,或同时与ROBO2的Ig 1和Ig2SLIT结合域结合,即,各自SEQ ID NO:1的ROBO2(46-145)和ROBO2(151-237),以及各自SEQ ID NO:3的ROBO2(30-129)和ROBO2(135-221)。在此描述的组合物和方法的一些具体实施方式中,抗体或其抗原结合片段结合到或封闭ROBO2的胞内域,即,SEQ ID NO:3的ROBO2(818-1378)。在此描述的组合物和方法的一些具体实施方式中,抗体或其抗原结合片段结合到或封闭含有四个ROBO2的细胞内富含脯氨酸基序的Nck胞内结合域。
适用于在此描述的组合物和实施在此描述的方法的ROBO2的特异性的抗体或选择性结合ROBO2的抗体,优选为单克隆的,且可包括但不限于,人类抗体,人源化抗体或嵌合抗体,含有单链抗体,Fab片段,F(ab’)片段,由Fab表达库产生的片段,和/或上述任意的结合片段。抗体也可指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,含有抗原的分子或靶向结合位点或“抗原结合片段”的分子。这里描述的免疫球蛋白分子可为本领域技术人员理解的免疫球蛋白分子的任意类型(IgG、IgE、IgM、IgD、IgA和IgY)、类(IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)或亚类。
因此,在此描述的组合物和方法的一些具体实施方式中,在此描述的ROBO2抑制剂为单克隆抗ROBO2抗体或抗原结合片段。
在此描述的组合物和方法的一些具体实施方式中,在此描述的ROBO2抑制剂是ROBO2抗体片段或抗原结合片段。在此所用的术语“抗体片段”、“抗体结合片段”和“抗体衍生物”是指仅含有完整抗体的部分的蛋白质片段,通常包括完整抗体的抗原结合点,并且因此保留了与抗原结合的能力。该术语抗体片段包括的抗体片段或抗原结合片段的实例包括:(i)Fab片段,具有VL、CL、VH和CH1结构域;(ii)Fab’片段,其是一种Fab片段,在CH1结构域的C-端具有一个或多个半胱氨酸残基;(iii)Fd片段,具有VH、CH1域;(iv)Fd’片段,具有VH和CH1结构域,以及在CH1结构域的C-端具有一个或多个半胱氨酸残基;(v)Fv片段,具有单臂抗体VL和VH结构域;(vi)dAb片段(沃德等,自然杂志,1989(341):544-546)(Ward et al.,Nature 341,544-546(1989)),由VH或VL结构域组成;(vii)分离的CDR区;(viii)F(ab’)2片段,其为二价片段,包含两个通过二硫桥键在铰链区连接的Fab’片段,(ix)单链抗体分子(如单链Fv、scFv)(伯德等,科学杂志,1998,242:423-426,和休斯顿等,美国国家科学院院刊(美国),1988,85:5879-5883)(Bird et al.,Science 242:423-426(1988);and Huston et al.,PNAS(USA)85:5879-5883(1988));(x)具有两个抗原结合点的“双体”,在相同多肽链中包括与轻链可变区(VL)相连的重链可变区(VH)(见,例如,EP404097;WO 93/11161;霍林格等,美国国家科学协会公报,美国,1993,90:6444-6448)(EP 404,097;WO 93/11161;and Hollinger et al.,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993));(xi)“线性抗体”,包括一对串联的Fd片段(VH-CH1-VH-CH1),其与互补的轻链多肽形成一对抗原结合域(萨帕塔等。蛋白质工程,1995,8(10):1057-1062;美国专利5641870)(Zapata et al.Protein Eng.8(10):1057-1062(1995);and U.S.Pat.No.5,641,870);以及前述任意的修饰版本(通过聚二醇(聚乙二醇、聚丙二醇、聚丁二醇)或其它适当聚合物的共价结合的修饰)。
在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂或拮抗剂为ROBO2拮抗剂抗体或其抗原结合片段的嵌合抗体衍生物。
在此所述的ROBO2抑制剂或拮抗剂抗体及其抗原结合片段,在一些具体实施方式中,也可为人源化抗体衍生物。
在一些具体实施方式中,在此所述的ROBO2抑制剂或拮抗剂抗体及其抗原结合片段,包括修饰的衍生物,如被任意类型的分子通过的共价连接与抗体结合,条件是共价结合不会阻止抗体与目标抗原的结合,如ROBO2。
在此描述的组合物和方法的一些具体实施方式中,使用完整的人类抗体,其对人类患者的治疗处理是尤为令人满意的。
在此描述的组合物和方法的一些具体实施方式中,ROBO2抑制剂包括至少一种通过靶向于编码ROBO2的核酸能够封闭或减少特定功能ROBO2的表达的反义分子,例如SEQ ID NO:2或SEQ ID NO:4,或两者,或其相关的结构域。在此所述的组合物和方法的一些具体实施方式中,所述至少一种反义分子靶向于编码ROBO2的Ig SLIT结合域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种反义分子靶向于编码ROBO2的Ig1SLIT结合域或ROBO2的Ig1和Ig2SLIT结合域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种反义分子靶向于编码ROBO2胞内域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种反义分子靶向于编码包含四个ROBO2的细胞内富含脯氨酸基序的Nck胞内结合域的核酸。反义寡核苷酸的制备方法为本领域普通技术人员已知的,所述的反义寡核苷酸不与其它多核苷酸交叉反应即可特异性地与ROBO2mRNA结合。靶向位点的示例包括但不限于,起始密码子;5’调节区,包括启动子或增强子编码序列,包括任意保守的共识区;和3’非翻译区。在此所述的这些方面和这些所有方面的具体实施方式中,所述反义寡核苷酸的长度约为10至约100个核苷酸,约15至约50个核苷酸长度,约18至约25个核苷酸长度或更多。在某些具体实施方式中,反义寡核苷酸进一步包括化学修饰以提高抗核酸酶等诸如此类,例如,本领域普通技术人员已知的硫代磷酸酯键和2’-O-糖基修饰。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂包括至少一种小干扰RNA(siRNA)分子,该小干扰RNA能够封闭或减少功能性ROBO2表达的其是通过靶向于编码ROBO2的核酸或靶向于ROBO2的两种亚型如SEQ ID NO:2或SEQ ID NO:4或其相关域的核酸实现的。在此所述的组合物和方法的一些具体实施方式中,所述至少一种siRNA分子靶向于编码ROBO2的Ig SLIT结合域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种siRNA分子靶向于编码ROBO2的Ig1SLIT结合域或ROBO2的Ig1和Ig2SLIT结合域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种siRNA分子靶向于编码ROBO2胞内域的核酸。在此所述的组合物和方法的一些具体实施方式中,所述至少一种siRNA分子靶向于编码包含四个ROBO2的细胞内富含脯氨酸基序的Nck胞内结合域的核酸。制备siRNA分子是常规的,不与其它多核苷酸交叉反应可特异性地靶向于ROBO2mRNA。用于在此所述的组合物和方法的siRNA分子可由本领域已知方法制成,例如采用典型的固相合成寡核苷酸,并且与化学修饰结合用以提高siRNA药剂的半衰期和/或功效,和/或产生更多的强的递送制剂。做为选择地,siRNA分子通过编码细胞内转录siRNA的表达盒的载体进行递送。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂为RNA或DNA适体,其与一种或多种ROBO2亚型结合。在此所述的组合物和方法的一些具体实施方式中,ROBO2抑制剂或拮抗剂为RNA或DNA适体,其与ROBO2结合或与其进行物理上的相互作用,并且封闭ROBO2与配体分子或衔接分子之间的相互作用,诸如分别为SLIT2或Nck。在此所述的组合物和方法的一些具体实施方式中,ROBO2抑制剂或拮抗剂为RNA或DNA适体,其与ROBO2结合或与其物理上相互作用,并且降低、阻止或封闭下游的ROBO2信号,例如Nephrin介导肌动蛋白聚合的抑制介导的SLIT2-ROBO-2,和/或诱导对ROBO2的细胞应答。在此所述的组合物和方法的一些具体实施方式中,所述为RNA或DNA适体与ROBO2的Ig SLIT结合域进行结合或与其进行物理上相互作用。在此所述的组合物和方法的一些具体实施方式中,所述RNA或DNA适体与ROBO2的Ig1SLIT结合域或与ROBO2的Ig1和Ig2SLIT结合域结合或与其物理上相互作用,即SEQ ID NO:1各自的ROBO2(46-145)和ROBO2(151-237),以及SEQ ID NO:3各自的ROBO2(30-129)和ROBO2(135-221)。在此所述的组合物和方法的一些具体实施方式中,所述RNA或DNA适体与ROBO2胞内域例如SEQ ID NO:3的ROBO2(881-1378)结合或与其物理上相互作用。在此所述的组合物和方法的一些具体实施方式中,所述RNA或DNA适体与Nck胞内结合域结合或与其物理上相互作用或封闭Nck胞内结合域,所述Nck胞内结合域含有四个ROBO2细胞内富含脯氨酸基序。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂为靶向于ROBO2或与其结合的小分子化合物或药剂,包括但不限于,小肽或肽类分子,可溶性肽,以及合成的非肽基有机化合物或合成的非肽基无机化合物。这里使用的术语“小分子”是指以一种化学的药剂,可包括但不限于,肽、拟肽物、氨基酸、氨基酸类似物、多核苷酸、多核苷酸类似物、适体、核苷酸、核苷酸类似物、分子量小于约10000g/mol的有机或无机化合物(例如,包括杂有机化合物(heterorganic compoundd)和有机金属化合物)、分子量小于约5000g/mol的有机或无机化合物、分子量小于约1000g/mol的有机或无机化合物、分子量小于约500g/mol的有机或无机化合物、以及这些化合物的盐、酯和其它药学上可接受的形式。小分子结合位点的示例包括但不限于,与SLIT2或适体Nck结合的ROBO2的部分,即,ROBO2的Ig SLIT结合域或ROBO2的Ig1和Ig2SLIT结合域,ROBO2胞内域或含有四个ROBO2细胞内富含脯氨酸基序的Nck胞内结合域。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂或拮抗剂含有与ROBO2结合或抑制ROBO2生物活性的小分子。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂或拮抗剂含有至少一种ROBO2结构类似物,诸如显性失活ROBO2多肽。这里使用的术语ROBO2结构类似物是指具有与ROBO2的部分的三维结构相似的化合物,并且其与SLIT2和/或Nck在生理条件下在体内或体外结合,其中,结合至少部分地抑制ROBO2生物活性,例如Nephrin介导肌动蛋白聚合的抑制介导的SLIT2-ROBO2,和/或诱导ROBO2细胞应答。例如,可通过SLIT2-ROBO2结合的分子模型设计和合成合适的ROBO2结构类似物。ROBO2结构类似物可为单体、二聚体或以相同或不同结构任意希望组合的高阶多聚体以获得改进的亲和力和生物效应。
在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制剂或拮抗剂含有至少一种可溶性ROBO2受体或其融合多肽,例如,ROBO2抑制性多肽。在一些这样的具体实施方式中,所述ROBO2抑制性多肽为显性失活的ROBOR2融合蛋白质。在此所述的组合物和方法的一些具体实施方式中,所述ROBO2抑制性多肽含有ROBO2胞外域,例如ROBO2的Ig1SLIT结合域或ROBO2的Ig1和Ig2SLIT结合域,没有ROBO2胞内域。
在此所述的组合物和方法中使用的ROBO2抑制剂或拮抗剂可采用本领域已知的方法识别或表征,例如,蛋白质-蛋白质结合分析,生化筛选分析,免疫分析和基于细胞的分析,这些是本领域众所周知的,包括但不限于实施例中描述的那些。
例如,为了鉴定抑制ROBO2与其配体如SLIT2相互作用的分子,可使用结合分析。例如,通过共价连接或非共价连接,将ROBO2或SLIT固定在微量滴定板上。该分析通过将可被检测标签标记的非固定化组分(配体或受体)加入固定化组分中,在存在或不存在检测试剂的情况下。当反应完全时,移出未反应的组分并检测结合复合物。例如,如果结合复合物的形成被存在的检测试剂抑制,那么可认为检测试剂是抑制ROBO2与SLIT之间结合的候选的拮抗剂。基于细胞的分析或基于膜的分析也可用于鉴定ROBO2抑制剂。在其它具体实施方式中,通过检测和/或测量ROBO2基因的表达水平,可检测出抑制ROBO2基因表达的ROBO2抑制剂分子。可通过多种方法检测和/测量ROBO2基因表达,例如实时逆转录聚合酶链反应(RT-PCR),酶联免疫吸附分析(ELISA),RNA印迹分析(Northern blotting)或流式细胞术以及本领域普通技术人员已知的方法。
这些被鉴定的ROBO2抑制剂可采用慢性肾脏疾病的体内动物模型进一步测试,例如肾小球和间质损伤模型(例如,狼疮性肾炎的动物模型,包括新西兰黑鼠(NZB),(NZB x NZW)第一代杂交体(称为NZB/W),及其同类系衍生物,MRL/lpr和BXSB菌株),衰老动物模型(例如,老年雄性远交群大鼠和老年C57BL/6小鼠);自发性高血压大鼠(SHR);Buffalo/mna大鼠,其是人类原发性肾病综合征的模型;Munich Wistar(MWF)大鼠,其为与先天性肾单元数目缺陷有关的遗传模型,肾单元数目缺陷可使成人有发展为高血压和盐敏感的倾向;原发性足细胞特异性遗传性FSGS模型;HIV相关肾病转基因小鼠模型;Alport综合征动物模型,其包括IV型胶原(COL4A3、COL4A4和COL4A5)的α3、α4或α5链的突变体;免疫诱导模型,例如Thy-1肾炎模型,其为系膜增生性肾小球肾炎(MsPGN)的大鼠实验模型,抗肾小球基底膜(GBM)模型;和非免疫诱导模型。
关于ROBO2抑制剂,在此使用的“选择性结合”或“特异性结合”或“特异性于”是指在此描述的ROBO2抑制剂的能力,例如,ROBO2拮抗剂抗体或其ROBO2抗原结合片段,与靶标如ROBO2结合的KD为10-5M(10000nM)或更小,例如10-6M或更小,10-7M或更小,10-8M或更小,10-9M或更小,10-10M或更小,10-11M或更小,或10-12M或更小。例如,如果在此描述的ROBO2抑制剂/拮抗剂与ROBO2结合的KD为10-5M或更低,而不与相关分子如ROBO家族的其它成员结合,则可以说该药剂是可特异性结合ROBO2。例如,特异性结合可受亲和力和亲合性(affinity and的影响,例如ROBO2抑制剂/拮抗剂抗体或其抗原结合片段和多肽试剂的浓度。本领域普通技术人员可确定适当的条件,在该条件下,在此描述的多肽试剂采用适当的方法选择性地与靶标结合,例如在细胞结合分析中多肽试剂的滴定。
关于通过抑制ROBO2活性治疗慢性肾脏疾病的方法,术语“慢性肾脏疾病”或CKD是指肾脏疾病,其由于肾单位逐步缺失以及随后的肾功能缺失,随时间缓慢和逐步恶化的。在开始阶段可能没有症状。功能丧失通常需要几个月或几年才会发生。可能是太缓慢以至于直到肾功能不足正常的十分之一时症状才会出现。慢性肾脏疾病的最终阶段称为终末期肾病(ESRD)。在这个阶段,肾脏不再能够清除体内足够的废物和多余的液体。患者需要透析或肾脏移植。可引起糖尿病肾病的糖尿病和高血压是慢性肾脏疾病的两种最常见原因,并占大多数。其它可损害肾脏并引起慢性肾脏疾病的疾病和状态包括:自身免疫性紊乱(如系统性红斑狼疮和硬皮病),肾脏先天缺陷(如多囊性肾病),某些有毒化学物质,肾小球性肾炎,损伤或创伤,肾结石和感染,通向肾脏或肾脏中的动脉相关问题,一些止痛药或其它药物(如抗癌药物),返流性肾病(其中尿液逆流至肾脏而损害肾脏),等等。在此使用的“蛋白尿”是指尿液中存在过量的血清蛋白。在一些具体实施方式中,蛋白尿是肾脏疾病的象征,但其本身并不是决定性的。
因此,在此所述的这些方面和所有这些方面的一些具体实施方式中,患有或具有患慢性肾脏疾病风险的受治疗者患有糖尿病肾病。
在慢性肾脏疾病和蛋白尿的治疗方法方面,在此描述的“减少”或“抑制”意思是对于慢性肾脏疾病给定的参数或症状整体上降低的能力,所述“减少”或“抑制”是指优选可整体下降20%或更多,30%或更多,40%或更多,45%或更多,更优选地50%或更多,55%或更多,60%或更多,65%或更多,70%或更多,最优选75%或更多,80%或更多,85%或更多,90%或更多,或95%或更多。例如,减少或抑制可以是指被治疗的疾病的症状,例如高血压、尿中的蛋白等。
高血压几乎一直存在于慢性肾脏疾病的各个阶段。神经系统检查可显示神经损伤的迹象。在用听诊器听的时候,医疗服务人员可能会听到不正常的心脏或肺部声音。慢性肾脏疾病的早期症状也有其它疾病的症状。这些症状在病症更进一步发展之前可能是肾脏疾病的唯一迹象。慢性肾脏疾病的症状可包括:食欲不振,一般不适和疲劳,头痛,痒(瘙痒)和皮肤干燥,恶心,不尝试减肥而体重减少,等等。特别是当肾功能恶化时,可发展的其它症状包括:皮肤异常暗或亮;骨痛;脑和神经系统症状;昏睡和困惑;集中或思考的问题;手脚或其它部分麻木;肌肉抽搐或痉挛;口臭;易瘀伤,出血或便血;烦渴;经常打嗝;性欲低下和阳痿;月经周期停止(闭经);气息不足;睡眠问题,如失眠,不宁腿综合征和阻塞性睡眠呼吸暂停;手脚浮肿(水肿);呕吐,特别是在上午。
因此,在此所述方法的一些具体实施方式中,有效量的含有在此描述的ROBO2抑制剂的组合物给予受治疗者以减轻慢性肾脏疾病的症状。在此所用的“减轻慢性肾脏疾病的症状”为改善与慢性肾脏疾病相关的任何状态或症状。可选地,减轻慢性肾脏疾病可包括,减少受治疗者的一种或多种慢性肾脏疾病症状,相对于未处理的患有慢性肾脏疾病的对照或相对于受治疗者治疗前。与相当的未处理对照相比,或与用ROBO2抑制剂处理前的受治疗者相比,这些减少或预防程度为至少5%,至少10%,至少15%,至少20%,至少25%,至少30%,至少35%,至少40%,至少45%,至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%,或更多,通过任何标准技术测量。理想的是,采用本领域已知的任意标准方法检测,慢性肾脏疾病显著降低或检测不到,这种情况下认为慢性肾脏疾病得到了治疗。正在接受治疗慢性肾脏疾病的患者是医师已经诊断为具有这种状态的人。本领域普通技术人员已知的任何合适的方法均可用于诊断。例如,诊断和监控包括检测尿液、血液或血清样本中特异性蛋白质或分子的水平,例如白蛋白,钙,胆固醇,全血计数(CBC),电解质,镁,磷,钾,钠,或上述任意组合;例如检测分析肌酐清除率,肌酐水平,BUN(血尿素氮);通过使用特异性的技术或程序,例如腹部CT扫描、腹部MRI、腹部超音波、肾脏活组织切片、肾脏扫描、肾脏超音波;通过分析或测试红细胞生成素、甲状旁腺素(PTH)的结果变化的检测;骨密度检测或维生素D;或其它这些检测方法和分析的任意组合。
关于在此所述任一方法使用的术语“受治疗者”和“个体”在此中可交换使用,并且是指动物,如人类,是在此所述ROBO2抑制剂的接受者。为了治疗对特定动物如人类受治疗者特定的病态,术语“受治疗者”是指特定的动物。术语“非人类动物”和“非人类哺乳动物”在此中可交换使用,包括哺乳动物如大鼠、小鼠、兔子、羊、猫、狗、牛、猪和非人灵长类动物。术语“受治疗者”也包括任何脊椎动物,包括但不限于,哺乳动物、爬行动物、两栖类动物和鱼。然而,有利的是,受治疗者是哺乳动物如人类,或其它哺乳动物例如家养的哺乳动物,如狗、猫、马等等。
在此描述的这些方法和所有这些方法的一些具体实施方式中,该方法进一步包括,除ROBO2抑制剂外,给予受治疗者额外的治疗剂。这种额外的治疗剂可与ROBO2抑制剂共同给药。如在此使用的短语“共同给药(co-administering)”或“共同给予(co-administer)”是将在此所述的ROBO2抑制剂和另一种化合物如治疗剂单独地、同时地和/或经过一段由有资格的护理人员确定的时间连续地给药。
在一些这样的具体实施方式中,额外的治疗剂为血管紧张素转换酶(ACE)抑制剂,血管紧张素II受体拮抗剂(ARB)或盐皮质激素受体(MR)拮抗剂。
在此所述的与ROBO2抑制剂使用的ACE抑制剂包括但不限于,贝那普利(benazepril)(在美国以LotensinTM销售),卡托普利(captopril)(在美国以CapotenTM销售),依那普利(enalapril)/依那普利拉(enalaprilat)(在美国以口服和注射的VasotecTM销售),福辛普利(fosinopril)(在美国以MonoprilTM销售),赖诺普利(lisinopril)(在美国以ZestrilTM或PrinivilTM销售),莫西普利(moexipril)(在美国以UnivascTM销售),培哚普利(perindopril)(在美国以AceonTM销售),喹那普利(quinapril)(在美国以AccuprilTM销售),雷米普利(ramipril)(在美国以AltaceTM销售)和群多普利(trandolapril)(在美国以MavikTM销售)。与在此所述的ROBO2抑制剂使用的ARB类包括:坎地沙坦(candesartan)(在美国以ATACANDTM销售),厄贝沙坦(irbesartan)(在美国以AVAPROTM销售),奥美沙坦(olmesartan)(在美国以BENICARTM销售),洛沙坦(losartan)(在美国以COZAARTM销售),缬沙坦(valsartan)(在美国以DIOVANTM销售),替米沙坦(telmisartan)(在美国以MICARDISTM销售),依普沙坦(eprosartan)(在美国以TEVETENTM销售)。
在此所述这些方法和所有这些方法的一些具体实施方式中,该方法进一步包括,除ROBO2抑制剂外,给予受治疗者有效量的利尿剂。利尿剂包括但不限于:托拉塞米(torsemide)(在美国以DEMADEXTM销售),呋塞米(furosemide)(在美国以LASIXTM销售),布美他尼(bumetanide)(在美国以BUMEXTM销售),依他尼酸(ethacrynic acid)(在美国以EDECRINTM销售),托拉塞米(torsemide)(在美国以DEMADEXTM销售),阿米洛利(amiloride)(在美国以MIDAMORTM销售),乙酰唑胺(acetazolamide)(在美国以DIAMOXTM销售),帕马溴(pamabrom)(在美国以AQUA-BANTM销售),甘露醇(mannitol)(在美国以ARIDOLTM或OSMITROLTM销售),氨苯蝶啶(traimterene)(在美国以DYRENIUMTM销售),螺内酯(spironolactone)(在美国以ALDACTONETM销售),阿米洛利(amiloride)(在美国以MIDAMORTM销售),吲达帕胺(indapamide)(在美国LOZOLTM销售),氢氯噻嗪(hydrochlorothiazide)(在美国以HYDRODIURILTM销售),美托拉宗(metolazone)(在美国以ZAROXOLYNTM或MYKROXTM销售),甲氯噻嗪(methylclothiazide)(在美国以AQUATENSENTM或ENDURONTM销售),氢氯噻嗪(hydrocholorthiazide)(在美国以AQUAZIDE HTM或ESIDRIXTM或MICROZIDETM销售),氯噻嗪(chlorothiazide)(在美国以DIURILTM销售),苄氟噻嗪(bendroflumethiazide)(在美国以NATURETINTM销售),泊利噻嗪(polythiazide)(在美国以RENESETM销售),氢氟甲噻嗪(hydroflumethiazide)(在美国以SALURONTM销售),氯噻酮(chlorthalidone)(在美国以THALITONETM销售)。为了获得完整的列表,还参见例如《医生案头参考》(Physician’s Desk Reference),2012编著,PDR,Network,(2011)。
如在此所用,关于在此所述包括ROBO-2抑制剂或其联合治疗的任意组合物和方法,术语“治疗(treat)”、“疗法(treatment)”、“治疗(treating)”或“改善(amelioration)”是指治疗方法,其中,目的是逆转、减轻、改善、抑制、减慢或停止与疾病或失调有关的状态的进程或严重程度。术语“治疗(treating)”包括减少或缓解与慢性肾脏疾病有关的状态、疾病或失调的至少一种不利的效果或症状,例如,但不限于,糖尿病肾病。如果一种或多种临床症状减少,治疗通常是“有效的”。可选地,如果疾病的进程被缩减或停止,则治疗是“有效的”。也就是说,“治疗(treatment)”不只包括症状或标记的改善,也包括中断在预期没有治疗的情况下发生的至少缓慢进程或症状恶化。有益的或期望的临床结果包括,但不限于,一种或多种症状缓和,疾病程度减小,疾病状态稳定(即不恶化),疾病进程的推迟或减慢,疾病状态的改善或减轻,以及缓解(无论是部分或全部),无论是可检测的或不可检测的。术语疾病的“治疗(treatment)”还包括提供疾病的症状或副作用安慰(包括缓和治疗)。
在此使用的术语“有效量”是指减轻至少一种或多种需要治疗的疾病或失调的症状所需要的在此所述ROBO-2抑制剂的量,并与为了提供期望的效果使用的足够量的药理成分相关。因此,术语“治疗有效量”是指在此描述的ROBO-2抑制剂的量,采用在此公开的方法,当给予典型的受治疗者时足以提供特殊效果。在此所用的有效量也包括足以推迟疾病症状发展、改变疾病症状进程(例如,但不限于,减慢疾病症状进程)或逆转疾病症状的量。因此,不可能指定精确的“有效量”。然而,对于任何给定的情况,适当的“有效量”可由本领域普通技术人员仅仅通过常规实验确定。
有效量、毒性和治疗效果可通过标准制药程序在细胞培养和试验用动物中确定,例如,确定LD50(半数致死量)和ED50(半数有效量)。这些剂量可根据所采用的剂型和所用给药途径而变化。毒性效应和治疗效果的剂量比为治疗指数,其可以用LD50/ED50的比值表达。呈现大的治疗指数的组合物和方法是优选的。治疗有效剂量最初可根据细胞培养试验分析估算。另外,剂量可以在动物模型中配制,以获得包括在细胞培养或适当的动物模型中确定的IC 50(即,获得测量功能或活性的半数最大抑制的在此描述的ROBO-2抑制剂的浓度)的循环血浆浓度范围。例如,血浆中的水平可通过高效液相色谱法测量。任何具体剂量的效果可以通过由合适的生物试验监控到。必要时,剂量可由医师为适应治疗的观察效果进行调整而确定。根据慢性肾脏疾病的类型和严重程度,在此描述的约1μg/kg至100mg/kg(例如0.1-20mg/kg)的ROBO-2抑制剂的量是给予受治疗者的最初候选剂量范围,例如,无论是一个或多个分开给药或是连续输注。
给药模式
在此所述ROBO2抑制剂或其联合治疗可通过任意合适途径给予受治疗者,使受治疗者得到有效治疗。如在此所用的术语“给予(administering)”和“采用(introducing)”可交换使用,并且是指将ROBO2抑制剂配置给受治疗者,其通过可使这些药剂至少部分定位在期望位点的方法或途径进行配置,以产生期望效果。
在一些具体实施方式中,ROBO2抑制剂通过任意给药模式给予给患有慢性肾脏疾病的受治疗者,所述给药模式可全身性递送药剂或将药剂递送至所需表面或目标,并包括但不限于,注射给药、输注给药、滴注给药和吸入给药。为了保护多肽药剂不在肠道中失活,也可以考虑口服给药形式。“注射”包括但不限于,静脉内注射、肌肉注射、动脉内注射、鞘内注射、室内注射、囊内注射、眶内注射、心内注射、皮内注射、腹膜内注射、经气管注射、皮下注射、表皮下注射、关节内注射、子囊注射、蛛网膜下腔注射、椎管内注射、内脑脊髓注射以及胸骨内注射和灌输。在一些具体实施方式中,用于在此所述方法的ROBO2抑制剂是通过静脉灌输或注射给药的。
在此所用短语“肠胃外给药”和“非肠道给药”是指与肠内或局部给药不同的给药模式,通常通过注射给药。在此所用短语“全身用药”、“全身给药”、“全身地给予”和“外周给药”是指ROBO-2抑制剂的给药而不是直接给予靶点、组织或器官,例如肿瘤部位,而是ROBO-2抑制剂可进入受治疗者的循环系统,并因此经历代谢和其它相似过程。
对于在此所述方法的临床使用,在此ROBO-2抑制剂的给药包括配制成药物组合物或用于肠胃外给药的药物制剂,例如静脉内的,粘膜的如鼻内的,眼睛的或其它给药模式。在一些具体实施方式中,在此描述的ROBO-2抑制剂可以连同任何药学上可接受的载体化合物、材料或组合物给药,其可使受治疗者得到有效治疗。因此,在此所述方法使用的药物制剂可包含在此描述的ROBO-2抑制剂,与一种或多种药学上可接受的成分的组合。
短语“药学上可接受的”是指那些化合物、材料、组合物和/或剂型,它们在合理的医学判断范围内,适用于与人类或动物的组织接触而没有过多的毒性、刺激性、过敏反应或其它问题或并发症,具有相当的的利益/风险比。在此所用短语“药学上可接受的载体”意为药学上可接受的材料、组合物或载体,如液体或固体填料、稀释剂、赋形剂、溶剂、媒介、封装材料、制造助料(如润滑剂、滑石镁、硬脂酸钙或硬脂酸锌或硬脂酸)或溶剂封装材料,它们参与维持ROBO-2抑制剂的稳定性、溶解性或活性。每种载体必须是“可接受的”的意思是与制剂中的其它成分相容并不会伤害病人。可作为药学上可接受的载体的材料的一些示例包括:(1)糖类,如乳糖、葡萄糖和蔗糖;(2)淀粉,如玉米淀粉和土豆淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、甲基纤维素、乙基纤维素、微晶纤维素和醋酸纤维素;(4)黄蓍胶粉末(powdered tragacanth);(5)麦芽糖;(6)明胶;(7)赋形剂,如可可油和栓状蜡(suppository waxes);(8)油类,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和豆油;(9)二醇类,如丙二醇;(10)多元醇,如甘油、山梨醇、甘露醇和聚乙二醇(PEG);(11)酯类,如油酸乙酯和月桂酸乙酯;(12)琼脂;(13)缓冲剂,如氢氧化镁和氢氧化铝;(14)海藻酸;(15)无热原水;(16)等渗盐水;(17)林格氏溶液;(19)pH缓冲溶液;(20)多元酯、聚碳酸酯和/或聚酸酐;(21)膨胀剂,如多肽和氨基酸;(22)血清成分,如血清白蛋白,高密度脂蛋白(HDL)和低密度脂蛋白(LDL);(23)C2-C12的醇,如乙醇;以及(24)药物制剂中使用的其它无毒相容物质。脱模剂、被膜剂、防腐剂和抗氧化剂也可用于该制剂。如“赋形剂”、“载体”、“药学上可接受的载体”或类似的术语在此中可交换使用。
在此描述的ROBO-2抑制剂可专门制成用于以固体、液体或凝胶形式的化合物给予受治疗者,包括以下适用的形式:(1)肠胃外给药,例如通过皮下、肌肉内、静脉内或硬膜外注射如无菌溶液或悬浮液,或缓释制剂;(2)局部给药,如乳膏、油膏或控释贴剂或应用于皮肤的喷雾;(3)阴道内或直肠内,如阴道药栓、乳膏或泡沫;(4)通过眼睛;(5)透皮;(6)粘膜;以及(7)鼻。此外,ROBO-2抑制剂可通过药物递送系统植入或注射给受治疗者。例如,可参见厄克特(Urquhart)等,《药理学与毒理学年度回顾》(Ann.Rev.Pharmacol.Toxicol.)24:1984:199-236;路易斯编辑,《农药和医药的控释》(普雷纳姆出版社,纽约,1981);美国专利申请NO.3773919,和美国专利申请NO.353270960。
可用于在此描述的方法的、包括在此描述的ROBO-2抑制剂的该组合物的制剂和给药模式的进一步的具体实施方式,描述如下。
肠胃外剂型。ROBO-2抑制剂的肠胃外剂型也可通过多种途径给予患有慢性肾脏疾病的受治疗者,包括但不限于,皮下、静脉内(包括弹丸注射)、肌肉内和动脉内。由于肠胃外剂型给药一般绕过了受治疗者对污染物的天然防御屏障,所以肠胃外剂型优选无菌或能够在给药于受治疗者前灭菌。肠胃外剂型的示例包括但不限于,随时可以注射的溶液,随时可以溶解或悬浮在药学上可接受的载体中用于注射的干燥产品,随时可以注射的悬浮液,控释肠胃外剂型以及乳剂。
可用于提供公开的肠胃外剂型的合适的载体是本领域技术人员众所周知的。示例包括但不限于,无菌水;USP注射用水;盐水;葡萄糖溶液;水性载体例如但不限于氯化钠注射液,林格注射液,葡萄糖注射液,葡萄糖和氯化钠注射液和乳酸钠林格注射液;水混溶载体,例如但不限于,乙醇,聚乙二醇和聚丙二醇;以及非水溶性载体,例如但不限于,玉米油,棉籽油,花生油,芝麻油,油酸乙酯,肉豆蔻酸异丙酯和苯甲酸苄酯。
在一些具体实施方式中,含有有效量ROBO-2抑制剂的组合物可适合于口服给药,如离散剂型,例如,但不限于,片剂(包括但不限于刻痕片剂或包衣片剂),丸剂,囊片,胶囊,咀嚼片,粉末包,扁囊剂,锭剂,糯米纸囊剂,喷雾剂,或液体例如但不限于,以水液体、非水液体、水包油乳剂或油包水乳剂形式的糖浆剂、酏剂、溶液或悬浮液。这些组合物含有预定量的所公开的化合物的药学上可接受盐,并可通过本领域技术人员公知的制造方法制成。一般可参考,雷明顿制药科学,第18版,麦出版公司,伊斯顿,宾夕法尼亚州,1990(Remington's Pharmaceutical Sciences,18th ed.,Mack Publishing,Easton,Pa.(1990))。
由于其易于给药,使用固体药物赋形剂的片剂和胶囊剂代表最有利的固体口服单位制剂。如果需要,可通过标准的水或非水化技术将片剂包衣。这种剂型可通过任意制药方法制成。一般而言,药物组合物和剂型这样制得:将活性成分与液体载体、良好分散的固体载体或两者均匀地并充分地混合,然后如果需要的话,将产品成型为所需形式。在一些具体实施方式中,口服剂型不适用于抗生素药剂。
含有有效量ROBO2抑制剂的组合物的典型的口服剂型可根据传统制药复合技术制成,将紧密混合物(intimate admixture)中ROBO2抑制剂的药学上可接受的盐与至少一种赋形剂结合制成。赋形剂可根据给药所需组合物的形式而采取各种各样的形式。例如,适用于口服液体或气雾剂剂型的赋形剂包括,但不限于,水、二醇类、油类、醇类、调味剂、防腐剂和着色剂。适用于固体口服剂型(例如散剂、片剂、胶囊剂和囊片)的赋形剂的示例包括,但不限于,淀粉、糖、微晶纤维素、高岭土、稀释剂、造粒剂、润滑剂、粘合剂和崩解剂。
适用于在此所述的药物制剂的粘合剂包括,但不限于,玉米淀粉、土豆淀粉或其它淀粉,明胶,天然或合成的树胶例如阿拉伯树胶,藻酸钠,海藻酸,其它藻酸盐,黄蓍胶粉末,瓜尔胶,纤维素及其衍生物(如乙基纤维素、醋酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠),聚乙烯吡咯烷酮,甲基纤维素,预糊化淀粉,羟丙基甲基纤维素(如编号2208、2906、2910),微晶纤维素,以及上述混合物。
适用于在此所述的药物制剂的填充剂包括,但不限于,滑石,碳酸钙(例如颗粒或粉末),微晶纤维素,粉末纤维素,葡萄糖结合剂,高岭土,甘露醇,硅酸,山梨醇,淀粉,预糊化淀粉,以及上述混合物。在此所述药物组合物中的粘合剂或填充剂通常占药物组合物重量的约50%至约99%。
用在在此的口服药物制剂中的崩解剂是当片剂暴露于含水环境时,使其碎裂。既不是太少也不是太多以致破坏性地改变活性成分释放的有效量的崩解剂可用于形成在此描述的ROBO2抑制剂的固体口服剂型。所用崩解剂的量根据制剂的类型而不同,其是易被本领域普通技术人员辨别。可用于形成口服药物制剂的崩解剂包括,但不限于,琼脂、海藻酸、碳酸钙、微晶纤维素、交联羧甲基纤维素钠、交聚维酮、波拉克林钾、羧基乙酸淀粉钠、土豆或木薯淀粉、其它淀粉、预糊化淀粉、黏土、其它藻胶、其它纤维素、树胶,以及上述混合物。可以用于形成在此描述的ROBO2抑制剂的药物制剂的润滑剂包括,但不限于,硬脂酸钙,硬脂酸镁,矿物油,轻矿物油,甘油,山梨醇,甘露醇,聚乙二醇,其它二醇,硬脂酸,月桂基硫酸钠,滑石,氢化植物油(如花生油、棉籽油、葵花油、芝麻油、橄榄油、玉米油和大豆油),硬脂酸锌,油酸乙酯,月桂酸乙酯,琼脂,以及上述混合物。其他的润滑剂,包括,例如,syloid硅胶(200,由马里兰州巴尔的摩的W.R.Grace Co.生产),合成二氧化硅的凝聚型气溶胶(由德克萨斯州普莱诺的Degussa Co.销售),CAB-O-(一种由马萨诸塞州波士顿的Cabot Co.销售的热解二氧化硅产品),以及上述混合物。如果使用的话,润滑剂通常以小于其所掺入的药物组合物或剂型重量的约1%的量使用。
在其它具体实施方式提供了不含乳糖的药物制剂和剂型,其中,这些组合物优选含有少量,如果有的话,乳糖或其它单糖或二糖。如在此所用的术语“不含乳糖”是指乳糖的存在量,如果有的话,不足以实质上增加活性成分的降解速率。在此公开的不含乳糖的组合物可包含本领域公知的赋形剂,以及被引入在此作为参考的USP(XXI)/NF(XVI)所列举的赋形剂。
在一些具体实施方式中,ROBO2抑制剂的口服制剂进一步涵盖含有以在此的ROBO2抑制剂为活性成分的无水药物组合物和剂型,因为水可以促进某些化合物降解。例如,为了确定制剂随时间变化的性质,如保质期或稳定性,加入水(例如5%)作为一种模拟长期贮存的方式在制药领域是被广泛接受的。参见例如延斯T.卡斯滕森(Jens T.Carstensen),《药物稳定性:原则和实践》(Drug Stability:Principles&Practice):379-380(第二版,马塞尔德克尔出版社(Marcel Dekker),纽约州纽约,1995)(2nd ed.,Marcel Dekker,NY,N.Y.:1995)。在此描述的无水药物组合物和剂型可采用无水或低水分材料在低水分或低湿度条件下制成。如果预计在生产、包装和/或储存期间会与水分和/或湿气发生大量接触,那么包含乳糖和至少一种含有伯胺或仲胺的活性成分的药物组合物和剂型优选是无水的。无水组合物优选用已知可防止暴露于水的材料来包装,因此可将它们装在合适的制剂盒中。合适的包装的例子包括但不限于密封的薄膜、塑料、带有干燥剂或没有干燥剂的单位剂量容器(如药瓶)、水泡包装和窄条包装。
气溶胶剂型。ROBO-2抑制剂可与合适的推进剂一起装在加压气溶胶容器中,推进剂例如碳氢化合物推进剂,如丙烷、丁烷或异丁烷与常规助剂。ROBO-2抑制剂也可在非加压形式下如喷雾器或雾化器中给药。ROBO-2抑制剂也可以干粉形式直接给予呼吸道,例如,通过使用吸入器。
通过举例说明的方式,合适的粉末组合物包括ROBO-2抑制剂与乳糖或其它适于支气管给药的惰性粉末充分混合的粉末制剂。粉末组合物可通过气溶胶分配器给药或装在易碎胶囊中,受治疗者可以插入装置,该装置可刺穿胶囊并将粉末源源不断吹出以适于吸入。该组合物可能包括推进剂、表面活性剂和共溶剂,并装入传统气溶胶容器中,其上有适当的计量阀关闭。
递送至呼吸道的气溶胶是本领域已知的。参见例如阿杰伊,A.和格连J.,《药学与临床研究》,1:565-569(1990)(Adjei,A.and Garren,J.Pharm.Res.,1:565-569(1990));扎嫩P.和拉姆,J.-W.J.,《国际药学杂志》,114:111-115(1995)(Zanen,P.and Lamm,J.-W.J.Int.J.Pharm.,114:111-115(1995));贡达I.,“用于递送治疗剂和诊断剂至呼吸道的气溶胶”在治疗性药物载体系统中的关键回顾,6:273-313(Gonda,I."Aerosols for delivery of therapeutic and diagnostic agents to the respiratory tract,"in Critical Reviews in Therapeutic Drug Carrier Systems,6:273-313(1990));安德森等,《美国呼吸疾病评论》,140:1317-1324(1989)(Anderson et al.,Am.Rev.Respir.Dis.,140:1317-1324(1989))并具有肽和蛋白质全身递送潜能(巴顿和普拉茨,《高等药物输送评论》,8:179-196(1992))(Patton and Platz,Advanced Drug Delivery Reviews,8:179-196(1992));Timsina等,《国际药学杂志》,101:1-13(1995)(Timsina et.al.,Int.J.Pharm.,101:1-13(1995));以及坦西I.P.,《喷雾技术市场》,4:26-29(1994)(Tansey,I.P.,Spray Technol.Market,4:26-29(1994));弗伦奇D.L.,爱德华D.A.和尼文R.W.,《气溶胶科学与技术》,27:769-783(1996)(French,D.L.,Edwards,D.A.and Niven,R.W.,Aerosol Sci.,27:769-783(1996));维萨J.,《粉体工程》,58:1-10(1989)(Visser,J.,Powder Technology 58:1-10(1989));路德S.和R.H.穆勒,《控释杂志》,22:163-172(1992)(Rudt,S.and R.H.Muller,J.Controlled Release,22:263-272(1992));塔巴达Y.和Y.Ikada,《生物医学材料研究杂志》,22:837-858(1988)(Tabata,Y,and Y.Ikada,Biomed.Mater.Res.,22:837-858(1988));沃尔D.A.,《给药杂志》,2:101-120,1995(Wall,D.A.,Drug Delivery,2:10 1-20 1995));巴顿和普拉茨,《先进药物输送评论》,8:179-196(1992)(Patton,J.and Platz,R.,Adv.Drug Del.Rev.,8:179-196(1992));布里翁P.,《先进药物输送评论》,5:107-132(1990)(Bryon,P.,Adv.Drug.Del.Rev.,5:107-132(1990));巴顿J.S.,等,《控释杂志》,28:1579-1585(1994)(Patton,J.S.,et al.,Controlled Release,28:15 79-85(1994));达蒙B.和贝恩斯W.,《生物自然技术》(1996)(Damms,B.and Bains,W.,Nature Biotechnology(1996));尼文R.W.等,《药学与临床研究》,12(9):1343-1349(1995)(Niven,R.W.,et al.,Pharm.Res.,12(9);1343-1349(1995));以及小林S.等,《药学与临床研究》,13(1):80-83(1996)(Kobayashi,S.,et al.,Pharm.Res.,13(1):80-83(1996)),在此通过引入将其整体作为参考并入本文。
在此所述ROBO-2抑制剂制剂进一步涵盖包括以公开的化合物作为活性成分的无水药物组合物和剂型,因为水可以促进某些化合物降解。例如,为了确定制剂随时间变化的性质,如保质期或稳定性,加入水(例如5%)作为一种模拟长期贮存的方式在制药领域是被广泛接受的。参见例如延斯T.卡斯滕森(Jens T.Carstensen),《药物稳定性:原则和实践》(Drug Stability:Principles&Practice):379-380页(第二版,马塞尔德克尔出版社(Marcel Dekker),纽约州纽约,1995)(2nd ed.,Marcel Dekker,NY,N.Y.:1995)。在此描述的无水药物组合物和剂型可采用无水或低水分材料在低水分或低湿度条件下制成。如果预计在生产、包装和/或储存期间会与水分和/或湿气发生大量接触,那么包含乳糖和至少一种含有伯胺或仲胺的活性成分的药物组合物和剂型优选是无水的。无水组合物优选用已知可防止暴露于水的材料来包装,因此可将它们装在合适的制剂盒中。合适的包装的例子包括但不限于密封的薄膜、塑料、带有干燥剂或没有干燥剂的单位剂量容器(如药瓶)、水泡包装和窄条包装。
控制释放剂型和延迟释放剂型。在在此所述方面的一些具体实施方式中,ROBO-2抑制剂可通过控制或延迟释放的形式给予受治疗者。理想地,在医疗中使用最优设计的控释制剂的特征在于:采用最少药物,在短时间内治愈或控制病症。控释制剂的优点包括:1)延长药物活性;2)降低给药频率;3)提高受治疗者依从性;4)使用更少的总药物;5)减少局部或全身副作用;6)最小化药物积累;7)减少血液水平波动;8)提高疗效;9)减少增强作用或药物活性损失;以及10)改善的疾病或状态的控制速度(吉姆,朱成,《控释剂型设计》(Technomic出版,兰开斯特,宾夕法尼亚州,2000年))(Kim,Cherng-ju,Controlled Release Dosage Form Design,2(Technomic Publishing,Lancaster,Pa.:2000))。控释制剂可用于控制式(I)化合物的起始作用、作用持续时间、治疗窗内的血浆水平和峰值血液水平。特别地,控制或延迟释放剂型或制剂可用于保证实现式(I)化合物的最大效果,同时最小化潜在的负面影响和安全隐患,这可以在从剂量下给药的药物(即,低于最小治疗水平)以及超过该药物毒性水平时发生。
各种已知的控制或延迟释放剂型、制剂或装置适于与在此所述ROBO-2抑制剂共同使用。示例包括但不限于以下文件中描述的那些:美国专利号3,845,770、3,916,899、3,536,809、3,598,123、4,008,719、5674,533、5,059,595、5,591,767、5,120,548、5,073,543、5,639,476、5,354,556、5,733,566和6,365,185B1,每一个文件通过引入作为参考将其整体并入本文。例如通过使用例如羟丙基甲基纤维素、其它聚合物基质、凝胶、可渗透性膜、等渗系统(例如(阿尔扎公司,山景城,加利福尼亚州,美国))、多层包衣、微颗粒、脂质体或微球体或其组合来产生不同比例的理想释放效果,这些剂型可用于缓释或控释一种或多种活性成分。另外,离子交换材料可用于制备所公开化合物的固定化形式、吸附盐形式,从而实现药物的控制递送。特异性的离子交换材料的示例包括但不限于, A568和 AP143(罗门哈斯公司,春之楼,宾夕法尼亚州,美国)(Rohm&Haas,Spring House,Pa.USA)。
在此所述方法的一些具体实施方式中,用于在此描述方法的ROBO-2抑制剂通过持续释放或脉冲形式给予受治疗者。脉冲疗法不是一种相同量组合物随时间推移的不连续给药的形式,而是包括在降低频率或降低给药剂量时进行相同剂量组合物的给药。当受治疗者持续发生失调时,持续释放或脉冲给药是特别优选的,例如,当受治疗者患有慢性肾脏疾病。可以减少每个脉冲的剂量,并且在此所述给予的ROBO-2抑制剂的总量随着受治疗者或患者治疗过程中减至最小。
必要时候,脉冲之间的间隔可由本领域普通技术人员确定。经常地,脉冲间的间隔一般可通过在下一脉冲递送之前,受治疗者体内不再检测到组合物或该组合物的活性组分时,给予组合物的另一剂量计算。间隔也可根据组合物在体内的半衰期计算。间隔可以计算为大于体内的半衰期,或2、3、4、5甚至10倍以上的该组合物的半衰期。美国专利号4,747,825、4,723,958、4,948,592、4,965,251和5,403,590公开了用于脉冲组合物通过输注或其它形式递送至受治疗者的多种方法和装置。
在一些具体实施方式中,可制备包含ROBO-2抑制剂的持续释放制剂。持续释放制剂的合适示例包括含有抑制剂的固体疏水性聚合物的半渗透基质,其中基质以成型制品如膜或微胶囊存在。持续释放基质的示例包括聚酯、水凝胶(如聚(2-羟乙基-甲基丙烯酸酯)或聚乙烯醇)、聚乳酸(美国专利号3,773,919)、L-谷氨酸和y乙基-L-谷氨酸(y ethyl-L-glutamate)共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物如醋酸亮丙瑞林(LUPRON DEPOT)(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球)以及聚-D-(-)-3-羟基丁酸。
用于体内给药的含有ROBO-2抑制剂的制剂优选是无菌的。例如,采用无菌过滤膜过滤或其它本领域技术人员已知的方法可轻易实现无菌。
在此一些方面还提供了分析方法、方法和系统,其依照指示慢性肾脏疾病的生物标志物或慢性肾脏疾病或蛋白尿的预倾向,基于ROBO2的表达谱或序列信息,确定个体是否具有慢性肾脏疾病或慢性肾脏疾病或蛋白尿的预倾向。如在此所示,ROBO2作为生物标志物对鉴定受治疗者是否患有慢性肾脏疾病或是否具有患有慢性肾脏疾病或蛋白尿的高风险,或监控慢性肾脏疾病或蛋白尿进程的治疗效果是有用的。
如在此所用的“生物标志物”是指一种有机生物分子,其区别地存在于样品中使一种表型状态(phenotypic status)受治疗者(例如患有一种疾病)与另一种表型状态受治疗者(例如没有患病)区分开。如果计算得到的不同群组中的生物标志物的平均或中位表达水平具有统计显著性,则生物标志物区别存在于不同表型状态中。统计显著性一般检验,除其它外还包括,t-检验、方差分析(ANOVA)、Kruskal-Wallis秩和检验、Wilcoxon秩和检验、曼-惠特尼U检验和机率比。生物标志物,单独或组合,提供受治疗者属于一种表型状态或另一种的相对风险的测量。照这样,它们作为标志物对疾病(诊断)、药物和药物毒性的治疗效果(诊疗)是有用的。
用于在此所述分析方法的ROBO2表达可由任何合适方法检测,包括蛋白质水平检测或mRNA表达水平检测。ROBO2多肽可以以任何可从受治疗者获得的生物样本中找到的形式检测,或者任何操纵生物样本引起的形式(例如样本处理引起的)。ROBO2修饰形式可包括如下方式获得的产品:等位基因变异体、剪接变异体、翻译后修饰(例如糖基化、溶蛋白质水解裂解(如母本蛋白质片段)、糖基化、磷酸化、脂化、氧化、甲基化、半胱氨酰化(cysteinylation)、磺化、乙酰化等等)、低聚反应、解低聚反应(以使单体从蛋白质多聚体形式中分离)、变性作用等等。
设计的在此所述分析方法用以检测ROBO2的所有形式或特殊形式。在需要时,不同形式ROBO2之间进行区分,例如不同亚型,可通过使用基于区分不同形式的物理特性的检测方法完成,物理特性例如,不同分子量、不同分子大小、存在/不存在不同表位等等。
因此,在此一些方面提供了用于诊断受治疗者患有慢性肾脏疾病或具有患有慢性肾脏疾病或蛋白尿风险的分析方法,该分析方法包括:测量从受治疗者获得的生物样本中ROBO2蛋白质或核酸水平,其中,如果从受治疗者取得的生物样本中ROBO2的水平等于或高于(例如统计量上明显高于)ROBO2阈值参考水平,受治疗者极有可能具患慢性肾脏疾病或蛋白尿的风险,或具有慢性肾脏疾病。例如,ROBO2水平增加大于约10%,或大于约20%,或大于约30%,或大于约40%,或大于约50%,或大于约60%,或更多,与ROBO2阈值参考水平相比。在一些具体实施方式中,ROBO2水平的增加高于中值或平均ROBO2阈值参考水平至少一个标准偏差或至少两个标准偏差,或更多。例如,所述中值或平均ROBO2阈值参考水平可从5个或更多个没有患有慢性肾脏疾病或蛋白尿的受治疗者取得的样本、或5个或更多个从相同受治疗者在不同时间点取得的样本中获得。
在这些分析方法的一些具体实施方式中,将生物样本中测得的ROBO2的量与参考阈值水平或参考生物样本进行相比,参考生物样本例如从年龄匹配的正常对照(例如不具有患有慢性肾脏疾病或蛋白尿风险的年龄匹配的受治疗者)得到的生物样本,或健康的受治疗者,例如健康个体。
在的一些具体实施方式中,在此公开的分析方法、系统和试剂盒可也可用于监测给予受治疗者的治疗进程。例如,可以测量受治疗者的生物样本中第一时间点(如t1)的ROBO2的水平,并与ROBO2生物标志物参考阈值水平相比,如果测得的ROBO2水平等于或高于参考阈值水平,可以给予受治疗者合适的治疗性疗法或养生法,以延迟或降低慢性肾脏疾病或蛋白尿的发生,例如,如在此公开方法的增加锻炼,降低心脏压力,调整饮食等等,然后,ROBO2的生物标志物蛋白质面板水平可在第二时间点(如t2)和随后时间点(如t3、t4、t5等等)测得,并与一个或多个时间点(如t1或任何随后时间点)的tROBO2水平或ROBO2的参考阈值水平相比,以确定治疗性治疗或药物治疗或养生法对于降低慢性肾脏疾病或蛋白尿风险、延迟或减少慢性肾脏疾病或蛋白尿发生的是否有效。在一些这样的具体实施方式中,在此公开的分析方法、系统或试剂盒可能用于监测有症状的受治疗者(例如,已知患有慢性肾脏疾病或蛋白尿的受治疗者)的治疗性治疗,这里有效的治疗是可以减少受治疗者的ROBO2,可选择地,在此公开的分析方法、系统或试剂盒可能用于监测有症状的受治疗者的预防性治疗(例如,用于预防受治疗者慢性肾脏疾病或蛋白尿的发生)效果,例如,根据在此公开的方法,或其它本领域已知的方法或因为遗传原因,已经鉴定这里的受治疗者具有患慢性肾脏疾病或蛋白尿的风险。
在此使用的术语“样本”一般是指含有核酸、DNA或RNA,或氨基酸的任何材料。一般而言,这样的材料会以下面的形式存在:血液样本、大便样本、组织样本、细胞、细菌、组织切片或口腔抹试。样本是可以被制备的,例如样本可以是新鲜的、固定的、冷冻的或嵌入石蜡中。在此使用的术语“生物样本”是指从受治疗者取得的细胞或细胞群或一些组织或液体。最经常的是,样本可以脱离受治疗者,但术语“生物样本”也可是指体内分析的细胞或组织,即不需要脱离受治疗者。经常地,“生物样本”含有来自动物的细胞,但该术语也可是指非细胞生物材料,例如血液、唾液或尿液中的非细胞组分,其可用于测量基因表达水平。生物样本包括但不限于,活组织切片、刮片(scrapes)、全血、血浆、血清、尿液、唾液、细胞培养或脑脊液。生物样本还包括活组织切片、细胞培养液。生物样本或组织样本可以是指脱离个体的组织或液体样本,例如包括但不限于,尿液、血液、血浆、血清、肾脏活组织切片、大便、痰液、脊髓液、胸膜液、乳头吸出物(nipple aspirates)、淋巴液、皮肤外部、呼吸道、肠道和泌尿生殖道、泪水、唾液、奶、细胞(包括但不限于血细胞)、肿瘤、器官以及体外细胞培养物组分的样本。在一些具体实施方式中,当获得尿液样本时,离心尿液样本以沉淀任何肾脏细胞,基于此可进行在此所述的分析方法和方法。在一些具体实施方式中,样本来自肾脏活组织切片,例如肾脏或其部分的芯针活组织切片,例如足细胞样本。另外,使用细针抽吸样本。在一些具体实施方式中,生物样本是可以制备的,例如生物样本可以是新鲜的、固定的、冷冻的或嵌入石蜡中。可通过将细胞样本脱离受治疗者而得到样本,但也可以通过使用预先分离的细胞(例如,由另一人分离)来完成,或在此描述的体内的方法。
如在此使用的术语“表达”可交换地是指多肽或蛋白质的表达或多核苷酸的表达或基因的表达。表达也指预转译修饰蛋白的表达和翻译后修饰的蛋白质的表达,以及前体mRNA分子,或者剪接或成熟的mRNA分子的表达。例如,多核苷酸的表达可通过测量RNA转录分子的产生来确定,如信使RNA(mRNA)转录水平。例如,蛋白质或多肽的表达可采用与多肽结合的抗体通过免疫分析确定。应用于多核苷酸的术语“编码”是指一种可以“编码”多肽或蛋白质的多核苷酸,如果以其天然状态或当采用本领域技术人员公知的的方法进行操作时,它可以被转录以产生可以被翻译成氨基酸序列而生成多肽和/或其片段的RNA。反义链是这些核酸的补体,由此可推导出编码序列。术语“内源性地表达”或“内源性表达”是指基因产物在正常水平和在正常调节该细胞类型中的表达。
可以用于在此所述分析方法、方法和系统的用于测量样本或生物样本中ROBO2蛋白质或核酸水平的检测方法,包括光学方法,电化学方法(伏安法和电流分析技术),原子力显微镜技术和射频方法,例如多级共振光谱。光学方法包括显微镜检查,包括共焦和非共焦两者,荧光检测,发冷光,化学发光,吸光度,反射比,透射比,双折射或折射率(例如表面等离子体共振,椭圆测量术,共振镜法,光栅耦合器波导法或干涉量度法)。
在此所述分析方法、方法和系统的这些具体实施方式中,其中,ROBO2蛋白质水平是可以测量的,例如,SEQ ID NO:1或SEQ ID NO:3的蛋白质水平,人们可以使用任何本领域普通技术人员公知的蛋白质组学方法来测量生物样本中生物标志物蛋白的水平。测量可以是定量的或定性的,只要测量能够确定或指示生物样本中ROBO2蛋白质的水平是否等于、高于或低于ROBO2蛋白的参考阈值水平。
在一些具体实施方式中,测得的ROBO2蛋白质水平可以是测定ROBO2蛋白质本身数量的ROBO2蛋白质水平的初始测量,例如,通过测量样本中ROBO2蛋白质分子数量),或者在一些具体实施方式中,它可以是ROBO2蛋白质二级测量(从该测量可以,但不必然,推导出ROBO2蛋白质的数量,例如功能活性的测量或核酸的测量,如编码ROBO2蛋白质的mRNA)。可从初始测量导出或得到定性数据。
在此所述分析方法和方法的一些具体实施方式中,ROBO2蛋白质水平可采用基于亲和力的测量技术测得。与抗体相关的“亲和力”是本领域很好理解的术语,且意思是抗体与结合伴侣结合的程度或强度,结合伴侣例如在此所述的生物标志物(或其抗原决定部位)。亲和力可通过本领域已知的多种方法测量和/或表达,包括但不限于,平衡解离常数(KD或Kd),表观平衡解离常数(KD或Kd),以及IC50(竞争分析方法中实现50%抑制的所需量,与在此的“I50”可交换使用)。可以理解的是,基于本发明的目的,亲和力是结合至表位的给定数量的抗体的平均亲和力。
基于亲和力的测量技术利用特异性结合至测量中的生物标志物蛋白质(一种“亲和试剂”,例如抗体或适体)的分子,虽然也可使用其它技术,如基于光谱的技术(例如基质辅助激光解吸电离飞行时间质谱法,MALDI-TOF光谱),或测量生物活性的分析方法(例如测量生长因子丝裂原活性的分析方法)。用于在此所述分析方法和方法的基于亲和力的测量技术可包括基于抗体的分析方法(免疫分析法)和利用适体(与其它分子特异性结合的核酸分子)的分析方法,例如酶联寡聚核苷酸吸附试验(ELONA)。此外,利用抗体和适体两者的分析方法预期也是可以的(例如利用抗体捕获和适体检测的夹心格式分析)。各种各样基于亲和力的试验也是本领域公知的。
基于亲和力的分析方法使用至少一种源于生物标志物蛋白质的表位,即ROBO2,且多种基于亲和力的分析方法的格式使用一种以上的表位(即“夹心”格式分析方法涉及两种或多种表位;至少一种表位用于捕获生物标志物蛋白质,和至少一种不同表位用于检测标志物)。
基于亲和力的分析方法可以是竞争或直接反应格式,使用夹心型格式,且可进一步是多相的(如利用固体支持物)或同质的(如在单相中发生),和/或使用免疫沉淀反应。多种分析方法包括使用标记亲和试剂(例如抗体、多肽或适体);该标签可以是,例如,酶的、荧光的、化学发光的、放射性的或染料分子。放大探针信号的分析方法也是已知的,这些分析方法的示例为利用生物素和抗生物素蛋白的分析方法,以及酶标记和介导的免疫分析方法,例如酶联免疫吸附测定方法(ELISA)和ELONA分析方法。例如,生物液体样本的生物标记物浓度可由分析方法或ELISA测量。生物标志物或特异性于生物标志物的试剂可附于表面,并可直接或间接测量水平。
在此所述分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白质水平可采用基于亲和力的免疫分析测定技术测量。
免疫分析技术可包括任何定性或定量测量生物样本中ROBO2蛋白质水平的免疫分析技术。合适的免疫分析技术包括但不限于,放射免疫检定法,ELISA(酶联免疫吸附分析),“夹心”免疫分析法,免疫放射测定法,免疫扩散分析法,原位免疫分析法(例如采用胶体金、酶或放射性同位素标记),Western印迹分析,免疫沉淀反应法,免疫荧光分析法,免疫电泳分析法,荧光免疫分析(FIA),免疫放射测定法(IRMA),免疫酶测定法(IEMA),免疫发光测定法以及免疫荧光测定法(Madersbacher S.,伯杰P.,《抗体与免疫确定法》,方法,21:41-50,2000年)(Madersbacher S,Berger P.Antibodies and immunoassays.Methods 2000;21:41-50),化学发光法,免疫-PCR技术和Western印迹分析。同样地,可定性或定量测量生物样本中生物标志物水平的基于适体的分析方法可用于在此所述的分析方法、方法和系统中。通常,在免疫分析几乎所有格式中,抗体可代替适体,尽管适体允许额外的分析方法格式(例如采用核酸放大技术如PCR(美国专利号4,683,202)的结合适体的放大)或与合成引物的等温放大(美国专利号6,251,639和6,692,918)。
在此所述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白水平可采用基于亲和力的免疫分析技术进行测量,免疫分析法可通过测量生物标志物/抗体相互作用的蛋白质/抗体相互作用程度完成。可使用任何已知的免疫分析方法。
在一些具体实施方式中,结合伴侣,如在结合分析方法中结合至ROBO2蛋白的抗体或配体,优选标记的特异性结合伴侣,但不一定是抗体。结合伴侣通常标记本身,但可替换地,其可通过产生信号的二次反应而被检测到,信号例如是从另一标记的物质产生的。
因此,特异性结合至ROBO2蛋白的抗体可用于在此的分析方法、方法和系统中,用于确定生物样本中ROBO2蛋白的存在和/或其量,其可用于检测诊断样本中存在的ROBO2蛋白浓度的增加或降低。这样的抗体可通过任何免疫诊断领域熟知的方法找到。抗体可以是蛋白质生物学相关状态的任何抗ROBO2蛋白抗体。因此,例如,它们可以针对ROBO2蛋白的以糖基化形式存在于人体中的非糖基化形式而被找到,或针对携带ROBO2蛋白相关表位的缩氨酸。
在此的这些分析方法、方法和系统的一些具体实施方式中,可使用放大的分析方法格式,由此检测的相对低的蛋白质水平的可产生增强的“信号”。放大的免疫分析法的一种具体格式是增强的化学发光法。例如,抗体用辣根过氧化物酶标记,参与与鲁米诺、过氧化物底物和增强发射光强度和持续时间的化合物的化学发光反应,特别是4-碘苯酚或4-羟基肉桂酸。
在此的这些分析方法、方法和系统的一些具体实施方式中,可使用包括免疫-PCR的放大的免疫分析法。在这个技术中,抗体与任意含有PCR引物的DNA分子共价连接,由此,连接有抗体的DNA用聚合酶链反应进行放大。参见E.R.亨德里克森等,《核酸研究》,23:522-529(1995)(E.R.Hendrickson et al.,Nucleic Acids Research 23:522-529(1995))。
因此,在此描述的分析方法、方法和系统的所有具体实施方式中,ROBO2蛋白的水平可采用蛋白结合剂确定,在此也可称为“蛋白质结合实体”或“亲和试剂”,具体来说,是抗体。例如,具体来说是抗体如抗-生物标志物抗体的亲和试剂可用于免疫分析法中,特别是ELISA(酶联免疫吸附分析法)。在具体实施方式中,生物标志物蛋白的水平可在生物样本中采用本领域公知的方法测量,例如包括但不限于,同种型蛋白质的同种型特异性化学或酶分解,免疫印迹法,免疫组织化学分析,ELISA以及质谱分析法。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用“酶联免疫吸附分析法(ELISA)”测量。ELISA是一种采用标记(如酶联)形式的抗体检测和测量抗原浓度的技术。本领域技术人员公知的ELISA有不同形式。以下文献中描述了本领域已知的ELISA标准技术:《免疫诊断方法》,第二版,罗斯和比格茨编辑,约翰威利&伞斯,1980(Methods in Immunodiagnosis",2nd Edition,Rose and Bigazzi,eds.John Wiley&Sons,1980);坎贝尔等,《方法与免疫学》,W.A.本杰明公司,1964(Campbellet al.,"Methods and Immunology",W.A.Benjamin,Inc.,1964);和Oellerich M.1984,《临床化学和临床生物化学》,22:895-904(Oellerich,M.1984,J.Clin.Chem.Clin.Biochem.,22:895-904.)。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用夹心ELISA分析方法测量。“夹心ELISA”中,抗体(例如抗-酶)连接至固相(即微量滴定板),并暴露在含有抗原(例如酶)的生物样本中。然后清洗固相以除去未结合的抗原。随后标记的抗体(例如酶联)结合至结合抗原(如果存在)以形成抗体-抗原-抗体的夹心。因此,采用这种方法,ROBO2的第一抗体与例如塑料微量滴定板的孔的固相结合,并与样本一起培养,分析ROBO2蛋白特异性的标记第二抗体。与抗体连接的酶的示例为碱性磷酸酶,辣根过氧化物酶,荧光素酶,脲酶和β-半乳糖苷酶。连接抗体的酶与底物反应,生成可以测量的有色反应产物。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平采用抗体捕获分析方法或竞争ELISA测量。在“竞争ELISA”中,抗体与含有抗原(即酶)的样本一起培养。然后抗原-抗体混合物与覆盖抗原(即酶)的固相(例如微量滴定板)接触。样本中存在的抗原越多,可用于与固相结合的自由抗体就越少。然后将标记的(例如酶联)第二抗体加至固相中,以确定与固相结合的初始抗体的量。因此,在一些这样的具体实施方式中,生物测试样本可以与固相结合,并且可添加抗ROBO2蛋白抗体(例如与ROBO2特异性结合的抗体)并使其结合。清洗未结合材料后,与固相结合的抗体的量可采用与第一抗体相反的标记的第二抗体确定。
在这些分析方法、方法和系统的一些具体实施方式中,标记物优选酶。例如,酶的底物可为显色的、荧光的或化学发光的。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用免疫组织化学法测量。在“免疫组织化学法”中,通过将组织暴露在被检测蛋白特异性的抗体中,将组织切片用于测试特异性蛋白。然后,通过多种方法中的任一种将抗体可视化,以确定蛋白的存在和存在蛋白的量。用于可视化抗体的方法的示例,例如,通过将连接至抗体的酶(例如荧光素酶、碱性磷酸酶、辣根过氧化物酶或β-半乳糖苷酶),或化学方法(例如DAB/底物发色体)。然后将样本经显微镜分析,优选采用光学显微镜分析被可在可见光谱中检测的着色剂染色的样本,采用本领域技术人员已知的多种染色方法和试剂中的任一种方法。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用放射免疫检定法测量。放射免疫检定法是一种采用抗原的标记(如放射性或荧光性标记)形式检测和测量抗原即ROBO2浓度的技术。抗原的放射性标记物的示例包括3H、14C和125I。生物样本中ROBO2的浓度通过将生物样本中的ROBO2与标记(例如放射性)的ROBO2竞争地与ROBO2抗体结合。为了保证标记的ROBO2和未标记的ROBO2之间的竞争性结合,标记的ROBO2存在的浓度足以使抗体的结合位点饱和。样本中ROBO2浓度越高,结合至抗体的标记的ROBO2的浓度越低。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用免疫放射测定法(IRMA)测量。IRMA是一种免疫分析方法,其中,抗体试剂被放射性地标记。IRMA需要多价抗原缀合产物,采用技术与蛋白质缀合,所述蛋白质例如兔血清白蛋白(RSA)。多价抗原缀合物的每个分子必须具有至少2个抗原残基,并且抗原残基必须有足够的分开距离,以使至少2个抗体结合至抗原。例如,在IRMA中,多价抗原缀合物可与固体表面如塑料球相连。与放射性标记的抗原结合的未标记的抗原和抗体“样本”被加至含有多价抗原缀合物覆盖的球的试管中。样本中的抗原与多价抗原缀合物竞争抗原抗体结合位点。适当的潜伏期后,清洗掉未结合的反应物,并确定固体球表面的放射性量。结合的放射性抗体的量与样本中抗原的浓度成反比。
其它用于检测生物样本中ROBO2蛋白水平的技术可依据医生喜好进行,并根据在此的公开内容和生物样本种类(即,血浆、尿液、组织样本等)进行。Western印迹(托宾等,《美国国家科学院学报》,76:4350(1979))(Towbin et at.,Proc.Nat.Acad.Sci.76:4350(1979))是这种技术中的一种,其中,适当处理的样本在SDS-PAGE凝胶中运行,之后转移至固体支持物载体上,如硝化纤维滤器。可检测地标记的抗ROBO2抗体或蛋白结合分子用于评定ROBO2蛋白水平,可检测标记物的信号强度与ROBO2蛋白的量对应。存在的ROBO2蛋白的量的水平也可被量化,例如通过光密度测定法。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白的水平可采用质谱分析法如MALDI/TOF(飞行时间),SELDI/TOF,液相色谱-质谱法联用(LC-MS),气相色谱-质谱法联用(GC-MS),高效液相色谱-质谱法联用(HPLC-MS),毛细管电泳-质谱法联用,核磁共振谱或串联质谱(例如MS/MS、MS/MS/MS、ESI-MS/MS等)测量。参见例如美国专利申请号20030199001、20030134304、20030077616,通过引用将其整体并入本文中。
在一些这样的具体实施方式中,这些方法可与机器、计算机系统和媒体结合,以产生用于测量和分析生物样本中ROBO2蛋白水平的自动化系统,并产生识别生物样本中ROBO2蛋白的水平的可打印报告。在一些实例中,ROBO2水平的测量是通过确定模块和比较模块远程完成的。
质谱法是本领域众所周知的,并用于定量和/或鉴定生物分子,例如蛋白质(参见例如,Li等(2000),Tibtech,18:151-160;Rowley等(2000),方法,20:383-397;和Kuster和Mann(1998),《结构生物学当代进展》,8:393-400)(see,e.g.,Li et al.(2000)Tibtech 18:151-160;Rowley et al.(2000)Methods 20:383-397;and Kuster and Mann(1998)Curr.Opin.Structural Biol.8:393-400)。此外,质谱技术已经发展至能够对分离蛋白质的至少部分的从头测序。Chait等,《科学》,262:89-92(1993);Keough等,《美国科学院院刊》,96:7131-6(1999)(Chait et al.,Science 262:89-92(1993);Keough et al.,Proc.Natl.Acad.Sci.USA.96:7131-6(1999));Bergman评论,EXS 88:133-44(2000)(reviewed in Bergman,EXS 88:133-44(2000))。
在某些具体实施方式中使用气相离子分光光度法。在其它具体实施方式中,采用激光解吸/电离质谱分析样本。现代激光解吸/电离质谱(“LDI-MS”)可以以两种主要变型实施:基质辅助激光解吸/电离(“MALDI”)质谱和表面增强激光解吸/电离(“SELDI”)。在MALDI中,分析物与含有基质的溶液混合,并将一滴液体放在底物表面。然后将基质溶液与生物分子共结晶。将底物放入质谱仪中。激光能直接作用于底物表面,在此吸收和电离生物分子,没有将其明显分散。参见例如,美国专利号5,118,937(Hillenkamp等)和美国专利号5,045,694(Beavis&Chait),通过引用将其整体并入本文中。
在SELDI中,修饰底物表面以使其成为解吸过程的积极参与者。一种变体的表面用吸附剂和/或捕获试剂衍生化以使其选择性地结合至感兴趣的蛋白。另一种变体的表面用能量吸收分子衍生化,当用激光照射时,能量吸收分子不被吸收。另一种变体的表面用结合有感兴趣蛋白和含有激光应用时断裂的光解键的分子进行衍生化。在这些方法的每一种方法中,衍生剂定一般位于底物表面的特异性位置,其上施加样本。参见例如美国专利号5,719,060和WO 98/59361,通过引用将其整体并入本文中。例如,这两种方法可以组合,通过使用SELDI亲和表面来捕获分析物,以及将含有基质的液体加入捕获的分析物中以得到能量吸收材料。
关于质谱的更多信息,参见例如《仪器分离原理(第3版)》,Skoog,桑德斯学院出版,费城,1985;和《化学技术柯克奥斯莫默百科全书(第4版)》,第15卷(John Wiley&Sons,纽约,1995),第1071-1094页(Principles of Instrumental Analysis,3rd edition.,Skoog,Saunders College Publishing,Philadelphia,1985;and Kirk-Othmer Encyclopedia of Chemical Technology,4th ed.Vol.15(John Wiley&Sons,New York 1995),pp.1071-1094)。
ROBO2蛋白水平的检测通常取决于信号强度的检测。反过来,这可以反映出结合至底物的多肽的数量和特征。例如,在某些具体实施方式中,比较第一样本和第二样本的光谱中峰值的信号强度(例如视觉上地、通过计算机分析等),以确定具体生物分子的相对量。可使用软件程序,例如生物标记向导程序(赛弗吉生物系统公司,弗里蒙特,加利福尼亚州),帮助分析质谱图。质谱仪及其相关技术是本领域技术人员是熟知的。
在此所述分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白水平可采用凝胶电泳技术测量,具体为SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳),特别是二维PAGE(2D-PAGE),优选二维SDS-PAGE(2D-SDS-PAGE)。根据具体实施例,该分析方法是基于2D-PAGE,具体采用优选4-9的pH范围的固相pH梯度(IPGs)。
在此描述的分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白水平可采用凝胶电泳技术测量,具体地,上述提到的技术与其它蛋白质分离方法组合,特别是本领域技术人员已知的方法,具体为色谱分析和体积排阻法。
在此所述分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白水平可采用共振技术测量,具体为表面等离子体共振。
在此所述分析方法、方法和系统的一些具体实施方式中,ROBO2蛋白水平可采用蛋白质生物芯片测量。生物芯片一般包括具有基本平坦表面的固体底物,其上连接有捕获试剂(例如,一种吸附剂或亲和剂)。通常,生物芯片表面包括多个结合有捕获试剂的可寻址位置。生物芯片还可包括作为对照的结合捕获试剂。蛋白质生物芯片是可适用于捕获多肽的生物芯片。本领域中有多种蛋白质生物芯片。例如,这些包括以下公司生产的蛋白质生物芯片:赛弗吉生物系统公司(弗里蒙特,加利福尼亚),Zyomyx(海沃市,加利福尼亚),英杰公司(卡尔斯巴德,加利福尼亚),Biacore(乌普萨拉,瑞典)和通用电器医疗生物学有限公司(伯克郡,英国)(Ciphergen Biosystems,Inc.(Fremont,Calif.),Zyomyx(Hayward,Calif.),Invitrogen(Carlsbad,Calif.),Biacore(Uppsala,Sweden)and Procognia(Berkshire,UK))。以下专利或公开的专利申请中描述了这些蛋白质生物芯片的示例:美国专利号6,225,047(Hutchens&Yip),美国专利号6,537,749(Kuimelis and Wagner),美国专利号6,329,209(Wagner等),PCT国际公开号WO00156934(Englert等),PCT国际公开号WO031048768(Boutell等)和美国专利号5,242,828(Bergstrom等)。
用于与来自受治疗者ROBO2蛋白水平对比的ROBO2蛋白水平的参考阈值水平或数值,根据在此实施的方面或具体实施方式可以变化,通过本说明书和下述内容可理解。参考阈值取决于单个样本值,例如从测试受治疗者取得的生物样本得到的值,但在较早的时间点(例如在第一时间点(t1),例如测量的第一生物标志物水平,或在第二时间点(t2))。参考阈值也可能取决于样本组,例如从测试受治疗者样本组中得到的值。例如,在一些具体实施方式中,ROBO2蛋白的参考阈值取决于已知患有慢性肾脏疾病或蛋白尿的受治疗者中测量的ROBO2蛋白值的50%的值(例如,中值)。例如,ROBO2蛋白在50%以上(例如等于或高于中值水平)的受治疗者可能具有患慢性肾脏疾病或蛋白尿的风险。参考阈值也可能取决于包括或排除待测样本的样本组。参考值可能取决于大量样本,例如来自按时间顺序排列的年龄匹配组的健康受治疗者人群的样本,或来自那些有或没有具有患慢性肾脏疾病或蛋白尿风险的受治疗者的样本。在一些具体实施方式中,参考值比任何分析方法的平均值或中值,或预定的平均值或中值高至少一个,多个通常是至少两个标准差。
通过在此所述分析方法、方法和系统用于评估受治疗者极有可能经历或患有慢性肾脏疾病或蛋白尿的风险,“参考阈值”通常是预先确定的参考阈值水平,例如,从与测试受治疗者时间顺序年龄匹配的时间顺序年龄组的健康受治疗者人群获得的尿液、血清或血液的中值ROBO2蛋白。如前面指出的,在一些情况下,参考样本也可以是性别匹配和/或基于种族匹配的。在一些具体实施方式中,ROBO2蛋白的参考阈值是一种生物样本中生物标志物的中值水平,例如相同种族受治疗者组的尿液、血液、血清,例如白种人,黑种人,西班牙人,亚洲人,以及亚洲-印第安人,巴基斯坦人,中东和/或太平洋岛民。
通过在此所述分析方法、方法和系统用于评估受治疗者极有可能经历或患有的慢性肾脏疾病或蛋白尿的风险,ROBO2蛋白的参考阈值水平可能是预先确定的水平,例如从与测试受治疗者时间顺序年龄匹配的时间顺序年龄组的健康受治疗者人群获得的平均或中值水平。可选地,ROBO2蛋白的参考阈值水平可以是特定受治疗者的历史参考水平,其是从相同受治疗者的样本中得到的,但在早些时间点,和/或当受治疗者没有患有慢性肾脏疾病或蛋白尿风险的时候。在一些例子中,ROBO2蛋白的参考阈值水平可以是特定受治疗者群组的历史参考水平,这些受治疗者均具有例如糖尿病引起的慢性肾脏疾病或蛋白尿。
在一些具体实施方式中,选择健康受治疗者作为对照受治疗者。在一些具体实施方式中,对照组为年龄匹配的对照组。健康受治疗者可用于获得例如尿液样本或血清样本中ROBO2蛋白的参考阈值水平。在此所用“健康”受治疗者或从“健康”受治疗者或个体中获得的样本与本领域技术人员通常理解的相同。例如,如在此描述的,人们可以使用公知的方法评估肾脏功能,选择健康受治疗者为对照组受治疗者,用于在此描述的诊断和治疗方法。在一些具体实施方式中,身体健康、没有慢性肾脏疾病迹象或症状的受治疗者可作为健康对照受治疗者。通过临床医生、实验室测试进行的广泛测试评价这些受治疗者,包括病史、家族病史、身体和肾脏测试。慢性肾脏疾病和/或蛋白尿的分析示例包括但不限于,检测尿液、血液或血清样本中的特异性蛋白质和/或分子,如白蛋白、钙、胆固醇、全血计数(CBC)、电解质、镁、磷、钾、钠或其任意组合;检测的分析方法,例如检测肌酐清除率的分析方法;肌酐水平;BNU(尿素氮);通过使用特异性的技术或程序,例如腹部CT扫描,腹部MRI,腹部超声波,肾脏活组织切片,肾脏扫描,肾脏超声波;通过检测红细胞生成素、PTH的分析方法或测试结果的变化;骨密度测试或维生素D;或这些检测方法和分析方法的任意组合。
理想的年龄匹配的人群(从中可以得到参考值)是与测试受治疗者或个体具有相同年龄顺序,但相近年龄匹配的人群也是可以接受的。相近年龄匹配的人群可能是测试受治疗者年龄顺序的1、2、3、4或5年内,或可以是包括测试个体年龄顺序的不同年龄顺序群组。
与其“年龄顺序匹配组”相比的受治疗者通常是指,与年龄顺序匹配在5-20年范围内的受治疗者相比。相近的年龄匹配的人群可以是2、3、4、5、6、7、8、9、10、15或20年增量(例如“5年增量”组可以是,62岁受治疗者的参考值的来源可能包括58-62岁个体、59-63岁个体、60-64岁个体、61-65岁个体或62-66岁个体)。在更广泛的定义中,不同年龄顺序群组间存在较大差异,例如,当存在用于参考值的少数不同年龄顺序群组和不同年龄顺序群组间的差异超过在此所述2、3、4、5、6、7、8、9、10或15或20年时,“年龄顺序匹配组”是指年龄组接近匹配受治疗者的年龄顺序(例如用于较高年龄组(例如80-90岁)和较低年龄组(例如20-30岁)的参考值时,51岁的年龄顺序匹配组可使用较低年龄组(20-30岁)作为参考水平,其更接近测试受治疗者的年龄顺序)。
选择对照组受治疗者需要考虑的其它因素,包括但不限于,物种,性别,种族等等。因此,在一些具体实施方式中,参考水平可以是预先确定的参考水平,例如从健康对照组受治疗者组得到的平均或中值水平,这些受治疗者的性别与测试受治疗者的性别是性别匹配的。在一些具体实施方式中,参考水平可以是与先确定的参考水平,例如从健康对照组受治疗者组得到的平均或中值水平,这些受治疗者的种族与测试受治疗者的种族是种族匹配的(例如白种人,黑种人,西班牙人,亚洲人,以及亚洲-印第安人,巴基斯坦人,中东和/或太平洋岛民)。在其它具体实施方式中,健康受治疗者组的年龄顺序和性别与测试受治疗者的年龄顺序和性别是分别匹配的。在其它具体实施方式中,健康受治疗者组的年龄顺序和种族与测试受治疗者的年龄顺序和种族是分别匹配的。在其它具体实施方式中,健康对照受治疗者组的年龄顺序、性别和种族与测试受治疗者的年龄顺序、性别和种族是分别匹配的。
受治疗者生物样本中ROBO2蛋白水平与ROBO2参考阈值水平的比较过程可采用本领域技术人员已知的任何和任何适当的方便方式进行。通常,采用在此所述分析方法、方法和系统确定的ROBO2蛋白水平值可以上定量值(例如浓度定量值,如每升样本中ROBO2蛋白的毫克数(如mg/L),或绝对量)。选择地,ROBO2蛋白水平值可以根据测量技术可以是定性的,因此,从受治疗者得到的值与参考值的比较的模式可以根据所用测量技术而变化。例如,该比较可通过检测数值数据,通过检测该数据的表达(例如检测图形表示如条形图或线形图)而进行,并使用例如标准差中至少一个或至少两个标准差。在一个实施例中,当定性分析用于测量ROBO2蛋白水平时,该水平可通过可视比较有色反应产物的强度,或通过比较密度计数值或有色反应产物的光谱测量(例如比较来自测量装置中的数值数据或例如条形图的图解数据)而被比较。
如在此所述,ROBO2蛋白水平可定量(绝对值)或定性(相对值)测量。在一些具体实施方式中,生物样本中ROBO2蛋白水平的定量值可以表明慢性肾脏疾病或蛋白尿风险的特定水平(或等级)。
在一些具体实施方式中,进行比较以确定受治疗者数值与参考值之间区别的大小(例如比较测得的受治疗者ROBO2蛋白水平与ROBO2蛋白参考阈值之间的“倍数”或百分比不同)。倍数差异可通过测量ROBO2蛋白水平的绝对浓度确定,并将其与ROBO2蛋白的水平的参考阈值的绝对值进行比较而确定,或者,倍数差异可通过参考值和样本值之间的相对差异确定,其中这两个值都不是绝对浓度的测量,和/或两个值可以同时测量。例如,ELISA测量蛋白质的绝对含量或浓度,其与参考的相同蛋白质的绝对浓度相比可确定倍数变化。如另一实施例,抗体阵列测量相对浓度,从而可确定倍数变化。因此,暗示或指示具体诊断的测量值和参考值之间区别的大小取决于所用的方法。
本领域技术人员显而易见的是,当采用重复测量法测量ROBO2蛋白水平时,测得的受治疗者的值可与ROBO2蛋白水平参考阈值比较,并考虑重复测量法。通过使用测量值中的均值或中值中的一个考虑重复测量法。
在一些具体实施方式中,比较方法可以是手动的,或者也可以优选为自动的。例如,分析装置(如测量化学发光信号的光度计)可能含有可比较受治疗者ROBO2蛋白值与参考ROBO2蛋白值的电路和软件。可选地,分开的装置(如数字电脑)可用于比较测得的受治疗者的ROBO2蛋白水平和ROBO2蛋白参考阈值水平。用于比较的自动装置可包括存储的ROBO2蛋白参考值,或可比较测得的受治疗者ROBO2蛋白水平和同时测得的参考样本得到的ROBO2蛋白参考阈值水平。
在一些具体实施方式中,基于在此所述分析方法、方法和系统的结果,测试ROBO2蛋白水平的受治疗者被分配至两组或多组(情况)中的一组。在此所述的诊断分析方法、方法和系统可用于在多种不同状态间进行分类。
因此,在一些具体实施方式中,采用在此所述诊断分析方法、方法和系统可确定受治疗者是否具有患慢性肾脏疾病或蛋白尿的高风险。可鉴别以如高、中、低的不同风险状态为特征确定的ROBO2蛋白的生物标识物量和形式。发展为慢性肾脏疾病或蛋白尿的风险通过测量单独ROBO2蛋白或与其它已知标志物的结合而确定,然后,或将其提交给分类算法或将其和与特定风险水平相关的参考量(如在此公开的分离参考量)比较。
在一些具体实施方式中,在此提供了用于确定受治疗者患有慢性肾脏疾病或蛋白尿风险的严重性、阶段或风险的诊断分析方法、方法和系统。例如,慢性肾脏疾病的每一阶段具有特征性的ROBO2蛋白量或ROBO2蛋白相对量。疾病的阶段通过测量单独ROBO2蛋白或测量与其它标志物的结合而确定,然后或将其提交到分类算法或将其与特定阶段相关生物标志物的参考量和/或模式比较,例如受治疗者有多久将会发展成慢性肾脏疾病或蛋白尿。例如,人们可以对一年内极有可能患有的慢性肾脏疾病或蛋白尿(不良预后),或在接下来的5年受治疗者极有可能患有慢性肾脏疾病或蛋白尿分类。
诊断分析方法、方法和系统的其他具体实施方式与结果或诊断或两者对技术人员、医生或受治疗者的交流相关。在某些具体实施方式中,使用计算机以将分析方法结果或诊断结果或两者的结果交流给感兴趣的方面,例如医生或他的患者。在一些具体实施方式中,例如,在一个国家或地区进行的分析方法或分析的分析方法结果,不同于与其沟通的国家或地区得到的结果或诊断。在一些具体实施方式中,基于受治疗者生物样本中ROBO2蛋白水平的患有慢性肾脏疾病或蛋白尿的风险,在获得水平或预后后交流给受治疗者。受治疗者的治疗医生将预后或诊断交流给受治疗者。可选地,预后和诊断可通过电子邮件或电话交流给受治疗者。计算机通过电子邮件或电话用于交流预后或诊断,或通过互联网使用安全网关患者登录服务。在某些的具体实施方式中,含有预后或诊断测试结果的信息,通过联合使用通讯领域技术人员熟悉的计算机硬件和软件,自动产生并递送给受治疗者。在此所述的分析方法、方法和系统的某些具体实施方式中,所有或部分方法步骤,包括样本分析方法、疾病诊断和分析方法结果或诊断的交流,可在不同地区(例如国外)进行。
用于确定或评估在此描述的慢性肾脏疾病或蛋白尿风险的诊断分析方法、方法和系统的一些具体实施方式中,所述分析方法、方法和系统进一步包括基于患有慢性肾脏疾病或蛋白尿风险的确定的管理受治疗者的治疗。这种管理包括医生或临床医生在确定受治疗者患有慢性肾脏疾病或蛋白尿风险后的行为。例如,如果医生诊断受治疗者具有患有慢性肾脏疾病或蛋白尿的风险,则接下来会给出一个特定的养生治疗方案。合适的养生治疗方案包括但不限于,监督下的锻炼计划,血压的控制、糖摄入量和/或体液水平,以及药物治疗。在一些具体实施方式中,患有慢性肾脏疾病或蛋白尿风险的诊断后,还要进一步测试以确定病人是否患有慢性肾脏疾病,或患者是否患有相关疾病。另外,如果诊断测试对主要不良事件状态风险的结果是不确定,则需要进一步测试。在在此所述用于确定或评估慢性肾脏疾病或蛋白尿风险的分析方法、方法和系统的一些具体实施方式中,如果医生诊断受治疗者不具有患有慢性肾脏疾病或蛋白尿的风险,则不提供治疗。
在此所述分析方法和ROBO2的检测方法可采用机器人和计算机指挥系统自动化实现。可将生物样本,如尿液、血清或血液样本注入系统中,如微流体装置,从样本输入至结果输出完全由自动工作站运行。
因此,在此提供在一些方面进一步提供了系统(和用于计算机系统的计算机可读介质),其基于表达谱或序列信息,执行检测个体是否患有慢性肾脏疾病或蛋白尿或是否具有患慢性肾脏疾病或蛋白尿的倾向的方法。
在一些方面,在此提供系统,用于评估受治疗者患有或具有患慢性肾脏疾病或蛋白尿的增加的风险,该系统包括:(a)确定模块,其配置用于接收至少一种生物样本并针对所述生物样本进行至少一次分析,以测量生物样本中ROBO2水平或确定相对于预先确定或参考阈值水平的ROBO2的表达比率,并输出所述测量水平或表达比率;(b)存储设备,其配置用于储存确定模块输出的数据信息;(c)比较模块,适合用于接收存储设备的输入,并将存储在存储设备的数据与至少一个ROBO2水平的参考阈值进行比较,其中,如果测量的ROBO2蛋白水平至少等于或高于参考阈值水平,比较模块提供信息给输出模块,生物样本与偏离参考阈值生物标志物水平的受治疗者相关;以及(d)输出模块,用于将信息显示给用户。
在发明的所有方面中,确定ROBO2蛋白水平的方法可采用自动化机器或系统进行。所述机器和系统产生报告,例如在可见屏幕中显示报告或打印的报告,所述报告表明了ROBO2蛋白的水平,和/或报告了与ROBO2蛋白参考阈值相同或增加,和/或获得样本的受治疗者是否具有患有慢性肾脏疾病或蛋白尿的风险。
因此,在此所述的一些具体实施方式也提供机器、计算机系统和计算机可读媒介,用于进行以下步骤:(i)确定ROBO2蛋白水平;以及(2)表明或报告受治疗者是否具有患慢性肾脏疾病或蛋白尿的风险。
这些方面的具体实施方式通过功能模块进行描述,这些具体实施方式由记录在计算机可读媒介上的计算机可执行指令定义,并在执行时使计算机进行方法步骤。出于清晰性的考虑,模块按功能进行分离。然而应该理解的是,模块不必对应严格的代码块,并且所述功能可以通过存储在不同媒介中的不同代码部分的执行,以及在不同时间执行来完成。另外,应当理解的是,模块可执行其它功能,因此,模块并不限于具有具体的功能或功能集。
计算机可读媒介可为任何可被计算机存取的有形媒介。计算机可读媒介包括易失性的或非易失性的、可移动的或不可移动的有形媒介,其通过用于存储信息的任何方法或技术实施,例如计算机可读指令,数据结构,程式模块或其它数据。计算机可读媒介包括但不限于,RAM(随机存取存储器),ROM(只读存储器),EPROM(可擦可编程只读存储器),EEPROM(电可擦可编程只读存储器),闪存存储器,和其他的存储技术,CD-ROM(只读压缩光盘存储器),DVDs(数字全能磁盘)或其它光存储媒介,磁带盒,磁带,磁盘存储器或其它磁存储器媒介,其它易失或非易失性存储器,以及其它用于存储所需信息的有形媒介,其可通过包括前述任何合适组合的计算机进行存取。
呈现在一个或多个计算机可读媒介或计算机可读介质的计算机可读数据,例如可定义指令作为一个或多个程序的一部分作为计算机执行的结果,指令指导计算机执行在此所述的一种或多种功能(例如与系统、或计算机可读媒介有关的),和/或不同具体实施方式、变形或其组合。这些指令可用多种编程语言中的任意一种编写,例如Java,J#,Visual Basic,C,C#,C++,Fortran,Pascal,Eiffel,Basic,COBOL汇编语言等等,或这些多种组合中的任何一种。呈现这些指令的计算机可读媒介可驻留在一个或多个在此所述系统或计算机可读媒介的组件中,可分布在一个或多个这样的组件中,并可在它们之间转变。
计算机可读媒介可以是可传输的,从而存储其中的指令可被加载至任何计算机资源,以实施本发明所讨论的方面。另外,需要理解的是,存储在上述计算机可读介质或计算机可读媒介中的指令并不限于作为主机上运行的应用程序中的一部分呈现的指令。当然,指令可作为任何一种用于编制计算机完成在此方面的电脑编码(例如软件或微码)呈现。计算机可执行指令可以以合适的计算机语言或几种语言的组合进行编写。小面参考资料中描述了本领域普通技术人员已知的基本计算生物学方法:例如Setubal and Meidanis等,《计算生物学方法介绍》(PWS出版公司,波士顿,1997)(Setubal and Meidanis et al.,Introduction to Computational Biology Methods(PWS Publishing Company,Boston,1997));Salzberg、Searles、Kasif,(编),《分子生物学计算方法》,(爱思唯尔,阿姆斯特丹,1998)(Salzberg,Searles,Kasif,(Ed.),Computational Methods in Molecular Biology,(Elsevier,Amsterdam,1998));Rashidi和Buehler,《生物信息学基础知识:应用生物科学与医学》(CRC出版,伦敦,2000)(Rashidi and Buehler,Bioinformatics Basics:Application in Biological Science and Medicine(CRC Press,London,2000))以及Ouelette和Bzevanis,《生物信息学:基因和蛋白质分析实用指南》(Wiley&Sons公司,第2版,2001)(Ouelette and Bzevanis Bioinformatics:A Practical Guide for Analysis of Gene and Proteins(Wiley&Sons,Inc.,2nd ed.,2001))。
在此所述方面的某些具体实施方式的功能模块包括确定模块,存储设备,比较模块和显示模块。功能模块可通过一个或多个计算机完成,或通过使用一个或多个计算机网络或计算机系统完成。
在一些方面,在此提供了计算机系统,其可用于确定受治疗者是否极有可能患有或具有患慢性肾脏疾病或蛋白尿的风险。在一些具体实施方式中,计算机系统与确定模块连接,其配置用于获得确定模块关于生物样本的输出数据,在此确定模块配置用于检测从受治疗者获得的生物样本中ROBO2蛋白水平;并且这里计算机系统包括:(a)存储设备,其配置用以储存确定模块的信息输出和参考数据,其中,存储设备连接至(b)比较模块,在一些具体实施方式中,其用于比较在存储设备中的输出数据和存储的参考数据,并且在可选的具体实施方式中,其适合用于将输出数据与其自身比较,在此比较模块生成报告数据,并连接至(c)显示模块,其用于向用户的客户端计算机显示重新取回内容的页面(即比较模块生成的报告数据),其中重新取回内容可以显示Robo2的水平,和/或受治疗者在将来经历慢性肾脏疾病或蛋白尿的可能性。
在一些具体实施方式中,确定模块具有计算机可执行指令,以提供表达数据、序列信息、与计算机可读形式信息有关的信息。如在此所用的“序列信息”是指任何核苷酸和/或氨基酸序列,包括但不限于,全长核苷酸和/或氨基酸序列,部分核苷酸和/或氨基酸序列,或突变序列。另外,与序列信息“相关的”信息包括存在或不存在的序列的检测(例如突变或缺失的检测),样本中序列浓度的确定(如氨基酸序列表达水平,或核苷酸(RNA或DNA)表达水平),等等。术语“序列信息”意在包括存在或不存在的翻译后修饰(例如磷酸化作用,糖基化作用,仿真化(summylation),法尼基化,等等)。
例如,用于确定ROBO2序列或核酸表达信息的确定模块包括自动序列分析的已知系统,包括但不限于,日立和日立 II荧光扫描仪(购买于日立遗传系统公司,阿拉米达,加利福尼亚州)(available from Hitachi Genetic Systems,Alameda,California); SCE 9610全自动96-毛细管电泳遗传分析系统(购买于SpectruMedix LLC,州立学院,宾夕法尼亚州)(available from SpectruMedix LLC,State College,Pennsylvania);ABI377DNA测序仪,ABI373DNA测序仪,ABI310遗传分析仪,ABI3100遗传分析仪以及ABI3700DNA分析仪(购买于美国应用生物系统公司,福斯特城,加利福尼亚州)(available from Applied Biosystems,Foster City,California);分子动力学FluorImagerTM575,SI荧光扫描仪,和分子动力学FluorImagerTM595荧光扫描仪(购于英国安玛西亚生物科学有限公司,白金汉郡,英格兰)(available from Amersham Biosciences UK Limited,Little Chalfont,Buckinghamshire,England);GenomyxSCTMDNA测序仪(购于Genomyx公司(福斯特城,加利福尼亚州));以及Pharmacia ALFTM DNA测序仪和Pharmacia ALFexpressTM(购于英国安玛西亚生物科学有限公司,小都,白金汉郡,英格兰)(available from Amersham Biosciences UK Limited,Little Chalfont,Buckinghamshire,England)。
在用于确定序列或蛋白质信息的一些具体实施方式中,确定模块包括用于蛋白质和DNA分析的系统。例如,质谱系统,包括基质辅助光解电离-飞行时间(MALDI-TOF)系统;SELDI-TOF-MS蛋白芯片阵列分析系统,例如具有赛弗吉蛋白生物系统IITM(CIPHERGEN PROTEIN BIOLOGY SYSTEM IITM)软件的机器;分析基因表达数据的系统(参见例如US2003/019711);基于数组的表达分析,例如HT数组系统和墨盒阵列系统,购于美国昂飞公司(圣克拉拉,加拿大95051)(see for example U.S.2003/0194711);systems for array based expression analysis,for example HT array systems and cartridge array systems available from Affymetrix(Santa Clara,CA 95051),自动装卸机,COMPLETE 仪表系统,孵育装置450,杂交箱645,QC工具箱软件工具包,扫描仪3000 7G,扫描仪3000 7G靶向基因分型系统,扫描仪3000 7G全基因组关联系统,GENETITANTM仪器,组合测站,HT数组;自动化ELISA系统(例如Dynax的或form,尚蒂伊,维吉尼亚,或ENEASYSTEMTHE Plus);光密度计(例如X-Rite-508-SpectroThe HYRYSTM2光密度计);自动化荧光原位杂交系统(参见例如美国专利6,136,540);耦合2-D成像软件的2D凝胶成像系统;微量盘式光谱仪,荧光激活细胞分选器(FACS)(例如流式细胞仪FACS Vantage SE,美国BD公司);放射性同位素分析仪(如闪烁计数器),或上述组合。
在本发明的该方面或所有其它方面的一些具体实施方式中,各种软件程序和格式可用于储存存储设备中的生物标志物蛋白水平信息。任何数量的数据处理器的结构化格式(如文本文件或数据库)可用于获取或创建具有记录在其上的序列信息或表达水平信息的媒介。
确定模块上确定的ROBO2表达信息或与ROBO2表达信息相关的信息可被存储设备读取。如在此使用的“存储设备”意在包括任何计算或处理设备或其它配置并适合用于存储数据或信息的装置。适合用于本发明的电子设备的示例包括单机计算设置;数据通信网络,包括局域网(LAN),广域网(WAN),云存储系统,因特网,内联网和外联网;以及局部或分布式计算机处理系统。存储设备还包括但不限于,磁存储介质,例如软盘、硬盘存储介质,磁带,光存储介质如CD-ROM、DVD,电子存储介质如RAM、ROM、EPROM、EEPROM等等,云存储系统,一般硬盘和这些种类如磁/光存储介质的混合。存储设备适合于或配置其用于记录其上的序列信息或表达水平信息。这些以数字形式提供的信息可被电子地传输和读取,例如通过因特网,通过云系统,在磁盘上通过USB(通用串行总线)或通过其它合适的通信方式。
如在此使用的“表达水平信息”是指任何核苷酸和/或氨基酸表达水平信息,包括但不限于,全长核苷酸和/或氨基酸序列,部分核苷酸和/或氨基酸序列,或突变序列。另外,与序列信息“相关的”信息包括存在或不存在序列的检测(例如存在或不存在的氨基酸序列、核苷酸序列或翻译后修饰),样本中序列浓度的确定(如氨基酸序列水平,或核苷酸(RNA或DNA)表达水平,或翻译后修饰水平),以及等等。
如在此使用的“存储”是指在存储设备上编码信息的过程。本领域技术人员可以容易想到采用任何本领域已知的方法在已知媒介上编码信息,以产生包含序列信息或表达水平信息的制成品。
各种软件程序和格式可用于存储存储设备中的序列信息或表达水平信息。任何数量的数据处理器的结构化格式(如文本文件或数据库)可用于获取或创建具有记录在其上的序列信息或表达水平信息的媒介。
通过提供计算机可读形式的序列信息或表达水平信息,人们可以在比较模块中使用计算机可读形式的序列信息或表达水平信息,以在存储设备中将特异序列或表达谱与参考数据进行比较。例如,搜索程序可用于识别序列的片段或区域,该序列与特定序列(参考数据,例如从对照样本中获得的序列信息)匹配,或将测得的表达水平的直接对比与参考数据表达水平(例如从对照样本中获得的表达水平信息)对比。以计算机可读形式进行的对比提供了计算机可读对比结果,该结果可由多种方法进行处理。基于对比结果的内容可以从比较模块重新取回,用以指示特定疾病或病症,如慢性肾脏疾病或蛋白尿。
在一些具体实施方式中,存储在存储设备中、由比较模块读取的参考数据是从与待测生物样本类型相同的对照生物样本获得的ROBO2序列或表达信息数据。可选地,参考数据是数据库,例如生物体全基因组序列的部分,或蛋白质家族的序列,或表达水平谱(RNA,蛋白质或肽)。在一些具体实施方式中,参考数据是序列信息或表达水平谱,其指示特定疾病或病症,如慢性肾脏疾病或蛋白尿。
在一些具体实施方式中,参考数据被电子地或数字地记录,并从数据库中标明,包括但不限于,基因库(NCBI)蛋白质或DNA数据库如基因组,ESTs,SNPS,Traces,Celara,Ventor Reads,Watson reads,HGTS等等;生物信息学数据库瑞士研究所(Swiss Institute of Bioinformatics databases),例如ENZYME,PROSITE,SWISS-2DPAGE,Swiss-Prot和TrEMBL数据库;梅兰妮软件包或ExPASy WWW服务器等等;SWISS-MODEL,Swiss-Shop和其它基于网络的计算工具;综合微生物资源数据库(购于基因组研究学院)(available from The Institute of Genomic Research)。由此产生的信息可存储在相关数据库中,用于确定其中蛋白质或基因的参考数据与基因组间的同源性。
通过在比较模块提供可读形式的ROBO2水平,其可用于比较在存储设备中的ROBO2参考阈值水平。以计算机可读形式进行的对比提供计算机可读内容,其可由多种方法处理。
“比较模块”可使用多种可用的软件程序和格式的比较操作,以比较确定模块确定的ROBO2序列或表达水平信息与参考ROBO2序列或表达水平数据。在一些具体实施方式中,配置比较模块用于采用模式识别技术,以比较一个或多个记录的ROBO2序列或表达水平数据与一个或多个参考数据模式。比较模块可使用现有市售的或者可免费获得的对比模式软件进行配置,并可以为所进行的比较特定数据进行优化。比较模块提供与序列信息相关的计算机可读信息,包括例如,存在或不存在序列的检测(突变或缺失(蛋白质或DNA)的检测,关于不同等位基因的信息,翻译后修饰检测,或序列的遗漏或重复);样本中序列浓度的确定(如氨基酸序列/蛋白质表达水平,或核苷酸(RNA或DNA)表达水平,或翻译后修饰水平),或表达谱确定。
在一些具体实施方式中,比较模块对确定模块输出数据的ROBO2水平与每一个ROBO2参考阈值水平间进行对比。
在一些具体实施方式中,比较模块进行质谱对比,例如肽片段序列信息的对比可通过采用具有脚本称为“Qpeaks”(参见例如WO2007/022248,本发明引用作为参考)或“Qpeaks”(光谱联营公司,伊萨卡岛,纽约)或CiphergenPeaks 2.1TM软件的MATLAB处理的光谱进行。处理后的光谱随后使用比对算法比对,比对算法利用最小熵法,通过取基线校正数据,将样本数据与对照数据进行比对(参见例如WIPO公开专利WO2007/022248,本发明引用作为参考)。对比结果可由计算比率进一步处理。可以看出蛋白质表达谱。
任何可利用的对比软件均可使用,包括但不限于,赛弗吉表达(Ciphergen Express)(CE)和生物标志模型软件(BPS)包,赛弗吉生物系统公司,美国(Ciphergen Biosystems,Inc.,CA,USA)。对比分析可以用蛋白质芯片系统软件(例如Bio-Rad实验室的蛋白质芯片套件)完成。
比较模块,或其它在此所述的模块,可包括操作系统(例如UNIX),其上运行相关的数据库管理系统,万维网应用程序,以及万维网服务器。万维网应用程序包括数据库语言语句产生所需的可执行代码(例如结构化查询语言(SQL)语句)。通常,可执行文件包括嵌入式SQL语句。另外,万维网应用程序包括配置文件,配置文件含有组成服务器以及各种内部和外部数据库的各种软件实体的指针和地址,各种内部和外部数据库是对服务用户请求可访问。配置文件还指示请求服务器资源到相应的硬件-如是必要的,服务器可被分布在两个或多个独立的计算机。在一些具体实施方式中,万维网服务器支持TCP/IP协议。这种局域网有时被称为“企业内部网”。这种局域网的优势是它们允许与驻留在万维网(例如基因数据库或瑞士专业万维网站点)(e.g.,the GenBank or Swiss Pro World Wide Web site)上的公共领域数据库进行简单交流。因此,在一些优选的具体实施方式中,用户可通过采用Web浏览器和网络服务器提供的HTML界面,直接访问驻留在网络数据库上的数据。
在一些具体实施方式中,比较模块对基因表达谱进行比较。例如,基因表达谱的确定可使用美国昂飞公司的微阵列套件软件5.0版(MAS 5.0)(购于美国昂飞公司,圣克拉拉,加利福尼亚)(available from Affymetrix,Santa Clara,California)检测,基于来自探针组的信号强度分析基因或基因组的相对丰度,并且MAS 5.0数据文件可转移至数据库,并用Microsoft Excel和GeneSpring 6.0软件(购于安捷伦科技公司,圣克拉拉,加利福尼亚)(available from Agilent Technologies,Santa Clara,California)分析。MAS 5.0软件的检测算法可用于获得给定样本中多少个转录本被检测到的全面概述,并且可进行两个或多个微阵列数据集的比较分析。
在一些具体实施方式中,比较模块对蛋白质表达谱进行比较。任何可利用的对比软件均可使用,包括但不限于,赛弗吉表达(Ciphergen Express)(CE)和生物标志模型软件(BPS)包(购于赛弗吉生物系统公司,美国(available from Ciphergen Biosystems,Inc.,Freemont,California))。对比分析可以用蛋白质芯片系统软件(例如蛋白质芯片套件(购于Bio-Rad实验室,大力神,加利福尼亚州))(e.g.,The Proteinchip Suite(available from Bio-Rad Laboratories,Hercules,California)完成。识别表达谱的算法可包括使用优化算法,如均方差算法(例如JMP基因组学算法,购于JMP软件,北卡罗来纳州)(e.g.JMP Genomics algorithm available from JMP Software Cary,North Carolina)。
比较模块提供计算机可读的比对结果,其可通过预定义的标准或用户定义的标准以计算机可读形式进行处理,以提供部分基于比较结果的内容,比较结果可以利用显示模块根据用户请求进行存储和输出。显示模块能够为用户提供给基于对比结果的内容的显示部分,其中,所述内容为慢性肾脏疾病或蛋白尿的指示性信号。这些信号,例如可以是电脑显示器上指示存在或不存在慢性肾脏疾病或蛋白尿的内容的显示,打印机中指示存在或不存在慢性肾脏疾病或蛋白尿的内容的打印页面,或存在或不存在慢性肾脏疾病或蛋白尿的光的或声音的指示。
基于对比结果的内容可包括一种或多种蛋白质的表达谱,或一种或多种基因的表达谱。在一些具体实施方式中,基于对比结果的内容仅仅是存在或不存在基于ROBO2蛋白水平的慢性肾脏疾病或蛋白尿的指示性信号。
在一些具体实施方式中,基于对比结果的内容显示在电脑显示器上。在本发明的一个具体实施方式中,基于对比结果的内容通过打印媒介显示。在本发明的一个具体实施方式中,基于对比结果的内容作为指示灯或指示声音进行显示。显示模块可为任何合适装置,配置其以接受来自计算机并向用户显示计算机可读信息。非限制性示例包括,例如,通用计算机如那些基于因特尔奔腾处理器,苹果电脑和平板设备,摩托罗拉PowerPC,SunUltraSPARC,惠普PA-RISC处理器,多种购于加利福尼亚州森尼维尔市超微半导体公司(AMD)的处理器中的任何一种,或其它类型的处理器,视频显示设备如平板设备,智能手机移动设备,平板显示器,阴极射线管等等,以及各种类型的电脑打印机。
在一些具体实施方式中,万维网浏览器用于向用户提供基于对比结果的内容的显示界面。应当理解的是,本发明的其它模块可以适于具有Web浏览器的界面。通过Web浏览器,用户可以构造来自比较模块中重新取回数据的请求。因此,该用户通常会指向和点击用户界面元素,如图形用户界面常规使用的按钮,下拉菜单,滚动条之类。用户Web浏览器制定的请求传输至网络应用程序,其将请求格式化以生成用于提取与序列信息相关的相关信息的查询,例如指示存在或不存在突变或缺失(DNA或蛋白质)的显示;氨基酸序列(蛋白质)表达水平的显示;核苷酸(RNA或DNA)表达水平的显示;表达、SNP或突变谱或单倍型的显示,或基于上述的信息的显示。在一个具体实施方式中,参考样本数据的序列信息也可以显示。
在一些具体实施方式中,显示模块显示比较结果和比较结果是否指示疾病,例如ROBO2表达谱是否指示慢性肾脏疾病或蛋白尿。
在一些具体实施方式中,基于显示的比较结果的内容是指示存在或不存在慢性肾脏疾病或蛋白尿的信号(如正或负信号),因此只显示正或负指示。
因此,在此提供的系统(和计算机可读媒介而产生的计算机系统),其是基于表达谱或序列信息,用以确定个体是否具有慢性肾脏疾病或蛋白尿或具有患慢性肾脏疾病或蛋白尿倾向的分析方法和方法。
系统和计算机可读媒介仅是本发明示例性的具体实施方式,其是基于表达谱或序列信息,用以确定个体是否具有特定疾病或失调,或具有患特定疾病或失调倾向的分析方法和方法,并不限制本发明的保护范围。系统和计算机可读媒介的变型是可能的,并落入本发明的保护范围。
系统的模块或用于计算机可读媒介的模块可以设想多种配置。例如,功能的提供可以是一台机器,或分布于多台机器。
Robo2是定位于小鼠足细胞基底细胞表面的足细胞蛋白
肾脏发育过程中,Robo2mRNA表达于围绕分叉输尿管芽的后肾间质,随后表达于S形主体的近端(Piper等,2000)(Piper et al.,2000),原始足细胞位置。为了研究Robo2是否参与足细胞的成熟,除了其在早期肾感应中的作用,我们进行了原位杂交,并发现Robo2mRNA表达于胚胎第16.5天(E16.5)的小鼠胚胎肾小球发育中的毛细血管袢阶段(图5A和图5B)。通过E14.5左右对发育中肾小球进行免疫荧光染色使Robo2蛋白成为可检测到的,在E16.5达到峰值表达(图5C-5E)。虽然表达在发育期的E17.5后降低(图5F),特异性的Robo2表达一直保持到出生后的肾小球,并在5周龄的成年小鼠可检测到(图5G、5H、5L-5M)。
为了确定Robo2在发育的肾小球中的细胞定位,我们用肾小球细胞类型特异性标志物进行了双标记免疫组织化学。我们发现Robo2蛋白与Nephrin(图1A-1C)和podocin(图1D-1F)共定位,两种足细胞缝隔膜相关的蛋白质。Robo2与Nephrin相互作用的衔接蛋白共表达于肾小球中,Nck和WT1是足细胞细胞核的组成成分(图5H-5K)。采用抗巢蛋白(nidogen)(图1J-1L和1P)和Pecam1(图1M-1O,5M)的抗体进行双标记显示Robo2定位于靠近肾小球基底膜外表面,不存在内皮细胞,其中巢蛋白(nidogen)是一种基底膜标志物,Pecam1是一种内皮细胞标志物。高分辨率共焦显微镜进一步显示在足细胞基底面具有最丰富的亚细胞的Robo2(图1Q)。具有胞浆结合域抗体的出生后小鼠肾脏的免疫胶体金电镜显示,Robo2定位于接近狭缝隔膜胞质面的足细胞足突(图1R)。这些结果显示,Robo2为足细胞蛋白,且其在足突中的基底亚细胞定位表面,其在调节足细胞足突结构中发挥作用。
Robo2胞内域与衔接蛋白Nck的SH3域的直接相互作用
Nephrin胞外域的衔接导致其通过Src激酶对其胞内域的酪氨酸磷酸化,和衔接蛋白Nck的SH2域的引入,这反过来又引起肌动蛋白聚合(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006)。Nck在C-端具有一个SH2域,在邻近N-端具有三个SH3域。肌动蛋白通过Nck的SH3结合域进行介导的(Rivera等,2004)(Rivera et al.,2004),这可以引入含有N-WASP和Pak的各种细胞骨架调节剂(Jones等,2006)(Jones et al.,2006)。先前的研究表明,果蝇同族体Dreadlock的Nck的SH3域也可与Robo胞内域直接相互作用,以抑制肌动蛋白的聚合(Fan等,2003;Yang和Bashaw,2006)(Fan et al.,2003;Yang and Bashaw,2006)。
我们测试哺乳动物Nck是否也可以与足细胞中的Robo2直接相互作用以调节F-肌动蛋白细胞骨架。为了回答这个问题,我们采用酵母双杂交分析以检测Robo2是否与Nck相互作用。由于两种哺乳动物Ncks(即Nck1,Nck2)在肾脏发育中具有相同的结构和功能(Jones等,2006)(Jones et al.,2006),在此时研究中我们使用Nck1,观察到Robo2胞内域可与Nck1直接相互作用(图2A-2C)。Robo2和Nck1的结合位点图表明,含有4个富含脯氨酸基序的氨基酸序列1085-1301,对相互作用是至关重要的(图2A和2C)。这种富含脯氨酸基序的缺失阻止其与Nck的相互作用(图2A)。Robo2和Nck1的结合位点图表明,前两个SH3域在其与Robo2的相互作用中是必需的,因为删除它们中的一个或两个都会使相互作用消失(图2B)。因此,Robo2与Nck1的相互作用可通过两个非常有特点的蛋白结构域SH3域和富含脯氨酸的基序介导的图2C)。CD2AP,另一种足细胞衔接蛋白,也在其N-端具有三个SH3域(Shih等,2001)(Shih et al.,2001),但我们没有检测到CD2AP与Robo2在酵母双杂交或共沉淀分析中有任何相互作用。这些观察结果表明,足细胞中Robo2和Nck1之间的结合是特异性的相互作用。
全长Robo2通过Nck与Nephrin形成复合物
我们通过体外结合捕获试验(pull down)和共沉淀分析确认了Robo2与Nck之间的相互作用。将His-和myc-标记的人类全长Robo2(His-myc-Robo2)或his-和myc-标记的Nck1结合域缺失的人类Robo2(His-myc-Robo2-ΔNBD)在HEK细胞中表达。转染的HEK细胞在Slit2条件培养液培养液(从Slit2稳定转染的细胞制备的)刺激,以激活Robo2并增加Nck结合(Fan等,2003)(Fan et al.,2003)。利用Ni-NTA磁珠,将Nck与His-myc-Robo2从HEK细胞裂解物拉出,而不是与His-myc-Robo2-ΔNBD(图2D)。因为Nck的SH2域与Nephrin细胞质区(NCD)中的磷酸络氨酸相互作用(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006),我们利用共沉淀分析检查Robo2是否通过Nck与Nephrin形成复合物。为了建立原理性的证明,我们利用Fyn激酶将Robo2与Nephrin在HEK细胞中共表达,以增加Nephrin磷酸化。当Fyn被表达时,利用Ni-NTA磁珠从HEK细胞裂解物中拉出与Nck和Nephrin共沉淀的His-myc-Robo2(图2E)。以相反的顺序,当Fyn被表达时,拉出与Nck和Robo2共沉淀的His-myc-nephrin(图2F)。此外,当Fyn被过表达时,用抗Nck抗体制备的沉淀物含有Robo2和Nephrin两者(图6A)。这些数据表明Nephrin、Nck和Robo2在体外形成复合物。为了在体内证实这些发现,我们从新生小鼠肾脏溶解物免疫沉淀Robo2,并且发现Nck与Nephrin是共沉淀的(图2G)。相反地,用抗Nephrin抗体制备的沉淀物也含有Nck和Robo2(图2H)。由于Nephrin独特地表达在足细胞中,Nck和Robo2也定位在肾脏的这些细胞中,这些结果表明,Nephrin、Nck和Robo2能够在足细胞中形成复合物。
为了确定Slit2在Robo2-Nck-Nephrin蛋白复合物形成中的作用,将His-myc-Robo2、Nephrin和Fyn在HEK细胞中共表达,其中HEK细胞在共沉淀前通过Slit2条件培养液或不含Slit2的对照条件培养液刺激(图2I)。我们观察到,Slit2的刺激增加了Robo2与Nck的结合及与Nephrin复合物的形成。Nck1对Robo2的比值以及Nephrin对Robo2的比值均在Slit2刺激后增加(图2J)。与该发现一致的是,我们观察到Slit2在新生小鼠肾小球中强烈表达(图6B、6C)。
Slit2-Robo2信号抑制Nephrin诱导的肌动蛋白聚合
由于Slit与Robo结合引入Dock和srGAPs,从而抑制肌动蛋白聚合(Fan等,2003)(Fan et al.,2003),我们希望测试哺乳动物细胞中Robo2是否也能引入Nck以抑制肌动蛋白聚合,与Nephrin促进肌动蛋白聚合的作用相反。为了说明这个问题,如前所述,我们通过分析表达CD16/7-NCD嵌合蛋白的细胞中的肌动蛋白尾巴研究了肌动蛋白聚合(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006)。该模型利用与Nephrin细胞质区(NCD)融合的人类免疫球蛋白Fc受体CD16和CD17的细胞外结构域和跨膜结构域。CD16/7-HA,其中的NCD用HA标签蛋白替代,用作负控制。这些嵌合蛋白在HEK细胞中与Robo2共表达,用抗-CD16抗体和与若丹明结合的第二抗体处理后成簇。我们首先检查Nephrin细胞质结构域的成簇是否可以引入Robo2。我们观察到,CD16/7-NCD的参与将Robo2带入该簇中,因为大多数Robo2与CD16/7-NCD簇共定位(图6D-6F)。然而,没有观察到Robo2与CD16/7-HA对照(图6D’)或与Robo2-ΔNBD构建体(图6E’)的共定位,其中Robo2Nck结合域(NBD)被删除。有趣的是,在没有Slit2情况下,CD16/7-NCD和Robo2的共定位显著减少(图6F’)。这些数据提供了进一步的证据证明,Nephrin细胞质结构域是能够在Slit2存在下与Robo2胞内域复合的,并验证该模型以确认Robo2-Nck-Nephrin复合物的形成是否影响肌动蛋白聚合。
表达CD16/7-NCD和Robo2的HEK细胞用Slit2或不含Slit2的条件培养液刺激,而通过抗CD-16抗体成簇。肌动蛋白聚合通过定量具有可见F-肌动蛋白尾巴的HEK细胞数量来评价(Rivera等,2004)(Rivera et al.,2004)。我们观察到,~80%的CD16/7-NCD簇细胞形成F-肌动蛋白尾巴,如先前报道,其可以通过鬼笔环肽染色显现(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006)。然而,由于Slit2刺激,具有F-肌动蛋白尾巴的细胞数目显著减少至约40%(图3A和3C)。当对照CD16/7-HA蛋白聚合时,观察到只有少量细胞含有较短F-肌动蛋白尾巴(图3B和3C)。为了进一步研究肌动蛋白聚合的这种抑制是否需要Nck,我们采用没有Nck结合域的Robo2(Robo2-ΔNBD)重复该试验,以确定封闭结合至Robo2的Nck是否可以阻止Slit2-Robo2对Nephrin诱导的肌动蛋白聚合的抑制。CD16/7-NCD与全长Robo2(图7A)或Robo2-ΔNBD(图7B)在HEK细胞中共表达。我们观察到,Robo2中Nck结合域的删除显著折中了Slit2-Robo2对Nephrin诱导的肌动蛋白聚合的抑制(图7C)。
前期研究已经表明,Nephrin连接至F-肌动蛋白细胞骨架(Yuan等,2002)(Yuan et al.,2002)。为了确定Slit2-Robo2信号是否能抑制与Nephrin相关的F-肌动蛋白,我们采用抗CD-16抗体对CD16/7-NCD和CD16/7-HA进行免疫沉淀反应,并用蛋白质印迹法检查沉淀物中F-肌动蛋白的数量。我们观察到,当Slit2刺激时,与Nephrin相关的F-肌动蛋白的丰度显著降低(图3D和3E)。相反地,体内免疫沉淀反应分析显示,与野生型或Robo2杂合小鼠肾脏获得的F-肌动蛋白相比,通过从无Robo2新生小鼠肾脏取得的抗-Nephrin抗体进行免疫沉淀的Nephrin相关F-肌动蛋白显著增加(图3F和3G)。综合起来,这些结果表明,Slit2-Robo2信号抑制Nephrin诱导的肌动蛋白聚合。
足细胞中Robo2的缺失引起小鼠足突结构改变
我们和其他人以前已经证实几乎所有混合遗传背景的Robo2纯合缺失小鼠在出生不久后死亡,归因于严重的CAKUT表型(Grieshammer等,2004;Lu等,2007;Wang等,2011)(Grieshammer et al.,2004;Lu et al.,2007;Wanget al.,2011)。用Robo2del5突变等位基因饲养小鼠五代至具有C57BL/6遗传背景后,与Robo2del5/+杂合父母交配可产生三个存活3周的Robo2del5/del5纯合缺失小鼠(在断奶分析总的160小鼠中)。为了确定发育过程中足细胞足突形成中对Robo2是否必需,我们检查了刚出生和3周龄Robo2缺失小鼠的肾小球超微结构。虽然足细胞本体、足突和Slit-隔膜在出生时形成,但透射电子显微镜显示,新生Robo2del5/del5纯合缺失小鼠中局灶性足突消失(图8A-8F)。使用扫描电镜,我们观察到刚出生和3周龄Robo2del5/del5纯合缺失小鼠中的不规则趾状突足突(图4A-4H)。这些发现表明,Robo2中肾脏发育过程中对正常足细胞足突图案是必需。
为了检测成熟肾小球中Robo2在足突结构保持中的作用,通过杂交具有Robo2del5/+的条件Robo2flox/flox小鼠和携带膜蛋白-Cre(podocin-Cre)转基因的TgNphs2-Cre/+杂合小鼠,我们产生足细胞特异性Robo2敲除小鼠。具有Robo2del5/flox、TgNphs2-Cre/+的20只足细胞特异性Robo2突变小鼠与20只同窝出生对照小鼠被分析至1岁龄。足细胞特异性Robo2敲除小鼠是可存活的并是可育的。然而,在一个月时,它们异乎寻常地表现出宽的足细胞足突和局灶节段性足突消失(图4I-4M)。6周龄时,突变小鼠形成显著的微白蛋白尿,由ELISA和蛋白质印迹分析法检测(图4N和图4O)。另外,扫描电镜显示,在Robo2足细胞特异性敲除小鼠中出现足突图案缺陷。与野生型有序拉链状趾状突的二次足突不同,Robo2足细胞特异性敲除小鼠在一个月时显示不规则和紊乱的足突趾状突图案(图8G-8J)。随时间推移,这些缺陷越来越明显。在7个月龄时,Robo2足细胞特异性敲除小鼠中明显观察到紊乱的、较短的和曲折的足突(图8K-8N),这与3周龄Robo2缺失小鼠的表型相似。虽然Robo2足细胞特异性敲除小鼠显示了正常的足细胞数量,但肾小球中基质沉积显著增加(图8O-8T,表1和表2)。这些形态变化表明,Robo2在调节和维持肾小球足细胞足突结构中的作用。
Robo2的缺失减轻Nephrin缺失小鼠中足细胞结构缺陷
Nephrin纯合小鼠形成特有的表型,其具有扩张肾小囊腔的异常宽的足突,肾小球slit-隔膜缺失,和显著蛋白尿(Done等,2008;Hamano等,2002)(Done et al.,2008;Hamano et al.,2002)。由于Robo2与Nephrin形成复合物,以及Slit2-Robo2信号抑制Nephrin诱导的肌动蛋白聚合,我们怀疑Robo2的缺失是否会修饰Nephrin缺失小鼠的足细胞表型。为了检验Robo2和Nephrin之间存在可能的基因相互作用这个假设,我们生成Robo2-/-种系;Nphs1-/-和足细胞特异性Robo2flox/flox,TgNphs2-Cre/+,Nphs1-/-双Robo2-Nephrin缺失小鼠。与Nphs1-/-单一纯合类似,Robo2-/-;Nphs1-/-(4/4;100%)以及Robo2flox/flox;TgNphs2-Cre/+;Nphs1-/-(3/3,100%)双敲除小鼠均在出生后10小时内死亡。然而,组织学分析揭示Robo2-/-;Nphs1-/-双纯合小鼠中肾小球的形态,与Nphs1-/-单一Nephrin纯合小鼠的表型相比,看起来相对正常,其具有扩大的肾小囊腔(图8U-8X)。具有扩大肾小囊腔的肾小球的数量,与Nephrin单一缺失小鼠(31/122,25.4%)相比,在Robo2-/-;Nphs1-/-双纯合小鼠(2/55,3.6%)中显著减少(图8Y和表3)。另外,扫描电镜显示的肾小球超微结构分析表明,与Robo2-/-单一纯合(图4T和4U)和野生型控制组(图4V和4W)的100%相比,只在来自Nephrin单一纯合小鼠的1/15(6.67%)的肾小球观察到趾状突足细胞足突结构(图4P和4Q)。显著地,足细胞足突的趾状突图案在Robo2-/-;Nphs1-/-双合新生小鼠肾脏的12/16(75%)的肾小球中恢复(图4R和4S,表4),表明Robo2和Nephrin同时缺失减轻这些小鼠中足细胞足突结构的表型。这些发现表明,当Robo2和Nephrin的表达水平被从遗传上改变时,上述的Robo2-Nck-Nephrin物理相互作用对体内足细胞足突形态具有巨大影响。
足细胞显示了相当大程度的适应性。在发育发过程中,它们区分简单立方上皮细胞进入到我们认为是成熟足细胞复杂的轴突细胞(Reeves等,1978)(Reeves et al.,1978)。该适应性被保留到成熟后。用硫酸鱼精蛋白进行表面电荷中和和用肝素恢复试验后(Seiler等,1975)(Seiler et al.,1975),以及在患有微小病变的蛋白尿儿童的复发期和缓解期(Nachman等,2008)(Nachman et al.,2008)内,它被认为是最生动的可逆足突消失。足突中更细微的变化可能会发生用以在生理条件下响应以血液动力学、激素或旁分泌刺激形式的正和负信号。考虑到足突中F-肌动蛋白的丰度,不希望受到理论的约束或限制,这些刺激引起那些细微变化以响应转换到F-肌动蛋白细胞骨架的正和负信号是有可能的。过多和不平衡的正信号可能导致疾病表型。事实上,虽然尚未确定生理性配体,很显然,Nephrin的成簇和磷酸化作用通过引入Nck诱导肌动蛋白聚合,机制是通过致肾炎单克隆抗体引入到Nephrin胞外域诱导大鼠的蛋白尿有关(Topham等,1999)(Topham et al.,1999),以及在肾移植后先天性肾病综合征情况下发展成抗Nephrin同种抗体的(Patrakka等,2002)(Patrakka et al.,2002)。
在此我们的研究显示了足细胞肌动蛋白聚合的负调控的另一个水平,其中,当Robo2与Slit结合时,Robo2抑制Nephrin诱导的肌动蛋白聚合。不希望被理论束缚或限制,我们认为Slit-Robo2信号可以抑制Nephrin诱导的肌动蛋白聚合,以维持如下正常的足细胞足突结构:在生理条件下(例如足突发育过程中),Nephrin参与引起细胞内的Y1191/1208/1232磷酸化,Nck的SH2结合域与其结合(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006)。Nck反过来引入如N-WASP的细胞骨架调节器中,通过其SH3域促进肌动蛋白聚合,以使足突扩展或延伸(图8Z)。局部分泌的Slit和结合的Slit通过其富含脯氨酸区域和Nck的前两个SH3域增加Robo2与Nck的相互作用。用Robo2分离Nck的前两个SH3域可抑制Nephrin-Nck介导的肌动蛋白聚合,并且降低与Nephrin相关的F-肌动蛋白以保持动态的和平衡的F-肌动蛋白细胞骨架和正常足细胞足突结构(图8Z)。除了通过Nck直接抑制Nephrin诱导肌动蛋白聚合外,Slit-Robo2信号可通过其它途径灭活肌动蛋白的聚合,例如,如前述报道,引入Ena、Abl、srGAPs以负向地调节F-肌动蛋白细胞骨架(Bashaw等,2000;Wong等,2001)(Bashaw et al.,2000;Wong et al.,2001)。在没有Slit-Robo2信号情况下(例如当Robo2被敲除时),Robo2对Nephrin诱导的聚合的抑制作用消失。Nck的SH3域能够与下游的细胞骨架调节剂相互作用,以增加肌动蛋白聚合(图8Z),这可解释在Robo2突变小鼠中确认的足细胞足突结构的改变。因此,在此我们的所述的结果支持这样一个机制:Slit-Robo2信号可通过负调节F-肌动蛋白细胞骨架而调节足细胞适应性,这与Slit-Robo2信号在轴突生长锥寻路(axon growth cone pathfinding)中的作用相似(Guan和Rao,2003)(Guan and Rao,2003)。在Robo2突变小鼠肾小球中增加基质沉积的病理发现极有可能显示了再次应答。
虽然从在此描述的我们的研究中,清楚的得出Robo2定位于足细胞的基底面,并通过其胞内域与其它既定的足突Slit-隔膜蛋白质形成复合物,但其本身实际上是否形成部分的Slit-隔膜仍是不确定的。有趣的是,Robo2的胞外域与Nephrin相似,其具有8种类免疫球蛋白(Ig)基序和1个纤连蛋白域,而Robo2具有5个类Ig基序和3个纤连蛋白域(图8Z)(Tryggvason等,2006)(Tryggvason et al.,2006)。我们在酵母双杂交试验中检测到Robo2胞内域和Nephrin细胞质域之间的相互作用。我们得到的生物化学数据(图2E和2F)也不支持体外这两个受体的直接相互作用。然而,这是可能的,Robo2胞外域可在相邻足突细胞膜上通过Slit-隔膜中的反式相互作用与体内Nephrin胞外域关联。
我们发现Robo2纯合缺失和足细胞特异性敲除小鼠形成改变的足突趾状突图案,表型不同于Nephrin缺失小鼠的表型(Hamano等,2002;Done等,2008)(Hamano et al.,2002;Done,2008)。这并不奇怪,因为Nephrin和Robo2在调节足细胞F-肌动蛋白细胞骨架中的作用相反。在Nephrin信号诱导局部肌动蛋白的聚合时,而Slit-Robo2信号作为肌动蛋白聚合的负调节剂,以维持足细胞足突的适应性和动态。值得注意的是,在小鼠中观察到类似的足突组织缺陷,这些小鼠缺少肌动蛋白解聚因子Cofilin-1,足细胞中另一种F-肌动蛋白细胞骨架负调节剂(Garg等,2010)(Garg et al.,2010)。这表明,肌动蛋白聚合促进因子如Nephrin信号或抑制因子如Robo2信号两个中任何一个的缺失都会影响足细胞的正常结构。因此,足细胞中正和负F-肌动蛋白细胞骨架调节剂间的平衡对维持正常足突结构是重要的。通过同时敲除正(Nephrin)和负(Robo2)信号获得这种平衡可以解释在Robo2-Nephrin双缺失小鼠中足细胞足突交错结合的恢复和更轻微的肾小球表型。在此描述的我们的研究证明Nephrin的双重作用,一方面,其作为Slit2-隔膜控制肾小球选择渗透性的主要组分(Tryggvason等,2006)(Tryggvason et al.,2006),另一方面,通过其与肌动蛋白细胞骨架的相互作用作为足突形态调节器(Jones等,2006;Verma等,2006)(Jones et al.,2006;Verma et al.,2006)。虽然Robo2信号可以明显抵制Nephrin对足突的正信号影响,但仍然要确定其是否也影响slit-隔膜的完整性。
因此,如在此所述,我们已经确认Robo2作为一种肾脏中足细胞的细胞间结合的新组分。我们采用生物化学、泛函和基因技术已经证明Robo2和Nephrin间的相互作用,并表明Slit-Robo2信号抑制Nephrin诱导的肌动蛋白动态。我们的结果表明Robo2信号作为Nephrin的负调节剂用以调节足细胞足突结构。该结果延伸了我们对Slit-Robo信号作用的理解,并确定一种新型的串扰机制,通过这种机制,导向暗示受体Robo可能会影响F-肌动蛋白细胞骨架的动态。
除非在此另有定义,使用的与本申请相关的科学术语和技术术语具有的含义是这些公开内容所述技术领域的本领域普通技术人员通常理解的含义。应当理解的是,发明并不局限于在此描述的具体方法、方案和试剂等等,并且这些可以变化。在此采用的术语的目的仅是为了描述具体实施方式,而不是为了限制本发明的范围,本发明的范围只由权利要求书限定。免疫学和分子生物学中普通术语的定义可在下列文献中找到:默克研究实验室2006年出版的《默克诊疗手册(第18版)》(ISBN 0-911910-18-2)(The Merck Manual of Diagnosis and Therapy,18th Edition,published by Merck Research Laboratories,2006(ISBN 0-911910-18-2));Robert S.Porter等(编写)、布莱克韦尔科学有限公司1994年出版的《分子生物学百科全书》(ISBN 0-632-02182-9)(Robert S.Porter et al.(eds.),The Encyclopedia of Molecular Biology,published by Blackwell Science Ltd.,1994(ISBN0-632-02182-9));和Robert A.Meyers(编写)、VCH出版公司1995年出版的《分子生物学与生物技术:综合性案头参考》(ISBN 1-56081-569-8)(Robert A.Meyers(ed.),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,published by VCH Publishers,Inc.,1995(ISBN 1-56081-569-8));爱思唯尔2006年出版、Werner Luttmann编著的《免疫学》(Immunology by Werner Luttmann,published by Elsevier,2006)。分子生物学中普通术语的定义可在下列文献中找到:Benjamin Lewin,琼斯&巴特利特出版社2007年出版的《基因IX》(ISBN-13:9780763740634)(Benjamin Lewin,Genes IX,published by Jones&Bartlett Publishing,2007(ISBN-13:9780763740634));Kendrew等(编写),布莱克韦尔科学有限公司1994年出版的《分子生物学百科全书》(ISBN 0-632-02182-9)(Kendrew et al.(eds.),The Encyclopedia of Molecular Biology,published by Blackwell Science Ltd.,1994(ISBN 0-632-02182-9));和Robert A.Meyers(编写),马尼亚蒂斯等,《分子克隆:实验指南》,冷泉港实验室出版社,冷泉港,纽约,美国(1982)(Robert A.Meyers(ed.),Maniatis et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,USA(1982));Sambrook等,《分子克隆:实验指南(2版)》,冷泉港实验室出版社,冷泉港,纽约,美国(1989)(Sambrook et al.,Molecular Cloning:A Laboratory Manual(2ed.),Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,USA(1989));Davis等,《分子生物学的基本方法》,爱思唯尔科学出版公司,纽约,美国(1986)(Davis et al.,Basic Methods in Molecular Biology,Elsevier Science Publishing,Inc.,New York,USA(1986));或《酶学方法:分子克隆技术指南》第152卷,S.L.Berger和A.R.Kimmerl编写,学术出版公司,圣地亚哥,美国(1987)(Methods in Enzymology:Guide to Molecular Cloning Techniques Vol.152,S.L.Berger and A.R.Kimmerl Eds.,Academic Press Inc.,San Diego,USA(1987));《现代分子生物学实验技术(CPMB)》(佛Fred M.Ausubel等主编,John Wiley和Sons出版公司)(Current Protocols in Molecular Biology(CPMB)(Fred M.Ausubel,et al.ed.,John Wiley and Sons,Inc.)),《现代蛋白科学实验技术(CPPS)》(John E.Coligan等主编,John Wiley和Sons出版公司)(Current Protocols in Protein Science(CPPS)(John E.Coligan,et.al.,ed.,John Wiley and Sons,Inc.)),和《现代免疫学实验技术(CPI)》((John E.Coligan等主编,John Wiley和Sons出版公司)(Current Protocols in Immunology(CPI)(John E.Coligan,et.al.,ed.John Wiley and Sons,Inc.)),在此通过整体引用将其全部并入本文。
在此使用的术语“包含(comprising)”是指除了存在的定义的组分外,也可存在的其它组分。使用“包括”表明包含而不限于。
在此使用的术语“基本包含……”是指给定具体实施方式所需要的那些组分。该术语允许附加元素存在,这些附加组分对本发明具体实施方式的基本的和新的或功能性的特征不会产生实质性影响。
在此使用的术语“由……组成(consisting of)”是指在此描述的组合物、方法及其各自组分,其中不包括未记载在说明书具体实施方式中的任何组分。
另外,除非上下文另有要求,单数术语可包括复数,复数术语可包括单数。如在说明书和所附权利要求书中使用的单数形式“一(a)”、“一(an)”和“该(the)”,除非上下文明确规定,否则均包括复数形式。因此,例如,“该方法”是包括一种或多种方法,和/或在此所述的该类型的多个步骤和/或在阅读公开内容等后对本领域技术人员是显而易见的方法。
除了操作实施例中的或某处另有说明外,在此使用的表达材料成分的量或使用的反应条件的所有数字,在任何情况下应当理解为被术语“约”修饰。当术语“约”与百分比结合使用时,术语“约”可以指±1%。
应当理解的是,本发明并不局限于本发明描述的具体方法、方案和试剂等等,并因此可以变化。在此采用的术语仅是为了描述具体实施方式,不是为了限制本发明的范围,本发明的范围只由权利要求书限定。
出于描述和公开的目的,在此通过引用明确并入了所有专利和经鉴定的其它出版物,例如,这些出版物中描述的方法可以与本发明结合使用。这些出版物被单独提供,因为它们在本申请的申请日之前公开。在这方面,没有什么可解释为对发明人无权凭借在先发明或任何其它原因而先于这些公开的承认。关于日期的所有声明或关于这些文件内容的陈述是基于申请人可获得的信息,不构成关于日期和这些文件内容正确性的任何承认。
在此所述不同方面的具体实施方式可由以下编号的段落说明:
2.一种治疗有需要受治疗者慢性肾脏疾病的方法,该方法包括将治疗有效量的含有ROBO2抑制剂的组合物给予患有或具有患慢性肾脏疾病风险的受治疗者。
3.一种降低有需要受治疗者蛋白尿的方法,该方法包括将治疗有效量的含有ROBO2抑制剂的组合物给予患有或具有患蛋白尿风险的受治疗者。
4.根据段1或2任一项的方法,其中,ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,特异性于ROBO2反义分子,特异性于ROBO2小干扰RNA(siRNA),ROBO2的小分子抑制剂,ROBO2抑制性多肽,或ROBO2结构类似物。
5.根据段1-3任一项的方法,其中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或两者的结合。
6.根据段1-4任一项的方法,其中,ROBO2抑制剂是特异性的Ig1SLIT结合域,Ig1和Ig2SLIT结合域,Nck胞内结合域,或上述任意组合。
7.根据段3的方法,其中ROBO2抑制性多肽是ROBO2显性失活融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
8.根据段1-6任一项的方法,其中,患有或具有患慢性肾脏疾病的受治疗者患有糖尿病肾病和高血压。
9.根据段1-7任一项的方法,该方法进一步包括将额外的治疗剂给予受治疗者。
10.根据段8的方法,其中,所述额外的治疗剂为血管紧张素转化酶(ACE)抑制剂或血管紧张素II受体拮抗剂(ARB)。
11.一种方法,包括:
a.分析受治疗者的生物测试样本以确定ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平;
b.确定生物测试样本中ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平是否高于参考阈值水平(reference threshold level);以及
c.对需要处理或治疗的慢性肾脏疾病的受治疗者进行诊断。
12.根据段10的方法,其中,ROBO2多肽的表达水平的分析采用ROBO2多肽抗体或其抗原结合段进行。
13.根据段10的方法,其中,编码ROBO2多肽的RNA的表达水平的分析采用PCR或杂交分析进行。
14.根据段10-12任一项的方法,其中,生物测试样本为肾脏活组织切片、尿、血液、血清样本或尿样颗粒化细胞。
15.根据段10-13任一项的方法,其中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高20%。
16.根据段10-13任一项的方法,其中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高两个标准差。
17.一种分析方法,包括:
a.将从受治疗者分离的生物测试样本与检测ROBO2多肽或编码ROBO2多肽的RNA的试剂接触;以及
b.测量ROBO2多肽的水平或编码ROBO2多肽的RNA的水平;
其中,相对于正常生物样本,所述ROBO2多肽或所述编码ROBO2多肽的RNA的水平增强的,鉴定受治疗者患有慢性肾脏疾病和/或处于慢性肾脏疾病或蛋白尿的进程中。
18.根据段16的分析方法,其中,检测ROBO2多肽的表达水平采用特异性于ROBO2多肽的抗体或其抗原结合段进行。
19.根据段16的分析方法,其中检测编码为ROBO2多肽的RNA的表达水平采用PCR或杂交分析进行。
20.根据段16-18任一项的分析方法,其中,生物测试样本为肾脏活组织切片、尿、血液、血清样本或来自于尿样颗粒化细胞。
21.根据段16-19任一项的分析方法,其中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少比参考阈值水平高20%。
22.根据段16-19任一项的分析方法,其中,ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平至少高于考阈值水平的两个标准差。
23.根据段16-21任一项的分析方法,其中,受治疗者被诊断为患有糖尿病或高血压。
24.一种确定受治疗者是否具有患上慢性肾脏疾病或蛋白尿的风险,或确定受治疗者是否患有慢性肾脏疾病的系统,该系统包括:
a.确定模块,其配置用以确定受治疗者生物样本中ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平;
b.比较模块,其配置用以接收通过确定模块确定的所述ROBO2多肽的表达水平或编码ROBO2多肽的RNA的表达水平,并进行至少一次分析以确ROBO2多肽的表达水平或编码为ROBO2多肽的RNA的表达水平是否大于预先确定的参考水平,进而提供重新取回内容;以及
c.显示模块,其用于显示基于来自所述比较模块输出数据的内容,其中,该内容包括ROBO2多肽或RNA的表达水平或比率大于预先确定的参考水平或比率的指示性信号,或ROBO2的水平或表达比率不大于参考水平或预先确定的比率的指示性信号。
25.根据段23的系统,其中,显示在显示模块上的内容进一步包括推荐受治疗者接收的具体的治疗方案的指示性信号。
26.一种确定受治疗者是否具有患上慢性肾脏疾病或蛋白尿的风险,或确定受治疗者是否患有慢性肾脏疾病的系统,该系统包括:
a.确定模块,其配置用以接收来自受治疗者的至少一个测试样本,并对至少一个测试样本进行至少一次分析以确定以下情况中的一种情况的存在或不存在:
i.ROBO2的表达比率大于预先确定比率,或
ii.ROBO2的表达水平高于预先确定水平;
b.存储设备,其设置用以储存所述确定模块输出的数据;以及
c.显示模块,用于显示基于来自所述确定模块输出数据的内容,其中,该内容包括ROBO2的表达比率大于预先确定比率或ROBO2的水平大于预先确定水平的指示信号,或ROBO2的表达比率不大于预先确定比率或不大于预先确定水平的指示性信号。
27.根据段25的系统,其中,显示在显示模块上的内容进一步包括推荐受治疗者接收的具体的治疗方案的指示性信号。
28.一种治疗具有患上慢性肾脏疾病或蛋白尿风险的人类受治疗者的方法,该方法包括给予处理或治疗以预防人类受治疗者慢性肾脏疾病或蛋白尿的发生,这些人类受治疗者被确定为ROBO2蛋白水平高于参考阈值水平。
29.根据段27的方法,其中,ROBO2蛋白的水平至少比参考水平高20%。
30.根据段27的方法,其中,ROBO2蛋白的水平至少比参考水平高两个标准差。
31.根据段27-29任一项的方法,其中,用于预防慢性肾脏疾病或蛋白尿发生的处理或治疗包括ROBO2抑制剂。
32.根据段30的方法,其中ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,特异性于ROBO2的反义分子,特异性于ROBO2的小干扰RNA(siRNA),ROBO2小分子抑制剂,ROBO2抑制性多肽,或ROBO2结构类似物。
33.根据段30-31任一项的方法,其中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或两者的结合。
34.根据段30-32任一项的方法,其中,ROBO2抑制剂是特异性于Ig1SLIT结合域,Ig1和Ig2SLIT结合域,Nck胞内结合域,或上述任意组合。
35.根据段31的方法,其中,ROBO2抑制性多肽是显性失活ROBO2融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
36.ROBO2抑制剂在治疗慢性肾脏疾病中的应用。
37.ROBO2抑制剂在治疗蛋白尿中的应用。
38.根据段35或36任一项的应用,其中,ROBO2抑制剂是特异性于ROBO2的封闭抗体或其抗原结合段,ROBO2的反义分子,ROBO2的小干扰RNA(siRNA),ROBO2小分子抑制剂,ROBO2抑制性多肽,或ROBO2结构类似物。
39.根据段35-37任一项的应用,其中,ROBO2抑制剂封闭或降低ROBO2与SLIT、Nck、或这两者的结合。
40.根据段35-38任一项的应用,其中,ROBO2抑制剂是特异性的Ig1SLIT结合域,Ig 1和Ig2SLIT结合域,Nck胞内结合域,或上述任意组合。
41.根据段37的应用,其中,ROBO2抑制性多肽是显性失活ROBO2融合蛋白,含有ROBO2胞外域不含胞内域的多肽,或含有ROBO2胞内域不含胞外域的多肽。
42.根据段35-40任一项的应用,其中,慢性肾脏疾病和蛋白尿由糖尿病肾病或高血压引起。
本发明由以下实施例进一步说明,这些实施例不应该解释对本发明的限制。
实施例
组织的原位杂交,免疫组织化学和免疫胶体金电镜
如前所述,用地高辛标记的Robo2核糖核酸探针(riboprobes)完成原位杂交分析(Grieshammer等,2004)(Grieshammer et al.,2004)。免疫组织化学法在固定在4%多聚甲醛的小鼠胚胎肾组织上和在固定在甲醇中的成年小鼠肾组织中进行的。为了进行免疫胶体金电镜,野生型小鼠肾脏被解剖并固定于多聚甲醛-赖氨酸-高碘酸盐(PLP)中。制备小鼠肾脏超薄切片,并用山羊抗-Robo2抗体(DAKO公司)并结合10nm胶体金的第二抗体进行培养(Ted Pella)。
酵母的双杂交,共沉淀和肌动蛋白聚合分析
根据制造商的说明书,用DUPLEX-ATM酵母双杂交系统(OriGene Tech)来表征Robo2和Nck1的相互作用。细胞的培养,His-标记蛋白的共沉淀,以及免疫共沉淀是依据前述报道进行(Fan等,2003)(Fan et al.,2003)。利用新生肾脏进行内源性免疫沉淀反应。CD16抗体介导CD16/7融合蛋白的交联与肌动蛋白聚合分析师根据前述进行的(Jones等,2006;Rivera等,2004;Verma等2006)(Jones et al.,2006;Rivera et al.,2004;Verma et al.,2006)。
缺失小鼠研究,透射电镜和扫描电镜以及肾脏肾小球分析
小鼠方案获得在波士顿大学医学中心(#14388)的实验动物管理委员会(IACUC)的批准。Robo2flox条件等位基因、Robo2del5(在本文中也可交换地称为Robo2-)生殖细胞系突变等位基因和Robo2+野生型等位基因的产生和基因分型在前面已经描述(Lu等,2007;Wang等,2011)(Lu et al.,2007;Wang et al.,2011)。为了产生Robo2-Nephrin双敲除小鼠,以前使用Robo2+/-小鼠与Nphs1+/-小鼠杂交(Hamano等,2002)(Hamano et al.,2002)。为了进行透射电镜分析,肾脏被固定并在含有2%戊二醛的0.15M二甲砷酸钠中培养,乙醇梯度脱水,嵌入环氧树脂(Epon)中,切片,并用醋酸铀酰和柠檬酸铅染色。用JEM-1011电镜检测超薄肾脏切片。为了进行扫描电镜分析,用下述标准方案准备肾脏。为了进行肾脏病理研究,肾脏固定在4%多聚甲醛中,嵌入石蜡中,切片,并用标准的希夫氏高碘酸(PAS)或苏木精伊红(H&E)方法染色。为了量化足细胞数量,WT1被用作足细胞的核标记物,根据标准方法对肾切片进行免疫过氧化物酶染色。对每个肾小球截面中的WT1阳性足细胞核进行计数。为了分析蛋白尿,采用鼠科动物尿蛋白ELISA定量试剂盒(Exocell)根据制造商的指导对从6周龄小鼠取得的“现货的”尿液样本进行检查,并用尿液试纸(Multistix,拜耳,IN)作为筛选方法。
组织的原位杂交和免疫组织化学法
如前所述,用地高辛标记的Robo2核糖核酸探针完成原位杂交分析(Grieshammer等,2004)(Grieshammer et al.,2004)。Robo2cDNA用NotI线性化,并使用DIG DNA标记和检测试剂盒(罗氏应用科学部)(Roche Applied Science)生成探针。杂交在由4%多聚甲醛固定的OCT嵌入的小鼠胚胎肾脏冰冻切片上进行。免疫组织化学法在经过4%多聚甲醛固定后用30%蔗糖抗冻剂处理的小鼠胚胎肾脏组织,以及在甲醇中固定的成年小鼠肾脏组织上进行(Mugford等,2008)(Mugford et al.,2008)。OCT化合物嵌入的小鼠肾脏被冻结,并在低温恒温器切成8-10微米切片。切片用第一抗体和随后用适当的FITC或Cy3共轭第二抗体染色。用于该研究的第一抗体包括抗Robo2抗体(研发体系,Abnova,圣克鲁兹生物技术公司)(R&D System,Abnova,Santa Cruz Biotechnology),Nephrin(定制合成)(Topham等,1999)(Topham et al.,1999),Nck(北部/密理博)(Upstate/Millipore),podocin(西格玛)(Sigma),nidogen(圣克鲁兹生物技术公司)(Santa Cruz Biotechnology),Pecam1(BD生物科学)(BD Biosciences),WT1(圣克鲁兹生物技术公司),SLIT2(圣克鲁兹生物技术公司),PDGFR beta(细胞信号)(Cell Signaling),突触极蛋白(圣克鲁兹生物技术公司)。用Perkin Elmer公司UltraView LCI多点旋转光盘激光扫描共聚焦显微镜和具有60倍油浸物镜的Zeiss LSM 510共聚焦激光扫描显微镜获得图像。
免疫胶体金电镜
切开野生型小鼠肾脏,并固定在多聚甲醛-赖氨酸-高碘酸盐(PLP)中4℃条件下过夜。该组织在1x PBS中洗涤,梯度乙醇脱水并嵌入LR白树脂中(电子显微镜科学)。准备小鼠肾脏超薄切片并转移至聚醋酸甲基乙烯酯包覆的金格中,在1x PBS中用1%牛血清白蛋白和5%正常山羊血清封闭。然后将切片用山羊抗Robo2抗体1:50稀释液在DAKO(DAKO公司)4℃条件下过夜培养。未免疫的血清用作对照。用1x PBS清洗3次后,切片用连接有10nm胶体金(Ted Pella)的IgG第二抗体在室温下培养2小时。最后,将切片用1%戊二醛后固定,与乙酸铀酰对比。用JEM-1011透射电镜(JEOL,东京,日本)在80kV下检查切片,用AMT数字成像系统(先进显微镜技术,丹弗斯,马萨诸塞州)(Advanced Microscopy Techniques,Danvers,MA.)获得图像,并输入Adobe Photoshop。与用未免疫血清染色的对照显微图相比,用金色颗粒染色的Robo2在肾小球中的亚细胞定位显示在数字电子显微图中。
酵母的双杂交分析
用DUPLEX-ATM酵母双杂交系统(OriGene Tech,罗克维尔市,马里兰州)表征Robo2和Nck1的相互作用。编码人类Robo2胞内域的cDNA及其截短形式被克隆至EcoRI/XhoI位点的pJG4-5载体中,将它们融合到B42的转录激活域。人类Nck1的cDNA及其截短形式被克隆至EcoRI/XhoI的pEG202载体,以将它们融合到LexA蛋白的DNA结合域中。构建体pSH18-34的lacZ基因和EGY48菌株酵母基因组中的LEU2基因被用作报告基因。pEG202、pSH18-34和pJG4-5构建体被共转化至酵母EGY48细胞中。如果酵母细胞在X-gal存在下变成蓝色并在缺乏亮氨酸时生长,该相互作用被认为是阳性的。
细胞培养,DNA构建体,转染,共沉淀以及分子印迹分析
使用磷酸钙转染HEK(239T)细胞为60%汇合(confluency)转染。为了得到C-端his-和myc-标记的的融合蛋白,全长的人类Nephrin和Robo2被分别克隆到HindIII/ECORI和EcoR1/Xho1限制性位点的pSecTag载体(英杰公司)(Invitrogen)。根据制造商的说明,使用QuikChange位点定向诱变试剂盒(Strategene)删除Nck结合域(图2C)从而获得Robo2-ΔNBD。非标记的Robo2和Nck1被克隆到EcoR1/Xho1位点的PCS2载体(Addgene),HindIII/EcoR1位点的Nephrin。先前已经报道人类Fyn-和myc-标记的Slit2构建体(Li等,2008;Wong等,2001)(Li et al.,2008;Wong et al.,2001)。先前也已有报道CD16/7-NCD和CD16/7-HA构建体(Verma等,2006)(Verma et al.,2006)。为了检测Robo2和Nck1的相互作用,将C-端His-和myc-标记的人Robo2或Robo2-ΔNBD在HEK细胞表达。转染后48小时,将细胞裂解在裂解缓冲液中(50mM NaH2PO4,300mMNaCl,10mM咪唑,0.5%TX100,1x蛋白酶抑制剂[pH8.0])。细胞裂解物在4℃下离心10分钟;上清液用Ni-NTA树脂(Qiagen)在4℃下培养2小时以沉淀His-Robo2,用无Ni的NTA树脂作对照。用洗涤缓冲液(50mM NaH2PO4,300mM NaCl,20mM的咪唑,0.5%TX100[pH8.0])洗涤该树脂三次,并加热至95℃保持10分钟。将沉淀物溶解在SDS-PAGE凝胶上,并用1:1000稀释的兔抗myc、兔单克隆抗Nck1(Cell Signaling公司)的抗体印迹。为了检查Robo2,Nck1和Nephrin三者的相互作用,将his-myc-Robo2或His-myc-Robo2-ΔNBD与人类Nephrin和人类Fyn共表达于HEK细胞。如上所述,用Ni-NTA微珠沉淀His-myc-Robo2。为了确认该三者相互作用,His-myc-Nephrin与Robo2和Fyn在HEK细胞中共表达,His-myc-Nephrin被Ni-NTA微珠拉出。沉淀物用1:1000稀释的兔多克隆抗-myc、兔单克隆抗-Nck1,兔多克隆抗-Nephrin,小鼠单克隆抗-Robo2(R&D Systems公司)和兔多克隆抗-Fyn(圣克鲁兹生物技术公司)(Santa Cruz Biotechnology)抗体进行印迹。对于内源性蛋白质的免疫共沉淀,新生小鼠肾脏均质在冰上的RIPA缓冲液中(50mM的Tris[pH 7.4],150mM NaCl,0.1%SDS,1%NP-40,0.5%脱氧胆酸钠,1mM Na3VO4,1mM NaF,1x蛋白酶抑制剂)。将样本在4℃下离心10分钟,并将上清液与1μg小鼠单克隆抗-Robo2抗体(R&D Systems公司)在4℃下培养1小时。空白山羊IgG(圣克鲁兹生物技术公司)(Santa Cruz Biotechnology)作为对照。然后将样本与30μl蛋白A/G Plus琼脂糖微珠浆液(圣克鲁兹生物技术公司)(Santa Cruz Biotechnology)混合,并进一步在4℃下培养12小时。然后将微珠在RIPA缓冲液中洗涤三次,通过加热至95℃保持10分钟,将蛋白质洗脱在1x蛋白载样缓冲液中。将沉淀物溶解在SDS-PAGE凝胶上,如上所述,并用小鼠抗-Robo2,兔抗-Nephrin和兔抗-Nck1抗体进行印迹。肌动蛋白用Sigma的抗-β-肌动蛋白小鼠抗体进行印迹。条带的强度使用ImageJ进行测量。为了蛋白尿的检测,收集小鼠现尿,并以1:100的稀释比例用1x蛋白载样缓冲液稀释。然后,将尿蛋白溶解在SDS-PAGE凝胶上,纯化白蛋白用作对照(MP Biomedicals公司)。凝胶用兔抗白蛋白多克隆抗体(MP Biomedicals公司)进行印迹。
CD16/7-NCD交联和肌动蛋白聚合分析
先前已经描述过CD16抗体介导的CD16/7融合蛋白的交联(Jones等,2006;Rivera等,2004;Verma等2006)(Jones et al.,2006;Rivera et al.,2004;Verma et al.,2006)。简单地说,CD16/7-NCD或CD16/7-HA与Robo2在HEK细胞中共表达。24小时后,将细胞转移并接种在涂有聚赖氨酸的玻璃盖玻片上过24小时。然后将细胞用1μg/ml的小鼠单克隆抗-CD16(Beckman Coulter公司)在37℃下培养30分钟,用DMEM洗涤一次,在稀释在Slit2条件培养液(Wong等,2001)或空白条件培养液中与罗丹明共轭的第二抗体(Thermo Scientific)培养30分钟,并用4%多聚甲醛的1xPBS固定。根据制造商的说明,用FITCF-偶联的鬼笔环肽(Invitrogen)染色肌动蛋白。新形成的F-肌动蛋白束粘在成簇的Nephrin(CD16/7-NCD)上,在荧光显微镜下看起来像彗星尾巴(即正文中的肌动蛋白尾巴)。在这个实验中,我们只分析了通过CD16/7-NCD簇而形成的并附着在该簇的F-肌动蛋白束。计数具有F-肌动蛋白尾巴的细胞,并与总CD16/7-NCD转染细胞进行比较。量化公式为:百分比(%)=(具有F-肌动蛋白尾巴的转染细胞数量/总转染细胞数)×100。采用具有60倍油浸物镜的LSM510共聚焦显微镜获得图像。
Robo2足细胞特异性敲除小鼠以及Robo2-Nephrin双敲除小鼠的产生和表征
先前已经描述过Robo2flox条件等位基因,Robo2del5(在本文中也可互换地称为Robo2-)生殖细胞系的突变等位基因和Robo2+野生型等位基因的产生和基因分型(Lu等,2007;Wang等,2011)(Lu et al.,2007;Wang et al.,2011)。根据标准育种方案产生Robo2足细胞特异性Robo2del5/FLOX;TgNphs2-Cre/+敲除小鼠,其携带一个Robo2del5等位基因和一个Robo2flox等位基因。在这种化合物突变体中,由podocin启动子驱动的足细胞特异性Cre重组酶仅删除Robo2flox等位基因,以促进表型的外显,因为其它等位基因,Robo2del5,已从生殖细胞系的表达中全部删除。Robo2del5/FLOX;TgNphs2-Cre/+小鼠的真实性通过存在Robo2del5和Robo2flox等位基因以及TgNphs2-Cre转基因的尾部DNA的基因分型确定。以不具有Robo2del5等位基因和TgNphs2-Cre转基因的F2同窝出生Robo2flox/+小鼠作为对照。为了得到Robo2-nephrin的双敲除小鼠,将先前已经产生Robo2+/-杂合小鼠与Nphs1+/-的杂合小鼠杂交(Hamano等,2002)(Hamano et al.,2002)。在Robo2+/-;Nphs1+/-双杂合小鼠产生后,进行双杂合小鼠的杂交以产生Robo2-/-;Nphs1-/-双纯合小鼠以及Nphs1-/-单纯合,Robo2-/-单纯合,和Robo2+/+;Nphs1+/+野生型对照。小鼠方案获得在波士顿大学医学中心(#14388)的实验动物管理委员会(IACUC)的批准。
透射电镜和扫描电镜
为了进行透射电镜分析,切开Robo2纯合缺失小鼠和足细胞特异性敲除小鼠的肾脏,固定在多聚甲醛-赖氨酸-高碘酸盐(PLP)中在4℃条件下过夜,并在含有2%戊二醛的0.15M二甲砷酸钠中培养6小时。在1x PBS中洗涤后,对固定的肾脏用梯度乙醇进行脱水,嵌入Epon中,切片,并用醋酸铀酰和柠檬酸铅染色。制备得到超薄肾脏切片,并用JEM-1011电镜检查。野生型同窝出生小鼠用作对照。为了进行扫描电镜分析,根据以前(Friedman和Ellisman,1981)(Friedman and Ellisman,1981)描述的方法稍作修改后的方法,从Robo2纯合缺失小鼠,足细胞特异性敲除小鼠,Nephrin纯合缺失小鼠和Robo2-Nephrin双纯合小鼠制备肾脏样本。简单的说,肾脏用2.5%的戊二醛和2%多聚甲醛溶液在0.1M二甲砷酸盐缓冲液(Karnovsky固定剂,电子显微镜科学)(Karnovsky’s fixative,Electron Microscopy Sciences)中灌注,随后用Karnovsky固定剂固定24小时,然后在2%四氧化锇溶液中进行后固定(电子显微镜科学)。使用六甲基二硅氮烷对肾脏样本低温破碎、脱水和干燥(电子显微镜科学)。使用Amray 1000A和Jeol 6340F扫描电镜对肾脏样本成像。检查从每个动物取得的三个肾小球以提供有代表性的图像。
小鼠肾脏的病理学研究,足细胞数量的定量,以及蛋白尿分析
为了进行肾脏的病理学研究,将肾脏切开,并固定在4%多聚甲醛中过夜,然后用梯度乙醇处理后用嵌入石蜡。使用MT-920切片机(MICROM)将肾蜡块切成4μm切片,并使用标准的希夫氏高碘酸(PAS)或伊红苏木精(H&E)的方法进行染色。使用配备SPOT数码相机系统的Olympus BHT光学显微镜检查和评估肾小球基质沉积,节段性肾小球硬化,以及肾小囊腔的扩张。为了定量足细胞的数量,WT1被用作足细胞的核标记物,按照以前的方法(Sanden等,2003)(Sanden et al.,2003)对肾脏切片进行免疫过氧化物酶染色。简单来讲,将从4个1岁龄的Robo2del5/FLOX;TgNphs2-Cre+足细胞特异性敲除小鼠和4个年龄匹配的野生型对照小鼠取得的嵌入石蜡的肾脏切成4μm切片,并在微波抗原修复后用WT1抗体(圣克鲁兹生物技术公司)(Santa Cruz Biotechnology)染色。用生物素化的第二抗体和Vectastain ABC试剂盒(载体实验室)(Vector Laboratories)检测WT1信号。对来自于4个突变小鼠的共165个肾小球和4个对照组小鼠的166个肾小球中每个肾小球横截面的WT1阳性足细胞细胞核计数。为了进行蛋白尿分析,根据制造商的说明,使用灵敏的鼠蛋白尿ELISA定量试剂盒(Exocell)检查6周龄小鼠的“现货”尿标本,以尿液试纸(MULTISTIX,来自拜耳,IN)(Multistix from Bayer,IN)作为筛查方法。尿白蛋白用肌酸酐标准化,以提供白蛋白/肌酸酐比值。根据制造商的说明,使用肌酸酐检测试剂盒(Sigma公司)确定尿液中的肌酸酐。也采用12%SDS-PAGE检查尿白蛋白,并用抗白蛋白抗体印迹尿白蛋白(MP生物医学)。突变体和对照组的数据采用单因素ANOVA、Student氏t-检验和卡方检验进行分析。
表1在2-9月龄Robo2足细胞特异性敲除小鼠(突变体)中具有增加的基质扩张的肾小球的定量分析与对照组(野生型)对比
*p<0.01,n=5,t-检验。
表2在12月龄Robo2足细胞特异性敲除小鼠(突变体)中具有增加的基质扩张的肾小球的定量分析与对照组(野生型)对比
*p<0.01,n=5,t-检验。
表3通过组织学对中Nphs1-/-单纯合(Robo2+/-;Nphs1-/-)小鼠中具有扩张的肾小囊腔的肾小球进行形态分析与Robo2-/-;Nphs1-/-双纯合新生小鼠对比
注:如果观察到肾小球显示与图S4U显示相似的表型,则具有扩张的肾小囊腔的肾小球被记录为阳性,如果观察到如图8V-8X显示相似的肾小球则记录为阴性。分析各基因型的三只小鼠。Robo2-/-单纯合(Robo2-/-;Nphs1+/-)和野生型(Robo2+/+;Nphs1+/+)用作对照。
表4用扫描电镜对Nphs1-/-单纯合(Robo2+/-;Nphs1-/-)小鼠的肾小球足细胞趾状突足突(FP)表型进行形态分析与Robo2-/-;Nphs1-/-双纯合新生小鼠对比
参考文献
Bashaw,G.J.,Kidd,T.,Murray,D.,Pawson,T.,和Goodman,C.S.(2000),排斥轴突导向:Abelson和Enabled对下游的迂回受体发挥相反的作用。《细胞》第101期,第703-715页。
(Bashaw,G.J.,Kidd,T.,Murray,D.,Pawson,T.,and Goodman,C.S.(2000).Repulsive axon guidance:Abelson and Enabled play opposing roles downstream of the roundabout receptor.Cell 101,703-715.)
Dickson,B.J.,和Gilestro,G.F.(2006)。通过slit及其Robo受体对连合轴突寻路的调节。《细胞发育生物学年度回顾》,第22期,第651-675页。
(Dickson,B.J.,and Gilestro,G.F.(2006).Regulation of commissural axon pathfinding by slit and its Robo receptors.Annu Rev Cell Dev Biol 22,651-675.)
Done,S.C.,Takemoto,M.,He,L.,Sun,Y.,Hultenby,K.,Betsholtz,C.,和Tryggvason,K.(2008)。Nephrin参与足细胞成熟,但在肾小球发育过程中不能存活。《美国国际肾脏疾病杂志》,第73期,第697-704页。
(Done,S.C.,Takemoto,M.,He,L.,Sun,Y.,Hultenby,K.,Betsholtz,C.,and Tryggvason,K.(2008).Nephrin is involved in podocyte maturation but not survival during glomerular development.Kidney Int 73,697-704.)
Fan,X.,Labrador,J.P.,Hing,H.,和Bashaw,G.J.(2003)。Slit刺激将Dock和Pak引入交叉受体,并增加Rac的活性以调节中枢神经系统中线的轴突排斥。《神经元》,第40期,第113-127页。
(Fan,X.,Labrador,J.P.,Hing,H.,and Bashaw,G.J.(2003).Slit stimulation recruits Dock and Pak to the roundabout receptor and increases Rac activity to regulate axon repulsion at the CNS midline.Neuron 40,113-127.)
Faul,C.,Asanuma,K.,Yanagida-Asanuma,E.,Kim,K.,和Mundel,P.(2007)。肌动蛋白:通过肌动蛋白细胞骨架的组件调节足细胞结构和功能。《趋势细胞生物学杂志》,第17期,第428-437页。
(Faul,C.,Asanuma,K.,Yanagida-Asanuma,E.,Kim,K.,and Mundel,P.(2007).Actin up:regulation of podocyte structure and function by components of the actin cytoskeleton.Trends Cell Biol 17,428-437.)
Furness,P.N.,Hall,L.L.,Shaw,J.A.,和Pringle,J.H.(1999)。Nephrin的肾小球表达在获得性人类肾病综合征中降低。《透析肾移植杂志》,第14期,第1234-1237页。
(Furness,P.N.,Hall,L.L.,Shaw,J.A.,and Pringle,J.H.(1999).Glomerular expression of nephrin is decreased in acquired human nephrotic syndrome.Nephrol Dial Transplant 14,1234-1237.)
Garg,P.,Verma,R.,Cook,L.,Soofi,A.,Venkatareddy,M.,George,B.,Mizuno,K.,Gurniak,C.,Witke,W.,和Holzman,L.B.(2010)。肌动蛋白解聚因子丝切蛋白-1在维持成熟足细胞结构是必要的。《生物化学杂志》,第285期,第22676-22688页。
(Garg,P.,Verma,R.,Cook,L.,Soofi,A.,Venkatareddy,M.,George,B.,Mizuno,K.,Gurniak,C.,Witke,W.,and Holzman,L.B.(2010).Actin-depolymerizing factor cofilin-1is necessary in maintaining mature podocyte architecture.J Biol Chem 285,22676-22688.)
Grieshammer,U.,Le,M.,Plump,A.S.,Wang,F.,Tessier-Lavigne,M.,和Martin,G.R.(2004)。SLIT2介导的Robo2信号限制肾脏对单一位点的感应。《发育细胞》,第6期,第709-717页。
(Grieshammer,U.,Le,M.,Plump,A.S.,Wang,F.,Tessier-Lavigne,M.,and Martin,G.R.(2004).SLIT2-mediated Robo2signaling restricts kidney induction to a single site.Dev Cell 6,709-717.)
Guan,K.L.,和Rao,Y.(2003)。介导神经元的信号机制对导向因子的反应。《自然-神经性评论》,第4期,第941-956页。
(Guan,K.L.,and Rao,Y.(2003).Signalling mechanisms mediating neuronal responses to guidance cues.Nat Rev Neurosci 4,941-956.)
Hamano,Y.,Grunkemeyer,J.A.,Sudhakar,A.,Zeisberg,M.,Cosgrove,D.,Morello,R.,Lee,B.,Sugimoto,H.,和Kalluri,R.(2002)。肾脏肾小球中血管通透性的决定因素。《生物化学杂志》,第277期,第31154-31162页。
(Hamano,Y.,Grunkemeyer,J.A.,Sudhakar,A.,Zeisberg,M.,Cosgrove,D.,Morello,R.,Lee,B.,Sugimoto,H.,and Kalluri,R.(2002).Determinants of vascular permeability in the kidney glomerulus.J Biol Chem 277,31154-31162.)
Jones,N.,Blasutig,I.M.,Eremina,V.,Ruston,J.M.,Bladt,F.,Li,H.,Huang,H.,Larose,L.,Li,S.S.,Takano,T.,等,(2006)。Nck衔接蛋白连接Nephrin至肾脏足细胞的肌动蛋白细胞骨架。《自然杂志》,第440期,第818-823页。
(Jones,N.,Blasutig,I.M.,Eremina,V.,Ruston,J.M.,Bladt,F.,Li,H.,Huang,H.,Larose,L.,Li,S.S.,Takano,T.,et al.(2006).Nck adaptor proteins link nephrin to the actin cytoskeleton of kidney podocytes.Nature440,818-823.)
Lu,W.,van Eerde,A.M.,Fan,X.,Quintero-Rivera,F.,Kulkarni,S.,Ferguson,H.L.,Kim,H.,Fan,Y.,Xi,Q.,Li,Q.G,等,2007。Robo2的破坏与泌尿道异常有关,并具有膀胱输尿管反流的危险。《美国人类遗传学杂志》,第80期,第616-632页。
(Lu,W.,van Eerde,A.M.,Fan,X.,Quintero-Rivera,F.,Kulkarni,S.,Ferguson,H.L.,Kim,H.,Fan,Y.,Xi,Q.,Li,Q.G.,et al.(2007).Disruption of Robo2is associated with urinary tract anomalies and confers risk of vesicoureteral reflux.Am J Hum Genet 80,616-632.)
Nachman,P.H.,Jennette,J.C.,和Falk,R.J.(2008)。原发性肾小球疾病。《Brenner&Rector:肾脏疾病学》,B.M.Brenne r编,(费城,Saunders),第987-1066页。
(Nachman,P.H.,Jennette,J.C.,and Falk,R.J.(2008).Primary glomerular disease.In Brenner&Rector's The Kidney,B.M.Brenner,ed.(Pheladelphia,Saunders),pp.987-1066.)
Patrakka,J.,Ruotsalainen,V.,Reponen,P.,Qvist,E.,Laine,J.,Holmberg,C.,Tryggvason,K.,和Jalanko,H.(2002)。受治疗者肾移植中肾病综合征与芬兰型先天性肾病综合征的复发:Nephrin的作用。《移植杂志》,第73期,第394-403页。
(Patrakka,J.,Ruotsalainen,V.,Reponen,P.,Qvist,E.,Laine,J.,Holmberg,C.,Tryggvason,K.,and Jalanko,H.(2002).Recurrence of nephrotic syndrome in kidney grafts of patients with congenital nephrotic syndrome of the Finnish type:role of nephrin.Transplantation 73,394-403.)
Piper,M.,Anderson,R.,Dwivedy,A.,Weinl,C.,van Horck,F.,Leung,K.M.,Cogill,E.,和Holt,C.(2006)。以Slit2诱发的爪蟾视网膜生长视锥细胞的崩塌为基础的信号机制。《神经元》,第49期,第215-228页。
(Piper,M.,Anderson,R.,Dwivedy,A.,Weinl,C.,van Horck,F.,Leung,K.M.,Cogill,E.,and Holt,C.(2006).Signaling mechanisms underlying Slit2-induced collapse of Xenopus retinal growth cones.Neuron 49,215-228.)
Piper,M.,Georgas,K.,Yamada,T.,和Little,M.(2000)。脊椎动物Slit基因家族及其假定的受体,Robo基因,在小鼠肾脏发育过程中的表达。《衰老与发育机制》,第94期,第213-217页。
(Piper,M.,Georgas,K.,Yamada,T.,and Little,M.(2000).Expression of the vertebrate Slit gene family and their putative receptors,the Robo genes,in the developing murine kidney.Mech Dev 94,213-217.)
Reeves,W.,Caulfield,J.P.,和Farquhar,M.G.(1978)。在肾小球发育过程中,上皮足突和过滤狭缝的分化:连续出现闭合连接,上皮聚阴离子和狭缝膜。《实验室研究》,第39期,第90-100页。
(Reeves,W.,Caulfield,J.P.,and Farquhar,M.G.(1978).Differentiation of epithelial foot processes and filtration slits:sequential appearance of occluding junctions,epithelial polyanion,and slit membranes in developing glomeruli.Lab Invest 39,90-100.)
Rivera,G.M.,Briceno,C.A.,Takeshima,F.,Snapper,S.B.,和Mayer,B.J.(2004)。衔接蛋白Nck的膜靶向SH3结合域的诱导聚集引发局部肌动蛋白聚合。《当代生物学》,第14期,第11-22页。
(Rivera,G.M.,Briceno,C.A.,Takeshima,F.,Snapper,S.B.,and Mayer,B.J.(2004).Inducible clustering of membrane-targeted SH3domains of the adaptor protein Nck triggers localized actin polymerization.Curr Biol 14,11-22.)
Seiler,M.W.,Venkatachalam,M.A.,和Cotran,R.S.(1975)。肾小球上皮细胞:聚阳离子诱导的结构改变。《科学》,第189期,第390-393页。
(Seiler,M.W.,Venkatachalam,M.A.,and Cotran,R.S.(1975).Glomerular epithelium:structural alterations induced by polycations.Science189,390-393.)
Shih,N.Y.,Li,J.,Cotran,R.,Mundel,P.,Miner,J.H.,和Shaw,A.S.(2001)。CD2AP定位于slit隔膜并通过新的C-端结合域结合Nephrin。《美国人体病理学杂志》,第159期,第2303-2308页。
(Shih,N.Y.,Li,J.,Cotran,R.,Mundel,P.,Miner,J.H.,and Shaw,A.S.(2001).CD2AP localizes to the slit diaphragm and binds to nephrin via a novel C-terminal domain.Am J Pathol 159,2303-2308.)
Topham,P.S.,Kawachi,H.,Haydar,S.A.,Chugh,S.,Addona,T.A.,Charron,K.B.,Holzman,L.B.,Shia,M.,Shimizu,F.,和Salant,D.J.(1999)。致肾炎单克隆抗体5-1-6指向大鼠Nephrin的胞外域。《临床研究杂志》,第104期,第1559-1566页。
(Topham,P.S.,Kawachi,H.,Haydar,S.A.,Chugh,S.,Addona,T.A.,Charron,K.B.,Holzman,L.B.,Shia,M.,Shimizu,F.,and Salant,D.J.(1999).Nephritogenic mAb 5-1-6is directed at the extracellular domain of rat nephrin.J Clin Invest 104,1559-1566.)
Tryggvason,K.,Patrakka,J.,和Wartiovaara,J.(2006)。遗传性蛋白尿综合征和蛋白尿的机制,《新英格兰医学杂志》,第354期,第1387-1401页。
(Tryggvason,K.,Patrakka,J.,and Wartiovaara,J.(2006).Hereditary proteinuria syndromes and mechanisms of proteinuria.N Engl J Med 354,1387-1401.)
Verma,R.,Kovari,I.,Soofi,A.,Nihalani,D.,Patrie,K.,和Holzman,L.B.(2006)。Nephrin的结合引起Src蛋白激酶的活化,Nephrin磷酸化,Nck引入和肌动蛋白聚合。《临床研究杂志》,第116期,第1346-1359页。
(Verma,R.,Kovari,I.,Soofi,A.,Nihalani,D.,Patrie,K.,and Holzman,L.B.(2006).Nephrin ectodomain engagement results in Src kinase activation,nephrin phosphorylation,Nck recruitment,and actin polymerization.J Clin Invest 116,1346-1359.)
Wang,H.,Li,Q.,Liu,J.,Mendelsohn,C.,Salant,D.J.,和Lu,W.(2011)。小鼠胎儿肾积水无创评估揭示Robo2在保持抗反流机制的重要作用。《公共科学图书馆综合》,第6期,第24763条。
(Wang,H.,Li,Q.,Liu,J.,Mendelsohn,C.,Salant,D.J.,and Lu,W.(2011).Noninvasive assessment of antenatal hydronephrosis in mice reveals a critical role for Robo2in maintaining anti-reflux mechanism.PLoS One 6,e24763.)
Wong,K.,Ren,X.R.,Huang,Y.Z.,Xie,Y.,Liu,G.Saito,H.,Tang,H.,Wen,L.,Brady-Kalnay,S.M.,Mei,L.,等。神经元迁移的信号转导:Slit-Robo通路中GTP酶激活蛋白和小GTP酶Cdc42的作用。《细胞》,第107期,第209-221页。
(Wong,K.,Ren,X.R.,Huang,Y.Z.,Xie,Y.,Liu,G.,Saito,H.,Tang,H.,Wen,L.,Brady-Kalnay,S.M.,Mei,L.,et al.(2001).Signal transduction in neuronal migration:roles of GTPase activating proteins and the small GTPase Cdc42in the Slit-Robo pathway.Cell 107,209-221.)
Yuan,H.,Takeuchi,E.,和Salant,D.J.(2002)。足细胞slit-隔膜蛋白Nephrin与肌动蛋白细胞骨架连接。《美国泌尿学与肾脏疾病学期刊》,第282期,第585-591页。
(Yuan,H.,Takeuchi,E.,and Salant,D.J.(2002).Podocyte slit-diaphragm protein nephrin is linked to the actin cytoskeleton.Am J Physiol Renal Physiol 282,F585-591.)
Friedman,P.L.,和Ellisman,M.H.(1981)。扫描电镜中,使用冷冻断裂和锇-硫代对称二氨基脲-锇浸渍提高外周神经和感觉感受器可视化。《神经细胞学杂志》,第10期,第111-131页。
(Friedman,P.L.,and Ellisman,M.H.(1981).Enhanced visualization of peripheral nerve and sensory receptors in the scanning electron microscope using cryofracture and osmium-thiocarbohydrazide-osmium impregnation.J Neurocytol 10,111-131.)
Li,X.,Gao,X.,Liu,G.,Xiong,W.,Wu,J.,和Rao,Y.(2008)。有吸引力的信号中,Nephrin信号转导和鸟嘌呤核苷酸交换因子DOCK180。《自然神经科学》,第11期,第11,28-35页。
(Li,X.,Gao,X.,Liu,G.,Xiong,W.,Wu,J.,and Rao,Y.(2008).Netrin signal transduction and the guanine nucleotide exchange factor DOCK180in attractive signaling.Nat Neurosci 11,28-35.)
Mugford,J.W.,Sipila,P.,Kobayashi,A.,Behringer,R.R.,和McMahon,A.P.(2008)。Hoxd11指定小鼠胚胎中间中胚层内后肾发育的程序。《发育生物学》,第319期,第396-405页。
(Mugford,J.W.,Sipila,P.,Kobayashi,A.,Behringer,R.R.,and McMahon,A.P.(2008).Hoxd11specifies a program of metanephric kidney development within the intermediate mesoderm of the mouse embryo.Dev Biol 319,396-405.)
Sanden,S.K.,Wiggins,J.E.,Goyal,M.,Riggs,L.K.,和Wiggins,R.C.(2003)。以Wilms肿瘤-1蛋白作为足细胞的核标记物的大鼠肾脏中,用于估计足细胞数目,肾小球体积,肾小球体积每个足细胞的厚和薄切片方法的评价。《美国肾脏疾病学会杂志》,第14期,第2484-2493页。
(Sanden,S.K.,Wiggins,J.E.,Goyal,M.,Riggs,L.K.,and Wiggins,R.C.(2003).Evaluation of a thick and thin section method for estimation of podocyte number,glomerular volume,and glomerular volume per podocyte in rat kidney with Wilms'tumor-1protein used as a podocyte nuclear marker.J Am Soc Nephrol 14,2484-2493.)
- 还没有人留言评论。精彩留言会获得点赞!