诱导改善的免疫反应的疫苗的制作方法
【技术领域】
本发明涉及一种诱导改善的免疫反应的疫苗组合物。
背景技术:
最近,免疫佐剂备受瞩目,并以多种方式用作宫颈癌疫苗及流感疫苗等。此类免疫佐剂中细菌DNA从1960年代开始,作为抗癌剂受到瞩目,并直到现在,研究仍在继续,但由于功效不足,无法单独用作抗癌剂(Glick,J.L.The specificity of inhibition of tumor cell viability by DNA.CancerRes.27:2338,1967)。但众所周知的是,细菌DNA无任何大的副作用,能够对多种免疫细胞进行活性化,尤其,作为佐剂具有很多优点(McCluskie MJ,etal..CpG DNA is a potent enhancer of systemic and mucosal immune responses against hepatitis B surface antigen with intranasal administration to mice.JImmunol.Nov1;161(9):4463-6.1998)。
对细菌DNA的此类效果,日本的Yamamoto等主张包括CG的序列起到重要的作用,并通过美国Krieg等的研究广为流传(Yamamoto S.et al.Unique palindromic sequences in synthetic oligonucleotides are required to induce IFN and augment IFN-mediated natural killer activity.J.Immunol.148:4072,1992;Krieg AM,Antitumor applications of stimulating toll-like receptor 9with CpG oligodeoxynucleotides.Curr.Oncol.Rep.Mar;6(2):88-95.2004)。尤其在1990年代中期以后,通过CPG公司相关研究的结果,通过DNA抗癌剂确认了包含未甲基化的CG的合成DNA(CpG-ODN)的可能性,并研究了用于抑制合成DNA的分解的二酯键中的S置换等。通过此类努力,CpG-ODN相关产品不仅作为佐剂,还能作为抗癌剂进行临床试验(http://www.coleypharma.com)。
但是,对CpG-ODN的二酯键的S置换的免疫原性问题及仍旧不足的抗癌效果等依旧成为有待解决的问题。现在,临床上所使用的CPG7909是引发anti-DNA Ab的硫代磷酸寡核苷酸(Clin Immunol.2001Aug;100(2):157-63),而这与系统性红斑狼疮(SLE,systemic lupus erythematosus)等自我免疫疾病具有密切的关系(J Clin Immunol.1986July;6(4):292-8)。并且,众所周知,硫代磷酸结构起到TI Ag作用,混乱对感染的免疫防御功能(Mol Immunol.1998Dec;35(18):1161-70)。
从1950年代开始广为流传其抗癌效果的脂多糖(LPS)的情况下,仅仅由于ng水准的污染,也能引起基于败血症的死亡的毒性,而很难使用。尤其,一般的意见是,LPS和DNA的结合呈现严重的毒性,并且,在有关DNA的医药品中,LPS的清除被理解为非常重要的过程(Gao JJ.et.al,Bacterial DNA and lipopolysaccharide induce synergistic production of TNF-alpha through a post-transcriptional mechanism.JImmunol166(11):6855-60,2001)。在功效方面,基于LPS的免疫增加虽然比基于DNA的更加强大,但由于不是抗癌的重要的T桢1型,而是T桢2型,因此,认为并不适合用作抗癌剂(Lebman DA et al Interleukin 4causes isotype switching to IgE in T cell-stimulated clonal B cell cultures.J Exp Med.Sep 1;168(3):853-62.1988)。尤其,由于T桢2型的免疫活性抑制T桢1型的免疫活性,因此,LPS的此类特性更难使LPS用作抗癌剂(Rengarajan J et al.Transcriptional regulation of Th1/Th2polarization.Immunol Today.Oct;21(10):479-83.2000)。
对LPS的减毒试图不断地研究,尤其,能够在通过聚糖链的清除或脂质A的脱酰基化来减少毒性方向获得成功(Katz SS et al Deacylation of lipopolysaccharide in whole Escherichia coli during destruction by cellular and extracellular components of a rabbit peritoneal inflammatory exudate.J Biol Chem.Dec 17;274(51):36579-841999)。尤其,通过清除LPS聚糖链所获得的脂质A的磷酸化来获得的单磷酸脂质A(MPL,monophosphoryl lipid)的情况下,作为清除LPS的毒性的免疫抗癌剂来研发,但其效果微不足道(http://www.corixa.com)。
对此,本申请人已研发过一种补充上述多个免疫佐剂的缺点的新免疫佐剂(韩国专利授权第0740237号(2007.07.10))。
本说明书全文参照了多篇论文及专利文献,并表示了其引用。所引用的论文及专利文献的公开内容全部插入到本说明书中作为参照,从而更加明确地说明本发明所属技术领域的水准及本发明的内容。
技术实现要素:
【发明要解决的技术课题】
本发明者为了研发一种能够解决现有疫苗的问题,尤其,能够增强疫苗的功效的新疫苗组合物而付出了努力。其结果,本发明者在利用多种病原体的抗原的免疫化过程中,作为免疫佐剂将脱酰基化非毒性脂寡糖(LOS,Lipooligosaccharide)用作免疫佐剂的情况下,已确认能够诱导比现有的疫苗得到大大改善的免疫反应,成为用于预防多种疾病的优秀的疫苗,从而完成了本发明。
因此,本发明的目的在于,提供一种疫苗药剂学组合物。
本发明的另一目的在于,提供一种树突状细胞的成熟化诱导用组合物。
本发明的其他目的及优点通过下述的发明内容,权利要求书及附图将会变得更加明确。
【解决课题的技术方案】
根据本发明的一实施方式,本发明提供一种疫苗药剂学组合物。该疫苗药剂学组合物包含:
(a)病原体衍生抗原,其选自结核菌抗原、炭疽菌抗原、甲型肝炎病毒(HAV,Hepatitis A virus)的抗原、乙型肝炎病毒(HBV,Hepatitis B virus)的抗原、丙型肝炎病毒(HCV,Hepatitis C virus)的抗原、人类免疫缺陷病毒(HIV,human immunodeficiency virus)的抗原、流感病毒的抗原、单纯性疱疹病毒(HSV,Herpes simplex virus)的抗原、B型流感嗜血杆菌(Hib,Haemophilus influenzae type b)的抗原、脑膜炎奈瑟菌(Neisseria meningitidis)的抗原、白喉棒状杆菌(Corynebacterium diphtheria)的抗原、百日咳杆菌(Bordetella pertussis)的抗原、破伤风梭菌(Clostridium tetani)的抗原及水痘病毒(Varicella virus)的抗原组成的组中选择;
(b)脱酰基化非毒性脂寡糖(LOS,Lipooligosaccharide);及
(c)药剂学上接受的载体。
本发明者为了研发一种能够解决现有疫苗的问题,尤其,能够增强疫苗的功效的新疫苗组合物而付出了努力。其结果,本发明者在利用多种病原体的抗原的免疫化过程中,作为免疫佐剂将脱酰基化非毒性脂寡糖(LOS,Lipooligosaccharide)用作免疫佐剂的情况下,已确认能够诱导比现有的疫苗得到大大改善的免疫反应,能够成为用于预防多种疾病的优秀的疫苗。
本发明对引发结核的结核菌的疫苗有用。
本发明的结核疫苗中所利用的结核菌抗原包含以往公知的多种结核菌的衍生抗原,优选为选自65kD热休克蛋白(HSP65)、抗原85A(Ag85A)、抗原85B、抗原85C、ESAT-6、Des蛋白、MPT32、MPT51、MPT63、MPT64、HspX及磷酸盐结合蛋白1的组中的至少1种抗原。
更优选地,本发明的结核疫苗所利用的结核菌抗原是选自抗原85A(Ag85A)、ESAT-6、HspX及磷酸盐结合蛋白1(Phosphate binding protein 1)的组中的至少1种抗原。
并且,本发明对引发炭疽病的炭疽疫苗有用。
本发明的炭疽疫苗中所利用的炭疽菌抗原包含以往公知的多种炭疽菌的衍生抗原,优选为保护性抗原(PA,protective antigen)、致死抗原(LF,lethal antigen)或水肿抗原(EA,edema antigen),更优选为保护性抗原(PA,protective antigen)。
并且,本发明对引发A型肝炎的HAV疫苗有用。本发明的HAV疫苗中所利用的HAV抗原包含以往公知的多种HAV衍生抗原,优选为选自活减毒HAV、惰性减毒HAV、VP1、VP2、VP3、VP4、2A、2B、2C、3A、3B、3C及3D蛋白的组中的抗原,更优选为惰性减毒HAV。
本发明对引发B型肝炎的HBV疫苗有用。本发明的HBV疫苗中所利用的HBV抗原包含以往公知的多种HBV衍生抗原,优选地,适合本发明的HBV抗原是HBV核心抗原(HBcAg,core antigen of HBV)或HBV表面抗原(HBsAg,surface antigen of HBV),更优选为HBV表面抗原(HBsAg,surface antigen of HBV)。
本发明对引发C型肝炎的HCV疫苗有用。本发明的HCV疫苗中所利用的HCV抗原包含以往公知的多种HCV衍生抗原,优选地,适合本发明的HCV抗原是E1、E2、NS3或NS3/4a抗原,更优选为NS3。
本发明对引发AIDS的HIV疫苗有用。本发明的HIV疫苗中所利用的HIV抗原包含以往公知的多种HIV衍生抗原,优选地,适合本发明的HIV抗原是Gag(p55gag)、Pol、Vif、Vpr、Tat、Rev、Vpu、Env或Nef抗原,更优选为Env抗原。
本发明对引发流感等的流感疫苗有用。本发明的流感疫苗中所利用的流感病毒的抗原包含以往公知的多种流感病毒衍生抗原,优选地,适合本发明的流感病毒的抗原是包膜糖蛋白HA或NA,更优选为HA。
本发明对引发单纯疱疹的HSV疫苗有用。本发明的HSV疫苗中所利用的HSV的抗原包含以往公知的多种HSV衍生抗原,优选地,适合本发明的HSV抗原是糖蛋白gB、gD或gH,更优选为gB或gD。
本发明对引发髓膜炎等的Hib疫苗有用。本发明的Hib疫苗中所利用的Hib的抗原包含以往公知的多种Hib衍生抗原,优选地,适合本发明的Hib抗原是磷酸多核糖核醇(Haemophilus type b capsular polysaccharide(PRP,polyribosyl-ribitol-phosphate))或其共轭物,更优选为PRP和破伤风(tetanus)毒素的共轭物。
本发明对引发脑膜炎等的脑膜炎奈瑟菌(Neisseria meningitidis)疫苗有用。本发明的疫苗中所利用的脑膜炎奈瑟菌的抗原包含以往公知的多种脑膜炎奈瑟菌衍生抗原,优选地,适合本发明的脑膜炎奈瑟菌抗原是PI、PII、PIII、菌毛蛋白、脂多糖、铁结合蛋白或蛋白酶体,更优选为蛋白酶体。
本发明对引发白喉等的白喉棒状杆菌(Corynebacterium diphtheria)疫苗有用。本发明的疫苗中所利用的白喉棒状杆菌的抗原包含以往公知的多种白喉棒状杆菌衍生抗原,优选地,适合本发明的白喉棒状杆菌的抗原是白喉毒素。
本发明对引发百日咳的百日咳杆菌(Bordetella pertussis)疫苗有用。本发明的疫苗中所利用的百日咳杆菌的抗原包含以往公知的多种百日咳杆菌衍生抗原,优选地,适合本发明的百日咳杆菌的抗原是百日咳毒素。
本发明对引发破伤风等的破伤风梭菌(Clostridium tetani)疫苗有用。本发明的疫苗中所利用的破伤风梭菌的抗原包含以往公知的多种破伤风梭菌衍生抗原,优选地,适合本发明的破伤风梭菌的抗原是破伤风毒素。
本发明对引发水痘等的水痘病毒(Varicella virus)疫苗有用。本发明的疫苗中所利用的水痘病毒的抗原包含以往公知的多种水痘病毒衍生抗原,优选地,适合本发明的水痘病毒的抗原是活减毒水痘病毒、惰性减毒水痘病毒、gpI或gpII,更优选为活减毒水痘病毒。
本发明的疫苗组合物中最大的特征在于,将非毒性脂寡糖(LOS,Lipooligosaccharide)作为免疫佐剂来利用。本说明书中首次采用的术语“非毒性脂寡糖(LOS,Lipooligosaccharide)”为脂多糖(LPS,lipopolysaccharide)的变形体,具有比天然(natural occurring)脂多糖更短的糖链,从而意味着分子量小。优选地,脱酰基化之前的脂寡糖的分子量为5000~10000Da。术语“脱酰基化脂寡糖”意味着在此类脂寡糖中清除与脂质A的葡萄糖胺通过-C(O)O-键相结合的脂肪酸,与LPO相比,毒性大大减少。脂肪酸在脂质A的葡萄糖胺通过-C(O)O-键及-C(O)NH-键相结合。本发明的脱酰基化脂寡糖表示通过脂质A的脱酰基化,来清除通过-C(O)O-键相结合的脂肪酸。
脱酰基化非毒性脂寡糖能够通过多种方法来制备,但也能通过作为本发明者的现有专利的韩国专利授权第0456681号、WO2004/039413;韩国专利授权第0740237号及WO2006/121232中公开的方法来制备。例如,将强碱(2N NaOH)处理在脂多糖中进行脱酰基化,并从脂质A中清除一部分脂肪酸,来进行脱毒化。
根据本发明的优选实施例,在本发明中用作免疫佐剂的脱酰基化非毒性脂寡糖是对脂多糖进行碱处理,来实现脱酰基化而被非毒性化的。上述碱基的优选例包含NaOH、KOH、Ba(OH)2、CsOH、Sr(OH)2、Ca(OH)2、LiOH、RbOH及Mg(OH)2,更优选为NaOH、KOH、Ba(OH)2、Ca(OH)2、LiOH及Mg(OH)2,进而优选为NaOH、KOH及Mg(OH)2,最优选为NaOH。
脂多糖的毒性程度能够通过所属领域公知的多种方法来分析。例如,可对处理脂多糖的急性单核细胞细胞白血病(THP-1,Acute monocytic leukemia)分泌的肿瘤坏死因子-α(TNF-α,tumor necrosis factor-α)的量进行测定,来分析毒性。本发明的脱酰基化非毒性脂寡糖与现有的脂多糖相比,诱导相对少量的肿瘤坏死因子-α。
作为本发明中所利用的免疫佐剂,脱酰基化非毒性脂寡糖的又一特征在于,分子量比一般以往所利用的脂多糖要少。优选地,本发明中所利用的脱酰基化非毒性脂寡糖具有1500~10000Da的分子量,更优选为2000~5000Da,进而优选为2000~4000Da,尤其优选为3000~4000Da,最优选为3200~37000Da。此类分子量能够通过所属领域常规的方法来测定,例如,利用基质辅助激光解吸电离质谱(MALDI-MASS,matrix assisted laser desorption/ionization mass spectrometry)来测定。
根据本发明的优选实施例,作为本发明的免疫佐剂的脱酰基化非毒性脂寡糖来源于大肠杆菌(E.coli),最优选地,来源于作为本发明的单独的菌的E.coli EG0021(KCCM 10374)。
本发明中所利用的脱酰基化非毒性脂寡糖在免疫促进(immunostimulatory)功效方面与现有的免疫佐剂相比更加优秀,与此同时,毒性也更加减少,因此,非常适合本发明的疫苗组合物。如下述实施例所论证一样,比起为了清除脂多糖的毒素,通过清除脂多糖的聚糖链获得的脂质A的磷酸化来获得的单磷酸脂质A,本发明的脱酰基化非毒性脂多糖的毒性更少。
并且,如下述实施例所示,将本发明的脱酰基化非毒性脂多糖与多种病原体的抗原一同给药的情况下,能够大大增加免疫反应。
本发明的疫苗组合物仅仅通过其基本的组成,病原体的抗原和脱酰基化非毒性脂寡糖,也能诱导充分的免疫反应,从而发挥对特定疾病的预防功效。选择性地,本发明的疫苗组合物还可包含其他免疫佐剂,例如,包含选自包含Mg、Ca、Sr、Ba及Ra的组中的第二族元素、选自包含Ti、Zr、Hf及Rf的组中的第四族元素,或铝的盐或其水合物。优选地,上述盐与氧化物、过氧化物、氢氧化物、碳酸盐、磷酸盐、焦磷酸盐、磷酸氢盐、磷酸二氢、硫酸盐或硅酸盐一同形成。例如,能够在本发明的疫苗组合物中追加利用的免疫佐剂包含氢氧化镁、碱式碳酸镁五水合、二氧化钛、碳酸钙、氧化钡、氢氧化钡、过氧化钡、硫酸钡、硫酸钙、焦磷酸钙、碳酸镁、氧化镁、氢氧化铝、磷酸铝、十二水合硫酸铝钾(Alum)。最优选地,在本发明的疫苗组合物中,能够追加利用的免疫佐剂为氢氧化铝。
包含于本发明的疫苗药剂学组合物的、在药剂学上接受的载体是在制剂时通常利用的,其包含乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油,但并不局限于此。本发明的药剂学组合物除了上述成分之外,还可包含润滑剂、润湿剂、增甜剂、香味剂、乳化剂、悬浮剂、保存剂等。药剂学上接受的适合的载体及制剂在Remington's Pharmaceutical Sciences(19th ed.,1995)中有详细记载。
本发明的药剂学组合物能够以口服或非口服方式进行给药,优选为非口服给药,就非口服给药而言,能够以静脉内注射、皮下注射、肌肉注射、腹腔注射、经皮等方式进行给药。
本发明的药剂学组合物的适合的给药剂量会根据制剂方法、给药方式、患者的年龄、体重、性别、病态、饮食、给药时间、给药途径、排泄速度及反应灵敏性之类的因素,能够进行多种处方。另一方面,本发明的药剂学组合物的口服给药剂量,按每日优选为0.0001~1000mg/kg(体重)。
本发明的药剂学组合物根据所属领域技术人员能够容易实施的方法,利用药剂学上接受的载体和/或赋形剂进行制剂化,从而以单位容量形态进行制备或内置于多容量容器来制备。此时,剂型可以是油性或水性介质中的溶液、悬浮液或乳化液形态,也可以是浸膏剂、粉末剂、颗粒剂、片剂或胶囊剂,并且,还可包含分散剂或稳定剂。
本发明的疫苗组合物大大诱导对病原体的免疫反应,从而对特定疾病具有优秀的预防功效之外,由于用作免疫佐剂的脱酰基化非毒性脂寡糖几乎没有毒性,因此,在稳定性方面也非常优秀。
本发明所利用的脱酰基化非毒性脂寡糖在多种病原体抗原中,对结核菌抗原、炭疽菌抗原、HAV抗原、HBV抗原、HCV抗原、HIV抗原、流感病毒的抗原、HSV抗原、Hib(Haemophilus influenzae type b)的抗原、脑膜炎奈瑟菌抗原、白喉棒状杆菌、百日咳杆菌抗原、破伤风梭菌抗原及水痘疾病抗原起着尤其促进优秀的免疫反应的作用。脱酰基化非毒性脂寡糖的此类优秀的免疫反应促进效果在下述的实施例中有论证。
根据本发明的另一实施方式,本发明提供一种包含脱酰基化非毒性脂寡糖的树突状细胞的成熟化诱导用组合物。
根据本发明的又一实施方式,本发明提供一种包括将脱酰基化非毒性脂寡糖处理在未成熟树脂细胞的成熟化树突状细胞的制备方法。
在制备树突状细胞疫苗时,应对从生物体中分离的树突状细胞进行成熟化。在此过程中,能够非常有用地利用脱酰基化非毒性脂寡糖。
根据树突状细胞疫苗的制备方法,未成熟的树突状细胞来源于单核细胞或造血干细胞,更优选地,来源于单核细胞。从单核细胞中诱导树突状细胞的方法更加优选的理由在于,与使用多功能性造血干细胞(pluripotent hematopoietic stem/progenitor cells)的方法相比,能够在较短的步骤内获得均等性质的树突状细胞。根据本发明的优选实施例,上述单核细胞是从外周血中获得的。从外周血内的祖细胞(progenitor cell),例如,单核细胞或造血干细胞)中获得未成熟的树突状细胞的方法能够通过从外周血内其他细胞中分离上述祖细胞,来进行树突状细胞进行分化和诱导的过程,并且,还能进行以未从外周血内其他细胞中分离的状态,将上述祖细胞分化和诱导为树突状细胞的过程。
之后,将从外周血中获得的单核细胞分化和诱导为树突状细胞。为了分化为树突状细胞,在包含适合的细胞因子的培养基内培养单核细胞。所利用的细胞因子是粒细胞-巨噬细胞集落促进因子(GM-CSF,Granulocyte macrophage colony stimulating factor)、白细胞介素-4(IL-4,interleukin-4),白细胞介素-13(IL-13)或它们的组合。所添加的细胞因子的适合的量是充分分化为树突状细胞的量,因此,是各研究人员在实验室中以经验进行选择而优选的量。
从单核细胞中分化树突状细胞为目的的第一次培养时间,在使用细胞因子来进行的情况下,通常在5天以上,优选为6~7天。
利用在上述的分化过程中获得的未成熟的树突状细胞,最终实施成熟化过程。即,在包含本发明的脱酰基化非毒性脂寡糖的具有培养液的培养基中进行培养,来将树突状细胞进行成熟化。第二次培养的时间通常在10小时以上,优选为20小时以上,例如,1~3天。
本发明能够有效地制备成熟化的树突状细胞疫苗。
【发明效果】
归纳本发明的特征及优点如下。
(a)本发明的疫苗组合物利用脱酰基化非毒性脂寡糖作为病原体衍生抗原和免疫佐剂。
(b)作为免疫佐剂的脱酰基化非毒性脂寡糖对特定病原体的免疫反应中发挥非常优秀的免疫促进功效的同时,几乎没有毒性,因此,稳定性非常优秀。
(c)并且,脱酰基化非毒性脂寡糖能够有效地制备成熟化的树突状细胞疫苗。
【附图说明】
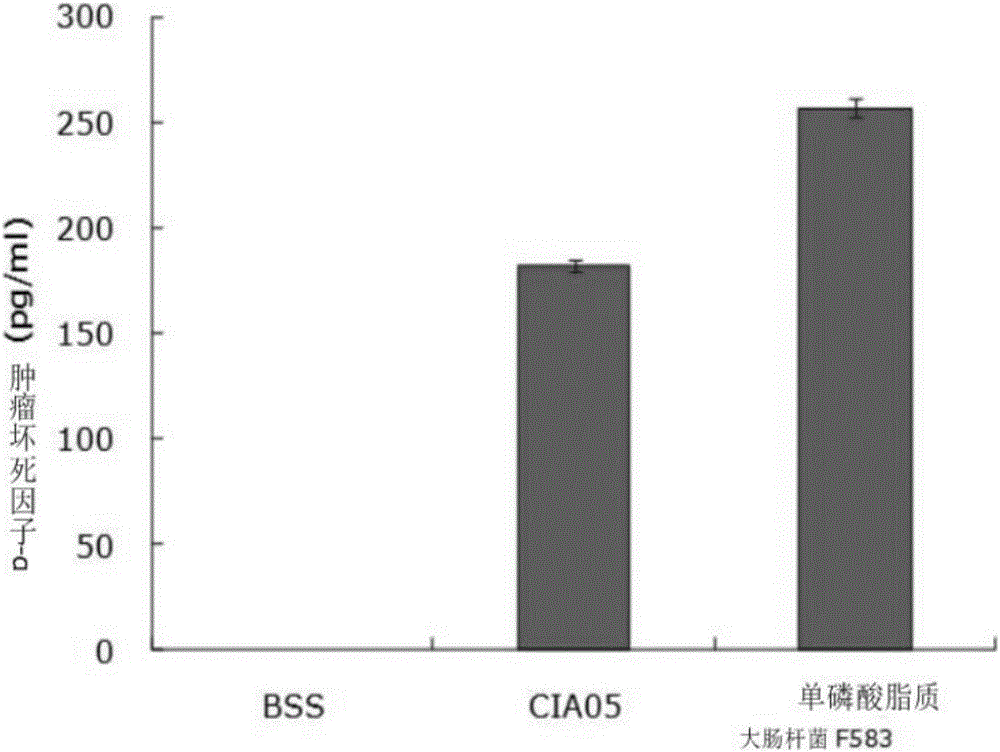
图1是表示新免疫佐剂(CIA05)的细胞毒性(分泌肿瘤坏死因子-α)比单磷酸脂质A更低的图表。
图2a~图2d是对本发明的结核疫苗的功效进行分析的实验结果。图2a~图2d中,作为针对结核菌的抗原,利用Ag85A、HspX、磷酸盐结合蛋白1(Phosphate binding protein 1)及ESAT-6。
图2e是对Ag85A、HspX、ESAT-6及38-kDa的免疫促进功能进行比较的实验结果。图2e中利用了CIA05 0.5μg及各个抗原2μg。
图3是对本发明的炭疽疫苗的功效进行分析的实验结果。
图4是对本发明的A型肝炎疫苗的功效进行分析的实验结果。
图5是对本发明的B型肝炎疫苗的功效进行分析的实验结果。
图6是对本发明的C型肝炎疫苗的功效进行分析的实验结果。
图7是对本发明的HIV疫苗的功效进行分析的实验结果。
图8是对本发明的流感疫苗的功效进行分析的实验结果。
图9a~图9b是对本发明的HSV-2(Herpes simplex virus type 2)疫苗的功效进行分析的实验结果。图9a及图9b中,作为各个抗原,利用了gD抗原及gB抗原。
图9c是对gD抗原及gB抗原的免疫促进功能进行比较的实验结果。图9c中利用了CIA05 0.5μg及各个抗原2μg。
图10是对本发明的Hib(Haemophilus influenzae type b)疫苗的功效进行分析的实验结果。
图11是对本发明的脑膜炎奈瑟菌疫苗的功效进行分析的实验结果。
图12a~图12c是对本发明的DPT疫苗的功效进行分析的实验结果。图12a~图12c中,作为各个抗原,分别利用了白喉毒素、百日咳毒素及破伤风毒素。
图12d是对白喉毒素、百日咳毒素及破伤风毒素的免疫促进功能进行比较的实验结果。图12d中,利用了CIA05 0.5μg及各个抗原2μg。
图13是对本发明的水痘疫苗疫苗的功效进行分析的实验结果。
图14a是在小鼠骨髓来源的树突状细胞(BMDCs,Bone marrow-derived dendritic cells)中,分析对树突状细胞的成熟化的CIA05(实施例1中制备的免疫佐剂)的功效的结果。
图14b是在人单核细胞来源的树突状细胞(MDDCs,Monocyte-derived dendritic cells)中,分析对树突状细胞的成熟化的CIA05(实施例1中制备的免疫佐剂)的功效的结果。
【实施方式】
以下,通过实施例对本发明进行更加详细的说明。这些实施例仅仅是为了对本发明进行更加详细的说明,根据本发明的主旨,本发明请求保护的范围并不局限于这些实施例,这对于本发明所属技术领域的普通技术人员来说是显而易见的。
【实施例】
【实施例1:作为新免疫佐剂的非常短的脂寡糖(LOS)CIA05的生产】
本发明者已经从生存在健康的人的肠道中的大肠杆菌中发掘了具有脂寡糖的糖链的长度非常短的脂多糖的菌株(E.coli EG0021),并于2002年5月2日,将此菌株寄托于寄托机构—韩国微生物保管中心,并获得了寄托编号KCCM10374(参照:韩国专利授权第0456681号;WO2004/039413;韩国专利授权第0740237号;WO2006/121232)。从上述菌株的脂多糖的纯化是根据韩国专利授权第0456681号;WO2004/039413;韩国专利授权第0740237号;WO2006/121232中公开的方法来实施的。利用MALDI-MASS(Shimadz公司,Axima-LNR V 2.3.5(Mode Liner,Power:106))来测定纯化的脂多糖的分子量,测定结果,确认了具有约3千5百Da的分子量。纯化的脂多糖根据韩国专利授权第0456681号;WO2004/039413;韩国专利授权第0740237号;WO2006/121232中公开的方法,根据公开的实验方案进行了脱毒化。简单地,在3mg/ml的上述纯化的脂多糖中,以1:1的量混合2N NaOH后,在60℃下每隔10分钟振荡一次,如此进行140分钟脱酰基化,投入初期0.2N NaOH量的约1/5左右的1N乙酸,来滴定至pH7.0。在pH滴定后,进行乙醇沉淀,从而获得非毒性脂寡糖(CIA05)。
【实施例2:新免疫佐剂CIA05和现有免疫佐剂单磷酸脂质A之间的毒性比较实验】
对本发明的疫苗中用作免疫佐剂的上述实施例中所制备的CIA05和现有的宫颈癌疫苗中所使用的单磷酸脂质A的毒性进行了比较分析。接收健康的人的血液,来分离外周血单核细胞(PBMC,Peripheral Blood Mononuclear Cell),在24孔培养皿中以5×105cell/ml的浓度培养上述外周血单核细胞。此时,使用在RPMI1640(Gibco公司)中混合10%的胎牛血清(FBS,fetal calf serum;Gibco公司)而得的培养液,而每个孔的容量均分为1ml。以如下条件分别处理了准备好的培养皿。1)阴性对照组:平衡盐溶液(BBS,Balanced salt solution)100μl;2)脱酰基化非毒性脂寡糖(CIA05)10μg/100μl:3)单磷酸脂质A(E.coli F583MPL)10μg/100μl。
经过12小时之后,收集已处理的培养液进行离心分离,并利用酶联免疫吸附测定方法(ELISA,enzyme linked immunosorbent assay),使用酶联免疫吸附测定试剂盒(R&D system公司,DY210)对急性单核细胞白血病(THP-1,Acute monocytic leukemia)中分泌的作为炎性蛋白的肿瘤坏死因子-α的量分别进行测定。实验结果表明,如图1所示,毒性比以往用作疫苗佐剂的单磷酸脂质A,大约少1/3左右。
【实施例3:本发明的结核疫苗的功效分析】
【结核疫苗抗原和免疫佐剂CIAO5的免疫】
为了在结核疫苗中确认免疫佐剂CIAO5的功效,使用了结核菌株(Mycobacterium tuberculosis)的4种抗原。这4种抗原为Ag85A(32-kDa)、HspX(16-kDa)、Phosphate binding protein 1(38-kDa)及ESAT-6(6-kDa)。分别混合每2μg的上述4种抗原,每隔一周向6周龄的Balb/c小鼠(SLC,日本)注射3次。此时,单独注射抗原或者包含Alum(氢氧化铝;Brenntag公司,德国)100μg或CIA050.5μg,以最终体积为100μl来进行注射。
【结核疫苗抗原的特意血清抗体的滴定】
为了测定免疫后的血清内结核抗原的特意抗体滴度,使用了终点稀释酶联免疫吸附测定(ELSIA,Enzyme-Linked Immunosorbent Assay)方法。以1μg/ml的浓度向96孔板分别涂敷(4℃,一夜)100μl的Ag85A(32-kDa)、HspX(16-kDa)、Phosphate binding protein1(38-kDa)及ESAT-6(6-kDa)后,利用1%牛血清白蛋白(BSA,bovine serum albumin)300μg来封闭(常温,1小时)。封闭之后,利用包含0.05%Tween-20的磷酸盐缓冲溶液(PBS,Phosphate-Buffered Saline)清洗3次,并将免疫后所获得的血清100μl进行反应(37℃,2小时)。为了确认结合抗原的特意抗体,将辣根过氧化物酶-共轭物抗-小鼠IgG(Zymed)进行反应后,添加四甲基联苯胺(TMB,tetramethylbenzidine,BD生物科学公司,55555214),并利用1N H2SO4终止反应。实验结果,在450nm测定吸光度,从而确认了免疫后回收的血清内结核抗原的特意抗体的量。
【结核疫苗中的免疫佐剂CIA05的功效分析】
对结核菌株的4种抗原和免疫佐剂CIA05的功效进行分析的结果,在Ag85A(32-kDa)抗原的情况下,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum100μg)左右增加的结核抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约128倍(CIA05 1μg)左右增加的结核抗原-特意抗体的生成(图2a)。并且,在利用CIA05的情况下,结核抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对结核抗原Ag85A是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)
在HspX(16-kDa)抗原中,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的结核抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约128倍(CIA05 1μg)左右增加的结核抗原-特意抗体的生成(图2b)。并且,在利用CIA05的情况下,结核抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对结核抗原HspX(16-kDa)是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。
对于Phosphate binding protein 1(38-kDa)抗原而言,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的结核抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约8倍(CIA05 0.5μg)或大约64倍(CIA05 1μg)左右增加的结核抗原-特意抗体的生成(图2c)。并且,在利用CIA05的情况下,结核抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对结核抗原Phosphate binding protein 1(38-kDa)是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。
对于ESAT-6(6-kDa)抗原而言,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum100μg)左右增加的结核抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约128倍(CIA05 1μg)左右增加的结核抗原-特意抗体的生成(图2d)。并且,在利用CIA05的情况下,结核抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对结核抗原ESAT-6(6-kDa)是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。
在结核抗原中,实施了一种用于选择免疫促进功能最优秀的抗原的分析(图2e)。实验结果表明,在结核菌抗原中,依次以Ag85A、HspX、ESAT-6及38-kDa的顺序具有免疫促进功能,由此能够了解与本发明的CIA05最适合的抗原为Ag85A。
综上所述,能够了解作为免疫佐剂包含CIA05的本发明的结核疫苗在免疫功效,即疫苗功效方面非常优秀,并且,与作为现有的免疫佐剂的Alum相比,对结核抗原具有更加优秀的免疫促进功能。
【实施例4:本发明的炭疽疫苗的功效分析】
【作为炭疽疫苗抗原的PA与免疫佐剂CIA05的免疫】
炭疽菌(Bacillus anthracis)以3种蛋白生成2种毒素,在此,3种蛋白由保护性抗原(PA,protective antigen)、致死抗原(LF,lethal antigen)及水肿抗原(EA,edema antigen)组成。其中,PA用于炭疽疫苗,并在本实验中使用了重组全长PA抗原。以腹腔注射方式,每隔两周向6周龄的雄性Balb/c小鼠3次注射10μg炭疽菌的PA抗原。使用10μg的PA抗原,使用0.5μg、1μg的CIA05,使用50μg、100μg的Alum,使最终体积达到100μl。对阴性对照组每次注射100μl的磷酸盐缓冲溶液(PBS,Phosphate-Buffered Saline,pH 7.3)。向小鼠注射3次之后,从小鼠身上采集全血,并通过离心分离获得血清。为了测定免疫后血清内PA特意抗体的滴度,如实施例3一样,使用终点酶联免疫吸附测定(ELSIA)方法。在免疫化后,对血清内PA特意抗原进行分析的结果表明,与单独免疫化PA抗原时相比,将0.5μg的CIA05作为免疫佐剂进行给药时,增加10倍的PA特意抗原,而将1μg的CIA05作为免疫佐剂进行给药时,增加21倍的PA特意抗原(图3)。这表示CIA05与作为炭疽抗原的PA一同在炭疽疫苗中起到免疫佐剂的作用。并且,能够确认混合使用CIA05和Alum(aluminum hydroxide),来用作免疫佐剂时,能够增进PA特意免疫反应(图3)。
综上所述,作为免疫佐剂包含CIA05的本发明的炭疽疫苗,尤其是利用PA抗原和CIA05组合的炭疽疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例5:本发明的A型肝炎(Hepatitis A virus;HAV)疫苗的功效分析】
作为抗原,使用了MRC-5细胞株中培养的惰性HAV。每隔一周向6周龄的Balb/c小鼠注射3次惰性HAV。此时,单独注射HAV或者包含CIA05进行注射。在注射3次过一周后,如同实施例3一样分离血清,通过终点酶联免疫吸附测定方法测定HAV特意抗体。
对于HAV抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约2倍(Alum 50μg)或大约4倍(Alum 100μg)左右增加的HAV抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约8倍(CIA05 0.5μg)或大约32倍(CIA05 1μg)左右增加的HAV抗原-特意抗体的生成(图4)。并且,在利用CIA05的情况下,HAV抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对HAV抗原(惰性HAV)是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的HAV疫苗,尤其是利用惰性HAV和CIA05组合的HAV疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例6:本发明的B型肝炎(Hepatitis B virus;HBV)疫苗的功效分析】
作为HBV预防疫苗中的抗原,将作为HBV的表面抗原的HBsAg(adr subtype)在多形汉逊酵母(Hansenula polymorpha)中表达、纯化并使其重组来使用。每隔一周向Balb/c小鼠注射3次作为HBV抗原的HBsAg 2μg。此时,单独注射抗原或者包含Alum或CIA05进行注射。在注射3次过一周后,如同实施例3一样分离血清,通过终点酶联免疫吸附测定方法测定HBsAg特意抗体。
对于HBsAg抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约2倍(Alum 50μg)或大约4倍(Alum 100μg)左右增加的HBsAg抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约8倍(CIA05 0.5μg)或大约16倍(CIA05 1μg)左右增加的HBsAg抗原-特意抗体的生成(图5)。并且,在利用CIA05的情况下,HBsAg抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对HBsAg抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的HBV疫苗,尤其是利用HBsAg和CIA05组合的HBV疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例7:本发明的C型肝炎(Hepatitis C virus;HCV)疫苗的功效分析】
为了在HCV疫苗中确认免疫佐剂CIA05的功效,购买HCV的重组NS3(Z00042,金斯瑞生物科技)作为抗原来使用。
每隔一周向6周龄Balb/c小鼠注射3次2μg的NS3抗原,单独注射抗原或者包含Alum或CIA05进行注射。在注射3次过一周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定NS3特意抗体。
对于NC3抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约2倍(Alum 50μg)或大约4倍(Alum 100μg)左右增加的NC3抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约4倍(CIA05 0.5μg)或大约16倍(CIA05 1μg)左右增加的NC3抗原-特意抗体的生成(图6)。并且,利用CIA05的情况下,NC3抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对NC3抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约4倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的HCV疫苗,尤其是利用NC3抗原和CIA05组合的HCV疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例8:本发明的HIV疫苗的功效分析】
为了在HIV疫苗中确认免疫佐剂CIA05的功效,购买HIV-1包膜(Env)抗原(H9909,西格马公司)作为抗原来使用。每隔一周向6周龄Balb/c小鼠注射3次2μg的HIV-1包膜抗原,单独注射抗原或者包含Alum或CIA05进行注射。在注射3次过一周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定HIV-1包膜抗原特意抗体。
对于HIV-1包膜抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的HIV-1包膜抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约64倍(CIA05 1μg)左右增加的HIV-1包膜抗原-特意抗体的生成(图7)。并且,在利用CIA05的情况下,HIV-1包膜抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对HIV-1包膜抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的HIV疫苗,尤其是利用HIV-1包膜抗原和CIA05组合的HIV疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例9:本发明的流感疫苗的功效分析】
为了在流感疫苗中确认免疫佐剂CIA05的功效,使用了从3种流感病毒菌株中获得的HA亚单位(subunit)(CJ公司,仁川,韩国)。3种流感病毒菌株为A/New Caledonia/20/99(HIN1)、A/Panama/2007/99(H3N2)及B/Shangdong/7/97。每隔四周向6周龄Balb/c小鼠注射2次来源于上述3种流感病毒菌株的HA subunit1.5μg。此时,单独注射抗原或者包含25μg的Alum或25μg的CIA05进行注射。在注射2次过4周后,如同实施例1一样,从小鼠身上分离血清,通过终点酶联免疫吸附测定方法测定HA subunit特意抗体。
对于流感HA subunit抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约2倍(Alum 50μg)或大约4倍(Alum 100μg)左右增加的流感HA subunit抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约4倍(CIA05 0.5μg)或大约8倍(CIA05 1μg)左右增加的流感HA subunit抗原-特意抗体的生成(图8)。并且,在利用CIA05的情况下,流感HA subunit抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对流感HA subunit抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约8倍(Alum100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约8倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的流感疫苗,尤其是利用流感HA subunit抗原和CIA05组合的流感疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例10:本发明的Ⅱ型单纯疱疹病毒(HSV-2,Herpes simplex virus type 2)疫苗的功效分析】
为了在HSV-2疫苗中确认免疫佐剂CIA05的功效,将HSV-2的糖蛋白gD和gB作为抗原来使用。由于2种抗原的糖化非常重要,因此,为了准确的糖化,在作为动物细胞的中国仓鼠卵巢(CHO,Chinese hamster ovary)细胞株中进行表达及纯化(Boucher et al.,Detection of antibodies to herpes simplex virus type 2with a mammalian cell line expressing glycoprotein gG-2.Clin.Diagn.Virol.1(1):29-38(1993))。每隔一周向6周龄Balb/c小鼠注射3次在CHO细胞株中进行表达、纯化的2μg的2种抗原,而实验组单独注射抗原或者包含Alum或CIA05进行注射。在注射3次过1周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定作为HSV-2抗体的gD和gB特意抗体。
对于gD抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约8倍(Alum 50μg)或大约32倍(Alum 100μg)左右增加的gD抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约24倍(CIA05 0.5μg)或大约128倍(CIA05 1μg)左右增加的gD抗原-特意抗体的生成(图9a)。并且,在利用CIA05的情况下,gD抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对gD抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约16倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约2倍(Alum 50μg)或大约16倍(Alum 100μg)。
对于gB抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约8倍(Alum 50μg)或大约32倍(Alum 100μg)左右增加的gB抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约32倍(CIA051μg)左右增加的gB抗原-特意抗体的生成(图9b)。并且,利用CIA05的情况下,gB抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对gB抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约16倍(Alum100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约16倍(Alum 100μg)。
HSV-2抗原中,实施了一种用于选择免疫促进功能最优秀的抗原的分析(图9c)。实验结果表明,在HSV-2抗原中,gD抗原的免疫促进功能比gB抗原优秀,由此,能够了解与本发明的CIA05最适合的抗原为gD抗原。
综上所述,作为免疫佐剂包含CIA05的本发明的HSV-2疫苗,尤其是利用gD抗原和CIA05组合的HSV-2疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例11:本发明的b型流感嗜血杆菌(Hib,Haemophilus influenzae type b)疫苗的功效分析】
作为Hib抗原,购买乙型流感嗜血杆菌疫苗安尔宝(ActHIB)(b型流感嗜血杆菌(破伤风类毒素,赛诺菲安万特公司)来使用。每隔两周向Balb/c小鼠注射2次ActHIB。此时,单独注射疫苗或者包含Alum或CIA05进行注射。在注射2次过1周后,如同实施例1一样,从已注射的小鼠身上分离血清,通过终点酶联免疫吸附测定方法测定Hib特意抗体。
对于ActHIB抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约16倍(Alum 100μg)左右增加的ActHIB抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA05 0.5μg)或大约32倍(CIA05 1μg)左右增加的ActHIB抗原-特意抗体的生成(图10)。并且,在利用CIA05的情况下,ActHIB抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对ActHIB是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约8倍(Alum50μg)或大约16倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约24倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的Hib疫苗,尤其是利用ActHIB和CIA05组合的Hib疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例12:本发明的脑膜炎奈瑟菌疫苗的功效分析】
为了在脑膜炎奈瑟菌疫苗中确认免疫佐剂CIA05的功效,从减毒的脑膜炎奈瑟菌中分离蛋白酶体,将其作为抗原来使用(Lowell et al.,Proteosome-lipopeptide vaccines:enhancement of immunogenicity for malaria CS peptides.Science,240:800-802(1980))。每隔两周向6周龄的Balb/c小鼠注射2次抗原,实验组组成单独使用疫苗或者包含CIA05的2种实验组。在注射2次过1周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定用作抗原的脑膜炎奈瑟菌蛋白酶体(Neisseria meningitidis proteosome)特意抗体。
对于脑膜炎奈瑟菌蛋白酶体抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约8倍(CIA05 0.5μg)或大约16倍(CIA05 1μg)左右增加的抗原-特意抗体的生成(图11)。并且,在利用CIA05的情况下,抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对脑膜炎奈瑟菌蛋白酶体抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约16倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约16倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的脑膜炎奈瑟菌疫苗,尤其是利用脑膜炎奈瑟菌蛋白酶体和CIA05组合的脑膜炎奈瑟菌疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例13:本发明的白喉、破伤风、百日咳(DPT)疫苗的功效分析】
DPT是预防由白喉,百日咳,破伤风引起的疾病的疫苗。为了对此类疾病的疫苗确认CIA05的免疫佐剂的功效,购买来源于白喉棒状杆菌的白喉毒素(DO564,西格玛公司)作为白喉来使用,购买来源于百日咳杆菌的百日咳毒素(P7208,西格玛公司)作为百日咳来使用,购买来源于破伤风梭菌的破伤风毒素(T3194,西格玛公司)作为破伤风来使用。混合每2μg的3种毒素,每隔两周向6周龄Balb/c小鼠注射2次。此时,单独注射抗原或者包含Alum或CIA05进行注射。在注射2次过一周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定对于3种毒素的特意抗体。
对于白喉病毒抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约32倍(Alum 50μg)或大约64倍(Alum 100μg)左右增加的抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约32倍(CIA05 0.5μg)或大约128倍(CIA05 1μg)左右增加的抗原-特意抗体的生成(图12a)。并且,在利用CIA05的情况下,抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对白喉毒素抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约8倍(Alum 50μg)或大约16倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。
对于百日咳病毒抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约16倍(Alum 100μg)左右增加的抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA050.5μg)或大约24倍(CIA051μg)左右增加的抗原-特意抗体的生成(图12b)。并且,在利用CIA05的情况下,抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对百日咳毒素抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约32倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约8倍(Alum 50μg)或大约32倍(Alum 100μg)。
对于破伤风毒素抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA050.5μg)或大约32倍(CIA051μg)左右增加的抗原-特意抗体的生成(图12b)。并且,在利用CIA05的情况下,抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对白喉毒素抗原是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。
在DPT抗原中,实施了一种用于选择免疫促进功能最优秀的抗原的分析(图12d)。实验结果表明,免疫促进功能依次以白喉毒素、百日咳毒素及破伤风毒素的顺序优秀,由此能够了解与本发明的CIA05最适合的抗原为白喉毒素。
综上所述,作为免疫佐剂包含CIA05的本发明的DPT,尤其是利用白喉毒素和CIA05组合的DPT疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例14:本发明的水痘疫苗功效分析】
为了在水痘疫苗中确认免疫佐剂CIA05的功效,作为抗原,使用了1VIA水痘疫苗株(1VIA Suduvax注射液,绿十字)。水痘疫苗株是一种减毒活疫苗形态的水痘疫苗。每隔两周向6周龄的Balb/c小鼠注射2次水痘疫苗。此时,单独注射疫苗或者包含CIA05进行注射。在注射2次过一周后,如同实施例1一样分离血清,通过终点酶联免疫吸附测定方法测定水痘菌株特意抗体。
对于水痘菌株抗原,利用Alum的实验组与单独使用抗原的实验组相比,增进大约4倍(Alum 50μg)或大约8倍(Alum 100μg)左右增加的抗原-特意抗体的生成,在利用CIA05的情况下,与单独使用抗原的实验组相比,增进大约16倍(CIA050.5μg)或大约64倍(CIA051μg)左右增加的抗原-特意抗体的生成(图13)。并且,在利用CIA05的情况下,抗原-特意抗体产量对给药剂量依赖性地剧增,从而能够了解CIA05对水痘菌株抗原(减毒的水痘菌株)是非常适合的免疫佐剂。一方面,作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用0.5μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约8倍(Alum 100μg)。作为免疫佐剂,将CIA05和Alum同时使用的情况下,比起只使用1.0μg的CIA05的情况,抗体产量增加大约4倍(Alum 50μg)或大约32倍(Alum 100μg)。
综上所述,作为免疫佐剂包含CIA05的本发明的水痘疫苗,尤其是利用减毒的水痘菌株和CIA05组合的水痘疫苗在免疫功效,即疫苗功效方面非常优秀。
【实施例15:对树突状细胞的成熟化的CIA05的功效分析】
【人单核细胞衍生的DC细胞(MDDCs,Monocyte-derived DC cells)和小鼠骨髓树突状细胞(BMDC,Bone marrow DCs)的分离】
从健康的人身上采集约80ml的血液后,通过聚蔗糖泛影钠TM梯度(Ficoll-PaqueTMgradient)分离法分离外周血单核细胞(PBMCs)。单核细胞(monocyte)是从外周血单核细胞(PBMCs)中利用anti-CD14微珠(microbeads)(免疫磁珠分离系统:MACS system)来分离的,并且,在24孔板中,以1×108cells/well的浓度,利用包含10%的FBS、IL-4、GM-CSF的RPMI1640培养基进行稀释和培养,从而获得人类单核细胞衍生的DC细胞。骨髓树突状细胞是在雌性BALB/c小鼠中,将骨髓细胞(bone marrow cell)在包含IL-4、GM-CSF的培养基中培养6天,并在第7天利用抗-CD11c-包被磁珠(anti-CD11c-coated magnetic beads)分离CD11c+cell。
【基于免疫佐剂CIA05的树状突细胞(DCs,Dendritic cells)表面标记表达增加分析】
通过上述方法分离人单核细胞衍生的DC细胞和小鼠的骨髓树突状细胞后,将脂多糖、单磷酸脂质A、CIA05分别以1μg/ml的浓度进行处理,在37℃下进行24小时反应。进行反应之后,在小鼠骨髓树突状细胞的表面确认了CD40、CD80及CD86,在人单核细胞衍生的DC细胞中分别通过流式细胞仪(flow cytometry)确认了HLA-DR、CD80及CD86。能够确认的是,小鼠的骨髓树突状细胞的情况下,脂多糖、单磷酸脂质A及CIA05几乎都类似地分布了作为DCs表面标记的CD40、CD80及CD86(图14a)。但是,在人单核细胞衍生的DC细胞中能够确认,与现在广泛使用于疫苗免疫佐剂的单磷酸脂质A相比,作为单核细胞衍生的DC细胞的表面标记的HLA-DR、CD80及CD86在CIA05中有着更多的表达(图14b)。这表示单磷酸脂质A在小鼠身上会维持脂多糖水准的功效,但在人身上会限制脂多糖水准的功效,并且,CIA05能够解决此类问题。
综上所述,上述实验结果表明,免疫佐剂CIA05在多种疫苗中起着大大增加免疫功效,即疫苗功效的作用,尤其,对人类树突状细胞的成熟化也有显著效果。
本说明书还包括下列内容:
1.一种疫苗药剂学组合物,其特征在于,包含:
(a)病原体衍生抗原,其选自包含结核菌抗原、炭疽菌抗原、HAV的抗原、HBV的抗原、HCV的抗原、HIV的抗原、流感病毒的抗原、HSV的抗原、Hib的抗原、脑膜炎奈瑟菌的抗原、白喉棒状杆菌的抗原、百日咳杆菌的抗原、破伤风梭菌的抗原及水痘病毒的抗原的组中;
(b)脱酰基化非毒性脂寡糖;以及
(c)药剂学上接受的载体。
2.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述结核菌抗原是选自包含65kD热休克蛋白、抗原85A、抗原85B、抗原85C、ESAT-6、Des蛋白、MPT32、MPT51、MPT63、MPT64、HspX及磷酸盐结合蛋白1的组中的至少1种抗原。
3.根据实施方式2所述的疫苗药剂学组合物,其特征在于,上述结核菌抗原是选自包含抗原85A、ESAT-6、HspX及磷酸盐结合蛋白1的组中的至少1种抗原。
4.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述炭疽病抗原为保护性抗原、致死抗原或水肿抗原。
5.根据实施方式3所述的疫苗药剂学组合物,其特征在于,上述炭疽菌抗原为保护性抗原。
6.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述HAV的抗原是选自包含活减毒HAV、惰性减毒HAV、VP1、VP2、VP3、VP4、2A、2B、2C、3A、3B、3C及3D蛋白的组中的抗原。
7.根据实施方式6所述的疫苗药剂学组合物,其特征在于,上述HAV的抗原为惰性减毒HAV。
8.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述HBV的抗原为HBV核心抗原或HBV表面抗原。
9.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述HCV的抗原为E1、E2或NS3/4a抗原。
10.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述HIV的抗原为Gag(p55gag)、Pol、Vif、Vpr、Tat、Rev、Vpu、Env或Nef抗原。
11.根据实施方式10所述的疫苗药剂学组合物,其特征在于,上述HIV抗原为Env抗原。
12.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述流感病毒的抗原为包膜糖蛋白HA或NA。
13.根据实施方式12所述的疫苗药剂学组合物,其特征在于,上述流感病毒的抗原为包膜糖蛋白HA。
14.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述HSV的抗原为HSV的糖蛋白gB、gD或gH。
15.根据实施方式14所述的疫苗药剂学组合物,其特征在于,上述HSV的抗原为HSV的糖蛋白gB或gD。
16.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述Hib的抗原为PRP或其共轭物。
17.根据实施方式16所述的疫苗药剂学组合物,其特征在于,上述Hib的抗原为PRP和破伤风毒素的共轭物。
18.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述脑膜炎奈瑟菌的抗原为PI、PII、PIII、菌毛蛋白、脂多糖、铁结合蛋白或蛋白酶体。
19.根据实施方式18所述的疫苗药剂学组合物,其特征在于,上述脑膜炎奈瑟菌的抗原为蛋白酶体。
20.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述白喉棒状杆菌的抗原为白喉毒素。
21.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述百日咳杆菌的抗原为百日咳毒素。
22.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述破伤风梭菌的抗原为破伤风毒素。
23.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述水痘病毒的抗原为活减毒水痘病毒、惰性减毒水痘病毒、gpI或gpII。
24.根据实施方式23所述的疫苗药剂学组合物,其特征在于,上述水痘病毒的抗原为活减毒水痘病毒。
25.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述非毒性脂寡糖是对脂多糖进行碱处理,来实现脂质A的脱酰基化而被非毒性化。
26.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述非毒性脂寡糖具有1500~10000Da的分子量。
27.根据实施方式26所述的疫苗药剂学组合物,其特征在于,上述非毒性脂寡糖具有2000~4000Da的分子量。
28.根据实施方式1所述的疫苗药剂学组合物,其特征在于,上述非毒性脂寡糖由肠埃希氏菌衍生。
29.根据实施方式1所述的疫苗药剂学组合物,其特征在于,
上述药剂学组合物还包含免疫佐剂;
上述免疫佐剂是选自包含Mg、Ca、Sr、Ba及Ra的组中的第二族元素、选自包含Ti、Zr、Hf及Rf的组中的第四族元素或铝的盐或其水合物。
30.一种树突状细胞的成熟化诱导用组合物,其特征在于,包含脱酰基化非毒性脂寡糖。
31.根据实施方式30所述的树突状细胞的成熟化诱导用组合物,其特征在于,上述非毒性脂寡糖是对脂多糖进行碱处理,来实现脂质A的脱酰基化二被非毒性化。
32.根据实施方式30所述的树突状细胞的成熟化诱导用组合物,其特征在于,上述非毒性脂寡糖具有1500~10000Da的分子量。
33.根据实施方式32所述的树突状细胞的成熟化诱导用组合物,其特征在于,上述非毒性脂寡糖具有2000~4000Da的分子量。
34.根据实施方式30所述的树突状细胞的成熟化诱导用组合物,其特征在于,上述非毒性脂寡糖由肠埃希氏菌衍生。
- 还没有人留言评论。精彩留言会获得点赞!