用于神经再生的生物相容性植入物及其使用方法与流程
相关申请的交叉引用
本申请要求2015年4月15日提交的第62/148,087号美国临时申请的优先权权益,所述临时申请的整体公开内容通过引用并入本文。
本专利文件涉及用于神经再生的植入物的领域,并且更具体地涉及用于治疗或修复外周神经损伤的生物相容性且生物可吸收性神经导管和神经包裹物(wrap),所述神经导管和神经包裹物的生物学性能经由涂层而得到进一步增强以控制纤维组织的浸润。
关于联邦政府资助研究的声明
本研究得到军队再生医学研究院(armedforcesinstituteofregenerativemedicine)(基金号为w81xwh-08-2-0034)的整体或部分资助。本工作还得到军队生物材料研究中心(cembr)(centerformilitarybiomaterialsresearch,基金号为w81xwh-04-2-0031)以及罗格斯大学新泽西生物材料中心(newjerseycenterforbiomaterialsatrutgersuniversity)和国家卫生研究院(nationalinstitutesofhealth)(基金号为r01ns078385)的支持。美国政府拥有本发明的某些权利。
背景技术:
由创伤或手术引起的外周神经损伤可以导致感觉和运动的丧失。恢复的速率和程度是缓慢的,通常是不完全且多变的。导致的功能丧失可能使患者非常痛苦并且由于缺少适当的治疗选择而可能导致永久性残废。
神经导管用于外周神经系统的损伤以便使切断的神经的末端连接并且在两个末端之间的间隙处架桥。神经导管向神经纤维(轴突)提供空间以进行生长,使脆弱的新生长的神经纤维免受其它创伤,并且理想地还提供免受形成疤痕的结缔组织细胞(成纤维细胞)的浸润,所述结缔组织细胞倾向于妨碍轴突生长。神经包裹物是围绕受损神经进行包裹以提供机械支撑、使对受损神经的其它创伤最小化以及增强受损神经的功能恢复的片。神经导管和神经包裹物在本专利文件中统称为神经辅助装置(nad),除非必须特别提及神经导管或神经包裹物。
对于神经再生而言,可降解且可吸收的nad是优选的,因为在愈合期间和在神经纤维已经修复后,nad分解并且被吸收,以使外来结构在愈合期后不需要去除并且不会有损害或刺激再生的神经的风险。已经由合成聚合物(例如,聚(乳酸))、衍生自生物来源的聚合物(例如,胶原、交联的明胶)以及诸如静脉移植物和神经移植物的人或动物尸体衍生的材料开发出nad。然而,这些导管中的许多导管与由腔体积的膨胀和减小、缝合拉出、塌陷、扭结、压缩和缺少用于经受移动关节的牵引的机械强度而引起的差的愈合有关。
仍然需要为神经导管和神经包裹物的形式的生物相容性且生物可吸收性nad,其不仅提供期望的物理和机械性能(特别是耐扭结和可缝合性),而且还促进神经纤维生长以及提供免受非神经组织浸润的保护。此类nad必须还具有适合的生物降解和生物吸收特性,以使它们丧失强度和物理完整性的时间与受损或切断的神经的功能恢复所需的时间相匹配。
发明概述
各种实施方案提供适用于治疗或修复外周神经损伤的nad,相对于常规导管在多个方面提供了显著改善。首先,用于构建神经导管的聚合物不仅是生物相容和生物可吸收的,而且已经发现通过吸附内源性蛋白质而支持轴突生长。第二,已经鉴定聚合物的库,从而可以调整nad的降解和生物吸收的最优速率以与使轴突生长穿过神经间隙的长度(需要架桥)所需的时间相匹配。可以在仅对聚合物的机械和生物学性能影响最小的情况下进行生物降解和生物吸收的速率的这种调整。第三,虽然编织是众所周知的,但是目前已认识到,当构建nad(改善的压缩强度、改善的耐扭结和耐拉伸)时,编织提供重要的优点。第四,在科学文献中已经激烈地争论了nad的孔隙率的作用。目前已认识到,nad壁必须是多孔的,以使营养物沿着装置的整个长度交换,但是必须严格控制孔隙率,以防止不期望的纤维组织浸润进入nad的内腔。因此,本发明的第四方面是开发水凝胶样涂层,所述水凝胶样涂层控制纤维组织的浸润,同时依然提供氧和营养物质通过nad的壁的改善的扩散。所有四个方面的组合产生了nad的新的和改进的设计,使得nad的整体性能导致患者的更好的功能性神经再生。
在本发明的方面中,提供了包括用于神经再生的多孔编织管的神经导管。将多孔编织管用生物可吸收性水凝胶涂覆,并且由可吸收的、生物相容性聚合物制造,所述聚合物由于其表面处的内源性蛋白质的吸附而支持轴突生长。使用耐扭结的编织图案对纤维进行编织以具有5微米至200微米的孔,并且选择水凝胶涂层材料和厚度以控制总孔隙率,以使营养物和氧可以扩散通过所述水凝胶涂层,但是防止纤维组织浸润通过所述涂层。在一个实施方案中,可吸收的生物相容性聚合物具有式i结构的重复单元:
其中a和b独立地为0或包括端点在内的1至6的整数;其中c和d独立地为0或包括端点在内的1至6的整数;其中各个r1独立地选自含有多至18个碳原子的直链和支链的烷基;其中各个r2独立地为含有多至6个碳原子的亚烷基;其中k为约20至约200;以及其中x为约0.002至约0.20;z为约0.005至0.1;以及x+y+z=1.00。
在式i的一些实施方案中,a和b分别为2和1。
在式i的一些实施方案中,c和d分别为2和1,并且r1为乙基。
在式i的一些实施方案中,r2为亚乙基并且k为约25至约50。
在一些实施方案中,通过编织来制造nad。在优选实施方案中,通过由具有上述式i的重复单元的聚合物制成的编织纤维来制备nad。
在一些实施方案中,使用螺旋缠绕双轴编织图案制造nad。
在一些实施方案中,用为交联的透明质酸(ha)的生物可吸收性水凝胶涂覆多孔nad。
在一些实施方案中,生物可吸收性ha水凝胶与聚(二丙烯酸乙二醇酯)(pegda)交联。
在一些实施方案中,生物相容性神经导管还包括用于填充生物相容性神经导管的内腔的第二生物可吸收性水凝胶。
在一些实施方案中,用于填充生物相容性神经导管的内腔的第二生物可吸收性水凝胶为用共价连接的神经营养因子增强的基于胶原的凝胶,所述神经营养因子例如人自然杀伤-1聚糖(被称为m-hnk-1)的神经突促进肽模拟物。
在本发明的另一方面,提供了使用神经导管形式或神经包裹物形式的上述nad的植入而治疗或修复外周神经损伤的方法。清洁且垂直地切割损伤神经的近残端和远残端,以便不保留无活性组织。然后原位放置导管,以使约1mm的各残端可以分别装入导管的近端和远端,然后使用常规的微神经外科技术使神经残端固定至导管。可以用缝合或通过用纤维蛋白样粘合剂注入修复位点或者两者,从而使导管进一步稳固于周围的软组织。在神经包裹物的情况下,将受损神经小心地放置在包裹物内,通过缝合神经包裹物至闭合,所述包裹物然后围绕受损神经闭合。
在本发明的另一方面中,提供了其中神经或神经组织或神经细胞组分插入生物相容性神经导管内腔的上述导管。可以将细胞组分注入水凝胶中以填充腔,或者可以将细胞组分注入腔内的水凝胶型填充剂中。在将导管纵向切开以提供入口后,可以将组织组分置于腔中。可选地,可以将神经包裹物用于包封受损神经和任一上述填充剂,然后通过缝合使导管或包裹物闭合。作为本发明的这方面的一部分,可能产生具有保持卷缩形状的固有倾向的导管和包裹物,在已经成功将受损神经和填充剂材料放入装置的内腔后,通过缝合促进装置的闭合。
在一些实施方案中,用于填充生物相容性nad的内腔的第二生物可吸收性水凝胶为用共价连接的聚(唾液酸)的轴突促进肽模拟物(在本文被称为mpsa)增强的胶原衍生水凝胶。
在一些实施方案中,生物相容性神经导管的内腔是含有治疗剂量且能够释放任何已知的轴突生长增强生物因子(例如m-hnk-1、m-psa等)的水凝胶。
在本发明的另一方面,将相同的聚合物制造成编织的片,所述编织的片可以任选地涂覆有相同的水凝胶,任选地含有相同的生物活性物质(m-hnk-1、m-psa或其它已知的神经纤维生长增强生物因子的小分子模拟物),以使所述片可以用作神经包裹物而不是用作神经导管。
在本发明的另一实施方案中,发现5-ht4激动剂的添加进一步支持在nad的腔内的轴突的生长,所述5-ht4激动剂包括但不限于bimu-8、西沙比利、cj-033,466、莫沙必利、普卡必利、伦扎必利、rs-67333、sl65.0155、扎考必利和替加色罗。
附图说明
图1示出由与10mol%脱氨基酪氨酰酪氨酸(dt)和0.50mol%聚(乙二醇)(peg)(mw1000)共聚的脱氨基酪氨酰酪氨酸乙酯(dte)组成的聚合物单元。
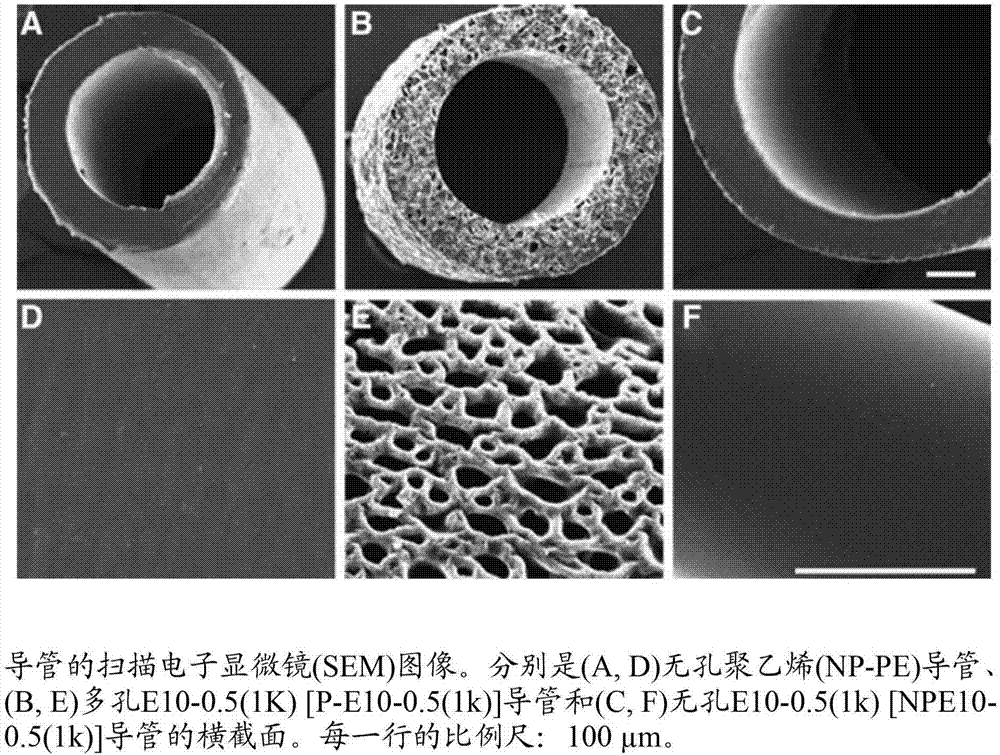
图2示出具有不同孔隙率的导管的横截面视图。
图3示出与在对照底物、组织培养聚苯乙烯(tcps)和玻璃上相比,神经突生长以及施万(schwann)细胞增殖和延伸在图1的聚合物和聚乙烯(pe)的二维(2d)膜上的体外评估。
图4示出与对照底物相比,神经支持性细胞外基质(ecm)蛋白质(层粘连蛋白、纤连蛋白和i型胶原)在图1的聚合物和pe的2d膜上的相对吸收。
图5示出在图1的聚合物和无孔聚乙烯(np-pe)导管中再生的股神经的组织形态分析。
图6示出在植入导管后的小鼠上进行的功能测量的视频帧以及通过在体内的图1的聚合物和无孔聚乙烯导管促进的功能恢复的度量。
图7示出代表性神经切片和纤维直径分析。
图8示出导管材料之间的神经修复的早期差异。
详述
各种实施方案提供用于神经再生的神经导管。用本发明的聚合物以适合的形式制造的导管提供包括适当范围的生物降解和吸收速率、期望的机械性能和与周围组织的相容性在内的潜在优点。此类导管的多孔纤维管上的涂层进一步促进轴突生长并且用作对非神经组织的屏障。与纤维组织浸润相比,水凝胶腔填充剂还促进更快的轴突再生。本发明的导管还可以包括预植入的神经或神经组织作为神经再生的种子、促进剂或桥。本发明的装置因此发现对人体或动物体中的神经或多个神经的创伤或损伤的治疗有实用性。
在整个本发明的文件中,参考各种出版物。这些出版物的公开内容通过引用整体并入本文,以便更全面地描述公开的主题所属的领域的状态。虽然下文可能提及或例示出具体的聚合物、纤维管或神经导管,但是其并不旨在将本发明的范围限于此类特定提及或实例。鉴于实际和经济的考虑,本领域技术人员可以进行各种修改。为了更清晰且简洁地描述权利要求的主题,以下定义旨在为了本文所用的术语含义提供指导。
定义
如本文所用的冠词“一个(a)”和“一个(an)”是指“一个或多个”或者“至少一个”,除非另外指明。即,由不定冠词“一个(a)”或“一个(an)”提及的本发明的任何要素不排除存在超过一个要素的可能。
如本文所用的“约”是指所提及的数值指示加或减10%的所提及的数值指示。
术语“烷基”、“亚烷基”和类似的术语具有本领域技术人员已知的通常含义,因此可以用于指直链或支链的烃链完全饱和(不含双键或叁键)的烃基团。例如通式-cnh2n+1的末端烷基可以在本文被称为“烷基”基团,而例如通式-(ch2)n-的连接烷基可以在本文被称为“亚烷基”基团。烷基可以具有1个至18个碳原子(每当其在本文中出现时,数值范围(例如“1至18”)是指所给范围中的各个整数;例如,“1个至18个碳原子”意指烷基可以由1个碳原子、2个碳原子、3个碳原子等组成,多至18个碳原子并且包括18个碳原子,然而本定义还涵盖未指定数值范围的术语“烷基”的出现)。烷基还可以是具有1个至6个碳原子的中等大小的烷基。烷基还可以是具有1个至5个碳原子的低级烷基。化合物的烷基可以被指定为“c1-c4烷基”或类似指定。仅举例来说,“c1-c4烷基”表示在烷基链中存在一个至四个碳原子,即,烷基链选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。典型的烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基等。
如本文所用的术语“降解”或“生物降解”是指导致聚合物主链化学裂解、引起聚合物分子量和机械强度降低的过程。在生理条件下的聚合物降解速率主要由用于将单个聚合物重复单元连接在一起的键的类型决定。因此,聚酸酐(例如含有高度不稳定的酸酐键的聚合物)将趋向于比聚酯降解更快。相反,术语“吸收”或“生物吸收”被定义为导致植入的装置的质量减少的过程。吸收速率主要受聚合物本身或其降解产物的溶解性控制。一旦植入物的全部质量已经从植入位点移除,则植入物的吸收是完全的。
术语“生物相容性”在科学文献中具有许多不同的含义。在本发明文件的语境中,生物相容性植入物被理解为在人体内发挥作用而在植入位点不引起临床不可接受的组织反应,其中不可接受的组织反应将在合理且确立的临床实践中需要从人体中移除植入物。
一方面,提供了用于神经再生的生物相容性神经导管,其包括涂覆有生物可吸收性水凝胶的多孔纤维管。本发明的神经导管由纤维制造,其相对于常规导管在生物降解和生物吸收特性、机械性能、蛋白质吸附、纤维蛋白基质形成和施万细胞浸润方面提供优势。体外和体内研究的结果(图1至图8)表明,包括上述四种设计策略的神经导管比未包括那些设计策略的常规导管表现得明显更好。特别地,将本发明的导管与用聚乙烯(pe)构建的常规导管进行对比。上述四种设计策略为(1)支持轴突生长的聚合物组成,(2)聚合物库的使用,以便可以将nad的降解和生物吸收的速率调整至使轴突生长穿过神经间隙的长度所需的时间,(3)编织结构,(4)在不允许纤维组织浸润的情况下,控制用于最优的营养物运输的孔隙率的涂层。目前已经发现,设计策略的这种组合赋予显著的性能优势,所述性能优势可以产生需要外周神经再生的患者的更好的临床结果。
在一些实施方案中,聚合物纤维材料由脱氨基-酪氨酰-酪氨酸烷基酯(dte)、脱氨基酪氨酰-酪氨酸侧链游离羧酸(dt)和聚(乙二醇)(peg)组成。可以调整本文所述的聚合物中的游离羧酸单元和peg单元的摩尔分数,以修饰由此类聚合物制备的nad的机械性能和降解速率。例如,具有较低量的游离羧酸的聚合物将趋向于在体内具有较长的寿命。此外,通过在优选的摩尔分数的范围内调整聚合物中的游离羧酸的量,所得的聚合物可以适合用于需要不同装置寿命的各种应用中。通常,游离的羧酸单元的摩尔分数越高,装置在体内的寿命越短,并且更多适合的此类装置用于其中期望或需要较短寿命的应用。
在一个实施方案中,纤维材料由具有结构(式i)的重复单元的生物相容性聚合物组成:
其中a和b独立地为0或包括端点在内的1至6的整数;其中c和d独立地为0或包括端点在内的1至6的整数;其中各个r1独立地选自含有多至18个碳原子的直链和支链的烷基;其中各个r2独立地为含有多至6个碳原子的亚烷基;其中k为约20至约200;以及其中x为约0.02至约0.20;z为约0.005至0.10;以及x+y+z=1.00。
在一些实施方案中,a和b分别为2和1。
在一些实施方案中,c和d分别为2和1,并且r1为乙基。
在一些实施方案中,所述聚合物的r2为亚乙基并且k为约25至约50。
各种碳酸酯聚合物的合成通常在本领域是已知的,包括例如第6,120,491号和第6,475,477号美国专利公开的方法,所述专利的公开内容通过引用并入本文。具有侧链游离羧酸基团的聚合物优选由相应的苄基酯聚合物和叔丁酯聚合物制备,以避免游离羧酸基团与共聚单体的交叉反应。可以将苄基酯聚合物通过第6,120,491号美国专利公开的钯催化的氢解方法转变为相应的游离羧酸聚合物。可以将叔丁酯聚合物通过第2006003476号美国专利公开案中公开的酸解方法经过选择性去除叔丁基而转变为相应的游离羧酸聚合物,所述专利也通过引用并入本文。
在一些实施方案中,选择在预定时间内降解或吸收的聚合物。为此,根据本发明的实施方案包括具有侧链游离羧酸基团(例如dt)的单体重复单元的摩尔分数为约2mol%至约20mol%并且优选为约5mol%至约20mol%的聚合物。
聚(亚烷基二醇)片段(例如peg)降低聚合物的表面粘附力。通过改变聚(亚烷基二醇)片段在本发明提供的嵌段共聚物中的摩尔分数,聚合物的亲水/疏水比率可以变化,以调整聚合物涂层修饰细胞行为的能力。增加聚(亚烷基二醇)的水平抑制细胞粘附、迁移和增殖。其次,peg增加水吸收,因此增加聚合物的降解速率。因此,在实施方案中,选择其中聚(亚烷基二醇)的量被限制为0.5mol%至约10mol%、并且优选为约0.5mol%至约5mol%以及更优选为约0.5mol%至约1mol%的聚合物。聚(亚烷基二醇)可以具有1k至2k的分子量。
在一些实施方案中,选择具有适用于具有适合的机械性能的神经导管的固有物理性能的聚合物,所述机械性能包括弹性、刚性、强度和降解行为。如果聚合物是无定形的,则此类聚合物包括当在生理条件下完全水合时具有大于37℃的玻璃化转变温度的聚合物,以及如果聚合物是结晶的,此类聚合物包括当在生理条件下完全水合时具有大于37℃的结晶熔融温度的聚合物。
应理解,可以使用其它生物相容性可降解的聚合物以形成提供或增强所得的神经导管的某些期望的性能的纤维。可以使用的其它聚合物的实例包括但不限于聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物、聚己内酯、各种聚(氨基酸)和聚酸酐。其它天然或非天然纤维材料(例如,胶原、纤维素、壳聚糖及其衍生物)可以替代地或额外地用于提供或增强所得的神经导管的某些期望的性能(参见,例如,第8,216,602号美国专利)。
在一些实施方案中,生物相容性聚合物组成是生物可降解且生物可吸收的。本发明的nad优选是生物可降解且生物可吸收的,并且具有特定的降解特性,其可以根据需要修复的神经间隙的长度来调整。神经纤维每天生长约1mm或每月生长约1英寸。因此,为了成功再生2英寸神经间隙,愈合过程将需要至少2个月,并且nad应使其大部分机械强度保持至少2个月。为了再生4英寸神经间隙,nad应使其大部分机械强度保持至少4个月,以确保nad在机械上变得太弱而不能支持损伤神经纤维再生长之前完全恢复。在一些实施方案中,可以通过由多种聚合物纤维形成nad来控制降解特性,各种聚合物纤维具有不同的降解特性。
在一些实施方案中,聚合物组成是不透射线的,然而在其它实施方案中,其并非是不透射线的。在一些实施方案中,聚合物在聚合物单元的一个或多个芳族环上被碘化(参见,例如,第6,4754,77号美国专利)。此类修饰允许用医学成像技术检测和跟踪nad。
在一些实施方案中,nad可以具有形状记忆。
图1示例出由89.5mol%脱氨基-酪氨酰酪氨酸乙酯(dte)、10mol%脱氨基酪氨酰酪氨酸(dt)和0.5mol%聚(乙二醇)(peg,分子量[mw]=1kda)[指定为e10-0.5(1k)]组成的聚合物纤维材料。当与pe(图2)相比时,在这种聚合物上观察到较长的轴突,如由峰移位至pe的右边和对照底物峰所示。在不同底物上的施万细胞粘附和突起延伸的评估表明,与pe(图2b,图2c)相比,这种聚合物类似地促进这些方面。对神经再生必不可少的蛋白质吸附对于不同材料也是显著不同的(图3)。如图4所示,与pe膜相比,吸附于这种聚合物的三种ecm蛋白质的量明显较大。
在运动功能恢复研究中,与接受np-pe导管的小鼠相比,接受89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管的动物在足部基准角(fba)中示出显著的改善。在具有较小面积的原纤维组织的这种聚合物导管内形成的再生神经索内存在明显较多数量的轴突,不论在外壁中是否存在孔(图5)。与np-pe导管相比,有髓神经纤维的横截面积在所有导管中明显较大,并且有髓神经纤维占据该面积的较大的百分数。本发明的导管产生具有大量轴突、束状结构、大范围的神经纤维直径和极少的纤维组织的神经索,而np-pe导管含有少数(如果有的话)明显的轴突(图7)。用看起来稠密的纤维组织完全填充内腔。纵切片表明纤维基质在本发明的导管内比在np-pe内更早产生(图8)。
可以使用编织方法制造本发明的多孔nad。编织方法的许多变体对于本领域技术人员是已知的。通过进行编织图案的变化,可以调整所得的nad的整体机械性能以处理不同的医学需要。发现可用于产生耐扭结神经导管的常用编织图案被称为螺旋缠绕双轴编织。此外,可以将多种不同类型的纤维组合使用,以产生由不同聚合物组成的编织装置。仅使用那些具有式i的重复单元的聚合物,可以构建复丝装置,其中单根纤维的降解速率不同。可以将这种方法用于细微调整装置的降解和吸收特性。在另一实施方案中,可以将适合的药物并入单根聚合物纤维中。通过使用纤维的组合,各纤维负载有不同的药物,可以预想到宽范围的药物增强的nad,各自释放自定义的不同药物的混合物,以辅助“个体化用药”方法中的神经再生。使用不同纤维编织nad的概念是使装置的整体性能特征最优化的有利手段,并且在装置设计中提供迄今为止未认识到的柔性程度。使用多种不同纤维以产出编织nad的其它潜在应用为使衍生自生物聚合物(胶原、明胶、交联的藻酸盐等)的纤维与来自合成聚合物(例如,上述的酪氨酸衍生的聚碳酸酯)的纤维组合。在编织方法中,单根纤维彼此层叠,由此产生独特的混合结构,其性能可以通过单根纤维、其在编织构建中的相对比例和所用的编织图案的选择来细微调整。使用编织来构建管的程序是本领域中众所周知的(参见例如第8,106,014号美国专利)。
通过编织构建多孔nad。如本发明专利文件的附图和实例所示,编织导管在物理和机械性能方面提供优势,但是当编织与上述其它关键的设计策略(增强营养物生长的聚合物组成、使用聚合物库调整降解特性和控制孔隙率的涂层)组合时,才获得显著的整体性能增强。这些设计策略具有协同作用,所述协同作用先前未认识到并且导致观察到的增强的神经再生。
编织导管可以提供包括柔性和耐扭结和拉伸强度在内的期望的机械性能,所述机械性能是导管设计的重要标准,尤其对于高机动性区域中的大的神经间隙而言。为了避免挤压或再切断脆弱的再生神经,导管必须能够在不经历腔闭塞的情况下弯曲。本发明的编织导管在扭结测试中表现出此能力,其中导管在线上弯曲直至出现扭结(腔内径的减小)。对编织导管(由聚(dte碳酸酯)制造,缩写为e0000)的研究表明,与临床使用的
研究还示出,本发明的nad是耐受良好的并且不会引起强的炎症性宿主反应。在植入的本发明的nad周围形成纤维囊在可接受的限度内,所述限度表示最小的炎症性宿主反应。
本发明的nad具有严格控制的孔隙率水平。编织材料内的孔径必须在适于促进沿着装置的整个长度的有效营养物和氧交换、同时还用作对疤痕组织浸润的屏障的范围内。可以通过使用不同的编织方法和/或通过控制纤维直径来操控nad的孔径。然后,还可以通过水凝胶涂覆方法来操控总孔隙率。在示例性实施方案中,通过第一代小直径的纤维制造编织导管,所述纤维单独使用或缠绕在一起形成纱,并且装载在编织装置上。装置在心轴周围包裹纤维或纱以产生导管。可以将纤维或纱以各种编织图案编织在心轴周围。心轴的直径决定了腔的直径,并且纤维或纱的直径决定了导管壁的厚度。一旦可获得适合的纤维,可以在没有尺寸限制的情况下快速且可重现地制造编织导管。
可以将水凝胶涂层用于进一步细微调整nad的总孔隙率。由涂层方法引起的孔径的非限制性实例为约3μm-40μm。在没有水凝胶涂层的情况下,这些编织诱导的孔太大并且会使得不期望的纤维组织浸润进入nad的腔中。先前已知的编织神经导管缺少对孔径的控制是其无法引起临床上有用的神经再生的原因之一。本发明的水凝胶涂覆方法已经解决了编织方法的这种固有缺点。可以将各种已知的技术(包括浸涂)应用于涂覆本发明的nad。
来自天然来源或合成来源的各种水凝胶,包括例如基于多肽的水凝胶、基于多糖的水凝胶和基于石化产品的水凝胶,可以单独使用或彼此组合使用以用于涂覆编织nad。涂层材料的非限制性实例包括海藻酸、透明质酸和聚(丙烯酸)水凝胶。
在一些实施方案中,通过交联剂进一步使用于涂覆纤维管的水凝胶功能化。这在非交联的水凝胶是水溶性的或太脆弱而不能提供机械稳定的涂层时是重要的。交联剂的非限制性实例包括聚(二丙烯酸乙二醇酯)(pegda)、聚(乙二醇二缩水甘油醚)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺和二乙烯砜。产生有效涂层所需的水凝胶的量和交联程度取决于各种因素,包括编织nad的初始孔径、管的直径和长度、孔隙率的大小和水平,也可能取决于再生的具体神经。使水凝胶交联的方法可易于在文献中获得,并且在无需过多实验的情况下实践(参见,例如nilimanka,internationaljournalofpharmacyandpharmaceuticalsciences,2013,5(4),55-58;hennink等人,adv.drugdeliv.rev.2002年1月17日;54(1):13-36)。在一些实施方案中,用于涂覆nad的生物可吸收性水凝胶是交联的透明质酸(ha)。在一些实施方案中,交联剂为pegda。
与未涂覆的多孔管相比,多孔管的水凝胶涂层可以导致显著改善的神经再生。对由e1001(1k)(由89mol%脱氨基酪氨酰-酪氨酸乙酯(dte)、10mol%脱氨基酪氨酰-酪氨酸(dt)和1mol%聚(乙二醇)组成的共聚物)制造的导管的研究表明水凝胶涂层对神经再生的作用。在四类导管(未涂覆的、交联的透明质酸(ha)涂层、电纺的89mol%dte-10mol%dt-1mol%peg1k聚合物纤维涂层,以及电纺的89mol%dte-10mol%dt-1mol%peg1k聚合物涂层且随后用ha涂覆的组合)中,ha涂覆的导管在神经再生中均表现出明显更好的结果。未涂覆的编织导管表现出在束内的许多再生轴突,所述束是松散组织化的并且是大量的非神经组织。电纺涂覆的编织导管还表现出与非神经组织不一致的轴突生长,表明编织导管周围的电纺垫可能已经促进纤维组织浸润。
相反,ha涂覆的导管均表现出圆形且密集填充的神经索,所述神经索具有紧密填充的束和轴突。这些特征在涂覆有电纺纤维和ha的编织导管内再生的神经中不是重复的,其中观察到大量的纤维组织已经插入再生神经轴突和束内。此外,对于ha涂覆的编织导管的胫骨前肌(ta)肌肉重量恢复率明显比未涂覆的导管更高。此外,将神经传导通过缺陷和传导至神经再支配的肌肉群的电生理测量用于评估复合肌肉动作电位(cmap)。在导管群中,ha涂覆的编织导管具有最高的cmap振幅,并且在16周终点时约14%的cmap信号恢复。
在一些实施方案中,神经导管在其内腔中填充有生物可吸收性水凝胶。生物可吸收性水凝胶促进纤维基质的形成,所述纤维基质用作跨过神经间隙的物理桥并且提供用于细胞迁移跨越的结构。作为填充剂的水凝胶的非限制性实例包括衍生自层粘连蛋白、藻酸盐、胶原、透明质酸及其组合的水凝胶(参见,例如,verdú等人,restorativeneurology&neuroscience2002,20:169;ceballos等人,experimentalneurology1999,158:290-300)。在长的神经间隙的情况下,常需要多孔管,因为它们允许营养物、氧和废物沿着导管的长度交换,并且甚至允许血管浸润。然而,导管的孔隙率还允许非神经元纤维组织的浸润。因此,期望神经元组织与非神经元纤维组织之间的水凝胶填充剂有区别,与纤维变性组织浸润相比,促进更快的轴突再生。
因此,在一些实施方案中,通过细胞信号传导部分或神经突促进部分来增强用于填充管的内腔的水凝胶,其有助于轴突生长和适当的运动神经元靶向。此类神经突促进部分的非限制性实例包括人自然杀伤1聚糖的肽模拟物(m-hnk)、脑衍生神经营养因子(bdnf)、血小板衍生生长因子(pdgf)和神经胶质生长因子(ggf)。在一些实施方案中,神经突促进部分为人自然杀伤1聚糖的肽模拟物(m-hnk)。用于使神经突促进部分与水凝胶连接的程序在本领域是众所周知的,并且可以在无需过多实验的情况下进行实践。例如,可以使用如先前所述的edc化学,通过将人自然杀伤1聚糖的肽模拟物(m-hnk)移植于胶原上来制备m-hnk增强的胶原(参见,例如masand等人,biomaterials,2012,33:8353-62)。
另一方面,提供了治疗或修复外周神经损伤的方法,其包括植入本发明的神经导管。用于植入神经导管的方案可易于获得并且可以在无需过多实验的情况下进行实践(参见,例如rui等人,actabiomaterialia2012;8(2):511-518;deruiter等人,expneurol2008;211(2):339-50)。在示例性实施方案中,神经导管的两末端与损伤处形成的两个神经残端连接,以在其间存在的间隙上架桥。神经残端之间保留的神经导引的腔规定了用于再生轴突的方向并且避免任何不正确引导的生长,因此促进靶向再生(参见,例如第8,216,602号美国专利)。
另一方面,提供了用组织工程化(例如,实验室生长的)轴突预填充的神经导管。预填充的轴突通过用作向组织生长提供生物活性支持的种子来促进神经的再生。在植入患者体内之前,使用生物学组分和/或活的工程化神经组织预填充导管的概念具有大的潜力并且可以促进前所未有的长度的神经间隙的愈合。组织工程化神经移植物(teng)的使用已经被宾夕法尼亚大学和axoniamedical(kalamazoo,mi)所倡导。为了这种改革方法实现其全部临床潜力,需要将teng闭合在仔细最优化的nad内。维持在大的间隙上的营养物交换、机械性能和耐扭结,同时使延长的生物可吸收的时间最优化,是困难的挑战,任何目前可获得的合成神经导管迄今为止都未能令人满意地解决所述挑战。宾夕法尼亚大学和axonia的研究目前已经表明,与自身移植物相比,本发明的nad支持施万细胞的进入和宿主轴突沿着teng的延伸,并且导致神经再生的改善速率。用活的(工程化)神经组织预填充的本发明的nad的使用呈现了本发明的其它实施方案。
实施例
实施例1
导管制造
利用先前公开的程序(magno等人,jmaterchem20,8885,2010)合成由89.5mol%脱氨基酪氨酰酪氨酸乙酯[dte]、10mol%脱氨基酪氨酰酪氨酸[dt]和0.5mol%的mw为1kda的聚(乙二醇)[peg]组成的e10-0.5(1k)(图1)。使用浸涂(ksv浸涂机;ksvinstruments,inc.)技术制造内径为580mm的中空导管,其中将铁氟龙涂覆的心轴以恒速(40mm/min)浸入聚合物溶液中。对于无孔导管,使用在3ml二氯甲烷中含有900mg聚合物的溶液。对于无孔导管,使用450mg蔗糖晶体(筛选25mm-45mm)和450mg聚合物溶于3ml二氯甲烷中的溶液。在浸涂后,将心轴在真空中干燥过夜,并且将导管拉出以及切成5mm长度,以用于体内评估。对于多孔导管,蔗糖在水中浸出以产生多孔结构。还将可商购获得的pe管用作神经导管(5mm长,0.58mm内径;bectondickinson)。
体外评估
用脊髓神经元和施万细胞进行导管材料的体外评估。使用旋转涂覆有89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物(在四氢呋喃中的2.5%w/v溶液)或涂覆有pe的薄的自粘附膜的玻璃盖玻片,确定89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物和聚乙烯(pe)对神经突生长以及施万细胞粘附和延伸的作用。为了促进细胞存活和生长,用200μg/ml聚-l-赖氨酸(pll;sigma)涂覆盖玻片,然后用20μg/ml层粘连蛋白(invitrogen)涂覆。将胚胎的脊髓神经元分离和纯化以用于运动丰富的群体。根据公开的方案(honkanen等人,eurjneurosci26,953,2007),将施万细胞从p2新生儿的坐骨神经中分离和纯化,得到>95%的细胞对于s100β呈染色阳性的培养物。将细胞接种于盖玻片上(1.5×104个细胞/盖玻片)并且在37oc下用5%co2维持48小时。使用β-微管蛋白抗体(covance;1:500)和s100β(abcam;1:500)分别评估神经元和施万细胞的神经突和突起生长,并且使用alexafluor488二级抗体(invitrogen)使两种细胞类型显现。用hoechst33258染色剂(anaspec,inc.)进行核染色。使用imagej(nih)测量每个细胞的总的神经突/突起的长度。对于各个盖玻片,以双盲的方式分析10张随机选择的代表性图像,并且根据其长度划分神经突。
蛋白质吸附测定
评估89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物和pe膜上的三种细胞外基质(ecm)分子(层粘连蛋白[invitrogen]、纤连蛋白[invitrogen]和i型胶原[advancedbiomatrix])的蛋白质吸附的相对量。将通过压缩成型制备的89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物膜和pe膜装入96孔板中。将各蛋白质的70ml溶液(20mg/ml,在ddh2o中)添加至各个孔并且使其在37oc下粘附至膜,持续48小时。在去除上清液后,各个孔被彻底清洗并且用含有胎牛血清的培养基封闭。在清洗后,将针对各蛋白质的一级抗体(millipore;1:100)在室温下添加,持续1小时。重复整个清洗过程,并且将缀合二级辣根过氧化物酶(hrp)的抗体(millipore;1:200稀释)在室温下添加,持续1小时。再次重复清洗过程,并且将鲁米诺(invitrogen)添加至各个孔。在5分钟后,使用tecan平板读数器以1000ms的积分时间和500ms的稳定时间读取各个孔的发光。将蛋白质的量归一化于对照表面,即,组织培养聚苯乙烯。
体内评估
手术方法和动物组。依据研究动物护理及使用委员会(iacuc)进行所有实验。通过腹膜内注射氯胺酮(80mg/kg)与甲苯噻嗪(12mg/mg)混合物使雌性c57bl/6j小鼠(年龄为3个月)麻醉。通过手术暴露左侧股神经,并且以邻近神经的分叉约3mm的距离进行神经切断。将神经的切割端插入盐水填充的神经导管中并且经10-0尼龙缝合(ethicon)而固定在各个末端上,以使在近端残端与远端残端之间存在5mm的间隙。用创缘夹闭合切开的皮肤,将创缘夹在手术后2周移除。将接受三种导管类型的三个动物组(每组8只动物)在15周的时段内进行对比,所述三种导管类型包括p-e10-0.5(1k)、np-e10-0.5(1k)和np-pe。
运动功能恢复
使用单帧运动分析方法(sfma)评估功能恢复。训练40只动物以在植入导管前进行平衡木行走试验。在手术后,每周进行这种试验,直至实验的终点。使用高速摄影机(a602fc;basler)收集小鼠行走的后视视频。使用simi-motion(simirealitymotionsystems)从单个视频帧中分析后肢在正常步态周期内的运动。测量足部基准角(fba)40以评估四头肌的功能。此外,测量伸长肢体比(plr)40,同时在握笔试验内小鼠进行随意运动。
对各动物的fba和plr计算恢复指数(ri)以提供功能恢复的相对测量值。使用下式以百分数计算ri:
其中x第0周、x第1周和x第y周分别为在第0周(fba或plr)的完整值、损伤后第1周时测量的值以及在第y周时测量的值(其中y为研究的终点,第15周)(irintchev等人,eurjneurosci22,802,2005)。100的ri值表明股神经的完全恢复。
外植神经的组织形态分析
在16周时用4%多聚甲醛灌注后,从动物中切开股神经并且根据标准方案进行形态分析。
用imagej测量每个神经横截面的有髓鞘的轴突的总数量、原组织面积、再生索的横截面积以及神经再生%。在各个切片的随机样品中测量轴突(在髓鞘内部)和神经纤维(包括髓鞘)直径。
在体内1周时神经渗出物的蛋白印迹分析
为了评估神经导管内施万细胞的存在,在神经渗出物上进行施万细胞标志物的蛋白印迹分析(kaewkhaw等人,glia59,734,2011)。将导管(n=3)植入小鼠股神经中,保持1周,此后处死动物,并且将导管内的神经渗出物移除且在sds-page凝胶(invitrogen)上跑电泳以及转移至pvdf膜(biorad)。将膜封闭并且用针对s100β(1:1000)、胶质原纤维酸性蛋白(gfap,1:50,000)、gapdh(1:1000)和β-肌动蛋白(1:5000)(abcam)的抗体探测,以及通过二级抗体的hpr发光来检测。进行光密度分析以使用imagej(nih)从蛋白印迹中量化gfap、s100β和肌动蛋白的带密度。量基于肌动蛋白负载对照而归一化。
纤维蛋白基质形成的形态分析
在植入后2周时处死动物(在每种条件下n=3),以显现纤维蛋白链的存在。将神经外植体根据标准方案而后固定在四氧化锇中并且包埋在树脂中。切下神经的纵向1-mm厚的段,并且用蒸馏水中的1%甲苯胺蓝/1%硼砂染色。将常规的光学显微镜用于显现纤维蛋白基质的存在和方向。
统计分析
本研究设计成使得89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物和pe的聚合物以2d和导管方式对神经再生的作用进行对比。使用利用单因素方差分析的方差分析,然后用tukey检验进行事后有计划的比较。在p<0.05时,差异被认为是显著的。
结果
体外表征
基于sem显微照片(图2a、图2d、图2c、图2f),pe和89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物无孔导管均具有类似的外观。多孔的89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管具有互相连接的孔结构,并且导管的孔隙度和平均孔径分别为55.2%-1.2%和35.7mm-9.0mm(图2b、图2e)。由e10-0.5(1k)制造的导管是不透明的、刚性的(在5mm长时),具有580mm的内径和680mm的外径。所有导管在整个研究中保持完整。材料和细胞研究在导管类型之间表现出不同的性能。在涂覆有pll和层粘连蛋白的89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物和pe的2d膜上评估运动神经元对不同材料的反应。当与pe相比时,在89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物上观察到较长的轴突(图3),如通过89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物的峰移位至pe的右边和对照底物峰所示。在不同底物上的施万细胞粘附和突起延伸的评估表明,与pe相比,89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物相似地促进这些方面(图3b,图3c)。对神经再生必不可少的蛋白质吸附对于不同材料也是显著不同的(图4)。与pe膜相比,吸附于89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物的三种ecm蛋白质的量明显较大。
体内评估
运动功能恢复。使用完全确立的方法(irintchev等人,eurjneurosci22,802,2005),通过fba和plr的sfma量化功能恢复(图5a-图5d)。在第8周,与接受np-pe导管的小鼠相比,接受89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管的动物在fba中表现出显著的改善(图5e)。不管是否使用了多孔导管或无孔导管,早在2周时,也通过plr表明89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物治疗的动物的运动功能的改善。至多15周,收集的结果表明,用89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管的动物的plr值以比用np-pe处理的动物更快的速率达到手术前的值。
ri的计算还支持,由89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物促进的恢复相对于由pe导管促进的恢复是增强的。接受89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管的动物对于fba实现了接近50%的ri值(图5f),而对于plr实现了100%的ri值(图5h)。接受np-pe导管的动物表现出fba的平均ri值为-26%,并且plr的平均ri值为23%。与从接受np-pe导管的动物计算的ri值的变化相比,在每一个89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物组内的严格分组的动物表明一致的表现(performance)。总之,功能结果表明,89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管的使用导致功能性运动的显著恢复,与89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管孔隙率无关。
组织形态分析
在研究的终点,分析神经的组织形态特征(图6)。在具有较小面积的原纤维组织的89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管内形成的再生神经索内存在明显较多数量的轴突,不论在外壁中是否存在孔。与np-pe导管相比,有髓神经纤维的横截面积在所有89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管中明显较大,并且有髓神经纤维占据该面积的较大百分数。在各个条件下,后固定在四氧化锇中的1mm厚横截面的代表性100倍图像以及纤维直径分布示于图7中。89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管产生具有大量轴突、束状结构、大范围的神经纤维直径和极少纤维组织的神经索,而np-pe导管含有少数(如果有的话)明显的轴突。用看起来稠密的纤维组织完全填充内腔。
导管材料之间的神经修复的早期差异
纤维蛋白索的初始形成有助于支持轴突向内生长和施万细胞浸润,并且对于在早期时间点确定使神经索再生的最终结果是重要的。我们发现,可以在89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管中于植入后2周观察到纵向的纤维蛋白链(如图8a中的黑色箭头所示),但是在np-pe导管中未观察到(图8a、图8b),表明初始形成横跨神经间隙的纤维蛋白索(zhao等人,restorneurolneurosci5,197,1993)。此外,植入后1周,神经渗出物内的施万细胞标志物的蛋白印迹分析表明,与从nppe导管内取出的渗出物相比,在从89.5mol%dte-10mol%dt-0.5mol%peg1k聚合物导管中取出的渗出物中有更丰富的s100β和gfap免疫反应活性(图8c、图8d)。
实施例2
材料及方法
聚合物合成及表征
使用酪氨酸衍生的聚碳酸酯进行研究,以经由熔融挤出产生纤维。选择单个聚合物组成用于研究,所聚合物组成为聚(脱氨基酪氨酰-酪氨酸乙酯碳酸酯),被称为聚(dte碳酸酯)并且缩写为“e0000”。聚(dte碳酸酯)在体内降解得非常缓慢,在显现分子量显著变化之前需要一年。由聚(dte碳酸酯)组成的导管因此在我们研究的时间跨度内将仅经历可忽略的降解,并且在导管性能中有效地消除作为变量的降解。
采用先前公开的程序(ertel等人,jbiomedmaterres1994;28(8):919-30),合成和纯化聚(dte碳酸酯)。使用凝胶渗透色谱法(gpc,waterscorporation,milford,ma),相对于聚苯乙烯标准在作为流动相的含有0.1%三氟乙酸的二甲基甲酰胺中,测定分子量(数均分子量,mn,重均分子量,mw)和多分散指数(pdi)。如前述那样(engelberg等人,biomaterials1991;12(3):292-304),测定聚合物的玻璃化转变温度(tg)。用于制造编织导管和浸涂导管的聚(dte碳酸酯)具有167,700da的mn,并且pdi为1.47以及tg为96.5℃。使用e1001(1k)制造电纺涂层,所述e1001(1k)是由89mol%脱氨基酪氨酰-酪氨酸乙酯(dte)、10mol%脱氨基酪氨酰-酪氨酸(dt)和1mol%1kda聚(乙二醇)(peg)组成的共聚物。e1001(1k)使用先前公开的程序(magno等人,journalofmaterialschemistry2010;20(40):8885-8893)合成,具有239,000da的mn,并且pdi为1.6以及tg为97.0℃。
编织导管制造
使用60μm厚的工业聚丙烯(pp)原型纱(atextechnologiesinc,pinebluff,nc)初始实施不同的编织设计,以确定编织图案和纤维密度对导管孔径和机械性能的作用。利用以下方法制造导管:a)单根纤维编织:24个导纱器(carrier),1根pp纤维/导纱器,2/2编织;b)三轴编织:24个导纱器,3根合股pp纤维/导纱器+4根纵向三轴纤维;c)三根纤维编织:24个导纱器,3根合股pp纤维/导纱器,2/2编织;d)三根纤维编织:24个导纱器,3根合股e0000纤维/导纱器,2/2编织。
通过聚(dte碳酸酯)纤维的管状编织来制造用于体外和体内试验的编织导管。将聚(dte碳酸酯)使用3/8英寸单螺杆挤出机(微型挤出机,来自randcastle,cedargrove,nj)熔融挤出,以得到约60微米的目标直径的纤维,并且使用激光测微器(z-mike1200系列,groβ-umstadt,德国)监测。最终的挤出纤维的直径为80μm至110μm,并且制造后,mn为138,550da以及pdi为2.05。然后将三根聚合物纤维合股在一起以形成复丝纱,并缠绕在编织纺锤体上。将配备有24个导纱器的herzogng1/24-120管状编织机器(herzogmaschinenfabrik,oldenburg,德国)用于在外径为1.5mm的铁氟龙心轴(appliedplasticsco.,inc.,norwood,ma)上编织导管。在编织后,将导管切成所需长度,并且使用热切割仪(zts20,azzangl,germany)对末端切边和密封。通过在环己烷(1×)、去离子水中的0.5体积%tween20(1×)和去离子水(5×)中顺序洗涤并同时超声来清洁导管。
浸涂导管制造
使用先前公开的程序(ezra等人,tissueengparta2013),经由浸涂由20%(w/v)聚(dte碳酸酯)在二氯甲烷中的溶液沉积在1.5mmod铁氟龙涂覆的心轴上来制造导管。
电纺
使用高压电源(gammahighvoltageresearchinc.,omahabeach,fl)和经由20容量规格x3’的铁氟龙管与钝头23g不锈钢针管(两者都来自hamiltoncompany,reno,nv)连接的注射泵(kdscientific,holliston,ma),在电纺设备中的旋转心轴上的编织导管上形成第二电纺层。使用1:25比率的反式-4-羟基-l-脯氨酸(thyp):89mol%dte-10mol%dt-1.0mol%peg1k聚合物在冰乙酸(fisherscientific,pittsburgh,pa)中制备89mol%dte-10mol%dt-1.0mol%peg1k聚合物的10%(w/v)聚合物溶液,以从电纺纤维中消除小珠形成。持续进行电纺,直至在编织导管周围形成300μm厚的涂层。在通风橱中完全干燥导管以去除残余溶剂。
透明质酸(ha)水凝胶涂层
在1%(w/v)无菌的硫醇修饰的透明质酸溶液(hystem)中浸涂无菌的编织导管,然后通过在超声水浴中的无菌1%(w/v)聚(二丙烯酸乙二醇酯)(pegda)溶液(两者均来自glycosanbiosystems-biotime,inc.alameda,ca)中浸涂而立即交联。在每一浸涂步骤后,将导管干燥5分钟,并且将过程重复总共五次。还通过首先在上述编织导管上沉积电纺层,然后在透明质酸和pegda溶液中浸涂,从而制造具有双层电纺丝和ha涂层的导管。将ha涂覆的导管在层流净化罩中干燥过夜并且以干燥状态植入,以用于体内实验。
灭菌
为了减少生物负载,在体内使用之前,将所有导管暴露于uv照射,持续40分钟。
扫描电子显微镜(sem)
使用sem(amray1830i,20kv)评估溅射涂覆(scd004溅射涂覆仪,用au/pd在30毫安下持续120秒)的试样的孔径和形态。使用imagej(来自国家卫生研究院的公用软件)在sem图像上测量导管的孔径、编织角和壁厚以及电纺垫的纤维直径。在垂直于编织物的纵轴的线与平行于接近于管轴而对齐的纤维群的线之间测量编织角。
机械测试
使用syntec5/d机械测试仪通过压缩试验和三点弯曲试验,以及使用mtstytrontm250微力测试系统(两者均来自mts,edenprairie,mn)通过拉伸试验,表征编织导管的机械性能。将样品通过在pbs中于37oc下孵育过夜进行预处理,并且在从孵育箱中取出后立即进行测试。以6mm/min的横向十字头速度在1cm长的导管上进行压缩试验,直至端点位移等于初始导管直径的60%。由力对位移曲线中的线性区域的斜率计算压缩刚度。
在放置于弯曲设备的下保持器梁上的1.5cm长导管上进行三点弯曲试验,其设置1cm间距。将第三点以10mm/min的十字头速度从导管中点的上方下降。对于拉伸试验,将3cm长的导管固定在夹具中,并且夹具距离为2cm以及以20mm/min的速度拉伸,直至失效。通过在柔性的0.6mm直径的线(appliedplasticsco.,inc.,norwood,ma)上使3cm长的导管弯曲直至出现扭结来进行扭结试验,其被定义为在弯曲点处在视觉上可检测的导管外直径的减小。使通过编织和浸涂制造的聚(dte碳酸酯)导管以及可商购获得的
体内评估
在罗格斯动物护理及设施委员会和研究动物护理及使用委员会(iacuc)的核准方案下进行所有实验
编织导管的皮下植入
通过腹膜内注射氯胺酮/甲苯噻嗪(分别为75mg/kg,10mg/kg)麻醉重量为250g-300g的雄性sprague-dawley大鼠(charlesriverlabs,wilmington,ma),并且将编织导管植入动物后背上的四个皮下袋中。在植入后3周处死动物,并且将导管相对于周围的结缔组织外植(explant)。在外植后,立即将导管放在10%缓冲福尔马林中,然后进行组织处理和石蜡包埋以用于组织学染色。制备6μm切片并且使用标准方法用苏木精和曙红(h&e)染色。
在1cm大鼠坐骨神经模型中原位植入导管:
通过腹膜内注射氯胺酮/甲苯噻嗪(分别为75mg/kg,10mg/kg)麻醉重量为200g-250g的雌性lewis大鼠(charlesriverlabs,wilmington,ma),并且使用公开的方案植入导管。对于导管组,取出5mm的坐骨神经切片,并且使神经残端收缩以形成10mm间隙。然后在各末端上使用两个9-0神经束膜缝合,将无菌导管(1.2cm长和1.5mm直径)缝合于神经残端,维持残端之间的10mm间隙。在自身移植物的情况下,将1cm神经片段取出,翻转,并且在各末端上使用三个至四个9-0缝合而缝合回间隙中。
电生理学:
通过在足背肌肉和足底肌肉(它们为坐骨神经的腓骨支和胫骨支的最远端靶标)处测量复合肌肉动作电位(cmap),在一般麻醉下评估神经损伤后电生理功能的恢复。使用vikingquestemg系统(natusmedicalinc.,sancarlos,ca)在手术前立即记录cmap以及在手术后每4周记录cmap。将皮下eeg针管用作记录电极、参比电极和接地电极。将参比电极和接地电极分别放置在大鼠的手术侧面上的第5跖骨和愈合根骨侧面。将记录电极皮下地插在第3跖骨上的足背肌上以用于腓骨的cmap,以及皮下插在足底肌上以用于胫骨的cmap。使用双极刺激电极在直接于胫骨后部的裸关节水平上皮下地刺激坐骨神经。局部调整电极以产生最大的cmap振幅,并且递增地增加刺激以产生超大的反应。对各动物计算从cmap信号开始至峰顶所测量的三个连续cmap振幅以及三个连续潜伏期的平均值,并且在相同的治疗组中对动物求得平均值,以用于绘图。
外植神经的组织形态分析
在手术后六十周,使用氯胺酮/甲苯噻唑麻醉来深度麻醉大鼠,暴露手术侧面上的坐骨神经,并且通过使神经在trump固定剂中浸渍30分钟进行神经的原位固定。然后如先前所述的那样,获取神经并且进行处理。通过对各个1μm厚的神经切片的随机100倍图像计数最少500个有髓鞘的轴突以及对神经切片重复三次进行平均,使用imagej1.43u软件计数每个神经横截面上有髓鞘的轴突的总数目。在10倍图像上测量原组织面积、有髓鞘的轴突的横截面积以及神经再生%,并且用imagej1.43u软件分析。在各个切片的三个随机100倍样品中测量轴突(在髓鞘内部)和神经纤维(包括髓鞘)直径。
肌肉获取
在神经获取时,通过co2窒息处死动物。通过使肌肉组织经由膝盖暴露于脚踝纵向皮肤切口,立即获取两个后肢的胫骨前肌和腓肠肌。获取从原始至插入的肌肉并且用电子天平称重。
统计方法
将本研究中的数据表示为平均值±se,除非另外指明。将单因素方差分析(anova)检验与dunnett事后检验用于本研究中以评价显著差异。将统计显著性定义为p<0.05。
结果
导管制造及物理表征
通过改变细丝的数目以及使用可商购获得的不可降解的聚丙烯原型纤维合股成纱,从而构建三种导管原型。所得的导管实际上在物理特性(例如孔径和编织角度)中示出本质差异。由三纤维(three-fiber)纱构建的2/2编织物具有最有利的机械特征,表现出优异的耐扭结和弹性变形。三轴编织物具有最小的孔径,是更硬的,并且在变形时具有不需要的形状记忆。由于孔径和机械性能的组合,选择传统的2/2编织方法,以使用聚(dte碳酸酯)纤维更详细地进行探索。用80μm至110μm直径的纤维制造聚(dte碳酸酯)编织导管。所得的导管具有65μm±19μm的平均孔径和1.5mm内腔直径。
编织导管的机械对比
对于修复高机动性区域中的大的神经间隙,柔性和防止扭结是重要的导管设计标准。我们对比了具有183μm±15μm厚的壁的编织聚(dte碳酸酯)导管、无孔浸涂聚(dte碳酸酯)导管与由胶原i组成的临床使用的
为了评价经受弯曲同时维持敞开的腔的能力,进行扭结试验以评价聚(dte碳酸酯)导管在出现任何腔闭塞前可以弯曲的角度。使导管在线上弯曲,直至出现扭结,所述扭结为腔内直径的减小。对于浸涂导管和
这些结果表明,我们的编织导管高度抵抗腔闭塞,并且当应用于高弯曲的区域时更有可能维持敞开的腔。编织导管允许的大弯曲角度是生理学相关的;肘和手指关节通常以完全超过90°的高角度弯曲。已经报告了用于大鼠坐骨神经损伤模型中的22mm长的胶原管在膝关节附近由于破裂而失效,这归因于管状构造的柔性不足。
外周神经还经历由肢体运动和肌肉收缩产生的拉伸力、压缩力和剪切力。外周神经在原位处于拉伸负载并且在其余位置经历约11%应变。同时耐受11.7mpa的最大拉伸应力。因此,用于在外周神经间隙上架桥的任何神经导管应当能够在多至11.7mpa的负载下可逆地伸长。我们发现这种负载在聚(dte碳酸酯)编织导管的应力-应变曲线的线性部分内,其在这种负载下表现出17%-22%的可逆应变,足以经受肢体运动的应力。
在横向压缩时,浸涂导管对所施加的负载显示出最大的抵抗性,但是当压缩至内直径的60%时物理变形,而在去除压缩负载后,编织导管立即重新获得其原始形状。
宿主反应
进行小的对照研究,以确保导管材料不会引起强的炎症性反应,所述炎症性反应可以影响在随后的神经再生研究中获得的结果。为了评估大体的组织反应,将聚(dte碳酸酯)编织导管植入成年大鼠后背上的皮下袋中。3周后,取出导管并且进行h&e组织结构。切片表明在导管周围预期形成纤维包膜(capsule)。包膜组织被松散地组织化,并且缺少高浓度的炎症细胞,表明对聚(dte碳酸酯)编织导管的宿主反应是最小的,并且与在对酪氨酸衍生的聚碳酸酯家族中的聚合物的宿主反应得到的先前发现相一致。
第二涂层
h&e染色也表明周围组织粘附至导管材料,渗透穿过孔并且进入聚(dte碳酸酯)导管腔内。已经研究了导管孔径对神经再生结果的作用,尽管这种关键方面的结果和解释广泛地变化,但是导管的最优孔径报告为5μm至30μm,以能够使营养物和废物扩散并且使纤维性浸润和炎症细胞浸润最小化。聚(dte碳酸酯)编织导管具有20μm至140μm的孔。由于h&e染色切片表现出细胞浸润入编织导管,所以我们开发出临时的微米或纳米屏障涂层,所述屏障涂层允许营养物交换但是降低非神经细胞浸润入导管且中断再生的能力。
探索了三种导管涂层:涂覆后经脱水的由交联的透明质酸(ha)组成的水凝胶涂层,涂覆于导管表面的电纺的89mol%dte-10mol%dt-1.0mol%peg1k聚合物的层,以及电纺层随后用ha涂覆的组合。我们使用了高分子量且pegda交联形式的ha,我们发现这样的ha排斥成纤维细胞的粘附。pegda交联的ha水凝胶被报告在体内稳定4周至8周,但是据我们所知还未以这种方式用作神经导管涂层。
未涂覆的编织导管上的微孔的平均尺寸为65μm±19μm,并且二次涂覆方法在这些孔上提供了变化的覆盖程度。薄的ha涂层在其脱水状态时是无孔的,并且涂覆在编织纤维上以及孔上。电纺层具有292μm±39μm的平均厚度以及0.26μm±0.06μm的纤维直径和2.02μm的孔径,用方程式计算各向同性的近平面网络中的平均的孔半径,由sampson等人推导出,假设孔比例为0.85。对于电纺和ha涂覆的导管,使导管经超声处理同时浸涂,这允许水凝胶扩散通过电纺纤维垫,并且完全涂覆在垫的纤维周围以及导管下面,以产生明显的无孔屏障。在用ha水凝胶涂覆后,电纺层收缩至54μm±9μm的最终厚度。压缩、弯曲和拉伸试验表明,这些涂层未破坏编织导管的机械优势。
大鼠坐骨神经的再生评价
为了评估支持神经再生的基本能力,在充分描述的1cm间隙大鼠坐骨神经损伤模型中测试聚(dte碳酸酯)编织导管。治疗组包括未涂覆的编织导管(n=7只动物/组),涂覆有ha的编织导管(n=7),涂覆有电纺的89mol%dte-10mol%dt-1.0mol%peg1k聚合物的编织导管(n=4),顺序地涂覆电纺的89mol%dte-10mol%dt-1.0mol%peg1k聚合物、涂覆ha的编织导管(n=4)。使用在损伤位点内反向的自身移植物的对照组(n=7),并且在16周后收集所有组的再生神经。
外植神经的组织形态分析
来自导管中心的再生的神经片段的切片表明,所有条件支持轴突的再生,但是观察到显著的变化。未涂覆的编织导管内的再生组织表现出在松散组织化的束内的许多再生轴突。在导管内观察到大量具有纤维外观的非神经组织,所述导管在再生神经外面以及插入位于再生神经外周的束之间。在具有电纺纤维涂层的编织导管内再生的神经上记录了类似的特征。电纺涂覆的编织导管中的神经索在轴突区域与周围组织之间存在边界时尺寸更小并且可变化;一些样品具有松散的神经束,而在其它样品中,束更加紧密地堆积,并且神经索被松散排列的非神经组织层包围。这种结果是令人惊讶的,并且表明编织导管周围的电纺垫可以促进纤维组织浸润。
相反,ha涂覆的导管全部均显示出圆形且致密堆积的神经索,所述神经索具有紧密堆积的束和轴突。ha涂覆的导管内的再生神经全部似乎均已经形成了神经束膜层,其在导管内的再生神经与纤维组织之间形成明显边界。这些特征在涂覆有电纺纤维和ha二者的编织导管内再生的神经中未能重复,其中观察到大量的纤维组织已经插入再生神经轴突和束内。正如所期望,自体移植物内的再生神经被成熟的神经束膜高度组织化。
组织形态表征表明,有髓鞘的区域或由神经轴突占据的区域在未涂覆的编织导管中是最大的,其与自体移植物相当。ha涂覆的导管表现出第二最大的有髓鞘的区域,随后是电纺纤维涂覆的导管和ha涂覆的导管,最后是仅涂覆有电纺纤维的导管。相反,轴突密度在ha涂覆的导管中最大并且在未涂覆的编织导管中最小,证实了ha涂覆的导管含有致密的再生神经索,而未涂覆的编织导管具有大的但松散堆积的神经索。通过测量g-比率而对轴突髓鞘形成的评价表明,最小的g-比率存在于自体组中,并且所有其它组明显比自体组更大,但是彼此相等。与自体移植物相比,ha涂覆的导管具有在每单位面积上堆积的较大数量的轴突,即使这些轴突较不成熟(较大的g-比率、更薄的髓鞘),如所预期的。在再生过程内,ha涂覆的导管组中的轴突会似乎更成熟,以实现更快的神经传导以及改善的再生结果。
肌肉重量
在坐骨神经对切后,胫骨前肌(ta)和腓肠肌萎缩以及肌肉重量的重新获得表示恢复。从两个后肢获取这些肌肉,并且在16周恢复期的终点称重。自体移植物的肌肉重量恢复是最大的,随后是ha涂覆的编织导管。ha涂覆的编织导管的ta肌肉重量恢复明显比未涂覆的导管更高。其余导管组的ta和腓肠肌肉重量恢复是相等的。ha涂覆的编织导管的改善的ta肌肉重量恢复支持神经组织结构的发现,其中增强的再生与限制纤维组织浸润程度和在这些导管上形成神经束膜层的能力相对应。
电生理学
为了评价功能神经再生,通过记录复合肌肉动作电位(cmap)的超大振幅以及腓神经和胫神经的潜伏期,评价神经传导通过缺陷和传导至神经支配恢复的肌肉群的电生理测量。对于胫骨和腓骨cmap,在第8周检测自身移植物的最早期的手术后cmap信号,以及在第12周检测导管组的最早期的手术后cmap信号。在16周终点时自身移植物组中恢复37%的cmap信号,这是在治疗之间显示的最大振幅。在导管群中,ha涂覆的编织导管具有最高的cmap振幅,并且在16周终点时恢复约14%的cmap信号。
在cmap潜伏期与振幅之间的负相关中,功能再生的改善是明显的。因此,自身移植物组在16周时具有最低的腓骨和胫骨潜伏期,表明更快速的信号传导。观察到的潜伏期值对于编织导管组而言是相等的,除了es涂覆的导管以外,所述es涂覆的导管显示出更长的潜伏期,与该组的组织结构中观察到较少轴突和较大的g-比率相一致。
电生理学支持组织结构,表明损伤后阻碍神经恢复的孔隙率和细胞浸润的主要作用。可能最令人惊讶的是,具有或不具有ha的es层对非神经组织浸润的负作用。本研究发现,当作为涂层应用于导管时,这些导管在整个垫中变得富含纤维组织。可能的是,由垫提供的大量的细胞友好表面区域压倒ha的细胞排斥性质。此外,由于连续暴露于体内环境,松散的垫还可以促进组织浸润。导管材料,聚(dte碳酸酯)和89mol%dte-10mol%dt-1.0mol%peg1k聚合物,也表现出对细胞粘附和蛋白质吸附是友好的。
- 还没有人留言评论。精彩留言会获得点赞!