与肝脏脂肪变性相关的排卵过少的治疗的制作方法
本发明涉及一种用于治疗或预防pcos和pcos类似症状的方法和组合物,包括低排卵率造成的生育能力低下的治疗或预防,所述低排卵率与青春期少女或育龄妇女患有的与肝脏脂肪变性相关。
背景技术:
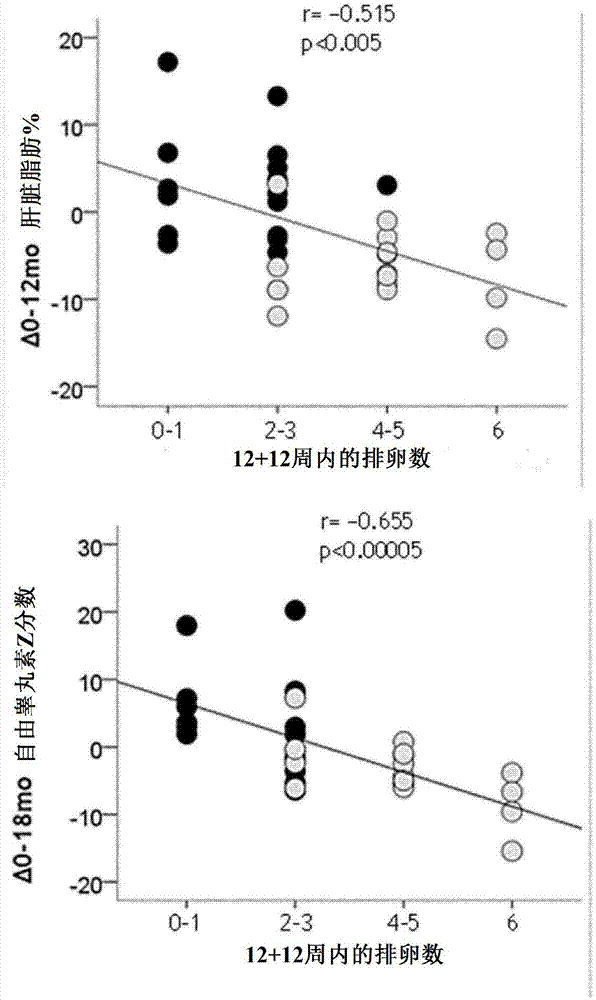
高胰岛素血症性雄激素过多是导致诊断为多囊卵巢综合症(pcos)的症状,是青春期少女患有多毛症、痤疮、皮脂溢和月经失调的最常见的原因。1术语‘高胰岛素血症性雄激素过多’可以代替术语‘多囊卵巢综合症’,这一点被美国国立卫生研究院(nih)的研究小组批评为聚焦于诊断该综合症的标准是既不必要也不充分的。卵巢雄激素过多似乎最常起源于脂肪组织中,特别是肝脏中,绝对的或相对的脂肪过剩,进而将导致胰岛素血症和促性腺激素分泌的提高。2,3另外,低排卵雄激素过多是女性生育能力低下的主要原因,其也与肝脏脂肪变性有关,而与肥胖无关。对于青春期少女患有的高胰岛素血症性雄激素过多症没有被认可的疗法。主要建议是通过生活方式措施降低身体肥胖。4,5广泛认可的一种做法是增加口服的雌孕激素避孕药(oc)。5,6对于那些并不是性活跃的雄激素过多的女孩,另一种方法是增加胰岛素增敏药物。7,8迄今为止,对这两种方法在患有雄激素过量的女孩中的比较研究表明,胰岛素增敏赋予了更多正常化的影响,包括对内脏的肥胖标志物、低级别炎症和心血管健康,以及作为细胞老化标志物的白细胞端粒长度。9-12然而,由于被测试的药物(如氟他胺和醋酸环丙孕酮)在许多国家都不可用,这些数据具有有限的实用性。5,9,10技术实现要素:本发明公开对广泛认可的oc和那些新的增敏疗法的效果进行比较的首次随机研究,所述新的增敏疗法涉及在服用或未服用口服避孕药的患有高胰岛素血症性雄激素过多症的青春期少女中施用低剂量组合的螺旋内酯甾酮-吡格列酮-二甲双胍(spiomet)。意外地发现,与以往研究中报道的替代胰岛素增敏疗法的研究效果相比,本发明的spiomet疗法,在更大程度上降低了内脏和肝脏的脂肪含量。另外,在治疗后一年,没有观察到本发明的spiomet疗法对于内脏和肝脏的积极效应发生逆转。这一发现特别令人感兴趣,内脏,特别是肝脏脂肪在pcos的表型中产生关键作用。本发明的疗法对于患有与肝脏脂肪变性相关的雄激素过多(pcos)的青春期少女或年轻女性的排卵率具有持续的显著效果,并且,在治疗结束后,这种积极效果也持续存在。因此,本发明的主要目的是有助于pcos和pcos类似症状的治疗,包括青春期少女或育龄妇女患有的由与肝脏脂肪变性相关的低排卵率造成的生育能力低下的治疗或预防。本发明的第一方面是一种药物组合物,包括螺旋内酯甾酮、吡格列酮和二甲双胍,用于治疗pcos和pcos类似症状,包括青春期少女或育龄妇女患有的由与肝脏脂肪变性相关的低排卵率造成的生育能力低下的治疗或预防。本发明的另一方面是一种治疗pcos和pcos类似症状的方法,包括青春期少女或育龄妇女患有的由与肝脏脂肪变性相关的低排卵率造成的生育能力低下的治疗或预防,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的组合施用。本发明的再一方面是一种药物传送形式,优选口服传送形式,在所述传送形式的每个个体单元中包括螺旋内酯甾酮、吡格列酮和二甲双胍。更优选所述传送形式的每个个体单元,优选口服传送形式,包括螺旋内酯甾酮、吡格列酮和二甲双胍中的每一个的每日所需剂量。详细描述附图说明图1:与治疗中肝脏脂肪的变化有关的在治疗后12+12周内的推断排卵数,以及与睾丸甾体血症治疗前后的变化有关的在治疗后12+12周内的推断排卵数。来自于oc女孩们(n=17)的结果以黑色圆圈表示,来自于spiomet女孩们的结果以白色圆圈(n=17)表示。p和r值来自于皮尔森相关系数。图2:接受了12个月的oc或spiomet治疗的患有pcos的青春期女孩的月经史、唾液孕酮和推断排卵的具有代表性的治疗后范例。数据是在治疗后的3-6个月之间的12周(加两周的月经史)的两个时间窗口中收集的,以及再一次在治疗后的9-12个月。具有相同月经史的女孩可能有明显不同的排卵率。图3:接受了12个月的oc(黑色圆圈,n=17)或低剂量spiomet(白色圆圈,n=17)治疗,并在随后保持12个月不治疗的患有pcos的青春期女孩的肝脏脂肪和自由雄激素血症z分数。对于肝脏脂肪,oc与spiomet具有相反的作用;和spiomet相比,oc更快地降低了自由雄激素血症,但随后具有更快的反弹。结果表示为平均数和sem。p值是指子群(0-24个月)间的差异。x轴上的符号(*p<0.05,&p<0.01,#p<0.001)是指0-6个月之间、12-18个月之间的差异性变化。图4:是表示用于治疗或预防青春期少女患有的由与肝脏脂肪变性相关的低排卵率造成的生育能力低下的本发明的治疗方法的示意图。图5:是表示用于治疗或预防育龄妇女患有的由与肝脏脂肪变性相关的低排卵率造成的生育能力低下的本发明的治疗方法的示意图。图6:是表示实施例1的研究过程的流程图。图7:是表示患有多囊卵巢综合症的青春期女孩的治疗后排卵的极端模式。内容在本发明中,螺旋内酯甾酮是指具有如下所示结构的合成甾体化合物及其衍生物。在大多数国家,螺旋内酯甾酮在被称为的药物制剂中销售。螺旋内酯甾酮的结构式为:螺旋内酯甾酮的系统名称是:7α-(乙酰硫基)-3-氧代-17α-孕甾-4-烯-21,17-木香内酯,或17-羟基-7α-巯基-3-氧代-17α-孕甾-4-烯-21-羧酸,γ-乙酸乙酯在本发明中,吡格列酮是指具有如下所示结构的噻唑烷二酮类化合物及其衍生物。在大多数国家,吡格列酮在被称为的药物制剂中销售。吡格列酮的结构式为:吡格列酮的系统名称是:(rs)-5-(4-[2-(5-乙基吡啶-2-基)乙氧基苄基]噻唑烷-2,4-二酮。在本发明中,二甲双胍指具有如下所示结构的化合物及其衍生物。在大多数国家,二甲双胍在被称为或的药物制剂中销售。二甲双胍的结构式为:二甲双胍的系统名称是:n,n-二甲基亚氨基二碳亚胺二酰胺(n,n-dimethylimidodicarbonimidicdiamid)在本发明中,排卵率是指在一段给定的时间内,例如三个月,自然排卵的发生。低排卵率是指每月排卵低于0.7的情况,例如低于0.6,例如低于0.5或低于0.4。在本发明中,肝脏脂肪变性是指与在肝脏中的脂肪积累相关的状况。在本发明的特定背景下,肝脏脂肪变性和饮酒无关,本发明所述的这一类型的肝脏脂肪变性通常被称为非酒精性脂肪肝病(nafld)。在人类中,女性的生育高峰在20至30年龄段的初期和中期,在这之后开始缓慢下降,在35左右时发生更加急剧地下降。更年期或停经通常发生在40至50年龄段和50至60年龄段,这标志着生育能力的停止。因此,在本发明中,育龄优选指20岁至45岁之间的年龄,更优选指20岁至35岁之间的年龄。青春期少女或女性的排卵过少雄激素过多(根据nih可以用于指多囊卵巢综合症[pcos]的另一个术语)是生育能力低下的主要原因,并且与肝脏脂肪变性有关,而与肥胖无关。进一步的,多囊卵巢综合症与下列症状的发生有关:多毛症、痤疮、皮脂溢和月经失调。尚不清楚早期干预是否影响治疗后的自发排卵。然而,在本发明的内容中,发明人发现,对患有与肝脏脂肪变性相关的雄激素过多的(大部分非肥胖)青春期少女/年轻女性进行随机干预后,与使用包括口服避孕药的使用的标准疗法进行治疗的组相比,使用螺旋内酯甾酮、吡格列酮和二甲双胍组合物进行治疗的组,治疗后的排卵率显著增加。本发明公开了一个首次的随机研究,该研究比较了广泛认可的oc和那些增敏疗法的效果,所述疗法是对于患有高胰岛素血症性雄激素过多症,也可以被称为pcos的青春期少女,联合使用低剂量的螺旋内酯甾酮-吡格列酮-二甲双胍(spiomet)。意外地发现,与以往研究中报道的替代胰岛素增敏疗法的研究效果相比,本发明的spiomet疗法,在更大程度上降低了内脏和肝脏的脂肪含量,例如,吡格列酮、氟他胺和二甲双胍的联合使用17。另外,本发明的spiomet疗法,逐步地使内源性规律月经以及雄激素血症和胰岛素血症的指标正常化(表3)。此外,在治疗后一年,观察发现,spiomet疗法对于胰岛素血症的指标,内脏和肝脏的脂肪的积极效应没有发生逆转,同时,治疗后的高胰岛素血症的复发明显慢于标准oc疗法结束后观察到的。本发明的另一个令人惊讶且重要的发现是,治疗后的排卵率的正常化与肝脏脂肪的减少显著相关(图1)。因此,在治疗后一年内,由spiomet疗法带来的肝脏脂肪的减少与排卵率的正常化有关。这一发现对于预防或治疗与pcos相关的难以受孕或不孕是非常重要的,尽管在螺旋内酯甾酮或吡格列酮摄入期间不得不避免怀孕。事实上,长期的治疗后的排卵率正常化为pcos患者提供了充足的时间以在停止摄入spiomet后,尝试以安全,优选自然的方式怀孕。进一步的,观察到过多的肝脏脂肪可造成排卵率的降低,这为患有肝脏脂肪变性(与pcos无关)的女性提供了治疗选择,其遭受不孕,例如,超重和/或具有过多异常脂肪沉积的女性。事实上,根据本发明,也建议在患者组中将spiomet疗法作为恢复生育能力的治疗方式的一部分,优选结合生活方式的改变,促进体重减轻和利于增加体力活动。本发明的第一方面是一种药物组合物,包括螺旋内酯甾酮、吡格列酮和二甲双胍,所述药物组合物用于预防或治疗青春期少女或育龄妇女患有的pcos或排卵过少雄激素过多。典型地,本发明的药物组合物用于表现出雄激素过多和/或高胰岛素血症、低脂联素、高c-反应蛋白水平和/或高促性腺激素水平的青春期少女或育龄妇女的治疗。一般来说,这些女孩和育龄妇女也表现出肝脏和内脏脂肪过多和/或血脂异常。这些pcos症状的发生可能与超重或肥胖有关或可能与超重或肥胖无关。典型地,根据本发明的第一方面,所述药物组合物的使用减轻了单个、多个或全部所述pcos相关的症状。例如,所述使用可以减轻或减弱以下pcos症状的任何一种、几种或全部:高胰岛素血症、雄激素过多、过多的肝脏脂肪、过多的内脏脂肪、不规则的内源性月经和低排卵率。进一步的,观察到在所述药物组合物停止使用后持续存在所述症状的任何一种、几种或全部的减轻或减弱。特别是在治疗后的长时间内,保持了过多的肝脏脂肪和内脏脂肪的减少和排卵率的正常化,例如,在所述药物组合物停止使用后的6个月内或12个月内。本发明的第二方面是一种药物组合物,包括螺旋内酯甾酮、吡格列酮和二甲双胍,所述药物组合物用于预防或治疗青春期少女或育龄妇女患有的和肝脏脂肪变性相关的低排卵率。在治疗的人群中,肝脏脂肪变性并不一定与超重或肥胖有关。典型地,本发明的药物组合物用于表现出雄激素过多和高胰岛素血症、低脂联素、高c-反应蛋白水平和/或高促性腺激素水平的青春期少女或育龄妇女的治疗。一般来说,这些女孩和育龄妇女也表现出肝脏和内脏脂肪过多和/或血脂异常。本发明的第二方面的一个具体实施方式是一种药物组合物,其包括螺旋内酯甾酮、吡格列酮和二甲双胍,所述药物组合物用于预防或治疗患有排卵过少雄激素过多或pcos的青春期少女或育龄妇女患有的低排卵率。使用该药物组合物对排卵率的积极作用与先前的肝脏脂肪减少明显相关。因此,所述药物组合物的使用特别适合用于治疗具有过多肝脏脂肪或肝脏脂肪变性的pcos病人患有的低排卵率。本发明的第二方面的另一个具体实施方式是一种药物组合物,其包括螺旋内酯甾酮、吡格列酮和二甲双胍,所述药物组合物用于预防或治疗青春期少女或育龄妇女患有的与肝脏脂肪变性相关的低排卵率,她们没有被认为患有排卵过少雄激素过多或pcos。典型地,在该病人组中的青春期少女或育龄妇女是超重的和/或表现出过多异常脂肪沉积,特别是过多的内脏和肝脏脂肪沉积。本发明的第三方面是一种包括螺旋内酯甾酮、吡格列酮和二甲双胍的药物组合物,其用于治疗得益于肝脏和/或内脏脂肪减少的状况。在具体的实施方式中,这样的肝脏和/或内脏脂肪减少在没有伴随着总体重、体重、瘦体重和/或总脂肪量的减少的情况下发生。所述状况可以是多囊卵巢综合症、代谢性肥胖正常体重综合症(delorenzo综合症)、代谢综合症、肥胖或超重。优选地,所述治疗与采用涉及平衡饮食和有利于增加体力活动的生活方式相结合。本发明的第三方面的一个具体实施方式是一种包括螺旋内酯甾酮、吡格列酮和二甲双胍的药物组合物,用于治疗青春期少女或育龄妇女患有的得益于肝脏和/或内脏脂肪减少的状况。在具体的实施方式中,这样的肝脏和/或内脏脂肪减少在没有伴随着总体重、体重、瘦体重和/或总脂肪量的减少的情况下发生。所述状况可以是多囊卵巢综合症、代谢性肥胖正常体重综合症(delorenzo综合症)、代谢综合症、肥胖或超重。优选地,所述治疗与采用涉及平衡饮食和有利于增加体力活动的生活方式相结合。对于白人、西班牙裔和黑人而言,所述术语“超重”已经被美国国立卫生研究院(nih)和世界卫生组织(who)定义为,其bmi为25或更多。对于亚洲人来说,“超重”被定义为其bmi在23到29.9之间。对于儿童和青少年来说,必须考虑其年龄、性别、种族和/或特定的国家,因此,对于儿童和青少年来说,“超重”通常对应于超过bmi的85%。对于所有的组而言,“肥胖”被定义为,其bmi为30或更多。然而,对于儿童和青少年来说,“肥胖”被定义为,大于或等于bmi的95%。根据美国国立卫生研究院的说法,“代谢综合症”是增加你的心脏病和其它健康问题例如糖尿病和中风的风险的一组危险因素的统称。术语“新陈代谢”是指人体正常运作的生化过程。危险因素是提高你的患病几率的特征、环境或习惯。你必须具有至少三个新陈代谢危险因素,才能被诊断为代谢综合症。这些危险因素包括:大腰围或腹部肥胖;高甘油三酯水平;低hdl胆固醇水平;高血压;以及高空腹血糖。优选地,根据本发明所使用的药物组合物与通过所述青春期少女或育龄妇女使用的口服或非口服避孕用具相结合。在具体的实施方式中,所述避孕用具是非口服的避孕用具,例如子宫内避孕用具,比如子宫内线圈。根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至少25,优选为至少30,例如至少40或至少45mg的螺旋内酯甾酮。另外,根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至多100,优选至多75,例如最多70或60mg的螺旋内酯甾酮。在一个具体的实施例中,根据本发明使用的药物组合物,在所述组合物的每日剂量中,包括50mg的螺旋内酯甾酮。根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至少2.5,优选为至少5,例如至少6或至少7mg的吡格列酮。另外,根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至多15,优选至多10,例如最多9或8mg的吡格列酮。在一个具体的实施方式中,根据本发明所使用的药物组合物,在所述组合物的每日剂量中,包括7.5mg的吡格列酮。根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至少500,优选为至少600,例如至少700或至少800mg的二甲双胍。另外,根据本发明所使用的药物组合物,典型地,在所述组合物的每日剂量中,包括至多1500,优选至多1200,例如最多1000或900mg的二甲双胍。本发明所使用的药物组合物的优选实施方式中,在所述组合物的每日剂量中,包括850mg的二甲双胍。进一步优选地,根据本发明的药物组合物的每日剂量包括螺旋内酯甾酮、吡格列酮和二甲双胍的所需的每日剂量被配制在口服传送形式的单一的单元中,例如方便吞咽的单一的药片或胶囊。因此,根据本发明,所述药物组合物的使用可有助于怀孕,优选为自然怀孕,一旦所述青春期少女达到成年和生育年龄(见图4)。在育龄妇女中,特别是患有与肝脏脂肪变性相关的排卵过少雄激素过多的育龄妇女,根据本发明,所述药物组合物的使用导致随着异常脂肪的减少,特别是肝脏脂肪的减少,排卵过少生育能力低下的衰减(图5)。优选地,根据本发明,在青春期少女或育龄妇女中,持续使用所述药物组合物,直到观察到异常脂肪的足够减少。优选地,与治疗开始时估算的肝脏脂肪含量相比,所述异常脂肪的足够减少对应于估算的肝脏脂肪含量减少至少10%,更优选为至少20%或30%,例如减少40%或50%或更多。典型地,与治疗开始时估算的内脏脂肪含量相比,这种异常脂肪的足够减少和估算的内脏脂肪减少至少10%相关,更优选为15%,例如20%或30%或更多。考虑到在终止所述药物组合物的摄入之后,使用本发明的药物组合物对于排卵率的积极效果持续存在,当希望怀孕时,为避免这些组合物与胚胎或胎儿发育的任意假定的干扰,优选为,一旦达到这种异常脂肪的足够减少,可以考虑终止所述药物组合物的摄入。优选地,根据本发明,所需药物组合物的使用与口服或非口服避孕用具的使用相结合,特别是非口服避孕用具,例如子宫内避孕用具。所述非口服避孕用具的使用具有的好处是,其避免在包含于所述组合物中的药物化合物的摄入期间怀孕和妊娠,因此避免了这些化合物对胚胎和/或胎儿发育的任何假定的干扰。优选地,一旦达到这种异常脂肪的足够减少,并且希望怀孕时,所述口服或非口服避孕用具,优选为非口服避孕用具可以随着本发明所述的螺旋内酯、吡格列酮和二甲双胍的联合使用的终止而停止施用。本发明的第四个方面是一种预防或治疗青春期少女或女性患有的排卵过少雄激素过多或pcos的方法,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的联合使用。典型地,本发明所述的方法用于表现出高胰岛素血症、低脂联素、高c-反应蛋白水平和/或高促性腺激素水平的青春期少女或育龄妇女的治疗。通常,这些少女或育龄妇女也表现出肝脏和内脏脂肪过多和/或血脂异常。这些pcos症状的发生与超重或肥胖可能有关或可能无关。典型地,根据本发明第三方面所述的方法减轻了单个、多个或全部所述pcos相关的症状。例如,所述方法可以减轻或减弱以下pcos症状的任何一种、几种或全部:高胰岛素血症、雄激素过量、过多的肝脏脂肪、过多的内脏脂肪、不规则的内源性月经和低排卵率。进一步的,观察到所述症状的任何一种、几种或全部的减轻或减弱在所述药物组合物停止使用后持续存在。特别是过多的肝脏脂肪和内脏脂肪的减少和排卵率的正常化在治疗后长时间保持,例如,在螺旋内酯甾酮、吡格列酮和二甲双胍停止施用后的6个月或12个月期间。本发明的第五个方面提供了一种预防或治疗青春期少女或育龄妇女患有的和肝脏脂肪变性相关的低排卵率的方法,所述方法包括使用螺旋内酯甾酮、吡格列酮和二甲双胍的组合物。本发明的第五个方面的一个具体实施方式是一种预防或治疗患有排卵过少雄激素过多或pcos的青春期少女或育龄妇女患有的低排卵率的方法,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用。所述方法对于排卵率的积极作用与先前的肝脏脂肪减少明显相关。因此,所述方法特别适合用于治疗具有过多肝脏脂肪或肝脏脂肪变性的pcos病人患有的低排卵率。本发明的第五个方面的另一个实施方式是一种预防或治疗不认为患有排卵过少雄激素过多或pcos的青春期少女或育龄妇女患有的和肝脏脂肪变性相关的低排卵率的方法,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用。典型地,在病人组中的青春期少女或育龄妇女是超重的和/或表现出过多异常脂肪沉积,特别是过多的内脏和肝脏脂肪沉积。本发明的第六个方面是一种治疗得益于肝脏和/或内脏脂肪减少的状况的方法,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用。在具体的实施方式中,所述肝脏和/或内脏脂肪减少在没有伴随着总体重、体重、瘦体重和/或总脂肪量的减少的情况下发生。所述状况可以是代谢性肥胖正常体重综合症(delorenzo综合症)、代谢综合症、肥胖或超重。优选地,所述治疗与采用涉及平衡饮食和有利于增加体力活动的生活方式相结合。本发明的第六个方面的一个具体实施方式是一种治疗青春期少女或育龄妇女患有的得益于肝脏和/或内脏脂肪减少的状况的方法,所述方法包括螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用。在具体的实施方式中,所述肝脏和/或内脏脂肪减少在没有伴随着总体重、体重、瘦体重和/或总脂肪量的减少的情况下发生。所述状况可以是多囊卵巢综合症、代谢性肥胖正常体重综合症(delorenzo综合症)、代谢综合症、肥胖或超重。优选地,所述治疗与采用涉及平衡饮食和有利于增加体力活动的生活方式相结合。在青春期少女中,特别在表现出高胰岛素血症性雄激素过多症症状的那些青春期少女中,根据本发明的治疗方法导致了异常脂肪,特别是肝脏脂肪的减少,以及在(早期)成年期和生育能力低下相关的低排卵率的减少。因此,本发明的治疗方法可有助于受孕,优选自然受孕,一旦所述青春期少女达到成年和生育年龄(见图4)。在育龄妇女中,特别是患有和肝脏脂肪变性相关的排卵过少雄激素过多的那些育龄妇女中,根据本发明的治疗方法导致随着异常脂肪,特别是肝脏脂肪的减少,排卵过少的生育能力低下的减少(图5)。优选地,根据本发明的治疗方法,青春期少女和/或育龄妇女的治疗涉及坚持螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用,直到观察到异常脂肪的足够减少。优选地,与治疗开始时估算的肝脏脂肪含量相比,所述异常脂肪的足够减少对应于估算的肝脏脂肪含量减少至少10%,更优选为至少20%或30%,例如减少40%或50%或更多。典型地,与治疗开始时估算的内脏脂肪含量相比,这种异常脂肪的足够减少和估算的内脏脂肪减少至少10%相关,更优选为15%,例如20%或30%或更多。考虑到在终止螺旋内酯甾酮、吡格列酮和二甲双胍的组合的摄入之后,本发明的治疗方法对于排卵率的刺激效应持续存在,可以考虑当希望怀孕时,为了避免这些化合物与胚胎或胎儿发育的任意假定的干扰,优选为一旦达到这种异常脂肪的足够减少,终止这些化合物的摄入。本发明的治疗方法被认为对于表现出肝脏脂肪变性的青春期少女和/或育龄妇女是有效的,无论该肝脏脂肪变性是否与肥胖或超重相关。本发明的方法可用于表现出雄激素过多和高胰岛素血症,以及低脂联素、高c-反应蛋白水平和/或高促性腺激素水平的青春期少女或育龄妇女的治疗。一般来说,这些青春期少女和育龄妇女也表现出内脏脂肪过多和/或血脂异常。本发明的治疗方法通常涉及每日施用至少25,优选至少30,例如至少40或至少45mg的螺旋内酯甾酮。另外,本发明的治疗方法通常涉及每日施用至多100,优选至多75,例如至多70或至多60mg的螺旋内酯甾酮。在一个具体的实施方式中,本发明的治疗方法包括每日施用50mg的螺旋内酯甾酮。本发明的治疗方法通常涉及每日施用至少2.5,优选至少5,例如至少6或至少7mg的吡格列酮。另外,本发明的治疗方法通常涉及每日施用至多15,优选至多10,例如至多9或至多8mg的吡格列酮。在一个具体的实施方式中,本发明的治疗方法包括,在所述组合物的每日剂量中,每日施用7.5mg的吡格列酮。本发明的治疗方法通常涉及,在所述组合物的每日剂量中,每日方式至少500,优选至少600,例如至少700或至少800mg的二甲双胍。另外,本发明的治疗方法通常涉及,在所述组合物的每日剂量中,每日施用至多1500,优选至多1200,例如至多1000或至多900mg的二甲双胍。在一个具体的实施方式中,本发明的治疗方法包括,在所述组合物的每日剂量中,每日施用850mg的二甲双胍。在一个优选的实施方案中,本发明包括每日施用60至70mg的螺旋内酯甾酮,8至9mg的吡格列酮和800至900mg的二甲双胍。优选地,本发明包括每日施用50mg的螺旋内酯甾酮,7.5mg的吡格列酮和850mg的二甲双胍。进一步优选地,本发明的治疗方法包括以口服传送形式施用药物组合物,包括在所述口服传送形式的每一个独立单元中的螺旋内酯甾酮、吡格列酮和二甲双胍,例如在每一个单独的药片或胶囊中。更优选地,所述口服传送形式的单独的单元包括螺旋内酯甾酮、吡格列酮和二甲双胍的所需的每日剂量。典型地,所述口服传送形式的单独的单元,例如单独的药片或胶囊,可以被方便的吞咽。该药片或胶囊可能是本领域技术人员根据任何本领域已知的方法制备的薄膜包衣胶囊或药片。优选地,该胶囊或药片被配制为立即释放的传送形式。在本发明的另一个实施方案中,螺旋内酯甾酮、吡格列酮和二甲双胍均以单独的传送形式依次使用。以单独的传送形式的螺旋内酯甾酮、吡格列酮和二甲双胍可能形成一种组合。在一个进一步的实施方案中,以单一的传送形式施用螺旋内酯甾酮、吡格列酮和二甲双胍中的两种,并且以单独的传送形式施用剩余的化合物。该单一的传送形式可以是同时施用或在彼此的5分钟至1小时内施用,优选为在彼此的15分钟至30分钟内施用。优选地,本发明的治疗方法,螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用和避孕疗法特别是非口服避孕用具,例如子宫内避孕用具的使用相结合。在本发明的另一个实施方案中,螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用和以单一传送形式的口服避孕药相结合。在另一个实施方案中,螺旋内酯甾酮、吡格列酮、二甲双胍和口服避孕药中的两种或三种以单一的传送形式施用,并且剩余的化合物以单独的传送形式施用。避孕疗法的使用具有以下优点:在所述药物组合物的摄入期间避免怀孕,并且因此避免了这些化合物对胚胎和/或胎儿发育的任何假定的干扰。优选地,一旦已经实现了异常脂肪的足够减少,并且希望怀孕时,所述非口服避孕用具可以随着螺旋内酯甾酮、吡格列酮和二甲双胍的联合施用的终止而停止使用。本发明的另一方面是一种药物组合物,其中,所述药物组合物包括25至100mg的螺旋内酯甾酮,和/或5至15mg的吡格列酮,和/或500至1500mg的二甲双胍。在一个实施方式中,所述药物组合物包括25至100mg的螺旋内酯甾酮和5至15mg的吡格列酮。在另一个实施方案中,所述药物组合物的每日剂量包括25至100mg的螺旋内酯甾酮,5至15mg的吡格列酮,和500至1500mg的二甲双胍。在一个特别优选的实施方案中,所述药物组合物的每日剂量包括50mg的螺旋内酯甾酮,7.5mg的吡格列酮,和850mg的二甲双胍。在一个实施方案中,该药物组合物为口服传送形式,以及该口服传送形式的独立单元,包括25至100mg的螺旋内酯甾酮,5至15mg的吡格列酮,和500至1500mg的二甲双胍。在一个特别优选的实施方案中,该口服传送形式的独立单元是药片或胶囊。实施例1:用于患有高胰岛素血症性雄激素过多症的青春期少女/年轻女性的低剂量的螺旋内酯甾酮吡格列酮二甲双胍的治疗方法。方法研究计划和对象表1总结了该超过24个月的随机的、单中心的、开放式的研究计划。研究对象包括36位加泰罗尼亚女孩,她们满足多毛症的四个选择标准(弗里曼-盖尔韦量表分数>8),月经过少(月经间隔>45天),妇科年龄(或月经初潮后的时间)>2.0年,以及没有性活动(不需要避孕)。在2013年1月至2014年5月之间,西班牙巴塞罗那的桑特贞德大学医院的青春期内分泌科招募了这些女孩(匹配流程图;图6)。招募对超重/肥胖持有偏见,因为,在我们的设定中,超重的/肥胖的青春期少女主要指肥胖科而不是指青少年内分泌科。所有的满足四个纳入标准的女孩都登记了,因为她们中没有一个被下列标准排除:21-羟化酶缺乏症(通过在卵泡期或停经两个月后的17-oh-孕激素血症≥200ng/dl判断);葡萄糖不耐症或糖尿病;甲状腺迹象,肝脏或肾功能失调;高泌乳素血症;任何影响性腺或肾上腺功能药物的预先使用,或碳水化合物或脂质代谢。17端点主要的端点是治疗后排卵率。次要结果是多毛症和痤疮分数,身体组成,腹部脂肪分配(皮下脂肪、内脏脂肪和肝脏脂肪),颈动脉内膜中层厚度(cimt),和循环胰岛素,睾丸素,雄烯二酮,c-反应蛋白(crp),脂类和高分子量(hmw)脂联素。研究注册和行为准则该研究被注册为isrctn29234515,并在桑特贞德大学医院的机构审查委员会批准后,家长书面同意后,以及每个研究女孩同意后实施,包括允许得到指示值的健康对照组。原始研究注册的更新材料反映了自从2012年8月以来发生的变化,特别是青春期pcos的诊断结论,6在该研究期间(在获得了一个资金延期后,治疗后时间从6个月延长至12个月),以及循环雄激素的测定(切换到液相色谱-串联质谱法)。随机化和研究药物地中海饮食和定期锻炼被推荐给所有女孩。研究药物的随机化(1:1)是基于网络的(http://www.sealedenvelope.com),使用随机排列区组,以及以年龄(<16.0或≥16.0岁)和体重指数(bmi,<24.0或≥24.0kg/m2)分层。女孩们被随机分配为接受每日一次,在晚餐时间,不是loettediario(辉瑞公司,马德里,西班牙;21/28天的20mcg乙炔雌二醇加100mg乙羟基二降孕甾烯炔酮,和7/28天的安慰剂)就是spiomet,一个低剂量的三种单独药物的结合:50mg螺旋内酯甾酮(西班牙马德里的辉瑞公司的安体舒通的100mg药片的一半),7.5mg吡格列酮(西班牙马德里的塔克达公司的阿克托斯的15mg药片的一半),和850mg二甲双胍(西班牙巴塞罗那的山德士公司的二甲双胍的850mg药片)。在每一次临床诊断中,坚持通过历史审查治疗,以及通过在药房中的药丸计数提供该研究药物。临床&内分泌代谢评估一名研究者(li,知道该治疗)测量体重,身高(哈彭登测距仪)和腰围,其评分显示多毛症(弗里曼-盖尔韦(ferriman-gallwey))和痤疮(利兹分级量表(leedsgradingscale))的存在,以及副作用筛选。在女孩仰卧休息5分钟后,使用电子血压计(767系列,伟伦公司,西班牙)在右臂记录了心脏收缩和心脏舒张的血液压力。在月经周期3-7天间(除了一个女孩的所有女孩)或停经两个月后(一个女孩),在早晨进行内分泌代谢评估。评估空腹血糖和循环胰岛素(同时允许抗胰岛素性的稳态模型评估法的计算,homa-ir),性激素结合球蛋白(shbg),睾丸素,雄烯二酮,ldl胆固醇和hdl胆固醇,甘油三酯,hmw脂联素和crp,以及安全标志物丙氨酸转氨酶(alt),天冬氨酸转氨酶(ast),和γ-谷氨酸转移酶(ggt)。另外的安全标志物是血球计数和循环尿素和肌氨酸酐(数据未显示)。在高碳水化合物饮食(300g/天)3天和一晚禁食后,用75g葡萄糖进行口服葡萄糖耐量试验(ogtt),在葡萄糖摄入前取血样,此后在30、60、90和120分钟进行葡萄糖和胰岛素测量,从中得出平均血糖和胰岛素血症z分数。17颈动脉内膜中层厚度(cimt)通过一个研究者(gs,不知道该治疗)采用高分辨率设备(acusonsequoia512sha,medisales,losalamitos,ca)获得颈动脉的纵向超声扫描;计算了3个左侧cimt测量值和3个右侧测量值的平均值。17身体成分&腹部脂肪分布通过采用lunarprodigy和lunar软件(版本3.4/3.5,lunar公司,wi)的双x射线吸光测定法(dxa)评估身体成分。17通过磁共振成像(mri)评估腹部脂肪在皮下和内脏分布,使用多层切片mri1.5特斯拉扫描(signalxechospeedplusexcite,generalelectric,milwaukee,wi)。17mri也被用于评估肝脏脂肪(%),通过比较肝脏脂肪和皮下脂肪和脾脏的强度,假定脾脏是无脂肪的。通过一位操作员进行扫描,并通过一位放射线学者对图像进行分析,他们都不知道该治疗。分析通过葡萄糖氧化酶法测定血糖。通过免疫化学发光法(immulite2000,diagnosticproducts,洛杉矶,ca)检测循环胰岛素和shbg。通过[空腹胰岛素mu/l]×[空腹血糖mg/dl]/405计算homa-ir。通过高灵敏法(architectc8000;abbott,威斯巴登,德国)测量crp。通过酶联免疫吸附测定(linco,st.louis,mo)分析hmw脂联素。通过液相色谱-串联质谱法测量循环睾丸素和雄烯二酮,使用了一种基于已知方法的方法。19简单地,将50μl的样品和20μl的istd混合物(睾丸素-d35ng/ml)和150μl的乙腈混合,进行蛋白质沉淀。将样品离心,之后将上清液蒸发(40℃,氮气流),加入1ml水。将混合物用3ml叔丁基甲醚萃取,分离有机层并蒸发至干燥。用100μl去离子水:甲醇(1:1,v/v)混合物对提取物进行溶解,并取10μl注入到液相色谱-串联质谱系统中(uplc耦合到xevo三重四极质谱仪,沃特斯)。使用梯度程序进行液相色谱分离,有机溶剂的线性变化的百分比如下所示:0min,70%;0.5min,70%;3min,95%;3.5min,95%;3.6min,95%;5min,70%。通过选定的反应监测方法,通过捕获每个分析物的两个转变测定雄激素类(睾丸素为289→97和289→109,雄烯二酮是287→97和287→109.内部标准是292→97和292→109)。通过两个转变获得定量数据。五个浓度水平的溶剂标准用于量化目的。采用masslynx软件进行数据管理。通过100×[循环雄激素浓度(nmol/l)]/[性激素结合球蛋白(shbg,nmol/l)]计算睾丸素和雄烯二酮的自由指数。在没有正常值的情况下(采用这些方法,在这个年龄范围内,以及在该族群中),自由雄激素z分数是从在相同年龄和种族背景,以及月经规律的健康女孩中使用相同的方法获得的结果中得出的(表2)。这个指示性群体的相对均匀性导致相对较小的标准偏差,并且,在本研究人群中,当解释相对升高的z分数偏离时,应该考虑这些标准偏差。排卵通过结合月经日记的证据和唾液孕酮测量来推断排卵。在治疗后的第二个和第四个三月期,在唾液中测量孕酮浓度(研究月数15-18和21-24,在表1中)。每周收集一次唾液样品(在相同的工作日),在每个三月期内连续收集12周,每个患者总共24个样品。这些样品(每个大约5ml)在清水漱口后和食物摄取前,通过吐唾液进入塑料收集器。避免使用刺激唾液分泌的装置。在存储在患者的家庭冰箱之前,每一个收集器都被贴上标签(名称和日期)。每一个12周的唾液收集完成之后,这些唾液样品被放到等温袋中带到医院,以及每个女孩保留的月经日记,并且这些日期跨越了14周(包括12周的唾液收集之后的两周)。收到后,样品被解冻并被转移到聚丙烯管中,在300rpm下离心15分钟以除去细胞残骸,然后在-20℃储存最多3个月,直到分析。在通过elisa(novatec,免疫诊断学,迪岑巴赫,德国)进行孕酮测试当天,将唾液样品解冻,以及再次离心;分析内变异系数和分析间变异系数是5.5%和6.0%,并且检测极限为3.8pg/ml。通过使用一个99pg/ml的低孕酮界限确认候选排卵,由分析制造商推荐。当月经日记表明,月经没有开始最多两周之前,获得相关的唾液样品,并在之后的2周之内开始时,确认候选排卵。全部排卵都是在这个两步法中被证实的,证明和唾液孕酮浓度>150pg/ml相关;相反地,通过月经模式,没有浓度>150pg/ml的候选排卵被证实。统计使用spss22.0(spss,芝加哥,il)进行分析。通过重复测量的一般线性模型对比组间的数量变数的纵向变化。通过在受试者之间和受试者之内效果的交互作用项测试组间的纵向变化的差异。通过mann-witneyu测试探索排卵数的组间差异,并且通过fisherexact测试排卵正常分数。通过相关分析探索数量变数间的关联。p<0.05有统计学意义。结果研究完成,坚持治疗,副作用研究完成率为94%(每组有一个在治疗后退出)。根据病史和药丸计数判断,坚持治疗估计为>97%。值得注意的是,在第一个月出现了副作用(17%的oc女孩),并且在第一个月有偶发/轻度腹部不适(11%的spiomet女孩)。主要结果:治疗后排卵和oc相比,spiomet治疗后,排卵率要高2.5倍,排卵正常女孩分数要高6倍(表2)。和oc相比,spiomet之后的无排卵的绝对风险要低65%(95%置信区间,40-89%)。需要用spiomet治疗的人数中观察到一个额外的pcos女孩,其正常排卵数为2(95%置信区间,1.1-2.5)。治疗后的排卵率和治疗中的肝脏脂肪的变化相关,并且和处理后和处理前的自由睾丸甾体血症的变化相关(图1),也与bmi和总脂肪量的变化调整之后相关。月经史和唾液孕酮的代表性模式(图2)说明,具有相似月经史的女孩在oc或spiomet之后可能具有显著不同的排卵率。低排卵数(0或1,在12+12周期间)仅在oc治疗后[这些女孩的35%]发现,并且高排卵数(5或6)仅在spiomet治疗后发现[这些女孩的59%](图7)。次要结果spiomet疗法伴随着一系列的正常化效果,包括在肝脏脂肪(图3),内脏脂肪,腰围,和循环胰岛素,crp和hmw脂联素(表3)方面。和oc治疗后相比,spiomet治疗后的肝脏和内脏脂肪以及葡萄糖刺激的胰岛素血症保持更加正常(表4)。与在oc治疗期间相比,在spiomet治疗期间,高雄激素血症的正常化更加缓慢,但是在spiomet治疗后的反弹也更加缓慢(图3)。在研究过程中,两组的bmi、肌肉量和腹部的皮下脂肪量保持稳定。结论对青春期pcos少女进行随机治疗后,产生明显不同的排卵率。更多的治疗中的肝脏脂肪过多的减少和更正常的治疗后的排卵率相关。本研究的相继的发现证实了这样的观点,其中肝脏-内脏脂肪和/或高胰岛素血症是主要的pcos驱动因素7,8,9,它们在多层次上具有协调功能,包括在神经内分泌水平上的促性腺激素分泌的上调,20和在卵巢水平上的雄激素释放的上调。由于和spiomet相关的肝脏和内脏脂肪的正常化发生在体重、肌肉量或总脂肪没有出现可检测的变化的情况下,因此它们可能已经由来自于中心/异常部位(肝和内脏)的脂肪向外周/正常部位(皮下脂肪组织)的转移引起,从而能够减少任何和异常脂肪储存相关的并发症。22,23更多的治疗中的中心脂肪过多的减少,特别是肝脂肪,能够带来更多的治疗后排卵。pcos中的不排卵可能因此是优秀运动员的不排卵的镜像,优秀运动员的不排卵长期以来一直与中心脂肪缺乏有关。24现在是将“排卵的正确体重”的概念更新为“排卵的正确肝脏-内脏脂肪量”的概念的时候,其中u形曲线描述了肝脏-内脏脂肪量(沿x轴)和不排卵的患病率(沿y轴)之间的关系。7大多数患有lh升高、雄激素过多和排卵障碍的pcos女性可能没有患有卵巢病症,但是可能处于一种内分泌方式,该内分泌方式被超过一个个体阙值的肝脏-内脏脂肪触发,并且这是作为一种反馈机制的进化保护,其减少了中心肥胖,26并且作为预防高危妊娠的保护机制。27通过早期的二甲双胍治疗(8-12岁)导致的青春期pcos的延迟也与肝脏和内脏脂肪的联合减少相关。28,29因此,进化推测和个体发生的证据一致建议pcos并不是一种卵巢综合症,而是一种假性卵巢中心性肥胖序列(pcos)。目前的结果揭露了肝脏脂肪和排卵功能之间的联系(图1),与体重、肌肉量、总脂肪量和腹部皮下脂肪量无关。尽管目前的发现大多数是在患有pcos且体重稳定的非肥胖的青春期少女身上获得的,它们可能仍然提供了一个关于为什么健康的生活方式和/或减肥可以如此有效的提高自发性排卵功能(排卵功能的易反应性)的解释:处于更健康的生活方式和/或减肥时,肝脏似乎是第一个减少脂肪的部位,并且内脏似乎是下一个。30,31事实上,在处于低热量饮食的肥胖人群中,大约10%的体重减少伴随着60%的肝脏脂肪的减少和20%内脏脂肪的减少,以及仅仅10%的皮下脂肪的减少。31对于在pcos表型中的肝脏-内脏脂肪的关键作用的认识提供了关于为什么患有pcos的非肥胖的青春期少女往往具有更低的出生体重的解释:7,9具有更低的出生体重的少女往往具有更多的肝脏和内脏脂肪(和bmi无关),并且,这来自于儿童早期。32,33总之,和oc相比,spiomet更能使患有pcos的青春期少女的治疗后的排卵率正常化。对于早期异常脂肪的减少,特别是肝脏脂肪,重新聚焦pcos治疗,可能防止部分随后发生的排卵过少的生育能力低下。实施例2:药片关于药片的制造,活性物质螺旋内酯甾酮、二甲双胍和吡格列酮和聚乙烯吡咯烷酮混合。进行低剪切湿法造粒,并对制得的颗粒进行干燥和研磨。剩余的辅料(交联羧甲基纤维素钠,微晶纤维素,硬脂酸镁和聚乙烯醇)和研磨后的颗粒混合,并一起与润滑剂聚乙烯醇混合。最终将该混合物压缩成具有以下组成的药片。制得的药片芯包括:药片芯数量/mg功能芯螺旋内酯甾酮50活性基本成分吡格列酮7.5活性基本成分二甲双胍850活性基本成分聚乙烯吡咯烷酮55粘合剂交联羧甲基纤维素钠30稀释剂微晶纤维素70崩解剂硬脂酸镁10润滑剂聚乙烯醇26,5成膜聚合物在一个实施方式中,该药片具有薄膜包衣。表1.研究计划研究月数06121824oc或spiomet摄入(0-12月)*√√临床和循环标志物^√√√√√dxa,腹部mri,cimt&√√√√√口服葡萄糖耐量试验√√√排卵评估#√√*oc,口服避孕药;spiomet,低剂量的螺旋内酯甾酮-吡格列酮-二甲双胍;对于年龄和bmi以1:1进行随机化分层^早晨空腹状态下取血样,在早期卵泡期&dxa,双x射线吸光测定法;mri,磁共振成像(肝脏和内脏脂肪);cimt,颈动脉内膜中层厚度#在研究之前,通过超过12周的每周地唾液孕酮,以及一个超过相同的12周+接下来的2周的月经日记。表2.排卵结果结果表示为平均数±标准误。mo:月;wk:周。&标准排卵定义为在12周内推断排卵数为2或3个,或在总的24周的时间期限内为4个或更多的排卵。hp≤0.05,随时间变化的组内变化;ip≤0.05和jp≤0.05,组间差异。表3.治疗中的结果(0-12月)表3.续表数值表示为平均数±sem。shbg,性激素结合球蛋白;homa-ir:稳态模型评估抗胰岛素性;ogtt,口服葡萄糖耐量试验;ggt,γ-谷氨酸转移酶;hmw,高分子量;imt,内膜中层厚度;dxa,双x射线吸光测定法;abdmri,腹部磁共振成像;subc,皮下的。^在摄入7/28天的安慰剂之后,100%的这些女孩出现了假月经。*健康女孩的指示值(n=18;年龄16.9±0.3yr;bmi21.1±0.6kg/m2);shbg59±5nmol/l;睾丸素0.7±0.1nmol/l;雄烯二酮3.4±0.2nmol/l;空腹胰岛素21.0±2.1pmol/l;homa-ir0.7±0.1;ggt12±1iu/l;hmw-低脂联素12.7±1.6mg/l;crp0.7±0.2mg/l。#健康女孩的指示dxa值,匹配的年龄和升高(n=41):肌肉量35.1±1.0kg;脂肪量17.6±1.4kg健康女孩的指示mri值(n=15;age15.7±0.3yr;bmi22.1±0.8kg/m2):皮下脂肪97±11cm2;内脏脂肪32±2cm2;肝脏脂肪12±1%。a在开始时,随机分组间没有显著差异。bp≤0.05,cp≤0.01和dp≤0.001指开始后的组内变化(δ)。ep≤0.05,fp≤0.01,gp≤0.001指在δ0-12月的组间差异。表4.治疗后结果(12-24月)和累积变化(0-24月)表4.续表数值表示为平均数±sem。shbg,性激素结合球蛋白;homa-ir:稳态模型评估抗胰岛素性;ogtt,口服葡萄糖耐量试验;ggt,γ-谷氨酸转移酶;hmw,高分子量;imt,内膜中层厚度;dxa,双x射线吸光测定法;abdmri,腹部磁共振成像;subc,皮下的。^在摄入7/28天的安慰剂之后,100%的这些女孩出现了假月经。*健康女孩的指示值(n=18;年龄16.9±0.3yr;bmi21.1±0.6kg/m2);shbg59±5nmol/l;睾丸素0.7±0.1nmol/l;雄烯二酮3.4±0.2nmol/l;空腹胰岛素21.0±2.1pmol/l;homa-ir0.7±0.1;ggt12±1iu/l;hmw-低脂联素12.7±1.6mg/l;crp0.7±0.2mg/l。#健康女孩的指示dxa值,匹配的年龄和升高(n=41):肌肉量35.1±1.0kg;脂肪量17.6±1.4kg健康女孩的指示mri值(n=15;age15.7±0.3yr;bmi22.1±0.8kg/m2):皮下脂肪97±11cm2;内脏脂肪32±2cm2;肝脏脂肪12±1%。a在开始时,随机分组间没有显著差异。bp≤0.05,cp≤0.01和dp≤0.001指开始后的组内变化(δ)。ep≤0.05,参考文献1.legrors,arslaniansa,ehrmannda,hoegerkm,muradmh,pasqualir,weltck;endocrinesociety.diagnosisandtreatmentofpolycysticovarysyndrome:anendocrinesocietyclinicalpracticeguideline.jclinendocrinolmetab2013;98:4565-92.2.dumesicda,oberfieldse,stener-victorine,marshalljc,lavenjs,legrors.scientificstatementonthediagnosticcriteria,epidemiology,pathophysiology,andmoleculargeneticsofpolycysticovarysyndrome.endocrrev2015;36:487-525.3.kuchenbeckerwk,groenh,vanasseltsj,bolsterjh,zwerverj,slartrh,vdjagtej,mullerkoboldac,wolffenbuttelbh,landja,hoeka.inwomenwithpolycysticovarysyndromeandobesity,lossofintra-abdominalfatisassociatedwithresumptionofovulation.humreprod2011;26:2505-12.4.jonesh,sprungvs,pughcj,daousic,irwina,azizn,adamsvl,thomasel,belljd,kempgj,cuthbertsondj.polycysticovarysyndromewithhyperandrogenismischaracterisedbyanincreasedriskofhepaticsteatosiscomparedtononhyperandrogenicpcosphenotypesandhealthycontrols,independentofobesityandinsulinresistance.jclinendocrinolmetab2012;97:3709-16.5.cs,ottj,bozkurtl,feichtingerm,rehmannv,cserjana,heinischm,steinbrecherh,justkukurovai,tuskovar,leutnerm,vytiska-binstorfere,kurzc,weghofera,turaa,egarterc,kautzky-willera.toassesstheassociationbetweenglucosemetabolismandectopiclipidcontentindifferentclinicalclassificationsofpcos.plosone2016;11:e0160571.6.witchelsf,oberfields,rosenfieldrl,codnere,bonnya,l,penaa,horikawar,gomez-lobov,joeld,tfaylih,arslanians,dabadghaop,garciarudazc,leepa.thediagnosisofpolycysticovarysyndromeduringadolescence.hormrespaediatr2015apr1[epub].7.l,ongkk,lópez-bermejoa,dungerdb,dezegherf.hyperinsulinemicandrogenexcessinadolescentgirls.natrevendocrinol2014;100:499-508.8.dezegherf,l.earlyoriginsofpolycysticovarysyndrome:hypothesesmaychangewithoutnotice.jclinendocrinolmetab2009;94:3682-5.9.dezegherf,lópez-bermejoa,l.adiposetissueexpandabilityandtheearlyoriginsofpcos.trendsendocrinolmetab2009;20:418-23.10.azzizr,carminae,chenz,dunaifa,lavenjs,legrors,liznevad,natterson-horowitzb,teedehj,yildizbo.polycysticovarysyndrome.natrevdisprimers2016;2:16057.11.lassn,kleberm,winkelk,wunschr,reinehrt.effectoflifestyleinterventiononfeaturesofpolycysticovariansyndrome,metabolicsyndrome,andintima-mediathicknessinobeseadolescentgirls.jclinendocrinolmetab2011;96:3533-40.12.hechtbaldauffn,arslanians.optimalmanagementofpolycysticovarysyndromeinadolescence.archdischild2015;100:1076-83.13.rosenfieldrl.thediagnosisofpolycysticovarysyndromeinadolescents.pediatrics2015;136:1154-65.14.bonnyae,appelbaumh,connorel,cromerb,divastaa,gomez-lobov,harelz,huppertj,sucatog;naspagresearchcommittee.clinicalvariabilityinapproachestopolycysticovarysyndrome.jpediatradolescgynecol2012;25:259-61.15.l,vallsc,potaun,marcosmv,dezegherf.sensitizationtoinsulininadolescentgirlstonormalisehirsutism,hyperandrogenism,oligomenorrhea,dyslipidaemiaandhyperinsulinismafterprecociouspubarche.jclinendocrinolmetab2000;85:3526-30.16.l,dezegherf.low-doseflutamide-metformintherapyforhyperinsulinemichyperandrogenisminnon-obeseadolescentsandwomen.humreprodupdate2006;12:243-52.17.l,díazm,sebastianig,marcosmv,lópez-bermejoa,dezegherf.oralcontraceptionvsinsulinsensitizationfor18monthsinnonobeseadolescentswithandrogenexcess:posttreatmentdifferencesinc-reactiveprotein,intima-mediathickness,visceraladiposity,insulinsensitivity,andmenstrualregularity.jclinendocrinolmetab2013;98:e902-7.18.goodmannf,cobinrh,futterweitw,glueckjs,legrors,carminae.americanassociationofclinicalendocrinologists,americancollegeofendocrinology,andandrogenexcessandpcossocietydiseasestateandclinicalreview:guidetothebestpracticesintheevaluationandtreatmentofpolycysticovarysyndrome-part1.endocrpract2015;21:1291-300.19.marcosj,renaun,casalsg,seguraj,venturar,pozooj.investigationofendogenouscorticosteroidsprofilesinhumanurinebasedonliquidchromatographytandemmassspectrometry.analchimacta2014;812:92-104.20.georgejt,kakkarr,marshallj,scottml,finkelmanrd,hotw,veldhuisj,skorupskaitek,andersonra,mclntoshs,webberl.neurokininbreceptorantagonisminwomenwithpolycysticovarysyndrome:arandomized,placebo-controlledtrial.jclinendocrinolmetab2016jul26:jc20161202.[epubaheadofprint]21.mcallisterjm,legrors,modibp,straussjf3rd.functionalgenomicsofpcos:fromgwastomolecularmechanisms.trendsendocrinolmetab2015;26:118-24.22.shulmangi.ectopicfatininsulinresistance,dyslipidaemia,andcardiometabolicdisease.nengljmed2014;371:2237-8.23.yki-h.non-alcoholicfattyliverdiseaseasacauseandaconsequenceofmetabolicsyndrome.lancetdiabetesendocrinol2014;2:901-10.24.frischre,snowrc,johnsonla,gerardb,barbierir,rosenb.magneticresonanceimagingofoverallandregionalbodyfat,estrogenmetabolism,andovulationofathletescomparedtocontrols.jclinendocrinolmetab1993;77:471-7.25.frischre.therightweight:bodyfat,menarcheandovulation.baillieresclinobstetgynaecol1990;4:419-39.26.dumesicda,abbottdh,eisnerjr,herrmannrr,reedje,welchtj,jensenmd.pituitarydesensitizationtogonadotropin-releasinghormoneincreasesabdominaladiposityinhyperandrogenicanovulatorywomen.fertilsteril1998;70:94-101.27.palombas,dewildema,falboa,kostermp,lasalagb,fauserbc.pregnancycomplicationsinwomenwithpolycysticovarysyndrome.humreprodupdate2015;21:575-92.28.l,lopez-bermejoa,diazm,marcosmv,dezegherf.pubertalmetformintherapytoreducetotal,visceral,andhepaticadiposity.jpediatr2010;156:98-102.29.l,lópez-bermejoa,diazm,marcosmv,dezegherf.earlymetformintherapy(age8-12years)ingirlswithprecociouspubarchetoreducehirsutism,androgenexcess,andoligomenorrheainadolescence.jclinendocrinolmetab2011;96:e1262-7.30.fonvigce,chabanovae,ohrtjd,nielsenla,pederseno,hansent,thomsenhs,holmjc.multidisciplinarycareofobesechildrenandadolescentsforoneyearreducesectopicfatcontentinliverandskeletalmuscle.bmcpediatr2015;15:196.31.vogtlj,stevelinga,meffertpj,kromreyml,kesslerr,hostenn,krügerj,s,aghdassiaa,mayerlej,lerchmm,kühnjp.magneticresonanceimagingofchangesinabdominalcompartmentsinobesediabeticsduringalow-calorieweight-lossprogram.plosone2016;11:e0153595.32.l,lopez-bermejoa,suárezl,marcosmv,díazm,dezegherf.visceraladipositywithoutoverweightinchildrenbornsmallforgestationalage.jclinendocrinolmetab2008;93:2079-83.33.sebastianig,díazm,bassolsj,aragonésg,lópez-bermejoa,dezegherf,l.thesequenceofprenatalgrowthrestraintandpost-natalcatch-upgrowthleadstoathickerintima-mediaandmorepre-peritonealandhepaticfatbyage3-6years.pediatrobes2016;11:251-7.34.l,dezegherf,potaun.anovulationafterprecociouspubarche:earlymarkersandtimecourseinadolescence.jclinendocrinolmetab1999;84:2691-5.35.legrors,dodsonwc,kris-ethertonpm,kunselmanar,stettercm,williamsni,gnatukcl,estessj,flemingj,allisonkc,sarwerdb,coutifarisc,dokrasa.randomizedcontrolledtrialofpreconceptioninterventionsininfertilewomenwithpolycysticovarysyndrome.jclinendocrinolmetab2015;100:4048-58.36.legrors,dodsonwc,kunselmanar,stettercm,kris-ethertonpm,williamsni,gnatukcl,estessj,allisonkc,sarwerdb,diamondmp,schlaffwd,cassonpr,christmangm,barnhartkt,batesgw,usadir,lucidis,bakerv,zhangh,eisenberge,coutifarisc,dokrasa.benefitofdelayedfertilitytherapywithpreconceptionweightlossoverimmediatetherapyinobesewomenwithpcos.jclinendocrinolmetab2016;101:2658-66.37.desouzalr,bergerh,retnakaranr,maguirejl,nathensab,connellypw,rayjg.first-trimestermaternalabdominaladipositypredictsdysglycaemiaandgestationaldiabetesmellitusinmidpregnancy.diabetescare2016;39:61-4.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1