培美曲塞制剂的制作方法
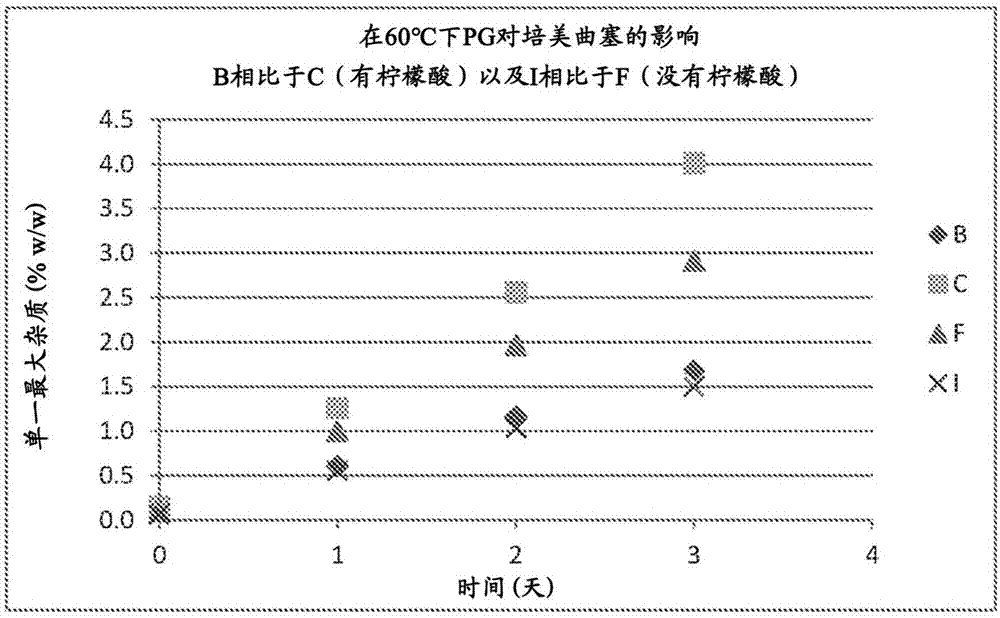
表现出抗叶酸剂活性的化合物具有众所周知的作为化学治疗剂的作用。一种这样的化合物是培美曲塞(pemetrexed),其具有化学名称n-[4-[2-(2-氨基-4,7-二氢-4-氧代-1h-吡咯并[2,3-d]嘧啶-5-基)乙基]苯甲酰基]-l-谷氨酸和式(1)的结构:培美曲塞用于治疗胸膜间皮瘤和非小细胞肺癌。alimta(礼来公司(elililly)的培美曲塞产品)目前以注射用冻干培美曲塞二钠的100mg和500mg小瓶供应。根据处方信息,为了制备输注用alimta,将小瓶在足够的0.9%氯化钠注射液(不含防腐剂)中重构,得到含有25mg/ml的alimta的溶液。然后将此浓缩溶液进一步稀释到0.9%氯化钠注射液(不含防腐剂)的溶液中。处方信息警告说,重构和进一步稀释仅建议使用0.9%氯化钠注射液(不含防腐剂),并且“alimta与含钙稀释剂(包括乳酸林格氏注射液(usp)和林格氏注射液(usp))在物理上不相容,因此不应该使用这些”。含钙稀释剂(诸如乳酸林格氏注射液和林格氏注射液)是医疗环境中用于在静脉内施用之前重构和/或稀释药物产品的常用溶液。需要在用含钙稀释剂重构和/或稀释后是化学稳定的培美曲塞剂型。除了可与更广泛的可用稀释剂一起使用之外,使用这样的剂型将最小化由于不适当的重构或稀释导致的剂型损失以及患者将被施用重构或稀释在不相容稀释剂中的培美曲塞的风险。在溶液中,培美曲塞经历水解并迅速降解。由于这种快速降解,培美曲塞制剂必须冻干以获得长期稳定性,或者包含稳定剂。然而,重构冻干制剂需要多个步骤,每个步骤都增加了使用者错误的风险。此外,冻干制剂的重构在临床上是不方便的并且可能需要长达30分钟。虽然已知稳定的即用型培美曲塞制剂,但它们需要稳定剂,诸如抗氧化剂或氨基酸,如us6,686,365、cn101081305和wo2012015810中所述;或者高水平的非水溶剂,如wo2013144814中所述。使患者对这些额外成分的暴露最小化将是有利的。因此,需要具有极少量的额外成分的稳定的非冻干培美曲塞组合物。为此,我们已开发了稳定的培美曲塞制剂。发明概述在某些实施方案中,本发明涉及药物组合物,该药物组合物包含培美曲塞和以小于0.30ml/ml的浓度存在的非水溶剂,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含该培美曲塞的初始剂量浓度的至少90%。在另外的实施方案中,本发明涉及药物组合物,该药物组合物包含25mg/ml的培美曲塞、250μl/ml的丙二醇和水,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含该培美曲塞的初始剂量浓度的至少90%。在仍另外的实施方案中,本发明涉及药物组合物,该药物组合物包含初始浓度为10至50mg/ml的培美曲塞和以小于0.30ml/ml的浓度存在的非水溶剂,其中该组合物在2℃至8℃的温度下储存至少12个月后包含该初始培美曲塞浓度的至少90%。在另外的实施方案中,本发明涉及药物组合物,该药物组合物包含25mg/ml的培美曲塞、250μl/ml的丙二醇和水,其中该组合物在2℃至8℃的温度下储存至少12个月后包含该初始培美曲塞浓度的至少90%。在某些实施方案中,本发明涉及药物组合物,该药物组合物包含培美曲塞和以小于0.30ml/ml的浓度存在的非水溶剂,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含不超过8%w/w的总杂质。在另外的实施方案中,本发明涉及药物组合物,该药物组合物包含25mg/ml的培美曲塞、250μl/ml的丙二醇和水,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含不超过8%w/w的总杂质。在仍另外的实施方案中,本发明涉及药物组合物,该药物组合物包含初始浓度为10至50mg/ml的培美曲塞和以小于0.30ml/ml的浓度存在的非水溶剂,该组合物在2℃至8℃的温度下储存至少24小时后包含不超过8%w/w的总杂质。在另外的实施方案中,本发明涉及药物组合物,该药物组合物包含25mg/ml的培美曲塞、250μl/ml的丙二醇和水,该组合物在2℃至8℃的温度下储存至少24小时后包含不超过8%w/w的总杂质。本发明的其他实施方案包括:1.一种药物组合物,其包含:a)培美曲塞,以及b)以小于0.30ml/ml存在的非水溶剂;其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少12小时后包含该培美曲塞的初始剂量浓度的至少90%。2.实施方案1的药物组合物,其中该组合物在稀释并储存选自以下项的时段时保留该培美曲塞的初始剂量浓度的至少90%:a)至少24小时,以及b)至少48小时。3.实施方案1的药物组合物,其中该组合物在稀释并储存选自以下项的时段时保留该培美曲塞的初始剂量浓度的至少95%:a)至少12小时,b)至少24小时,以及c)至少48小时。4.实施方案1的药物组合物,其中该组合物在稀释并储存选自以下项的时段时保留该培美曲塞的初始剂量浓度的至少98%:a)至少12小时,b)至少24小时,以及c)至少48小时。5.实施方案1的药物组合物,其中该药学上可接受的稀释剂选自由以下项组成的组:生理盐水、注射用水、5%葡萄糖水溶液、林格氏注射液和乳酸林格氏注射液。6.实施方案1的药物组合物,其包含10至50mg/ml的培美曲塞。7.实施方案6的药物组合物,其包含25mg/ml的培美曲塞。8.实施方案1的药物制剂,其中该非水溶剂选自由以下项组成的组:丙二醇、乙醇、聚乙二醇或其组合。9.实施方案8的药物制剂,其中该非水溶剂是丙二醇。10.实施方案9的药物制剂,其中丙二醇以250μl/ml存在。11.实施方案1的药物组合物,其包含至少0.50ml/ml的水。12.实施方案1的药物组合物,其中该培美曲塞呈培美曲塞二元酸的形式。13.实施方案1的药物组合物,其中该培美曲塞呈培美曲塞二钠的形式。14.实施方案1的药物组合物,其基本上不含抗氧化剂。15.一种药物组合物,其包含a)25mg/ml的培美曲塞,以及b)250μl/ml的丙二醇c)水其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含该培美曲塞的初始剂量浓度的至少90%。16.实施方案15的药物组合物,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少48小时后包含该培美曲塞的初始剂量浓度的至少90%。17.一种药物组合物,其包含:a)初始浓度为10至50mg/ml的培美曲塞,以及b)以小于0.30ml/ml存在的非水溶剂,其中该组合物在2℃至8℃的温度下储存至少12个月后包含该初始培美曲塞浓度的至少90%。18.实施方案17的药物组合物,其中该组合物在储存选自以下项的时段后包含该初始培美曲塞浓度的至少90%:a)至少18个月,以及b)至少24个月。19.实施方案17的药物组合物,其中该组合物在储存选自以下项的时段后包含该初始培美曲塞浓度的至少95%:a)至少12个月,b)至少18个月,以及c)至少24个月。20.实施方案17的药物组合物,其中该组合物在储存选自以下项的时段后包含该初始培美曲塞浓度的至少98%:a)至少12个月,b)至少18个月,以及c)至少24个月。21.实施方案17的药物组合物,其具有25mg/ml的初始培美曲塞浓度。22.实施方案17的药物制剂,其中该非水溶剂选自由以下项组成的组:丙二醇、乙醇、聚乙二醇或其组合。23.实施方案22的药物制剂,其中该非水溶剂是丙二醇。24.实施方案23的药物制剂,其中丙二醇以250μl/ml存在。25.实施方案17的药物组合物,其包含至少0.50ml/ml的水。26.实施方案17的药物组合物,其中该培美曲塞呈培美曲塞二元酸的形式。27.实施方案17的药物组合物,其中该培美曲塞呈培美曲塞二钠的形式。28.实施方案17的药物组合物,其基本上不含抗氧化剂。29.一种药物组合物,其包含a)25mg/ml的初始培美曲塞浓度,b)250μl/ml的丙二醇,以及c)水;其中该组合物在2℃至8℃的温度下储存至少12个月后包含该初始培美曲塞浓度的至少90%。30.实施方案29的药物组合物,其中该组合物在2℃至8℃的温度下储存至少24个月后包含该初始培美曲塞浓度的至少90%。31.一种药物组合物,其包含:a)培美曲塞,以及b)以小于0.30ml/ml存在的非水溶剂,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少12小时后包含不超过8%w/w的总杂质。32.实施方案31的药物组合物,其中该组合物在稀释并储存选自以下项的时段后包含不超过8%w/w的总杂质:a)至少24小时,以及b)至少48小时。33.实施方案31的药物组合物,其中该组合物在稀释并储存选自以下项的时段后包含不超过5%w/w的总杂质:a)至少12小时,b)至少24小时,以及c)至少48小时。34.实施方案31的药物组合物,其中该组合物在稀释并储存选自以下项的时段后包含不超过2%w/w的总杂质:a)至少12小时,b)至少24小时,以及c)至少48小时。35.实施方案31的药物组合物,其中该药学上可接受的稀释剂选自由以下项组成的组:生理盐水、注射用水、5%葡萄糖水溶液、林格氏注射液和乳酸林格氏注射液。36.实施方案31的药物组合物,其包含10至50mg/ml的培美曲塞。37.实施方案36的药物组合物,其包含25mg/ml的培美曲塞。38.实施方案31的药物制剂,其中该非水溶剂选自由以下项组成的组:丙二醇、乙醇、聚乙二醇或其组合。39.实施方案38的药物制剂,其中该非水溶剂是丙二醇。40.实施方案39的药物制剂,其中丙二醇以250μl/ml存在。41.实施方案31的药物组合物,其包含至少0.50ml/ml的水。42.实施方案31的药物组合物,其中该培美曲塞呈培美曲塞二元酸的形式。43.实施方案31的药物组合物,其中该培美曲塞呈培美曲塞二钠的形式。44.实施方案31的药物组合物,其基本上不含抗氧化剂。45.一种药物组合物,其包含a)25mg/ml的培美曲塞,b)250μl/ml的丙二醇,以及c)水;其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少24小时后包含不超过8%w/w的总杂质。46.实施方案45的药物组合物,其中在用药学上可接受的稀释剂稀释至培美曲塞的初始剂量浓度时,该组合物在2℃至8℃的温度下储存至少48小时后包含不超过8%w/w的总杂质。47.一种药物组合物,其包含:a)初始浓度为10至50mg/ml的培美曲塞,以及b)以小于0.30ml/ml存在的非水溶剂,其中该组合物在2℃至8℃的温度下储存至少12个月后包含不超过8%w/w的总杂质。48.实施方案47的药物组合物,其中该组合物在储存选自以下项的时段后包含不超过8%w/w的总杂质:a)至少18个月,以及b)至少24个月。49.实施方案47的药物组合物,其中该组合物在储存选自以下项的时段后包含不超过5%w/w的总杂质:a)至少12个月,b)至少18个月,以及c)至少24个月。50.实施方案47的药物组合物,其中该组合物在储存选自以下项的时段后包含不超过2%w/w的总杂质:a)至少12个月,b)至少18个月,以及c)至少24个月。51.实施方案47的药物组合物,其包含25mg/ml的培美曲塞。52.实施方案47的药物制剂,其中该非水溶剂选自由以下项组成的组:丙二醇、乙醇、聚乙二醇或其组合。53.实施方案52的药物制剂,其中该非水溶剂是丙二醇。54.实施方案53的药物制剂,其中丙二醇以250μl/ml存在。55.实施方案47的药物组合物,其包含至少0.50ml/ml的水。56.实施方案47的药物组合物,其中该培美曲塞呈培美曲塞二元酸的形式。57.实施方案47的药物组合物,其中该培美曲塞呈培美曲塞二钠的形式。58.实施方案47的药物组合物,其基本上不含抗氧化剂。59.一种药物组合物,其包含a)25mg/ml的初始培美曲塞浓度,b)250μl/ml的丙二醇,以及c)水;其中该组合物在2℃至8℃的温度下储存至少12个月后包含不超过8%w/w的总杂质。60.实施方案59的药物组合物,其中该组合物在2℃至8℃的温度下储存至少24个月后包含不超过8%w/w的总杂质。附图简述图1a-1d:描绘了丙二醇(pg)对某些培美曲塞制剂的稳定性的影响。发明详述除非另外定义,否则本文中使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。如果本文中使用的术语存在多个定义,除非另外说明,否则以本章节中的那些定义为准。如本文所用,“单一最大杂质”是指根据百分比具有最大hplc峰的杂质。如本文所用,“培美曲塞的初始剂量浓度”是指在储存之前,培美曲塞在稀释时的浓度。如本文所用,“初始培美曲塞浓度”是指在稀释和/或储存之前,培美曲塞在配制时的浓度。如本文所用,“室温”是约20℃至约25℃。培美曲塞或其药学上可接受的盐当作为无水培美曲塞二元酸计算时以约10mg/ml至约50mg/ml之间的浓度存在于本发明的组合物中。在本发明的某些实施方案中,培美曲塞以约10mg/ml至约40mg/ml、约10mg/ml至约30mg/ml、约10mg/ml至约20mg/ml、约20mg/ml至约50mg/ml、约20mg/ml至约40mg/ml、约20mg/ml至约30mg/ml、约30mg/ml至约50mg/ml、约30mg/ml至约40mg/ml或约40mg/ml至约50mg/ml存在。在本发明的另外的实施方案中,培美曲塞以约10mg/ml、约15mg/ml、20mg/ml、约25mg/ml、约30mg/ml、约35mg/ml、约40mg/ml、约45mg/ml或约50mg/ml可用。培美曲塞作为二元酸、一元酸、药学上可接受的盐或其组合存在于组合物中。在本发明的某些实施方案中,培美曲塞作为培美曲塞二钠存在,在本发明的另外的实施方案中,培美曲塞作为培美曲塞二钾存在。在本发明的又另外的实施方案中,培美曲塞作为培美曲塞葡甲胺存在。在本发明的仍另外的实施方案中,培美曲塞作为培美曲塞氨丁三醇存在。非水溶剂合适的非水溶剂包括但不限于醇、酮、酯、醚、芳烃、腈、非质子极性溶剂、酸性溶剂及其任何两种或更多种的混合物。可用的醇包括例如甲醇、乙醇、变性酒精、正丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、多羟基醇,例如甘油、丙二醇、聚乙二醇、二甘醇、双甘油、三甘醇、四甘醇、三羟甲基丙烷等。可用的酮包括丙酮、2-丁酮等。可用的酯包括例如乙酸乙酯、乙酸正丙酯、乙酸异丙酯、乙酸正丁酯、乙酸叔丁酯等。可用的醚包括例如二甲醚、二乙醚、甲基叔丁基醚、乙基甲基醚、二异丙基醚等。可用的芳烃包括例如等。可用的腈包括乙腈、丙腈等。可用的非质子极性溶剂包括n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、n,n-二甲基乙酰胺(dma)等。在本发明的某些实施方案中,非水溶剂是醇。在本发明的另外的实施方案中,非水溶剂是多羟基醇。在本发明的仍另外的实施方案中,非水溶剂是丙二醇。在本发明的又另外的实施方案中,非水溶剂是聚乙二醇。在本发明的具体实施方案中,非水溶剂是低分子量聚乙二醇。在本发明的其他实施方案中,非水溶剂选自由以下项组成的组:聚乙二醇200、聚乙二醇300、聚乙二醇400或其组合。在本发明的某些实施方案中,存在多于一种的非水溶剂,诸如但不限于聚乙二醇和丙二醇。在本发明的某些实施方案中,非水溶剂在稀释之前以约50mg/ml至300mg/ml的浓度存在。在本发明的另外的实施方案中,非水溶剂在稀释之前以约50mg/ml至100mg/ml、50mg/ml至200mg/ml、50mg/ml至250mg/ml、50mg/ml至300mg/ml、100mg/ml至200mg/ml、100mg/ml至250mg/ml、100mg/ml至300mg/ml、200mg/ml至250mg/ml、200mg/ml至300mg/ml或250mg/ml至300mg/ml存在。在具体实施方案中,非水溶剂在稀释之前以制剂的不超过30重量百分比(wt.%)的浓度存在。在另外的实施方案中,非水溶剂在稀释之前以制剂的至少5重量百分比(wt.%)的浓度存在。在本发明的某些实施方案中,非水溶剂在稀释之前以制剂的5-30重量百分比(wt.%)存在。在本发明的具体实施方案中,非水溶剂在稀释之前以约10-30wt.%、15-30wt.%、20-30wt.%、25-30wt.%、5-28wt.%、10-28wt.%、15-28wt.%、20-28wt.%、25-28wt.%、5-25wt.%、10-25wt.%、15-25wt.%、20-25wt.%、25-28wt.%、5-20wt.%、10-20wt.%、15-20wt.%、5-15wt.%、10-15wt.%或5-10wt.%存在。在具体实施方案中,非水溶剂在稀释之前以不超过300μl/ml的浓度存在。在另外的实施方案中,非水溶剂在稀释之前以至少50μl/ml的浓度存在。在本发明的某些实施方案中,非水溶剂以约50μl/ml至300μl/ml的浓度存在。在本发明的另外的实施方案中,非水溶剂在稀释之前以约50μl/ml至100μl/ml、50μl/ml至200μl/ml、50μl/ml至250μl/ml、50μl/ml至275μl/ml、50μl/ml至300μl/ml、100μl/ml至200μl/ml、100μl/ml至250μl/ml、100μl/ml至275μl/ml、100μl/ml至300μl/ml、200μl/ml至250μl/ml、200μl/ml至300μl/ml或250μl/ml至300μl/ml存在。在某些实施方案中,水在稀释之前以至少约500μl/ml的浓度存在。在本发明的其他实施方案中,水在稀释之前以至少约600μl/ml、750μl/ml或950μl/ml的浓度存在。在本发明的另外的实施方案中,水在稀释之前以约500μl/ml至950μl/ml的浓度存在。在本发明的仍另外的实施方案中,水在稀释之前以约500μl/ml至800μl/ml、500μl/ml至700μl/ml、500μl/ml至600μl/ml、600μl/ml至750μl/ml、600μl/ml至800μl/ml、600μl/ml至950μl/ml、700μl/ml至800μl/ml、700μl/ml至950μl/ml或750μl/ml至950μl/ml存在。在具体实施方案中,水在稀释之前以制剂的至少约50wt.%的浓度存在。在另外的实施方案中,水在稀释之前以至少约60wt.%、75wt.%或95wt.%的浓度存在。在本发明的某些实施方案中,水在稀释之前以至少约50-95wt.%的浓度存在。在本发明的某些实施方案中,水在稀释之前以至少约50-60wt.%、50-70wt.%、50-80wt.%、60-70wt.%、60-80wt.%、60-95wt.%、70-80wt.%或70-95wt.%的浓度存在。在本发明的某些实施方案中,该制剂基本上不含抗氧化剂和/或氨基酸。在本发明的具体实施方案中,该制剂基本上不含抗氧化剂。在本发明的另外的实施方案中,该制剂基本上不含螯合剂。如本文所用,基本上不含抗氧化剂、氨基酸和/或螯合剂意指该制剂不包含足以具有稳定作用的浓度的一种或多种抗氧化剂、氨基酸和/或螯合剂。在具体实施方案中,该制剂基本上不含选自由以下项组成的组的添加剂:抗坏血酸及衍生物、生育酚及衍生物、没食子酸丙酯、硫代甘油、乳糖酸、甲硫氨酸、叔丁基氢醌(tbhq)、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、甲醛次硫酸氢钠、亚硫酸氢钠、乙二胺四乙酸(edta)及衍生物、龙胆酸单乙醇胺、谷胱甘肽、丙酸、丙酮合亚硫酸氢钠、连二亚硫酸钠、柠檬酸及衍生物即三元(柠檬酸三钠二水合物)或其合适混合物。如本文所用,基本上不含意指该制剂不包含足以具有稳定作用的浓度的一种或多种以上列出的添加剂。在本发明的具体实施方案中,该制剂包含氨丁三醇。在本发明的某些实施方案中,该制剂包含约12至24mg/ml的氨丁三醇。在本发明的另外的实施方案中,该制剂包含约12至14mg/ml的氨丁三醇、约12至16mg/ml的氨丁三醇、约14至16mg/ml的氨丁三醇、约14至18mg/ml的氨丁三醇、约16至18mg/ml的氨丁三醇、约16至20mg/ml的氨丁三醇、约17至19mg/ml的氨丁三醇、约17至21mg/ml的氨丁三醇、约18至20mg/ml的氨丁三醇、约18至22mg/ml的氨丁三醇、约20至22mg/ml的氨丁三醇、约20至24mg/ml的氨丁三醇或约22至24mg/ml的氨丁三醇。在本发明的又另外的实施方案中,该制剂包含约18mg/ml的氨丁三醇。在本发明的某些实施方案中,该制剂在室温下储存至少约6个月后未显著降解。在本发明的具体实施方案中,该制剂在室温下储存至少约1年后未显著降解。在本发明的另外的实施方案中,该制剂在室温下储存至少约18个月后未显著降解。在本发明的仍另外的实施方案中,该制剂在室温下储存至少约2年后未显著降解。在本发明的另外的实施方案中,该制剂在2℃-8℃下储存至少约6个月后未显著降解。在本发明的某些实施方案中,该制剂在2℃-8℃下储存至少约1年后未显著降解。在本发明的另外的实施方案中,该制剂在2℃-8℃下储存至少约18个月后未显著降解。在本发明的仍另外的实施方案中,该制剂在2℃-8℃下储存至少约2年后未显著降解。在本发明的其他实施方案中,该制剂在室温下储存至少约6个月、约12个月、约18个月或约24个月后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的另外的实施方案中,该制剂在2℃-8℃下储存至少约6个月、约12个月、约18个月或约24个月后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的仍另外的实施方案中,该制剂在室温下储存至少约6个月、约12个月、约18个月或约24个月后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的又另外的实施方案中,该制剂在2℃-8℃下储存至少约6个月、约12个月、约18个月或约24个月后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的具体实施方案中,在室温下储存至少约6个月、约12个月、约18个月或约24个月后,该制剂保留其初始培美曲塞浓度的至少约85%、其初始培美曲塞浓度的至少约90%,该制剂保留其初始培美曲塞浓度的至少约92%、其初始培美曲塞浓度的至少约95%,该制剂保留其初始培美曲塞浓度的至少约97%、其初始培美曲塞浓度的至少约98%、其初始培美曲塞浓度的至少约99%、其初始培美曲塞浓度的至少约99.5%。在本发明的另外的实施方案中,在2℃-8℃下储存至少约6个月、约12个月、约18个月或约24个月后,该制剂保留其初始培美曲塞浓度的至少约85%、其初始培美曲塞浓度的至少约90%,该制剂保留其初始培美曲塞浓度的至少约92%、其初始培美曲塞浓度的至少约95%,该制剂保留其初始培美曲塞浓度的至少约97%、其初始培美曲塞浓度的至少约98%、其初始培美曲塞浓度的至少约99%、其初始培美曲塞浓度的至少约99.5%。在本发明的某些实施方案中,将该制剂在药学上可接受的稀释剂中进一步稀释。合适的稀释剂包括但不限于盐水、葡萄糖、水、林格氏注射液和乳酸林格氏注射液。在本发明的某些实施方案中,可以将该制剂在含钙稀释剂(诸如林格氏注射液或乳酸林格氏注射液)中稀释。在本发明的具体实施方案中,将该制剂在药学上可接受的稀释剂中稀释至培美曲塞的合适初始剂量浓度。在本发明的某些实施方案中,培美曲塞的初始剂量浓度基于各种因素,诸如但不限于患者的体重、年龄和病状以及稀释剂的体积,并且可以由医师或本领域技术人员确定。在另外的实施方案中,将培美曲塞稀释至初始剂量浓度并且可以将其在施用前进一步稀释。在本发明的其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约12小时后保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其培美曲塞的初始剂量浓度的至少约95%、其培美曲塞的初始剂量浓度的至少约97%、其培美曲塞的初始剂量浓度的至少约98%、其培美曲塞的初始剂量浓度的至少约99%、其培美曲塞的初始剂量浓度的至少约99.5%。在本发明的仍其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约24小时后保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其培美曲塞的初始剂量浓度的至少约95%、其培美曲塞的初始剂量浓度的至少约97%、其培美曲塞的初始剂量浓度的至少约98%、其培美曲塞的初始剂量浓度的至少约99%、其培美曲塞的初始剂量浓度的至少约99.5%。在本发明的又其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约48小时后保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其培美曲塞的初始剂量浓度的至少约95%、其培美曲塞的初始剂量浓度的至少约97%、其培美曲塞的初始剂量浓度的至少约98%、其培美曲塞的初始剂量浓度的至少约99%、其培美曲塞的初始剂量浓度的至少约99.5%。在本发明的另外的实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约12小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约24小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的又其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约48小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的仍其他实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约12小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的另外的实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约24小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的仍另外的实施方案中,该制剂在稀释并在约2℃至约8℃下储存至少约48小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的其他实施方案中,该制剂在稀释并在室温下储存至少约12小时后保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其培美曲塞的剂量浓度的至少约95%、其培美曲塞的剂量浓度的至少约97%、其培美曲塞的剂量浓度的至少约98%、其培美曲塞的剂量浓度的至少约99%、其培美曲塞的剂量浓度的至少约99.5%。在本发明的仍其他实施方案中,该制剂在稀释并在室温下储存至少约24小时后保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其培美曲塞的剂量浓度的至少约95%、其培美曲塞的剂量浓度的至少约97%、其培美曲塞的剂量浓度的至少约98%、其培美曲塞的剂量浓度的至少约99%、其培美曲塞的剂量浓度的至少约99.5%。在本发明的又其他实施方案中,在稀释并在室温下储存至少约48小时后,该制剂保留其培美曲塞的初始剂量浓度的至少约85%、其培美曲塞的初始剂量浓度的至少约90%、其培美曲塞的初始剂量浓度的至少约92%、其初始培美曲塞浓度的至少约95%,该制剂保留其初始培美曲塞浓度的至少约97%、其初始培美曲塞浓度的至少约98%、其初始培美曲塞浓度的至少约99%、其初始培美曲塞浓度的至少约99.5%。在本发明的另外的实施方案中,该制剂在稀释并在室温下储存至少约12小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的其他实施方案中,该制剂在稀释并在室温下储存至少约24小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的又其他实施方案中,该制剂在稀释并在室温下储存至少约48小时后包含不超过约10%w/w的杂质、不超过约8%w/w的杂质、不超过约6%w/w的杂质、不超过约5%w/w的杂质、不超过约4%w/w的杂质、不超过约3.5%w/w的杂质、不超过约3%w/w的杂质、不超过约2.5%w/w的杂质、不超过约2%w/w的杂质、不超过约1.5%w/w的杂质、不超过约1%w/w的杂质、不超过约0.5%w/w的杂质、不超过约0.2%w/w的杂质、不超过约0.1%w/w的杂质。在本发明的另外的实施方案中,该制剂在稀释并在室温下储存至少约12小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的又另外的实施方案中,该制剂在稀释并在室温下储存至少约24小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的仍另外的实施方案中,该制剂在稀释并在室温下储存至少约48小时后包含不超过约10%w/w的单一最大杂质、不超过约8%w/w的单一最大杂质、不超过约6%w/w的单一最大杂质、不超过约5%w/w的单一最大杂质、不超过约4%w/w的单一最大杂质、不超过约3.5%w/w的单一最大杂质、不超过约3%w/w的单一最大杂质、不超过约2.5%w/w的单一最大杂质、不超过约2%w/w的单一最大杂质、不超过约1.5%w/w的单一最大杂质、不超过约1%w/w的单一最大杂质、不超过约0.5%w/w的单一最大杂质、不超过约0.2%w/w的单一最大杂质、不超过约0.1%w/w的单一最大杂质。在本发明的具体实施方案中,该制剂是在顶部空间氧气浓度小于约20v/v%、18v/v%、16v/v%、14v/v%、12v/v%、10v/v%、8v/v%、6v/v%、5v/v%、4v/v%、3v/v%、2v/v%或1v/v%氧气的小瓶中。在本发明的某些实施方案中,该制剂是在单剂量小瓶中。在本发明的另外的实施方案中,该制剂是在多剂量小瓶中。在本发明的又另外的实施方案中,该制剂是在旨在供同一患者使用的多剂量小瓶中。在本发明的仍另外的实施方案中,该制剂是在旨在供不同患者使用的多剂量小瓶中。在另一个实施方案中,本发明涉及向有需要的患者施用培美曲塞的方法,该方法包括施用有效量的如本文所述的制剂。在一个另外的实施方案中,本发明涉及向有需要的患者施用培美曲塞的方法,该方法包括施用有效量的包含培美曲塞和以小于30wt.%存在的非水溶剂的制剂。在一个另外的实施方案中,本发明涉及向有需要的患者施用培美曲塞的方法,该方法包括施用有效量的包含培美曲塞和丙二醇的制剂,其中丙二醇以5-30wt.%存在。实施例实施例1:非水溶剂对培美曲塞稳定性的影响如表1中所述的制剂制备如下:将注射用水、合适的碱溶液(0.1-1nnaoh或koh)和柠檬酸(当存在时)合并并且混合以产生视觉上均匀的混合物。在连续搅拌下将培美曲塞二元酸渐增地加入到混合物中,并且搅拌所得的均匀悬浮液直至所有固体完全溶解。将溶液的ph调节至约7.4-7.6。然后将丙二醇(当存在时)加入到培美曲塞溶液中,并且搅拌混合物直至获得视觉上均匀的混合物。将溶液的ph调节至7.4-7.6。在60℃和40℃/75%rh下的加速条件下测试制剂b、c、f和i在几天的过程中的稳定性。在不同时间点获取样品并且在测试之前将其用hplc稀释剂(60:40(v/v,水:acn))稀释。通过hplc测量杂质。结果在表2a-2d和图1a-1d中示出。表2a:在60℃下储存后的单一最大杂质(%w/w)表2b:在60℃下储存后的总杂质(%w/w)总杂质bcfi初始0.690.920.740.70第1天1.502.352.021.39第2天2.203.933.312.04第3天2.865.634.542.65表2c:在40℃/75%rh下储存后的单一最大杂质(%w/w)rrt0.87bcfi初始0.090.150.100.072天1.706.363.361.334天3.2913.449.242.35表2d:在40℃/75%rh下储存后的总杂质(%w/w)总杂质bcfi初始0.690.920.740.702天3.6311.757.282.754天6.0520.9416.714.31还测量制剂b、i和k(参见表4,如上所述制备)的长期稳定性(实时的和预测的)。结果在表3中示出。表3:培美曲塞制剂b、i和k的长期稳定性表4:培美曲塞制剂k成分/ml培美曲塞二元酸25.0mg丙二醇250μl氨丁三醇适量至ph7.4-7.6盐酸适量至ph7.4-7.6注射用水适量至1ml实施例2:稀释后培美曲塞制剂k的稳定性。评价在稀释制剂k后培美曲塞长达48小时的稳定性。生理盐水、注射用水和5%葡萄糖水溶液、林格氏注射液和乳酸林格氏注射液是直接购买的并且按原样使用。测试每种稀释剂的ph并且记录在表6中。表6:稀释剂的ph稀释剂ph生理盐水(ns)6.8注射用水(wfi)7.01林格氏注射液(lr)6.6乳酸林格氏注射液(lrs)6.55%葡萄糖水溶液(d5w)7.5将制剂k(25mg/ml)在以上列出的稀释剂中稀释至0.15、1.5和15mg/ml。将混合物储存在2℃-8℃并在12、24和48小时时测试外观、含量分析、杂质和ph。稀释后立即获取样品以成为零时间样品。在不进一步稀释的情况下原样分析0.15mg/ml样品,同时在测试之前用hplc稀释剂(60:40(v/v,水:acn))稀释1.5mg/ml和15mg/ml样品。结果列于表6和7中(每个表代表单独的研究)。表6:在生理盐水或注射用水中稀释后制剂k的稳定性表7:在林格氏注射液、乳酸林格氏注射液或5%葡萄糖中稀释后制剂k的稳定性前面的发明详述仅仅为了清楚理解的目的而给出,而不应从中理解出不必要的限制,因为修改对本领域技术人员来说是显而易见的。尽管已经结合本发明的具体实施方案对本发明进行了描述,但应当理解能够对本发明进行进一步的修改,并且本申请旨在涵盖总体上遵循本发明的原理,并且包括属于本发明所属领域内的已知或惯常实践的且可以应用于上文所述的和如下在所附权利要求范围之内的实质特征的与本公开文本的此类偏离的对本发明进行的任何变动、使用或改编。本文所引用的每个专利、专利申请和出版物的公开内容(包括权利要求、图和/附图)特此以引用的方式以其整体并入本文。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1