一种具有药物两相脉冲控释功能的核壳纳米颗粒及制备方法与流程
技术领域
本发明属于材料学领域,涉及一种药物缓控释纳米材料,具体来说是一种具有药物两相脉冲控释功能的核壳纳米颗粒及制备方法。
背景技术:
高压静电喷雾技术(简称电喷)是一种自上而下(top-down)的微纳米制造技术,该技术通过外加电场力克服喷头尖端液滴的液体表面张力和粘弹力而形成射流,在静电斥力、库仑力和表面张力共同作用下,被雾化后的液体由于巨大的表面积,溶剂迅速挥发,聚合物溶质被干燥成细小的微纳米颗粒。该技术工艺过程简单、操控方便、选择聚合物材料范围广泛、可控性强、能够实现连续工业化生产,应用该技术制备功能微纳米颗粒具有良好的前景。
电喷聚合物功能纳米颗粒一般以成纤聚合物为基材,通过加入活性成分而赋予纳米颗粒功能,并充分利用电喷纳米颗粒尺寸微小、表面积巨大而充分发挥活性成分的效用。在生物医药领域,一般将药物加入聚合物溶液,形成共溶溶液作为电喷工作液,通过普通电喷过程的快速干燥和成型,获得药物均匀分布在整个纳米颗粒的载药纳米颗粒。大部分载药纳米颗粒都是该类药物均匀分布的、结构单一的纳米颗粒。它们主要通过聚合物载体材料的理化性能和纳米颗粒膜的特点而获得所需要的药物缓控释性能。目前虽有少量通过同轴电喷来实施对药物的有效包封,以获得所需药物控释性能的电喷核壳纳米颗粒,但是还没有发现将核壳纳米结构特点和局部成分设置进行有效调控以获得药物两相脉冲的相关应用。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了一种具有药物两相脉冲控释功能的核壳纳米颗粒及制备方法,所述的这种具有药物两相脉冲控释功能的核壳纳米颗粒及制备方法要解决现有技术中的电喷聚合物功能纳米颗粒缓释控制效果不佳的技术问题。
本发明提供了一种具有药物两相脉冲控释功能的核壳纳米颗粒,包括一个内核,所述的内核的外侧设置有一个外壳,所述的内核由药物和pH-敏感型聚合物药用辅料组成,在所述的内核中,所述的药物和pH-敏感型聚合物药用辅料的质量比为1:10~20;在所述的外壳中,所述的药物和易溶于水的药用辅料的质量比为1:4~8。
进一步的,在所述的内核中,所述的聚合物药用辅料不溶于水。
进一步的,在所述的内核中,所述的药物和pH-敏感型聚合物药用辅料的质量比为1:15;在所述的外壳中,所述的药物和易溶于水的药用辅料的质量比为1:5。
进一步的,所述的聚合物药用辅料为pH-敏感型药用聚合物辅料。
进一步的,所述的药物为酮洛芬;所述的聚合物药用辅料为虫胶;所述的易溶于水的药用辅料为聚乙烯吡咯烷酮K10。
进一步的,所述的药物为小分子化学合成药物或者中药活性成分。
本发明还提供了上述的一种具有药物两相脉冲控释功能的核壳纳米颗粒的制备方法,包括如下步骤:
1)采用第一有机溶剂,将用于外壳部的水溶性聚合物和药物调配成共溶溶液,作为外壳部的工作流体;
2)采用第二有机溶剂,将用于内核部的pH-敏感型聚合物药用辅料和药物调配成共溶溶液,作为内核部工作流体;
3)将外壳部的工作流体设置在一个第一注射器中,所述的第一注射器安装到第一注射泵中;
4)将内核部的工作流体设置在一个第二注射器中,所述的第二注射器安装到第二注射泵中;
5)所述的第一注射器和第二注射器分别连接一个同轴喷头;
6)采用一个高压发生器,所述的高压发生器和一个同轴喷头的两个入口连接;
7)通过两台注射泵分别控制两种溶液注入同轴喷头的速率,开启高压发生器,在高压静电的作用下,以同轴喷头出口为模板,通过接地颗粒接收平板收集具有药物两相脉冲控释功能的核壳纳米颗粒。
进一步的,所述的第一有机溶剂和所述的第二有机溶剂为无水乙醇。
本发明的纳米颗粒具有核壳结构特征,通过纳米颗粒的核壳双层采用不同溶解性能的聚合物基材,在结构的支撑下,能够调控所载的药物通过两相脉冲的方式释放。颗粒的壳部采用的药用辅料是易溶于水的,在接触到溶出液后,能够快释放出其中所含的部分药物;颗粒核部采用的pH-敏感型聚合物,在酸性条件下不溶,但是在中性和碱性条件下溶解。两种聚合物的组合能够充分保证药物在经口给药后根据人体消化道的生理特点获得两相脉冲控释模式。
本发明和已有技术相比,其技术进步是显著的。本发明的核壳电喷纳米颗粒通过同轴电喷工艺制备,药物在初期脉冲快速释放后,经过一段时间药物近似零释放后,药物随即开始第二相的脉冲快速释放。通过将纳米颗粒充胶囊等方式,可以直接开发出药物的经口给药系统,提供安全有效的药物控释方式。该核壳结构纳米颗粒能够为众多药物的两相脉冲提供实施方法。而且本发明的制备工艺简单,单步有效、制备的纳米颗粒核壳结构清晰。
附图说明
图1为本发明的两相脉冲纳米颗粒的同轴电喷制备过程拍摄图;
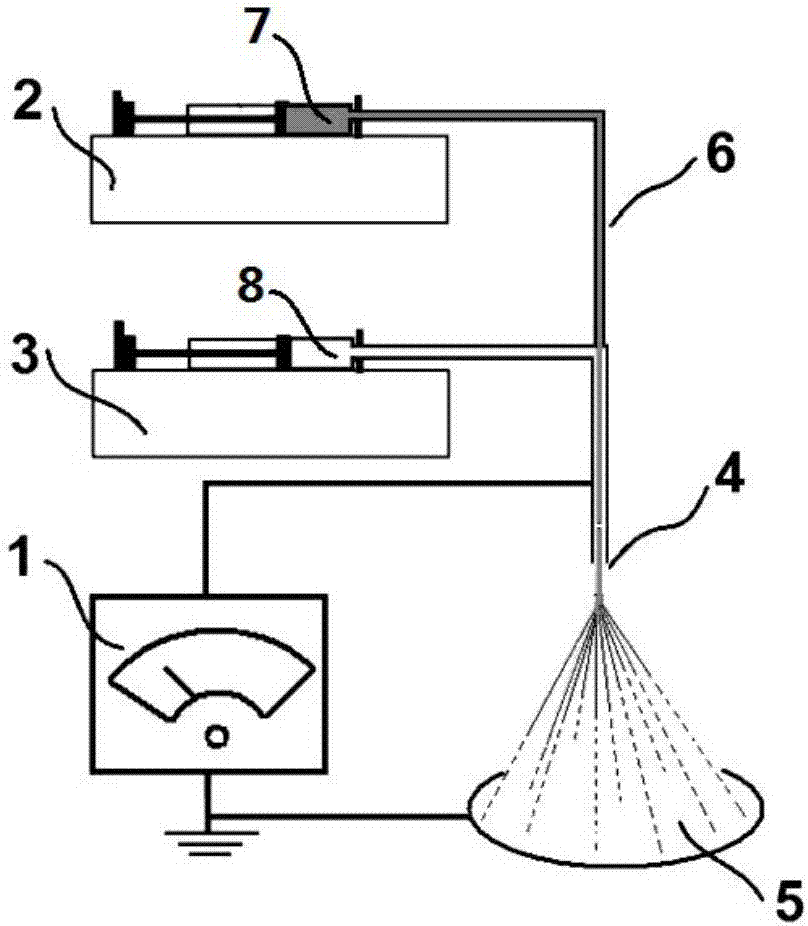
图2为本发明所采用的同轴电喷装置示意图;
图3为本发明的两相脉冲纳米颗粒的扫描电子显微镜图;
图4为本发明的两相脉冲纳米颗粒的透射电子显微镜图;
图5 为本发明的两级控释纳米颗粒的内部结构示意图;
图6为本发明的两相脉冲纳米颗粒的药物体外药物两相脉冲释放图;
具体实施方式
以下结合附图和实施例对本发明进行详细说明。这些实施例仅用于解释本发明而不是用于限制本发明。凡采用与本发明相同或相似的方法,或做出的等价修改,均应落入本发明保护范围。
实施例1:电喷工艺实施和核壳纳米颗粒的制备
将2克药物酮洛芬和10克聚乙烯吡咯烷酮K10共溶于100 ml 的无水乙醇中,配制壳部电喷工作流体。
将2克药物酮洛芬和30克虫胶共溶于100 ml 无水乙醇,配制成核部电喷工作流体。
将上述两种工作流体分别装入相应的注射器7、8中,安装到各自注射泵2、3上,并连接到同轴喷头4的入口中,接通高压纺丝头4和高压发生器1。
通过两台注射泵2、3分别控制核壳溶液注入同轴纺丝头4的速率,核壳流速均为1.0 mL/h,颗粒接收板5离核壳喷丝口距离为15 cm , 环境温度为 (20±2) ℃,环境湿度为58±5%。在上述工况下,开启高压发生器1,电压18 kV,对电喷过程进行原位放大拍摄,结果如图1所示,从同轴喷头4出来两股流体形成一个复合泰勒锥体,锥体的顶端发出一个直线射流,随后开始高压静电喷雾的雾化过程。
本发明采用一种同轴高压静电喷雾装置如图2所示,包括高压发生器1;第一注射泵2、第二注射泵3、同轴喷头4、颗粒接收板5、硅胶软管6、第一注射器7、第二注射器8组成,所述的第一注射器7安装在第一注射泵2中,所述第一注射器7通过所述的硅胶软管6和所述的同轴喷头4的一个入口连接,所述的第二注射器8安装在第二注射泵3中,所述第二注射器8和所述的同轴喷头4的另外一个入口连接,所述的高压发生器1和所述的同轴喷头4连接,所述的同轴喷头4下端设置有一个纤维接收板5。上述的高压发生器1;第一注射泵2、第二注射泵3、同轴喷头4、纤维接收板5、硅胶软管6、第一注射器7、第二注射器8都可以通过市场购买获得。
实施例2:电喷两相脉冲纳米颗粒的结构和形貌表征
采用场发射扫描电镜(FESEM)对实施例1所制备颗粒进行表面喷金后观察,结果如图3所示。所制备的颗粒呈现良好的圆球型、颗粒堆积均匀。直径为 890 ± 130 nm,分布比较均匀,直径分布比较集中。
采用高分辨透射电子显微镜(TEM)对所制备颗粒内部结构进行观察,结果如图4所示,纳米颗粒的核壳结构特征清晰。颗粒内部结构如图5所示,药物33均匀地分散在鞘部11聚合物聚乙烯吡咯烷酮和芯部22虫胶之中。
实施例3:电喷两相脉冲纳米颗粒的药物控释功能分析
按中国药典2015版附录ⅩD释放度测定第二法浆法,采用RCZ-8A智能溶出实验仪进行对上述所得的纳米颗粒进行体外溶出试验。控制转速50rpm,温度为37±0.1℃。在前2h内采用不加酶的人工胃液900mL为溶出介质,后面采用不加酶的人工肠液(pH6.8的磷酸盐缓冲溶液)900mL为溶出介质,考察纳米颗粒的药物体外控释性能。按预定时间取样5mL,0.22 µm微孔滤膜过滤,得到溶出液样品,并立刻补充同体积等温新鲜介质。对样品适当稀释后,在λ=264 nm处,采用紫外可见分光光度计进行紫外测定,计算药物酮洛芬的累积溶出百分比,重复6次。结果如图6所示,从图中可以看出,药物呈现明显的二级脉冲释放效果。由于外壳聚乙烯吡咯烷酮的聚合物基材易溶于水,在纳米纤维接触人工胃液后,马上脉冲释放第一级的全部药物。在随后的2个小时中,核部消失,由于芯部虫胶不溶于酸,所以其所载的酮洛芬几乎不会释放。当转入中性的人工肠液之后,由于虫胶快速溶解,药物获得第二级的脉冲释放效果。这种药物控释效果不仅仅可以降低药物毒副作用、延长药物治疗效果、减少给药次数并提高生物利用度,而且可以为许多特殊疾病(如许多心血管疾病高血压、缺血性心脏病、心绞痛等具有明显的昼夜节律性疾病,一些夜发性和晨发性疾病)提供一种临睡前服药而凌晨释药的脉冲制剂,用以该类疾病的预防与治疗。
实施例4:中药活性成分白藜芦醇的两相脉冲电喷纳米颗粒
按照实施例子1的纺丝液调配方法和实施工艺条件,制备白藜芦醇的两相脉冲纳米颗粒,按照实施例3进行药物体外溶出实验,检测颗粒对药物的控释性能,结果表明,药物白藜芦醇的体外释放具有明显的两相脉冲释放特点。
- 还没有人留言评论。精彩留言会获得点赞!