一种由脏毒清制备的含药血清及其制备方法和应用与流程
本发明属于生物药物领域,具体涉及一种由脏毒清制备的含药血清及其制备方法和在治疗结肠癌上的应用。
背景技术:
结肠癌是世界上最常见的恶性肿瘤之一,它的发病率和死亡率在世界上分别居于第二位和第三位,四十到五十岁之间发病率最高,且男性发病率为女性的2到3倍,早已成为威胁人类健康的重大疾病之一。结肠癌主要为腺癌、黏液腺癌、未分化癌,其主要发病原因是高脂肪食物摄入过多和纤维素摄入不足。近年来,临床上对结肠癌的治疗已取得较大进步,目前西医治疗结肠癌多采用手术、放化疗等方法,但总体治疗效果仍不佳。因此,探索新型低毒高效的抗结肠癌中医药非常有意义。中药是中华民族的宝贵财富,有史以来为中华民族的繁衍昌盛做出了巨大贡献,其治疗理念源远流长,符合先进医学的发展方向,抗肿瘤有独特的优势。中医认为,结肠癌是由于脏腑不和,正气虚弱或气滞血瘀,毒邪凝聚所致,一般都会采用具有扶正固本、清湿消热等功能的中药配方进行治疗。
脏毒清(ZDQ)是由闻名全国的老中医--河南中医学院一附院终身教授张东岳先生总结了治疗结肠癌等肛肠病的多年经验的基础上,精心筛选整理而成,其中药方剂为当归15g,党参20g,焦白术30g,半枝莲30g,山慈菇20g,白花蛇舌草30g,白头翁30g,炙鳖甲20g。当归功效在于补血,活血,调经止痛,润燥滑肠;党参功效在于补中益气,健脾益肺;焦白术功效在于健脾益气,燥湿利水,止汗,安胎;半枝莲功效在于凉血解毒,散瘀止痛,消肿和清热利湿;山慈菇功效在于清热解毒,消痈散结;白花蛇舌草功效在于清热解毒、消痛散结、利尿除湿;白头翁功效在于止痢解毒;炙鳖甲功效在于滋阴潜阳,软坚散结。该方剂中八味药材相辅相成,具有抗炎消肿攻毒,益气健脾养血,和胃化瘀止痛,软坚散结消瘤的功效,临床上常被应用于各种正虚邪恋型大肠肿瘤及脏毒证等疾病并取得良好疗效。
中药血清药理学的相关研究在近年来中药或中药复方研究有了新的进展,它主要是通过模拟中药或中药复方在体内的消化、吸收、转化、代谢的一些过程,然后通过采集服用(或注射)中药的动物的血液并分离血清,进行体外培养实验研究的一种新的方法。中药服用或注射的方法及简称如下:静脉注射(iv)、腹腔注射(ip)、口服(po)、皮下注射(ih)、灌胃(ig)、肌注(im)、静滴(iv)等。这种实验方法的提出,既可以在一定程度上排除中药或中药复方直接进行体外实验所产生的难以确定的因素干扰,也可以使实验结果的可信度大大提高,更重要的是中药血清使疗效更加显著。芦冲等研究发现,半枝莲醇提物灌胃大鼠经处理获得的含药血清对HT-29人结肠癌细胞有抑制作用,作用机制可能不仅与抑制细胞生长有关,还和阻滞细胞生长周期及诱导细胞凋亡有关。范钦等研究发现,九香虫灌胃后处理得到的含药血清孵育SW480人结肠癌细胞,可促使结肠癌细胞凋亡,并影响凋亡相关因子P53、FADD的表达,从而达到抗肿瘤作用。肖海娟等研究发现,肠胃清灌胃大鼠经处理获得的含药血清能够逆转HCT116人结肠癌铂类化疗耐药,其机制与促进肿瘤细胞DNA损伤、诱导凋亡有关。李素云等研究发现,扶正抑癌方灌胃大鼠经处理获得的含药血清通过上调上皮钙黏蛋白表达和下调神经钙黏蛋白的表达,抑制lovo细胞的间叶表型细胞即发生上皮间质化转变,从而降低lovo细胞的侵袭力和运动能力。李傲等研究发现,加味三棱丸灌胃大鼠经处理获得的含药血清可能是通过降低内异症在位内膜细胞雌二醇的分泌水平,从而降低血管内皮生长因子的表达和分泌,发挥其抑制血管生成的作用。安永康等用脏毒清干预体外培养的SW480结肠癌细胞研究发现,脏毒清具有促进人结肠癌细胞凋亡的作用,并通过线粒体凋亡途径发挥作用。目前常用的结肠癌细胞系有HCT116,HCT8,HT-29,LS174T,LOVO,SW480,SW620等。但暂未发现使用脏毒清含药血清对LS174T结肠癌细胞做相关研究的报道。
技术实现要素:
发明目的:针对现有技术存在的问题,本发明提供一种由脏毒清制备的含药血清;该含药血清可有效抑制结肠癌细胞的增殖、促进其凋亡、抑制其转移。
本发明还提供一种由脏毒清制备的含药血清的制备方法及其应用。
技术方案:为了实现上述目的,如本发明所述的一种由脏毒清制备的含药血清,所述含药血清为将脏毒清对大鼠进行灌胃后,采血得到。
其中,所述脏毒清由当归、党参、焦白术、半枝莲、山慈菇、白花蛇舌草、白头翁和炙鳖甲组成,经磨粉、煮沸、煎煮后,将提取液过滤并且蒸馏浓缩得到膏体,再经冷冻干燥后粉碎得到。
所述所大鼠为清洁级SD雄性大鼠,大鼠购自扬州大学比较医学中心,体重为250~400g。
本发明所述的由川芎醇提物制备的含药血清的制备方法,包括如下步骤:
(1)给大鼠按体重比灌胃脏毒清(30-50)g/kg;
(2)末次灌胃后1-2h对大鼠进行麻醉,无菌条件下经腹主动脉采血;
(3)将血液静置3-5h,离心,取上清,灭活后过滤除菌,得到含药血清,分装,冻存备用。
作为优选,步骤(1)所述灌胃每日1-2次,持续4-6d,末次禁食12-14h给药。
作为优选,步骤(3)所述离心为3000-5000rpm,4-6℃离心10-15min。
作为优选,步骤(3)所述灭活为56-60℃灭活25-30min。
作为优选,步骤(3)所述过滤除菌为通过滤膜过滤除菌,优选为0.22um的滤膜。
本发明所述的由脏毒清制备的含药血清在制备治疗结肠癌的药物中应用。
进一步地,所述由脏毒清制备的含药血清在制备治疗LS174T结肠癌细胞的药物中应用。
有益效果:与现有技术相比,本发明具有如下优点:
1、本发明由脏毒清制备的含药血清根据脏毒清抗炎消肿攻毒,益气健脾养血,和胃化瘀止痛,软坚散结消瘤的特征,可有效抑制结肠癌细胞的增殖、促进其凋亡、抑制其转移。
2、本发明以LS174T结肠癌细胞作为模型,使用脏毒清灌胃大鼠后处理得到的含药血清培养LS174T结肠癌细胞,对于抑制结肠癌细胞的增殖、促进其凋亡、抑制其转移的效果明显要优于脏毒清以及现有治疗结肠癌的药物;其中给大鼠按体重比灌胃脏毒清(30-50)g/kg制备的含药血清,取浓度为15%(与DMEM培养基体积比)的含药血清抑制LS174T结肠癌细胞存活率可以达到45.72%以下,促进LS174T结肠癌细胞存活率凋亡率达到34.12%以上;而脏毒清和现有治疗结肠癌的药物抑制细胞存活率最好的效果仅为82.42%、70.23%,脏毒清和现有治疗结肠癌的药物促进凋亡率最好的效果为15.48%、16.78%;同时该含药血清可以有效的抑制LS174T结肠癌细胞的迁移能力,从而验证其具有抑制结肠癌的良好效果;本发明脏毒清制备的含药血清制备的药物在治疗结肠癌时也具有显著的效果。
3、本发明的制备方法安全可控,并且便于操作、保管、贮存和运输。
附图说明
图1为将实施例4给大鼠按体重比灌胃脏毒清50g/kg制备的含药血清以及对照组孵育Transwell细胞,Transwell细胞迁移检测细胞迁移能力的示意图;
图2为将实施例5给大鼠按体重比灌胃脏毒清40g/kg制备的含药血清以及对照组孵育Transwell细胞,Transwell细胞迁移检测细胞迁移能力的示意图;
图3为将实施例6给大鼠按体重比灌胃脏毒清30g/kg制备的含药血清以及对照组孵育Transwell细胞,Transwell细胞迁移检测细胞迁移能力的示意图。
具体实施方式
以下结合实施例和附图对本发明作进一步说明。
实施例1
由脏毒清制备的含药血清
(1)首先称取当归15g,党参20g,焦白术30g,半枝莲30g,山慈菇20g,白花蛇舌草30g,白头翁30g,炙鳖甲20g,由河南中医学院第一附属医院提供生草药,经磨粉、煎煮、提取后合并提取液,将提取液通过200目筛网过滤并且蒸馏浓缩得到膏体,再经冷冻干燥后粉碎得到脏毒清。
(2)给400g清洁级SD雄性大鼠按体重比灌胃脏毒清50g/kg,每日1次,持续4d,末次禁食12h给药;
(2)末次灌胃后1h对大鼠用戊巴比妥钠麻醉进行麻醉,无菌条件下经腹主动脉采血;
(3)将血液静置3h,3000rpm,4℃离心15min,取上清,56℃灭活30min后通过0.22μm滤膜过滤除菌,得含药血清,分装,冻存于-80℃冰箱备用。
实施例2
由脏毒清制备的含药血清
(1)首先称取当归15g,党参20g,焦白术30g,半枝莲30g,山慈菇20g,白花蛇舌草30g,白头翁30g,炙鳖甲20g,由河南中医学院第一附属医院提供生草药,经磨粉、煎煮、提取后合并提取液,将提取液通过200目筛网过滤并且蒸馏浓缩得到膏体,再经冷冻干燥后粉碎得到脏毒清。
(2)给300g清洁级SD雄性大鼠按体重比灌胃脏毒清40g/kg,每日2次,持续6d,末次禁食14h给药;
(2)末次灌胃后2h对大鼠用戊巴比妥钠麻醉进行麻醉,无菌条件下经腹主动脉采血;
(3)将血液静置5h,5000rpm,6℃离心10min,取上清,60℃灭活25min后通过0.22μm滤膜过滤除菌,得含药血清,分装,冻存于-80℃冰箱备用。
实施例3
由脏毒清制备的含药血清
(1)首先称取当归15g,党参20g,焦白术30g,半枝莲30g,山慈菇20g,白花蛇舌草30g,白头翁30g,炙鳖甲20g,由河南中医学院第一附属医院提供生草药,经磨粉、煎煮、提取后合并提取液,将提取液通过200目筛网过滤并且蒸馏浓缩得到膏体,再经冷冻干燥后粉碎得到脏毒清。
(2)给250g清洁级SD雄性大鼠按体重比灌胃脏毒清30g/kg,每日2次,持续5d,末次禁食12h给药;
(2)末次灌胃后2h对大鼠用戊巴比妥钠麻醉进行麻醉,无菌条件下经腹主动脉采血;
(3)将血液静置3h,5000rpm,4℃离心10min,取上清,60℃灭活25min后通过0.22μm滤膜过滤除菌,得含药血清,分装,冻存于-80℃冰箱备用。
实施例4
将实施例1给大鼠按体重比灌胃脏毒清50g/kg后处理得到的含药血清孵育LS174T结肠癌细胞。
将LS174T结肠癌细胞解冻复苏后加入含有(体积比)10%胎牛血清(FBS)的DMEM培养基制成细胞悬液,分种于培养瓶中并置于5%CO2(细胞培养的常规环境,CO2体积分数为5%),饱和湿度95%,37℃培养箱中培养。正常培养时约每天更换1次培养液,等到细胞生长融合度达到70%-80%时进行传代培养;传代培养时首先弃去培养瓶中的旧培养液,加入37℃磷酸缓冲盐溶液(PBS)液洗瓶2次,在25cm2培养瓶中加入2mL浓度为0.25%的胰蛋白酶(即2.5g/L的胰蛋白酶溶液)进行消化。然后在倒置显微镜下仔细随时观察,当发现细胞质回缩、细胞间隙变大时终止消化。接下来弃去胰酶溶液,加入含浓度(体积比)10%胎牛血清的DMEM培养基之后用吸管轻柔吹打使贴壁细胞悬浮。紧接着将含悬浮细胞的培养液转移至10mL离心管中,1500rpm离心5min,弃上清液。将细胞重新悬浮于5mL含(体积比)10%胎牛血清的完全培养基中。细胞计数结束,选择合适浓度将细胞分装到新的无菌培养瓶进行培养。最后6h后可见细胞贴壁,以后每2-3天换液次,待细胞长滿瓶底70%-80%后再次消化传代。
取4-6代的生长良好,融合度约为60%-70%的细胞进行细胞实验。呈亚融合状态的细胞,轻柔吹打配成单细胞悬液并接种于96孔培养板,24孔培养板以及Tranwell铺板,细胞贴壁生长24h后用各个分组对细胞进行孵育24h处理,具体分组情况如下:
对照组(共设6组,组1-组6):
1、空白对照组:用无血清DMEM培养液孵育细胞24h;
2、胎牛血清对照组:DMEM培养液中仅加入血清(所述血清为标准胎牛血清,购自杭州四季青生物科技有限公司),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
3、空白血清对照组:DMEM培养液中仅加入血清(血清采集方法与实施例1相同,不同在于没有灌胃),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
4、脏毒清对照组:用脏毒清与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例1相同,不同在于没有灌胃,脏毒清与实施例1的大鼠体重的重量比为50g/kg),然后加入到DMEM培养液中,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
5、生理盐水对照组:给大鼠按体重比灌胃生理盐水50g/kg得到的血清(血清采集方法与实施例1相同,不同之处脏毒清换成生理盐水)加入到DMEM培养液中加入,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
6、现有药物对照组:用现有治疗结肠癌药物5-Fu(5-氟尿嘧啶)与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例1相同,不同在于没有灌胃,5-Fu与实施例1的大鼠体重的重量比为50g/kg,5-Fu购买于上海旭东海普药业有限公司),然后加入到DMEM培养液中,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
对照组中没有设置5-氟尿嘧啶灌胃制备含药血清对照组及5-氟尿嘧啶注射制备含药血清对照组是由于5-氟尿嘧啶注射是其常用方法,不适合灌胃使用,而在本实施例中注射就失去其本身对照组的意义。
处理组(共设2组,组7和组8):
按实施例1给大鼠按体重比灌胃脏毒清50g/kg制得的含药血清加入到DMEM培养液中,配制出含药血清浓度(体积比)为15%和20%两种DMEM培养液,分别用浓度15%和20%含药血清DMEM培养液孵育细胞24h。
实施例5
将实施例2给大鼠按体重比灌胃脏毒清40g/kg后处理得到的含药血清孵育LS174T结肠癌细胞,具体的细胞培养方法与实施例4相同,
对照组(共设6组,组1-组6):
1、空白对照组:用无血清DMEM培养液孵育细胞24h;
2、胎牛血清对照组:DMEM培养液中仅加入血清(所述血清为标准胎牛血清,购自杭州四季青生物科技有限公司),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
3、空白血清对照组:DMEM培养液中仅加入血清(血清采集方法与实施例2相同,不同在于没有灌胃),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
4、脏毒清对照组:用脏毒清与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例2相同,不同在于没有灌胃,脏毒清与实施例2大鼠体重的重量比为40g/kg),然后加入到DMEM培养液中,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
5、生理盐水对照组:给大鼠按体重比灌胃生理盐水40g/kg得到的血清(血清采集方法与实施例2相同,不同之处脏毒清换成生理盐水)加入到DMEM培养液中加入,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
6、现有药物对照组:用现有治疗结肠癌药物5-Fu(5-氟尿嘧啶)与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例2相同,不同在于没有灌胃,5-Fu与实施例2大鼠体重的重量比为40g/kg),然后加入到DMEM培养液中,血清与DMEM培养液重量比为15%,用该DMEM培养液孵育细胞24h;
处理组(共设2组,组7和组8):
按实施例2给大鼠按体重比灌胃脏毒清40g/kg制得的含药血清加入到DMEM培养液中,配制出含药血清浓度(体积比)为15%和20%两种DMEM培养液,分别用浓度15%和20%含药血清DMEM培养液孵育细胞24h。
实施例6
将实施例3给大鼠按体重比灌胃生理盐水30g/kg后处理得到的含药血清孵育LS174T结肠癌细胞,具体的细胞培养方法与实施例4相同,
①对照组(共设6组,组1-组6):
1、空白对照组:用无血清DMEM培养液孵育细胞24h;
2、胎牛血清对照组:DMEM培养液中仅加入血清(所述血清为标准胎牛血清,购自杭州四季青生物科技有限公司),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
3、空白血清对照组:DMEM培养液中仅加入血清(血清采集方法与实施例2相同,不同在于没有灌胃),血清浓度(体积比)为15%,该DMEM培养液孵育细胞24h;
4、脏毒清对照组:用脏毒清与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例3相同,不同在于没有灌胃,脏毒清与实施例3大鼠体重的重量比为30g/kg),然后加入到DMEM培养液中,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
5、生理盐水对照组:给大鼠按体重比灌胃生理盐水30g/kg得到的血清(血清采集方法与实施例3相同,不同之处脏毒清换成生理盐水)加入到DMEM培养液中加入,血清浓度(体积比)为15%,用该DMEM培养液孵育细胞24h;
6、现有药物对照组:用现有治疗结肠癌药物5-Fu(5-氟尿嘧啶)与没有灌胃的大鼠得到的血清进行混合(血清采集方法与实施例3相同,不同在于没有灌胃,5-Fu与实施例3大鼠体重的重量比为30g/kg),然后加入到DMEM培养液中,血清与DMEM培养液重量比为15%,用该DMEM培养液孵育细胞24h;
处理组(共设2组,组7和组8):
按实施例3给大鼠按体重比灌胃脏毒清30g/kg制得的含药血清加入到DMEM培养液中,配制出含药血清浓度(体积比)为15%和20%两种DMEM培养液,分别用浓度15%和20%含药血清DMEM培养液孵育细胞24h。
试验例1MTT方法检测药物对LS174T结肠癌细胞增殖活性的作用
MTT全称3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,汉语化学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,是一种黄色的染料。处于增殖期的活细胞线粒体中含有的琥珀脱氢酶可使外源性的MTT还原成难溶的针状Formazan结晶,呈蓝紫色,并沉淀在活细胞中,细胞活力与Formazan的形成量成正比,DMSO能使Formazan结晶溶解,使用酶标仪于波长570nm处测定吸收值,以此间接反映细胞增殖的情况。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。
分别取实施例4,5,6各分组孵育后制备的96孔板的细胞,每孔定量加100μL含(体积比)15%胎牛血清(FBS)完全培养基,然后置于5%CO2,饱和湿度95%,37℃培养箱中进行培养24~72h;培养终止前4h加入10μL/孔(浓度为5mg/mL)的MTT;继续培养4h后,小心吸弃上清培养液后加100μL/孔二甲基亚砜(DMSO)终止反应,于振荡器上震荡10min左右,使结晶物充分溶解;酶标仪570nm检测OD值,实验至少重复三次。记录结果,计算存活率。
细胞存活率(%)=处理组平均OD值/对照组平均OD值×100%;结果见表1至3。
表1 50g/kg的脏毒清灌胃大鼠时MTT法检测LS174T结肠癌细胞存活率
*表示与对照组比较差异显著
表2 40g/kg的脏毒清灌胃大鼠时MTT法检测LS174T结肠癌细胞存活率
*表示与对照组比较差异显著
表3 30g/kg的脏毒清灌胃大鼠时MTT法检测LS174T结肠癌细胞存活率
*表示与对照组比较差异显著
由表1至3可知,给大鼠按体重比分别灌胃脏毒清50、40、30g/kg制备得到的含药血清,当使用体积比15%和20%的含药血清时LS174T结肠癌细胞存活率可以达到45.72%和45.58%以下,与脏毒清对照组的细胞存活率以及现有药物对照组的细胞存活率相比具有明显的优势,都具有很好的抑制LS174T结肠癌细胞存活效果,说明本发明实施例制备的含药血清具有良好的抑制LS174T结肠癌细胞的存活的作用。
由表2可知,给大鼠按体重比灌胃脏毒清40g/kg制得的含药血清效果最好,15%和20%含药血清组的细胞存活率分别是42.18%,42.20%效果最好;20%含药血清组时细胞存活率与15%含药血清组无统计学差异,因此,通过给大鼠按体重比灌胃脏毒清40g/kg制得的含药血清,使用其15%的含药血清就可以取得良好的抑制LS174T结肠癌细胞存活效果。
试验例2流式细胞术检测细胞凋亡
磷脂酞丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸由脂膜内侧翻向外侧。在鞘液的约束和包围下,待测样本的细胞排成单列由流动室喷嘴高速喷出,而形成细胞液柱。液柱在通过检测区时,在入射激光束的照射下可产生侧向散射光(SSC)和前向散射光(FSC),它们分别反映细胞颗粒度和大小,根据这些特性将细胞分类。样本经一种或几种特殊荧光标记后,可在激光束的激发下产生特定荧光,该特定荧光可被光学系统检测并分析,由此得到相应的各种细胞特性。AnnexinV是一种分子量35~36kDa的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。将AnnexinV进行FITC标记,以标记了AnnexinV作为荧光探针,利用流式细胞仪可检测细胞凋亡的发生。
分别取实施例4,5,6各分组孵育后制备的24孔板的细胞,弃去培养上清后每孔加入0.5mL浓度为0.25%的胰蛋白酶(即2.5g/L的胰蛋白酶溶液),在倒置显微镜下观察待细胞开始变圆,加少量含血清培养液,终止消化,吹打悬浮细胞后移至离心管中,1000rpm下离心10min,弃上清,用预冷的PBS洗涤2次,用250μL结合缓冲液重悬细胞。调节其浓度为1×106/mL,取100μL细胞悬液于5mL流式管中,加入5μL AnnexinVFITC和10μL 20μg/mL的PI溶液,混匀后室温避光孵育15min,在反应管中加入400μL PBS,上流式细胞仪分析。实验结果经计算机软件ModFitLT3.0分析软件分析细胞周期细胞数,每组实验至少重复3次,结果见表4至6。
表4 50g/kg的脏毒清灌胃大鼠时LS174T结肠癌细胞凋亡率的变化
*表示与对照组比较差异显著
表5 40g/kg的脏毒清灌胃大鼠时LS174T结肠癌细胞凋亡率的变化
*表示与对照组比较差异显著
表6 30g/kg的脏毒清灌胃大鼠时LS174T结肠癌细胞凋亡率的变化
*表示与对照组比较差异显著
由表4至6可知,给大鼠按体重比分别灌胃脏毒清50、40、30g/kg制备得到的含药血清,当使用体积比15%和20%的含药血清时LS174T结肠癌细胞存活率可以达到34.12%和34.47%以上,与脏毒清对照组的细胞存活率以及现有药物对照组的细胞存活率相比具有明显的优势,都可以使LS174T结肠癌细胞的凋亡率大大增加,说明本发明实施例制备的含药血清具有良好的促进LS174T结肠癌细胞的凋亡的作用。
由表5可知,给大鼠按体重比灌胃脏毒清40g/kg制得的含药血清效果最好,15%和20%含药血清组的细胞凋亡率分别是39.78%,39.75%效果最好;20%含药血清组时细胞存活率与15%含药血清组无统计学差异,因此,通过给大鼠按体重比灌胃脏毒清40g/kg制得的含药血清,使用其15%的含药血清就可以取得良好的促使LS174T结肠癌细胞凋亡效果。
试验例3Transwell侵袭实验检测脏毒清含药血清对细胞侵袭能力的影响
细胞迁移实验是将Transwell小室放入培养板中,小室内称为上室,培养板内称下室,上下层培养液以聚碳酸酯膜相隔,将研究的肿瘤细胞种在上室内,下室加入含FBS或某些特定的趋化因子的培养液,由于聚碳酸酯膜具有通透性,肿瘤细胞会向营养成分高的下室迁移,计数进入下室的细胞数量就能反应细胞的迁移能力。
分别取实施例4,5,6的Transwell铺板细胞经过各个分组对细胞进行孵育处理24h后,细胞的终浓度大小约为5×105个/mL;24孔板的下室内加入500μL的含(体积比)20%FBS的DMEM,在Transwell小室内加入100μL的细胞悬液,常规培养24h;细胞培养完成后,轻提Transwell小室,倾倒室内的培养基,用适量的PBS将细胞洗涤2遍,之后每孔加入1mL 4%的多聚甲醛(4%的多聚甲醛为4g多聚甲醛融于100mLPBS中制得;PBS缓冲液的配制:NaCl 8g,KCl 0.2g,Na2HPO4 1.44g,KH2PO4 0.24,加入800mL去离子水,充分搅拌,用HCl调节pH值至7.4,补充去离子水定容至1000mL,高压蒸汽灭菌,保存于4℃。)固定细胞15min,PBS再清洗3次,每次5min,再使用0.1%的结晶紫染色细胞30min,用PBS洗涤3次,每次5min,使用超纯水轻轻冲洗湿润小室表面的细胞,最后用湿润棉签轻轻擦去未迁移过膜的细胞,风机风干;倒置Transwell小室,显微镜进行观察和拍照。于显微镜下随机选取5个视野观察细胞,并计数迁移细胞数。
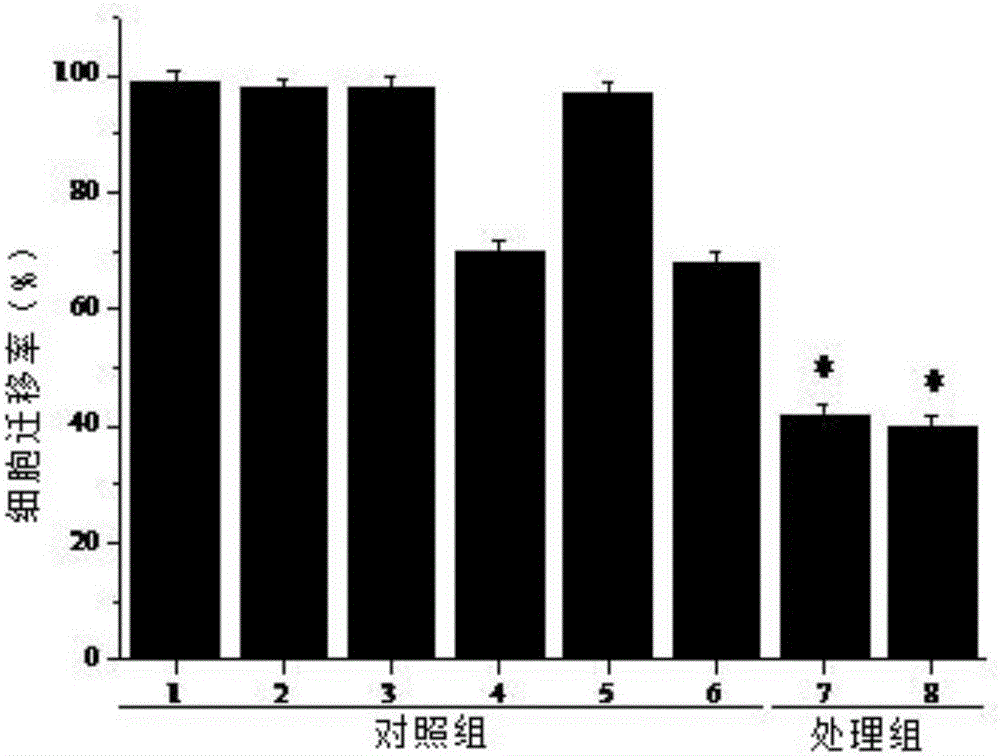
图1为实施例1给大鼠按体重比灌胃脏毒清50g/kg制备的含药血清孵育LS174T结肠癌细胞,Transwell细胞迁移检测细胞迁移能力,具体分组参照实施例4,其中1空白对照组;2胎牛血清对照组;3空白血清对照组;4脏毒清对照组;5生理盐水对照组;6现有药物对照组;7浓度(体积比)15%含药血清组;8浓度(体积比)20%含药血清组。图中*为P<0.05,差异显著。
图2为实施例2给大鼠按体重比灌胃脏毒清40g/kg制备的含药血清孵育LS174T结肠癌细胞,Transwell细胞迁移检测细胞迁移能力,具体分组参照实施例5,其中1空白对照组;2胎牛血清对照组;3空白血清对照组;4脏毒清对照组;5生理盐水对照组;6现有药物对照组;7浓度(体积比)15%含药血清组;8浓度(体积比)20%含药血清组。图中*为P<0.05,差异显著。
图3为实施例3给大鼠按体重比灌胃脏毒清30g/kg制备的含药血清孵育LS174T结肠癌细胞,Transwell细胞迁移检测细胞迁移能力,具体分组参照实施例6,其中1空白对照组;2胎牛血清对照组;3空白血清对照组;4脏毒清对照组;5生理盐水对照组;6现有药物对照组;7浓度(体积比)15%含药血清组;8浓度(体积比)20%含药血清组。图中*为P<0.05,差异显著。
从图1至3可以看出,给大鼠按体重比分别灌胃脏毒清50g/kg、40g/kg和30g/kg后经腹主动脉取血离心后,将其配制成与DMEM培养液体积比15%、20%的含药血清对LS174T结肠癌细胞进行孵育,结果表明含药血清孵育的LS174T结肠癌细胞相对于4脏毒清对照组、6现有药物对照组迁移能力显著降低,说明本发明实施例制备的含药血清具有良好的抑制LS174T结肠癌细胞迁移的作用。
- 还没有人留言评论。精彩留言会获得点赞!