二酯酰甘油激酶γ在肝癌的治疗、诊断和预测中的应用的制作方法
本发明涉及肝癌的治疗、诊断和预测技术领域,具体地涉及二酯酰甘油激酶γ(DGKγ)在肝癌的治疗、诊断和预测中的应用。
背景技术:
原发性肝细胞癌(Hepatocellular carcinoma,HCC,简称肝癌)是我国最常见的恶性肿瘤之一,居我国癌症发病率的第三位、病死率的第二位。全球肝癌年新发病例约74万例,死亡病例约69万例,超过一半病例发生在中国。目前,肝癌最有效的治疗手段仍是以手术为主,但由于肝癌起病隐匿,许多病人在确诊时已是晚期,失去了手术治疗的机会。针对晚期肝癌,现有唯一的靶向化疗药物索拉菲尼仅能使患者生存时间平均延长3个月左右,且价格昂贵。因此,进一步认识肝癌发病的分子机制,并用于指导开发新的肝癌治疗药物和措施,仍是我们面临的巨大挑战。
肝癌的发生是一个多因素、多途径、多步骤的长期过程。目前明确的肝癌诱发因素有多种,包括乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)的感染、长期大量饮酒、黄曲霉素暴露以及宿主基因异常等。其中,HBV感染促发肝癌的机制主要包括:①在慢性乙型肝炎导致的肝细胞坏死和代偿性增生过程中,肝细胞基因组逐渐产生和积累与癌症发生发展相关的遗传学或表观遗传学变异,直至引发细胞恶性转化和肝癌发生。②HBV表达病毒蛋白的直接致癌作用,如HBx蛋白、突变的preS/S蛋白等。③HBV基因序列在人类基因组中整合的致癌作用。发明人的前期研究发现和其他实验室的研究报道提示,HBV整合对附近宿主基因表达和功能的影响是HBV整合致癌的重要机制。
二酯酰甘油激酶(diacylglycerol kinases,DGKs)是细胞磷脂酰肌醇信号通路中一类特异而保守的脂激酶,可磷酸化二脂酰甘油(diacylglycerol,DAG)生成磷脂酸(phosphatidic acid,PA)。DAG作为磷脂酰肌醇信号通路的第二信使,可以激活蛋白激酶C(PKC),在细胞代谢、增殖分化及信号传导过程中发挥重要作用。目前发现的DKGs家族共有10个成员,根据各自不同的蛋白结构、激活分子及反应底物分为I-V 5个亚型,DGKγ是DKGs家族第I亚型的成员之一。目前有关DGKγ与肿瘤发生的相关性研究尚未见报道。
技术实现要素:
本发明的发明人意外地发现,DGKγ在肝癌组织中呈低表达,且DGKγ低表达肝癌患者的术后生存期显著低于DGKγ正常或高表达的肝癌患者,提示DGKγ表达水平与患者预后相关。进一步在肝癌细胞系中过表达DGKγ发现,在肝癌细胞系中过表达DGKγ后,细胞的生长速度明显减慢,提示DGKγ具有抑制肿瘤细胞生长的作用。至少基于部分上述发现,完成了本发明。具体地,本发明包括以下内容。
本发明的一方面,提供使用二酯酰甘油激酶γ(DGKγ)治疗肝癌的方法,以及DGKγ在制备用于治疗肝癌的药物中的用途。
本发明的另一方面,提供使用DGKγ的活化剂治疗肝癌的方法,以及DGKγ的活化剂在制备用于治疗肝癌的药物中的用途。
在某些实施方案中,二酯酰甘油激酶γ包括哺乳动物来源的任何类型。优选来源于人类。
在某些实施方案中,二酯酰甘油激酶γ具有全长氨基酸序列或其等同形式,所述等同形式包括具有二酯酰甘油激酶γ的酶活性的截短形式和突变形式(突变体)。所述突变包括通过例如人工诱变获得的突变形式或自然突变获得的突变形式。所述截短形式包括从全长氨基酸序列两端截短的任意片段,或在全长氨基酸序列中间至少一个氨基酸的缺失的任意片段。
在某些实施方案中,所述DGKγ的活化剂是能够提高DGKγ活性的物质或者能够提高DGKγ表达水平的物质。
在某些实施方案中,所述DGKγ的活化剂是DGKγ或表达DGKγ的载体。
在某些实施方案中,所述DGKγ的活化剂优选蛋白质乙酰化剂;所述蛋白质乙酰化剂优选组蛋白去乙酰化酶抑制剂;所述组蛋白去乙酰化酶抑制剂优选组蛋白H3和H4去乙酰化酶抑制剂。优选的组蛋白去乙酰化酶抑制剂包括:氧肟酸盐类,如曲古柳菌素(TSA)或伏立诺他(SAHA);苯酰胺类,如MGCD0103或MS-275;脂肪酸类,如丁酸盐、丁酸苯酯或丙戊酸;环肽类,如天然产物缩酚酸肽FK-228、apicidin或depsipeptide。所述组蛋白去乙酰化酶抑制剂还优选恩替诺特(Entinostat)。
在某些实施方案中,所述治疗肝癌是指选自下列各项组成的组,抑制肝癌细胞的增殖、抑制肝癌细胞的迁移、阻滞肝癌细胞的细胞周期进程、抑制肝癌细胞摄入葡萄糖、使肝癌细胞中的PIK3R1、RICTOR和PRKAA2的水平下调、使肝癌细胞中的GLUT1和GLUT3的水平下调、抑制细胞的糖酵解和乳酸生成、影响谷氨酰胺等氨基酸代谢。
在某些实施方案中,所述药物可以与其它治疗肝癌或肝脏疾病的药物联合使用。
在某些实施方案中,其它治疗肝癌或肝脏疾病的药物包括单抗类分子靶向药物,包括但不限于Herceptin(Trastuzumab,贺赛汀)、Rituximab(美罗华)、IMC-C225(cetuximab,Erbitux,爱必妥)和Bevacizumab(Avastin,阿瓦斯汀)等;小分子化合物,包括但不限于Glivec(STI51,格列卫)、Iressa(ZD1839,Gefitinib,易瑞沙)、Erlotinib(Tarceva,OSI-774,特罗凯)、Sorafenib(索拉非尼,多吉美)、Antroquinonol(安卓健)、Sunitinib(Sutent,SU11248,舒尼替尼)、Lapatinib(拉帕替尼)、Vandetanib(凡德他尼)、Dasatinib(Sprycel,达沙替尼)等。
本发明的第三方面,提供一种使用用于检测DGKγ的试剂诊断预后不良的肝癌的方法,以及用于检测DGKγ的试剂在制备用于诊断预后不良的肝癌的试剂中的用途。优选所述预后不良是指低的术后生存率。
本发明的第四方面,提供使用用于检测DGKγ的试剂预测肝癌的预后情况的方法,以及用于检测DGKγ的试剂在制备用于预测肝癌的预后情况的试剂中的用途。
在某些实施方案中,二酯酰甘油激酶γ作为检测的靶点。
在某些实施方案中,用于检测DGKγ的试剂是指用于检测DGKγ的基因转录或表达水平的试剂,用于检测DGKγ的水平或量的试剂,用于检测DGKγ的甲基化情况的试剂,或者用于检测DGKγ的突变的试剂,优选检测DGKγ基因或DGKγ蛋白的特异性引物、探针、抗体、结合肽或适体。
在某些实施方案中,所述试剂可以是单独试剂、试剂组合或试剂盒。
在某些实施方案中,治疗、诊断或预测的对象是人。
附图说明
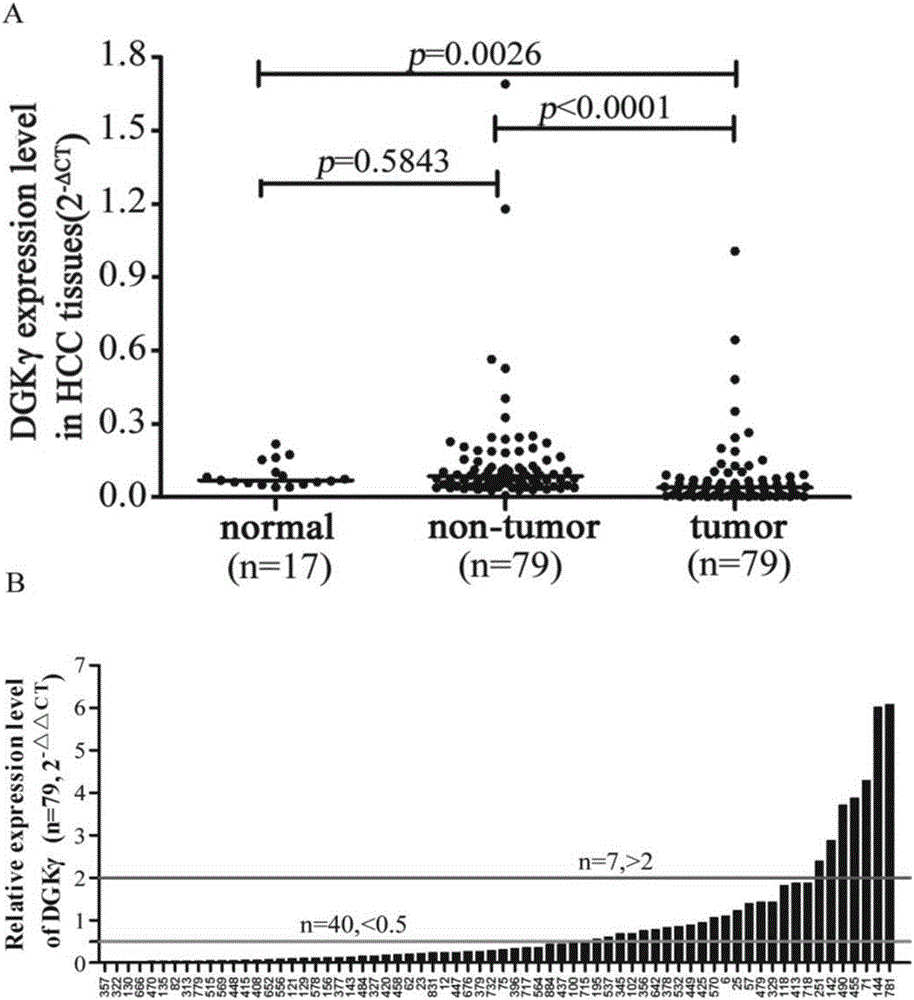
图1 DGKγ在肝组织中的mRNA水平表达。A.在肝癌组织、癌旁组织及正常组织中的表达差异;B.在肝癌病人中的相对表达率。
图2 DGKγ表达与术后生存期的相关性分析。A.肝癌组织DGKγ相对表达水平(低表达组<0.5,非低表达组≥0.5)与术后生存期的相关性分析。B.两组病人之间的逐年生存率。C.肝癌组织中DGKγ表达水平(癌组织的表达中位数为分界点)与术后生存期的相关性分析。D.癌旁组织中DGKγ表达水平(癌旁组织的表达中位数为分界点)与术后生存期的相关性分析。
图3甲基化酶抑制剂5-aza抑制剂处理各肝癌细胞系后DGKγ的表达变化。
图4去乙酰化酶抑制剂TSA对DGKγ表达的调控。A.Real-time PCR检测TSA处理肝癌细胞系后,DGKγ表达的差异。B,不同浓度梯度的TSA处理PLC/PRF/5,SMMC7721及SNU449细胞系后,DGKγ表达的TSA浓度依赖性。
图5 ChIP-PCR方法确定DGKγ启动子区的乙酰化区域。A,PCR扩增DGKγ启动区片段示意图。B,ChIP-PCR后琼脂糖凝胶半定量结果。
图6不同HDAC抑制剂处理对细胞DGKγ表达水平的影响。A,Realtime PCR检测不同HDAC抑制剂处理SNU449细胞后DGKγ的mRNA水平。B,不同HDAC抑制剂的抑制靶点、IC50和处理浓度。
图7组蛋白H3和H4的乙酰化水平影响DGKγ的表达。ChIP-PCR后琼脂糖凝胶电泳半定量结果。
图8过表达DGKγ对细胞增殖能力的影响。A,DGKγ对SNU449细胞增殖的影响。B,DGKγ对SMMC7721细胞增殖的影响。
图9 gRNA切割效率检测结果。A,PCR鉴定gRNA的切割作用。B,测序鉴定gRNA的切割作用。
图10过表达DGKγ对细胞迁移能力的影响。A,划痕实验;B,Transwell小室实验。
图11过表达DGKγ对SK-Hep1细胞EMT相关标志基因表达的影响
图12 DGKγ对细胞周期的影响。A,SNU449细胞;B,SMMC7721细胞
图13在不同谷氨酰胺和葡萄糖浓度的培养条件下,DGKγ对SNU449细胞增殖的影响
图14 DGKγ对SNU449细胞葡萄糖摄入的影响
图15 DGKγ对SNU449细胞中代谢调节相关基因表达的影响。
图16 DGK对SNU449细胞总蛋白和膜蛋白中GLUT1和GLUT3的表达水平的影响。A,Western Blot检测总蛋白中GLUT1和GLUT3的表达,以α-tubulin为内参蛋白。B,Western Blot检测经膜蛋白提取试剂盒提取的膜蛋白中GLUT1和GLUT3的表达,以Na+/K+ATPase为内参蛋白,并对膜蛋白样品中的胞浆蛋白a-tubulin进行了检测。
图17 DGKγ对SNU449细胞物质代谢的影响。A,代谢组学PLS-DA分析的得分图。B,PLS-DA分析的VIP图,认为VIP大于1的变量有显著性差异。
具体实施方式
通过解释以下本申请的优选实施方案,本发明的其他目的和优点将变得清楚。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的实验方法、测定或测试方法,但是在本发明的实验、测定或测试中也可以使用与本文所述相似或等同的任何方法。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法或实验。在与任何并入的文献冲突时,以本说明书的内容为准。
本发明中,名词术语既包括单数形式,也包括复数形式,除非上下文另行明确指出。本发明中所述的“至少之一”或“至少一种”不仅仅指包含“一个”或“一种”的情况,更重要的还包含“多个”或“多种”的情况。
实施例
实施例1DGKγ表达情况分析
为探索DGKγ在肝癌组织中的表达情况,本研究采用Real-time PCR方法检测了DGKγ基因在79对肝癌与配对癌旁组织以及17例正常肝组织中mRNA的表达水平。结果如图1所示,DGKγ在肝癌组织中的表达水平显著低于癌旁组织和正常组织(P<0.0001,P=0.0026),而在癌旁组织和正常组织中的表达水平则无显著差异(图1A)。此外,与癌旁组织相比,DGKγ在肝癌组织中呈低表达的样本比率为50.6%(40/79),而DGKγ高表达比率仅为8.8%(7/79),提示DGKγ基因在肝癌组织中呈显著低表达(图1B)。
实施例2肝癌组织中DGKγ表达水平与临床病理参数的相关性及其对患者预后的可能影响
为了分析DGKγ的表达水平与肝癌患者临床病理背景的相关性,收集整理了79例病人的性别、年龄、肿瘤大小及数目,AFP、谷丙转氨酶(ALT)、谷草转氨酶(AST)及总胆红素等临床病理指标。根据病人DGKγ的相对表达水平,以癌/癌旁<0.5为分界点,将病人分为低表达组和非低表达组。用Chi-square test或Fisher's exact test分析发现,DGKγ的表达与病人性别、年龄、肿瘤大小及数目,AFP、ALT、AST及Toatal bilirubin等因素并无相关性,但是与HBV病毒感染背景有一定的关系。在HBV感染背景(即HBs-Ag阳性)的病人中,DGKγ的表达水平多为低表达(表1)。提示HBV对DGKγ的表达也具有一定的调控作用。
为明确DGKγ在肝癌组织中低表达的临床意义,我们整理并分析病人术后跟踪随访数据,其中68例有术后随访数据,通过Kaplan-Meier(KM)法绘制生存曲线,Log-Rank test比较两组的差异。结果发现,DGKγ在肝癌中相对表达水平对于病人术后的生存时间具有很好的预测价值。以癌/癌旁<0.5为DGKγ低表达的分界点,发现DGKγ低表达极不利于病人术后的生存,且与非高表达组相比具有显著差异(图2A),且在术后四年两组病人生存率差距最大,非低表达组病人生存率约是低表达组的4倍(图2B)。
为进一步分析DGKγ在癌组织中的表达亦或在癌旁组织中的表达差异引起的病人术后的生存差异。以DGKγ在组织中表达的中位数为分界点,将病人分为高表达DGKγ组与低表达组。结果发现DGKγ在癌组织中的表达差异是病人术后生存率不同的主要原因(图2C),而癌旁组织中并无明显的差异(图2D)。
表1.肝癌组织中DGKγ表达水平与患者临床病理背景的相关性
实施例3DGKγ基因转录调控机制分析
为了明确肝癌组织中DGKγ低表达的分子机制,我们首先分析了DGKγ基因在肝癌组织中的缺失和突变。通过对本实验室前期25例aCGH结果的分析,没有发现肝癌组织中存在DGKγ基因的缺失;通过检索cosmic数据库查询DGKγ的突变,发现在942例肝癌组织样本中只有5例有突变,突变率仅为0.53%;因此,缺失或突变并不是引起肝癌组织中DGKγ低表达的主要机制。
启动区甲基化是抑癌基因表达抑制的重要机制之一。为了确定肝癌组织中DGKγ低表达是否与DGKγ基因启动子区的异常甲基化有关,我们采用甲基化敏感酶酶切联合Real-time PCR方法,检测了18例肝癌及配对癌旁组织中DGKγ启动子区的甲基化水平。结果无论是在肝癌组织还是在癌旁组织中均未检测到DGKγ启动子区的甲基化。为了进一步验证上述组织中的甲基化检测结果,我们采用甲基化转移酶抑制剂5-aza处理了7种肝癌细胞系,并用Real-time PCR方法检测5-aza处理前后DGKγ的表达水平。结果如图3所示,在所有检测的7种肝癌细胞系中,5-aza都不能显著增强DGKγ的表达,证明甲基化修饰也不是影响肝癌组织中DGKγ低表达的机制。
乙酰化修饰也是调控基因转录的重要机制。为了明确乙酰化修饰是否影响DGKγ基因的表达,我们首先用TSA处理各肝癌细胞系,并用Real-time PCR方法检测TSA处理对DGKγ基因表达的影响。结果如图4A所示,TSA处理后,7种肝癌细胞系中有5种细胞内源DGKγ的表达水平显著增加。进一步采用不同浓度的TSA处理SNU449,SMMC7721及PLC/PRF/5三种肝癌细胞系,并用半定量PCR和琼脂糖凝胶电泳方法检测DGKγ基因的表达,结果表明,在上述三种细胞系中随着TSA浓度的增加,DGKγ的表达水平也不断增加,呈现TSA的剂量依赖效应(图4B)。上述结果证实乙酰化修饰能促进DGKγ的表达,乙酰化修饰与DGKγ的表达调控有关。为了进一步明确DGKγ启动区受乙酰化调控的位点,我们采用ChIP-PCR方法检测了TSA处理前后DGKγ启动区不同DNA片段的乙酰化富集水平(图5A)。琼脂糖凝胶电泳半定量结果提示,DGKγ启动子区主要乙酰化位点可能在转录起始位点前-297bp~-579bp(primer3)及-1261bp~-1439bp(primer4)位置,即实验组与对照组条带有明显差异区域(图5A)。
TSA是去乙酰化酶HDAC的非选择性抑制剂,为了进一步研究主要参与抑制DGKγ表达的HDAC亚型,我们用不同靶点特异性的HDAC抑制剂处理SNU449细胞,进行Realtime PCR检测处理组和对照组的DGKγ的mRNA表达水平,结果显示HDAC1和HDAC3的抑制剂Entinostat的促进DGKγ表达的作用最明显,提示HDAC1和HDAC3可能对于DGKγ的低表达发挥更主要的作用。
组蛋白乙酰化和转录因子的乙酰化都可能参与基因的表达调控,为了研究组蛋白乙酰化是否参与了DGKγ的表达调控,我们用Entinostat处理SNU449细胞后,进行ChIP-PCR检测DGKγ基因启动子区主要乙酰化位点与乙酰化的组蛋白H3和H4的富集水平。结果显示,在Entinostat处理后,SNU449细胞的DGKγ基因启动子区的组蛋白H3和H4的乙酰化增强,提示组蛋白H3和H4的乙酰化参与DGKγ表达的调控。
实施例4DGKγ抑制肝癌细胞的增殖
为了检测DGKγ对细胞增殖能力的影响,我们采用慢病毒体系构建了稳定表达DGKγ的SNU449和SMMC7721细胞,并采用MTT实验检测了过表达DGKγ对SNU449和SMMC7721细胞增殖和生长能力的影响。结果如图8所示,过表达DGKγ的SNU449和SMMC7721细胞生长速度明显减慢,提示DGKγ能抑制细胞的增殖。
实施例5构建敲除小鼠DGKγ基因的CRIPR/Cas9系统
为实现DGKγ基因的特异性敲除,我们首先设计和构建了两组靶定小鼠DGKγ基因的gRNA表达质粒(表2),转染入小鼠永生化肝细胞H2.235中,48小时后提取细胞DNA,采用PCR实验检测gRNA的切割作用,若两个gRNA均对靶DNA发挥剪切作用,则靶基因可被剪切下来一个小片段,通过鉴定引物进行PCR扩增,将扩增出较野生型片段更短的片段。如图9A所示,PCR扩增可扩增出长度小于野生片段的小片段,且片段大小符合预期,即证明针对DGKγ基因的两个gRNA均发挥对靶基因的切割作用。为了进一步证明gRNA的切割作用并明确其切割位点,将小片段切胶回收后进行测序,结果显示DGKγ基因区域均缺失一段,且位于两个gRNA切割位点之间(图9B)。以上结果证明靶定DGKγ基因的gRNA能发挥高效的切割作用,为实现DGKγ基因在小鼠肝脏内的敲除提供了技术保障。
表2.DGKγ-sgRNA和检测引物序列.
实施例6DGKγ抑制肝癌细胞的迁移
为了检测DGKγ对细胞迁移能力的影响,我们采用慢病毒体系构建了稳定表达DGKγ的SK-hep1细胞,并采用划痕实验和Transwell小室实验检测了过表达DGKγ对SK-hep1细胞迁移能力的影响。结果如图10所示,过表达DGKγ的SK-Hep1细胞迁移速度明显减慢,提示DGKγ能抑制细胞的迁移。
实施例7DGKγ影响SK-Hep1细胞EMT相关标志基因的表达
为了研究DGKγ抑制SK-Hep1细胞迁移的机制,我们采用Realtime-PCR的方法检测了过表达DGKγ对SK-Hep1细胞EMT相关标志基因表达的影响,结果如图11所示,过表达DGKγ的SK-Hep1细胞中N-cadherin、Vimentin表达下调,Fibronectin表达上调,可见DGKγ通过影响N-cadherin、Vimentin和Fibronectin的表达抑制SK-Hep1细胞的迁移。
实施例8DGKγ阻滞肝癌细胞的细胞周期进程
为了检测DGKγ对SNU449和SMMC7721细胞周期的影响,我们用流式细胞术进行了细胞周期检测,结果如图12所示,过表达DGKγ使SNU449和SMMC7721细胞的G1期比例增加,S期和G2/M期比例下降,提示DGKγ使SNU449和SMMC7721细胞发生G1期阻滞。
实施例9DGKγ抑制谷氨酰胺、葡萄糖对SNU449细胞增殖的促进作用
为了研究DGKγ与肝癌细胞代谢的关系,用CCK8增殖实验检测了在不同谷氨酰胺和葡萄糖浓度的培养条件下,DGKγ对SNU449细胞增殖的影响,结果如图13所示,在无谷氨酰胺的培养条件下,过表达DGKγ的SNU449细胞与对照组细胞的增殖速度无明显差异,而在添加谷氨酰胺的培养条件下,对照组细胞增殖速度明显加快,而过表达DGKγ的SNU449细胞的增殖速度无明显变化(图13A);相似地,与无葡萄糖的培养条件相比,1g/L的葡萄糖能明显促进对照组细胞的增殖,但对过表达DGKγ的SNU449细胞的增殖无明显影响(图13B),提示DGKγ能抑制谷氨酰胺、葡萄糖对SNU449细胞增殖的促进作用。
实施例10DGKγ抑制SNU449细胞对葡萄糖的摄入
为了检测DGKγ对SNU449细胞葡萄糖摄入的影响,我们用葡萄糖摄入分析试剂盒进行了检测,结果如图14,过表达DGKγ的SNU449细胞对葡萄糖的摄入速率降低,提示DGKγ能抑制SNU449细胞摄入葡萄糖,进而抑制细胞的增殖。
实施例11DGKγ影响SNU449细胞代谢调节相关基因的表达
为研究DGKγ影响SNU449细胞对葡萄糖摄入、代谢的分子机制,我们利用Realtime PCR检测了过表达DGKγ的SNU449细胞的代谢调节相关基因的表达,包括PI3K、mTOR和AMPK通路中的部分基因,结果如图15所示,过表达DGKγ使SNU449细胞中的PIK3R1、RICTOR和PRKAA2的mRNA水平下调。
实施例12DGKγ影响SNU449细胞中GLUT1和GLUT3的蛋白表达水平
为了研究SNU449细胞过表达DGKγ后葡萄糖摄入速率降低的机制,我们用Western Blot检测了细胞总蛋白以及用试剂盒提取的膜蛋白中葡萄糖转运蛋白GLUT1和GLUT3的表达水平。结果如图16所示,在SNU449细胞中过表达DGKγ后总蛋白和膜蛋白中GLUT1和GLUT3的表达水平均有所减弱,提示DGKγ可能通过影响GLUT1和GLUT3在细胞膜上的表达抑制细胞葡萄糖的摄入。
实施例13DGKγ影响SNU449细胞的物质代谢
葡萄糖是肿瘤细胞重要的物质和能量来源,葡萄糖的摄入减少可能会影响细胞的整体代谢水平。为了研究DGKγ是否能影响SNU449细胞的物质代谢,收集细胞沉淀利用NMR平台进行代谢组学检测和PLS-DA分析。结果如图17所示,DGKγ组与对照组细胞的代谢轮廓相异,并且在DGKγ过表达细胞中谷氨酸、乳酸、UDP-葡萄糖等物质含量降低,天冬酰胺和谷氨酰胺等含量升高,提示DGKγ可能通过抑制葡萄糖的摄取抑制细胞的糖酵解和乳酸生成,并可能影响谷氨酰胺等氨基酸代谢。
参考本申请的优选技术方案详细描述了本申请,然而,需要说明的是,在不脱离本申请的精神的情况下,本领域技术人员可在上述公开内容的基础上做出任何改造、修饰以及变动。本申请包括上述具体实施方案及其任何等同形式。
- 还没有人留言评论。精彩留言会获得点赞!