具有凝胶态压力传输控制层的长效控释复合膜及其制法的制作方法
本发明涉及医疗复合膜技术领域,尤其是一种具有凝胶态压力传输控制层的长效控释复合膜及其制法。
背景技术:
药物控释是通过控释衣膜来定量匀速的向外释放药物,使血药浓度保持恒定,药物控制释放的功能可以通过膜透过控制体系、机体扩散体系到达,药物的靶向释放功能可以通过生物学认识机制、透过机制、以及体外控制等手段实施。现有含药辅料的复合膜控释比较困难,满足不了日常的医疗需求,在已知的凝胶制程中,由于用以形成凝胶的反应混合溶液在进行聚合反应之前会呈现溶液状态,因此需先盛装在容器中进行聚合反应以形成凝胶块体,再将凝胶块体裁切成具有适当厚度与尺寸的凝胶敷料,制程繁琐。
技术实现要素:
为了克服现有载药复合膜控释困难的不足,本发明提供了一种具有凝胶态压力传输控制层的长效控释复合膜及其制法。
本发明解决其技术问题所采用的技术方案是:一种具有凝胶态压力传输控制层的长效控释复合膜,包括控释复合载体和设置在控释复合载体底部的微通道传递层,控释复合载体由内到外依次分为互穿网微支架结构层、可膨润性微凝胶体压力传输控制层和限制性压力传输控制层,且可膨润性微凝胶体压力传输控制层内部均布可膨润压力控制微凝胶体及,用来强化的微凝胶体强化剂,在系统中形成氢键,稳定可膨润压力控制微凝胶体的安定性。
根据本发明的另一个实施例,进一步包括互穿网微支架结构层由相互交织的第一穿网高分子链、第二穿网高分子链和功能体构成。
根据本发明的另一个实施例,进一步包括微通道传递层底部两端设置有辅助皮肤固定层。
根据本发明的另一个实施例,进一步包括微通道传递层上均布传递微通道。
根据本发明的另一个实施例,进一步包括传递微通道是疏水性,并透过聚乙烯或聚丙烯或聚乳酸或几丁聚糖或含硅聚丙烯酸或硅胶来达成。
根据本发明的另一个实施例,进一步包括微凝胶体强化剂与可膨润压力控制微凝胶体物理性结合,并在系统中提供氢键。
根据本发明的另一个实施例,进一步包括微凝胶体强化剂选自由苯乙烯/丙烯酸共聚物,侧链带胺基酸苯乙烯/丙烯酸共聚衍生物及其组合的族群。
根据本发明的另一个实施例,进一步包括限制性压力传输控制层包含一高分子薄膜作为限制膜,该高分子薄膜在含药控释系统中将限制药物传输方向性。
根据本发明的另一个实施例,进一步包括限制性压力传输控制层与所述可膨润性微凝胶体压力传输控制层之间设有一第一固定层,在所述可膨润性微凝胶体压力传输控制层与所述互穿网微支架结构层之间设有一第二固定层,其中所述第一固定层及所述第二固定层为固定化反应层,而固定化反应系透过黏着或气体氧化或电浆暴露或强能量供应之固化反应条件来达成,固化反应条件系选自由臭氧气曝处理10至60分钟,uv照射10至60分钟,电浆照射10至60分钟,黏着剂涂覆及其组合条件之族群。
根据本发明的另一个实施例,进一步包括其制备方法,步骤如下:
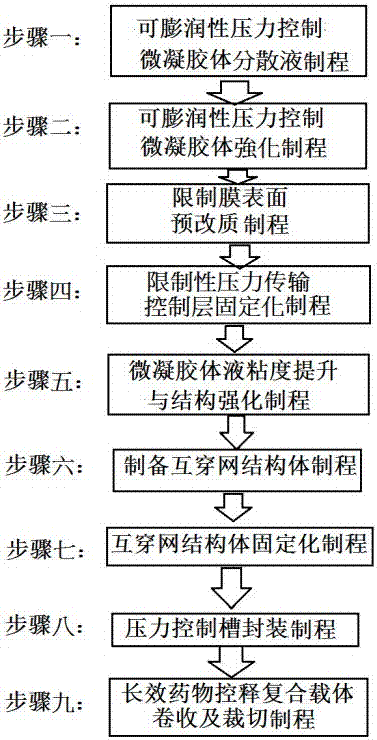
步骤一:可膨润性压力控制微凝胶体分散液制程:在水中加入可膨润性水凝胶,例如交链型的卡波姆或亚克力水凝胶,并搅拌均匀形成一含微凝胶体水相分散液备用,交链型水凝胶即微凝胶体确保在高含水系统或水相中,具有稳定的分散态;
步骤二:可膨润性压力控制微凝胶体强化制程:在微凝胶体分散液中添加具有界面活性及氢键形成基团的微凝胶体强化剂,在15至40摄氏温度下,水相分散溶液慢速搅拌,搅拌时间在3小时以上;
步骤三:限制膜表面预改质制程:取一高分子薄膜作为限制膜,该高分子薄膜在含药控释系统中将限制药物传输方向性,在进行该限制膜表面预改质,利用气体或电浆或强能量氧化限制膜表面进行表面预改质反应,反应条件系选自由臭氧气曝处理10至60分钟,uv照射10至60分钟,电浆照射10至60分钟,及其组合条件的族群;
步骤四:限制性压力传输控制层固定化制程:将预改质处理完成的限制膜表面与可膨润性压力控制微凝胶体均匀分散固定在已改质的限制膜表面,形成可膨润性微凝胶体压力传输控制层,混合的方式首先将强化后可膨润性压力控制微凝胶体的水相分散溶液慢速搅拌,在15至40摄氏温度下,搅拌时间在6小时以上,透过该温度范围操作来限定可膨润性压力控制微凝胶体的安定范围;
步骤五:微凝胶体液粘度提升与结构强化制程:使可膨润性压力控制微凝胶体均匀分散固定在已改质的限制膜表面,形成可膨润性微凝胶体压力传输控制层,持续进行uv射线后照射制程1分钟~15分钟照射,完成强化结构可膨润性微凝胶体压力传输控制层,并使强化结构可膨润性微凝胶体压力传输控制层活化可利于后段固定化反应;
步骤六:制备互穿网结构体制程:在水中加入聚乙烯醇,羧甲基纤维素,以及功能性成分,并混合均匀,因物理性的交互作用力,辅助形成均匀互穿网结构体预处理液备用;
步骤七:互穿网结构体固定化制程:预先调配并搅拌溶解及分散均匀的互穿网结构体溶液,在强化结构可膨润性微凝胶体压力传输控制层上进行涂布浓缩及干燥,达成互穿网结构体固定化反应,形成互穿网微支架结构层;
步骤八:压力控制槽封装制程:将固定有可膨润性微凝胶体压力传输控制层之互穿网结构体设置于一限制性压力传输控制层与一微通道传输层之间,透过多段涂布来达成,使达成所述可膨润性微凝胶体压力传输控制层内部均布可膨润压力控制微凝胶体可以在临床应用时随时间增加吸湿而逐渐膨润体积放大,在膨润过程中压缩周边环境,因限制性压力传输控制层之方向限制而在互穿网微支架结构层内创造强制性压力,使功能性成分浓度减低时可透过逐渐产生的强制性压力使残留于复合膜的药物可长效地释放;
步骤九:长效药物控释复合载体卷收及裁切制程:将封装有长效控释传输结构体的压力控制槽覆于基材层上,贴覆后即可卷收及裁切,以制得具有长效药物控释复合载体。
本发明的有益效果是,简化互穿网长效控释传输结构体制程步骤,且大幅提升制程效率,适合工厂连续自动化的方式制造,以快速大量地生产具有各种不同厚度的复合性敷料;另一方面,所制作的具有可膨润性压力控制微凝胶体与敷料提供较佳的透气、透湿、阻隔细菌侵入以及控制和吸收渗出液等特性,使得伤口处于良好细胞生长愈合环境;再者,由于敷料呈透明状,因此有利于直接观察伤口愈合情况,以掌控伤口的治疗状况。
附图说明
下面结合附图和实施例对本发明进一步说明。
图1是本发明的结构示意图。
图2是本发明的制法流程图。
图中1.复合膜主体,2.微通道传递层,3.互穿网微支架结构层,4.可膨润性微凝胶体压力传输控制层,5.限制性压力传输控制层,6.辅助皮肤固定层,7.可膨润压力控制微凝胶体,8.传递微通道,9.功能体,10.第一穿网高分子链,11.第二穿网高分子链,20.微凝胶体强化剂,25.分子间氢键。
具体实施方式
如图1、2所示,一种具有凝胶态压力传输控制层的长效控释复合膜,包括控释复合载体1和设置在控释复合载体1底部的微通道传递层2,复合膜主体1由内到外依次分为互穿网微支架结构层3、可膨润性微凝胶体压力传输控制层4和限制性压力传输控制层5,且可膨润性微凝胶体压力传输控制层4内部均布可膨润压力控制微凝胶体7及用来强化的微凝胶体强化剂20,互穿网微支架结构层3由相互交织的第一穿网高分子链10、第二穿网高分子链11和功能体9构成,微通道传递层2底部两端设置有辅助皮肤固定层6,微通道传递层2上均布传递微通道8,传递微通道8是疏水性,并透过聚乙烯或聚丙烯或聚乳酸或几丁聚糖或含硅聚丙烯酸或硅胶来达成,微凝胶体强化剂20与可膨润压力控制微凝胶体7物理性结合,并在系统中提供氢键,微凝胶体强化剂20选自由苯乙烯/丙烯酸共聚物,侧链带胺基酸苯乙烯/丙烯酸共聚衍生物及其组合的族群,限制性压力传输控制层5包含一高分子薄膜作为限制膜,该高分子薄膜在含药控释系统中将限制药物传输方向性,限制性压力传输控制层5与所述可膨润性微凝胶体压力传输控制层4之间设有一第一固定层,在所述可膨润性微凝胶体压力传输控制层4与所述互穿网微支架结构层3之间设有一第二固定层,其中所述第一固定层及所述第二固定层为固定化反应层,而固定化反应系透过黏着或气体氧化或电浆暴露或强能量供应之固化反应条件来达成,固化反应条件系选自由臭氧气曝处理10至60分钟,uv照射10至60分钟,电浆照射10至60分钟,黏着剂涂覆及其组合条件的族群。
该具有凝胶态压力传输控制层的长效控释复合膜制法为:步骤一:可膨润性压力控制微凝胶体分散液制程:在水中加入可膨润性水凝胶,例如交链型的卡波姆或亚克力水凝胶,并搅拌均匀形成一含微凝胶体水相分散液备用,交链型水凝胶即微凝胶体确保在高含水系统或水相中,具有稳定的分散态;步骤二:可膨润性压力控制微凝胶体强化制程:在微凝胶体分散液中添加具有界面活性及氢键形成基团的微凝胶体强化剂,在15至40摄氏温度下,水相分散溶液慢速搅拌,搅拌时间在3小时以上;步骤三:限制膜表面预改质制程:取一高分子薄膜作为限制膜,该高分子薄膜在含药控释系统中将限制药物传输方向性,在进行该限制膜表面预改质,利用气体或电浆或强能量氧化限制膜表面进行表面预改质反应,反应条件系选自由臭氧气曝处理10至60分钟,uv照射10至60分钟,电浆照射10至60分钟,及其组合条件的族群;步骤四:限制性压力传输控制层固定化制程:将预改质处理完成的限制膜表面与可膨润性压力控制微凝胶体均匀分散固定在已改质的限制膜表面,形成可膨润性微凝胶体压力传输控制层,混合的方式首先将强化后可膨润性压力控制微凝胶体的水相分散溶液慢速搅拌,在15至40摄氏温度下,搅拌时间在6小时以上,透过该温度范围操作来限定可膨润性压力控制微凝胶体的安定范围;步骤五:微凝胶体液粘度提升与结构强化制程:使可膨润性压力控制微凝胶体均匀分散固定在已改质的限制膜表面,形成可膨润性微凝胶体压力传输控制层,持续进行uv射线后照射制程1分钟~15分钟照射,完成强化结构可膨润性微凝胶体压力传输控制层,并使强化结构可膨润性微凝胶体压力传输控制层活化可利于后段固定化反应;步骤六:制备互穿网结构体制程:在水中加入聚乙烯醇,羧甲基纤维素,以及功能性成分,并混合均匀,因物理性的交互作用力,辅助形成均匀互穿网结构体预处理液备用;步骤七:互穿网结构体固定化制程:预先调配并搅拌溶解及分散均匀的互穿网结构体溶液,在强化结构可膨润性微凝胶体压力传输控制层上进行涂布浓缩及干燥,达成互穿网结构体固定化反应,形成互穿网微支架结构层;步骤八:压力控制槽封装制程:将固定有可膨润性微凝胶体压力传输控制层之互穿网结构体设置于一限制性压力传输控制层与一微通道传输层之间,透过多段涂布来达成,使达成所述可膨润性微凝胶体压力传输控制层内部均布可膨润压力控制微凝胶体可以在临床应用时随时间增加吸湿而逐渐膨润体积放大,在膨润过程中压缩周边环境,因限制性压力传输控制层之方向限制而在互穿网微支架结构层内创造强制性压力,使功能性成分浓度减低时可透过逐渐产生的强制性压力使残留于复合膜的药物可长效地释放;步骤九:长效药物控释复合载体卷收及裁切制程:将封装有长效控释传输结构体的压力控制槽覆于基材层上,贴覆后即可卷收及裁切,以制得具有长效药物控释复合载体
制备微凝胶体亲水液制程:将30g的卡波姆(carbopol941,德国merck公司)溶于适量的水中,并搅拌均匀后备用,该微凝胶体的平均粒径分布以3到30μm为较佳。
可膨润性压力控制微凝胶体强化步骤:在微凝胶体分散液中添加具有界面活性及氢键形成基团的微凝胶体强化剂,在15至40摄氏温度下,水相分散溶液慢速搅拌,搅拌时间在3小时以上,在此所描述具有界面活性及氢键形成基团的微凝胶体强化剂,优选地,透过有机合成及纯化而得,利用苯乙烯及马林酸酐(maleicanhydride)摄氏60度,通氮气,搅拌12小时,以起始剂诱发自由基共聚合反应,透过丙酮沉淀,先得到sma(由傅立叶红外谱ir可发现酸酐基团特性吸收1862cm-1)再经过水解,将酸酐转化为丙烯酸基团得到苯乙烯与丙烯酸共聚物结构psac。本发明所合成psac若在水性系统因其接口活性可用以形成100奈米至500奈米的微粒。在此,苯乙烯与丙烯酸共聚物结构psac用来做为本发明所需要的凝胶体添加剂,所得产物分子量透过gpc量测约104至106.这样的共聚物具有疏水基团和亲水基团,在系统中有助于凝胶体得稳定分散,并且可以进一步提供氢键基团维持系统均匀性及安定性,也可以进一步加入胺基酸进行缩和,形成胜肽侧链(由傅立叶红外谱ir,1670至1680cm-1特性吸收)聚合物(psacp),可使本发明的凝胶体添加剂更符合医学工程材料生物兼容特性,如下结构,r为胺基酸的取代基,不同r会有不同的强化特质。而在本发明特别是针对与丙烯酸系统所形成的凝胶体,为本发明的重要关键成分及设计,进一步,配合本发明另一个重要配搭选择卡波姆(carbopol941),因其具备有下列结构可符合本发明设计透过可膨润性压力控制微凝胶体,形成限制性压力传输控制效应,其中r为氢基团或脂肪酸基团,分子量约为1.25x106。
制备功能性包覆液制程:将25g的阿拉伯胶(美国sigma公司)溶解在100ml之蒸馏水中,并且放在一个50℃水浴的容器中备用,然后将5克薄荷脑(美国sigma公司)、5克的冬绿油(美国sigma公司),以及3克的山梨醇酯(德国merck公司)一起倒入,将25g的明胶加入水温60℃的蒸馏水中,然后隔水加热并搅拌至溶解,形成功能性包覆液;制备基质互穿网结构体制程:将10克的聚乙烯醇(德国merck公司)作为第一穿网高分子链,选择聚乙烯醇的原因是因为聚乙烯醇高分子带有相当多可形成氢键的亲水基团及功能性氢氧基团,可以具有物理性交链以及化学性交链之潜力,选择长碳脂肪酸作为中性界面活性剂来添加,例如添加中性界面活性剂1克,磷脂质1克作为包覆体结构调节剂,也可以配合添加甘油,透过界面活性剂与调节剂的添加,形成亲水性基团外露的微胞,例如在本实施的氢氧基团,当作为第二穿网高分子链的纤维素或海藻酸钠5克、与50ml水缓缓加入,均匀搅拌,使作为第二穿网高分子链的纤维素或海藻酸钠可以轻易地形成物理性或化学性交链,并且透过亲水基团与第二穿网高分子链相交错,形成互穿网结构,并与50ml基质功能性包覆液充分混合。这种透过形成微胞再进行物理性或化学性交链,使第二穿网高分子链与第一穿网高分子链微胞作用产生互相穿透交错的互穿网结构之方法,并未见诸其他习知已公开技术文献,这是本发明为了达到可长效控制的互穿网结构制作方法。该功能性基质的成份并没有特别的限制,即只要符合功能性成份产生预期疗效者即可,在本实施例中,该基质包含有:水、聚乙烯醇、乙烯缩水山梨糖醇硬酯酸酯、羧甲基纤维素,以及少量例如:薄荷脑、冬绿油、甘姜、茴姜等等的易挥发性物质。以上成份调配而成的基质属于水性,若将乙烯缩水山梨糖醇硬酯酸酯改变成橡胶、天然橡胶、松脂及树脂时,调配出来的基质属于油性。
该互穿网微支架结构层3中所分散存在的基质通常包含:水相、油相、乳化剂与交联剂,其中乳化剂是选自至少一种:十二烷基硫酸钠、例如:聚氧乙烯山梨糖醇酐单月桂酸酯、聚氧乙烯山梨糖醇酐单棕榈酸酯、聚氧乙烯山梨糖醇酐单硬脂酸酯、聚氧乙烯山梨糖醇酐三硬脂酸酯、聚氧乙烯山梨糖醇酐单油酸酯、聚氧乙烯山梨糖醇酐三油酸酯等之tween类、例如:山梨糖醇酐单月桂酸酯、山梨糖醇酐单棕榈酸酯、山梨糖醇酐单硬脂酸酯、山梨糖醇酐三硬脂酸酯、山梨糖醇酐单油酸酯、山梨糖醇酐倍半油酸酯、山梨糖醇酐三油酸酯等之司盘(span)类、硬脂酸与氧氧化钠或氢氧化钾或氢氧化铵形成的一价皂;油相选自液体石蜡、硅酮以及磷苯二甲酸异丁酯、磷苯二甲酸二乙酯、磷苯二甲酸异丙酯、磷苯二甲酸二丁酯、已二酸二乙酯、辛酸二乙酯、癸二酸二乙酯。亲水性的基底由亲水性的黏着性基质、保湿剂、填充剂、水组成,其中亲水性的黏着性基质选自至少一种:聚丙烯酸钠、聚丙烯酸钾、聚丙烯酸铵、聚丙烯酸单乙醇铵、聚丙烯酸二乙醇铵、聚丙烯酸三乙醇铵、羧甲基纤维素钠、羧甲基淀粉、聚乙烯醇、聚羧乙烯、聚乙烯吡咯烷酮、聚丙烯酸、聚乙二醇、阿拉伯胶、羟丙基纤维素、羟乙基纤维素、羟甲基纤维素、明胶。保湿剂是选自至少一种:甘油、甘露醇、丙二醇、山梨醇。渗透促进剂选自乙醇、丙二醇、脂肪酸酯、二甲基亚砜、油酸、亚油酸、月桂醇、氮酮、十二烷基硫酸钠、聚氧乙烯山梨糖醇酐单油酸酯、尿素、水杨酸和n-甲基吡咯烷酮、n-乙基吡咯烷酮、薄荷醇、樟脑和柠檬烯。亲油性的基底由亲油性的黏着性基质、填充剂组成,其中亲油性的黏着性基质是选自:橡胶、天然橡胶、松脂与树脂等。本发明基质可进一步混合有包覆有易挥发成分之功能性包覆微胶囊,易挥发功能性成分内容物具有易挥发的特性,具体例如:薄荷脑(menthol)、冬绿油(methylsalicylate,学名为水杨酸甲酯),以及甘姜、茴姜与丁香等植物之芳香精油,而功能性包覆微胶囊系由两种不同带电荷胶体(如:明胶与阿拉伯胶)等胶质硬化而成功能性包覆微胶囊。特定地,亲水性基质会选择可产生氢键或离子性键结具有物理化学性质的两种聚合物,在本发明实施例中系选择聚乙烯醇与羧甲基纤维素来形成互穿网,互穿网的形成必须充分溶解或分散,最后再进行浓缩或干告来达成。
本发明另一关键设计是疏水性传递微通道,可以透过聚乙烯或聚丙烯或聚乳酸或几丁聚糖或含硅聚丙烯酸或硅胶来达成,这样的疏水性传递微通道是一种仿生设计,例如细胞膜内外属亲水环境,但并须经过一疏水膜层来传递各种功能性成分并透过疏水通道内部改质可形成对药物控释成份的选择性,可以进阶作为多成分释放的基础。
本发明可膨润性微凝胶体压力传输控制层所使用微粒测试方法:粒径分析:采用雷射粒径仪(coulterlaserparticlecounterls230,usa),与带目镜测微仪的光学显微镜进行粒径分析;溶离率测试:将离型纸撕离功能性贴片或含药贴片,然后将样品置于溶离度试验机中进行溶离试验,在该溶离度试验机中采用乙醇为溶离液,并以转速100rpm进行试验,试验的温度为25℃及37℃两种,从进行试验开始,以20分、30分、60分、90分、120分、150分、180分、210分、240分、270分、300分、330分、360分、390分及420分等不同时间进行抽样,每次抽5ml,并以气相层析仪和火焰燃烧离子侦测器(shimadzugc-14a,japan)测定溶离率。另外,还包含化学结构鉴定之红外线光谱仪、碳氢核磁共振仪及元素分析。模拟药物是使用蒎及萘分子来测试药物控至释放系统的功效,进一步可制备客制化的互穿网微支架结构层、可膨润性微凝胶体压力传输控制层和限制性压力传输控制层,且可膨润性微凝胶体压力传输控制层、可膨润压力控制微凝胶体、微凝胶体强化剂。
以上说明对本发明而言只是说明性的,而非限制性的,本领域普通技术人员理解,在不脱离所附权利要求所限定的精神和范围的情况下,可做出许多修改、变化或等效,但都将落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!