一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法与流程
本发明涉及生物医药领域,尤其是涉及一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法。
背景技术:
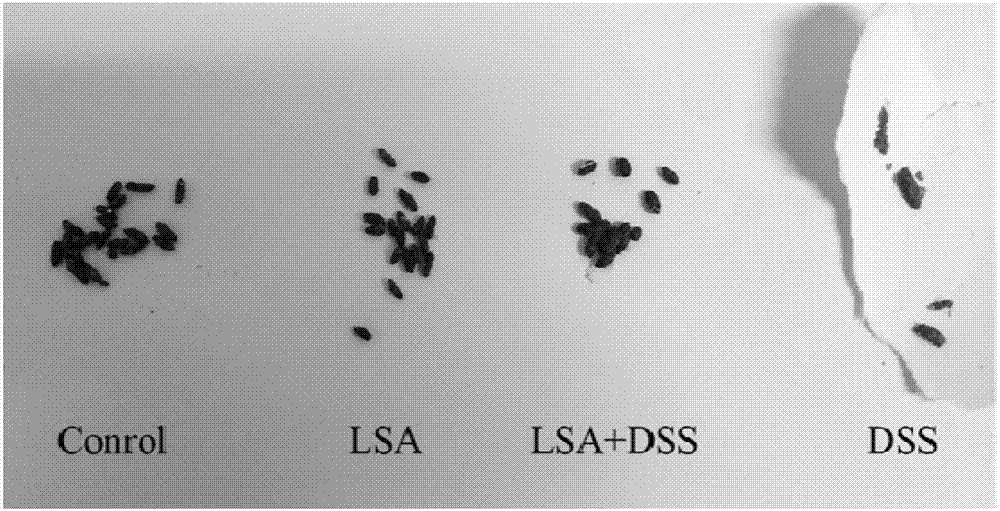
:炎症性肠病(IBD)是近年来在我国有较高发病率的一种慢性非特异性肠炎,对于IBD的发病原理尚未清楚,目前达成一致的认知是外在的环境因素对先天的遗传易感染患者产生作用。IBD包括溃疡性结肠炎(ulcerativecolitis,UC)和克罗恩病(Crohndisease,CD)。UC能够发生于任何年龄段的人,近年来在我国发病率呈逐渐提高,并有年轻化趋势。UC的病患主要是结、直肠癌等高危人群。在癌细胞生成的过程中,炎症因素起着较大的影响,例如癌细胞的出现和生长,以及侵袭与转移。与UC相关的结直肠癌虽然只占所有结肠癌的1%-2%,但其死亡率较高,且确诊后癌变风险还会逐年增长。UC的发病和肠道屏障的损坏、氧化应激、炎症因子的分泌密切相关。虽然近几年医学治疗水平有所提高,但仍无法彻底对IBD这一疾病治愈。壳聚糖作为一种阳离子多糖同时有极佳生物相容性,以及生物降解性,且无毒副作用,其弱酸性水溶液有高粘性,其表面的氨基基团带正电荷(亦称氨基多糖),可与细胞表面带负电荷的磷脂等生物大分子作用,使药物易于结合到细胞膜表面促进其吸收,因此已经广泛被应用于药物载体和医用辅助材料领域。硒对人体的必要性已是研究人员的共识,它是人体必需的微量元素之一,硒在体内主要参与抗氧化、甲状腺激素合成和免疫功能等代谢通路,硒在体内的缺乏会引起癌症等数种慢性疾病。随着人们对氨基多糖金属复合物的认识的进一步深入,结合有机硒化合物良好的生物学活性,人们对氨基多糖硒的研究也越来越多。低聚化促进了氨基多糖的水溶性,有利于促进吸收,进而极大发挥其生物活性。硒化低聚氨基多糖(LSA)具有良好的细胞修复、抗氧化和免疫调节功能,能调节肠腔氧化还原状态,可能具备防治溃疡性结肠炎的能力。技术实现要素:本发明是为了克服现有技术中的不足,得到了一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法。研究结果显示LSA组相对DSS模型组小鼠血液DAO、溶菌酶、D-LAC含量降低,紧密连接蛋白和黏蛋白含量增高,HE染色和电镜扫描显示结构明显更加完整,提示小鼠肠黏膜通透性降低;LSA可通过抑制NF-κBp65相关信号通路的磷酸化水平显著缓解DSS导致的炎症因子表达异常,及结肠炎相关氧化指标MDA和氧化酶iNOS浓度的升高。UC的发病和肠道屏障的损坏、氧化应激、炎症因子的分泌密切相关,虽然近几年医学治疗水平有所提高,但仍无法彻底对IBD这一疾病治愈,因此我们急需一个安全有效的治疗和预防IBD的药物,硒化低聚氨基多糖作为一个潜在的抗生素替代品可能是理想的选择。为了实现上述目的,本发明采用以下技术方案:一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法,(a)取40只小鼠,适应性饲养三天后,按每组十只分成四组:正常组:使用蒸馏水饲养,并以水溶液灌胃,每日一次共10天;LSA组:使用蒸馏水饲养,并以硒化低聚氨基多糖(LSA)水溶液灌胃,每日一次共10天;LSA+DSS组:前三天使用蒸馏水饲养,后七天使用葡聚糖硫酸钠(DSS)水溶液饲养,并每天以硒化低聚氨基多糖(LSA)水溶液灌胃,每日一次共10天;DSS组:前三天使用蒸馏水饲养,后七天使用葡聚糖硫酸钠(DSS)水溶液饲养,并每天以水溶液灌胃,每日一次共10天;(b)每天记录小鼠的体重变化,计算小鼠体重减轻率,记录小鼠大便的性状,并收集粪便以用来测试小鼠隐血的状况和疾病活动指数(DAI)。所述的建立方法还包括(c)解剖小鼠,通过测量小鼠结肠长度、血清细胞因子、结肠组织匀浆液指标、结肠组织RT-PCR、病理切片、电镜扫描与蛋白印迹检测,评价LSA对DSS诱导的溃疡性结肠炎的在改善小鼠的体重减轻、便血和腹泻,减轻肠道炎性细胞浸润和腺体破坏的抗结肠炎的影响。作为优选,所述的硒化低聚氨基多糖溶液为500mg/kg的硒化低聚氨基多糖水溶液。作为优选,LSA溶液每日灌液量为200μl/day。作为优选,所述的葡聚糖硫酸钠水溶液为3.5%葡聚糖硫酸钠水溶液因此,本发明具有如下有益效果:通过让BALB/C小鼠自由饮用浓度为3.5%的DSS溶液7天制备结肠炎小鼠。LSA可显著缓解DSS导致的促炎因子表达异常,有证据表明组织中促炎因子的表达水平提高会导致炎症的级联放大反应,同时也会造成组织损伤。DSS处理显著上调了促炎因子表达这水平,而LSA显著改善了这一分泌趋势。DSS模型组小鼠肠道氧化损伤明显,表现在MDA、iNOS含量增高、抗氧化物质SOD、GSH-Px和CAT活性降低,LSA可显著降低MDA和iNOS含量,升高SOD、GSH-Px和CAT活性,提高总抗氧化能力(T-AOC),表明LSA具有显著的抗氧化作用,可通过抗氧化作用减轻肠道黏膜上皮细胞和紧密连接相关结构的损伤,有助于恢复肠黏膜屏障功能和结构,改善肠黏膜通透性,改善UC的炎症反应。LSA+DSS组相对DSS模型组小鼠血液DAO、溶菌酶、D-LAC含量降低,紧密连接蛋白和黏蛋白含量增高,HE染色和电镜扫描显示结构明显更加完整,提示小鼠肠黏膜通透性降低。说明LSA对小鼠结肠炎肠道屏障的损伤有一定保护修复作用。本实验使用DSS模型,发现LSA可显著抑制各种炎症因子的分泌,减少氧化应激的伤害,进一步研究发现其实现这一功能很可能是通过抑制NF-κBp65相关信号通路的磷酸化水平,进而结合体内外模型,证明了LSA缓解炎症的机制,我们的研究结果表明LSA可以作为很好的UC治疗药物。附图说明图1为小鼠体重变化图。图2为小鼠粪便外观图。图3为小鼠粪便隐血试验。图4为小鼠结肠炎的DAI评分。图5为小鼠结肠对比图。图6为小鼠结肠长度变化。图7为LSA对血清中炎症因子的影响(A、B、C分别代表血清中IL-6、TNF-α和COX-2的含量)。图8为LSA对血清中氧化指标的影响(A、B分别代表血清中iNOS和MDA的含量)。图9为LSA对血清中氧化指标的影响(A代表血清的总抗氧化能力T-AOC,B、C、D分别代表血清SOD、GSH-Px、CAT的酶活力)。图10为LSA对血清中肠道损伤指标的影响(A、B、C、D分别代表血清中DAO、D-LAC、LDH和溶菌酶的含量)。图11为LSA对结肠炎症因子的影响(A、B、C代表结肠组织中IL-6、TNF-α和COX-2含量)。图12为LSA对结肠组织中氧化指标的影响(A、B分别代表结肠组织中的iNOS和MDA的含量)。图13为LSA对结肠组织中抗氧化指标的影响(A代表结肠组织的总抗氧化能力T-AOC,B、C、D分别代表血清SOD、GSH-Px、CAT的酶活力)。图14为LSA对结肠组织中LDH(A)和溶菌酶(B)含量的影响。图15为LSA对小鼠结肠组织TNF-α(A)和IL-6(B)基因表达量的影响。图16为LSA对小鼠结肠组织ZO-1(A)、ZO-1(B)、claudin-1(C)和occludin(D)基因表达量的影响。图17为LSA对小鼠结肠组织mucin-1(A)、mucin-2(B)基因表达量的影响。图18为LSA对小鼠结肠组织GPX-1(A)、GPX-2(B)以及SOD-1(C)、SOD-2(D)和SOD-3(E)基因表达量的影响。图19为小鼠结肠病理组织切片A:Control(HE×100);B:LSA(HE×100);C:LSA+DSS(HE×100);D:DSS(HE×100)。图20为小鼠结肠病理组织切片A:Control(HE×200);B:LSA(HE×200);C:LSA+DSS(HE×200);D:DSS(HE×200)。图21为小鼠结肠病理组织切片A:Control(HE×400);B:LSA(HE×400);C:LSA+DSS(HE×400);D:DSS(HE×400)。图22为小鼠病理组织学评分。图23为小鼠结肠超显微结构(600×)。图24为小鼠结肠超显微结构(1000×)。图25为小鼠结肠超显微结构(20000×)。图26为Western-bolt分析mCRAMP的表达量。图27为LSA对DSS诱导BALB/C小鼠结肠组织NF-κBp65、IκB-α磷酸化和Nrf2蛋白水平的影响。具体实施方式下面结合附图与具体实施方式对本发明做进一步的描述。一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法,(a)取40只6-8周龄雄性BALB/C小鼠,体重在18~22g,适应性饲养三天后,按每组十只分成四组:正常组:使用蒸馏水饲养,并以水溶液灌胃,每日一次共10天,灌液量为200μ1/day;LSA组:使用蒸馏水饲养,并以硒化低聚氨基多糖(LSA)水溶液灌胃,每日一次共10天,灌液量为200μl/day;LSA+DSS组:前三天使用蒸馏水饲养,后七天使用3.5%葡聚糖硫酸钠(DSS)水溶液饲养,并每天以500mg/kg硒化低聚氨基多糖(LSA)水溶液灌胃,每日一次共10天,灌液量为200μl/day;DSS组:前三天使用蒸馏水饲养,后七天使用葡聚糖硫酸钠(DSS)水溶液饲养,并每天以水溶液灌胃,每日一次共10天,灌液量为200μl/day;(b)每天记录小鼠的体重变化,计算小鼠体重减轻率,记录小鼠大便的性状,并收集粪便以用来测试小鼠隐血的状况和疾病活动指数(DAI)。DAI评分标准如表1所示。隐血试验方法:用干净的棉签剥取一小块粪便放置在载玻片上面,用滴管吸取0.1%邻甲苯胺-乙酸溶液1至3滴,然后再滴加3%过氧化氢3滴混匀,然后密切注意粪便颜色发生的变化。呈现出蓝色化合物表示潜血实验阳性(+),未出现为阴性(-)。表1DAI评分标准体重下降(%)大便性状*大便隐血/肉眼血便计分0正常正常01~5松散隐血阳性16~10211~15稀便肉眼血便3>164*正常大便:成形大便;松散大便:不黏附于肛门的糊状、半成形大便;稀便:可黏附于肛门的稀水样便。如图1中所示,小鼠喂养前三天,小鼠体重未有明显变化,第四天DSS代替自来水喂养后,体重逐渐出现差异。第七天差异变的较为明显,第十天时,DSS<LSA+DSS组<LSA组<正常组。LSA组和LSA+DSS组虽然各自都有一定的体重减轻,但相较于DSS模型组,情况相对良好。如图2、图3以及图4中所示,DSS组和LSA+DSS组小鼠在第5天,也就是DSS造模第二天开始出现肠炎症状,与正常对照组比较,DSS模型组小鼠开始行动迟缓、同时精神较差,懒于运动,还有其进食及饮水频率显著下降,体重变轻。等到第10d,饮用DSS的小鼠基本出现了一定的血便及粪便隐血,粪便已经无法成型。DSS组DAI的评分和时间成正相关,到最后几天,正常对照组和LSA组的DAI评分总体上一致,基本都为零。而LSA+DSS组小鼠虽然行动、精神、饮食饮水方面较正常组和LSA组有一定差距,但是已经显著好于DSS模型组。如图5及6所示,正常组和LSA组的结肠通过目视显示为淡粉色,并且在小鼠的结肠肠腔里面能够看到一颗颗的粪便;而对DSS组小鼠结肠的观察发现,整条结肠基本看不到完整的颗粒状粪便,结肠内容物普遍呈暗红色。经过测量,发现饮用DSS后小鼠结肠长度都有一定程度变短,但LSA+DSS组情况明显好于DSS单独造模组,LSA+DSS组结肠长度与肉眼观察情况均显著好于DSS组(P<0.05)。2进一步,血清细胞因子检测方法如下:将小鼠称重后眼球取血于1.5ml离心管中,在4℃冰箱内过夜凝血,次日取出后,3000g离心10分钟;取上清于干净的离心管中,于-20℃保存,直到待测时取出。使用市售ELISA检测炎症因子TNF-α、IL-6、COX-2、溶菌酶水平,检测抗氧化指标GSH-PX、iNOS,试剂盒根据制造商说明书推荐方法使用。从图7中可知,与正常组和LSA组相比,DSS组血清IL-6、TNF-α、COX-2含量均明显升高且均有显著差异(P<0.05)。DSS造模两组中,LSA给药预防组IL-6、TNF-α、COX-2含量显著小于DSS组(P<0.05)。从图8可知,与正常组及LSA组对比,DSS组和LSA+DSS组小鼠血清的iNOS、MDA含量显著增高(P<0.05),表明本次试验DSS组UC模型造模成功。同时,与DSS组相比,LSA+DSS组小鼠血清iNOS、MDA的含量显著降低(P<0.05),表明LSA对结肠炎中产生的氧化因子有一定抑制效果。从图9可知,跟正常组和LSA组相比,DSS组和LSA+DSS组小鼠血清总抗氧化能力(T-AOC),以及SOD和CAT这两种抗氧化酶的活力显著降低(P<0.05);和DSS组相对比,LSA+DSS组小鼠血清的T-AOC能力,SOD、GSH-Px和CAT酶的活力都显著增强(P<0.05);与正常组相比,LSA组和LSA+DSS组GSH-PX含量均有提高,特别是图C中,LSA组GSH-PX含量显著高于正常组(P<0.05)。结果见图。表明LSA在结肠炎中有一定的抗氧化效果,特别是能提高GSH-Px的酶活力,具有良好而抗氧化活性。图10可知,DSS组血清DAO、D-LAC、LDH、溶菌酶含量跟正常组和LSA组比较显著升高(P<0.05);LSA+DSS组小鼠血清DAO、D-LAC、LDH、溶菌酶的含量跟DSS组相比明显降低(P<0.05)。表明LSA对DSS诱导结肠炎的恢复确实有效。3结肠组织匀浆液指标处死小鼠后在病变严重区取一段结肠约1em,置于液氮后取出研磨,按1:9质量体积比加入PBS磷酸缓冲液配制成匀浆液,然后置冷冻离心机中3000×g离心10min(4℃)。分离上清液,即为10%的肠组织匀浆液。用ELISA酶联免疫吸附试剂盒检测炎症因子TNF-α、IL-6、COX-2、溶菌酶水平,检测抗氧化指标GSH-PX、iNOS、T-AOC、SOD、MDA、LSH、CAT等,试剂盒根据制造商说明书推荐方法使用。如图11所示,跟正常组相比,DSS组小鼠结肠组织各种炎症因子IL-6、TNF-α、COX-2显著升高(P<0.05),表明本次试验,DSS组肠炎症状严重,模型成功。与DSS组相比,LSA+DSS组小鼠结肠组织中IL-6、TNF-α、COX-2含量明显降低(P<0.05),表明LSA对结肠炎小鼠结肠组织中炎症因子的调节确实有效。从图12中可知,DSS组和LSA+DSS组小鼠结肠组织中iNOS和MDA含量显著高于正常组和LSA组(P<0.05),表明DSS诱导的结肠炎发生了氧化应激反应。同时,与DSS组相比,LSA+DSS组小鼠结肠组织中iNOS、MDA含量明显降低(P<0.05),表明LSA对结肠炎中产生的氧化因子有一定抑制效果。从图13中可知,相对于正常组和LSA组,DSS组和LSA+DSS组小鼠结肠组织的T-AOC活性以及SOD、GSH-Px、CAT的酶活力显著降低(P<0.05);LSA+DSS与DSS组相比小鼠结肠组织中T-AOC活性以及SOD、GSH-Px、CAT的酶活力显著升高(P<0.05),表明LSA能够提高UC模型小鼠的抗氧化能力。图A、B、C中,LSA组T-AOC能力和SOD、GSH-Px活力略高于正常组水平,虽然不显著,但是表明了LSA能提高结肠部位抗氧化能力。从图14中可知,与正常组和LSA组比较,DSS组和LSA+DSS组小鼠结肠组织中LDH和溶菌酶含量均显著增高(P<0.05);同时相对于DSS组,LSA+DSS组小鼠结肠组织中LDH和溶菌酶含量明显降低(P<0.05)。结果见图5-12。由此可见,LSA对DSS诱导结的UC恢复确实有效。4结肠组织RT-PCR将小鼠解剖后,截取2-3cm近直肠段远端结组织,液氮速冻近直肠段远端结组织,液氮速冻-80℃保存,用于检测上述相关细胞因子的mRNA表达,引物序列见表2。从图15中可知,从图5-13可见,跟正常组相比,LSA+DSS组和DSS组小鼠结肠组织TNF-α和IL-6的基因表达量显著升高(P<0.05)。LSA+DSS组与DSS组对照,小鼠结肠组织中TNF-α和IL-6基因表达量显著降低(P<0.05),表明LSA对DSS诱导结肠炎有预防治疗作用。从图16中可知,与正常组和LSA组相比,LSA+DSS组和DSS组小鼠结肠组织中ZO-1,ZO-2,claudin-1还有occludin基因表达量显著降低(P<0.05);LSA+DSS组相对于DSS组,小鼠结肠组织中ZO-1,ZO-2,claudin-1还有occludin基因表达量显著增高(P<0.05),与正常组接近但不显著(P>0.05),表明LSA对DSS诱导结肠炎,能通过黏膜保护起到一定抗炎作用。另外在图A和图B中,LSA组相对空白组小鼠结肠ZO-1、ZO-2基因表达量显著增高(P<0.05),表明补充LSA能够提高肠道致密蛋白的合成量从而增强黏膜屏障的完整性。从图17中可知,与空白组比,LSA+DSS组和DSS组小鼠结肠组织mucin-1和mucin-2基因表达量显著降低(P<0.05)。LSA+DSS组与DSS组相比,小鼠结肠组织中mucin-1和mucin-2基因表达量显著增高(P<0.05),表明LSA对DSS诱导的UC能通过提高肠道黏蛋白发挥黏膜保护作用。从图18中可知,与正常组相比,DSS组小鼠结肠组织GPX-1、GPX-2基因表达量显著降低(P<0.05);LSA组和LSA+DSS组小鼠结肠GPX-1基因表达量较空白组显著增高并显著高于DSS组(P<0.05),表明LSA对DSS诱导结肠炎的抗氧化作用的主要途径,可能是通过提高GSH-Px含量来实现。另外从图C、D、E可见,与空白组比DSS组小鼠结肠组织SOD-1、SOD-2和SOD-3的基因表达量显著降低(P<0.05);LSA+DSS组与DSS组相比,小鼠结肠组织中SOD-1、SOD-2和SOD-3基因表达量显著增高(P<0.05),表明LSA能够提高超氧化物歧化酶在基因水平的表达,从而发挥对DSS诱导结肠炎的抗氧化作用。表2RT-PCR的引物5病理切片取结肠病变最严重处的组织块(5×5×2mm)。用PBS磷酸缓冲液洗去肠道内容物,置于4%多聚甲醛溶液中固定24h,采用HE染色,观察组织学改变并按表3评分。表3小鼠结肠炎组织学评分项目病变程度计分病变范围计分炎症无01-251轻度126-502中度251-753重度376-1004病变深度无0黏膜层1黏膜层与黏膜下层2全层炎3隐窝破坏无0基底1/3隐窝被破坏1基底2/3隐窝被破坏2仅表面上皮完整3全部隐窝和上皮被破坏4再生指数完全再生或正常组织0几乎完全再生1再生伴隐窝缺损2表面上皮不完整3无修复4从图19-21可知,与正常组对照发现,DSS组小鼠结肠黏膜破损,并能观察到多灶性浅溃疡。几乎所有上皮细胞以及腺体都不完整,并且有大量的炎症细胞浸润,黏膜下层发生水肿,可见到淋巴细胞聚集形成淋巴滤泡。而正常组的小鼠结肠黏膜完好无损,腺体都排列整齐,未观察到炎性细胞的浸润。LSA+DSS组与DSS组小鼠相比,其结肠黏膜基本完整,但是部分区域仍可观察到浅溃疡。基本所有皮细胞和腺体的结构都保持完整,有少量的炎症细胞浸润,黏膜下层没有观察到水肿。LSA组小鼠结肠整体状况跟正常组接近。从图22中可知,与正常组比较,LSA组HI评分虽然有所升高,但是差异并不显著(P>0.05),可能是药物对肠道的轻微刺激所造成。与正常组对照,DSS组小鼠HI评分明显增高(P<0.05),LSA+DSS组小鼠HI评分较正常组较高,但和DSS组相比明显降低(P<0.05)。6电镜扫描试验结束后取小鼠结肠肠段约1cm,按照电镜观察要求,迅速将肠组织样在冰上用刀片修成大约1mm*1mm*1mm大小,用镊子将组织块移至盛有4℃预冷2.5%戊二醛固定液的小广口瓶中进行固定。样品送检。从图23、24以及25中可知,肠黏膜损伤SEM观察:(1)空白组表现为正常上皮:结肠黏膜表面是一层平滑似天鹅绒样的微绒毛毯,被有序的凹沟分割。(2)DSS组为典型发生结肠炎症黏膜的表现:正常表皮结构严重破坏,微绒毛在20000×倍镜下可看到严重缺损甚至消失。(3)LSA+DSS组,显示病变减轻,黏膜表面无破损,但凹沟结构不太清晰。虽然大部分微绒毛处在破损膨大状态,但其形态结构清晰可见。7蛋白印迹检测将小鼠结肠于-80℃保存,之后用液氮研磨,对结肠中的nrf-2、keap-1、p65、actin、ikb-α、p-ikb-α、p-p65进行蛋白印迹检测。从图26、27中的结果表明,DSS刺激下激活了炎症经典相关信号通路NF-κBp65的磷酸化水平,DSS造模组NF-κBp65的磷酸化水平较正常组和LSA组显著提高(p<0.05),LSA+DSS组较DSS造模组显著降低(p<0.05),同时各组NF-κBp65的蛋白表达无显著差异(p>0.05)。检测NF-κBp65上游因子IκB-α的磷酸化水平,发现DSS造模组IκB-α的磷酸化水平与正常组及LSA组比均显著提高(p<0.05),而LSA+DSS组较DSS造模组显著降低(p<0.05),各组IκB-α的蛋白表达无显著差异(p>0.05)。另外检测Nrf2-Keap1抗氧化系统的蛋白表达水平,发现DSS处理组keap-1和Nrf-2蛋白表达水平显著高于其他各组(p<0.05),其中LSA+DSS组的keap-1和Nrf-2蛋白表达水平与DSS组比较虽显著下调(p<0.05),但同时仍显著高于正常组(p<0.05)。序列表<110>浙江海洋大学<120>一种硒化低聚氨基多糖对溃疡性结肠炎小鼠影响模型的建立方法<160>28<170>SIPOSequenceListing1.0<210>1<211>20<212>DNA<213>引物-f(primer-f)<400>1cctgtagcccacgtcgtagc20<210>2<211>20<212>DNA<213>引物-r(primer-r)<400>2ttgacctcagcgctgagttg20<210>3<211>25<212>DNA<213>引物-f(primer-f)<400>3tggagtcacagaaggagtggctaag25<210>4<211>25<212>DNA<213>引物-r(primer-r)<400>4tctgaccacagtgaggaatgtccac25<210>5<211>22<212>DNA<213>引物-f(primer-f)<400>5cccgaaactgatgctgtggata22<210>6<211>24<212>DNA<213>引物-r(primer-r)<400>6cccttggaatgtatgtggagagaa24<210>7<211>20<212>DNA<213>引物-f(primer-f)<400>7gctttggtgtggaccaagat20<210>8<211>20<212>DNA<213>引物-r(primer-r)<400>8tccattatgggtttgcatga20<210>9<211>22<212>DNA<213>引物-f(primer-f)<400>9gctgggtttcatcctggcttct22<210>10<211>22<212>DNA<213>引物-r(primer-r)<400>10cctgagcggtcacgatgttgtc22<210>11<211>22<212>DNA<213>引物-f(primer-f)<400>11gcccaggcttctggatctatgt22<210>12<211>23<212>DNA<213>引物-r(primer-r)<400>12ggggatcaaccacacagtagtga23<210>13<211>21<212>DNA<213>引物-f(primer-f)<400>13tggattgtttctgcagatttt21<210>14<211>20<212>DNA<213>引物-r(primer-r)<400>14cctgacctgaacttgatgct20<210>15<211>20<212>DNA<213>引物-f(primer-f)<400>15cccagaagggactgtgtatg20<210>16<211>19<212>DNA<213>引物-r(primer-r)<400>16tgcagacacactgctcaca19<210>17<211>22<212>DNA<213>引物-f(primer-f)<400>17acagtccaccgtgtatgccttc22<210>18<211>24<212>DNA<213>引物-r(primer-r)<400>18ctcttcattcttgccattctcctg24<210>19<211>22<212>DNA<213>引物-f(primer-f)<400>19ctggtagttctcggcttccctt22<210>20<211>23<212>DNA<213>引物-r(primer-r)<400>20ggtcggacatacttgaggctgtt23<210>21<211>20<212>DNA<213>引物-f(primer-f)<400>21atggcgatgaaagcggtgtg20<210>22<211>23<212>DNA<213>引物-r(primer-r)<400>22ttactgcgcaatcccaatcactc23<210>23<211>19<212>DNA<213>引物-f(primer-f)<400>23atgcccaaacctatcgtgt19<210>24<211>19<212>DNA<213>引物-r(primer-r)<400>24cccaatgagccaaagaaac19<210>25<211>20<212>DNA<213>引物-f(primer-f)<400>25gctaggtcgaagctggactc20<210>26<211>20<212>DNA<213>引物-r(primer-r)<400>26ttctacggcttgctactggc20<210>27<211>25<212>DNA<213>引物-f(primer-f)<400>27tggaatcctgtggcatccatgaaac25<210>28<211>25<212>DNA<213>引物-r(primer-r)<400>28taaaacgcagctcagtaacagtccg25当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1