pH响应和多肽靶向的纳米药物递送载体及其制备和应用的制作方法
本发明涉及生物医药肿瘤治疗药物领域,尤其是涉及一种pH响应和多肽靶向的纳米药物递送载体及其制备和应用。
背景技术:
近年来,癌症的发病率逐渐升高。化疗和放疗在当前癌症治疗中扮演越来越重要的角色。然而化疗和放疗常伴随许多明显的副作用,如身体衰弱,消化障碍,免疫功能下降等,且患者生存质量差。由于纳米药物载体能提高药物的吸收、稳定性,具有一定的组织靶向性,能够减少化疗和放疗的副作用。因此利用纳米材料来递送化疗药物和放疗药物受到国内外学者的广泛关注。金纳米团簇是近年来合成的一种新型的纳米粒子,粒径为2纳米左右,通过功能化修饰后容易与放化疗药物结合,具有良好的生物相容性和红色荧光性能,因此其在纳米医学领域吸引了越来越多的关注,包括生物成像、传感器、药物传输和癌症治疗等。
纳米药物载体递送系统虽然具有靶向,穿透性强等优势。但有可能在到达目的部位前释放药物,或在到达靶区后不能及时有效释放药物。而肿瘤部位的微环境与正常组织差别较大。因此利用肿瘤微环境设计纳米药物载体系统可能提高药物在肿瘤的部位的有效释放,从而达到更好的治疗效果。如基质金属蛋白酶(MMPs)属于锌和钙黏着家族成员,通常与癌症扩散、转移和血管生成有关,在肿瘤细胞高度表达。因此基质金属蛋白酶可被用于设计肿瘤微环境靶向纳米药物载体。肿瘤细胞的pH值为弱酸性,正常组织的生理pH值是呈中性。而利用此特性亦设计酸性响应性纳米药物未见相关报道。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种pH响应和多肽靶向的纳米药物递送载体及其制备和应用。本发明主要解决的技术问题为利用肿瘤微环境与正常组织的区别设计肿瘤微环境响应型纳米药物递送系统,通过荧光成像发现该纳米药物递送系统能够靶向到肿瘤部位,且在近红外光的照射下肿瘤的生长受到了抑制。因此该纳米药物递送系统可以用于肿瘤的治疗和成像。
本发明的目的可以通过以下技术方案来实现:
本发明的目的之一在于提出了一种pH响应和多肽靶向的纳米药物递送载体,其主要包括金纳米团簇GNCs,与所述金纳米团簇GNCs表面连接的光敏剂、对pH敏感的化疗药物以及靶向多肽。
优选的,所述的光敏剂为二氢卟吩e6(Ce6)。
优选的,所述对pH敏感的化疗药物为顺式乌头酸酐修饰的阿霉素(DOX)。
优选的,所述靶向多肽为mPEG连接的多肽。
优选的,所述纳米药物递送载体中,光敏剂的含量为2-8mg/Kg,对pH敏感的化疗药物的含量为5-10mg/Kg,靶向多肽的含量为3-12mg/kg。
优选的,所述的金纳米团簇GNCs通过采用GSH(谷胱甘肽)和TBAB(四正丁基硼氢化铵)还原氯金酸制成。
光敏剂限定的种类为二氢卟吩e6(Ce6),用于光动力治疗以及荧光成像,化疗药物是阿霉素DOX用于对肿瘤细胞进行化学治疗,靶向多肽序列是CPLGVRGRGDS,用作最终合成的载体的靶向。金纳米团簇表面的羧基是有限的,约18个,DOX,Ce6和mPEG修饰的多肽都是通过共价键结合到金纳米团簇上,因此这三种物质的含量过高会影响其他成分与金纳米团簇的结合,当其与金纳米团簇的摩尔比高于18:1时,会超过金纳米团簇的上载极限。当含量过低时,影响靶向和治疗效果。
本发明的目的之二在于提出了一种pH响应和多肽靶向的纳米药物递送载体的制备方法,其具体可包括以下步骤:
(1):合成金纳米团簇GNCs;
(2):取mPEG-马来酰亚胺和多肽溶于二甲亚砜中,反应,分离,干燥,即得到mPEG-多肽;
(3):取化疗药物、顺式乌头酸酐、三乙胺和吡啶,混合,反应,分离,纯化,干燥,即得到对pH敏感的顺式乌头酸酐修饰的化疗药物;
(4):将光敏剂与步骤(3)制得的顺式乌头酸酐修饰的化疗药物分别用EDC/NHS活化处理后,滴加到步骤(1)所制得的金纳米团簇GNCs水溶液中,室温避光搅拌,透析,得到接有光敏剂和顺式乌头酸酐修饰的化疗药物的纳米载体;
(5):最后,将步骤(2)所得mPEG-多肽用EDC/NHS活化后,加入到步骤(4)制得的含光敏剂和顺式乌头酸酐修饰的化疗药物的纳米载体溶液中,避光搅拌,透析纯化,干燥,即得到最后目的产物。
优选的,步骤(1)中金纳米团簇GNCs具体通过以下方法合成:
按照以下氯金酸量为计量基准,取150mM的GSH溶液4ml加入到10ml浓度为20nM的氯金酸溶液中,剧烈搅拌5min,随后,再加入预冷后的6ml浓度为0.186M的TBAB溶液,快速搅拌10min,静置,纯化,即得到。
优选的,步骤(2)中mPEG-马来酰亚胺和多肽的摩尔比为1:1.2;
反应条件为在30℃下剧烈搅拌24h。
优选的,步骤(3)中,所述的化疗药物为阿霉素。
优选的,步骤(3)中,混合反应的过程具体为:
先取摩尔比为1:2的盐酸阿霉素与三乙胺溶于二甲亚砜中,避光搅拌,纯化,干燥,得到DOX;
然后,将制得的DOX分散于吡啶中,再逐滴加入顺式乌头酸酐溶液,控制DOX、吡啶与顺式乌头酸酐的添加量比为20mg:2ml:25mg,搅拌过夜,即完成反应。此混合反应过程中,搅拌的温度为优选为4℃。
优选的,步骤(4)中,光敏剂、顺式乌头酸酐修饰的化疗药物和金纳米团簇的添加量之比摩尔比为3:3:1。
优选的,步骤(5)中,mPEG-多肽与含光敏剂和顺式乌头酸酐修饰的化疗药物的纳米载体的摩尔比为1-3:1。
优选的,最后制得的纳米药物递送载体的粒径为50-100nm。
本发明中各步骤的反应温度要适中,温度过高药物失效,过低影响反应的发生
本发明的目的之三在于提出了一种pH响应和多肽靶向的纳米药物递送载体在制备肿瘤治疗或成像药物上的应用,所述的纳米药物递送载体主要包括金纳米团簇GNCs,与所述金纳米团簇GNCs表面连接的光敏剂、对pH敏感的化疗药物以及靶向多肽。
优选的,所述的光敏剂为二氢卟吩e6(Ce6)。
优选的,所述对pH敏感的化疗药物为顺式乌头酸酐修饰的阿霉素(DOX)。
优选的,所述靶向多肽为mPEG连接的多肽。
优选的,所述纳米药物递送载体中,光敏剂的含量为2-8mg/Kg,对pH敏感的化疗药物的含量为5-10mg/Kg,靶向多肽的含量为3-12mg/kg。
优选的,所述的金纳米团簇GNCs通过采用GSH(谷胱甘肽)和TBAB(四正丁基硼氢化铵)还原氯金酸制成。
优选的,治疗的肿瘤细胞为非小细胞癌细胞、胃癌细胞或肝癌细胞中的一种。
优选的,治疗时,所述纳米药物递送载体采用尾静脉注射方式注入,同时,在肿瘤部位采用能量密度为50-100mW/cm2的近红外激光照射30min。
与现有技术相比,本发明具有以下优点:
(1)本发明以GNCs为载体,将光敏剂和化疗药物通过化学键连接到GNCs上,然后将mPEG修饰的多肽连接到含有光敏剂和化疗药物的载体上用于动物的近红外成像及联合治疗。
(2)本发明中所用的纳米载体的制备条件温和,步骤简单,容易操作。
(3)本发明中所制备的纳米药物载体具有很好的生物相容性。
(4)本发明中所制备的纳米药物载体是近红外成像,背景低,干扰少,穿透深度深。
(5)本发明中所制备的纳米药物载体含有靶向多肽,靶向效果好。
(6)本发明中所制备的纳米药物载体的靶向多肽可进一步带领纳米药物载体进入肿瘤细胞,因此靶向效果好。
(7)本发明中所制备的纳米药物载体中化疗药物与载体的连接是通过pH敏感键连接的,而肿瘤区域是偏酸性的,因此在纳米药物载体到达肿瘤区域后才释放。所以对正常组织的副作用小。此外,本发明中所制备的纳米药物载体连接的光敏剂在近红外光的刺激下才会产生ROS,在纳米药物载体到达肿瘤部位后再配合近红外光照射,产生的ROS可作用于肿瘤细胞,从而进一步抑制肿瘤的生长。
附图说明
图1是本发明的纳米药物递送载体的结构示意图。
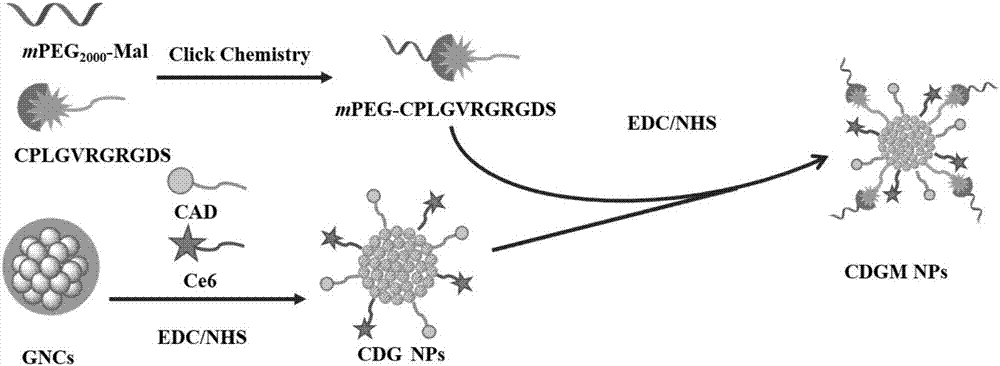
图2是本发明的纳米药物递送载体的制备方法流程图。
图3是本发明的纳米药物递送载体的TEM表征图片
图4是本发明的纳米药物递送载体的水动力学粒径分布图片。
图5是不同药物组分的紫外吸收图片。
图6是不同药物组分的荧光光谱图片。
图7是本发明的纳米药物递送载体用于联合治疗肺癌细胞A549的MTT结果图片。
图8是本发明的纳米药物递送载体的动物组织荧光成像图片。
具体实施方式
下面结合具体实施例和附图对本发明的具体实施方式做详细的说明。应理解,这些实施例仅用于说明本发明而不限于以下的实施例。
如图1所示的基于金纳米团簇制备的pH响应和多肽靶向的纳米药物递送载体,其核心为GNCs,然后在其表面连接上二氢卟吩e6(Ce6),顺式乌头酸酐修饰的阿霉素(DOX)以及多肽修饰的聚乙二醇。
上述纳米药物递送载体的制备过程可参见图2所示,具体工艺条件详见下述实施例1-实施例3。
实施例1
金纳米团簇GNCs的制备与纯化:
(1-1)金纳米团簇的制备:
首先,将174mL去离子水加入到250mL锥形瓶中,然后继续加入新鲜配置的20mM氯金酸10ml,在加入新配置的150mM的谷胱甘肽4ml并剧烈搅拌5分钟。随后,在上述溶液中加入预冷的TBAB溶液6ml(0.186M)快速搅拌10分钟,而后于冰上静置。2个小时后用盐酸调节pH值到3.0左右继续于冰上放置12小时。
(1-2)金纳米团簇的纯化:
如实施例一合成的金纳米团簇中加入氯化钠和甲醇,然后9000rpm离心10分钟,除去不溶的杂质,完成初次纯化。其次,将初次纯化的金纳米团簇置于透析袋中用去离子水透析3天并冷冻真空干燥。
实施例2
(2-1)合成对pH敏感的顺式乌头酸酐修饰的DOX。
盐酸阿霉素和三乙胺以摩尔比为1:2溶于二甲亚砜中避光搅拌过夜,透析纯化后冷冻真空干燥获得DOX。
然后将20mg DOX溶于2ml吡啶超声1分钟。2.5ml顺乌头酸酐(10mg/ml)逐滴加入到DOX溶液中于4℃下搅拌过夜。接着,加入4ml氯仿和4ml(5%)碳酸氢钠水溶液。将此溶液转移到烧瓶中,通过旋转蒸发除去有机相,如此重复三次,离心沉淀去除杂质,上清用盐酸调pH值调到2.5-3.0。最后,4℃下离心沉淀,溶液通过冷冻真空干燥获取终产物顺乌头酸酐修饰的DOX。
(2-2)将Ce6和顺乌头酸酐修饰的DOX连接到金纳米团簇上形成Ce6-DOX-GNCs。
Ce6和DOX分别用EDC和NHS活化后,逐滴加入到1ml金纳米团簇水溶液中,并保证Ce6、顺乌头酸酐修饰的DOX和金纳米团簇的摩尔比为3:3:1,室温温和避光搅拌过夜。形成的纳米药物载体置于透析袋(MWCO,3500Da)中纯水避光透析3天。
实施例3
(3-1)合成mPEG-修饰的多肽
5ml(1mg/ml)多肽逐滴加入到溶于二甲亚砜的马来酰亚胺修饰的mPEG中,避光剧烈搅拌24小时,产物通过透析纯化,得到mPEG-修饰的多肽。
(3-2)将mPEG-修饰的多肽连接到Ce6-DOX-GNCs上形成CDGM NPs纳米颗粒。
mPEG修饰的多肽(5mg)溶于1ml二甲亚砜中,然后加入10mg EDC和10mg NHS并于室温搅拌3个小时。并将其加入到1ml含Ce6-DOX-GNCs水溶液中避光搅拌24小时,保证mPEG-多肽与Ce6-DOX-GNCs的摩尔比为3:1。然后通过超纯水透析纯化2天。最终获得的含有mPEG-修饰的多肽的纳米药物载体通过冷冻真空干燥,即得到最后目的产物纳米药物递送载体CDGM NPs。
图3-6分别表示了上述实施例1-3中所制得的产物的TEM表征图、水动力学粒径分布、紫外吸收图谱以及荧光光谱,从图3和4中可以看出,合成的载体的粒径大小约50-100nm。图5表明合成的靶向载体含有Ce6的特征吸收峰665nm和DOX的吸收峰488nm,由此可以看出Ce6和DOX成功连接到了金纳米团簇上。图6则说明合成的pH敏感的药物递送系统含有DOX和Ce6的荧光,且Ce6的荧光强度几乎和游离的Ce6相同。因此Ce6和载体的连接不影响其荧光成像效果实施例4
评价Ce6与DOX混合物(Mix),以及CDGM NPs在激光照射下对非小细胞型肺癌A549的治疗效果。
为检测Mix以及合成的纳米药物载体CDGM NPs对非小细胞型肺癌的治疗效果。将A549细胞(5000个/孔)种植于96孔板,孵育24h。去掉培养液,替换含有PBS,Mix或CDGM NPs的培养液。暗处培养12h,630nm激光照射Mix和CDGM NPs组。激光功率为100mW/cm2照射10分钟。暗处培养12小时后,MTT法检测细胞活性。
图7结果显示:在不同Ce6剂量下,CDGM NPs组光动力治疗和化疗联合治疗的疗效高于单纯混合的Ce6和DOX组(Mix)。
实施例5
评价CDGM NPs用于肿瘤的荧光成像。
为构建A549皮下肺癌模型,雌性BALB/c裸鼠(5周龄),用注射器于裸鼠臀部皮下注射一定数量的A549细胞,待肿瘤长至约200mm3即可用于成像。150μL Ce6-GNCs-DOX(CDG NPs)和CDGM NPs尾静脉分别注入皮下肺癌模型中,每组三只,用于裸鼠的荧光成像。采集图像用小动物荧光成像系统Bruker In-Vivo F PRO imaging system仪器。36小时后杀死裸鼠,取心肝脾肺肾采集Ce6荧光信号。从图8可以看出,CDG NPs处理组中,肝脏部位有很强的荧光信号,说明CDG NPs靶向肿瘤能力较差。然而,在CDGM NPs处理组肿瘤部位能观察到很强的荧光信号,表明CDGM NPs有很强的靶向肿瘤的能力。
实施例6
与实施例3有所不同的是,本实施例中,mPEG-多肽与Ce6-DOX-GNCs的摩尔比为1:1。
实施例7
与实施例3有所不同的是,本实施例中,mPEG-多肽与Ce6-DOX-GNCs的摩尔比为2:1。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!