一种磺酰脲类药物的注射用药物组合物及其制备方法与流程
本发明属于医药技术领域,特别是涉及一种磺酰脲类药物的注射用药物组合物及其制备方法。
背景技术:
磺酰脲类药物是一种促胰岛素分泌剂,广泛应用于II型糖尿病的临床治疗。临床上广泛应用的磺酰脲类降糖药物包括格列本脲(Glibenclamide或Gliburide)、格列齐特(Gliclazide)、格列吡嗪(Glipizide)、格列喹酮(Gliquidone)、格列波脲(Glibornuride)、格列美脲(Glimepiride)等。已上市磺酰脲类降糖药物均为口服固体制剂。
近年来研究表明,格列本脲(式1,也称格列苯脲,化学名称为5-氯-N-(4-〔N-(环己基氨甲酰基)氨黄酰基〕苯乙基)-2-甲氧基苯甲酰胺)静脉注射给药可以用于预防中风患者脑水肿(Sheth等,Pilot study of intravenous glyburide in patients witha large ischemic stroke.Stroke,2014,45:281-283)。磺酰脲类药物是通过作用于磺酰脲受体(SURs)发挥作用。磺酰脲类药物呈弱酸性,水溶性差,尤其在中性和酸性pH值条件下溶解度极低。格列本脲在水中的溶解度低于5μg/ml。Schrage等报道了采用0.1M NaOH配制1mg/ml格列本脲注射液(Schrage等.Effects of combined inhibition of ATP-sensitive potassium channels,nitric oxide,and prostaglandins on hyperemia during moderate exercise.J Appl Physiol,2006,100:1506-1512)。但该溶液pH值高达11,超过了注射液的常用pH值范围(pH4~pH9)。如采用酸性pH调节剂降低pH,则药物存在析出风险。且PVC输液袋对低浓度格列本脲溶液存在明显的吸附。
技术实现要素:
经研究,发明人创造性地发明了一种新的含有附加剂、环糊精的磺酰脲类药物,特别是格列本脲的注射用组合物,与现有技术相比,联合使用环糊精和附加剂,比单独使用环糊精或单独使用附加剂,大大提高了难溶性磺酰脲类药物的水中溶解度和稳定性。发明人还发现,联合使用环糊精和附加剂,能显著抑制PVC输液袋对药物格列本脲的吸附。
本发明一个方面提供一种药物组合物,含有磺酰脲类药物、环糊精和附加剂。
在一个实施方案中,本发明任一项的药物组合物,其中所述附加剂与环糊精的重量比为1:0.1~4000,例如1:1~400,例如1:1~100,例如1:1~50,例如1:5~50,例如1:50~400,例如1:1~10,例如1:1~8,例如1:1~6,例如1:1~4,例如1:6~8;
优选地,所述附加剂是葡甲胺,所述附加剂与环糊精的重量比为1:1~400;
优选地,所述附加剂是碳酸钠,所述附加剂与环糊精的重量比为1:50~400;
优选地,所述附加剂是氢氧化钠,所述附加剂与环糊精的重量比为1:50~4000;
优选地,所述附加剂是碳酸氢钠,所述附加剂与环糊精的重量比为1:0.1~10。
在一个实施方案中,本发明任一项的药物组合物,其中所述磺酰脲类药物与附加剂的重量比为1:0.01~100,例如1:0.05~100,例如1:0.5~100。
在一个实施方案中,本发明任一项的药物组合物,其中所述磺酰脲类药物与环糊精的重量比为1:0.2~1000,例如1:25~250,例如1:1~50。
在一个实施方案中,本发明任一项的药物组合物,所述磺酰脲类药物、附加剂和环糊精的重量比为1:0.05~100:0.2~1000,例如1:0.5~50:25~250。
在一个实施方案中,本发明任一项的药物组合物,其中所述磺酰脲类药物选自格列本脲、格列齐特、格列吡嗪、格列喹酮、格列波脲、格列美脲、格列派特、醋酸己脲、格列环脲、格列沙脲、格列生脲、格列索脲、格列辛脲、氯磺丙脲、妥拉磺脲、甲苯磺丁脲、瑞格列奈和那格列奈;
优选地,所述磺酰脲类药物为格列本脲。
在一个实施方案中,本发明任一项的药物组合物,其中所述环糊精选自α-环糊精、β-环糊精、γ-环糊精及药学上可接受的环糊精衍生物;
优选地,所述药学上可接受的环糊精衍生物选自二甲基-β-环糊精、2-羟乙基-β-环糊精、2-羟丙基-β-环糊精、3-羟丙基-β-环糊精和三甲基-β-环糊精;
优选地,所述环糊精选自β-环糊精、二甲基-β-环糊精、2-羟乙基-β-环糊精、2-羟丙基-β-环糊精、3-羟丙基-β-环糊精和三甲基-β-环糊精;
进一步优选地,所述环糊精为2-羟丙基-β-环糊精和/或3-羟丙基-β-环糊精;
更进一步优选地,所述环糊精为2-羟丙基-β-环糊精。
在一个实施方案中,本发明任一项的药物组合物,其中所述附加剂选自碳酸钠、碳酸氢钠、硼砂、氢氧化钠、氢氧化钾、磷酸氢二钠、磷酸二氢钠、柠檬酸二氢钠、柠檬酸一氢钠、柠檬酸钠、葡甲胺、三羟甲基氨基甲烷、单乙醇胺、二乙醇胺、赖氨酸、精氨酸和组氨酸。
优选地,所述附加剂选自氢氧化钠、碳酸钠、碳酸氢钠、硼砂和葡甲胺;
优选地,所述附加剂为碳酸钠、碳酸氢钠、氢氧化钠和/或葡甲胺;
优选地,所述附加剂为碳酸钠;
优选地,所述附加剂为碳酸氢钠;
优选地,所述附加剂为氢氧化钠;
优选地,所述附加剂为葡甲胺。
在一个实施方案中,本发明任一项的药物组合物,其还包括葡萄糖、氯化钠、冻干添加剂(例如甘露醇、乳糖或明胶)、pH调节剂和/或水。
在一个实施方案中,本发明任一项的药物组合物,其为注射剂,优选为溶液型注射剂(例如水溶液型注射剂)或粉针剂。
在一个实施方案中,本发明任一项的药物组合物,其为溶液型注射剂(例如水溶液型注射剂);
优选地,所述药物组合物中所述环糊精浓度为0.5%~40%(w/v),例如为1%~40%(w/v),例如为2.5%~40%(w/v),例如为5%~20%(w/v),例如为1%~5%(w/v);
优选地,所述附加剂浓度为0.01%~20%(w/v),例如为0.01%~15%(w/v),例如为0.01%~10%(w/v),例如为0.01%~5%(w/v),例如为0.1%~5%(w/v);
优选地,所述药物组合物中所述环糊精浓度为0.5%~40%(w/v),例如为1%~40%(w/v),例如为2.5%~40%(w/v),例如为5%~20%(w/v),例如为1%~5%(w/v);其中所述附加剂浓度为0.01%~20%(w/v),例如为0.01%~15%(w/v),例如为0.01%~10%(w/v),例如为0.01%~5%(w/v),例如为0.1%~5%(w/v);
进一步优选地,所述药物组合物中所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度;更进一步优选地,其中所述磺酰脲类药物的浓度为0.01~50mg/ml,例如为0.01~10mg/ml,例如为0.01~5mg/ml,例如为0.01~2.5mg/ml,例如为0.01~2mg/ml。
本领域技术人员可以根据需要,在含有附加剂和环糊精的水溶液中溶解磺酰脲类药物,磺酰脲类药物的浓度小于或等于其饱和浓度。饱和浓度是指磺酰脲类药物在溶液中达到饱和状态时的浓度(单位mg/mL)。
在一个实施方案中,本发明任一项的药物组合物,其具有以下一项或多项特征:
a)所述附加剂的浓度为0.01~0.5%(w/v),所述环糊精的浓度为0.5~10%(w/v),所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度(优选所述磺酰脲类药物的浓度为0.01~3mg/mL、例如0.1~3mg/mL,例如1~3mg/mL);
b)所述附加剂的浓度为0.1~0.5%(w/v),所述环糊精的浓度为0.5~10%(w/v),所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度(优选所述磺酰脲类药物的浓度为0.01~3mg/mL,例如0.1~3mg/mL,例如1~3mg/mL);
c)所述附加剂的浓度为0.1~0.3%(w/v),所述环糊精的浓度为1~5%(w/v),所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度(优选所述磺酰脲类药物的浓度为0.01~2.5mg/mL,例如0.1~2.5mg/mL,例如1~2.5mg/mL);
d)所述附加剂的浓度为1~10%(w/v),所述环糊精的浓度为1~30%(w/v),所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度(优选所述磺酰脲类药物的浓度为0.01~50mg/mL,例如0.1~50mg/mL,例如10~50mg/mL);
e)所述附加剂的浓度为4~6%(w/v),所述环糊精的浓度为5~20%(w/v),所述磺酰脲类药物的浓度小于或等于该磺酰脲类药物在所述溶液型注射剂中的饱和浓度(优选所述磺酰脲类药物的浓度为0.01~50mg/mL,例如0.1~50mg/mL,例如25~50mg/mL)。
在一个实施方案中,本发明任一项的药物组合物,其pH为5~11,优选为6~10,进一步优选为7~9,更优选为7~8。
本发明又一方面提供本发明任一项的药物组合物的制备方法,包括以下步骤:
a)将附加剂和环糊精溶解在溶剂中;
b)加入磺酰脲类药物,搅拌混合;
c)可选地,加入冻干添加剂,调节pH;
d)灭菌,任选地,进行干燥,得到所需产品;
优选地,所述干燥为冷冻干燥;
优选地,所述溶剂为水、生理盐水或葡萄糖溶液。
本发明又一方面提供本发明任一项的药物组合物在用于制备预防和/或治疗急性中风、外伤性脑损伤、脑水肿、脊髓损伤、心肌梗塞、休克、器官缺血、室性心律失常、I型糖尿病或II型糖尿病的药物中的用途。
在一个实施方案中,本发明任一项的药物组合物的制备方法包括以下步骤:
a)将附加剂和环糊精溶解在水中,混合均匀;
b)再加入活性成分磺酰脲类药物,搅拌;
c)调节pH;
d)将所制得的溶液通过无菌过滤或热压灭菌;
e)分装于管形瓶或安瓿中,然后密封/加盖。
在另一个实施方案中,本发明任一项的药物组合物的制备方法包括以下步骤:
a)将附加剂和环糊精溶解在水中,混合均匀;
b)再加入活性成分磺酰脲类药物,搅拌;
c)加入冻干添加剂,调节pH;
d)分装于西林瓶或安瓿中;
e)将所制得的溶液通过冷冻干燥去除水分然后密封/加盖。
在一个具体实施方案中,本发明任一项的药物组合物的制备方法包括以下步骤:
a)称取处方量的附加剂(例如选自碳酸钠、碳酸氢钠、硼砂、氢氧化钠、氢氧化钾、磷酸氢二钠、磷酸二氢钠、柠檬酸二氢钠、柠檬酸一氢钠、柠檬酸钠、葡甲胺、三羟甲基氨基甲烷、单乙醇胺、二乙醇胺、赖氨酸、精氨酸、组氨酸中的一种或多种)、环糊精(例如选自α-环糊精、β-环糊精、γ-环糊精、及药学上可接受的环糊精衍生物中的一种或多种),搅拌,溶解于水中;
b)再加入活性成分磺酰脲类药物(例如选自格列本脲、格列齐特、格列吡嗪、格列喹酮、格列波脲、格列美脲、格列派特、醋酸己脲、格列环脲、格列沙脲、格列生脲、格列索脲、格列辛脲、氯磺丙脲、妥拉磺脲、甲苯磺丁脲、瑞格列奈、那格列奈中的一种或多种),搅拌溶解,即得。
在一个实施方案中,术语“附加剂”是指能够和活性成分发生某种相互作用,从而提高环糊精包合效率,进一步改善药物溶解度的物质。
本发明中,“%(w/v)”是指质量体积浓度,表示每100ml溶液中含有的溶质克数,例如20%(w/v)表示每100ml溶液中含有20g溶质。
本发明的有益效果:
与现有技术相比,本发明的药物组合物,联合使用环糊精和附加剂,比单独使用环糊精或单独使用附加剂,大大提高了难溶性磺酰脲类药物的水中溶解度和稳定性,且能显著抑制PVC输液袋对药物格列本脲的吸附。
本发明一个或多个实施方案的药物组合物或其制备方法具有以下一项或多项有益效果:
1)磺酰脲类药物在水中溶解度高,特别是在中性或酸性环境中,磺酰脲类药物在水中溶解度高;
2)药物组合物的水溶液析出少,稳定性好,特别是在中性或酸性环境中,药物组合物的水溶液析出少,稳定性好;
3)药物组合物的药物在PVC输液袋中吸附少;
4)药物组合物的处方简单,质量稳定;
5)制备方法重现性好,容易操作,可控性强。
附图说明
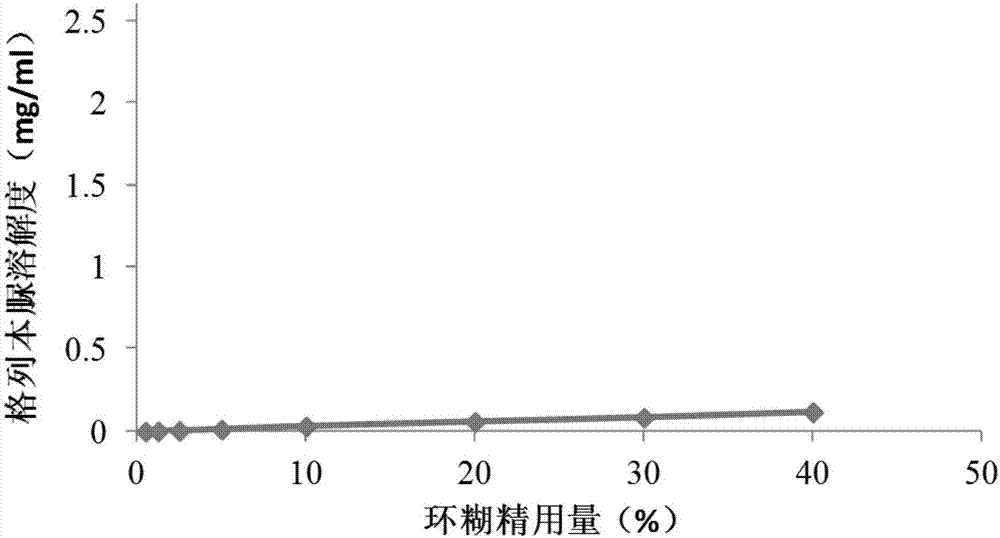
图1~图7为25℃下,格列本脲在含不同溶液中的溶解度曲线,其中:
图1为格列本脲在只含有葡甲胺的溶液中的溶解度曲线;
图2为格列本脲在只含有2-羟丙基-β-环糊精的溶液中的溶解度曲线;
图3为格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为0.1%)的溶液中的溶解度曲线;
图4为格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为5%)的溶液中的溶解度曲线;
图5为格列本脲在同时含有2-羟丙基-β-环糊精和碳酸钠(碳酸钠浓度固定为0.1%)的溶液中的溶解度曲线;
图6为格列本脲在同时含有2-羟丙基-β-环糊精和碳酸氢钠(碳酸氢钠浓度固定为4%)的溶液中的溶解度曲线;
图7为格列本脲在同时含有2-羟丙基-β-环糊精和氢氧化钠(氢氧化钠浓度固定为0.01%)的溶液中的溶解度曲线;
附图中,MEG指葡甲胺。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例和实验例仅用于说明本发明,而不应视为限定本发明的范围。实施例和试验例中未注明具体条件者,按照常规条件或制造商建议的条件进行,所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表1所示。
表1:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至7.0,定容至100ml即得。
实施例2:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表2所示。
表2:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至8.0,定容至100ml即得。
实施例3:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表3所示。
表3:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至7.5,定容至100ml即得。
实施例4:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表4所示。
表4:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至9.0,定容至100ml即得。
实施例5:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表5所示。
表5:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至7.0,定容至100ml即得。
实施例6:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表6所示
表6:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至6.5,定容至100ml即得。
实施例7:含葡甲胺的格列本脲注射用增溶组合物制备,处方如表7所示。
表7:处方
制备方法:先将处方量的葡甲胺和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至6.0,定容至100ml即得。
实施例8:含碳酸钠的格列本脲注射用增溶组合物制备,处方如表8所示。
表8:处方
制备方法:先将处方量的无水碳酸钠和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至7.5,定容至100ml即得。
实施例9:含氢氧化钠的格列本脲注射用增溶组合物制备,处方如表9所示。
表9:处方
制备方法:先将处方量的氢氧化钠和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。以0.1M盐酸调节pH至8.5,定容至100ml即得。
实施例10:含碳酸氢钠的格列本脲注射用增溶组合物制备,处方如表10所示。
表10:处方
制备方法:先将处方量的碳酸氢钠和羟丙基-β-环糊精溶解在50~70ml体积的水中,再加入处方量的格列本脲原料药粉末,搅拌溶解。加入处方量的冻干添加剂甘露醇,搅拌溶解。以0.1M盐酸调节pH至7.5,定容至100ml。分装至西林瓶,按表11冻干程序冷冻干燥,即得。
表11:冻干程序
试验例1:格列本脲注射用增溶组合物配伍稳定性试验
试验方法:取上述实施例2制备的格列本脲注射用增溶组合物1ml,分别注入100ml葡萄糖注射液或生理盐水注射液中,分别在0h、24h、48h、72h、96h观察外观、pH值和有关物质的变化。格列本脲注射用增溶组合物与葡萄糖注射液配伍稳定性实验结果如表12所示,格列本脲注射用增溶组合物与生理盐水配伍稳定性实验结果如表13所示。
试验结果:
表12:与葡萄糖注射液配伍稳定性实验结果
a注:杂质I:4-[2-(5-氯-2-甲氧基苯甲酰胺)-乙基]-苯磺酰胺;杂质II:4-[2-(5-氯-2-甲氧基苯甲酰胺)-乙基]-苯磺酰氨基-甲酸乙酯。
表13:与生理盐水配伍稳定性实验结果
a注:杂质I:4-[2-(5-氯-2-甲氧基苯甲酰胺)-乙基]-苯磺酰胺;杂质II:4-[2-(5-氯-2-甲氧基苯甲酰胺)-乙基]-苯磺酰氨基-甲酸乙酯
表12和表13的实验结果显示上述格列本脲增溶组合物与葡萄糖注射液或生理盐水相容性良好。
试验例2:格列本脲注射用增溶组合物稀释稳定性试验
试验方法:取10支试管,按1~10编号,分别加入1ml pH7.4的磷酸缓冲液,然后在1号试管中加入1ml实施例2制备的格列本脲注射用增溶组合物,振荡混合均匀,从1号中取1ml至2号试管中,重复操作直至10号试管,静置观察澄清度。
试验结果:10支试管在96h内均无药物析出,说明该处方与pH=7.4的磷酸缓冲液相容性良好。
试验例3:溶解度试验
将过量的格列本脲原料药粉末加入到含有不同比例的附加剂(例如葡甲胺、碳酸钠、碳酸氢钠或氢氧化钠)和环糊精(羟丙基-β-环糊精)水溶液中形成混悬液,置于恒温培养振荡器25±1℃温度条件下振荡1h。采用0.45μm水系滤膜滤过,弃初滤液,取续滤液,用pH7.4PBS缓冲液将续滤液稀释至适宜倍数后,在225nm处测定吸光度,计算格列本脲的溶解度。以格列本脲的溶解度为纵坐标、以环糊精和/或葡甲胺的浓度为横坐标绘制相应的溶解度曲线。试验结果:25℃下格列本脲的溶解度曲线见图1至图7;相应溶解度数据见表14至表20。
图1为格列本脲在只含有葡甲胺的溶液中的溶解度曲线,表14为相应溶解度数据。由图1可见,格列本脲的水中溶解度随葡甲胺浓度的增加而升高:葡甲胺浓度在0.1%(w/v)至10%(w/v)范围内,格列本脲在25℃条件下的水中溶解度分别为0.96mg/ml至19.05mg/ml。
表14:格列本脲在只含有葡甲胺的溶液中的溶解度
图2为格列本脲在只含有2-羟丙基-β-环糊精的溶液中的溶解度曲线,表15为相应溶解度数据。由图2可见:格列本脲的水中溶解度随环糊精浓度的增加呈线性升高:环糊精浓度在0.5%(w/v)至40%(w/v)范围内,格列本脲在25℃条件下的水中溶解度分别为0.0013mg/ml至0.12mg/ml。
表15:格列本脲在只含有2-羟丙基-β-环糊精的溶液中的溶解度
图3为格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为0.1%)的溶液中的溶解度曲线,表16为相应溶解度数据。由图3可见:联合使用环糊精和葡甲胺可使格列本脲的水中溶解度显著增加。当葡甲胺浓度为0.1%(w/v)且环糊精浓度在0.5%(w/v)至5%(w/v)范围内时,格列本脲在25℃条件下的水中溶解度分别为1.25mg/ml至2.17mg/ml。环糊精浓度由5%(w/v)继续增加至40%(w/v),格列本脲溶解度保持在约2.17mg/ml。
表16:格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为0.1%)的溶液中的溶解度
图4为格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为5%)的溶液中的溶解度曲线,表17为相应溶解度数据。由图4可见:联合使用环糊精和葡甲胺可使格列本脲的水中溶解度显著增加。当葡甲胺浓度为5%(w/v)且环糊精浓度在5%(w/v)至30%(w/v)范围内时,格列本脲在25℃条件下的水中溶解度分别为25.23mg/ml至49.37mg/ml。环糊精浓度由30%(w/v)继续增加至40%(w/v),格列本脲溶解度保持在约49.37mg/ml。
表17:格列本脲在同时含有2-羟丙基-β-环糊精和葡甲胺(葡甲胺浓度固定为5%)的溶液中的溶解度
图1~4和表14~17的结果说明葡甲胺和环糊精两者对格列本脲的增溶产生了意想不到的协同作用。葡甲胺的加入可能促进了环糊精对格列本脲的包合作用,进一步增加了格列本脲的溶解度。图3~4的结果说明葡甲胺促进环糊精对格列本脲的包合作用可能与葡甲胺的浓度相关。
图5为格列本脲在同时含有2-羟丙基-β-环糊精和碳酸钠(碳酸钠浓度固定为0.1%)的溶液中的溶解度曲线,表18为相应溶解度数据。由图5可见:联合使用环糊精和碳酸钠可使格列本脲的水中溶解度显著增加。当碳酸钠浓度为0.1%(w/v)且环糊精浓度在5%(w/v)至20%(w/v)范围内时,格列本脲在25℃条件下的水中溶解度分别为2.35mg/ml至10.63mg/ml。环糊精浓度由20%(w/v)继续增加至40%(w/v),格列本脲溶解度保持在约10.63mg/ml。
表18:格列本脲在同时含有2-羟丙基-β-环糊精和碳酸钠(碳酸钠浓度固定为0.1%)的溶液中的溶解度
图6为格列本脲在同时含有2-羟丙基-β-环糊精和碳酸氢钠(碳酸氢钠浓度固定为4%)的溶液中的溶解度曲线,表19为相应溶解度数据。由图5可见:联合使用环糊精和碳酸氢钠可使格列本脲的水中溶解度显著增加。当碳酸氢钠浓度为4%(w/v)且环糊精浓度在0.5%(w/v)至10%(w/v)范围内时,格列本脲在25℃条件下的水中溶解度分别为0.32mg/ml至1.69mg/ml。环糊精浓度由10%(w/v)继续增加至40%(w/v),格列本脲溶解度保持在约1.69mg/ml。
表19:格列本脲在同时含有2-羟丙基-β-环糊精和碳酸氢钠(碳酸氢钠浓度固定为4%)的溶液中的溶解度
图7为格列本脲在同时含有2-羟丙基-β-环糊精和氢氧化钠(氢氧化钠浓度固定为0.01%)的溶液中的溶解度曲线,表20为相应溶解度数据。由图5可见:联合使用环糊精和氢氧化钠可使格列本脲的水中溶解度显著增加。当氢氧化钠浓度为0.01%(w/v)且环糊精浓度在0.5%(w/v)至10%(w/v)范围内时,格列本脲在25℃条件下的水中溶解度分别为0.14mg/ml至1.26mg/ml。环糊精浓度由10%(w/v)继续增加至40%(w/v),格列本脲溶解度保持在约1.26mg/ml。
表20:格列本脲在同时含有2-羟丙基-β-环糊精和氢氧化钠(氢氧化钠浓度固定为0.01%)的溶液中的溶解度
图1~7和表14~20的结果说明附加剂(例如葡甲胺、碳酸钠、碳酸氢钠或氢氧化钠)和环糊精两者对格列本脲的增溶产生了意想不到的协同作用。附加剂的加入可能促进了环糊精对格列本脲的包合作用,进一步增加了格列本脲的溶解度。图3~7的结果说明附加剂促进环糊精对格列本脲的包合作用可能与附加剂的浓度相关。
试验例4:pH调节试验
按上述实施例2方法制备格列本脲注射用增溶组合物,固定格列本脲加入量为1mg/ml,葡甲胺浓度为0.1%(w/v),但调整环糊精浓度分别为1.25%(w/v)、2.50%(w/v)和5%(w/v)。将每一处方分为三等份,分别以0.1M盐酸将pH调节至7.0,7.5和8.0,获得格列本脲药物溶液。同时还制备格列本脲加入量为1mg/ml,不含环糊精,仅含0.1%(w/v)葡甲胺的药物溶液,将每一处方分为三等份,分别以0.1M盐酸将pH调节至7.0,7.5和8.0,获得格列本脲药物溶液。将上述格列本脲药物溶液置于25℃放置,观察药物溶液的析出情况。
试验结果如表21所示,“-”表示未析出沉淀;“+~++++”表示析出沉淀,“+”越多,沉淀越多。
仅含0.1%(w/v)葡甲胺的药物溶液以0.1M盐酸调节pH至7.5时,即析出药物沉淀;调节pH至8.0的药物溶液放置24h后析出白色沉淀。而含0.1%(w/v)葡甲胺和不同浓度环糊精的药物溶液调节pH至8.0,放置96h均未见沉淀析出。将含0.1%(w/v)葡甲胺+1.25%环糊精的药物溶液调节pH至7.5,放置96h后析出少量药物晶体;将含0.1%(w/v)葡甲胺+2.50%环糊精的药物溶液调节pH至7.0,放置96h后析出极少量药物晶体;将含0.1%(w/v)葡甲胺+5.0%环糊精的药物溶液调节pH至7.0,放置96h后未见晶体析出。以上结果说明增溶组合物中环糊精可以起到抑制格列本脲析出,稳定药物溶液的作用。
表21:pH调节试验结果
注:-:未析出沉淀;+~++++:析出沉淀,+越多,沉淀越多
试验例5:输液袋吸附试验
按上述实施例2、实施例8和实施例9方法制备注射用增溶组合物,以0.9%注射用氯化钠溶液稀释至格列本脲浓度为5μg/ml,编号5a、5b、5c。同时按相同处方制备相应的不含羟丙基-β-环糊精的注射用增溶组合物,以0.9%注射用氯化钠溶液稀释至格列本脲浓度为5μg/ml,编号5a’、5b’、5c’。将稀释后药物溶液分为两份,一份注入PVC输液袋中,置于25℃,100rpm振摇;另一份置于量瓶25℃,100rpm振摇(作为对照用)。96小时后取样,HPLC法(Agilent Eclipse XDB-C18柱(5μm,4.6×250mm);流动相为甲醇:50mM磷酸二氢铵(体积比)=72.5:27.5(2%磷酸调pH至3.5±0.1);检测波长300nm;流动相流速1ml/min;进样量20μl)测定主药峰面积。以量瓶中药物溶液为对照,计算药物吸附率(药物吸附率=100×(量瓶中主药峰面积-PVC输液袋中主药峰面积)/量瓶中主药峰面积)。
试验结果如表22所示:3种不含羟丙基-β-环糊精的低浓度药物溶液(5a’、5b’、5c’)在PVC输液袋中均发生明显的药物吸附作用,吸附率均高于10%,药物浓度显著降低。而相应的含有羟丙基-β-环糊精的低浓度药物溶液(5a、5b和5c)在PVC输液袋中均未发生明显的药物吸附,吸附率均低于0.1%。表明:增溶组合物中的环糊精可以显著抑制PVC输液袋对药物的吸附。
表22:PVC输液袋吸附试验结果
综上所述,与现有技术相比,本发明提供的磺酰脲类药物的注射用药物组合物,联合使用环糊精和附加剂,比单独使用环糊精或单独使用附加剂,大大提高了磺酰脲类药物的水中溶解度和稳定性,且能显著抑制PVC输液袋对药物的吸附。该药物组合物且具有处方简单、成本低廉、易操作、质量稳定可控、重现性好等优点。
- 还没有人留言评论。精彩留言会获得点赞!