抗癌剂、放射线敏化剂及食品组合物的制作方法
本发明涉及用于与放射治疗并用的抗癌剂、放射线敏化剂及用于增强放射治疗的效果的食品组合物。
背景技术:
癌症治疗的3大疗法为“手术治疗”、“抗癌剂治疗”及“放射治疗”。其中,较新的治疗法为“放射治疗”。放射治疗为对癌细胞照射x射线、γ射线及电子射线等放射线而使其消灭的治疗法。放射线会损伤癌细胞内的dna而引起癌细胞的分裂停止、细胞的凋亡。另外,放射线使细胞内的氧活化而形成活性氧,由此强化dna杀伤力。放射治疗的优点可列举:无基于手术的组织切除、能够进行局部治疗、对正常组织的损害小等。对于担心因手术而导致后遗症的癌症(喉头癌、宫颈癌、膀胱癌及前列腺癌等)、手术困难的胰腺癌等,大多进行抗癌剂与放射线的并用治疗。放射治疗的目的有根治治疗、延命治疗及缓和治疗等,其目的根据癌症的种类及进行状况等而不同。
50~70%的癌症患者在治疗的过程中接受放射治疗。放射线不仅伤害肿瘤组织,而且还有伤害正常组织的风险,因此在治疗时实施对病灶的局限照射或非照射部位的遮蔽,付出将伤害抑制为最小限度的努力。放射线伤害正常组织的细胞而引起细胞死亡,将该影响蓄积并扩大而陷入的身体功能的降低称作放射损伤(非专利文献1)。放射线敏感性根据各脏器而不同,决定其的要因为构成细胞的性质。越是细胞分裂的频率高、将来进行的细胞分裂的数量多的细胞,即越是形态或功能未分化的细胞,敏感性越高。因此,造血干细胞或成体干细胞容易受到影响,其结果是,受到低剂量的照射时暂时性地出现血细胞减少、脱毛。受到高剂量的放射线照射的情况下,根据被照射脏器的放射线敏感性,出现急性期的特征性疾病。具体而言,在放射线敏感性特别高的送血组织或消化道中,在分别被照射大约1.5gy以及5gy以上的放射线的情况下,引起疾病,在进一步受到数十gy以上的照射时出现对中枢神经系统的影响。
将放射线的能量被靶分子直接吸收而带来损害的情况称作放射线的直接作用(非专利文献2)。由于放射线的直接作用,靶分子激发或电离,因具有多余的能量而变得不稳定。在释放该多余的能量的过程中,靶分子的共价键断裂而成为2个自由基。
另一方面,将靶以外的分子吸收放射线的能量而形成自由基等的活化剂,该活化剂与靶分子反应而带来损害的情况称作间接作用(非专利文献2)。在水溶液中,放射线的能量首先被水分子吸收,生成羟基自由基、氢自由基、水合电子及过氧化氢等自由基或分子产物。然后,这些活化剂在水中移动,与靶分子发生化学反应来发挥作用。
直接作用和间接作用可以根据有无稀释效应、化学性防护效果及氧效应等来判别(非专利文献2)。一般而言,某种物质的水中浓度越低,因放射线而失活的分子的比例越增加。该现象被称作稀释效应,其表示间接作用的存在。在照射一定量的放射线的情况下,如果只有直接作用,则随着靶物质的水中浓度变低,失活的物质也应该减少。但是,在水分子因放射线分解而生成某一量的自由基、分子产物的情况下,在一定的剂量下生成一定量的这些物质。因此,与靶物质的水中浓度无关,一定量的物质被失活。因此,观察到稀释效应。
另外,氧的存在会使放射治疗的相应在质和量上发生变化(非专利文献2)。其中之一为:与水合电子、氢原子反应而形成超氧化物(eaq-+o2→o2-;h·+o2→ho2·)。ho2·的氧化力强,通过与核酸、蛋白质及脂质等生物有机分子的反应,来制作过氧化氢、有机分子的不稳定的烷氧基自由基(ro·)。
综上,若在氧分压高的条件下照射x射线或γ射线,则得到比在低氧下的照射更大的效果。将此称作氧效应,将其程度以[无氧状态下所需的剂量相对于在有氧状态下引起特定效果所需的剂量的比例]所定义的氧效应比(oer;oxygenenhancementratio)来表示。认为其原因在于:在氧的存在下,被放射线直接或间接地激发的靶分子与氧反应而形成过氧化物,由放射线所致的损伤被固定。即,由于在低氧下变得不易引起氧效应,因此与通常氧分压(约40mmhg)下的组织相比,产生放射线抵抗性,得到某一放射线效果所需的剂量比通常组织更多。这是使放射治疗的效果降低的一个原因。
据报道,在各种的癌症中,尤其是胰腺癌的癌微环境是低氧及低营养,以往的抗癌剂和放射线难以发挥效力。在对胰腺癌进行放射治疗时,使用放射线敏化剂,或者需要使癌微环境变化而成为容易引起氧效应的环境。就放射线敏化剂而言,已知的是:例如在细胞增殖中代替胸苷被组入dna中的、提高对放射线的敏感性的溴脱氧尿苷。另外,有如下称作kortuc的方法,即,为了提高对放射线的敏感性,对癌注入分解抗氧化酶的双氧水、和使双氧水停留于患部的透明质酸,提高氧效应的方法。它们在临床中被部分使用,并未达到一般的普及。
另外,在专利文献1中公开了一种放射线敏化剂,其在放射治疗时,既保护正常细胞,又使肿瘤细胞的放射线敏感性上升。该放射线敏化剂包含抗坏血酸、抗坏血酸的药学上所允许的盐、或抗坏血酸的药学上所允许的溶剂合物作为有效成分。
现有技术文献
专利文献
专利文献1:日本特开2014-139138号公报
非专利文献
非专利文献1:“对于放射线诱导性细胞死亡引起的器官损伤的自然免疫学的治疗战略(日文:放射線誘導性細胞死が引き起こす臓器障害に対する自然免疫学的治療戦略)”、实验医学、日本、2016年、第34卷、第7号、第110-115页
非专利文献2:“放射线的直接作用和间接作用(日文:放射線の直接作用と間接作用)”[online]、一般财团法人高度信息科学技术研究机构、(2016年6月27日检索)、internet<url:http://www.rist.or.jp/atomica/data/dat_detail.php?title_no=09-02-02-10>
技术实现要素:
发明要解决的课题
在胰腺癌等癌微环境中,血管欠缺,处于极重度的低氧及低营养环境下。在这样的环境下,不仅以往的抗癌剂、放射线难以发挥效力,而且容易产生与癌症的恶化有关的癌干细胞。因此,期望开发能够提高放射治疗的效果的方法。
本发明的目的在于,提供能够提高放射治疗的效果的抗癌剂、放射线敏化剂及食品组合物。
用于解决课题的手段
本发明人等对于移植有人胰腺癌细胞的小鼠并用基于包含牛蒡子苷元的牛蒡子提取物的治疗、和放射治疗,结果发现:与未治疗组及各单独治疗组相比,显著地缩小肿瘤。本发明人等发现:牛蒡子苷元抑制肿瘤组织的氧消耗,并且使肿瘤内的血流上升,由此改善肿瘤内的低氧环境,从而使放射治疗的效果增大。
本发明提供一种用于与放射治疗并用的抗癌剂,其含有牛蒡子苷元和/或牛蒡子苷作为有效成分。
另外,本发明提供一种抗癌剂,在上述抗癌剂中,以牛蒡、牛蒡子、牛蒡芽或连翘(日文:レンギョウ)、或者由它们提取的提取物的形式含有牛蒡子苷元和/或牛蒡子苷。
另外,本发明提供一种放射线敏化剂,其含有牛蒡子苷元和/或牛蒡子苷作为有效成分。
另外,本发明提供一种用于增强放射治疗的效果的食品组合物,其含有牛蒡子苷元和/或牛蒡子苷作为有效成分。
另外,本发明提供一种食品组合物,在上述食品组合物中,以牛蒡、牛蒡子、牛蒡芽或连翘、或者由它们提取的提取物的形式含有牛蒡子苷元和/或牛蒡子苷。
另外,本发明提供一种用于放射治疗的预处置剂,其含有牛蒡子苷元和/或牛蒡子苷作为有效成分。
发明效果
根据本发明,通过改善肿瘤的低氧环境,从而可以提高放射治疗的效果。因此,本发明通过与放射治疗并用,从而可以增强放射治疗的效果、增强抗肿瘤效果、以及进一步延伸生存率。
附图说明
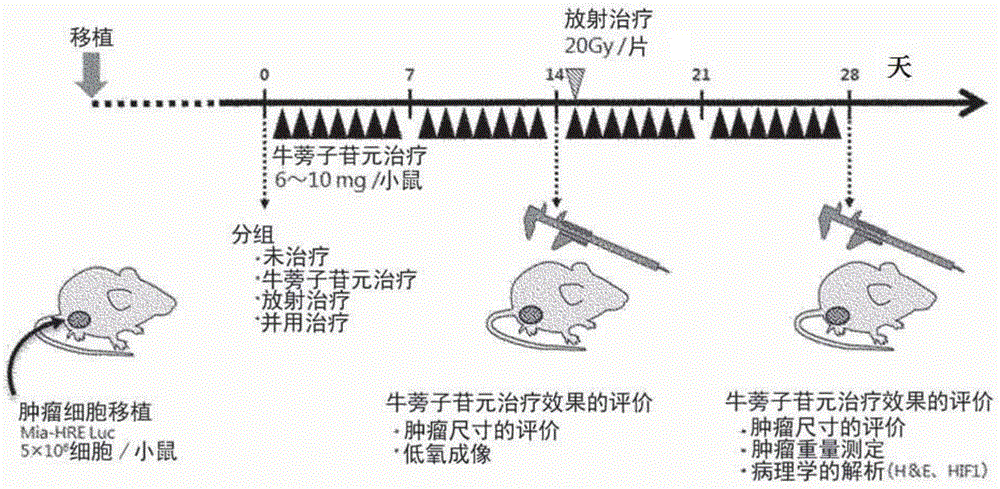
图1为对在试验例1中使用的试验方法进行说明的图。
图2为表示最初的牛蒡子苷元治疗2周后(放射治疗前)的未治疗组及牛蒡子苷元治疗组的平均肿瘤尺寸的图表。
图3为表示使用ivis对牛蒡子苷元治疗后的肿瘤内低氧区域(photoncounts/tumorvolume)进行评价的结果的图表。
图4为表示未治疗组及牛蒡子苷元治疗组的ivis成像结果的图。
图5为表示各治疗组的平均肿瘤尺寸的变化(mean±s.e.)的图表。
图6为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤尺寸的箱线图。
图7为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤重量(g)的箱线图。
图8为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤的状态的图。
图9为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤的状态的图。
图10为对在试验例2中使用的试验方法进行说明的图。
图11为表示各治疗组的平均肿瘤尺寸的变化的图表。
图12为使用ivis评价的治疗结束时(放射治疗2周后)的肿瘤内低氧区域、与相对于放射治疗前的肿瘤尺寸的放射治疗2周后的肿瘤尺寸(%)的相关图。
具体实施方式
本发明提供一种用于与放射治疗并用的抗癌剂,其含有牛蒡子苷元和/或牛蒡子苷作为有效成分。
在本说明书中,“放射治疗”是对癌细胞照射放射线而消灭癌细胞的治疗方法。在放射治疗中所使用的放射线只要是有助于抑制癌细胞的增殖或转移的抑制、癌细胞的杀伤、或者癌细胞的产生的抑制的放射线,则并无特别限定。放射线可以直接或间接地作用于癌细胞。在放射治疗中所使用的放射线并无限定,例如可以为x射线、γ射线及电子射线等。放射线的照射方法并无限定,例如可以为定位放射治疗及高精度放射治疗等。
本发明的抗癌剂通过与放射治疗并用,从而可以增强放射治疗的效果、增强抗肿瘤效果、减轻由放射治疗引起的副作用、以及进一步延伸生存率。
在本说明书中,将抗癌剂治疗和放射治疗“并用”是指在放射治疗之前、放射治疗的同时和/或放射治疗之后给与抗癌剂。只要使用抗癌剂治疗和放射治疗两者,则它们的给与顺序及给与形态并无限定。
由放射治疗引起的副作用是指不符合治疗的目的、或对生物体不良的作用,包括一般所认识的副作用。例如,由放射治疗引起的副作用包括:糜烂等皮肤炎症、粘膜炎症、脱毛、腹泻、食欲不振、全身倦怠感、疼痛、呼吸困难感、恶心、呕吐、发热、嗅觉缺失、器官损伤、间质性肺炎、器官衰竭及骨髄抑制等症状。另外,伴随这些身体的损伤而产生的不安、焦燥、兴趣丧失、情感迟钝、失眠、疏远感、恐惧、适应障碍、抑郁及精神错乱等精神的痛苦也包括在放射治疗的副作用中。本发明的抗癌剂尤其可以使糜烂等皮肤炎症减轻。
牛蒡子苷元及牛蒡子苷是牛蒡等植物中所含的二苯基丙酸类(日文:ジフェニルプロパノイド)(木酚素类)的1种。已知牛蒡子苷为牛蒡子苷元的前体,在生物体内被代谢而成为牛蒡子苷元。本发明的抗癌剂可以仅含有牛蒡子苷元或牛蒡子苷中的一者,也可以含有牛蒡子苷元及牛蒡子苷两者。
作为牛蒡子苷元和/或牛蒡子苷,可以使用化学上合成的牛蒡子苷元和/或牛蒡子苷,也可以使用从植物分离的牛蒡子苷元和/或牛蒡子苷。另外,作为牛蒡子苷元和/或牛蒡子苷,可以使用包含牛蒡子苷元和/或牛蒡子苷的植物本身或从植物提取的提取物。就包含牛蒡子苷元和/或牛蒡子苷的植物而言,包括例如:牛蒡(芽·叶·根茎·牛蒡子)、金连翘(花·叶·果实·根茎)、朝鲜连翘(花·叶·果实·根茎)、连翘(花·叶·果实·根茎)、金钟花(花·叶·果实·根茎)、红花、矢车菊、翼蓟、藏掖花(地中海蓟)、刺菜蓟、大翅蓟、onopordumillyricum、芝麻、五爪金龙、小花远志、朝鲜络石、络石、台湾络石、细梗络石、络石藤、亚洲络石(日文:ケテイカカズラ)、了哥王、红蓼、山樱、拟南芥、苋紫、胡桃、燕麦、斯卑尔脱小麦、软质小麦、墨西哥柏及日本榧。其中,牛蒡(尤其是牛蒡子及牛蒡芽)及连翘(尤其是叶)的牛蒡子苷元和/或牛蒡子苷的含量高,因此优选。
在使用从植物提取的提取物作为牛蒡子苷元和/或牛蒡子苷的情况下,提取物例如可以通过以下的方法由植物来制备。在本发明中所使用的提取物例如可以由包含牛蒡子苷元和/或牛蒡子苷的植物利用酶转化工序及基于有机溶剂的提取工序的2阶段来提取。
酶转化工序是利用植物固有的酶即β-葡糖苷酶将该植物中所含的牛蒡子苷进行酶转化为牛蒡子苷元的工序。具体而言,将植物干燥并且切栽后,保持于适当的温度,由此使其固有的β-葡糖苷酶发生作用,进行从牛蒡子苷向牛蒡子苷元的反应。例如,对切裁的植物添加水等任意的溶液,以30℃附近的温度(20~50℃)之间进行搅拌等,由此能够将植物保持为任意的温度。
基于有机溶剂的提取工序是使用任意适当的有机溶剂,由植物提取牛蒡子苷元及牛蒡子苷的工序。即,其是在利用上述的酶转化工序使牛蒡子苷元为高含量的状态下,添加适当的溶剂,由植物提取提取物的工序。例如,对植物添加适当的溶剂,加热搅拌适当的时间来提取提取物。另外,除加热搅拌以外,也可以使用加热回流、滴液式提取、滴注式提取或加压式提取法等本领域技术人员公知的任意的提取法来提取提取物。
由于牛蒡子苷元为水难溶性,因此通过添加有机溶剂,从而可以提高牛蒡子苷元的收率。有机溶剂可以使用任意的有机溶剂。例如可以使用甲醇、乙醇及丙醇等醇、以及丙酮。若考虑到安全性的方面,则在本发明的抗癌剂所使用的提取物的制造方法中,优选使用30%量的乙醇作为有机溶剂。若从提取物蒸馏除去溶剂,则得到糊状的浓缩物,若将该浓缩物进一步干燥,则可以得到干燥物。
本发明的抗癌剂可以按照使牛蒡子苷元/牛蒡子苷的重量比达到0.7以上的方式来含有牛蒡子苷元及牛蒡子苷。牛蒡子苷元/牛蒡子苷的重量比并无特别限定,可以为1.3以下。本发明的抗癌剂可以含有以牛蒡子苷元/牛蒡子苷=0.7~1.3的重量比含有牛蒡子苷元及牛蒡子苷的植物的提取物、例如牛蒡子提取物。另外,本发明的抗癌剂可以包含含有3%以上牛蒡子苷元的牛蒡子提取物。这样的牛蒡子提取物可以利用后述的牛蒡子提取物的制造方法来得到。本发明的抗癌剂含有利用后述的牛蒡子提取物的制造方法得到的牛蒡子提取物,由此可以提供比含有以往的牛蒡子提取物的情况更高的抗癌效果。
本发明的抗癌剂可以为任意形态的制剂。关于本发明的抗癌剂,作为口服给药制剂,可以为例如:糖衣片、颊含片、包衣片及咀嚼片等的片剂;糖锭剂;丸剂;散剂;包含硬胶囊剂及软胶囊剂的胶囊剂;颗粒剂;以及混悬剂、乳剂、糖浆剂及酏剂等液剂等。
另外,本发明的抗癌剂可以为静脈注射、皮下注射、腹腔内注射、肌肉内注射、经皮给药、经鼻给药、经肺给药、经肠给药、口腔内给药及经粘膜给药等非口服给药制剂。本发明的抗癌剂可以为例如注射剂、经皮吸收贴剂、气雾剂及栓剂等。
另外,本发明的抗癌剂可以为适合于食用的形态,可以为例如固体形状、液状、颗粒状、粒状、粉末状、胶囊状、膏状及糊状等。
本发明的抗癌剂可以还含有药品、准药品及食品中通常所使用的任意成分。例如,本发明的抗癌剂可以还含有药学上允许的基质、载体、赋形剂、粘合剂、崩解剂、润滑剂及着色剂等。
本发明的抗癌剂中使用的载体及赋形剂的例子包括:乳糖、葡萄糖、白糖、甘露醇、糊精、马铃薯淀粉、玉米淀粉、碳酸钙、磷酸钙、硫酸钙及结晶纤维素等。
粘合剂的例子包括:淀粉、明胶、糖浆、黄蓍胶、聚乙烯醇、聚乙烯基醚、聚乙烯基吡咯烷酮、羟丙基纤维素、甲基纤维素、乙基纤维素及羧甲基纤维素等。
崩解剂的例子包括:淀粉、琼脂、明胶粉、结晶纤维素、碳酸钙、碳酸氢钠、海藻酸钠、羧甲基纤维素钠及羧甲基纤维素钙等。
润滑剂的例子包括硬脂酸镁、氢化植物油、滑石及聚乙二醇等。着色剂可以使用允许在药品、准药品及食品中添加的任意的着色剂。
另外,本发明的抗癌剂可以根据需要用白糖、明胶、纯化虫胶、明胶、甘油、山梨糖醇、乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯基吡咯烷酮、邻苯二甲酸纤维素乙酸酯、羟丙基甲基纤维素邻苯二甲酸酯、甲基丙烯酸甲酯及甲基丙烯酸聚合物等以一层以上的层来进行包覆。
另外,本发明的抗癌剂可以根据需要添加ph调节剂、缓冲剂、稳定化剂、保存剂、防腐剂、稀释剂、包衣剂、甜味剂、香料及助溶剂等。
本发明的抗癌剂中的牛蒡子苷元和/或牛蒡子苷的含量只要是能够发挥提高放射治疗效果的效果的量即可,可以根据所应用的对象、目的及给药方法(摄取方法)进行适当设定。例如,在使人口服摄取的情况下,优选的是:可以按照使每1天的摄取量达到10~2000mg的方式含有牛蒡子苷元和/或牛蒡子苷。
本发明的抗癌剂并无特别限定,可以每周给药1~7天。例如,本发明的抗癌剂可以连日给药或每周给药5或6次。另外,本发明的抗癌剂可以在放射治疗之前、放射治疗的同时和/或放射治疗之后来给药。
例如,本发明的抗癌剂可以在放射治疗之前给药至少1次,优选给药1周以上,更优选给药2周以上。本发明的抗癌剂通过在放射治疗之前进行给药,从而可以改善肿瘤的低氧状态、提高肿瘤的放射线敏感性、提高基于放射治疗的效果。另外,通过在放射治疗之前进行给药,从而可以抑制基于放射治疗的副作用。
另外,本发明的抗癌剂可以在放射治疗后给药至少1次,优选给药1周以上,更优选给药2周以上。本发明的抗癌剂通过在放射治疗后进行给药,从而可以提高基于放射治疗的效果。另外,通过在放射治疗后进行给药,从而可以治疗或改善基于放射线照射的放射损伤。
本发明还提供含有牛蒡子苷元和/或牛蒡子苷作为有效成分的、放射线敏化剂。在本说明书中,“放射线敏化剂”是指使基于放射治疗的效果增强的药剂。本发明的放射线敏化剂可以为例如用于提高肿瘤的放射线敏感性的放射线敏化剂。本发明的放射线敏化剂可以通过改善肿瘤内的低氧状态,从而提高肿瘤的放射线敏感性。本发明的放射线敏化剂可以与上述的抗癌剂同样地构成。
本发明还提供含有牛蒡子苷元和/或牛蒡子苷作为有效成分的、用于减轻基于放射治疗的副作用的副作用减轻剂。本发明的药剂可以减轻例如因放射治疗而产生的糜烂等皮肤炎症、粘膜炎症、脱毛、腹泻、食欲不振、全身倦怠感、疼痛、呼吸困难感、恶心、呕吐、发热、嗅觉缺失、器官损伤、间质性肺炎、器官衰竭及骨髄抑制等症状、以及伴随这些身体的损伤而产生的不安、焦燥、兴趣丧失、情感迟钝、失眠、疏远感、恐惧、适应障碍、抑郁及精神错乱等精神的痛苦。在本说明书中,就“减轻副作用”而言,只要结果会减轻副作用即可,例如不只是直接作用于上述的症状的原因而减轻这些症状,而且是指通过提高肿瘤的放射线敏感性而间接地减轻这些症状的情形。本发明的药剂可以与上述的抗癌剂同样地构成。
本发明还提供含有牛蒡子苷元和/或牛蒡子苷作为有效成分的、用于放射治疗的预处置剂。本发明的预处置剂为用于在放射治疗之前对患者进行给药的药剂。在本说明书中,“用于放射治疗的预处置剂”是指:为了提高放射治疗的效果、或减轻由放射治疗引起的副作用,而在放射治疗之前对患者进行给药的药剂。本发明的预处置剂可以与上述的抗癌剂同样地构成。
在胰腺癌等癌微环境中,血管欠缺,处于极重度的低氧及低营养环境下。在这样的环境中,因放射治疗而变化为活性氧的氧较少,因此放射治疗难以起效。本发明的预处置剂通过在放射治疗之前对癌患者进行给药,从而可以抑制肿瘤的氧消耗、使肿瘤内的血流上升、改善低氧状态。因此,本发明的预处置剂可以提高肿瘤的放射线敏感性、提高基于放射治疗的效果。另外,本发明的预处置剂可以抑制由放射治疗引起的副作用。
本发明的处置剂在放射治疗之前给药至少1次。本发明的处置剂可以在放射治疗之前连续地给药一定期间,优选给药1周以上,更优选给药2周以上。
本发明还提供含有牛蒡子苷元和/或牛蒡子苷作为有效成分的、用于增强放射治疗的效果的食品组合物。本发明的食品组合物可以与上述的抗癌剂同样地构成。
在本说明书中,“食品组合物”不仅包括一般的饮食品,而且还包括病人用食品、健康食品、功能性食品、特定保健用食品、营养辅助食品及补充剂等。一般的饮食品包括例如:各种饮料、各种食品、加工食品、液状食品(汤等)、调料、营养饮料及糕点类等。在本说明书中,“加工食品”是指对天然的食材(动物及植物等)实施加工和/或烹调而得的食品,包括例如:肉加工品、蔬菜加工品、果实加工品、冷冻食品、蒸煮食品、罐装食品、瓶装食品及速食食品等。本发明的食品组合物可以为附上增强放射治疗的效果的主旨的表达的食品。另外,本发明的食品组合物可以以封入袋及容器等的形态来提供。本发明中使用的袋及容器可以为在食品中通常所使用的任意的袋及容器。
本发明还提供包括对患者给药牛蒡子苷元和/或牛蒡子苷的工序的、使基于放射治疗的效果增强的方法。在本说明书中,“基于放射治疗的效果”包括例如肿瘤尺寸和/或肿瘤重量的减少等。牛蒡子苷元和/或牛蒡子苷可以以上述的抗癌剂及放射线敏化剂等形态对患者进行给药。适用本发明的方法的患者包括需要放射治疗的患者、例如癌症患者等。如果使用本发明的方法,则可以提高肿瘤的放射线敏感性。
本发明的方法中的给药工序可以在放射治疗之前进行。给药工序可以在放射治疗之前进行至少1次,也可以连续进行一定期间。给药工序可以在优选1周以上、更优选2周以上的期间内每天进行。本发明的方法可以还包括在给药工序之后对患者进行放射治疗的工序。
本发明还提供用于增强基于放射治疗的效果的、牛蒡子苷元和/或牛蒡子苷。本发明还提供牛蒡子苷元和/或牛蒡子苷在用于制造增强基于放射治疗的效果的放射线敏化剂时的用途。就本发明的牛蒡子苷元和/或牛蒡子苷的形态以及本发明的使用的形态而言,可以援用对于本发明的抗癌剂、放射线敏化剂及方法而上述的记载。
实施例
以下示出实施例,对本发明的实施方式进行更详细地说明,但是本发明并不受以下实施例的限定。
〔实施例1〕
利用以下的方法,制备含有牛蒡子苷元的牛蒡子提取物。
裁切牛蒡子(酶活性7.82u/g),使其全部通过9.5mm的筛,再使其通过0.85mm的筛,确认到75%残留。将该牛蒡子碎片80kg加入到保温于30~32℃的水560l中,搅拌30分钟后,加入乙醇253l,升温至85℃,再加热回流40分钟。将该液体离心分离,得到所得的提取液。将该操作重复2次,将所得的提取液合并,进行减压浓缩,对提取物固体成分添加糊精25%,进行喷雾干燥。牛蒡子苷元及牛蒡子苷含量分别为6.4%及7.2%,得到牛蒡子苷元/牛蒡子苷(重量比)=0.89的牛蒡子提取物粉末(含有糊精25%)。
〔试验例1〕
(试验方法)
对基于牛蒡子苷元治疗及放射治疗的抗肿瘤效果进行了评价。本试验例中使用的试验方法如图1所示。
将人胰腺癌细胞miapaca-2的1×106细胞移植于balb/cajc1-nu/nu小鼠(日本clea)的皮下。在移植第14天,将移植小鼠分成(a)未治疗组、(b)牛蒡子苷元治疗组、(c)放射治疗组及(d)牛蒡子苷元治疗和放射治疗的并用组的四组。对牛蒡子苷元治疗组及并用组进行2周的牛蒡子苷元治疗。牛蒡子苷元治疗通过将在饵料中配合有0.5%(w/w)的实施例1的牛蒡子提取物的饵料提供给小鼠来进行。若将小鼠的一天的饵料的摄取量设为3~5g来计算,则牛蒡子苷元的给药量为1.5~2.5mg/只/天。2周的牛蒡子苷元治疗后,在放射治疗组及并用组中使用x射线照射装置(faxitronx-ray(型号:cp160)),将设定条件设为160kv及6.3ma,在安装铜板的过滤器的条件下以使照射量达到20gy/次(fraction)的方式对肿瘤照射放射线。之后,对牛蒡子苷元给药组及并用组进行2周的牛蒡子苷元治疗。牛蒡子苷元治疗后,实施各组的肿瘤尺寸及肿瘤重量的测定。另外,回收肿瘤,实施病理学的解析。
(基于牛蒡子苷元治疗的效果)
在最初的牛蒡子苷元治疗2周后(放射治疗前),测定未治疗组及牛蒡子苷元治疗组的平均肿瘤尺寸。其结果如图2所示。如图2所示,牛蒡子苷元治疗组的平均肿瘤尺寸与未治疗组相比显著较小。因此显示利用牛蒡子苷元治疗,肿瘤尺寸显著地缩小。另外,使用ivis对牛蒡子苷元治疗后的肿瘤内低氧区域(光子计数/肿瘤体积(photoncounts/tumorvolume))进行评价的结果如图3所示。如图3所示,牛蒡子苷元治疗组的肿瘤内低氧区域与未治疗组相比显著较小。未治疗组及牛蒡子苷元治疗组的ivis成像结果如图4所示。根据这些结果,暗示利用牛蒡子苷元治疗,低氧区域显著地缩小。
(肿瘤尺寸变化)
图5为表示各治疗组的平均肿瘤尺寸的变化(mean±s.e.)的图表。图5的图表示出治疗开始前(分组前)、治疗开始2周后(最初的牛蒡子苷元治疗后)、放射治疗1周后及放射治疗2周后(第2次的牛蒡子苷元治疗后)的平均肿瘤尺寸。另外,图6为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤尺寸的箱线图,图7为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤重量(g)的箱线图。另外,图8及图9为表示治疗结束时(放射治疗2周后)的各治疗组的肿瘤的状态的图。
如图5~图9所示,治疗结束时(放射治疗2周后),与未治疗组(对照(control))相比,放射治疗组(放射(radiation))及并用组(并用(combination))的肿瘤尺寸及肿瘤重量显著变小,牛蒡子苷元治疗组(牛蒡子苷元(arctigenin))存在肿瘤尺寸变小的倾向。另外,明确的是:与单独进行放射治疗的情况相比,通过并用牛蒡子苷元治疗和放射治疗,从而使肿瘤显著变小。
〔试验例2〕
为了对牛蒡子提取物治疗和放射治疗的顺序是否影响抗肿瘤效果进行评价,在放射治疗的实施前或实施后进行2周的牛蒡子苷元治疗。本试验例中使用的试验方法如图10所示。
将人胰腺癌细胞miapaca-2的1×106细胞移植于balb/cajc1-nu/nu小鼠(日本clea)的皮下。在移植第14天,将移植小鼠分成(a)未治疗组、(b)牛蒡子苷元治疗组、(c)放射治疗组及(d)牛蒡子苷元治疗和放射治疗的并用组。(b)的牛蒡子苷元治疗组进一步分成在移植的14天后开始2周的牛蒡子苷元治疗的组、和在移植的4周后开始2周的牛蒡子苷元治疗的组。另外,(d)的并用组进一步分成在放射治疗的实施前进行2周牛蒡子苷元治疗的组、和在放射治疗的实施后进行2周牛蒡子苷元治疗的组。
牛蒡子苷元治疗通过将在饵料中配合有0.5%(w/w)的实施例1的牛蒡子提取物的饵料提供给小鼠来进行。若将小鼠的一天的饵料的摄取量设为3~5g来计算,则牛蒡子苷元的给药量为1.5~2.5mg/只/天。在放射治疗中,使用x射线照射装置(faxitronx-ray(型号:cp160)),将设定条件设为160kv及6.3ma,在安装铜板的过滤器的条件下以使照射量达到20gy/次(fraction)的方式对肿瘤照射放射线。在放射治疗后的2周的牛蒡子苷元治疗后,实施各组的肿瘤尺寸及肿瘤重量的测定。另外,回收肿瘤,实施病理学的解析。
(治疗结束时的各治疗组的肿瘤尺寸变化)
图11为表示各治疗组的平均肿瘤尺寸的变化的图表。图11的图表示出放射治疗开始时(细胞移植2周后)、放射治疗1周后及放射治疗2周后的各治疗组的平均肿瘤尺寸。如图11所示,与并用组中在放射治疗后进行牛蒡子苷元治疗的组(con-ag、rt(+))相比,在并用组中在放射治疗前实施牛蒡子苷元治疗的组(ag-con、rt(+))中,肿瘤显著地缩小。
图12为使用ivis评价的治疗结束时(放射治疗2周后)的肿瘤内低氧区域、与相对于放射治疗前的肿瘤尺寸的放射治疗2周后的肿瘤尺寸(%)的相关图。在图12中示出仅实施放射治疗的组(con-con、rt(+))、在放射治疗后进行牛蒡子苷元治疗的组(con-gbs、rt(+))及在放射治疗前实施牛蒡子苷元治疗的组(gbs-con、rt(+))的结果。如图12所示,明确的是:肿瘤内的低氧区域越低,基于放射治疗的肿瘤尺寸的缩小效果越高。
由这些结果显示:通过在放射治疗前实施牛蒡子苷元治疗,从而改善肿瘤内的低氧状态,变化为容易发挥放射治疗的效果的环境。
产业上的可利用性
本发明可以提高放射治疗的效果,因此能够适合作为与放射治疗并用的抗癌剂、放射线敏化剂及食品组合物进行利用。
- 还没有人留言评论。精彩留言会获得点赞!