c-Met抑制剂用于治疗带有MET突变的癌症的用途的制作方法
本说明书涉及c-met受体酪氨酸激酶(“c-met”)抑制剂及其在治疗以某些met突变为特征的癌症(例如包含表达met蛋白质的细胞的癌症,该met蛋白质具有metv1092i、meth1094l或metl1195f突变)中的用途。本说明书进一步涉及met突变状态来选择适合用c-met抑制剂治疗的患者的用途,以及涉及用c-met抑制剂治疗以某些met突变为特征的癌症的方法。
背景技术:
met蛋白质也称为c-met受体酪氨酸激酶,是胚胎发育和伤口愈合所必需的跨膜受体。met受体通常通过与其特异性配体(肝细胞生长因子(hgf))的相互作用而活化,并且是hgf的唯一的高亲和力细胞表面受体(bottaro等人,1991)。met受体在许多类型的人类恶性肿瘤(包括肾癌、肝癌、胃癌、肺癌、乳腺癌和脑癌)中脱调节(deregulate)。肿瘤中hgf/c-met轴的异常活化触发肿瘤生长、促进肿瘤血管生成、并诱导肿瘤转移。此外,met活化异常与耐药性相关,并且与预后不良有关。最近,抑制c-met信号传导通路已经成为搜寻由c-met活化而驱动的癌症的潜在新疗法的感兴趣区域。
已经在患有遗传性乳头状肾细胞癌(prcc)的患者中和在偶发性prcc中检测到met基因座7q31的种系突变(salvi等人,2008,schmidt等人,1997,schmidt等人,1999)。通常认为i型肿瘤通常与met突变相关,无论是偶发性met突变还是遗传性met突变。尽管在群组分析中,met突变与i型prcc相关,但也报道了在prcc的非i型组织学亚型中的met突变(albiges等人,2014,linehan等人,2016)。已经报道了偶发性prcc中的met体细胞突变,而仅i型prcc病例的分析显示了21.6%met激酶结构域突变频率(11/51)(albiges等人,2014),并且来自癌症基因组图谱(tcga)的报告显示13/75(17.3%)i型prcc和1/26(3.8%)未分类prcc在met激酶结构域中带有体细胞突变(linehan等人,2015)。所有报道的met突变都是错义突变,并且没有发现无义或丧失的功能突变。此外,tcga已经报道了met突变是prcc中最常突变的基因(17/157(10.8%))。
目前尚无专门用于治疗prcc的经批准的疗法,并且因此用与治疗透明细胞(也称为常规)rcc患者(rcc=肾细胞癌)相似的方式来治疗患有prcc的患者。患有早期rcc的患者的首要治疗涉及根治性手术切除,这可治愈超过40%至60%的患者,尽管许多患有局部性疾病的患者会复发(linehan等人,2001)。大约25%的患者在诊断时会出现局部晚期疾病或转移性疾病。患有远端转移的患者的预后差,其中在患有阶段iv疾病的患者的5年生存率为10%。经批准的透明细胞rcc的药剂靶向vegf途径,并且包括舒尼替尼(sunitinib)、索拉非尼(sorafenib)、贝伐珠单抗(bevacizumab)、帕唑帕尼(pazopanib)和阿西替尼(axitinib)。经批准的靶向mtor途径的药剂包括坦罗莫司(temsirolimus)和依维莫司(everolimus)。在任何vegf或mtor途径抑制剂的情况下,prcc患者的最佳响应率为11%orr。
沃利替尼(savolitinib)是一种有效和选择性的小分子c-met激酶抑制剂(jiah.等人,j.med.chem.[药物化学杂志],2014;7577)。发现沃利替尼在酶和细胞水平上抑制c-met激酶,其中对于细胞中的酶和met磷酸化两者,ic50为4nm。与其有效的酶和细胞活性一致,发现在met基因扩增下,在不存在hgf刺激的情况下,沃利替尼在体外针对肿瘤抑制细胞生长,其中ic50通常低于10nm。在小鼠的人类异种移植模型中,在ed50低于5mg/kg的情况下,遵循每日口服治疗,沃利替尼证明了对met基因扩增胃肿瘤和肺肿瘤的优异的抗肿瘤活性。
met尚未成为临床验证的靶标。然而,偶然地靶向met的非选择性抑制剂已被批准用于治疗。这些包括批准用于治疗甲状腺髓样癌(由于其ret活性)和透明细胞rcc(由于其vegfr2活性)的卡博替尼(ret、flt3、kit、met、vegfr2);和批准用于治疗alk融合的非小细胞肺癌的克唑替尼(alk、met)。虽然这些药物具有met激酶抑制活性,但患有met引起的疾病的患者尚未接受靶向的治疗。使用沃利替尼(一种有效和选择性的met抑制剂)可以提供为具有met基因扩增、met突变和其他仍有待验证的met途径生物标志物的患者提供抗肿瘤益处所需要的临床验证。
本说明书涉及某些met突变的表征,这些突变可用作c-met疗法的生物标志物,包括metl1195f、metv1092i和meth1094l突变。以前报道了在乳头状肾癌患者中的metl1195f突变(schmidt等人,naturegenetics[自然-遗传学]1997,albiges等人,ccr2014),但之前尚未进行功能调查。本说明书中报道的数据是首次表明该metl1195f突变体是可起作用的。当metl1195f过量表达时,metl1195f被磷酸化,证明其活化met途径(包括erk1/2活化)的倾向。metl1195f突变体被证明对沃利替尼抑制敏感,并且可以在稳定的细胞系中赋予与在m1250t临床前功能表征的met突变相似的程度的生长优势(bardelli等人,pnas[美国科学院院报]1998)。
本说明书还提供metl1195f突变体可起作用的临床验证,显示在不存在任何其他met改变的情况下,带有metl1195f突变的prcc患者从沃利替尼的单一疗法中获益。综合来看,metl1195f的临床前功能表征和临床信号提供了对该激酶结构域突变分类为被报道的在试验台上进行功能性了解并证明临床抗肿瘤验证的首个激酶结构域突变的基础。值得注意的是,在ii型组织学亚型的prcc患者的背景文中发现了metl1195f突变体,其进一步提供了prcc的分子分类的案例,而不是与met基因突变的经典i型相关。
尽管met抑制剂被认为是在met基因拷贝数扩增设置中理想地开发(garber,naturereviewsdrugdiscovery[自然综述:药物发现]2014),但本说明书提供了另外使用met突变体作为可起作用的生物标志物的证据。可以看出,本说明书证明某些met突变(包括metl1195f、metv1092i和meth1094l)可作为c-met抑制的生物标志物起作用。因此,癌细胞met突变状态可用于鉴定对于用c-met抑制剂(例如沃利替尼或其药学上可接受的盐)治疗更可能起反应的癌症患者(例如乳头状肾细胞癌患者)。对于所有可能的met突变,这不是真的:metl1195f、metv1092i和meth1094l是对于c-met疗法可起作用的生物标志物的发现特别令人惊讶,假定当在此所述的相同的体外试验中检查时,包含mety1230h突变(以前在乳头状肾细胞癌患者中报道的并且预测被活化的另一种c-met激酶结构域突变)的细胞对用c-met抑制剂治疗不敏感。
技术实现要素:
本说明书部分地描述了一种用于治疗癌症的c-met抑制剂,其中该癌症以met1092、met1094或met1195突变为特征。
本说明书还部分描述了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗。
本说明书还部分地描述了c-met抑制剂在制备用于治疗癌症的药物中的用途,其中该癌症以met1092、met1094或met1195突变为特征。
本说明还部分描述了用于治疗癌症的方法,该方法包括向需要此治疗的患者给予治疗有效量的c-met抑制剂,其中所述癌症以met1092、met1094或met1195突变为特征。
本说明书还部分描述了一种用于治疗需要这种治疗的患者的癌症的方法,该方法包括以下步骤:a)请求测试,该测试结果可以确定该患者癌症是否以met1092、met1094或met1195突变为特征;并且b)如果发现该患者癌症以met1092、met1094或met1195突变为特征,则向该患者给予治疗有效量的c-met抑制剂。
附图说明
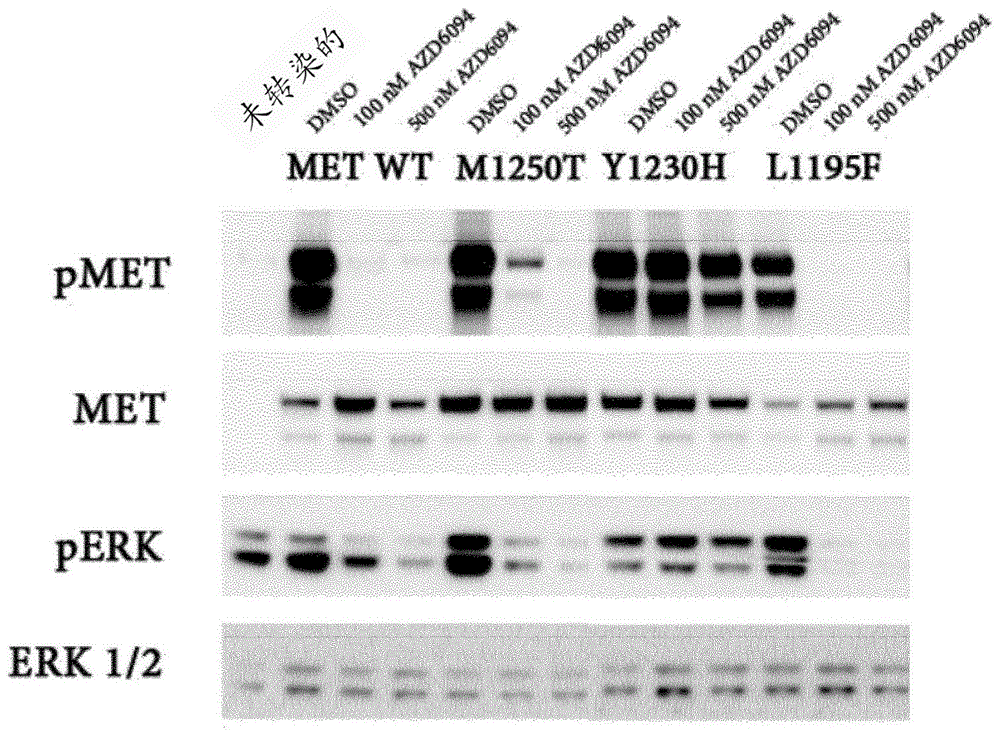
图1:met受体酪氨酸激酶的磷酸化和点突变对于用沃利替尼进行的c-met抑制的敏感性的影响
图2:met野生型(wt)对沃利替尼和其他c-met抑制剂的剂量响应
图3:metm1250t点突变体对沃利替尼和其他c-met抑制剂的剂量响应
图4:metv1092i点突变体对沃利替尼和其他c-met抑制剂的剂量响应
图5:meth1094l点突变体对沃利替尼和其他c-met抑制剂的剂量响应
图6:metl1195f点突变体对沃利替尼和其他c-met抑制剂的剂量响应
图7:mety1230h点突变体对沃利替尼和其他c-met抑制剂的剂量响应
图8:met突变克隆在met突变细胞系中的稳定表达
图9:亲本ba/f3稳定细胞系的转化能力
图10:metwt稳定细胞系的转化能力
图11:mety1230h点突变稳定细胞系的转化能力
图12:metm1250t点突变稳定细胞系的转化能力
图13:metv1092i点突变稳定细胞系的转化能力
图14:meth1094l点突变稳定细胞系的转化能力
图15:metl1195f点突变稳定细胞系的转化能力
图16:metl1195f突变乳头状肾细胞癌患者肿瘤响应
说明性实施例
许多实施例在本说明书中详细描述,并且对于本领域有技术的读者而言将是明显的。这些实施例不被认为是限制性的。
在第一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以met1092、met1094或met1195突变为特征。
“c-met抑制剂”是降低c-met受体酪氨酸激酶活性的分子。c-met抑制剂包括小分子(无论是选择性小分子或是非选择性小分子)和生物分子(例如抗体(天然抗体和工程化抗体))两者。c-met抑制剂可以直接(例如通过直接与酶结合)或间接(例如通过结合肝细胞生长因子(c-met受体酪氨酸激酶的天然配体))抑制c-met受体酪氨酸激酶。
c-met抑制剂的实例包括:amg-208、amg-337、amg-458、pha-665752、su11274、nps-1034、sgx-523、bms-777607、tepotinib、bms-794833、nvp-bvu972、mk-2461、mgcd-265、golvatinib、jnj-38877605、bms-754807、pf-04217903、沃利替尼、克唑替尼、蒂万替尼(tivantinib)、卡博替尼、福瑞替尼(foretinib)、卡奈替尼(inc280)、奥纳妥珠单抗(onartuzumab)、非拉珠单抗(ficlatuzumab)或利妥木单抗(rilotumumab)。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是amg-208或其药学上可接受的盐、amg-458或其药学上可接受的盐、pha-665752或其药学上可接受的盐、su11274或其药学上可接受的盐、nps-1034或其药学上可接受的盐、sgx-523或其药学上可接受的盐、bms-777607或其药学上可接受的盐、tepotinib或其药学上可接受的盐、bms-794833或其药学上可接受的盐、nvp-bvu972或其药学上可接受的盐、mk-2461或其药学上可接受的盐、mgcd-265或其药学上可接受的盐、golvatinib或其药学上可接受的盐、jnj-38877605或其药学上可接受的盐、bms-754807或其药学上可接受的盐、pf-04217903或其药学上可接受的盐、沃利替尼或其药学上可接受的盐、克唑替尼或其药学上可接受的盐、蒂万替尼或其药学上可接受的盐、卡博替尼或其药学上可接受的盐、福瑞替尼或其药学上可接受的盐、卡奈替尼或其药学上可接受的盐、奥纳妥珠单抗、非拉珠单抗或利妥木单抗。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是沃利替尼或其药学上可接受的盐、克唑替尼或其药学上可接受的盐、蒂万替尼或其药学上可接受的盐、卡博替尼或其药学上可接受的盐、福瑞替尼或其药学上可接受的盐、卡奈替尼或其药学上可接受的盐、奥纳妥珠单抗、非拉珠单抗或利妥木单抗。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是沃利替尼或其药学上可接受的盐、克唑替尼或其药学上可接受的盐、蒂万替尼或其药学上可接受的盐、卡博替尼或其药学上可接受的盐、福瑞替尼或其药学上可接受的盐,或卡奈替尼或其药学上可接受的盐。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是沃利替尼或其药学上可接受的盐、克唑替尼或其药学上可接受的盐或卡奈替尼或其药学上可接受的盐。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是卡奈替尼或其药学上可接受的盐。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是克唑替尼或其药学上可接受的盐。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是沃利替尼或其药学上可接受的盐。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以是奥纳妥珠单抗、非拉珠单抗或利妥木单抗。
“沃利替尼”描述于wo2011079804(作为第106页的化合物270),其内容通过引用结合在此。沃利替尼作为游离碱具有以下结构:
术语“药学上可接受的”通常用于指定一个对象(例如盐或赋形剂)是适合在患者中使用的。药学上可接受的盐的实例列表可以发现于:handbookofpharmaceuticalsalts:properties,selectionanduse,2ndrevisededition[药用盐手册:特性、选择和使用,第二修订版本];编辑p.h.stahl和c.g.wermuth;wiley2011;isbn:978-3-90639-051-2;其内容通过引用结合在此。
在提及药学上可接受的盐的任何实施例中,该药学上可接受的盐可以是发现于以下中的任何这样的盐:handbookofpharmaceuticalsalts:properties,selectionanduse,2ndrevisededition[药用盐手册:特性、选择和使用,第二修订版本];编辑p.h.stahl和c.g.wermuth;wiley2011;isbn:978-3-90639-051-2。
c-met抑制剂可以借助不对称碳原子而以光学活性形式或外消旋形式存在。例如,沃利替尼和其药学上可接受的盐具有这样的不对称碳原子。光学活性形式的合成可以通过本领域中熟知的有机化学标准技术进行,例如通过使用光学活性物质合成或通过拆分外消旋形式。
在提及c-met抑制剂的任何实施例中,c-met抑制剂可以包含药物组合物,其中单一光学异构体以≥95%、≥98%或≥99%的对映异构体或非对映异构体过量(%ee)存在。
在提及c-met抑制剂的任何实施例中,c-met抑制剂可以包含药物组合物,其中单一光学异构体以≥99%的对映异构体或非对映异构体过量(%ee)存在。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,沃利替尼或其药学上可接受的盐可以是处于≥95%、≥98%或≥99%的对映异构体过量(%ee)的(s)-光学异构体。在提及沃利替尼或其药学上可接受的盐的(s)-异构体的任何实施例中,该(s)-光学异构体可以以≥99%的对映异构体过量(%ee)存在。
c-met抑制剂可以作为药物组合物给予,该药物组合物包含一种或多种药学上可接受的赋形剂。针对包含于具体组合物中而选择的一种或多种赋形剂将取决于如以下因素,如给予方式和提供的组合物的形式。合适的药学上可接受的赋形剂是本领域技术人员所熟知的,并且描述于:例如handbookofpharmaceuticalexcipients,6thedition[药物赋形剂手册,第6版];编辑r.c.rowe、p.j.sheskey和m.quinn;pharmaceuticalpress[医药出版社];其内容通过引用结合在此。药学上可接受的赋形剂可以用作例如,佐剂、稀释剂、载体、稳定剂、调味剂、着色剂、填料、粘合剂、崩解剂、润滑剂、助流剂、增稠剂以及包衣剂。某些药学上可接受的赋形剂可用于多于一种功能,并且可用于可替代性作用,这取决于组合物中存在多少赋形剂并且该组合物中存在哪些其他赋形剂。
包含c-met抑制剂的药物组合物可以处于适于口服使用的形式(例如作为片剂、锭剂、硬或软胶囊,水性或油性悬浮液、乳液、可分散的粉剂或颗粒剂、糖浆或酏剂),适用于局部使用的形式(例如作为乳膏、软膏、凝胶、或水性或油性溶液或悬浮液),适用于通过吸入给予的形式(例如作为精细分散粉末或液体气雾剂),适用于通过吹入给予的形式(例如作为精细分散粉末)或适用于肠胃外给予的形式(例如作为无菌水性或油性溶液,用于静脉内、皮下、肌肉或肌内给药),或作为栓剂用于直肠给药。这些组合物可以通过本领域熟知的常规程序来获得。旨在用于口服使用的组合物可含有另外的组分,例如,一种或多种着色剂、甜味剂、调味剂和/或防腐剂。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以口服给予。
在提及c-met抑制剂的任何实施例中,该c-met抑制剂可以作为片剂或胶囊口服给予。
c-met抑制剂可以是以单位剂型给予,以达到治疗有效剂量。单位剂型如片剂或胶囊通常含有例如0.1-5000mg的c-met抑制剂。总体剂量和剂量方案将必然取决于所治疗的宿主、具体的给予途径、共给予的任何疗法、以及正在治疗的疾病的严重性而变化。因此,治疗任何具体患者的执业医生可以参考任何与c-met抑制剂相关的管制标签来确定最佳剂量。
在提及c-met抑制剂或其药学上可接受的盐的任何实施例中,该c-met抑制剂或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含在0.1mg-1mg、1-10mg、10-50mg、50-100mg、100-500mg、或500mg至5000mg之间的c-met抑制剂或其药学上可接受的盐。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,该沃利替尼或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含在0.1-1mg、1-10mg、10-50mg、50-100mg、100-500mg、或500mg至5000mg之间的沃利替尼或其药学上可接受的盐。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,该沃利替尼或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含100-1000mg处于游离碱形式的沃利替尼。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,该沃利替尼或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含500-1000mg处于游离碱形式的沃利替尼。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,该沃利替尼或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含600mg处于游离碱形式的沃利替尼。
在提及沃利替尼或其药学上可接受的盐的任何实施例中,该沃利替尼或其药学上可接受的盐可以在药物组合物中进行给予,该药物组合物包含600mg处于游离碱形式的沃利替尼,每日给药一次。
“以met1092、met1094或met1195突变为特征的癌症”包含一些细胞,这些细胞表达包含met1092、met1094或met1195突变的met蛋白质。
“包含met1092、met1094或met1195突变的met蛋白质”是与野生型met相差在一个或多个指定氨基酸位置处发生的突变或变化(例如取代或缺失)的met蛋白质。
野生型met蛋白质的序列描述于在此提供的refseq:ncbi参考序列数据库(refseq登录nm_00245)(seqidno:1)。该序列用作参考序列以描述本说明书中描述的蛋白质突变。例如,提及以met1092、met1094或met1195突变为特征的癌症描述了一种癌症,该癌症包含表达met蛋白质的细胞,该met蛋白质在此所列举的序列的位置1092、1094或1195中的一个或多个处包含至少一个突变或变化。
在具有18个另外的氨基酸的met的长同种型中的met突变导致相同的生物学后果,即对c-met抑制剂敏感。
当提及以met1092、met1094或met1195突变为特征的癌症时,应当理解,该癌症也可以以其他突变(包括与met无关的那些)为特征。类似地,包含met1092、met1094或met1195突变的met蛋白质也可能在其他氨基酸位置处具有其他突变。
还应当理解的是,以met1092、met1094或met1195突变为特征的癌症可以以一个或多个指定突变(例如met1092和met1094突变,met1092和met1195突变,met1094和met1195突变,或met1092、met1094和met1195突变)为特征。类似的,包含met1092、met1094或met1195突变的met蛋白质可以包含这些指定突变中的一个或多个。
在提及以met1092、met1094或met1195突变为特征的癌症的任何实施例中,该癌症可以以met1092和met1094突变为特征。
在提及以met1092、met1094或met1195突变为特征的癌症的任何实施例中,该癌症可以以met1092和met1195突变为特征。
在提及以met1092、met1094或met1195突变为特征的癌症的任何实施例中,该癌症可以以met1094和met1195突变为特征。
在提及以met1092、met1094或met1195突变为特征的癌症的任何实施例中,该癌症可以以met1092、met1094和met1195突变为特征。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该突变可以是氨基酸取代。
“氨基酸取代”可以包括在框内的插入缺失。“在框内的插入缺失”是在阅读框内的氨基酸的插入和/或缺失,并因此导致在给定位置处的额外的氨基酸或丢失的氨基酸。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该突变可以是插入缺失。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该突变可以是在框内的插入缺失。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该突变可以是体细胞突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是种系突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是metv1092突变。当野生型蛋白质的位置1092处的缬氨酸氨基酸改变时,发生metv1092突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是metv1092i突变。当野生型蛋白质的位置1092处的缬氨酸氨基酸被异亮氨酸氨基酸取代时,发生metv1092i突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是meth1094突变。当野生型蛋白质的位置1094处的组氨酸氨基酸改变时,发生metv1094突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是meth1094l突变。当野生型蛋白质的位置1094处的组氨酸氨基酸被亮氨酸氨基酸取代时,发生meth1094l突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是metl1195突变。当野生型蛋白质的位置1195处的亮氨酸氨基酸改变时,发生metv1095突变。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,该met突变可以是metl1195f突变。当野生型蛋白质的位置1195处的亮氨酸氨基酸被苯丙氨酸氨基酸取代时,发生metl1195f突变。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以metv1092i、meth1094l或metl1195f突变为特征。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以v1092i突变为特征。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以meth1094l突变为特征。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以metl1195f突变为特征。
如已经提到的,以met1092、met1094或met1195突变为特征的癌细胞表达met蛋白质,该met蛋白质包含至少一个所述的变化。因此,相关的癌细胞在编码相关突变蛋白质的核酸序列中携带相应的突变。这样的突变核酸也可以用作c-met抑制的生物标志物,并且因此也形成说明书的实施例。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以met_c.3583c>t突变为特征。
当编码野生型met蛋白质的核酸序列的位置3583处的胞嘧啶核苷酸被胸腺嘧啶核苷酸取代时,发生“met_c.3583c>t突变”。met_c.3583c>t突变编码包含metl1195f突变的met蛋白质。
编码野生型met蛋白质的核酸序列描述于在此提供的refseq:ncbi参考序列数据库(refseq登录nm_00245)(seqidno:2)。所提供的refseq包括非编码序列(“非翻译区”或“utr”),包括在编码序列开始之前长度为202个核苷酸的utr序列。
当描述本说明书中讨论的遗传突变时,使用refseq:ncbi参考序列数据库(refseq登录nm_00245)作为参考序列。例如,提及具有met_c.3583c>t突变的核酸描述了一种核酸,其中在此所述序列的位置3785处的胞嘧啶核苷酸已被胸腺嘧啶核苷酸替代。
“癌症”是指在患者体内导致肿瘤或生长的细胞的不受控制的生长。可以互换使用“癌症”和“肿瘤”来描述癌症患者体内存在的物理生长。“癌症”包括非转移性癌症和转移性癌症两者,使得治疗癌症涉包括治疗原发性肿瘤和还有局部或远端转移两者。
癌症肿瘤本质上是异质性的,并且癌症患者体内的每个肿瘤可能含有分离的细胞群体,这些细胞群体由于不同原因而以不受控制的方式增殖。例如,给定的肿瘤可以含有不同的细胞群体,它们的生长由其细胞机器中的不同畸变(例如不同的dna突变)驱动。因此,当提及一种细胞以met1092、met1094或met1195突变为特征并且因此包含表达met蛋白质(包含met1092、met1094或met1195突变)的细胞时,不是所有的癌细胞都可以表达这种突变met蛋白质。
在提及癌症的任何实施例中,该癌症可以是肺癌(例如小细胞肺癌或非小细胞肺癌)、胃癌、脑癌(例如恶性胶质瘤)、结肠直肠癌、乳腺癌(例如三阴性乳腺癌)或肾癌(例如肾透明细胞癌或乳头状肾细胞癌)。
在提及癌症的任何实施例中,该癌症可以是肾癌(例如肾透明细胞癌或乳头状肾细胞癌)。
在提及癌症的任何实施例中,该癌症可以是乳头状肾细胞癌。
在提及乳头状肾细胞癌的任何实施例中,该乳头状肾细胞癌可以i型乳头状肾细胞癌。
“i型乳头状肾细胞癌”是一种以具有透明至嗜碱性细胞质的小细胞的内衬为特征的组织学亚型。
在提及乳头状肾细胞癌的任何实施例中,该乳头状肾细胞癌可以ii型乳头状肾细胞癌。
“ii型乳头状肾细胞癌”是一种以具有丰富的嗜酸性细胞质的大细胞的内衬为特征的组织学亚型。
技术人员能够使用上述和其他组织学标准来区分乳头状肾细胞癌的组织学亚型。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以met1092、met1094或met1195突变为特征,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含500-1000mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以met1092、met1094或met1195突变为特征,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以metv1092i、meth1094l或metl1195f突变为特征,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症是以metv1092i、meth1094l或metl1195f突变为特征的乳头状肾细胞癌。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症是以metv1092i、meth1094l或metl1195f突变为特征的乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症是以metv1092i、meth1094l或metl1195f突变为特征的乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症是以metv1092i、meth1094l或metl1195f突变为特征的ii型乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了用于治疗以metv1092i、meth1094l或metl1195f突变为特征的ii型乳头状肾细胞癌的沃利替尼,其中该沃利替尼在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括获得患者癌症的代表性样品,对该样品进行体外分析,以确定该患者癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗。
在一个实施例中,提供了确定癌症患者是否可能从用c-met抑制剂治疗中获益的方法,该方法包括体外测试患者癌症的代表性样品是否存在met1092、met1094或met1195突变,以确定该患者癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症以met1092、met1094或met1195突变为特征,则患者更有可能从用c-met抑制剂的治疗中获益。
在一个实施例中,提供了一种用于选择对于癌症患者来说合适的治疗方案的方法,该方法包括以下步骤:
a)通过在患者癌症的代表性样品中进行分析来确定患者癌细胞中是否存在met1092、met1094或met1195突变;并且
b)如果在患者的癌细胞中存在metl1195f突变,则选择包括给予c-met抑制剂的治疗方案。
在一个实施例中,提供了一种用于选择对于癌症患者来说合适的治疗方案的方法,该方法包括以下步骤:
a)获得患者癌症的代表性样品;
b)通过分析样品来确定患者癌细胞中是否存在met1092、met1094或met1195突变;并且
b)如果在患者的癌细胞中存在met1092、met1094或met1195突变,则选择包括给予c-met抑制剂的治疗方案。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗,其中该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在药物组合物中进行给予,该药物组合物包含500-1000mg处于游离碱形式的沃利替尼,每日给药一次。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗,其中该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在药物组合物中进行给予,该药物组合物包含600mg处于游离碱形式的沃利替尼,每日给药一次。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f为特征,则该患者适合用c-met抑制剂进行治疗,其中该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在药物组合物中进行给予,该药物组合物包含600mg处于游离碱形式的沃利替尼,每日给药一次。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f为特征,则该患者适合用c-met抑制剂进行治疗,其中该癌症是乳头状肾细胞癌。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f为特征,则该患者适合用c-met抑制剂进行治疗,其中该癌症是乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f为特征,则该患者适合用c-met抑制剂进行治疗,其中该癌症是乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f为特征,则该患者适合用c-met抑制剂进行治疗,其中该癌症是ii型乳头状肾细胞癌,该c-met抑制剂在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在一个实施例中,提供了筛选乳头状肾细胞癌患者以确立对用沃利替尼或其药学上可接受的盐进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该患者癌症是否以metv1092i、meth1094l或metl1195f突变为特征,其中如果发现患者癌症是以metv1092i、meth1094l或metl1195f突变为特征,则该患者适合用沃利替尼或其药学上可接受的盐进行治疗。
在一个实施例中,提供了c-met抑制剂在制备用于治疗癌症的药物中的用途,其中该癌症以met1092、met1094或met1195突变为特征。
在一个实施例中,提供了一种治疗患者的癌症的方法,其中该癌症以met1092、met1094或met1195突变为特征,该方法包括向所述患者给予治疗有效量的c-met抑制剂。
在一个实施例中,提供了一种用于治疗需要这种治疗的患者的癌症的方法,该方法包括以下步骤:
a)确定患者癌症是否以met1092、met1094或met1195突变为特征;并且
b)如果发现该患者癌症以met1092、met1094或met1195突变为特征,则向该患者给予治疗有效量的c-met抑制剂。
在一个实施例中,提供了一种用于治疗需要这种治疗的患者的癌症的方法,该方法包括以下步骤:
a)请求测试,该测试结果可以确定该患者癌症是否以met1092、met1094或met1195突变为特征;并且
b)如果发现该患者癌症以met1092、met1094或met1195突变为特征,则向该患者给予治疗有效量的c-met抑制剂。
在一个实施例中,提供了一种用于治疗需要这种治疗的患者的癌症的方法,该方法包括以下步骤:
a)请求测试,该测试结果可以确定该患者癌症是否以met1092、met1094或met1195突变为特征;并且
b)如果发现该患者癌症以met1092、met1094或met1195突变为特征,则向该患者开治疗有效量的c-met抑制剂。
在一个实施例中,提供了适合于确定met突变(例如met1092、met1094或met1195突变)的诊断试剂盒,该试剂盒包含适合于扩增met基因中的靶核酸的简并引物以及包含扩增方案和结果分析的可任选的说明书。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以包括包含扩增方案和结果分析的说明书。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以包含用于进行扩增产物的扩增和分析的缓冲液、酶和容器。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以包括一个或多个dna微阵列。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以包括一个或多个对照模板。合适的对照模板包括从正常组织样品分离的核酸以及代表参考基因中的不同变化的样品。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以包括两个或更多个引物对,每一对均能够扩增met基因的不同区域(每一区域具有可能变化位点),由此提供用于分析生物样品在一个反应或若干平行反应中的若干基因变化的存在的试剂盒。
合适的引物可以经标记(例如荧光标记)以促进检测扩增产物以及随后分析核酸的变化。该试剂盒可以允许在一个分析中检测一种以上变化。组合试剂盒将因此包含能够扩增参考基因的不同区段的引物。这些引物可以例如使用不同的荧光标记进行差示性标记,以便在这些变化之间进行区分。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒可以允许确定met的突变形式,其中该突变存在于基因中的任何位置。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒允许确定met1092、met1094或met1195突变。
在提及适用于确定met突变的诊断试剂盒的任何实施例中,该试剂盒允许确定metv1092i、meth1094l或metl1195f突变。
可以基于细胞的基因组dna分析、或通过分析由dna编码的dna转录物或蛋白质来确定癌症是否以某种突变为特征(例如,相对于野生型met蛋白质,该癌症是否包含表达met蛋白质的细胞,该met蛋白质包含在位置1092、1094或1195处的突变)。所希望的可以是通过转录物和/或蛋白质的平行分析来证实在癌细胞的基因组dna中给定的突变的存在,以确保突变确实在患者的癌细胞中表达。
本领域中存在大量熟知的分析程序,这些分析程序可用于检测基因中一个或多个位置处的突变,然后这些突变编码蛋白质(诸如met蛋白质)中的相应突变。通常,这种检测方法需要突变检测技术,任选的扩增方法(例如聚合酶链反应或“pcr”),任选的捕获方法或富集方法(例如下一代测序方法中的杂交捕获)和任选的信号产生系统。用于检测遗传突变的实例方法讨论于:nollau等人,clin.chem.[临床化学]1997,43,1114-1120;anderson,s.m;expertrev.mol.diagn.[分子诊断学专家评论]2011,11,635-642;meyersonm.等人,nat.rev.genet.[自然综述遗传学]2010,11,685-696;以及标准教科书中,例如laboratoryprotocolsformutationdetection,2ndedition[突变检测的实验室方案,第2版],由u.landegren编,oxforduniversitypress[牛津大学出版社]1996和pcr,由newton和graham编,biosscientificpublisherslimited[拜尔斯科学出版社有限公司]1997。本段中提及的所有参考文献的内容通过引用结合在此。
在需要确定癌症是否以met突变(例如met1092、met1094或met1195突变)为特征的任何实施例中,该确定可以包括突变检测技术。
在需要确定癌症是否以突变(例如met1092、met1094或met1195突变)为特征的任何实施例中,该确定可以包括突变检测技术和扩增方法。
在需要确定癌症是否以突变(例如met1092、met1094或met1195突变)为特征的任何实施例中,该确定可以包括突变检测技术和捕获方法或富集方法。
在需要确定癌症是否以突变(例如met1092、met1094或met1195突变)为特征的任何实施例中,该确定可以包括突变检测技术和信号产生系统。
在需要确定癌症是否以突变(例如met1092、met1094或met1195突变)为特征的任何实施例中,该确定可以包括突变检测技术、扩增方法、捕获方法或富集方法、和信号产生系统。
可以通过分析以各种方法从生物样品收集的dna或rna来进行“突变检测技术”,这些方法包括pcr、与等位基因特异性探针杂交、酶突变检测、错配的化学裂解、质谱或dna测序(包括微测序)。突变检测技术的实例包括扩增阻碍突变系统(armstm)、扩增阻碍突变系统线性延伸(alextm)、竞争性寡核苷酸引发系统(cops)、塔克曼(taqman)、分子信标(molecularbeacons)、限制性片段长度多态现象(rflp)、基于限制位点的pcr以及荧光共振能量转移(fret)技术、以及寡核苷酸连接测定(ola)。
与等位基因特异性探针杂交可以使用以下来进行:(1)溶液中结合到与标记样品接触的固相(例如玻璃、硅、尼龙膜)的等位基因特异性寡核苷酸,例如,如同在许多dna芯片应用中;或(2)溶液中的经结合样品(通常为经克隆dna或pcr扩增的dna)和经标记寡核苷酸(或者等位基因特异性或者短的以便允许通过杂交来测序)。诊断测试可以包括一组突变,通常在固体支撑物上,这使得能够同时确定一种以上突变。这些杂交探针在本领域中为熟知的(参见例如molecularcloning:alaboratorymanual,4thedition,volumes1-3[分子克隆实验指南,第4版,第1-3卷];编辑green和sambrook;coldspringharbor,n.y[冷泉港,纽约州]2012,isbn:9781936113422),并且可以跨越两个或更多个变化位点。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括将包含假定突变位点的met核酸与至少一个核酸探针接触。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括将包含潜在突变位点的met核酸与至少一个核酸探针接触,其中该探针与在选择性杂交条件下与包括突变位点且在该突变位点处包含互补核苷酸碱基的核酸序列杂交。
杂交可以使用本领域技术人员已知的标记来检测。这些标记包括放射性、荧光、染料以及酶标记。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括将包含潜在突变位点的met核酸与至少一个核酸引物接触。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括将包含潜在突变位点的met核酸与至少一个核酸引物接触,其中该引物优选与在选择性杂交条件下与包括突变位点且在该变化位点处包含互补核苷酸碱基的核酸序列杂交。
用作特异性扩增的引物的寡核苷酸可以携带与分子中间(因此扩增取决于差异性杂交(参见例如gibbs等人,nucl.acidsres.[核酸研究]1989,17,2437)或在一个引物的3'远端处的感兴趣的突变互补的核苷酸碱基,其中在恰当的条件下,可以防止错配或减少聚合酶延伸(参见例如prossner1993,tibtech[蒂布技术],11238)。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括测序测序至少一种核酸序列并将获得的序列与已知的野生型核酸序列进行比较。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括至少一种核酸序列的质谱确定。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括进行pcr。
基因组核酸中的突变还可以有利地通过基于扩增核酸片段中的活动位移的技术来检测。举例来说,chen等人,analbiochem[分析生物化学]1996,239,61,描述通过竞争性活动位移测定来检测单碱基突变。此外,基于marcelino等人,biotechniques[生物技术]1999,26,1134-1148的技术的测定是可商购的。
在提及突变检测技术的任何实施例中,该突变检测技术可以包括使用毛细管异源双链分析来检测基于双螺旋核酸在毛细管系统中由于错配存在的导致的活动位移的突变的存在。
可以使用“扩增方法”来产生更多量的、在突变检测技术期间检测到的核酸,使随后的分析步骤更为容易。大多数扩增方法依赖于酶链反应(如pcr、连接酶链反应或自持续序列复制)或来自已进行克隆的所有或一部分载体。
许多靶标和信号扩增方法已描述于文献中,例如这些方法的总体综述描述于:landegren,u等人,science[科学]1988,242,229-237和lewis,r.,geneticengineeringnews[基因工程新闻]1990,10,54-55。这些扩增方法可用于在此所述的方法,并且包括pcr、原位pcr、连接酶扩增方法(lar)、连接酶杂交、qβ噬菌体复制酶、基于转录的扩增系统(tas)、基因组扩增与转录物测序(gawts)、基于核酸序列的扩增(nasba)以及原位杂交。适用于不同扩增技术的引物可以根据本领域中已知的方法制备。
pcr为核酸扩增方法,尤其描述于美国专利号4,683,195和4,683,202中。pcr由dna聚合酶产生的引物延伸反应的重复周期组成。靶dna是热变性的且使两个寡核苷酸杂交,这两个寡核苷酸囊括待扩增的dna相对链上的靶序列。这些寡核苷酸变成引物用于dna聚合酶。通过引物延伸复制dna来制造两个链的第二拷贝。通过重复热变性、引物杂交以及延伸的周期,靶dna可以在约二到四小时内扩增一百万倍或更多。pcr为分子生物学工具,它必须与检测技术结合用于测定扩增结果。pcr的优点为它通过将靶dna的量在约4小时内扩增一百万到十亿倍来增加敏感性。pcr可以用于在诊断背景中扩增任何已知核酸(mok等人,gynaecologiconcology[妇科肿瘤学],1994,52:247-252)。
如扩增阻碍突变系统(armstm)的等位基因特异性扩增技术(newton等人,nucleicacidsres.[核酸研究],1989,17,2503-2516)也可以用于检测单碱基突变。在恰当的pcr扩增条件下,位于引物的3'末端的单碱基错配对完全匹配的等位基因的优先扩增来说已足够(newton等人,1989,前述),允许辨别密切相关的物质。使用上述引物的扩增系统的基础是具有错配3'-残基的寡核苷酸在恰当的条件下将不充当pcr引物。这一扩增系统允许在琼脂糖凝胶电泳之后仅通过检查反应混合物来进行基因分型。
在提及扩增方法的任何实施例中,该扩增方法可以包括pcr。
可以使用各种“信号产生系统”来分析扩增产物。信号产生系统可以使用能够根据它们的大小分离扩增产物的任何方法来进行,包括自动化和手动凝胶电泳、质谱等。
核酸分离、扩增以及分析方法对本领域技术人员来说为常规的并且方案的实例可以见于例如:molecularcloning:alaboratorymanual,4thedition,volumes1-3[分子克隆实验指南,第四版,第1-3卷];编辑green和sambrook;coldspringharbor,n.y[冷泉港、,纽约州]2012,isbn:9781936113422)。pcr扩增中所用方法的尤其有用的方案来源是pcr(basics:frombackgroundtobench[基础:从背景到实验台]),m.j.mcpherson,s.g.mailer,r.beynon,c.howe,springerverlag[斯普林格出版社];第1版(2000年10月15日),isbn:0387916008。其内容通过引用结合在此。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,met突变的检测可以包括信号产生系统,该信号产生系统是凝胶电泳。
在提及met突变(例如met1092、met1094或met1195突变)的任何实施例中,met突变的检测可以包括信号产生系统,该信号产生系统是质谱。
可用于检测在此所述的蛋白质突变的方法包括:质谱或基于抗体的方法(被设计用于检测在指定位置处的氨基酸取代)。
“患者癌症的代表性样品”可以是从癌症患者获得或可获得的任何肿瘤组织或含肿瘤细胞的样品,包括含有肿瘤核酸的任何样品,如循环游离dna(ctdna)。患者癌症的样品可包括从患者获得的血液样品、口腔抹片、活检体或其他体液或组织。特定实例包括:存在于患者血浆或血清中的循环肿瘤细胞或循环肿瘤dna、从卵巢癌患者的腹水液分离的细胞、从患有肿瘤的患者肺内获得的肺痰、从乳腺癌患者获得的细针抽出物、尿液、外周血液、细胞刮片、毛囊、皮肤钻孔或面颊样品。
用于突变状态测试的患者癌症的代表性样品同样可以为对应于在患者癌症的代表性样品中的序列的核酸序列,换句话说,样品核酸中的所有或一部分区域可以在分析之前先使用任何便利技术(例如聚合酶链反应(pcr))扩增。核酸可以为基因组dna或者分级的或全细胞rna。在一些实施例中,rna为全细胞rna且直接用作使用随机引物或polya引物来标记一个第一链cdna的模板。可以根据标准方法从样品提取该患者癌症样品中的核酸或蛋白质,例如参考以下的那些:molecularcloning:alaboratorymanual,4thedition,volumes1-3[分子克隆实验指南,第四版,第1-3卷];编辑green和sambrook;coldspringharbor,n.y[冷泉港,纽约州]2012,isbn:9781936113422;其内容通过引用结合在此。
患者癌症的代表性样品可以是先前从患者身上获取的。这些样品可以通过冷冻或固定以及嵌埋于福尔马林-石蜡或其他介质中来保存。可替代地,可以获得且使用新鲜样品。
在提及患者癌症的代表性样品的任何实施例中,该患者癌症的代表性样品可以包括肿瘤细胞样品。
在提及患者癌症的代表性样品的任何实施例中,该患者癌症的代表性样品可以包含含有肿瘤核酸的样品。
在提及患者癌症的代表性样品的任何实施例中,该患者癌症的代表性样品可以包含含有肿瘤dna的样品。
在提及患者癌症的代表性样品的任何实施例中,该患者癌症的代表性样品可以包含含有肿瘤循环游离dna的样品。
在实施例[a]中,提供了一种用于治疗癌症的c-met抑制剂,其中该癌症以met1092、met1094或met1195突变为特征。
在实施例[b]中,提供了用于治疗癌症的c-met抑制剂(如实施例[a]中所述),其中该met1092、met1094或met1195突变是氨基酸取代。
在实施例[c]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]或实施例[b]中所述),其中该癌症以metv1092i、meth1094l或metl1195f突变为特征。
在实施例[d]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[c]中所述),其中该癌症以metv1092i突变为特征。
在实施例[e]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[c]中所述),其中该癌症以meth1094l突变为特征。
在实施例[f]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]中所述),其中该癌症以metl1195f突变为特征。
在实施例[g]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]至[f]中任一项所述),其中该癌症是肺癌、胃癌或乳头状肾细胞癌。
在实施例[h]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[g]中所述),其中该癌症是乳头状肾细胞癌。
在实施例[i]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[h]中所述),其中该癌症是ii型乳头状肾细胞癌。
在实施例[j]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]至[i]中任一项所述),其中该c-met抑制剂是沃利替尼或其药学上可接受的盐、克唑替尼或其药学上可接受的盐、蒂万替尼或其药学上可接受的盐、卡博替尼或其药学上可接受的盐、福瑞替尼或其药学上可接受的盐、卡奈替尼或其药学上可接受的盐、奥纳妥珠单抗、非拉珠单抗或利妥木单抗。
在实施例[k]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[j]中所述),其中该c-met抑制剂是沃利替尼或其药学上可接受的盐。
在实施例[l]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]至[k]中任一项所述),其中癌症的治疗包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗。
在实施例[m]中,提供了一种用于治疗癌症的c-met抑制剂(如实施例[a]中所述),其中该癌症是以metv1092i、meth1094l或metl1195f突变为特征的ii型乳头状肾细胞癌,并且该c-met抑制剂是沃利替尼或其药学上可接受的盐,该沃利替尼或其药学上可接受的盐在包含600mg处于游离碱形式的沃利替尼的药物组合物中进行给予,每日给药一次。
在实施例[n]中,提供了一种筛选癌症患者以确立用c-met抑制剂对其进行治疗的适宜性的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以met1092、met1094或met1195突变为特征,其中如果发现患者癌症是以met1092、met1094或met1195突变为特征,则该患者适合用c-met抑制剂进行治疗。
在实施例[o]中,提供了实施例[n]所述的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以metv1092i突变为特征,其中如果发现患者癌症是以metv1092i突变为特征,则该患者适合用c-met抑制剂进行治疗。
在实施例[p]中,提供了实施例[n]所述的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以meth1094l突变为特征,其中如果发现患者癌症是以meth1094l突变为特征,则该患者适合用c-met抑制剂进行治疗。
在实施例[q]中,提供了实施例[n]所述的方法,该方法包括对患者癌症的代表性样品进行体外分析,以确定该癌症是否以metl1195f突变为特征,其中如果发现患者癌症是以metl1195f突变为特征,则该患者适合用c-met抑制剂进行治疗。
在实施例[r]中,提供了实施例[n]至[q]中任一项所述的方法,其中该癌症是乳头状肾细胞癌。
在实施例[s]中,提供了实施例[n]至[r]中任一项所述的方法,其中该c-met抑制剂是沃利替尼或其药学上可接受的盐。
在实施例[t]中,提供了c-met抑制剂在制备用于治疗癌症的药物中的用途,其中该癌症以met1092、met1094或met1195突变为特征。
在实施例[u]中,提供了一种用于治疗需要这种治疗的患者的癌症的方法,该方法包括以下步骤:
a)请求测试,该测试结果可以确定该患者癌症是否以met1092、met1094或met1195突变为特征;并且
b)如果发现该患者癌症以met1092、met1094或met1195突变为特征,则向该患者给予治疗有效量的c-met抑制剂。
在实施例[v]中,提供了实施例[u]所述的方法,其中该癌症是乳头状肾细胞癌。
在实施例[w]中,提供了实施例[u]或实施例[v]所述的方法,其中该c-met抑制剂是沃利替尼或其药学上可接受的盐。
实例
以下测试支持在此所述的实施例:a)met受体酪氨酸激酶的磷酸化和点突变对于用沃利替尼进行met抑制的敏感性的影响b)确定metwt和met点突变体对沃利替尼和其他met抑制剂的剂量响应;c)metwt、met突变或亲本ba/f3稳定细胞系的转化能力;d)metl1195f突变prcc患者肿瘤响应。在测试的描述中,通常:
i.ic50值是抑制50%生物活性的测试化合物的浓度。
ii.所使用的缩写解释于正文或后续段落中,否则所使用的缩写是本领域技术人员熟知的。aptt=活化部分凝血激酶时间;bca=二辛可宁酸;edta=乙二胺四乙酸;ctcae=不良事件通用术语标准;dbp=舒张压;dor=响应期;dvt=深静脉血栓形成;ecog=东部肿瘤协作组;ecg=心电图;fbs=胎牛血清;h=小时;gfr=肾小球滤过率;hek=人胚肾细胞系;il-3=白介素-3;lds=加载染料溶液(loadingdyesolution);lmwh=低分子量肝素;ngs=下一代测序;nyha=纽约心脏协会;orr=总体响应率;os=总体存活;pd=进行性疾病;pbs=磷酸盐缓冲盐水;pfs=无进展存活期;pk=药代动力学;po=经口;qd=每日一次;rfp=红色荧光蛋白质;sc=皮下;sbp=收缩压;tbst=tris缓冲盐水-吐温20;uln=正常值的上限;wb=蛋白质印迹。
测试a):met受体酪氨酸激酶的磷酸化和点突变对于用沃利替尼进行met抑制的敏感性的影响
使用磷酸化metwb分析研究metwt的hek293t细胞的瞬时转染和具有氨基酸取代的特异性突变体的它们的活化met激酶的能力,并且用p-erk1/2wb分析研究下游通路活化。当瞬时过过量表达时,metwt和所有met突变体都被活化,如dmso处理条件和磷酸化met(y1234/y1235)的检测所证明的。新颖met突变体l1195f可以活化met和erk1/2,并且对于沃利替尼抑制敏感(与metwt类似的程度)。新颖met突变体v1092i和h1094l也被过量表达活化并导致下游erk通路活化。相比之下,已知的稳健的活化met突变体m1250t仅在100nm处被部分抑制,并且y1230h对于沃利替尼完全耐药。该测试的结果显示于图1中,并且证明metl1195f、v1092i和h1094l是met的活化突变体,并且下游erk1/2信号传导可以用沃利替尼治疗来抑制。
测试b):确定metwt和met点突变体对沃利替尼和其他met抑制剂的剂量响应
以指定剂量(范围为2.7nm至6.0μm)的沃利替尼、inc280或克唑替尼来处理如所指出的用metwt和met突变构建体瞬时转染的hek293t细胞2.5小时,以检测磷酸-md抑制的程度。结果示于图2-7和下表1中。
表1:c-met抑制剂的代表性选择的活力ic50和pmetic50
在表1中,ic50表示每种metwt和突变蛋白质对用相关c-met抑制剂的抑制的敏感性。沃利替尼对wtmet蛋白质具有13nm的ic50,针对已知的活化met突变体m1250t具有6nm的ic50。因此,沃利替尼对两种蛋白质具有可比的ic50值。类似地,瞬时表达metl1195f的细胞具有35nm的沃利替尼ic50,这也表明该met突变体可被沃利替尼抑制(与metwt和已知的活化m1250t突变体相似的程度)metv1092i和h1094l的瞬时表达证明这些突变蛋白质是磷酸化的,并且证明可以用met抑制剂抑制该磷酸化,使得沃利替尼的ic50分别为12nm和4nm。相比之下,mety1230h突变体对沃利替尼抑制不敏感,因为由于无法抑制至少50%的磷酸-metmsd信号而导致ic50不能确定。磷酸-metmsd信号被归一化为总met信号。
测试c):metwt、met突变或亲本ba/f3稳定细胞系的转化能力
在il-3存在下测定生长依赖于il-3的稳定细胞系群体的相对存活力,以确定细胞生长倾向。去除il-3以确定每个met构建体的转化能力。此外,hgf处理条件证明对met依赖性细胞生长的完全贡献。该测试的结果显示于图8中。
当依赖于il-3生长的亲本ba/f3细胞对载体或hgf处理无反应时,metwt过量表达也不以il-3独立的方式来赋予生长优势。相比之下,如所预期的,metm1250t细胞在不存在il-3的情况下生长,并且新颖met突变体l1195f被证明具有赋予生长的能力(与metm1250t类似的程度)。其他新颖met突变体(metv1092i和meth1094l,但不是mety1230h)也具有相对较大的赋予il-3独立细胞生长的能力。
测试d):metl1195f突变prcc患者肿瘤响应
在2014年9月,一名56岁的女性参加了ii期试验,以评估了沃利替尼(azd6094/hmpl-504)在患有prcc的患者(nct02127710)中的疗效。在2012年12月,在切除若干个转移性病灶到腹部淋巴结期间从患者收集诊断样品。通过中心病理学分析档案肿瘤样品,证明高等级分化、低分化的prccii型。患者于2014年9月2日开始用沃利替尼治疗。先前的系统疗法包括舒尼替尼和细胞因子,其中对于以前的治疗方案,最佳反应是进行性疾病(pd)。使用的沃利替尼周期为3周。
具有500x中位数外显子覆盖率的诊断性肿瘤样品(基础医学公司(foundationmedicineinc,fmi))的测序(ngs)证明存在具有24%的met等位基因分数的met突变met_c.3583c>t。l1195f的氨基酸取代位于met受体酪氨酸激酶的激酶结构域内的外显子18中。fmi将其报道为重要性不明的变体。这种肿瘤样本不带有共同发生的met基因拷贝数变化、没有其他met突变、并且在7号染色体增加(7号染色体增加是prcc的标志,并且met基因及其配体hgf基因位点两者都在其中)的背景下没有共同发生。使用在fmi测序测定中测量的400个基因和4200个snp的综合拷贝数分析来检测7号染色体的拷贝数。
根据recist1.1标准,受试者9203-002病情稳定。然而,该受试者在沃利替尼治疗36周时发生的最佳肿瘤响应是4个靶病灶的最长直径的总和的29.7%下降(图9)。靶病灶的总和用蜘蛛图上的数据标签(以mm计)表示。
在上述测试中使用以下一般实验技术:
metwt和突变克隆
合成基因plvxip_met_flag由合成寡核苷酸和/或pcr产物组装。将片段插入到载体骨架plvxires-puro_p839克隆位点bamhi/ecori中。从经转化的细菌中纯化质粒dna,并通过紫外光谱确定浓度。通过测序验证最终构建体。插入位点内的序列(abi)汇合为100%。以与metwt(英杰公司(invitrogen),赛默飞世尔科技公司(thermofischerscientific))相同的方式,在指定氨基酸位置(nm_000245)m1250t、y1230h、l1195f、h1094l和v1092i处产生点突变。
瞬时转染和抑制剂治疗
用质粒瞬时转染人胚胎肾细胞系(hek293t),如上述metwt和m&m突变克隆部分所概述的。将hek293t细胞铺板,95%在转染当天融合(每个病毒构建体1个板)。将met构建体(24μg)和optimem(1.5ml)与lipofectamine2000(60μl/反应,英杰公司(invitrogen))在optimem(1.5ml/反应)中组合用于mastermix,并在室温下孵育5分钟。将ad1.5ml的mastermix添加至含有构建体的每个管中,终体积为约3ml。对每个混合物进行上下移液混合,并且在室温下静置20分钟。将质粒混合物(3ml)轻轻添加到每个含有12ml培养基的10cm板中,并将板孵育过夜。24h后,取出培养基,并且使用剪切力采取步骤轻轻移取293t细胞以1:10在所希望的剂量板(6孔或96孔)上重新铺板,并使其粘附过夜。将沃利替尼(azd6094)以指定浓度稀释于dmso中,并且随后稀释于细胞培养条件下进行2.5小时的处理。从细胞吸出培养基并用给药培养基(dosingmedia)代替。将所得板孵育2.5小时,并立即在冰冷的裂解缓冲液中裂解,然后储存在-20℃下。
细胞裂解物的制备
将裂解缓冲液(tbs+1%np40)补充有phosstop磷酸酶抑制剂和完全蛋白酶抑制剂混合物(罗氏(roche)),每10ml裂解缓冲液1片。将混合物保持冷却。通过移液裂解缓冲液培养基(6孔培养皿)从孔中除去细胞,直至半粘附的293t细胞悬浮。然后将它们以1500rpm离心5min。吸出培养基,并且将细胞沉淀物重新悬浮于冰上的100μl裂解缓冲液中。立即将该悬浮液在干冰中冷冻/解冻两次。然后将样品以约14000rpm离心10分钟。将上清液转移到新管(约85μl)中,并保持在冰上或在-20℃下冷冻直到准备使用。进行bca测定以确定蛋白质浓度。使用裂解缓冲液以及30μllds样品缓冲液和添加的还原剂溶液将样品归一化为90μl中3.0mg/ml。将所得悬浮液以1500rpm离心10秒,将这些样品加热至沸腾(thermocycler-200),再次离心,并使其冷却。
蛋白质印迹
使用sds-page10%bis-trismidigel(生命技术公司(lifetech))通过凝胶电泳将40μg蛋白质从全细胞裂解物中分离。电泳后,将分离的蛋白质转移到硝酸纤维素(生命技术公司)膜上。在tbst中,将膜封闭,以阻止抗体与5%脱脂奶的非特异性结合。然后将该膜与针对感兴趣的蛋白质产生的第一抗体进行孵育,然后与随后的与针对第一抗体产生的与hrp轭合的第二抗体进行孵育。最后,将该膜与可通过增强化学发光(ecl,赛默飞世尔科技公司(thermofisherscientific))检测的底物在室温下孵育3分钟,并用成像系统(富士(fuji),imagequantlas-4000)显影。
使用的抗体包括:met(cst,8198s,兔)、pmet(cst,3077s,兔)erk1/2(cst,4695s,兔)、perk(cst,4370s,兔)、所轭合的第二抗兔hrp(cst,7074p2)。
msd磷蛋白质测定
如上制备的全细胞裂解物用于与multi-spot磷酸(tyr1349)/总met测定(mesoscalediscovery,msd)一起使用。msd提供了一种已经预涂布了捕获针对于磷酸化met(tyr1349)和在空间上不同点上的总met的抗体的板。在每个孔中添加150μl封闭溶液。用黏合板密封件来密封板,并在室温下剧烈摇动(300-1000rpm)来孵育1h。用300μl/孔的tris洗涤缓冲液将板洗涤3次。每孔添加25μl样品。用黏合板密封件来密封板,并在室温下剧烈摇动(300-1000rpm)来孵育1h。用300μl/孔的tris洗涤缓冲液将板洗涤3次。将25μl检测抗体溶液添加至msd板(与电化学发光化合物msdsulfo-tag标记轭合的抗总met)的每个孔中。用黏合板密封件来密封板,并在室温下剧烈摇动(300-1000rpm)来孵育1h。用300μl/孔的tris洗涤缓冲液将板洗涤3次。向msd板的每个孔中添加150μl1x读出缓冲剂t。将板加载到
稳定细胞系的生成
将il-3依赖性鼠类祖b细胞系(ba/f3)以5.2x105个细胞/ml的密度铺板于6孔板中,该6孔板具有突变病毒构建体、最终浓度为8μg/ml的聚凝胺,并且用完全培养基(rpmi-1640(吉博科公司(gibco))、10%fbs、1%l-谷氨酸,il-31ng/ml)填充至2ml体积。用石蜡膜密封悬浮培养物,并在20℃下以1500-2000rpm离心45分钟,然后孵育过夜并用完全培养基替换。在融合时,在添加选择压力下,2.0x106个细胞/ml,在2-4天后,替代培养基,其中培养基含有最终浓度为0.5μg/ml的嘌呤霉素。保持细胞在具有嘌呤霉素的选择素下持续3周。分裂细胞群,并且对一个孔进行处理以验证稳定细胞系中感染的克隆。使用qiagenblood和tissuekit提取dna,并用nanodrop验证dna浓度。使用q5热启动高保真2x主混合物(新英格(兰生物实验室(newenglandbiolabs))通过pcr扩增dna。通过在1%琼脂糖凝胶上用溴化乙锭进行电泳来纯化pcr产物。从凝胶中切下正确分子量的条带,并使用wizardsv凝胶纯化试剂盒(普洛麦格(promega))进行纯化。用nanodrop和10nm纯化dna来验证dna浓度,并测序10μm引物以证实met突变克隆稳定细胞系(伊顿生物科学(etonbioscience))。用测序仪5.4确认序列。用不含构建体的聚凝胺和病毒包装感染阴性对照组的细胞,并且用聚凝胺和红色荧光蛋白质(rfp)病毒感染阳性对照组细胞。
所用的pcr引物包括met正义143090519和反义143090520。所使用的测序引物包括f1143090521、f2143090522、f3143090523、r1143090524、r2143090525、r3143090526。用于证实位置1195、1092和1094处的突变构建体的引物的序列如下和在此序列表所示。
met测序引物:
f1agatacgacgcccgggtgc(seqidno:3)
f2agaaaatccactgcgccg(seqidno:4)
f3cgtgcacaacaagacagg(seqidno:5)
非编码链引物:
r1tctggtcatcagctccc(seqidno:6)
r2agcaggctcagcacgttgg(seqidno:7)
r3aactggtcctcggggaagg(seqidno:8)
对于1195突变构建体,使用f2和r3引物。对于1092突变构建体,使用f1和r2引物。对于1094突变构建体,使用f1和r2引物。
细胞转化测定
用完全培养基(+il-3、ba/f3依赖性生长因子)、不含il-3(-il-3)的培养基、以及不含il-3但含有met的配体hgf(-il-3/+hgf)的培养基处理细胞。用celltiter-
肿瘤中心组织学
使用一个5μm厚的档案肿瘤样本部分进行h&e染色和中心病理学检查(美国控股实验室公司(labcorp))。两名病理学家阅读染色部分以证实prcc诊断并分配组织学亚型(i型或2型)。如果病理学家不确定他们的分析,具有prcc病理学专业知识的外部第三病理学家可阅读病例(布列根和妇女医院(brighamandwoman’shospital))。
肿瘤测序
方法和材料描述于在其他地方(frampton等人,naturebiotechnology[自然生物技术]2013)。简言之,在基础药物公司clia实验室(foundationmedicineinc.clialaboratory)进行dna制备和文库构建后,构建400基因面板(版本t7)的靶向ngs。使用专有分析来识别由fmi管道(pipeline)导致的变化。由az生物信息管道(pipeline)重新分析原始测序bam文件,并证实fmi报道的结果。
沃利替尼临床试验
以开放标签、单臂、多中心、全球ii期试验中确定metl1195f突变prcc患者的肿瘤响应,以评估沃利替尼(azd6094/hmpl-504)在患有乳头状肾细胞癌(prcc)的患者中的疗效,这些患者初次接受治疗或以前接受过治疗(clinicaltrials.gov标识符:nct02127710;网址:https://clinicaltrials.gov/ct2/show/nct02127710)。能够允许熟练的临床团队对结果进行复制的关键试验和给药细节如下:
主要结果测量值:评估azd6094在患有prcc非患者和在met阳性患者亚组中的抗肿瘤活性,如通过研究者-评估总体响应率所测量的。响应率被定义为至少4周后证实的具有至少有一次完全或部分响应的访问响应的受试者的数量(%)。
次要结果测量值:在患有prcc的患者和met阳性患者亚组中的pfs(与基线相比靶病灶肿瘤大小的变化)、dor和os。无进展存活期被定义为从随机分组直到客观疾病进展或死亡(通过在不存在进展的情况下的任何原因)的时间,无论受试者是否退出随机治疗或在进展前接受另一种抗癌治疗。
评估azd6094的安全性和耐受性。依据ae和实验室数据、收集的所有患者的生命体征和ecg,将评估安全性特性。
auc,auc(0-24)、auc(0-t)、aucss、cmax、cssmax和cssmin的azd6094和主要代谢物m2和m3的pk(时间框架:周期1:第8天和第15天,周期2:第1天,周期3:第1天,以及周期4:第1天)。当口服给予时在多次给药后,在给予后至稳态,对azd6094和主要代谢物m2和m3的pk表征。
与基线相比,评估靶病灶肿瘤大小的变化。靶病灶的变化是12周时肿瘤大小与基线相比的百分比变化。这是基于在基线和第12周进行的recist靶病灶的测量值。靶病灶是可测量的肿瘤病变。
根据recistv1.1评估响应持续时间。响应持续时间被定义为从首次记录响应的日期到记录进展或任何原因死亡的日期之间的时间。在受试者在响应后没有进展的情况下,响应持续时间将与pfs审查时间相同。
根据recistv1.1评估总体存活的持续时间。总体存活(os)-总体存活被定义为从随机化的日期到由于任何原因导致的死亡的日期之间的时间。
实验:每日连续600毫克azd6094。所有参加研究的患者均服用azd6094600mgpoqd。治疗不间断药物:azd6094。azd6094是一种有效的和选择性的小分子c-met激酶抑制剂。其他名字:hmpl-504。
具体实施方式:这是一项开放标签、单臂、多中心、全球ii期的研究,旨在评估azd6094在患有乳头状肾细胞癌(prcc)的患者中的疗效和安全性,这些患者初次接受治疗或以前接受过治疗。
肿瘤样品的独立中心病理学检查将用于证实所有参加的患者的prcc诊断。然而,证实prcc的局部可用的病理学结果将被允许及时进入研究。
所有参加研究的患者均服用azd6094600mgpoqd。治疗不间断。
资格:适宜于研究的年龄:18岁至99岁(成人,老年人);适宜于研究的性别:男性女性都可以;接受健康志愿者:否。
入选标准:在任何研究特定程序、取样和分析之前提供知情同意。
组织学证实的乳头状肾细胞癌,其是局部晚期或转移的。
用于通过中心实验室和其他生物标志物证实prcc的档案肿瘤样品或预处理新鲜肿瘤样品的可用性。
初次接受prcc治疗或先前接受prcc治疗失败了。以前的治疗可能包括:靶向治疗(即舒尼替尼、索拉非尼、贝伐珠单抗、帕唑帕尼、坦罗莫司和依维莫司)、传统免疫疗法(即干扰素-a、白介素-2)、化学疗法或化学免疫疗法的组合。
ecog性能状态为0或1。
至少有一个之前没有被照射过并且没有选择用于活检的病灶,如果在筛选过程中进行,这些可以在基线时精确测量并且适用于精确的重复测量。
足够的血液学功能被定义为:
(anc)≥1500/μl。
(hgb)≥9g/dl。
血小板≥100,000/μl。
足够的肝功能被定义为:
alt和ast≤2.5xuln。
总胆红素≤1.5xuln。
足够的肾功能被定义为gfr≥40ml/分钟,
足够的凝血参数,定义为国际标准化比率(inr)<1.5xuln或aptt<1.5xuln。
患有已知肿瘤血栓或dvt的患者如果关于lmwh稳定≥4周,则是合格的。
女性应该使用适当的避孕措施,不应该是母乳喂养,如果有生育潜力,则在开始给药前必须具有阴性妊娠试验,或者必须有不具有生育潜力的证据。
男性患者应该愿意使用屏障避孕,即避孕套。
能够吞咽和保持口服药物。
预期寿命≥12周。
年龄至少18岁。
有遵守研究和随访程序的意愿和能力。
了解本研究的性质并给予书面知情同意的能力。
排除标准:最近的化学疗法、免疫疗法、化学免疫疗法或研究药剂<研究治疗的第一剂量的21天。最近的靶向治疗<研究治疗的第一剂量的14天。
在开始研究治疗时除了脱发之外,来自任何现有治疗的未解决的毒性大于ctcae1级。
先前或目前用c-met抑制剂的治疗。
在第一次给药研究治疗(圣约翰草3周)前2周内,cyp3a4的强诱导剂或抑制剂,cyp1a2的强抑制剂或具有狭窄治疗范围的cyp3a4底物。
在开始研究药物前给予≤28天的宽场放射疗法(包括治疗性放射同位素如锶89)或≤7天的有限场辐射用于缓解或者未从所述疗法的副作用中恢复。
主要外科手术≤开始研究药物的28天,或小手术≤开始研究药物的7天。在静脉导管(port-a-cath)置入后不需要等待。
先前未治疗的脑转移。
目前由于疾病引起的柔脑膜转移或脊髓受压。
急性或慢性肝脏疾病或胰腺疾病。
不受控制的糖尿病。
胃肠道疾病或其他明显干预口服治疗的吸收、分布、代谢或排泄的病症。
目前或过去6个月内有任何以下心脏病:
不稳定型心绞痛。
充血性心力衰竭(nyha≥2级)。
急性心肌梗塞。
中风或短暂性脑缺血发作。
控制不足的高血压(即sbp>160mmhg或dbp>100mmhg)(具有高于这些水平的值的患者必须在开始治疗前用药物控制其血压)。
从三次心电图获得的平均静息校正qt间期(qtc)>470msec。
任何临床上重要的静息心电图的节律、传导或形态的异常,例如完全性左束支传导阻滞、三度心脏传导阻滞、二度心脏传导阻滞、pr间期>250msec。
任何增加qtc延长风险或心律失常事件风险的因素,如心力衰竭、低钾血症、先天性或家族性长qt综合征或40岁以下不明原因的猝死家族史、或任何已知延长qt间期的伴随服药。
目前接受了治疗剂量的华法林钠(warfarinsodium)的治疗。允许lmwh。
在治疗时的严重的活动性感染,或另一种严重的潜在医学病症,该病症会损害患者接受方案治疗的能力。
人类免疫缺陷病毒(hiv)、乙型肝炎或丙型肝炎的已知诊断。
其他活动性癌症的存在或侵润性癌症治疗史≤5年。患有i期癌症的至少在3年前接受了明确的局部治疗的,并被认为不太可能复发的患者是合格的。所有先前治疗的原位癌(即非侵润性)的患者均符合资格,具有非黑素瘤皮肤癌历史的患者也是如此。
无法遵守方案的心理、家庭、社会或地理条件。
- 还没有人留言评论。精彩留言会获得点赞!