用于多麸酰氨酸(POLYQ)疾病的治疗的制作方法
本发明涉及神经退化性病症治疗领域。特定言之,本发明涉及一种利用干细胞治疗多麸酰氨酸(polyq)疾病的治疗方案。
背景技术:
共济失调是不定地影响小脑、脑干及脊髓小脑径的一组临床及基因异质性神经退化性疾病。脊髓小脑性共济失调(sca)为进行性、退化性且致命的疾病。sca包括神经元组织的退化,其中病理变化的主要部位存在于小脑、脑干或脊髓的核或神经路径中。sca的致命病况不仅来自大量神经元损失,而且亦来自晚期疾病时的卧床不起及呼吸衰竭。最常见的sca分类亚型为聚麸酰氨酸(polyq)介导的sca,亦即,sca1、sca2、sca3、sca6、sca7及sca17。
us7,067,545提供一种用于治疗脊髓小脑退化的方法,其包含向患有此疾病的患者投与有效剂量的一或多种选自d-环丝氨酸、d-丝氨酸酯、d-丝氨酸及其盐的成分。us9,125,924涉及通过静脉内投与包含海藻糖的含水调配物来缓解sca的症候或症状的方法。
但是,尚无针对sca的有效医药治疗或潜在治愈方法。因此,需要用于缓解sca的症候及症状的治疗方法。
技术实现要素:
本发明提供一种用于治疗个体的多麸酰氨酸(polyq)疾病的方法,所述方法包含向个体非经肠或局部地投与有效量的干细胞作为单位剂量,其中所述投与是以一或多个治疗周期进行,其中一个治疗周期包含分别以2至6周的给药间隔给与三个单位剂量。
在一些实施例中,polyq疾病包括(但不限于)脊髓小脑性共济失调(sca);马查多-约瑟夫病(machado-josephdisease,mjd/sca3);亨廷顿氏病(huntington'sdisease,hd);齿状红核苍白球路易体萎缩(drpla);及1型x连锁脊髓延髓性肌肉萎缩(smax1/sbma)。在一个实施例中,sca为sca1、sca2、sca3、sca6、sca7或sca17。
在一些实施例中,间叶干细胞为间叶干细胞群(msc)、脂肪组织源性干细胞(admsc)群、眼眶脂肪源性干细胞(ofsc)群或四潜能阳性基质细胞(quadri-positivestromalcell,qpsc)群。
在一些实施例中,细胞可通过非经肠投与或局部治疗投与(诸如脑内或颅内投与)。
在一些实施例中,单位剂量在0.5×105至5×1010个细胞/kg体重范围内。
在一个实施例中,投与是以一或多个治疗周期进行,其中一个治疗周期包含分别以2至6周(亦即,两周、三周、四周、五周或六周。在另一实施例中,间隔为两周)的给药间隔给与三个单位剂量。
图式简单说明
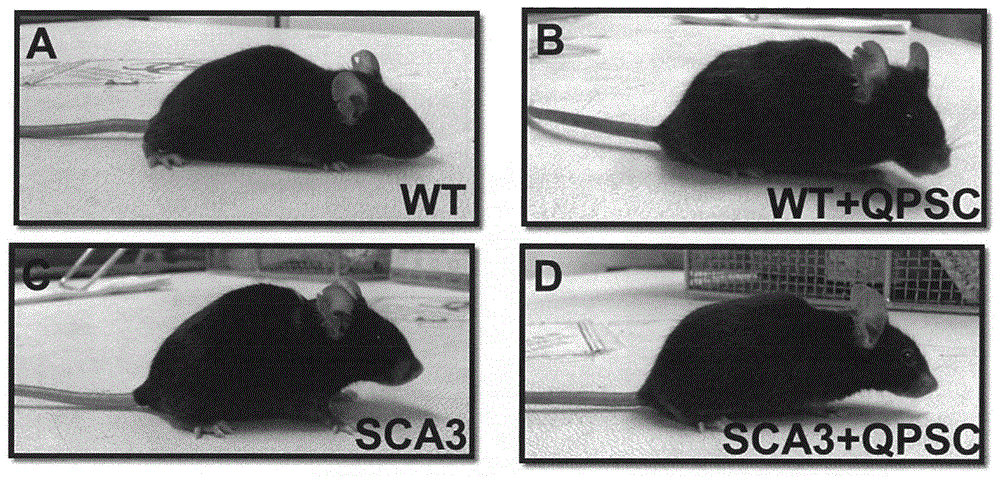
图1a至d展示sca3小鼠的外观及行为。
图2a至f展示异种移植模型中qpsc的免疫耐受性。图中显示小鼠在接受3剂qpsc之后进行的安全性测试的组织病理学发现。通过h&e染色(400x),在经qpsc治疗的小鼠中未观察到脑(图2a)、心脏(图2b)、肾脏(图2c)、肝(图2d)、肺(图2e)、胰脏(图2f)或脾(图2g)的显著病变。
图3a至3c展示qpsc停止sca3小鼠的体重减轻。在qpsc治疗之前每周及qpsc治疗之后每两周记录体重。在第三次qpsc注射之后一个月处死动物。图3a,在qpsc治疗之前,sca3小鼠的体重比野生型小鼠轻。图3b及3c,qpsc防止sca3小鼠体重减轻。
图4a至图4c展示qpsc改变sca3小鼠的表型。wt小鼠及sca3转基因小鼠(tg)两者皆接受静脉内qpsc投与3次。在qpsc治疗之前及之后进行改良的shirpa。图4a利用骨盆上提说明qpsc改变sca3小鼠的表型。图4b及4c,qpsc改变sca3小鼠在握力方面的表型。
图5a至图5c展示三个剂量的qpsc提高无显著运动功能退化的sca3小鼠的运动功能。wt小鼠及sca3转基因小鼠(tg)两者皆接受静脉内qpsc投与3次。在qpsc治疗之前及之后进行改良的shirpa及旋杆表现测试。图5a及b:sca3小鼠在qpsc治疗之后具有改善的运动及负趋地性表现。图5c:输注3个剂量的qpsc之后sca3小鼠(tg)的旋杆表现显著改善。
图6a至图6d展示三个剂量的qpsc提高具有显著运动功能退化的sca3小鼠的运动功能。关于小鼠的脚印分析是在第三次qpsc注射之后一个月进行。a至d图展示,sca小鼠的左前脚(l.f.)(图6a)、右前脚(r.f.)(图6b)、左后脚(l.h.)(图6c)及右后脚(r.h.)(图6d)呈现的脚印跨距减小,且3剂qpsc使异常跨距恢复。
图7a至图7d展示三个剂量的qpsc改善sca3小鼠的步态平衡。关于小鼠的脚印分析在第三次qpsc注射之后一个月进行。图7a至d:图7a及图7b分别展示小鼠前脚(f)及后脚(h)的脚印跨距,而图7c及图7d展示小鼠左脚(l)及右脚(r)的脚印重迭情况。三个剂量的qpsc不仅恢复受sca影响的异常跨距,而且亦保持接近100%重迭的脚印重迭。
图8展示能够经由iv输注颅内定位的qpsc。qpsc经由尾静脉注射移植入野生型小鼠中,且在移植7天后取出脑组织以用于定量实时rt-pcr分析。人类dna(通过人类β2微球蛋白侦测)与小鼠dna(通过小鼠18srrna侦测)的比率为约0.8%(1号小鼠)至2.8%(4号小鼠)。
图9a及9b展示能够在sca小鼠的小脑内分化成浦金埃氏(purkinje)类神经元细胞的qpsc。图9a:三次全身性(iv)投与qpsc之后一个月,一些移植细胞在sca小鼠的小脑内分化成具有长轴突结构的浦金埃氏类神经元细胞(箭头)。图9b:未发现经三次颅内(ic)注射的sca小鼠的小脑内自qpsc的神经元分化。
图10a及10b展示qpsc具有较强的免疫调节及抗ros能力。图10a:人类t细胞增殖受cd3/28刺激,且此经刺激的增殖通过与stemchymal以所有混合物比率共培养而抑制(***表明显著差异[p<0.05],n=3)。图10b:qpsc的抗h2o2能力比人类角膜上皮细胞(hce-t;对氧化应力具有相对较高抗性的细胞)的抗h2o2能力大3倍。
图11a及11b展示qpsc抑制sca小鼠的氧化应力相关运动功能退化。图11a:具有低氧化应力(低ros含量)的sca小鼠展示优于具有高氧化应力(高ros含量)的sca小鼠的旋杆表现。图11b:运动功能表现退化在sca小鼠(tg-ctrl)中进展,而相较于tg-ctrl,在具有较高及较低氧化负荷(tg-qpsc-高ros,tg-qpsc-低ros)的sca小鼠中全身性qpsc移植保持更好的旋杆表现,尤其在tg-qpsc-低ros组中(*p<0.05)。将野生型小鼠作为正常对照(wt-ctrl)进行比较。
图12a至12c展示qpsc表达多个旁分泌神经营养因子及组织生长因子。在qpsc中包括nt-3、nt-4、ngf、cntf、bdnf及gdnf在内的神经营养因子的基因表达为相对于内部对照18srrna基因通过定量pcr(qpcr)侦测(a)。qpsc中诸如egf、fgf-β及vegf(b)以及pdgf及tgf-β1(c)的组织因子亦通过elisa检查,且表明细胞内部分与分泌部分之间彼等因子的不同浓度。
图13展示qpsc旁分泌使星形胶质细胞神经元免受mpp诱导的神经元损失影响。人类星形胶质细胞株svgp12用1.25mm1-甲基-4-苯基吡啶(mpp+)处理且同时与不同比例的qpsc共培养。在处理24小时之后,计算svgp12的细胞数目。图13展示在mpp处理之后,svgp12的细胞数目显著减少且此现象在svgp12细胞与十倍量的qpsc共培养时逆转。
图14a至14c展示qpsc挽救sca3小鼠小脑内的浦金埃氏神经元损失。在处死之后,收集小鼠小脑。将收集的组织固定且用石蜡包埋以用于进一步组织病理学分析。组织切片用苏木精及曙红(he)染色且针对浦金埃氏细胞进行免疫组织化学(ihc)染色(抗钙结合蛋白,ab11426,abcam)。图14a.观测到当与野生型小鼠的小脑相比较时,具有明显运动功能退化的sca3小鼠的小脑中浦金埃氏细胞的大小较小且发生变形。图14b及图14c,sca3小鼠的小脑中浦金埃氏细胞数目显著减少,而三个剂量的qpsc防止由sca引起的浦金埃氏神经元损失。
具体实施方式
本发明提供用于干细胞疗法中,用于治疗polyq疾病的疾病或病况的方法及制品。polyq疾病是由各别蛋白质中编码长polyq链的胞嘧啶-腺嘌呤-鸟嘌呤(cag)重复序列扩增引起的一组神经退化性病症。polyq疾病是以不相关基因的转译区中cag三核苷酸重复的病理性扩增为特征。经转译的polyq聚集在退化的神经元内,导致特定神经元亚群的功能障碍及退化。本发明出人意料地发现利用干细胞的治疗方案,所述治疗方案提供用于恢复polyq疾病中退化及/或受损神经元的功能的有效疗法。
除非另外指出,否则技术性术语是根据公知用法使用。
如本文中所使用,单数形式“一个(种)(a/an)”及“所述/这些”是指单数以及多数两者,除非上下文另有清晰指示。
如本文所使用,术语“及”及“或”可用于指连接性或分离性的。亦即,所述两个术语应理解为等效于“及/或”,除非另有说明。
如本文所用,术语“治疗(treatment)”、“治疗(treat)”或“治疗(treating)”是指疾病或病况或病症,或症状、不良作用或后果,或与其相关的表型的完全或部分改善或减轻。希望的治疗作用包括(但不限于)防止疾病的发生或复发、缓解症状、减少疾病的任何直接或间接病理性后果、降低疾病进展速率及改善减轻疾病状态。
如本文所用,术语“延缓疾病发展”意指推迟、阻碍、减慢、停滞、稳定、抑制及/或延迟疾病的发展。取决于所治疗的疾病及/或个体的病史,此延缓可具有不同的时间长度。
如本文所用,在投药的情况下,术语药剂(例如医药调配物、细胞或组合物)的“有效量”是指以所需剂量/量且持续所需时段有效获得所希望的结果的量。
如本文所用,术语药剂(例如医药调配物或细胞)的“治疗有效量”是指以所需剂量且持续所需时段有效获得所希望的治疗结果(诸如用于治疗疾病、病况或病症,及/或治疗的药物动力学或药效学作用)的量。
如本文所用,“第一次剂量”是用于描述给定剂量在投与连续或后续剂量之前的时序。所述术语未必暗示个体之前从未接受过一剂细胞疗法或甚至个体之前从未接受过一剂相同细胞。
如本文所用,术语“后续剂量”是指在前一次剂量(例如,第一次剂量)之后向同一个体投与的剂量,在此期间未向个体投与任何插入剂量。
如本文所用,术语“个体”为哺乳动物,诸如人类或其他动物,且通常为人类。在一些实施例中,个体在投药之前曾利用靶向疾病或病况的治疗剂治疗。
如本文所用,术语“医药调配物”是指这样一种制剂,其形式允许其中所含活性成分的生物活性有效,且其不含对投与所述调配物的个体具有不可接受的毒性的额外组分。
如本文所用,术语“医药学上可接受的载剂”是指医药调配物中除活性成份以外的对个体无毒的成份。医药学上可接受的载剂包括(但不限于)缓冲剂、赋形剂、稳定剂或防腐剂。
在一个态样中,本发明提供一种用于治疗个体的多麸酰氨酸(polyq)疾病的方法,所述方法包含向个体非经肠或局部地投与有效量的干细胞作为单位剂量,其中所述投与是以一或多个治疗周期进行,其中一个治疗周期包含分别以2至6周的给药间隔给与三个单位剂量。
在一些实施例中,polyq疾病包括(但不限于)脊髓小脑性共济失调(sca);马查多-约瑟夫病(mjd/sca3);亨廷顿氏病(hd);齿状红核苍白球路易体萎缩(drpla);及1型x连锁脊髓延髓性肌肉萎缩(smax1/sbma)。
在一些实施例中,sca是多麸酰氨酸(polyq)介导的sca,sca优选为sca1、sca2、sca3、sca6、sca7或sca17。更佳地,sca为sca3。
在一些实施例中,间叶干细胞为间叶干细胞群(msc)、脂肪组织源性干细胞(admsc)群、眼眶脂肪源性干细胞(ofsc)群或四潜能阳性基质细胞(qpsc)群。在一个实施例中,qpsc是描述于美国申请案第14/615,737号的qpsc,其具有至少70%细胞同源性且表达细胞标记物cd273、cd46、cd55及cxcr4,但不表达cd45;其中cd273以超过70%的强度较强地表达。在一个实施例中,adsc是描述于美国20120288480中的彼等ofsc,其至少表达cd90、cd105、cd29、cd44、cd49b、cd49e、cd58及hla-abc,但不表达cd133、cd31、cd106、cd146、cd45、cd14、cd117。干细胞优选为qpsc群。
在一些实施例中,细胞可通过非经肠投与或局部治疗投与(诸如脑内或颅内投与)。非经肠输注包括肌内、静脉内、动脉内或皮下投与。非经肠投与优选为静脉内注射。
在一些实施例中,单位剂量在0.5×105至5×1010个细胞/kg体重范围内。在一些实施例中,单位剂量在0.5×105至5×109、0.5×105至5×108、0.5×105至5×107、0.5×105至5×106、1.0×105至5×1010、1.0×105至5×109、1.0×105至5×108、1.0×105至5×107或1.0×105至5×106个细胞/kg体重范围内。
在一个实施例中,投与是以一或多个治疗周期进行,其中一个治疗周期包含分别以2至6周(亦即,两周、三周、四周、五周或六周。在另一实施例中,间隔为两周)的给药间隔给与三个单位剂量。本发明的治疗周期的数目是根据共济失调评估及分级量表(scalefortheassessmentandratingofataxia,sara)确定(subramonysh.,sara--anewclinicalscalefortheassessmentandratingofataxia.natclinpractneurol.2007;3(3):136-7;kimbr,limjh,lees,parks,kohse,leeis,jungh,leej.usefulnessofthescalefortheassessmentandratingofataxia(sara)inataxicstrokepatients.annrehabilmed.2011;35:772-780;及tans,niuhx,zhaol等人,reliabilityandvalidityofthechineseversionofthescaleforassessmentandratingofataxia.chinmedj.2013;126(11):2045-8)。sara是基于小脑共济失调(脊髓小脑,弗里德希氏(friedreich)及散发性共济失调)损伤水准的半定量评估的临床量表。sara是基于8个项目的表达的量表,得到总分0分(无共济失调)至40分(最严重共济失调)。这些分数是基于步态、跨距、坐姿、言语障碍、手指追踪(fingerchase)、鼻-手指测试、快速交替手运动及踵-胫滑动的患者表现。在第一个治疗周期之后,若个体保持sara总分高于5分一个月,则将进行第二个及后续治疗周期。
单位剂量的干细胞是以2至6周的间隔投与。2至6周的间隔意指单位剂量的干细胞是在两周、三周、四周、五周或六周内投与一次。在一个实施例中,给药间隔是每两周一次。在一个实施例中,每两周一次给药意指单位剂量的干细胞是两周一次投与,亦即,在14天时段期间投与一次,优选在每两周的同一天投与。在每两周一次给药方案中,大体上约每14天投与单位剂量。
在干细胞疗法情况下,单位剂量的投与包含以单一组合物及/或单次不间断的投药(例如,单次注射或连续输注)投与给定量或数目的细胞。
在一些实施例中,细胞是作为组合治疗的一部分,诸如与另一治疗干预同时或按任何次序依序投与。在一些实施例中,干细胞是与一或多种额外治疗剂或结合另一治疗干预同时或按任何次序依序共投与。在一些情况下,这些额外治疗剂或另一疗法是与细胞以足够接近的时间共投与,由此使这些额外治疗剂或另一疗法增强细胞群的作用,或反之亦然。在一些实施例中,干细胞是在所述一或多种额外治疗剂之前投与。在一些实施例中,干细胞是在所述一或多种额外治疗剂之后投与。
用于本发明方法中的干细胞是调配为医药组合物或调配物形式,诸如包括供投与给定剂量或其部分的细胞数目的单位剂型组合物。医药组合物及调配物一般包括一或多种可选的医药学上可接受的载剂或赋形剂。在一些实施例中,所述组合物包括至少一种额外治疗剂。
载剂的选择部分由特定干细胞及/或由投与方法确定。因此,存在多种适合调配物。举例而言,所述医药组合物可含有防腐剂。
医药学上可接受载剂以所用剂量及浓度大体上对接受者无毒,且包括(但不限于):缓冲剂,诸如磷酸盐、柠檬酸盐及其他有机酸;抗氧化剂,包括抗坏血酸及甲硫氨酸;防腐剂(诸如氯化十八烷基二甲基苯甲基铵;氯化六羟季铵;苯扎氯铵(benzalkoniumchloride);苄索氯铵(benzethoniumchloride);苯酚、丁醇或苄醇;对羟基苯甲酸烷酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;及间甲酚);低分子量多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯啶酮;氨基酸,诸如甘氨酸、麸酰氨酸、天冬酰氨、组氨酸、精氨酸或离氨酸;单醣、双醣,及其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨醇;成盐相对离子,诸如钠;金属错合物(例如,zn-蛋白质错合物);及/或非离子界面活性剂,诸如聚乙二醇(peg)。
在一些态样中,缓冲剂包括在组合物中。适合的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾,以及各种其他酸及盐。在一些态样中,使用两种或多于两种缓冲剂的混合物。制备可投与的医药组合物的方法为已知的。
调配物可包括水溶液。调配物或组合物亦可含有多于一种可用于以干细胞治疗的特定适应症、疾病或病况的活性成份。
在一些实施例中,医药组合物包含有效治疗疾病或病况的量(诸如治疗有效量)的干细胞。在一些实施例中,通过定期评估所治疗的个体来监测治疗功效。所需剂量可通过单次快速注射投与细胞、通过多次快速注射投与细胞或通过连续输注投与细胞来递送。
干细胞及组合物可使用标准投药技术、调配物及/或装置投与。干细胞的投与可为自体或异源的。
无菌可注射溶液可通过将细胞并入溶剂中,诸如使细胞与适合的载剂、稀释剂或赋形剂(诸如无菌水、生理食盐水、葡萄糖、右旋糖或其类似物)混合来制备。取决于投药途径及所需制剂,组合物可含有辅助物质,诸如润湿剂、分散剂或乳化剂(例如甲基纤维素)、ph缓冲剂、胶凝或黏度增强添加剂、防腐剂、调味剂及/或着色剂。在一些态样中,可参考标准文本以制备适合制剂。
可添加增强组合物的稳定性及无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂及缓冲剂。可通过各种抗细菌剂及抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚及山梨酸)来确保防止微生物的作用。可通过使用吸收延迟剂(诸如单硬脂酸铝及明胶)来延长可注射医药形式的吸收。
实例
i.动物模型试验
材料及方法
动物及实验设计
无显著运动功能退化的小鼠
mjd84.2(b6;cba-tg(atxn3*)84.2cce/ibezj)小鼠已确立为人类马查多-约瑟夫疾病,亦称为3型脊髓小脑性共济失调(mjd/sca3)的疾病模型。在本研究中,研究年龄在20至34周范围内的mjd84.2动物。对此等动物进行行为分析,包括改良的shirpa、脚印分析及旋杆测试。以两周间隔对21、23及25周龄小鼠进行三次测试物注射。研究设计概述如下。
具有显著运动功能退化的小鼠
总计十三只sca3tg/0小鼠(b6;cba-tg(atxn3*)84.2cce/ibezj)及8只c57bl/60/0野生型小鼠最初全部来自jax实验室。动物随机登记分入四个实验组:(1)sca3+细胞;(2)sca3+pbs;(3)wt+细胞;(4)wt+pbs。在确定sca3tg/0小鼠出现明显着疾病表型之后以两周间隔进行三次测试物注射。研究设计概述如下。
间叶干细胞
本研究中的qpsc为人类admsc
细胞给与
对于使用无显著运动功能退化的小鼠的研究:
将2.5×107个细胞/kg体重的
对于使用具有显著运动功能退化的小鼠的研究:
小鼠随机分入四个组:(1)sca3+细胞;(2)sca3+pbs;(3)wt+细胞;(4)wt+pbs。将2.5×107个细胞/kg体重的
对于所述两项研究,在注射之后监测动物4个小时且每日观测。每两周一次给与细胞,总计三次。
数据收集及分析
在最后一次测试物注射之后一个月处死小鼠。记录整个研究中小鼠的体重及掉落的等待时间(latencytofall)。在测试物注射之后,亦针对步态表现分析小鼠脚印。收集小鼠组织(皮层、小脑、心脏、肾脏、肝、脾、肺及尾)以用于将来组织病理学分析及生物学分布研究。
统计学
数据以平均值±sem呈现。使用斯图登氏t检验(student'st-test)且以p<0.05的显著性临限值分析旋杆及脚印测试的结果。
运动协调及平衡分析
在旋杆设备(mk-670,muromachikikaico.,ltd.,japan)中评价运动协调及平衡情况。将小鼠置放于处于恒定速度(4rpm)的旋杆上,所述旋杆在5min时段内加速至40rpm。记录掉落的等待时间或者完成完整被动旋转(附着至杆上完整旋转)的等待时间。使小鼠进行3次各测试,其中各试验之间有15min休息。计算各测试中各小鼠的平均等待时间。测试结果使用t检验进行统计分析。
shirpa测试
改良的shirpa测试是在小鼠年龄为20、24及28周时进行。shirpa方案是改自rikenbrc的改良的shira方案。测试项目及评分标准列于下表中。
小鼠是根据其行为评分。研究组中小鼠总数计为100%。结果以某些评分层级的小鼠数目的百分比呈现。
脚印分析
在最后一次给与细胞之后约一个月分析小鼠脚印。参考2015(1)所公布的论文,将小鼠脚掌浸渍于墨水中(前脚:红色;后脚:绿色),以使得小鼠在沿走廊步行或跑至目标箱时留下脚印的形迹。将将小鼠置放于隧道前方的一张纸(50cm长,10cm宽)上。量测步幅、摇摆、跨距长度以及前脚爪及后脚爪重迭指示步态(参看下图)。所有小鼠在处死之前进行三轮量测。
mtt分析
cd3+t细胞分离
通过histopaque-1077(sigma-aldrich)密度梯度离心由来自健康供体的肝素化全血分离人类末梢血液单核细胞(pbmc)。随后,遵循制造商的说明,使用抗人类cd3抗体偶联的磁性粒子(bdbiosciences)通过阳性选择自pbmc纯化出cd3+t淋巴球。
t细胞增殖分析
在96孔盘中,利用盘结合的抗-cd3单株抗体(2μg/ml)及抗-cd28单株抗体(2μg/ml)(bdbiosciences)刺激经纯化的人类cd3+t细胞(1×105个细胞)且将其与不同数量的admsc共培养于含有10%胎牛血清(fbs)、2mml-麸酰氨酸、100u/ml青霉素、100u/ml链霉素及25mmhepesrpmi-1640培养基(gibco)中。在48小时之后,将5-溴-2-脱氧尿苷(brdu)添加至各孔中且再培育盘18小时以量测t细胞增殖情况。根据制造商的说明,使用细胞增殖elisa(cellproliferationelisa)brdu套组(roche)量测并入t细胞中的brdu的量。
免疫组织化学(ihc)
为评价qpsc的神经保护作用,将qpsc经由c57bl/6jsca2转基因小鼠的尾静脉(ivhmsc-tg组)或经由枕骨大孔(ichmsc-tg组)注射入小脑位置。选择与人类β2微球蛋白反应的特异性抗体(abcam,代码:ab15976),通过ihc展示鼠类脑组织中的人类细胞。切割鼠类切片(4μm)并安放至显微镜载片上。通过在二甲苯、100%乙醇、95%乙醇及80%乙醇中以5min间隔冲洗两次使切片复水。在去除石蜡之后,切片用3%h2o2处理以使过氧化酶失活,在10mm柠檬酸盐缓冲液(含0.05%tween20)中加热以用于抗原修复,且用1%阻断溶液阻断(1%bsa及0.1%tritonx-100(于pbs中),chang等人,journalofbiomedicalscience2011,18:54http://www.jbiomedsci.com/content/18/1/54,第3页,共9页)。将切片与在阻断溶液中稀释(1:400)的特异性抗人类b2微球蛋白多株抗体(abcam)一起在室温下培育40min。在用pbs充分洗涤三次之后,将切片与在阻断溶液中稀释(1:1000)的二次抗体一起在室温下培育40min。一次抗体使用envision侦测系统(dako)侦测,且用二氨基联苯胺(dab;dako)观测。用含水苏木精(sigmaaldrich)对比染色。对于直接比较,整批处理所有载片以使变异性最低。
安全性测试
动物
c57bl/6小鼠接受使用胰岛素注射器1/2cc30gx3/8”针头(terumo,或bdbioscience)经由尾部静脉内注射的3剂qpsc。在注射之前,动物通过置放在笼子下的加热垫温热15至20分钟以扩张其尾静脉。在尸检之前,所有动物使用氨基甲酸酯(2公克/公斤体重,sigma-aldrich)麻醉,接着自下颌下静脉或经由心脏穿刺收集血液。
血液样品收集
对于血液学分析,将全血样品收集在含有edta的采血管(bdbioscience,目录号365974)中。对于血液化学分析,将全血样品收集在含有血浆分离器的采血管(bdbioscience,目录号365967)中。在室温下静置血浆管20min之后,接着通过在4℃下以6000rpm离心5min分离血浆。
肉眼尸检及组织收集
在取血样之后,收集动物器官。将其各分成两部分:(1)一半器官保藏于-80℃冷冻器中,随后转移且储存在液氮容器中以用于生物分布分析;(2)另一半经固定(4%多聚甲醛,sigma-aldrich)且石蜡包埋以用于组织病理学分析。
定量pcr
遵循制造商的说明,使用总rna小规模纯化套组(totalrnaminipreppurificationkit;gmbiolab目录号tr01)自qpsc或鼠类组织提取总rna。随后,使用两步mmlvrt-pcr套组(gmbiolab目录号rp012-m)进行cdna合成。使用thefast
elisa
为量测qpsc中egf、fgf-b、vegf、pdgf及tgf-b1的细胞内及分泌含量,如下制备细胞溶解产物及改良性培养基的样品:通过使用冻融方法溶解qpsc,且在超速离心之后收集细胞溶解产物的上清液。且对于改良性培养基收集,在qpsc培养3天之后收集培养基。最后,根据制造商的说明,通过elisa(r&dsystem)测定以上生长因子的浓度。
神经元细胞共培养测试
人类星形胶质细胞株svgp12用1250μm1-甲基-4-苯基吡啶(mpp+)处理且与不同比例的qpsc(svgp12:qpsc=1:0.1-1:10)共培养。在24小时之后,计算svgp12的细胞数目。
实例1qpsc改变sca3的表型
qpsc改变sca3小鼠的表型。如图1所示,sca3小鼠展示与野生型小鼠相比略微较宽的基部(base)且在qpsc治疗之后,sca3小鼠的外观看起来类似于野生型小鼠。在各种功能测试中,诸如改良的shirpa(图4、图5)、脚印(图6、图7)及旋杆表现分析(图5c),观测到类似的改善结果。
实例2通过本发明的治疗使体重减轻停止且对器官组织无副作用
qpsc亦停止在疾病进展期间sca3的体重减轻(图3)。尽管如此,3次剂量的qpsc并不影响sca3个体的全血球计数(表1)或血液生物化学(表2)的型态。表1及表2展示25至30周龄野生型小鼠的全血球计数/生物化学型态在三次剂量的qpsc与生理食盐水(以一周间隔投与三次剂量)之间并无差异。组织病理学分析展示在注射三次剂量的qpsc之后各种重要器官组织的正常发现(图2)。
表1
数据以平均值±sd呈现
表2
数据以平均值±sd呈现
实例3使用本发明治疗的小鼠中的免疫调节及抗ros能力以及多个神经营养因子及生长因子的表达
活体外研究展示,qpsc不仅具有免疫调节及抗ros能力(图10),而且亦具有表达多个神经营养因子及生长因子的能力(图12)。活体内研究表明在qpsc治疗之后,sca小鼠在氧化应力下旋杆表现改善(图11)。此外,qpsc亦可同时在活体外(图13)及活体内(图14)防止神经元损失。尽管已提出有关细胞跨血脑屏障(bbb)迁移的可能性的疑问,但已显示qpsc经由静脉内输注而在颅内定位的能力(图8及图9)。
因此,合理地得出以下结论:经由静脉内输注,qpsc可通过bbb到达小脑且保护sca个体的神经元细胞免受ros及免疫过度反应的损害。qpsc亦分泌多个神经营养及生长因子以维持神经元细胞的数目,从而延缓poly-q疾病(诸如多麸酰氨酸脊髓小脑性共济失调、马查多-约瑟夫疾病、亨廷顿氏病、drpla及smax1/sbma)的进展。
ii.人类临床试验
所述人类临床试验旨在通过随机化、双盲、安慰剂对照研究设计来研究
在针对多麸酰氨酸脊髓小脑性共济失调的一个实例中,经历试验的个体具有经基因型确认的2型脊髓小脑性共济失调或3型脊髓小脑性共济失调。个体的基线sara分数在5至15分范围内。
将2.5×107个细胞/kg体重的
- 还没有人留言评论。精彩留言会获得点赞!