N-(2-(2-(二甲氨基)乙氧基)-4-甲氧基-5-((4-(1-甲基-1H-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺及其盐的药物制剂的制作方法
相关申请的交叉引用
本申请根据35u.s.c.§119(e)要求2017年6月16日提交的美国临时申请序列号62/521,007的优先权,将其公开文本通过引用以其整体并入本文。
本发明涉及n-(2-(2-(二甲氨基)乙氧基)-4-甲氧基-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺(特别是其甲磺酸盐)的药物制剂,以及使用所述制剂治疗或预防癌症的方法。
背景技术:
表皮生长因子受体(egfr、her1、erbb1)是四种结构相关的细胞表面受体的erbb家族的主要成员,其他成员是her2(neu、erbb2)、her3(erbb3)、和her4(erbb4)。egfr通过其固有的催化酪氨酸蛋白激酶活性发挥其主要的细胞功能。所述受体通过与生长因子配体(例如表皮生长因子(egf)和转化生长因子-α(tgf-α))结合而被激活,从而将无催化活性的egfr单体转变为具有催化活性的同二聚体和异二聚体。这些具有催化活性的二聚体然后启动细胞内酪氨酸激酶活性,从而导致特异性egfr酪氨酸残基的自磷酸化并引发信号传导蛋白的下游激活。随后,信号传导蛋白启动多个信号转导级联反应(mapk、akt和jnk),最终介导细胞生长、增殖、运动和存活的基本生物学过程。
在许多类型的癌细胞表面上发现egfr的水平异常高,而egfr水平的升高与晚期疾病、癌症扩散和不良的临床预后相关。egfr的突变可导致受体过表达、永久激活或持续的过度活跃,并导致不受控制的细胞生长,即癌症。因此,已在几种类型的恶性肿瘤中鉴定出egfr突变,所述恶性肿瘤包括转移性肺癌、头颈癌、结直肠癌和胰腺癌。在肺癌中,突变主要发生在外显子18至21中,这些外显子编码激酶结构域的三磷酸腺苷(atp)结合口袋。临床上最相关的药物敏感性egfr突变是外显子19的缺失(所述缺失消除了常见的氨基酸基序(lrea))和外显子21的点突变(这导致在858位的亮氨酸被精氨酸取代(l858r))。一起而言,这两种激活型突变占肺癌中观察到的egfr突变的近85%。两种突变都具有永久性的酪氨酸激酶活性,因此,它们是致癌的。在至少50%的最初对当前疗法有反应的患者中,疾病进展与egfr外显子20中t790m的继发突变(称为看门基因突变)的发生相关。需要开发用于癌症治疗的新的有效且稳定的制剂。
技术实现要素:
本发明提供了n-(2-(2-(二甲氨基)乙氧基)-4-甲氧基-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺(化合物1)或其药学上可接受的盐的药物制剂(所述药物制剂中存在药学上可接受的赋形剂),以及使用所述制剂治疗或预防通过表皮生长因子受体(egfr)的突变形式介导的疾病或医学病症例如各种癌症的方法。
一方面,本发明提供了包含作为活性成分的游离碱或在一个优选实施方案中的化合物1的甲磺酸盐(1·meso3h,化合物2)和一种或多种药学上可接受的赋形剂的药物制剂。
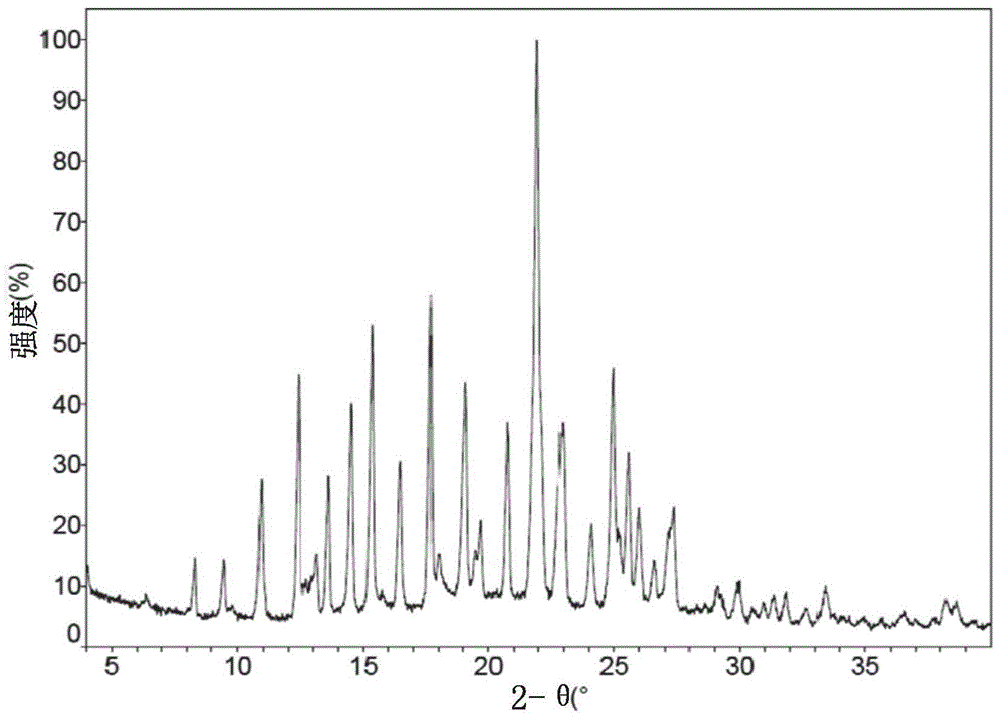
在一些实施方案中,化合物1处于指定为形式2a的甲磺酸盐晶型,其具有x射线粉末衍射图,所述x射线粉末衍射图包含使用cukα辐射测量的以下2θ值:11.1°±0.2°、12.6°±0.2°、13.8°±0.2°、14.7°±0.2°、15.5°±0.2°、16.7°±0.2°、17.9°±0.2°、19.3°±0.2°、20.9°±0.2°、22.1°±0.2°、23.2°±0.2°、25.2°±0.2°、和25.8°±0.2°。
在一些实施方案中,化合物1处于指定为形式2b的甲磺酸盐晶型(化合物2),其具有x射线粉末衍射图,所述x射线粉末衍射图包含使用cukα辐射测量的以下2θ值:9.7°±0.2°、12.8°±0.2°、15.7°±0.2°、18.2°±0.2°、20.3°±0.2°、25.1°±0.2°、25.6°±0.2°、和26.8°±0.2°。
在一些实施方案中,所述药学上可接受的赋形剂包括选自以下的一种或多种填充剂:乳糖一水合物、无水乳糖、蔗糖、右旋糖、甘露醇、山梨醇、淀粉、预胶凝淀粉、微晶纤维素、二水磷酸二钙或无水磷酸二钙、磷酸钙、碳酸钙、和硫酸钙,其中每种所述填充剂按重量计占所述制剂的约15%至约50%。
在一些实施方案中,所述药学上可接受的赋形剂包括选自以下的一种或多种崩解剂:淀粉、预胶凝淀粉、羟丙基淀粉、羟基乙酸淀粉钠、羧甲基纤维素钠、交联羧甲基纤维素钠、藻酸盐、硅酸铝、交联聚维酮、和羟丙基纤维素,其中每种所述崩解剂按重量计占所述制剂的约1%至约10%。
在一些实施方案中,所述药学上可接受的赋形剂包括选自以下的一种或多种润滑剂:硬脂酸镁、硬脂酸钙、滑石(“滑石粉”)、聚乙二醇(“peg”)、环氧乙烷聚合物、月桂基硫酸钠、月桂基硫酸镁、油酸钠、硬脂酰富马酸钠、和二氧化硅,其中每种所述润滑剂按重量计占所述制剂的约1%至约10%。
在一些实施方案中,所述药学上可接受的赋形剂包括选自以下的一种或多种粘结剂:阿拉伯胶、纤维素衍生物(例如:甲基纤维素、羧甲基纤维素、羟丙基甲基纤维素、羟丙基纤维素、羟乙基纤维素)、明胶、葡萄糖、右旋糖、木糖醇、聚甲基丙烯酸酯、聚乙烯吡咯烷酮、山梨醇、淀粉、黄芪胶、苍耳烷树脂、藻酸盐、硅酸镁-铝、聚乙二醇(peg)、和膨润土,其中每种所述粘结剂按重量计占所述制剂的约5%至约30%。
本发明的另一方面提供了一种治疗与egfr活性相关的疾病或障碍的方法,所述方法包括将治疗有效量的本文所述的制剂给予至对其有需要的患者。
在一些实施方案中,所述疾病或障碍与一种或多种egfr突变体相关。在一些实施方案中,所述一种或多种egfr突变体选自l858r激活型突变体l858r、dele746-a750、g719s;外显子19缺失激活型突变体;以及t790m抗性突变体。在一些实施方案中,所述疾病或障碍是癌症。
本发明的另一方面提供了包含化合物1的甲磺酸盐的药物组合物在制备用于治疗与一种或多种egfr突变体相关的疾病或病症(特别是各种癌症)的药物中的用途。
鉴于以下详细描述、附图和权利要求,将更好地理解本发明的其他方面或优点。
附图说明
图1a和1b分别展示了处于晶型2a的1·meso3h(化合物2)的xrpd图和xrpd数据。
图2展示了化合物2(形式2a)的dsc热谱图。
图3展示了化合物2(形式2a)的tga热谱图。
图4a和4b分别展示了处于晶型2b的化合物2的xrpd图和xrpd数据。
图5展示了化合物2(形式2a)的tga-ms热谱图。
图6展示了化合物2(形式2b)的dsc热谱图。
图7展示了在50℃下在制剂1的稳定性测试中作为对照的化合物2的hplc色谱图的重叠图。
图8展示了在50℃下来自制剂1的稳定性测试中的hplc色谱图的重叠图。
图9展示了在40℃、75%相对湿度下来自制剂1的稳定性测试中的hplc色谱图的重叠图。
具体实施方式
化合物1有效地抑制了激活型突变以及t790m双突变体的激酶结构域,因此克服了在目前使用的可逆抑制剂疗法中所观察到的耐药性。由于egfr在非小细胞肺癌(nsclc)中的作用已得到充分确立,因此化合物1代表了一种用于治疗非小细胞肺癌的新型治疗剂。
在一些实施方案中,本发明提供了化合物1的药学上可接受的盐,以及化合物1或其药学上可接受的盐的制剂。所述制剂不仅确保了理想的药代动力学特性,而且在长时间内显示出优异的稳定性。
如本文所使用的,术语“药学上可接受的赋形剂或载体”是指用作载体、稀释剂、佐剂、粘结剂、润滑剂、崩解剂和/或媒介物用于将治疗剂递送给患者或添加到药物组合物中以改善其处理或储存特性或以允许或促进化合物或药物组合物形成单位剂型以便给药的任何物质,其本身不是治疗剂。药学上可接受的赋形剂在药学领域是已知的,且公开于例如remington:thescienceandpracticeofpharmacy,第21版.(lippincottwilliams&wilkins,baltimore,md,2005)和handbookofpharmaceuticalexcipients,americanpharmaceuticalassociation,washington,d.c.,(例如,分别是1986年、1994年和2000年的第1版、第2版和第3版)。如本领域技术人员已知的,药学上可接受的赋形剂可以提供多种功能,并且可以描述为润湿剂、缓冲剂、悬浮剂、润滑剂、乳化剂、崩解剂、吸收剂、防腐剂、表面活性剂、着色剂、调味剂和甜味剂等。
如在此所使用的,术语“受试者”或“患者”是指哺乳动物,包括但不限于人。因此,本文公开的方法可用于人的治疗和兽医应用。在一个实施方案中,所述患者是哺乳动物。在一些实施方案中,所述患者是人。在一些实施方案中,所述患者是哺乳动物,例如狗、猫和马。
如本文所使用的,除非另外指出,否则本文所用冠词“一个/种”(“a”和“an”)是指“一个/种或多个/种”或“至少一个/种”。也就是说,用不定冠词“一个”或“一种”来提及本发明的任何元件或部件并不排除存在多于一个元件或部件的可能性。
本文使用的术语“约”表示某些优选的运行范围,例如材料量的摩尔比范围以及温度范围,不是固定确定的。如果缺乏普通技术人员的经验指导,缺乏上下文的指导,并且下文没有叙述更具体的规则,则“约”范围应不大于终点绝对值的10%或所述范围的10%,取较小值。
术语“治疗”(“treating”或“treatment”)是指(i)抑制疾病、障碍、或病症,即阻止其发展;或(ii)减轻疾病、障碍、或病症,即导致疾病、障碍、和/或病症消退。因此,在一个实施方案中,“治疗”是指改善疾病或障碍,其可以包括改善一种或多种物理参数,但对于所治疗的受试者而言可能是无法区分的。在另一个实施方案中,“治疗”包括在物理上(例如,可辨别症状的稳定)或生理上(例如,物理参数的稳定)或在两者上调节疾病或障碍。
药物制剂
本发明的一个方面提供了包含化合物1或其药学上可接受的盐和一种或多种药学上可接受的赋形剂的药物制剂。在一些实施方案中,活性成分化合物1在制剂中为游离碱形式。在一些实施方案中,活性成分是化合物1的药学上可接受的盐。适用于形成盐的酸的非限制性例子包括甲磺酸、盐酸盐、硫酸、甲苯磺酸和柠檬酸。除其他外,这些盐和相应的晶型已在申请人的国际申请号pct/us2017/037872中进行了描述,将其通过引用以其整体并入本文。
制剂中化合物1或其药学上可接受的盐的量取决于诸如目标治疗、给药方案、和实际赋形剂等因素。然而,制剂中化合物1或其药学上可接受的盐的示例性范围包括按重量计约10%至约50%、约10%至约30%、约15%至约35%、约15%至约30%、和约15%以及约25%。
在一些优选的实施方案中,制剂中的活性成分是化合物1的甲磺酸盐(即化合物2)。
在一个实施方案中,本发明提供了包含指定为形式2a的甲磺酸盐的晶型的药物制剂,其具有x射线粉末衍射图,所述x射线粉末衍射图包含使用cukα辐射测量的以下2θ值:12.6°±0.2°、15.5°±0.2°、17.9°±0.2°、22.1°±0.2°、和25.2°±0.2°。晶型2a具有以下特征中的一种或多种:
(a)x射线粉末衍射图,其包含使用cukα辐射测量的以下2θ值中的两个或更多个:11.1°±0.2°、13.8°±0.2°、14.7°±0.2°、16.7°±0.2°、19.3°±0.2°、20.9°±0.2°、23.2°±0.2°、和25.8°±0.2°;
(b)如通过差示扫描量热法测量的,约233.3℃起始温度和/或约238.1℃峰值温度的熔点;
(c)基本上如图1中描绘的x射线粉末衍射图;
(d)基本上如图2中描绘的差示扫描量热热谱图;和/或
(e)基本上如图3中描绘的热重分析热谱图。
在另一个实施方案中,本发明提供了包含指定为形式2b的甲磺酸盐晶型的药物制剂,其特征在于具有以下特征中的一项或多项:
(a)x射线粉末衍射图,其包含使用cukα辐射测量的以下2θ值中的三个或更多个:9.7°±0.2°、12.8°±0.2°、15.7°±0.2°、18.2°±0.2°、20.3°±0.2°、25.1°±0.2°、25.6°±0.2°、和26.8°±0.2°;
(b)基本上如图4a和图4b中描绘的x射线粉末衍射图;
(c)基本上如图6中描绘的差示扫描量热(dsc)热谱图;和/或
(d)具有基本上如图5中描绘的热重分析热谱图。
本发明的制剂包括一种或多种药学上可接受的赋形剂。赋形剂的非限制性例子包括填充剂、粘结剂、崩解剂、润滑剂、表面活性剂、ph调节剂、或来自这些的任何组合。在一些实施方案中,赋形剂包括选自填充剂、粘结剂、崩解剂和润滑剂的一种或多种成员。制剂中一种或多种赋形剂的量的范围为按重量计约10%至约98%,包括所有子范围。一种或多种赋形剂的量的例子包括按重量计约1%、约5%、约10%、约15%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、和约95%。
合适的填充剂包括但不限于乳糖一水合物、无水乳糖、蔗糖、右旋糖、甘露醇、山梨醇、淀粉、预胶凝淀粉、纤维素(特别是微晶纤维素)、二水磷酸二钙或无水磷酸二钙、磷酸钙、碳酸钙、和硫酸钙。每种填充剂按重量计占制剂的从约15%至约70%、从约15%至约60%、从约15%至约50%、从约20%至约60%、或从约20%至约50%。在一些实施方案中,填充剂包括作为第一填充剂的微晶纤维素和选自以下的第二填充剂:乳糖一水合物、无水乳糖、蔗糖、右旋糖、甘露醇、山梨醇、淀粉、预胶凝淀粉、二水磷酸二钙或无水磷酸二钙、磷酸钙、碳酸钙、和硫酸钙。
合适的粘结剂包括但不限于阿拉伯胶、纤维素衍生物(例如甲基纤维素、羧甲基纤维素、羟丙基甲基纤维素、羟丙基纤维素、羟乙基纤维素)、明胶、葡萄糖、右旋糖、木糖醇、聚甲基丙烯酸酯、聚乙烯吡咯烷酮、山梨醇、淀粉、黄芪胶、苍耳烷树脂、藻酸盐、硅酸镁-铝、聚乙二醇(peg)、和膨润土。每种粘结剂按重量计占制剂的从约1%至约50%、从约5%至约50%、从约10%至约50%、从约5%至约30%、或从约5%至约20%。
合适的崩解剂包括但不限于淀粉、预胶凝淀粉、羟丙基淀粉、羟基乙酸淀粉钠、羧甲基纤维素钠、交联羧甲基纤维素钠、藻酸盐、硅酸铝、交联聚维酮、和低取代羟丙基纤维素。每种崩解剂按重量计占制剂的从约1%至约10%、从约1%至约7%、从约1%至约5%、或从约2%至约4%。在一些实施方案中,崩解剂由一种、两种、三种或四种选自以下的成员组成:淀粉、预胶凝淀粉、羟丙基淀粉、羟基乙酸淀粉钠、羧甲基纤维素钠、交联羧甲基纤维素钠、藻酸盐、硅酸铝、交联聚维酮、和低取代羟丙基纤维素。
合适的润滑剂包括但不限于硬脂酸镁、硬脂酸钙、滑石(“滑石粉”)、聚乙二醇(“peg”)、环氧乙烷聚合物、月桂基硫酸钠、月桂基硫酸镁、油酸钠、硬脂酰富马酸钠、和二氧化硅。每种润滑剂按重量计占制剂的从约1%至约10%、从约1%至约7%、从约1%至约5%、或从约2%至约4%。在一些实施方案中,润滑剂由一种、两种、三种或四种选自以下的成员组成:硬脂酸镁、硬脂酸钙、滑石(“滑石粉”)、聚乙二醇(“peg”)、环氧乙烷聚合物、月桂基硫酸钠、月桂基硫酸镁、油酸钠、硬脂酰富马酸钠、和二氧化硅。在一些实施方案中,制剂基本上不含月桂基硫酸钠。
在一个实施方案中,有时优选的,制剂中药学上可接受的赋形剂包含微晶纤维素、磷酸二钙、羟基乙酸淀粉钠、二氧化硅、和硬脂酸镁。
在一个实施方案中,有时优选的,制剂中药学上可接受的赋形剂基本上由微晶纤维素、磷酸二钙、羟基乙酸淀粉钠、二氧化硅、和硬脂酸镁组成。此类型制剂的具体例子是基本上在实施例3和表1中描述的制剂1。
在一个实施方案中,有时优选的,制剂中药学上可接受的赋形剂包括微晶纤维素、乳糖一水合物、月桂基硫酸钠、交联羧甲基纤维素钠、二氧化硅、和硬脂酸镁。
在一个实施方案中,有时优选的,制剂中药学上可接受的赋形剂基本上由微晶纤维素、乳糖一水合物、月桂基硫酸钠、交联羧甲基纤维素钠、二氧化硅、和硬脂酸镁组成。此类型制剂的具体例子是基本上在实施例4和表2中描述的制剂2。
本发明的剂型的例子包括胶囊、片剂、小袋或颗粒粉末。单位剂型包含例如约1mg至约1000mg的化合物1或其药学上可接受的盐。单位剂型中化合物1或其药学上可接受的盐的量的非限制性例子包括约1mg、约5mg、约7.5mg、约10mg、约25mg、约35mg、约40或约50mg。剂型可以包含一种或多种单位剂型。
如本文所使用的,术语“甲磺酸盐(methanesulfonicacidsalt)”、“甲磺酸盐(methanesulfonatesalt)”、“甲磺酸盐(mesylatesalt)”等可互换使用。它们是指具有通式1·meso3h的酸加成盐,即化合物2。优选地,所述盐包含摩尔比为1:1或摩尔比基本为1:1的化合物1和甲磺酸。然而,如本领域技术人员将理解的,所述比率可以是或可以不是准确的1:1;因此,在1与meso3h之间的比率在1:0.8至1:1.2范围内的这种类型的加成盐应视为1·meso3h的盐,其比率优选控制在1:0.9至1:1.1,并且更优选控制在1:0.95至1:0.5的比率。如本领域技术人员还将理解的,化合物1和甲磺酸以任何比率共存可能形成甲磺酸盐,即化合物2,但取决于比率;化合物1或酸可以分别部分地以游离碱或游离酸的形式存在。
取决于晶型和生成晶型的溶剂,化合物1的甲磺酸盐可处于溶剂化物的形式,即含有不同量的溶剂分子,例如水(水合物)、甲醇、thf等。所有这些盐形式或溶剂化物形式可以基本上使用本文公开的方法配制,并且它们全部被本发明涵盖。
制剂的治疗用途
另一方面,本发明提供了一种治疗与egfr活性相关的疾病或障碍的方法,所述方法包括将包含根据本文公开的任何实施方案的化合物1的甲磺酸盐的药物制剂给予至对其有需要的受试者。
在一些实施方案中,所述疾病或障碍与一种或多种egfr突变体相关。
在一些实施方案中,所述一种或多种egfr突变体选自l858r激活型突变体l858r、dele746-a750、g719s;外显子19缺失激活型突变体;以及t790m抗性突变体。
在一些实施方案中,所述疾病或障碍是癌症。
在一些实施方案中,所述癌症选自脑癌、肺癌、肾癌、骨癌、肝癌、膀胱癌、头颈癌、食管癌、胃癌、结肠癌、直肠癌、乳腺癌、卵巢癌、黑色素瘤、皮肤癌、肾上腺癌、宫颈癌、淋巴瘤、和甲状腺瘤、或其并发症。
在一些实施方案中,所述癌症是脑癌或肺癌。
在一些实施方案中,所述癌症是转移性脑癌。
如国际申请号pct/us2017/032066中所公开的(将其通过引用以其整体并入本文),化合物1可用于治疗脑癌,包括转移性脑癌。因此,本发明的制剂特别可用于治疗患有这些病症的患者。用于这些治疗用途的特别有用的制剂包括本文公开的制剂1和制剂2。
在一些实施方案中,治疗疾病或障碍的方法的任何实施方案与给予患者第二治疗剂组合使用。
在一些实施方案中,所述第二治疗剂是化学治疗剂。
在一些实施方案中,所述第二治疗剂是不同的egfr调节剂。
另一方面,本发明提供了在受试者中抑制egfr突变体的方法,所述方法包括使患者的生物样品与根据本文公开的任何实施方案的制剂接触。
另一方面,本发明提供了根据本文公开的任何实施方案的制剂在制备用于治疗与egfr活性相关的疾病或障碍的药物中的用途。
在这方面的一些实施方案中,所述疾病或障碍是选自以下的癌症及其并发症:脑癌、肺癌、肾癌、骨癌、肝癌、膀胱癌、头颈癌、食管癌、胃癌、结肠癌、直肠癌、乳腺癌、卵巢癌、黑色素瘤、皮肤癌、肾上腺癌、宫颈癌、淋巴瘤、和甲状腺瘤。
在这方面的一些实施方案中,所述疾病或障碍是脑癌或肺癌。
在一些实施方案中,本发明的制剂可用于延迟疾病或障碍的发作,或在可能易患疾病、障碍和/或病症但尚未被诊断为患有所述疾病、障碍和/或病症的受试者中预防疾病、障碍和/或病症的发生。
本发明的另一方面提供了根据本文公开的任何实施方案(如基本上描述和展示)的制剂的制备过程方法。
药物制剂可以按单位剂型存在,每单位剂量包含预定量的活性成分。通常,将本公开文本的药物制剂以每天约1次至约5次或可替代地以连续输注来给药。这样的给予可以用作慢性或急性疗法。可与载体材料组合产生单一剂型的活性成分的量将根据所治疗的病症、病症的严重程度、给药时间、给药途径、所用化合物的排泄速率、治疗持续时间、以及患者的年龄、性别、体重和病症而变化。优选的单位剂量制剂是包含日剂量或亚剂量(如上文所述的)或其适当分数的活性成分的那些。通常,以基本上小于化合物最佳剂量的小剂量开始治疗。此后,以小增量增加剂量,直到达到各种情况下的最佳效果。通常,将化合物以通常可以提供有效的结果而不会引起实质性有害或有害副作用的浓度水平最理想地给药。
当本公开文本的制剂包含化合物1的晶型或其药学上可接受的盐与一种或多种(优选一种或两种)另外的治疗剂或预防剂的组合时,化合物1和另外的药剂两者的剂量水平通常以单一疗法中正常给药剂量的约10%至150%之间、并且更优选约10%与80%之间存在。
药物制剂可适于通过任何合适的途径给药,例如,通过口服(包括颊或舌下)、直肠、鼻、局部(包括颊、舌下或透皮)、阴道或肠胃外(包括皮下、皮内、肌内、关节内、滑膜内、胸骨内、鞘内、病灶内、静脉内或皮内注射或输注)途径。这样的制剂可以通过药学领域已知的任何方法来制备,例如通过将活性成分与一种或多种载体或赋形剂缔合。口服给药或注射给药是优选的。
适于口服给药的药物制剂可以按以下形式存在:离散单位例如胶囊或片剂;粉末或颗粒;在水性或非水性液体中的溶液或悬浮液;可食用的泡沫或搅打成的食品(whip);或水包油型液体乳液或油包水型乳液。
例如,为了以片剂或胶囊形式口服给药,可以将活性药物成分与口服、无毒的药学上可接受的惰性载体如乙醇、甘油、水等组合。通过将化合物粉碎至合适的细小尺寸并与类似粉碎的药物载体例如可食用的碳水化合物(作为例如淀粉或甘露醇)混合来制备粉末。也可以存在调味剂、防腐剂、分散剂和着色剂。
通过如上所述制备粉末混合物并填充形成的明胶壳来制备胶囊。在填充操作之前,可以将助流剂和润滑剂(例如硅溶胶、滑石、硬脂酸镁、硬脂酸钙或固体聚乙二醇)添加到粉末混合物中。还可以添加崩解剂或增溶剂,例如琼脂、碳酸钙或碳酸钠,以提高摄入胶囊后药物的利用率。
片剂是例如通过以下来配制:制备粉末混合物、造粒或重压(slugging),添加润滑剂和崩解剂,并压制成片剂。粉末混合物是例如通过以下来制备:将适当粉碎的化合物与如上所述的稀释剂或碱,以及任选地与粘结剂(例如羧甲基纤维素、藻酸盐、凝胶、或聚乙烯吡咯烷酮)、溶液阻滞剂(例如石蜡)、吸收促进剂(如季盐)和/或以及吸收剂(例如膨润土、高岭土或磷酸二钙)混合。可以通过用诸如糖浆、淀粉糊、acadia胶水、或纤维素材料或聚合物材料的溶液等粘结剂润湿并强制通过筛网来对粉末混合物制粒。作为制粒的替代方法,可以使粉末混合物运行通过压片机,结果是未完美形成的小块破碎成颗粒。可以通过添加硬脂酸、硬脂酸盐、滑石或矿物油来润滑颗粒,以防止粘附在片剂成型模具上。然后将润滑的混合物压制成片剂。也可以将本公开文本的化合物与自由流动的惰性载体组合并直接压制成片剂,而无需经历制粒或重压步骤。可以提供由虫胶的密封包衣、糖或聚合物材料的包衣、以及蜡的抛光包衣组成的透明或不透明的保护包衣。可以将染料添加到这些包衣中以区分不同的单位剂量。
适当时,可以将用于口服给药的剂量单位制剂微囊化。所述制剂还可以例如通过将微粒材料包覆或包埋在聚合物、蜡等中来制备以延长或维持释放。
以下非限制性实施例进一步说明了本发明的某些方面。
实施例实施例1
化合物1的制备
n-(2-(2-(二甲氨基)乙氧基)-4-甲氧基-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺(1)
步骤1。将4-(2-(二甲氨基)乙氧基)-6-甲氧基-n-1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)苯-1,3二胺(a,按照国际申请号pct/us15/65286制备;1当量,16.8g,26.2mmol)在thf(550ml)和水(120ml)中的溶液冷却至0-5℃。经30分钟滴加丙烯酰氯(1.0当量,3.3ml)。2小时后,经10分钟添加另外的丙烯酰氯(0.4ml),并将混合物搅拌1h。添加naoh(2当量,2.8g,68.0mmol),并将混合物搅拌30分钟,然后部分浓缩以除去thf。将水相用二氯甲烷(900ml)萃取,并将有机相用na2so4干燥,并浓缩。将粗产物通过柱色谱(硅胶;二氯甲烷/meoh,80:1至20:1的梯度)纯化,得到化合物1(14.0g),如果需要,可以根据步骤2进一步纯化。
步骤2。经5分钟向如步骤1中制备的化合物1(1当量,22.5g,46.3mmol)在850mlthf的溶液中添加naoh(9g溶解在203mlh2o中)。将混合物在搅拌下加热至60℃持续50分钟,然后冷却至10℃-20℃,并经20分钟添加1nhcl(180ml)。分离各层,并将水相用二氯甲烷(2×400ml)萃取。将有机相合并,干燥(na2so4)并浓缩。将粗产物通过柱色谱(硅胶;20:1的二氯甲烷/meoh)纯化,得到固体,将其溶于二氯甲烷/庚烷(2:3)中,然后浓缩,得到19.5g的呈结晶固体的化合物1。1hnmr(400mhz,cd3od)δppm2.42(s,6h),2.80(brt,j=5.0hz,2h),3.98(s,3h),3.92(s,3h),4.21(brt,j=5.0hz,2h),5.79(dd,j=10.2,1.4hz,1h),6.39(dd,j=16.9,1.4hz,1h),6.64(dd,j=16.9,10.2hz,1h),6.83(s,1h),7.15-7.30(m,3h),7.46(d,j=7.6hz,1h),8.16-8.30(m,2h),8.52(s,1h),9.29(s,1h).
实施例2
甲磺酸盐(化合物2,晶型2a和2b)的制备
n-(2-(2-(二甲氨基)乙氧基)-4-甲氧基-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺甲磺酸盐(1:1(2)
向100mg化合物1(游离碱)在4mlthf中的溶液中添加21.7mg甲磺酸在0.164ml水中的溶液,并将溶液在室温下搅拌过夜。通过以8000rpm离心5分钟来分离沉淀物。在30℃下真空干燥过夜后,获得60mg甲磺酸盐,晶型2a。1hnmr(400mhz,cd3od)δppm2.73(s,3h),3.06(s,6h),3.65-3.72(m,2h),3.94(s,3h),4.00(s,3h),4.54-4.60(m,2h),5.86(brd,j=10.0hz,1h),6.40-6.48(m,1h),6.56-6.66(m,1h),6.98(s,1h),7.20-7.34(m,3h),7.50(d,j=8.0hz,1h),8.11(brd,j=6.0hz,1h),8.35(brd,j=7.8hz,1h),8.42(s,1h),8.50(brs,1h).c28h34n6o6s的分析计算值(anal.calcd.):c,57.72;h,5.88;n,14.42;o,16.47;s,5.50。实验值:c,57.76;h,5.85;n,14.45;o,16.34;s,5.60;c27h30n6o3·1.0ch3so3h。
形式2a为米色结晶粉末;并且其xrpd图示于图1中。它显示出双折射性,并且具有起始温度为233.3℃的熔点,在差示扫描量热法(dsc)分析(图2)中在熔点之前重量损失约0.40%,并且在热重分析(tga)(图3)中从170℃至210℃重量损失约0.035%。
通过浆料、溶剂-热加热/冷却、反溶剂沉淀、固体加热-冷却和研磨方法对形式2a进行了多晶型筛选研究。通过在室温下使用二噁烷作为反溶剂从水溶液中沉淀获得一种新的晶型,形式2b。形式2b可以是形式2a的水合物形式,并且与形式2a相比显示更低的结晶度、更低的熔点和更高的重量损失。形式2b的xrpd、tga-ms和dsc分析分别显示在图4、5和6中。在本申请中,晶型2a由于其明显的优异稳定性(但不旨在进行限制)已用于制备甲磺酸盐(化合物2)的制剂。
实施例3
甲磺酸盐(2)的制剂1的制备
将微晶纤维素(392.43mg)、磷酸二钙(735.35mg)、羟基乙酸淀粉钠(45.09mg)、二氧化硅(15.03mg)和硬脂酸镁(15.03mg)合并并用涡旋混合器按表1所示的量和比例共混。将所得混合物通过#35网目筛过滤,得到混合物a。将混合物a的20.05mg部分与5.0mg的晶型2a的1·ms(c27h30n6o3·1.06ch3so3h,纯度=100%)在40ml玻璃小瓶中合并,并用涡旋混合器充分共混,得到制剂1,其理论组成如表1所计算出的。
将所有样品在温度-20℃、50℃、以及在40℃/75%相对湿度的稳定性室内储存2周和4周时间,并进行稳定性分析。将封闭皿的样品盖上盖并用封口膜(parafilm)密封。将开口皿的样品用被针孔刺穿的铝箔覆盖。
表1.1ms的制剂1的组分。
实施例4
甲磺酸盐(2)的制剂2的制备
通过与上述基本类似的程序制备和分析化合物2的制剂2。将微晶纤维素(545.23mg)、乳糖一水合物(495.71mg)、月桂基硫酸钠(7.51mg)、交联羧甲基纤维素钠(42.58mg)、二氧化硅(14.19mg)和硬脂酸镁(14.19mg)合并并用涡旋混合器按表1所示的量和比例共混。在此实施例中,晶型2a用于制备所有样品。将所得混合物通过#35网目筛过滤,得到混合物b。将混合物b的18.65mg部分与5.0mg的晶型2a的1·ms(c27h30n6o3·1.06ch3so3h,纯度=100%)在40ml玻璃小瓶中合并,并用涡旋混合器充分共混,得到制剂1,其理论组成如表2所计算出的。将所有样品在温度-20℃、50℃、以及在40℃/75%相对湿度的稳定性室内储存2周和4周时间,并进行稳定性分析。
表2.1ms的制剂2的组分。
实施例5
甲磺酸盐的制剂1的稳定性测试
达到室温后,将每个样品添加到40ml样品小瓶中,所述样品小瓶含10ml稀释剂(h2o中0.05%tfa:mecn=1:1v/v),并在偶尔摇动下声处理10分钟。将所有样品在14,000rpm下离心10分钟,并通过hplc分析上清液。将工作标准溶液(在10ml稀释剂中的5mg1·ms)用作参考。制剂1的结果显示在表3中,其中纯度以相对于总相关物质(trs)的百分比(%)测量。如表1和图7至9所示,制剂1在延长的时期内是稳定的。在50℃或在40℃/75%相对湿度的四周时间内未观察到制剂中化合物1的降解。
表3.1·ms和制剂1的稳定性
*trs=总相关物质。
本领域技术人员将理解,在不脱离本发明的精神的情况下,可以做出许多和各种修改。因此,应当理解,本文所述的本发明的各种实施例和实施方案仅是示例性的,并不旨在限制本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!