柔性起搏器及基于柔性起搏器的生物电监测方法与流程
本公开涉及医疗器械技术领域,尤其涉及一种柔性起搏器及基于柔性起搏器的生物电监测方法。
背景技术
起搏器是在需要的时候向组织发出微小的电脉冲设备,包括心脏起搏器、脑起搏器等。
脑起搏器是一种通过在人脑内植入刺激电极,通过体外遥感控制装置调控脑内刺激电极的刺激参数,控制和改善患者病症的医疗器械,广泛用于癫痫、原发性震颤、帕金森等疾病的治疗。
目前,脑起搏器有中枢型、周围型和分离型三种类型。中枢型脑起搏器与周围型脑起搏器均需要在人体胸大肌以下植入脉冲发射仪,导线经皮下到达颅内或迷走神经,将一对刺激电极植入颅内或迷走神经。而分离型脑起搏器仅需在颅内植入内电极,而外电极、导线和脉冲发射仪都置于体外,在内外电极之间传播脉冲电信号,实现脑起搏。
中枢型脑起搏器和周围型脑起搏器的植入人体内的脉冲发射仪由电池供电,当电池电量耗尽需手术取出更换,增加手术风险和成本。对于入体材料要求非常高,脑起搏器的高材料成本导致其价格昂贵。
分离型脑起搏器的设计有效避免了上述弊端,大幅度缩小了植入物的尺寸。对小尺寸的植入电极,低频电磁波进行信号传递时与人体组织的相互作用,使电磁波能量的传输效率大幅度降低,因此,小尺寸植入电极需要较高的电磁波能量,存在对起搏器周围脑组织造成不可逆损伤的潜在风险。
技术实现要素:
有鉴于此,本公开提出了一种柔性起搏器及基于柔性起搏器的生物电监测方法,能够使柔性植入物与体内组织紧密贴合,在治疗过程中对局部区域能够精确的实现无源无线的起搏。
根据本公开的一方面,提出了一种柔性起搏器,包括:
柔性植入物,所述柔性植入物被植入体内,所述柔性植入物包括超声波转换模块、电极、连接超声波转换模块和电极的导线、以及柔性封装材料;
超声换能器,用于向所述柔性植入物发射超声波;
其中,所述柔性封装材料用于封装所述超声波转换模块和导线;
所述超声波转换模块用于接收所述超声波,并将所述超声波转换成电信号,将所述电信号通过导线传输到电极。
在一种可能的实现方式中,所述超声波转换模块为压电陶瓷模块,所述压电陶瓷模块包括声阻匹配层、电极层以及压电陶瓷层;
其中,所述声阻匹配层位于所述柔性封装材料和压电陶瓷层之间,用于柔性封装材料和压电陶瓷层间的声阻匹配;
所述电极层位于所述声阻匹配层和压电陶瓷层之间,所述电极层通过所述导线连接所述电极,用于将所述压电陶瓷层产生的所述电信号通过所述导线传输给所述电极。
在一种可能的实现方式中,所述压电陶瓷层的两侧分别依次设置有电极层、声阻匹配层和柔性封装材料。
在一种可能的实现方式中,所述导线具有可延展性。
在一种可能的实现方式中,所述导线为波浪形,或者,
所述导线包括延展单元,所述延展单元包括两段交叉的导线。
在一种可能的实现方式中,所述两段交叉的导线为波浪形或直线形导线。
在一种可能的实现方式中,所述电极的一部分被所述柔性封装材料封装,所述电极未被封装的一部分与体内组织接触。
在一种可能的实现方式中,所述柔性封装材料厚度小于2mm。
在一种可能的实现方式中,所述柔性起搏器包括多个所述柔性植入物,所述超声换能器为相控阵超声换能器。
根据本公开的另一方面,提出了一种基于柔性起搏器的生物电监测方法,所述柔性起搏器为上文所述的柔性起搏器,所述柔性植入物被植入体内,所述电极与体内组织贴合,所述方法包括:
监测所述柔性植入物发射的超声波;
对所述超声波进行分析确定体内异常区域。
通过利用柔性材料作为基底封装超声波转换模块和导线,可以实现柔性植入物与体内组织的良好贴合;利用超声换能器产生的超声波作用于柔性植入物的超声波转换模块,能够降低能量传输过程中的损耗,减少了周围组织的损伤,无源无线的设计避免大体积植入物及手术更换电源,降低手术成本及风险。
根据下面参考附图对示例性实施例的详细说明,本公开的其它特征及方面将变得清楚。
附图说明
包含在说明书中并且构成说明书的一部分的附图与说明书一起示出了本公开的示例性实施例、特征和方面,并且用于解释本公开的原理。
图1示出了根据本公开一实施例的柔性起搏器的结构示意图;
图2示出了根据本公开一实施例的柔性起搏器的超声波转换模块的结构示意图;
图3示出了根据本公开一实施例的柔性起搏器的导线的平面结构示意图;
图4示出了根据本公开一实施例的柔性起搏器的导线的平面结构示意图;
图5示出了根据本公开一实施例的柔性起搏器的导线的平面结构示意图;
图6示出了根据本公开一实施例的柔性起搏器的单点刺激的结构示意图;
图7示出了根据本公开一实施例的柔性起搏器的多点刺激的结构示意图;
图8示出了根据本公开一实施例的一种基于柔性起搏器的生物电监测方法的流程图。
具体实施方式
以下将参考附图详细说明本公开的各种示例性实施例、特征和方面。附图中相同的附图标记表示功能相同或相似的元件。尽管在附图中示出了实施例的各种方面,但是除非特别指出,不必按比例绘制附图。
在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
另外,为了更好的说明本公开,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本公开同样可以实施。在一些实例中,对于本领域技术人员熟知的方法、手段、元件和电路未作详细描述,以便于凸显本公开的主旨。
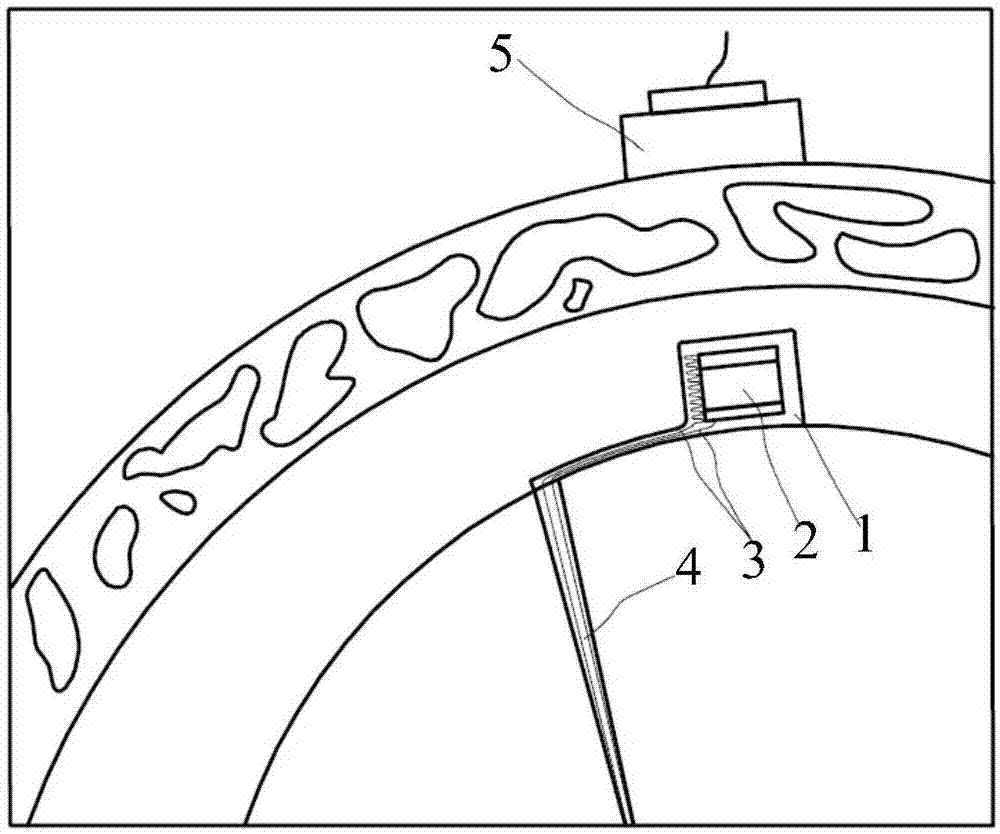
图1示出根据本公开一实施例的柔性起搏器的结构示意图。柔性起搏器可以用于大脑起搏,还可以应用于患者的其它的部位,比如心脏等。本公开下文的实施例中将以脑起搏为例进行说明。
如图1所示,该柔性起搏器可以包括:柔性植入物和超声换能器5,其中,
柔性植入物被植入体内,柔性植入物可以包括超声波转换模块2、电极4、连接超声波转换模块2和电极4的导线3、以及柔性封装材料1;
超声换能器5,用于向柔性植入物发射超声波;
柔性封装材料1用于封装所述超声波转换模块2和导线3;
超声波转换模块2用于接收所述超声波,并将所述超声波转换成电信号,将所述电信号通过导线3传输到电极4。
其中,所述超声换能器5可以将输入的电功率转换成机械功率(即超声波)再传递出去,相比于电磁波具有更好的方向性且不易对组织产生损伤,能够提高能量传输效率。
超声换能器5可以位于体外,例如可以通过固定部件固定在脑部外侧。在一种可能的实现方式中,超声换能器5可以被设置在脑部外侧上、与柔性植入物相对的位置,这样,超声换能器5发射的超声波可以更准确的向柔性植入物传输能量,进一步提高能量传输效率。将超声换能器5设置在体外可以避免大体积植入物,降低手术成本及风险。
超声波转换模块2可以将超声波的机械信号转换成电信号,例如,可以转换成脉冲电信号,导线3可以将脉冲电信号传输给电极4,电极4可以对周围的组织(例如,脑神经细胞)释放电信号刺激。
在一种可能的实现方式中,超声波转换模块2可以通过压电材料(比如压电陶瓷、压电晶体或者压电聚合物等)将机械能转换成电信号。
在一种可能的实施方式中,柔性封装材料1可以由具有良好生物相容性的柔性材料(例如硅橡胶等)制成。在一定范围内能够产生形变,例如:弯曲、折叠、扭转、压缩或拉伸等,柔性封装材料1的弯曲刚度与人体组织相近,其最小弯曲半径可达2mm。柔性封装材料1的平面尺寸较小,可以仅为数平方毫米,柔性封装材料1的厚度可以小于2mm,柔性封装材料1的平面尺寸以及厚度可以根据实际应用的需求进行设置。
柔性封装材料1可以包裹超声波转换模块2和导线3,由于柔性材料的可延展性,使得柔性植入物可以与周围组织良好贴合。
电极4可以采用不易被腐蚀或降解的材料制成,例如,铂及其合金等。电极4的前端可以形成为平滑的结构,避免对周围组织造成损伤。通过利用柔性材料作为基底封装超声波转换模块2和导线3,可以实现柔性植入物与脑组织的良好贴合;利用超声换能器5产生的超声波作用于柔性植入物的超声波转换模块2,能够降低能量传输过程中的损耗,减少了周围脑组织的损伤,无源无线的设计避免大体积植入物及手术更换电源,降低手术成本及风险。
在一种可能的实现方式中,所述电极的一部分被所述柔性封装材料封装,所述电极未被封装的一部分与体内组织接触。
例如:电极远离导线的一端未被柔性封装材料封装,电极未被封装部分的长度可以根据需要与电极接触的组织的情况确定,这样,在保证电极可以对组织产生有效刺激的同时,使得电极可以更紧密的贴合组织,精确的实现对局部区域的电极刺激,降低对周围组织的损伤。
图2示出了根据本公开一实施例的柔性起搏器的超声波转换模块的结构示意图。
在一种可能的实现方式中,如图2所示,超声波转换模块2可以为压电陶瓷模块,压电陶瓷模块可以包括声阻匹配层21、电极层22以及压电陶瓷层23。
其中,声阻匹配层21可以位于柔性封装材料1和压电陶瓷层23之间,用于柔性封装材料1和压电陶瓷层23间的声阻匹配。电极层22可以位于声阻匹配层21和压电陶瓷层23之间,电极层22可以通过导线3连接电极4,用于将压电陶瓷层23产生的电信号通过导线3传输给电极4。
其中,所述声阻匹配层21可以改变柔性封装材料1和压电陶瓷层23之间的阻抗关系,减少柔性封装材料1和压电陶瓷层23的声阻抗的差值。电极层极薄,在超声传播过程中对超声波的影响可忽略不计。这样,在超声换能器发射的超声波从柔性封装材料1向压电陶瓷层23传输时,几乎全透射,无反射,可以减少超声波在柔性封装材料1和压电陶瓷层23之间传输时的损耗。
压电陶瓷层23可以由具有压电特性的电子陶瓷材料组成,能够将超声波的机械能转化为电信号。例如,压电陶瓷层23可以在超声波的作用下在压电陶瓷层23的相对的两个表面(例如,与电极层接触的表面)上产生正负相反的电荷,电极层22可以将正负相反的电荷通过导线输出到电极4。
电极层22可以与压电陶瓷层23紧密接触,能够输出压电陶瓷层23产生的电信号。例如,电极层22可以与压电陶瓷层23产生正负电荷的相对的两个表面紧密接触,分别通过与电极层22连接的导线导出压电陶瓷层23的相对的两个表面上产生的正负电荷,通过柔性植入物的导线3输出到电极4,实现起搏。
在一种可能的实现方式中,如图2所示,压电陶瓷层23的两侧可以分别依次设置有电极层22、声阻匹配层21和柔性封装材料1。
通过本实施例的超声波转换模块可以减少超声波在柔性封装材料1和压电陶瓷层23之间传输时的损耗,对称式的设置能够将压电陶瓷层23产生的正负电荷经电极层22导出,经柔性植入物的导线3传输到电极4,降低超声波在传输过程中的能量损耗。
图3、图4和图5分别示出了根据本公开一实施例的柔性起搏器的导线的平面结构示意图。其中,导线是由能够导电的金属材料制成,用于传导电信号,例如:铜、铝等。
在一种可能的实现方式中,为了保证柔性植入物与体内组织(例如,大脑皮层等)的完全贴合、以及柔性植入物的可延展性,连接超声波转换模块2和电极4的导线3可以具有可延展性。
在一个示例中,如图3所示,导线3的形状可以呈s形,或者波浪形。
在另一个示例中,如图4或图5所示,导线3可以包括延展单元,每一个延展单元可以包括两段交叉的导线3。
如图4所示,延展单元的两段交叉的导线3可以为直线形导线,两段交叉的直线形导线3可以形成“x”形的延展单元,交叉的角度可以根据实际需要设置,本公开对交叉的角度不作限定。
如图5所示,延展单元的两段交叉的导线3可以为波浪形导线,两段交叉的波浪形(s形)导线可以形成花瓣状(双s型)的延展单元,同样的,交叉的角度可以根据实际需要设置,本公开对交叉的角度不作限定。
在一种可能的实现方式中,柔性植入物可以包括多条波浪形导线、或者多个延展单元,多条波浪形导线或者多个延展单元可以离散分布在电路板上形成导线区域。离散分布可以是指相邻的导线或者延展单元之间可以存在一定的延展空间,保证导线的延展性。
如图3所示,三条波浪形导线并排分布在电路板上形成的第一导线区域31,导线与导线之间不接触;图3中的32为第一导线区域31的边界的示意。
如图4所示为多个“x”形的延展单元形成的第二导线区域33的一个示例,多个“x”形的延展单元还可以呈两排分布,两排之间的延展单元不接触,每一排中的延展单元互相连接,等等。图4中的34为第二导线区域33的边界的示意。
如图5所示为多个双“s”形的延展单元形成的第三导线区域35的一个示例,图5中的36为第三导线区域35的边界的示意。
需要说明的是,图4和图5仅仅是本公开延展单元的一些示例,延展单元还可以是其他形状,比如“米”字形等,只要形成的导线具有可延展性,保证柔性植入物与体内组织(例如,大脑皮层等)的完全贴合、以及柔性植入物的可延展性即可。通过本公开实施例的导线3良好的可延展性,能够保证柔性植入物与体内组织良好贴合,使柔性植入物能够更好的适应体内组织的形状,从而提高起搏器的可靠性。
根据体内需要刺激的部位的大小、分布情况等可以在体内植入一个或多个柔性植入物,分别实现单点刺激和多点刺激。也就是说,柔性起搏器可以包括一个或多个柔性植入物。
图6示出了根据本公开一实施例的柔性起搏器的单点刺激的结构示意图。
在一种可能的实现方式中,如图6所示,可以在体内(例如,大脑皮层等)植入单个柔性植入物,超声换能器5位于与柔性植入物相对应的身体外侧上,超声换能器5向柔性植入物发送超声波,通过柔性植入物的单一电极精确刺激体内异常区域。例如,超声换能器5产生超声波,作用于植入颅内的柔性植入物的超声波转换模块2,超声波转换模块2将超声波转化为脉冲电信号,导线3传输脉冲电信号给单一电极4,通过单一电极4刺激脑内异常区域,实现脑起搏。
在一种可能的实现方式中,所述超声换能器5可以采用普通超声探头,例如,双晶探头、直探头等。
通过单点刺激方式,能够实现体内(例如,大脑皮层等)某一个区域异常放电时,准确的向柔性植入物发送超声波,有效的刺激异常区域,实现起搏。
图7示出了根据本公开一实施例的柔性起搏器的多点刺激的结构示意图。
在一种可能的实现方式中,如图7所示,可以在体内(例如,大脑皮层等)植入多个柔性植入物,所述多个柔性植入物可以是如图7所示的紧密排列在一起,还可以比较分散的分布在体内的不同位置,多个柔性植入物的植入方式可依据体内(例如,大脑皮层等)异常区域的位置设定,对此,不作一一限定。
这种情况下,超声换能器5可以为相控阵超声换能器。相控阵超声换能器可以位于人体外侧上,相控阵超声换能器可以向多个柔性植入物中的部分或全部发送超声波。例如,可以调整相控阵超声换能器的发射参数(比如:角度、深度、超声波强度等),精确的刺激体内多处异常放电区域的相应的多个柔性植入物的超声波转换模块2,实现多点刺激下的体内起搏。
通过多点刺激方式,能够实现体内(例如,大脑皮层等)多个区域异常放电时,同时有效的刺激异常区域相应的多个柔性植入物的超声波转换模块释放电信号,实现体内多处异常放电区域的起搏,提高刺激的效率。
通过本公开实施例的两种起搏方式,能够根据异常放电区域,选择合理的刺激方式,精确刺激电极,实现起搏,提高起搏效率。
图8示出了根据本公开一实施例的一种基于柔性起搏器的生物电监测方法的流程图。其中,图8所示的方法可以是基于上文所述的柔性起搏器,生物电可以为生物体在生命活动过程中释放的电信号,例如:脑电、心电等。本公开的实施例中将以脑电监测为例进行说明。
如图8所示,该生物电监测方法可以包括:
步骤s11,监测所述柔性植入物发射的超声波。
在一种可能的实现方式中,通过手术将柔性植入物植入颅内,柔性植入物的电极4能够与脑组织直接接触并良好贴合。当颅内脑部异常放电时,电极4将采集到的电信号通过导线3传输至压电陶瓷模块,压电陶瓷模块在接收到的电信号的作用下,能够产生相应的超声波。
步骤s12,对所述超声波进行分析确定体内异常区域。
在一种可能的实现方式中,利用体外超声波探测装置采集分析压电陶瓷模块产生的超声波,实现对生物电信号的异常监测。例如,体外超声波探测装置检测到颅内释放的电信号(脑电信号),分析电信号,以确定颅内异常放电区域,实现对脑电信号的异常监测。
通过监测所述柔性植入物发射的超声波,对所述超声波进行分析确定体内异常放电区域,实现对生物电的异常监测,通过体外的超声换能器对异常放电区域对应的柔性植入物发射超声波,能够精确的刺激异常放电区域,实现起搏。
该柔性起搏器仅需一次手术植入颅内,,既可以精确的对异常放电区域起搏,又可实现对生物电信号的异常监测,提高患者的生存质量。
需要说明的是,以上关于柔性起搏器在脑起搏领域的应用仅仅是本公开的一个示例,本公开不限于此,根据患者的需要还可以为将柔性起搏器用于其它部位,不一一列举。
以上已经描述了本公开的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。本文中所用术语的选择,旨在最好地解释各实施例的原理、实际应用或对市场中的技术改进,或者使本技术领域的其它普通技术人员能理解本文披露的各实施例。
- 还没有人留言评论。精彩留言会获得点赞!