TOLL样受体激动剂与免疫效应细胞的联用的制作方法
本发明属于免疫治疗领域;涉及具有靶向识别肿瘤抗原或病原体抗原的免疫效应细胞和toll样受体激动剂的联合应用。
背景技术
近年来,基因工程化的免疫细胞越来越多的应用于肿瘤治疗领域或者感染性疾病治疗领域,如嵌合抗原受体修饰的t细胞(car-t细胞)、嵌合抗原受体修饰的nk细胞(car-nk细胞)、tcr修饰的t细胞(tcr-t)等。
但由于肿瘤微环境的复杂性,在肿瘤治疗特别是实体瘤治疗中,免疫效应细胞在体内通常不能较好的发挥抗肿瘤作用。
技术实现要素:
本发明目在于提供一种toll样受体激动剂和免疫效应细胞联合应用在肿瘤、传染病及其他免疫相关性疾病的治疗中的用途。toll样受体激动剂能够增加免疫效应细胞的功效。
在本发明的第一方面,提供了包含免疫效应细胞和所述免疫效应细胞增效剂的组合物,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述免疫效应细胞增效剂为toll样受体激动剂。
具体地,本发明提供了包含免疫效应细胞的组合物,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述免疫效应细胞与在具有与肿瘤抗原或病原体抗原的表达相关的疾病的受试者的治疗中增加所述免疫效应细胞的功效的作用剂组合使用,其中:
(i)所述受体具有胞外区、跨膜区和胞内区,其中,胞外区具有抗原结合结构域,所述抗原结合结构域结合至与该疾病相关的肿瘤抗原或病原体抗原;
(ii)增加免疫效应细胞功效的所述作用剂为toll样受体激动剂。
在优选的实施方案中,所述受体的胞内区具有参与引发免疫细胞活化的结构域。
在优选的实施方案中,所述toll样受体激动剂为toll样受体3(tlr3)激动剂。
在优选的实施方案中,所述的tlr3激动剂选自天然或合成的双链核糖核酸。
在一优选例中,所述的tlr3激动剂为聚肌苷酸胞苷酸(poly(i:c))。
在一优选例中,所述的tlr3激动剂为错配的双链核糖核酸poly(i:c11-14u),示例性的,如poly(i:c12u)、poly(i:c13u)。
在优选的实施方案中,所述的识别肿瘤抗原或病原体抗原受体包括嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。
在一优选例中,所述嵌合抗原受体包括:
(i)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(ii)特异性结合所述抗原的抗体、cd28的跨膜区、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(iii)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域。
在优选的实施方案中,所述的tfp包括:(a)tcr亚基,所述tcr亚基包括tcr部分胞外结构域,跨膜结构域,和tcr胞内结构域,所述胞内结构域包括刺激信号传导结构域;(b)抗原结合结构域,所述tcr亚基和所述抗原结合结构域有效连接,所述tcr亚基的胞外、跨膜和胞内信号结构域来源于cd3ε或cd3γ,所述tfp整合进t细胞上表达的tcr。
在优选的实施方案中,所述的tac包括:(a)胞外结构域:所述胞外结构域包括具有抗原结合结构域和与cd3结合的单链抗体;(b)跨膜区;(c)胞内结构域,所述胞内结构域连接蛋白激酶lck。
在优选的实施方案中,所述的免疫效应细胞选自t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞或骨髓源性吞噬细胞。
在一优选例中,所述的免疫细胞为t细胞,所述的受体的胞内域能引发t细胞的活化。
在另一优选例中,所述的免疫效应细胞还表达其他外源性蛋白,优选的,所述外源性蛋白选自下组:flt3l、干扰素、白介素、白介素受体、pd-1抑制剂(如pd-1的抗体)、pd-l1抑制剂(如pd-l1的抗体、可溶性的pd-1、或者含有可溶性的pd-1的蛋白)、或其组合。
在另一优选例中,所述组合物还包括mdsc抑制剂、和/或免疫检查点抑制剂。
在另一优选例中,所述mdsc抑制剂选自下组:抗gr1抗体、环氧化酶-2抑制剂、前列腺素类干细胞因子抑制剂,巨噬细胞集落刺激因子抑制剂、粒单核细胞集落刺激因子抑制剂、血管内皮细胞生长因子抑制剂、或其组合。
在另一优选例中,所述免疫检查点抑制剂选自下组:pd-1抑制剂(如pd-1的抗体)、pd-l1抑制剂(如pd-l1的抗体)、ctla-4抑制剂(如ctla-4抗体)、或其组合。
在另一优选例中,所述的免疫效应细胞是tcr敲除或者pd-1敲除的t细胞。
在另一优选例中,所述的免疫效应细胞中的tcr基因或pd-1基因的表达是被沉默的。
在另一优选例中,所述“基因的表达是被沉默的”指被沉默基因不表达或低表达。
在另一优选例中,所述“低表达”指所述免疫效应细胞被沉默基因表达量g1与正常t细胞相应基因表达量g0的比值,即g1/g0≤0.5,较佳地g1/g0≤0.3,更佳地≤0.2,更佳地≤0.1,最佳地为0。
在本发明的第二方面,还提供了免疫效应细胞和免疫效应细胞增效剂的组合在制备抗肿瘤药物或抗病原体药物或抗免疫力低下的药物中的用途,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述免疫效应细胞增效剂是toll样受体激动剂。
具体地,本发明提供toll样受体激动剂和免疫效应细胞的组合在制备抗肿瘤药物或抗病原体药物或抗免疫力低下的药物中的用途,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,该受体具有胞外区、跨膜区和胞内区,所述的胞外区具有结合所述的肿瘤抗原或病原体抗原的抗原结合结构域。
在优选的实施方案中,所述toll样受体激动剂为toll样受体3(tlr3)激动剂,所述的tlr3激动剂优选自天然或合成的双链核糖核酸。
在一优选例中,所述的tlr3激动剂为聚肌苷酸胞苷酸(poly(i:c))。
在一优选例中,所述的tlr3激动剂为错配双链核糖核酸,示例性的,如poly(i:c12u)、poly(i:c13u)。
在一优选例中,所述错配双链核糖核酸的量足以与toll样受体3(tlr3)结合并且减少或消除所述受试对象中的所述肿瘤或其它转化细胞的增殖。
在优选的实施方案中,所述toll样受体激动剂对所述免疫效应细胞具有协同作用。
在优选的实施方案中,所述toll样受体激动剂和所述免疫效应细胞的给药方式为非胃肠道给药,优选静脉注射和瘤内注射;从而所述toll样受体激动剂和所述免疫效应细胞可制备成非胃肠道给药,优选静脉注射和瘤内注射给药的药物。
在优选的实施方案中,所述toll样受体激动剂和所述免疫效应细胞的给药方式可以相同,也可以不同。
在优选的实施方案中,给药方法为共同给予所述toll样受体激动剂和所述免疫效应细胞,或者先给予所述免疫效应细胞,再给予所述toll样受体激动剂;或者先给予所述toll样受体激动剂,再给予所述免疫效应细胞。
在一优选例中,所述的给药方法为先给予所述免疫效应细胞,再给予所述toll样受体激动剂。
在优选的实施方案中,所述的肿瘤抗原选自egfrviii、gpc3、cld18a2、cd19、cd20、cd22、cd30、wt1、cldn6、muc1、bcma、il-11ra、il-13ra、fap。
在优选的实施方案中,所述toll样受体激动剂给药量可以是1mg/kg~4mg/kg,优选2mg/kg~3mg/kg,更优的选自2.08mg/kg-2.77mg/kg。
在优选的实施方案中,所述toll样受体激动剂的给药次数为2~4次,优选2-3次。
在优选的实施方案中,所述的免效应疫细胞选自t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞或骨髓源性吞噬细胞,优选t细胞。
在一优选例中,所述的免疫效应细胞为t细胞,所述的受体的胞内域能引发t细胞的活化。
在优选的实施方案中,所述的识别肿瘤抗原或病原体抗原受体包括嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。
在优选的实施方案中,所述的免疫效应细胞选自表达car的t细胞、表达tcr的t细胞、表达car的nk细胞,表达tfp的t细胞、表达tfp的nk细胞、表达tac的t细胞、表达tac的nk细胞。
在一优选例中,所述嵌合抗原受体(car)包括:
(i)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(ii)特异性结合所述抗原的抗体、cd28的跨膜区、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(iii)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域。
在优选的实施方案中,所述的tfp包括:(a)tcr亚基,所述tcr亚基包括tcr部分胞外结构域,跨膜结构域,和tcr胞内结构域,所述胞内结构域包括刺激信号传导结构域;(b)抗原结合结构域,所述tcr亚基和所述抗原结合结构域有效连接,所述tcr亚基的胞外、跨膜和胞内信号结构域来源于cd3ε或cd3γ,所述tfp整合进t细胞上表达的tcr。
在优选的实施方案中,所述的tac包括:(a)胞外结构域:所述胞外结构域包括具有抗原结合结构域和与cd3结合的单链抗体;(b)跨膜区;(c)胞内结构域,所述胞内结构域连接蛋白激酶lck。
在优选的实施方案中,所述的免疫效应细胞还表达有其他蛋白,优选的,如pd1、pdl1的抗体、i型干扰素等。
在另一优选例中,所述药物还包括mdsc抑制剂或免疫检查点抑制剂。
在另一优选例中,所述mdsc抑制剂选自下组:抗gr1抗体、环氧化酶-2抑制剂、前列腺素类干细胞因子抑制剂,巨噬细胞集落刺激因子抑制剂、粒单核细胞集落刺激因子抑制剂、血管内皮细胞生长因子抑制剂、或其组合。
在另一优选例中,所述免疫检查点抑制剂选自下组:pd-1抑制剂(如pd-1的抗体)、pd-l1抑制剂(如pd-l1的抗体)、ctla-4抑制剂(如ctla-4抗体)、或其组合。
在本发明的第三方面,还提供了免疫效应细胞、免疫效应细胞增效剂和淋巴细胞清除剂的组合在制备抗肿瘤或抗病原体或抗免疫力低下的药物中的用途。
在优选的实施方式中,在将免疫效应细胞和免疫效应细胞增效剂给予有此需要的对象之前,先给予淋巴细胞清除剂。
在优选的实施方式中,所述免疫效应细胞增效剂是toll样受体激动剂。
具体地,本发明还提供了免疫效应细胞、toll样受体激动剂和淋巴细胞清除剂的组合在制备抗肿瘤药物或抗病原体药物或抗免疫力低下的药物中的用途,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,该受体具有胞外区、跨膜区和胞内区,所述的胞外区具有结合所述的肿瘤抗原或病原体抗原的抗原结合结构域。
在优选的实施方式中,在给予toll样受体激动剂和免疫效应细胞之前,先给予淋巴细胞清除剂。
在优选的实施方式中,所述淋巴细胞清除剂包括清除淋巴细胞的药物或者进行辐射处理。在一优选例中,清除淋巴细胞的药物包括但不限于氟达拉滨和/或环磷酰胺。
在优选的实施方式中,将toll样受体激动剂和免疫效应细胞给予有此需要的对象包括同时给予或顺次给予;例如,先给予toll样受体激动剂再给予免疫效应细胞,或者先给予免疫效应细胞再给予toll样受体激动剂;更优选地,先给予免疫效应细胞再给予toll样受体激动剂。
在本发明的第四方面,还提供了治疗肿瘤或病原体感染或免疫力低下的方法,所述方法包括:将免疫效应细胞和免疫效应细胞增效剂的组合给予有此需要的对象;或者
将免疫效应细胞、免疫效应细胞增效剂和淋巴细胞清除剂的组合给予有此需要的对象,其中,在将免疫效应细胞和免疫效应细胞增效剂给予有此需要的对象之前,先给予淋巴细胞清除剂。
具体地,本发明提供治疗肿瘤或病原体感染或免疫力低下的方法,所述方法包括:
将免疫效应细胞和toll样受体激动剂的组合给予有此需要的对象,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,该受体具有胞外区、跨膜区和胞内区,所述的胞外区具有结合所述的肿瘤抗原或病原体抗原的抗原结合结构域;或者
将免疫效应细胞、toll样受体激动剂和淋巴细胞清除剂的组合给予有此需要的对象。
在优选的实施方案中,所述toll样受体激动剂为toll样受体3(tlr3)激动剂,所述的tlr3激动剂优选自天然或合成的双链核糖核酸。
在一优选例中,所述的tlr3激动剂为聚肌苷酸胞苷酸(poly(i:c))。
在一优选例中,所述的tlr3激动剂为错配双链核糖核酸,示例性的,如poly(i:c12u)、poly(i:c13u)。
在一优选例中,所述错配双链核糖核酸的量足以与toll样受体3(tlr3)结合并且减少或消除所述受试对象中的所述肿瘤或其它转化细胞的增殖。
在优选的实施方案中,所述toll样受体激动剂对所述免疫效应细胞具有协同作用。
在优选的实施方式中,将toll样受体激动剂和免疫效应细胞给予有此需要的对象包括同时给予或顺次给予;例如,先给予toll样受体激动剂再给予免疫效应细胞,或者先给予免疫效应细胞再给予toll样受体激动剂;更优选地,先给予免疫效应细胞再给予toll样受体激动剂。
本发明第五方面提供了一种组合物产品,其特征在于,包括:
(i)第一药物组合物,所述第一药物组合物包括至少一种免疫效应细胞增效剂,所述免疫效应细胞增效剂包括toll样受体激动剂;和药学上可接受的载体;
(ii)第二药物组合物,所述第二药物组合物包括免疫效应细胞,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体;和药学上可接受的载体;和
(iii)第三药物组合物,所述第三药物组合物包括mdsc抑制剂或免疫检查点抑制剂;和药学上可接受的载体。
在另一优选例中,所述第一药物组合物、第二药物组合物、第三药物组合物是混合或独立存在的。
在另一优选例中,所述的第一药物组合物、第二药物组合物和第三药物组合物的总含量为70~100wt%,较佳地为80~100wt%,更佳地为90~100wt%,按所述组合物产品的总重量计。
在另一优选例中,所述免疫效应细胞的给药量为1×106-1×1012细胞/kg,更佳地,1×107-1×1010细胞/kg。
在另一优选例中,所述mdsc抑制剂选自下组:抗gr1抗体、环氧化酶-2抑制剂、前列腺素类干细胞因子抑制剂,巨噬细胞集落刺激因子抑制剂、粒单核细胞集落刺激因子抑制剂、血管内皮细胞生长因子抑制剂、或其组合。
在另一优选例中,所述免疫检查点抑制剂选自下组:pd-1抑制剂(如pd-1的抗体)、pd-l1抑制剂(如pd-l1的抗体)、ctla-4抑制剂(如ctla-4抗体)、或其组合。
在另一优选例中,所述组合物产品是用于治疗肿瘤或病原体感染或免疫力低下的药物组合物。
在另一优选例中,所述的组合物的剂型包括注射剂型、外用药物剂型和口服剂型。
在另一优选例中,所述组合物可以通过皮下注射、静脉注射、肌内注射的方式给药。
在另一优选例中,所述口服剂型包括片剂、胶囊剂、膜剂、和颗粒剂。
在另一优选例中,所述组合物的剂型包括缓释型剂型、和非缓释型剂型。
本发明第六方面提供了一种本发明第五方面所述的组合物产品的用途,用于制备抗肿瘤药物或抗病原体药物或抗免疫低下的药物。
在另一优选例中,所述组合物产品中,所述免疫效应细胞增效剂的给药量可以是1mg/kg~4mg/kg,优选2mg/kg~3mg/kg,更优的选自2.08mg/kg-2.77mg/kg。
在另一优选例中,所述组合物产品中,所述免疫效应细胞的给药量为1×106-1×1012细胞/kg,更佳地,1×107-1×1010细胞/kg。
在另一优选例中,所述组合物产品中,所述mdsc抑制剂的给药量为2mg/kg-5mg/kg,较佳地,2mg/kg-4mg/kg。
在另一优选例中,所述组合物产品中,所述免疫效应细胞增效剂的给药次数为2~4次,优选2-3次。
在另一优选例中,所述组合物产品中,所述免疫效应细胞的给药次数为2~4次,优选2-3次。
在另一优选例中,所述组合物产品中,所述mdsc抑制剂的给药次数为为2~4次,优选2-3次。
本发明第七方面提供了一种提高免疫效应细胞活力的方法,其特征在于,包括步骤:
给需要的对象施用(i)免疫效应细胞;(ii)免疫效应细胞增效剂;和/或(iii)任选的mdsc抑制剂或免疫检查点抑制剂,其中所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述免疫效应细胞增效剂为toll样受体激动剂。
在另一优选例中,所述对象包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物和灵长目动物,优选小鼠、大鼠、兔、猴。
在另一优选例中,所述组分(i)、组分(ii)、组分(iii)同时或先后施用。
在另一优选例中,与单独施用免疫效应细胞相比,施用(i)免疫效应细胞;(ii)免疫效应细胞增效剂;和(iii)任选的mdsc抑制剂或免疫检查点抑制剂的抑瘤率提高了≥20%,较佳地,≥30%。
在另一优选例中,与单独施用免疫效应细胞相比,施用(i)免疫效应细胞;(ii)免疫效应细胞增效剂;和(iii)任选的mdsc抑制剂或免疫检查点抑制剂的干扰素释放水平提高了≥20%,较佳地,≥30%,更佳地,≥50%。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
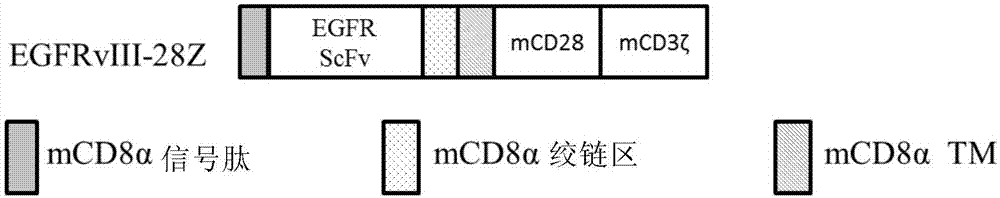
图1是重组逆转录病毒载体egfrviii-28z结构示意图。
图2是逆转录病毒感染小鼠t淋巴细胞效率。
图3是egfrviii-28zcar-t细胞体外杀伤功能检测。
图4a是显示了小鼠乳腺癌模型中egfrviii-28zcar-t细胞与polyi:c体内抗肿瘤作用;图4b显示了小鼠乳腺癌模型中egfrviii-28zcar-t细胞与polyi:c体内抗肿瘤实验结束后的肿瘤重量;图4c显示了小鼠乳腺癌模型中egfrviii-28zcar-t细胞与polyi:c体内抗肿瘤实验结束后外周血的ifnγ水平;图4d显示了抗肿瘤实验结束小鼠乳腺癌模型的脾脏和肿瘤中的car-t细胞拷贝数。
图5a是小鼠结肠癌模型中egfrviii-28zcar-t细胞与polyi:c的体内抗肿瘤作用;图5b显示了小鼠结肠癌模型中egfrviii-28zcar-t细胞与polyi:c体内抗肿瘤实验结束后的肿瘤重量;图5c显示了小鼠结肠癌模型中egfrviii-28zcar-t细胞与polyi:c体内抗肿瘤实验结束后外周血的ifnγ水平;图5d显示了抗肿瘤实验结束小鼠结肠癌模型的脾脏和肿瘤中的car-t细胞拷贝数。
图6是mscv-egfrviii-28z-flt3l的质粒图。
图7显示了egfrviii-28z-flt3lcar-t+polyi:c细胞在小鼠结肠癌模型中的作用。
图8a显示了i型干扰素被封闭后肠癌移植瘤的生长情况;图8b显示了i型干扰素被封闭后肠癌移植瘤的肿瘤重量。
图9a显示了i型干扰素被封闭后乳腺癌移植瘤的生长情况;图9b显示了i型干扰素被封闭后乳腺癌移植瘤的肿瘤重量。
图10显示了使用mdsc抑制剂、cart细胞和polyi:c在小鼠肿瘤模型中随时间对肿瘤体积影响的对比图(图10a)、肿瘤体重(图10b)以及肿瘤照片对比图(图10c)。
具体实施方式
为了克服现有技术中的缺陷,本发明进行了深入的研究,提供了(a)tlr激动剂和(b)嵌合抗原受体以及(c)任选的mdsc抑制剂和/或免疫检查点抑制剂联合应用肿瘤、传染病及其他免疫相关性疾病的治疗方法,具有显著优异的提高机体免疫力,杀伤肿瘤或病原体的能力。
术语
如本文所用,术语“增加免疫效应细胞功效的所述作用剂”、“免疫效应细胞增效剂”可互换使用,均指增强免疫效应细胞功效的药物或制剂。
本文采用的科技术语具有与本领域技术人员常规理解的相同或相似的含义。为便于理解本发明,一些术语定义如下。
当涉及可测量值比如给药量等时,包括指定值的±20%,或在某些情况下±10%,或在某些情况下±5%,或在某些情况下±1%,或在某些情况下±0.1%的变化,因此这样的变化适于进行所公开的方法。
术语,所述的“免疫效应细胞(在本文中也称免疫细胞)”,是指参与免疫应答,例如,促进免疫效应子应答的细胞。免疫效应细胞的实例包括t细胞、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞和骨髓源性吞噬细胞。例如,t细胞可以是直接来自外周血的t细胞、也可以是t细胞的亚型,如cd8+的t细胞,cd4+的t细胞,α/β的t细胞、γ/δt细胞等。
本文所用的“嵌合抗原受体”或“car”是指一组多肽,当其在免疫效应细胞中时,给所述的细胞提供针对靶细胞(通常是癌细胞)的特异性,并且具有细胞内信号产生。car通常包括至少一个细胞外抗原结合结构域、跨膜结构域(也称跨膜区)和细胞质信号传导结构域(本文中也称为“胞内区”),其包括来源于如下定义的刺激性分子和/或共刺激性分子的功能信号传导结构域。在某些方面,多肽组彼此邻接。多肽组包括在存在二聚化分子时可以使多肽彼此偶联的二聚化开关,例如,可以使抗原结合结构域偶联至胞内信号传导结构域。在一个方面,刺激性分子为与t细胞受体复合体结合的ζ链。在一个方面,细胞质信号传导结构域进一步包括一种或多种来源于至少一个如下定义的共刺激性分子的功能性信号传导结构域。在一个方面,共刺激性分子选自本文所述共刺激性分子,例如4-1bb(即,cd137)、cd27和/或cd28。在一个方面,car包括嵌合融合蛋白,该融合蛋白包含细胞外抗原结合结构域、跨膜结构域和包含来源于刺激性分子的功能性信号传导结构域的胞内信号传导结构域。在一个方面,car包含嵌合融合蛋白,该融合蛋白包含细胞外抗原结合结构域、跨膜结构域和包含来源于共刺激性分子的功能性信号传导结构域和来源于刺激性分子的功能性信号传导结构域的胞内信号传导结构域。在一个方面中,car包含嵌合融合蛋白,该融合蛋白包含细胞外抗原结合结构域、跨膜结构域和包含来源于一个或更多个共刺激性分子的两个功能性信号传导。
术语,所述的“信号传导结构域”是指通过在细胞内传递信息而起作用的蛋白质的功能性部分,用来通过产生第二信使或通过响应这样的信使起效应物作用经由确定的信号传导途径调节细胞的活性。
所述的“t细胞(抗原)受体(tcellreceptor,tcr)”,为所有t细胞表面的特征性标志,以非共价键与cd3结合,形成tcr—cd3复合物。tcr的作用是识别抗原。tcr是由两条不同肽链构成的异二聚体,由α、β两条肽链组成,每条肽链又可分为可变区(v区),恒定区(c区),跨膜区和胞质区等几部分;其特点是胞质区很短。tcr分子属于免疫球蛋白超家族,其抗原特异性存在于v区;v区(vα、vβ)又各有三个高变区cdr1、cdr2、cdr3,其中以cdr3变异最大,直接决定了tcr的抗原结合特异性。在tcr识别mhc-抗原肽复合体时,cdr1,cdr2识别和结合mhc分子抗原结合槽的侧壁,而cdr3直接与抗原肽相结合。tcr分为两类:tcr1和tcr2;tcr1由γ和δ两条链组成,tcr2由α和β两条链组成。任一t细胞只表达tcr2和tcr1之一。
所述的“t细胞融合蛋白(tcellfusionprotein,tfp)”,p包括构成tcr的各种多肽衍生的重组多肽,其能够i)结合到靶细胞上的表面抗原,和ii)与完整的tcr复合物的其他多肽相互作用,通常同定位在t细胞表面。tfp由一个tcr亚基与人或人源化抗体结构域组成的一个抗原结合结构域组成,其中,tcr亚基包括至少部分tcr胞外结构域、跨膜结构域、tcr胞内结构域的胞内信号结构域的刺激结构域;该tcrtcr亚基和该抗体结构域有效连接,其中,tcr亚基的胞外、跨膜、胞内信号结构域来源于cd3ε或cd3γ,并且,该tfp整合进t细胞上表达的tcr。
所述的“有效链接”指的是一个调控序列和异源核酸序列之间的功能联系,其能导致异源核酸序列的表达。例如,当第一核酸序列位于第二核酸序列功能调控区时,第一核酸序列可操作地与第二核酸序列连接。例如,如果需要启动子影响编码序列的转录和表达,那么这个启动子可有效地与该编码序列连接。可链接的dna序列可以互相邻接的,例如,可以将两个蛋白编码区放在同一个阅读框里。
所述的“t细胞抗原耦合器(tcellantigencoupler,tac)”,包括三个功能结构域:肿瘤靶向结构域,包括单链抗体、设计的锚蛋白重复蛋白(designedankyrinrepeatprotein,darpin)或其他靶向基团2;为胞外区结构域,与cd3结合的单链抗体,从而使得tac受体与其他tcr受体靠近;跨膜区和cd4共受体的胞内区,其中,胞内区连接蛋白激酶lck,催化tcr复合物的免疫受体酪氨酸活化基序(itams)磷酸化作为t细胞活化的初始步骤。
所述的“toll样受体”(tlr)是指结合至病原体相关分子模式(pamp)并且促进哺乳动物中的免疫应答的受体家族的成员。已知10种哺乳动物tlr,例如tlr1-10。术语“toll样受体激动剂”(tlr激动剂)是指与tlr相互作用并刺激所述受体活性的分子。合成的tlr激动剂是设计为与tlr相互作用并刺激所述受体活性的化合物。tlr激动剂的实例包括tlr-7激动剂、tlr-3激动剂或tlr-9激动剂。
所述的“toll样受体3(tlr3)是toll样受体家族成员之一,它能够特异性识别病毒的双链rna及其类似物poly(i:c)。dsrna为具有可在病毒复制循环期间形成的两个互补链的rna。在识别时,tlr3诱发转录因子如nf-κb和干扰素调节因子3(irf3)的活化以提高向其他细胞发出信号以增加其抗病毒防御的i型干扰素的产生。已有研究表明,体内多种免疫细胞包括nk细胞、巨噬细胞、树突状细胞以及t细胞中均可表达tlr3。而poly(i:c)作为tlr3的激动剂,能够促进b细胞的生长增殖及抗原呈递功能。另外,tlr3的激动剂也能够促进树突细胞(dc)细胞成熟,是树突细胞成熟剂。
所述的“聚肌苷酸聚胞苷酸(poly(i:c))”(在本申请文件中,与polyi:c具有同等含义,在附图中的pic也代指poly(i:c)),中文为聚肌肝,是合成的dsrna的类似物,为具有高达例如3,600,000道尔顿的mw分布的双链rna分子。poly(i:c)作为tlr3的激动剂,能够促进b细胞的生长增殖及抗原呈递功能。并且,在无特异性抗原刺激的情况下,tlr3激动剂poly(i:c)能够直接诱导b细胞产生igg1κ抗体。其抗肿瘤作用主要依赖于cd8+t细胞和nk细胞,并能协调诱导dc细胞、巨噬细胞/中性粒细胞、nk细胞和t细胞等多种免疫细胞分泌i型干扰素,共同促进抗肿瘤效应。
术语“树突细胞(dendriticcell,dc)”源自骨髓中的祖细胞,作为未成熟细胞迁移到外周组织,在那里它们内吞抗原并进行复杂的成熟过程。抗原经由很多表面分子被内吞,包括补体受体(例如,cd11c/cd18)和内吞受体(例如,dec-205、dc-sign和toll样受体)。在抗原获得过程中,未成熟dc也接受例如细菌细胞壁脂多糖(lps)的病原体相关分子形式的“危险信号”,或者经由例如ifn-γ的细胞因子的炎性刺激。然后dc迁移到次级淋巴器官,成熟成为感受态apc。受体例如cd11c/cd18、dec-205、dc-sign和toll样受体在ag捕获和递呈过程中扮演关键角色,并且主要表达在dc上。
术语“树突细胞成熟剂”是指诱导未成熟dc细胞成熟为感受态apc的物质,包括选自下组或其组合:sting激动剂;tlr激动剂诸如热灭活的或经福尔马林处理的卡介苗(bcg),优选bcg的细胞壁成分、bcg衍生的脂阿拉伯甘露聚糖或bcg成分;自大肠杆菌衍生的脂多糖(lps);溶链菌制剂(picibanil)(ok432)或灭活的革兰氏阳性或革兰氏阴性微生物;咪唑喹啉化合物,优选咪唑喹啉-4-胺化合物,特别是4-氨基-2-乙氧基甲基-x-二甲基-1h-咪唑[4,5-c]喹啉-1-乙醇或1-(2-甲基丙基)-1h-咪唑[4,5-c]喹啉-4-胺,或其衍生物;合成的双链多核糖核苷酸,优选多聚i:c;天然的双链rna或rna病毒或rna片段、或合成的类似物、或包含未甲基化的cpg基序的合成的或天然的核酸分子;细胞因子组合,优选肿瘤坏死因子α(tnf-α)、干扰素γ(ifn-γ)、、il-1、il-6、il-12或前列腺素e6、cd40l,优选重组cd40l或包含cd40l域的融合蛋白;或遗传工程化改造成表达cd40l的原代细胞或细胞系,或在生理学上上调cd40l表达的活化t淋巴细胞诸如t淋巴细胞;2-hydroxypropyl-β-cyclodextrin(hp-β-cd)[参考文献:frontimmunol.2016oct20;7:435.ecollection2016]、galectin(gal)-9[参考文献jimmunol.2005sep1;175(5):2974-81]。
术语,所述的“肿瘤”指的是一种以细胞或组织的病理性增生为特征的疾病,及其随后的迁移或侵袭其他组织或器官。肿瘤生长通常是不受控制的和进行性的,不诱导或抑制正常细胞增殖。肿瘤可影响多种细胞、组织或器官,包括但不限于选自膀胱、骨、脑、乳腺、软骨、神经胶质细胞、食管、输卵管、胆囊、心脏、肠、肾、肝、肺、淋巴结、神经组织、卵巢、胰腺、前列腺、骨骼肌、皮肤、脊髓、脾、胃、睾丸、胸腺、甲状腺、气管、尿道、输尿管、尿道、子宫、阴道器官,或组织或相应的细胞。肿瘤包括癌症,如肉瘤,癌,或浆细胞瘤(浆细胞的恶性肿瘤)。本发明所述的肿瘤,可包括,但不限于白血病(如急性白血病、急性淋巴细胞白血病、急性髓细胞性白血病,急性粒细胞白血病,急性早幼粒细胞白血病、急性粒-单核细胞白血病、急性单核细胞白血病、急性白血病、慢性白血病、慢性粒细胞白血病、慢性淋巴细胞白血病、真性红细胞增多症),淋巴瘤(霍奇金病、非霍奇金病)、原发性巨球蛋白血症,重链病,实体瘤如肉瘤和癌症(如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、脊索瘤、内皮肉瘤、淋巴管肉瘤、血管肉瘤、淋巴管内皮肉瘤,滑膜vioma,间皮瘤,尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、癌、支气管癌、髓样癌、肾细胞癌、肝癌,尼罗河管癌,绒癌、精原细胞瘤、胚胎癌、肾母细胞瘤、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、髓母细胞瘤,颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤,听神经瘤,少突胶质瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤、视网膜母细胞瘤)、食管癌、胆囊癌、肾癌、多发性骨髓瘤。较佳地,所述的“肿瘤”包括但不限于:胰腺癌、肝癌、肺癌、胃癌、食管癌、头颈部鳞状细胞癌、前列腺癌、结肠癌、乳腺癌、淋巴瘤、胆囊癌、肾癌、白血病、多发性骨髓瘤、卵巢癌、宫颈癌和胶质瘤。
术语,所述的“肿瘤抗原”是指全部地或以片段形式(例如mhc/肽)在肿瘤细胞表面上被表达的分子(通常为蛋白质、碳水化合物或脂质),并且其用于将药理学作用剂优先靶向肿瘤细胞。肿瘤抗原可以为由正常细胞和癌细胞表达的标记物,例如谱系标记物例如在b细胞上的cd19;肿瘤抗原也可以为在癌细胞中与正常细胞相比过表达的细胞表面分子,例如与正常细胞相比1倍过表达、2倍过表达、3倍或以上过表达;肿瘤抗原也可以为癌细胞中被不适当地合成的细胞表面分子,例如,与正常细胞上被表达的分子相比含有缺失、添加或突变的分子;肿瘤抗原也可以全部或以片段形式(例如,mhc/肽)被专一性地表达在癌细胞的细胞表面上,而不是在正常细胞的表面上合成或表达。在某些实施方式中,本发明的car包括包含结合mhc呈递肽的抗原结合结构域(例如,抗体或抗体片段)的car。通常,来源于内源蛋白质的肽填充主要组织相容性复合体(mhc)的i类分子的口袋,并且被cd8+t淋巴细胞上的t细胞受体(tcrs)识别。mhci类复合体由全部有核细胞组成型表达。在肿瘤中,病毒特异性和/或肿瘤特异性肽/mhc复合体代表免疫疗法的独特类型的细胞表面靶点。
肿瘤抗原包括但不限于:促甲状腺激素受体(tshr);cd171;cs-1(cd2子集1,cracc,slamf7,cd319,和19a24);c型凝集素样分子-1(cll-1);神经节苷脂gd3(aneu5ac(2-8)aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);tn抗原(tnag);cd19;cd20;cd22;cd30;cd70;cd123;cd138;cd33;cd44;cd44v7/8;cd38;cd44v6;b7h3(cd276),b7h6;kit(cd117);白介素13受体亚单位α(il-13ra);白介素11受体α(il-11ra);前列腺干细胞抗原(psca);前列腺特异性膜抗原(psma);癌胚抗原(cea);ny-eso-1;hiv-1gag;mart-1;gp100;酪氨酸酶;间皮素;epcam;蛋白酶丝氨酸21(prss21);血管内皮生长因子受体,血管内皮生长因子受体2(vegfr2);路易斯(y)抗原;cd24;血小板衍生生长因子受体β(pdgfr-β);阶段特异性胚胎抗原-4(ssea-4);细胞表面相关的粘蛋白1(muc1),muc6;表皮生长因子受体家族及其突变体(egfr,egfr2,erbb3,erbb4,egfrvii);神经细胞粘附分子(ncam);碳酸酐酶ix(caix);蛋白酶体(prosome,macropain)亚基,β型,9(lmp2);肝配蛋白a型受体2(epha2);岩藻糖基gm1;唾液酸基路易斯粘附分子(sle);神经节苷脂gm3(aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer;tgs5;高分子量黑素瘤相关抗原(hmwmaa);邻乙酰基gd2神经节苷脂(oacgd2);叶酸受体;肿瘤血管内皮标记1(tem1/cd248);肿瘤血管内皮标记7相关的(tem7r);claudin6(cldn6),claudin18.2、claudin18.1;asgpr1;cdh16;5t4;8h9;αvβ6整合素;b细胞成熟抗原(bcma);ca9;κ轻链(kappalightchain);cspg4;egp2,egp40;fap;far;fbp;胚胎型achr;hla-a1,hla-a2;magea1,mage3;kdr;lambda;mcsp;nkg2d配体;psc1;ror1;sp17;survivin;tag72;tem1;纤连蛋白;腱生蛋白;肿瘤坏死区的癌胚变体;g蛋白偶联受体c类5组,成员d(gprc5d);x染色体开放阅读框61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);聚唾液酸;胎盘特异性1(plac1);globohglycoceramide的己糖部分(globoh);乳腺分化抗原(ny-br-1);uroplakin2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺素受体β3(adrb3);pannexin3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合物,基因座k9(ly6k);嗅觉受体51e2(or51e2);tcrγ交替阅读框蛋白(tarp);肾母细胞瘤蛋白(wt1);ets易位变异基因6,位于染色体12p(etv6-aml);精子蛋白17(spa17);x抗原家族,成员1a(xage1);血管生成素结合细胞表面受体2(tie2);黑素瘤癌睾丸抗原-1(mad-ct-1);黑素瘤癌睾丸抗原-2(mad-ct-2);fos相关抗原1;p53突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;细胞凋亡的黑素瘤抑制剂(ml-iap);erg(跨膜蛋白酶,丝氨酸2(tmprss2)ets融合基因);n-乙酰葡糖胺基转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期蛋白b1;v-myc鸟髓细胞瘤病病毒癌基因神经母细胞瘤衍生的同源物(mycn);ras同源物家族成员c(rhoc);细胞色素p4501b1(cyp1b1);ccctc结合因子(锌指蛋白)样(boris);由t细胞识别的鳞状细胞癌抗原3(sart3);配对盒蛋白pax-5(pax5);proacrosin结合蛋白sp32(oytes1);淋巴细胞特异性蛋白酪氨酸激酶(lck);a激酶锚定蛋白4(akap-4);滑膜肉瘤,x断点2(ssx2);cd79a;cd79b;cd72;白细胞相关免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar);白细胞免疫球蛋白样受体亚家族成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素结构域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);含有egf样模块粘蛋白样激素受体样2(emr2);淋巴细胞抗原75(ly75);磷脂酰肌醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);免疫球蛋白λ样多肽1(igll1)。在具体的实施方案中,肿瘤抗原可以但不限于为egfrviii、gpc3、cld18a2、cd19、cd20、cd22、cd30、wt1、cldn6、muc1、bcma、il-11ra、il-13ra、fap。
术语,所述的“病原体”是指能够引起疾病的原生动物,包括:病毒、细菌、真菌或寄生虫。所述的“病毒抗原”是指病毒表达的,能够诱导免疫反应的多肽。
正如本文中使用的那样,术语“抗体”是指源于特异性地结合抗原的免疫球蛋白分子的蛋白质或多肽序列。抗体可以为多克隆的或单克隆的、多链或单链、或完整的免疫球蛋白,并且可以来源于天然来源或重组来源。抗体可以为免疫球蛋白分子的四聚体。
术语“抗体片段”是指保留与抗原的表位特异性地相互作用(例如,通过结合、空间位阻、稳定化/去稳定化、空间分布)的能力的抗体的至少一部分。抗体片段的实例包括,但不限于fab,fab'、f(ab')2、fv片段、scfv抗体片段、二硫键-连接的fvs(sdfv)、由vh和ch1结构域组成的fd片段、线性抗体、单域抗体比如sdab(vl或vh)、camelidvhh结构域、由抗体片段(例如包括在铰链区通过二硫键连接的两个fab片段的二价片段)形成的多特异性抗体和抗体的分离的cdr或其它表位结合片段。抗原结合片段也可以被掺入单域抗体、最大抗体、微小抗体、纳米抗体、胞内抗体、双抗体、三抗体、四抗体、v-nar和双-scfv(参见,例如hollinger和hudson,naturebiotechnology23:1126-1136,2005)。抗原结合片段也可以接枝到基于多肽的支架,比如iii型纤连蛋白(fn3)(参见美国专利号:6,703,199,其描述了纤连蛋白多肽微小抗体)。
术语“scfv”是指包含至少一个包括轻链的可变区抗体片段和至少一个包括重链的可变区的抗体片段的融合蛋白,其中所述轻链和重链可变区是邻接的(例如经由合成接头例如短的柔性多肽接头),并且能够以单链多肽形式表达,且其中所述scfv保留其所来源的完整抗体的特异性。除非指定,否则如正如本文中使用的那样,scfv可以以任何顺序(例如相对于多肽的n-末端和c末端)具有所述的vl和vh可变区,scfv可以包括vl-接头-vh或可以包括vh-接头-vl。
在本文中,术语“结合结构域”或“抗体分子”指的是蛋白质,例如,免疫球蛋白链或其片段,包含至少一个免疫球蛋白可变结构域序列。术语“结合结构域”或“抗体分子”包括抗体和抗体片段。抗体分子可以是多特异性抗体分子,例如,它包含多个免疫球蛋白可变结构域序列,其中第一免疫球蛋白可变结构域序列对第一表位具有结合特异性并且多个的第二免疫球蛋白可变结构域序列具有针对第二表位的结合特异性。多特异性抗体分子也可以为双特异性抗体分子。双特异性抗体具有对不超过两个抗原的特异性。双特异性抗体分子的特征在于对第一表位具有结合特异双特异性抗体分子的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。
术语“抗原”或“ag”是指引起免疫应答的分子。该免疫应答可以涉及抗体产生或有特异性免疫能力的细胞的活化或两者。本领域技术人员应当理解包括实际上所有蛋白质或肽的任何大分子都可以充当抗原。此外,抗原可以来源于重组或基因组dna。当在本文中使用该术语时,本领域技术人员应当理解包括编码引起免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna,因此编码“抗原”。此外,本领域技术人员应当理解抗原无需仅通过基因的全长核苷酸序列编码。显而易见的是,本发明包括但不限于使用超过一个基因的部分核苷酸序列,并且这些核苷酸序列以不同组合排列以编码引发期望免疫应答的多肽。而且,本领域技术人员应当理解抗原根本无需由“基因”编码。显而易见的是,抗原可以合成产生,或者可以来源于生物样品,或者可以是除了多肽之外的大分子。这样的生物样品可以包括,但不限于组织样品、肿瘤样品、具有其它生物组分的细胞或液体。
术语“抗癌作用”是指可以通过多种手段表现的生物效应,包括但不限于例如肿瘤体积减小、癌细胞数量减少、转移数量减少、预期寿命增加、癌细胞增殖减少、癌细胞存活率降低或与癌性病症有关的各种生理学症状的改善。“抗癌作用”也可以通过肽、多核苷酸、细胞和抗体预防癌症首次出现的能力。术语“抗癌作用”是指可以通过各种手段表现的生物学效应,包括但不限于例如肿瘤体积减小、肿瘤细胞数量减少、肿瘤细胞增殖减少或肿瘤细胞存活率降低。
如该术语在本文中使用的,“来源于”表示第一和第二分子之间的关系。它一般是指在第一分子和第二分子之间的结构相似性,并且不暗示或包括对来源于第二分子的第一分子的过程或来源的限制。例如,在来源于cd3ζ分子的胞内信号传导结构域的情况下,胞内信号传导结构域保持足够cd3ζ结构使得其具有所需的功能,即,在适当的条件下产生信号的能力。它不暗示或包括对产生胞内信号传导结构域的具体过程的限制,例如,它并不意味着,为了提供胞内信号传导结构域,必须从cd3ζ序列开始并缺失不需要的序列,或施加突变,以得到胞内信号传导结构域。
短语“与本文所述的肿瘤抗原的表达相关的疾病”包括,但并不限定于与如本文所述肿瘤抗原的表达相关的疾病或与表达如本文所述的肿瘤抗原的细胞相关的状况,包括例如,增生性疾病如癌症或恶性肿瘤或癌前状态,如脊髓发育不良,骨髓增生异常综合征或白血病前期;或与表达如本文所述的肿瘤抗原的细胞相关的非癌症相关的适应证。在一个方面中,与本文所述的肿瘤抗原的表达相关的癌症是血液癌症。在一个方面中,与本文所述的肿瘤抗原的表达相关的癌症是实体癌。与本文所述的肿瘤抗原的表达相关的其它疾病包括,但不限于,例如,非典型和/或非经典癌症,恶性肿瘤,癌前状态或与如本文所述的肿瘤抗原的表达相关的增生性疾病。与本文所述的肿瘤抗原的表达相关的非癌症相关适应证包括,但不限于,例如,自身免疫性疾病(例如,狼疮),炎性病症(过敏和哮喘)以及移植。肿瘤抗原表达可以细胞表达,或在任何时间表达了,编码所述肿瘤抗原的mrna。肿瘤抗原表达细胞可以产生肿瘤抗原蛋白(例如,野生型或突变体),并且所述肿瘤抗原蛋白可以在正常水平或降低的水平存在。肿瘤抗原表达细胞可以在一个点产生可检测水平的肿瘤抗原蛋白,并随后产生基本上不可检测的肿瘤抗原蛋白。
术语“刺激”是指由刺激性分子(例如,tcr/cd3复合体或car)与其同源配体(或在car的情况下为肿瘤抗原)的结合,由此介导信号转导事件(比如但不限于经由tcr/cd3复合体的信号转导或经由适合的nk受体或car的信号传导结构域的信号转导)而诱导的初次应答。刺激可以介导某些分子的改变的表达。
术语“刺激性分子”是指由免疫细胞表达的提供细胞质信号传导序列的分子,该信号传导序列以刺激性方式调节用于免疫细胞信号传导途径的至少一些方面的免疫细胞的活化。在一个方面,信号是通过例如tcr/cd3复合体与负载有肽的mhc分子的结合启动的初级信号,并且其导致介导t细胞应答,包括,但不限于增殖、活化、分化等。以刺激方式起作用的一级细胞质信号传导序列(也称为““一级信号传导结构域”)可以含有被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。特别地用于本发明的含有itam的细胞质信号传导序列的实例包括,但不限于来源于下述的那些:cd3ζ、常见的fcrγ(fcer1g)、fcγriia、fcrβ(fcepsilonr1b)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dap10和dap12。在本发明的特异性car中,在本发明的任一个或更多个car中的胞内信号传导结构域包括细胞内信号传导序列,例如cd3-ζ的初级信号传导序列。在本发明的特异性car中,cd3-ζ的初级信号传导序列是来自人或非人类种类例如小鼠、啮齿类动物、猴、猿等的等同残基。在本发明的特异性car中,cd3-ζ的初级信号传导序列是来自人或者非人类种类例如小鼠、啮齿类动物、猴、猿等的等同残基。
术语“抗原呈递细胞”或“apc”是指其表面上呈递与主要组织相容性复合体(mhc的)复合的外来抗原的免疫系统细胞,比如辅助细胞(例如,b-细胞、树突细胞等)。t-细胞可以使用其t-细胞受体(tcr)识别这些复合体。apc加工抗原且将其呈递给t-细胞。
术语“胞内信号传导结构域”是指分子的细胞内部分。胞内信号传导结构域产生促进含有car的细胞例如cart细胞的免疫效应子功能的信号。在例如cart细胞中免疫效应子功能的实例包括细胞裂解活性和辅助活性,包括细胞因子的分泌。在一种实施方式中,胞内信号传导结构域可以包括一级胞内信号传导结构域。示例性的一级胞内信号传导结构域包括来源于负责初次刺激或抗原依赖性刺激的分子的那些。在一种实施方式中,胞内信号传导结构域可以包括共刺激细胞内结构域。示例性的共刺激胞内信号传导结构域包括来源于负责共刺激信号或抗原独立的刺激的分子的那些。例如,在cart的情况下,一级胞内信号传导结构域可以包含t细胞受体的细胞质序列,并且共刺激胞内信号传导结构域可以包含来自共同受体或共刺激性分子的细胞质序列。
一级胞内信号传导结构域可以包括被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。含有itam的一级细胞质信号传导序列的实例包括,但不限于来源于下述的那些:cd3ζ、常见fcrγ(fcer1g)、fcγriia、fcrβ(fcepsilonr1b)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dap10和dap12。
术语“ζ”或备选地“ζ链”、“cd3-ζ”或“tcrζ”定义为如genbanacc.no.bag36664.1提供的蛋白质或来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基,且“ζ刺激结构域”或备选地“cd3-ζ刺激结构域”或“tcr-ζ刺激结构域”定义为来自ζ链的细胞质结构域的氨基酸残基或其功能性衍生物,其足以在功能上传递t细胞活化所需的起始信号。在一个方面,ζ的细胞质结构域包括genbankacc.no.bag36664.1的残基52至164或作为其功能性同源物的来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基。
术语“共刺激性分子”是指t细胞上的同源结合配偶体,其特异性地结合共刺激配体,从而介导t细胞的共刺激反应,比如但不限于增殖。共刺激性分子为除了抗原受体或其配体之外的细胞表面分子,其促进有效的免疫应答。共刺激性分子包括但不限于mhci类分子,btla和toll配体受体,以及ox40、cd27、cd28、cds、icam-1、lfa-1(cd11a/cd18)、icos(cd278)和4-1bb(cd137)。这样的共刺激性分子的进一步实例包括cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、nkg2d、nkg2c、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、cd19a,以及特异性地结合cd83的配体。
共刺激性胞内信号传导结构域可以为共刺激性分子的细胞内部分。共刺激性分子可以以下述蛋白质家族代表:tnf受体蛋白、免疫球蛋白样蛋白质、细胞因子受体、整联蛋白、信号传导淋巴细胞性活化分子(slam蛋白质)、和nk细胞受体。这样的分子的实例包括cd27、cd28、4-1bb(cd137)、ox40、gitr、cd30、cd40、icos、baffr、hvem、icam-1、与淋巴细胞功能相关的抗原-1(lfa-1)、cd2、cds、cd7、cd287、light、nkg2c、nkg2d、slamf7、nkp80、nkp30、nkp44、nkp46、cd160、b7-h3、以及特异性地结合cd83的配体等。
胞内信号传导结构域可以包括分子的全部细胞内部分或全部天然胞内信号传导结构域、或其功能片段或衍生物。
术语“4-1bb”是指具有如genbankacc.no.aaa62478.2提供的氨基酸序列的tnfr超家族的成员,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基;并且“4-1bb共刺激结构域”被定义为genbankacc.no..aaa62478.2的氨基酸残基214-255,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。在一个方面,“4-1bb共刺激结构域”为来自人或者来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。
术语“编码”是指多核苷酸比如基因、cdna、或mrna中的核苷酸的特异性序列在生物学过程中作为合成其它聚合物和大分子的模板的固有特性,该聚合物以及大分子具有确定的核苷酸序列(例如,rrna、trna和mrna)或确定的氨基酸序列及由其得到的生物学特性。因此,如果与所述基因对应的mrna的转录和翻译在细胞或其它生物系统中产生蛋白质,则基因、cdna或rna编码蛋白质。其核苷酸序列与mrna序列相同且通常被提供在序列表中的编码链和用作转录基因或cdna的模板的非编码链这两者都可以被称为编码该基因或cdna的蛋白或其他产物
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括作为彼此的简并形式且编码相同氨基酸序列的所有核苷酸序列。短语编码蛋白质或rna的核苷酸序列也可包括内含子,其达到编码蛋白质的核苷酸序列可以在一些形式中含有内含子的程度。
术语“有效量”或“治疗有效量”在本文中可互换地使用,并且是指如本文中所述有效地实现特定生物学结果的化合物、制剂、物质或组合物的量。
术语“表达”是指由启动子驱动的特定核苷酸序列的转录和/或翻译。
术语“转移载体”是指包括分离的核酸且可用于将所分离的核酸递送至细胞内部的物质组合物。大量载体是本领域已知的,包括,但不限于线性多核苷酸、与离子或两亲性化合物有关的多核苷酸、质粒和病毒。因此,术语“转移载体”包括自主复制的质粒或病毒。该术语也应当被解释为进一步包括非质粒和促进核酸转移到细胞中的非病毒化合物,比如例如聚赖氨酸化合物、脂质体等。病毒转移载体的实例包括,但不限于腺病毒载体、腺伴随病毒载体、逆转录病毒载体、慢病毒(lentiviral)载体等
术语"表达载体”是指包含重组多核苷酸的载体,其包含有效连接要表达的核苷酸序列的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其它元件可以由宿主细胞提供或在体外表达系统中。表达载体包括本领域已知的所有那些,包括被掺入重组多核苷酸的粘粒、质粒(例如,裸的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺伴随病毒)。
在本发明的上下文中,使用下述通常存在的核酸碱基的缩写。“a”是指腺苷、“c”是指胞嘧啶、“g”是指鸟苷、“t”是指胸苷、和“u”是指尿苷。
术语免疫原性的组合物的“肠胃外”施用包括例如皮下(s.c.)、静脉内(i.v.)、肌肉内(i.m.)或胸骨内注射、瘤内或输注技术。术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非明确地限定,否则该术语包括含有天然核苷酸的已知类似物的核酸,所述已知类似物具有与参考核酸类似的结合性质,并且以与天然存在核苷酸类似的方式代谢。除非另有说明,否则特定的核酸序列也隐含地包括其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、snp和互补序列以及明确指定的序列。特别地,简并密码子取代可以通过产生序列而实现,所述序列中一个或更多个所选择的(或所有的)密码子的三个位置被混合碱基和/或去氧肌苷残基取代(batzer等,nucleicacidres.19:5081(1991);ohtsuka等,j.biol.chem.260:2605-2608(1985);和rossolini等,mol.cell.probes8:91-98(1994))。
术语“肽”、“多肽”和“蛋白质”可互换地使用,并且是指由肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对于可以包括蛋白质或肽的序列的氨基酸的最大数量没限制。多肽包括含有彼此通过肽键结合的两个或多个氨基酸的任何肽或蛋白质。正如本文中使用的那样,该术语是指短链(其在本领域通常也称为例如肽、寡肽和寡聚物)以及较长链(其在本领域通常也称为蛋白质,其存在多种类型)。“多肽”包括例如生物学活性片段、基本上同源的多肽、寡肽、同型二聚体、异二聚体、多肽的变体、修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽或其组合。
正如本文中使用的那样,术语“治疗(treat、treatment、treating)”是指由于施用一种或多种疗法(例如一种或多种治疗剂比如本发明的car)减慢或改善增生性病症的进展、严重程度和/或持续时间,或改善增生性病症的一种或多种症状(优选地,一种或多种可辨别的症状)。术语“治疗”是也可以指改善增生性病症的至少一种可测量的物理参数比如肿瘤生长,不必是患者可辨别的。术语“治疗”也可以是指通过例如稳定可辨别的症状以物理方式、通过例如稳定物理参数以生理学方式或两者抑制增生性病症的进展。术语“治疗”也可以是指减小或稳定肿瘤尺寸或癌细胞计数。
术语“信号转导途径”是指在将信号从细胞的一个部分转导到细胞的另一个部分中起作用的多种信号转导分子之间的生化关系。短语“细胞表面受体”包括能够跨越细胞膜接受信号和传递信号的分子和分子复合体。
术语“受试者”是指包括其中可以引出免疫应答的活生物体(例如,哺乳动物、人类)。
术语“基本上纯化的”细胞是指基本上不含其它细胞类型的细胞。基本上纯化的细胞是指其已经与其天然存在状态中通常有关的其它细胞类型分离的细胞。在某些情况下,基本上纯化的细胞群是指细胞的同源群体。在其它的情况下,该术语仅指在其天然状态下与其天然有关的细胞分离的细胞。在某些方面中,所述细胞是体外培养的。在其它方面中,所述细胞不是体外培养的。
正如本文中使用的那样,术语“治疗”是指治疗。治疗效果是通过减轻、抑制、缓解或根除疾病状态获得的。
正如本文中使用的那样,术语“预防”是指预防性或保护性治疗疾病或疾病状态。
术语“转染的”或“转化的”或“转导的”是指外源性核酸通过其转移或引入到宿主细胞中的过程。“转染的”或“转化的”或“转导的是指外源性核酸通过其转移或引入到宿主细胞中的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源性核酸转染、转化或转导的细胞。所述细胞包括原发性受试者细胞及其后代。
术语“特异性地结合”是指识别并且结合存在于样品中的结合配偶体(例如肿瘤抗原)蛋白质的抗体或配体,但是该抗体或配体基本上不会识别或结合样品中的其它分子。
范围∶在整个公开中,本发明的各个方面都可以以范围形式存在。应当理解,范围形式的描述仅仅为方便和简洁起见,而不应当被看作是对本发明的范围不可改变的限制。因此,范围的描述应当被认为特别地公开了所有可能的子范围以及该范围内的单独数值。例如,范围的描述比如从1至6就应当被认为具体地公开了子范围比如1至3、1至4、1至5、2至4、2至6、3至6等,以及该范围内的单独数值,例如1、2、2.7、3、4、5、5.3、和6。作为另一个实例,范围比如95-99%的同一性包括具有95%、96%、97%、98%或99%同一性的范围,并且包括子范围比如96-99%、96-98%、96-97%、97-99%、97-98%和98-99%的同一性。不考虑范围的宽度,这均适用。
术语,所述的“flt3l”可以人的flt3l,由235个氨基酸残基组成的iv型跨膜蛋白(ncbireferencesequence:np_001191431.1),氨基酸序列如seqidno:8所示;也可以是与seqidno:8具有至少80%相似性的多肽,优选与seqidno:8具有至少85%或至少90%相似性的多肽;所述的“flt3l”还可以来自其他种属,包括但不限于鼠、猴、猪。flt3l可以是天然存在的,比如其可被分离或纯化自哺乳动物;也可以是人工制备的,比如可以根据常规的基因工程重组技术来生产重组各元件或flt3l。优选的,本发明可采用重组的各元件或flt3l。
组合物
本发明提供了包含免疫效应细胞的组合物,该组合物还包含toll样受体激动剂,所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述toll样受体激动剂在对受试者的治疗中能增加所述免疫效应细胞的功效,其中:所述受体具有胞外区、跨膜区和胞内区,其中,胞外区具有识别所述的肿瘤抗原或病原体抗原的抗原结合结构域,所述抗原结合结构域结合至与疾病相关的肿瘤抗原或病原体抗原。在一优选实施方式中,本发明的组合物还可包括mdsc抑制剂或免疫检查点抑制剂。
所述的“免疫效应细胞”可以来自自体细胞,也可以来自同种异体细胞。
所述的识别肿瘤抗原或病原体抗原的受体包括但不限于嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。
所述的“免疫效应细胞”还可以表达其他外源性蛋白,例如,所述外源性蛋白可以是但不限于flt3l、干扰素、白介素、pd-1或pd-l1抑制剂。这些外源性蛋白的存在可以增强“免疫效应细胞”的抗肿瘤或抗病原微生物的能力。
在具体实施方式中,所述的干扰素包括但不限于i型干扰素;所述的白介素包括但不限于il-2、il-12、il-21、il18;所述的白介素受体包括但不限于il-4的受体;pd-1或pd-l1的抑制剂包括但不限于可溶性的pd-1或者含有可溶性的pd-1的融合肽(可参见wo2017080377)、抗pd-1或者抗pd-l1的抗体。
所述toll样受体激动剂可以但不限于为toll样受体3(tlr3)激动剂。所述的tlr3激动剂可以为天然或合成的双链核糖核酸如聚肌苷酸胞苷酸(poly(i:c))。所述的tlr3激动剂还可以为错配的双链核糖核酸poly(i:c11-14u),示例性的,如poly(i:c12u)、poly(i:c13u)。
在优选的实施方案中,所述的识别肿瘤抗原或病原体抗原受体包括嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。
所述嵌合抗原受体可以包括常规的所有嵌合抗原受体结构,跨膜区通常可以任选已知的具有跨膜功能的蛋白或蛋白片段,胞内区也可以根据现有技术选择常规的具有引发免疫细胞活化的结构域,包括但不限于cd3ζ、fcrγ(fcer1g)、fcγriia、fcrβ(fcepsilonr1b)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dap10、dap12、cd137、cd27、cd28等的全长或活性片段(例如cn201580013987关于胞内域的描述)。例如,嵌合抗原受体的还可以具有以下几种结构:
(i)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(ii)特异性结合所述抗原的抗体、cd28的跨膜区、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(iii)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域。
所述的tfp包括:(a)tcr亚基,所述tcr亚基包括tcr部分胞外结构域,跨膜结构域,和tcr胞内结构域,所述胞内结构域包括刺激信号传导结构域;(b)抗原结合结构域,所述tcr亚基和所述抗原结合结构域有效连接。在一具体实施例中,所述tcr亚基的胞外、跨膜和胞内信号结构域来源于cd3ε或cd3γ,所述tfp整合进t细胞上表达的tcr。
所述的tac包括:(a)胞外结构域:所述胞外结构域包括具有抗原结合结构域和与cd3结合的单链抗体;(b)跨膜区;(c)胞内结构域,所述胞内结构域连接蛋白激酶lck。
在本发明中,所述的免疫细胞选自t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞或骨髓源性吞噬细胞。在一优选例中,所述的免疫细胞为t细胞,所述的受体的胞内域能引发t细胞的活化。
本发明还提供了包含表达有嵌合抗原受体的免疫效应细胞及医药学上可接受的载体或赋形剂的组合物,该组合物还包含tlr激动剂和/或树突细胞成熟促进剂。
在另一方面,本发明提供了包含免疫效应细胞的组合物,除了包含toll样受体激动剂,还可以包含mdsc抑制剂、抗pd-1抗体、或者抗pd-l1的抗体。
本发明还提供了包含表达有嵌合抗原受体的免疫效应细胞、tlr激动剂和/或树突细胞成熟促进剂及指导如何向个体给予所述细胞的说明书的试剂盒。
给药方法
本发明还提供了治疗、控制、或者预防肿瘤或者病原体感染的方法,该方法包括给予受试者治疗有效量的免疫效应细胞和toll样受体激动剂。所述免疫效应细胞具有靶向识别肿瘤抗原或病原体抗原的受体,所述toll样受体激动剂在对受试者的治疗中能增加所述免疫效应细胞的功效,其中:所述受体具有胞外区、跨膜区和胞内区,其中,胞外区具有识别所述的肿瘤抗原或病原体抗原的抗原结合结构域,所述抗原结合结构域结合至与疾病相关的肿瘤抗原或病原体抗原。
在具体实施方式中,免疫效应细胞和toll样受体激动剂可以同时给药,也可以先给予免疫效应细胞,再给予toll样受体激动剂,也可以先给予toll样受体激动剂,再给予免疫效应细胞。
所述的“免疫效应细胞”可以来自自体细胞,也可以来自同种异体细胞。
所述的识别肿瘤抗原或病原体抗原的受体包括但不限于嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。
所述的“免疫效应细胞”还可以表达其他外源性蛋白,例如,所述外源性蛋白可以是但不限于flt3l、干扰素、白介素、pd-1或pd-l1抑制剂。这些外源性蛋白的存在可以增强“免疫效应细胞”的抗肿瘤或抗病原微生物的能力。
在具体实施方式中,所述的干扰素包括但不限于i型干扰素;所述的白介素包括但不限于il-2、il-12、il-21、il18;所述的白介素受体包括但不限于il-4的受体;pd-1或pd-l1的抑制剂包括但不限于可溶性的pd-1或者含有可溶性的pd-1的融合肽(可参见wo2017080377)、抗pd-1或者抗pd-l1的抗体。
所述toll样受体激动剂可以但不限于为toll样受体3(tlr3)激动剂。所述的tlr3激动剂可以为天然或合成的双链核糖核酸如聚肌苷酸胞苷酸(poly(i:c))。所述的tlr3激动剂还可以为错配的双链核糖核酸poly(i:c11-14u),示例性的,如poly(i:c12u)、poly(i:c13u)。
所述嵌合抗原受体可以包括常规的所有嵌合抗原受体结构,跨膜区通常可以任选已知的具有跨膜功能的蛋白或蛋白片段,胞内区也可以根据现有技术选择常规的具有引发免疫细胞活化的结构域,包括但不限于cd3ζ、fcrγ(fcer1g)、fcγriia、fcrβ(fcepsilonr1b)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dap10、dap12、cd137、cd27、cd28等的全长或活性片段(例如cn201580013987关于胞内域的描述)。例如,嵌合抗原受体的还可以具有以下几种结构:
(i)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(ii)特异性结合所述抗原的抗体、cd28的跨膜区、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域;或
(iii)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域、cd137的共刺激信号结构域和cd3ζ胞浆信号传导结构域。
所述的tfp包括:(a)tcr亚基,所述tcr亚基包括tcr部分胞外结构域,跨膜结构域,和tcr胞内结构域,所述胞内结构域包括刺激信号传导结构域;(b)抗原结合结构域,所述tcr亚基和所述抗原结合结构域有效连接。在一具体实施例中,所述tcr亚基的胞外、跨膜和胞内信号结构域来源于cd3ε或cd3γ,所述tfp整合进t细胞上表达的tcr。
所述的tac包括:(a)胞外结构域:所述胞外结构域包括具有抗原结合结构域和与cd3结合的单链抗体;(b)跨膜区;(c)胞内结构域,所述胞内结构域连接蛋白激酶lck。
在本发明中,所述的免疫细胞包括但不限于t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞或骨髓源性吞噬细胞中的任一一种或其组合。在一优选例中,所述的免疫细胞为t细胞,所述的受体的胞内域能引发t细胞的活化。
在另一方面,本发明还提供了治疗、控制、或者预防肿瘤或者病原体感染的方法,该方法包括除了给予受试者治疗有效量的免疫效应细胞、toll样受体激动剂,还给与mdsc抑制剂、抗pd-1抗体、或者抗pd-l1的抗体。
制备治疗/预防/抑制肿瘤或者病原体感染、或调节免疫耐受能力的药物中的用途
本发明还提供了toll样受体激动剂和免疫效应细胞联合应用肿瘤、传染病及其他免疫相关性疾病的治疗方法,所述的肿瘤包括但并不限于:胰腺癌、肝癌、肺癌、胃癌、头颈部鳞状细胞癌、前列腺癌、结肠癌、乳腺癌、淋巴瘤、胆囊癌、肾癌、白血病、骨髓瘤、卵巢癌、宫颈癌、卵巢癌、宫颈癌或胶质瘤;所述的病原体包括但不限于:病毒、细菌、真菌、原生动物或寄生虫;较佳地,所述的病毒包括:巨细胞病毒、爱泼斯坦-巴尔病毒、人类免疫缺陷病毒或流感病毒。
在优选的实施方案中,所述toll样受体激动剂为toll样受体3(tlr3)激动剂,所述的tlr3激动剂优选自天然或合成的双链核糖核酸。在一优选例中,所述的tlr3激动剂为聚肌苷酸胞苷酸(poly(i:c))。所述的tlr3激动剂还可以为错配双链核糖核酸,示例性的,如poly(i:c12u)、poly(i:c13u)。
在一优选例中,所述错配双链核糖核酸的量足以与toll样受体3(tlr3)结合并且减少或消除所述受试对象中的所述肿瘤或其它转化细胞的增殖。
在优选的实施方案中,所述toll样受体激动剂对所述免疫效应细胞具有协同作用。
本领域技术人员可以凭借专业知识和现有技术,根据患者或对象的年龄、体重、性别、待治疗疾病的严重程度等因素决定所述toll样受体激动剂和所述免疫效应细胞的给药方式及用量。在具体的实施方案中,所述toll样受体激动剂和所述免疫效应细胞的给药方式可以相同,也可以不同。例如,给药方法为共同给予所述toll样受体激动剂和所述免疫效应细胞;或者先给予所述免疫效应细胞,再给予所述toll样受体激动剂;或者先给予所述toll样受体激动剂,再给予所述免疫效应细胞。在优选的实施方式中,所述的给药方法为先给予所述免疫效应细胞,再给予所述toll样受体激动剂。
在优选的实施方案中,所述toll样受体激动剂给药量可以是1mg/kg~4mg/kg,优选2mg/kg~3mg/kg,更优的选自2.08mg/kg-2.77mg/kg。在优选的实施方案中,所述toll样受体激动剂的给药次数为2~4次,优选2-3次。
在优选的实施方案中,所述的免疫细胞选自t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞或骨髓源性吞噬细胞,优选t细胞。在一优选例中,所述的免疫细胞为t细胞,所述的受体的胞内域能引发t细胞的活化。
在优选的实施方案中,所述的识别肿瘤抗原或病原体抗原受体包括嵌合抗原受体(car)、t细胞(抗原)受体(tcr)、t细胞融合蛋白(tfp)、或t细胞抗原耦合器(tac)。在优选的实施方案中,所述的免疫细胞可以为表达car的t细胞、表达tcr的t细胞、表达car的nk细胞,表达tfp的t细胞、表达tfp的nk细胞、表达tac的t细胞、表达tac的nk细胞。
所述嵌合抗原受体(car)可以但不限于下列结构:(i)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域和cd3ζ;或(ii)特异性结合所述抗原的抗体、cd28的跨膜区、cd137的共刺激信号结构域和cd3ζ;或(iii)特异性结合所述抗原的抗体、cd28的跨膜区、cd28的共刺激信号结构域、cd137的共刺激信号结构域和cd3ζ。
在优选的实施方案中,所述的tfp包括:(a)tcr亚基,所述tcr亚基包括tcr部分胞外结构域,跨膜结构域,和tcr胞内结构域,所述胞内结构域包括刺激信号传导结构域;(b)抗原结合结构域,所述tcr亚基和所述抗原结合结构域有效连接。在一优选例中,所述tcr亚基的胞外、跨膜和胞内信号结构域来源于cd3ε或cd3γ,所述tfp整合进t细胞上表达的tcr。
在优选的实施方案中,所述的tac包括:(a)胞外结构域:所述胞外结构域包括具有抗原结合结构域和与cd3结合的单链抗体;(b)跨膜区;(c)胞内结构域,所述胞内结构域连接蛋白激酶lck。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
本发明的示例性的抗原受体,包括car,以及用于工程改造和将受体导入细胞中的方法,参考例如中国专利申请公开号cn107058354a、cn107460201a、cn105194661a、cn105315375a、cn105713881a、cn106146666a、cn106519037a、cn106554414a、cn105331585a、cn106397593a、cn106467573a、cn104140974a、国际专利申请公开号wo2017186121a1、wo2018006882a1、wo2015172339a8、wo2018018958a1中公开的那些。
实施例1.car-t细胞的制备
本实施例选择egfrviii作用car-t细胞的靶点,为了更准确的验证在小鼠体内的抗肿瘤效果,因此,选择的信号肽、跨膜区、胞内区等为鼠源的。制备的方法按照本领域常规的car-t细胞制备方法操作。
1、逆转录病毒载体构建
将小鼠cd8α信号肽(seqidno:1)、抗egfrviii单抗抗体(seqidno:2)、cd8α胶链区及跨膜区(seqidno:3)、cd28胞内域(seqidno:4)、cd3ζ胞内域(seqidno:5)依次连接,通过体外基因合成的方法获得egfrviii-28z基因片段,并用mluⅰ和salⅰ双酶切位点置换逆转录病毒载体mscv-ires-gfp中的ires-gfp片段,获得重组载体mscv-egfrviii-28z。各组成片段组合顺序如图1所示。
2、逆转录病毒制备
操作如下:
(1)以4.5×106的密度接种293t细胞于培养皿中,co2培养过夜,培养基为添加胎牛血清的dmem,;
(2)将9μgmscv-egfrviii-28z与9μgpcl-eco溶入800μl无血清dmem培养液得到质粒混合液;将54μgpei(1μg/μl)溶解于800μl的无血清dmem培养液中,得到pei混合液;将质粒混合液加入pei混合液中室温孵育,得到转染复合物。
(4)将转染复合物1.6ml滴加入含步骤(1)的培养皿中培养,收集上清,得到。
3、逆转录病毒感染小鼠脾脏t淋巴细胞
取健康balb/c小鼠,脱颈处死后取出脾脏,并将脾脏细胞制备成单细胞悬液;加200ul红细胞裂解液裂红后采用小鼠cd3+t细胞分选试剂盒(stemcell,#19851)分选获得小鼠脾脏t淋巴细胞。
将小鼠cd3+t淋巴细胞纯化后按1:1的比例加入dynabeadsmouset-activatorcd3/cd28,在rpmi1640完全培养基中培养24小时。
将48孔板中每孔加入400μlretronectin溶液(5μg/ml)孵育过夜后弃去retronectn;将活化24h的小鼠脾脏t淋巴细胞接种于板中,每孔细胞数目1×106,加入1ml逆转录病毒,补充培养基至2ml,离心后培养并传代。
4、嵌合抗原受体在t淋巴细胞的表达
感染3天后,取4×105的t细胞,重悬细胞,加入biotin标记的egfrviii蛋白至终浓度为25ug/ml冰上孵育后清洗;加入50μlpbs+2%fcs重悬,加入1μlpe标记的streptavidin,冰上孵育清洗后,加入400μlpbs+2%fcs重悬细胞,流式检测,结果如图2所示,egfrviii-28zcart细胞感染效率为76.0%。
实施例2.egfrviii-28zcart淋巴细胞体外毒性
将小鼠结肠癌细胞ct26(购自美国模式培养物保藏所(atcc))和小鼠胰腺癌细胞e0771(获自贝勒医学院),采用本领域常规的技术手段,制备得到过表达egfrviii的ct26-egfrviii和e0771-egfrviii。
使用cytotox96非放射活性的细胞毒性测定试剂盒(promega,madison,usa)测定egfrviii-28zcart淋巴细胞对靶细胞的体外细胞毒性。调整靶细胞ct26、ct26-egfrviii、e0771、e0771-egfrviii浓度为2×105/ml,取50μl接种到96孔板;按效靶比0.3:1、1:1和3:1向96孔板中加入car-t细胞及对照t细胞(50ul),按试剂盒说明书设置各对照孔,各组均设5个复孔;共孵育18小时。孵育结束后按照试剂盒说明书进行操作测定egfrviii-28zcart淋巴细胞对靶细胞的体外细胞毒性,结果如图3所示。
结果显示,egfrviii-28zcar-t细胞对egfrviii表达阴性的ct26和e0771细胞无明显毒性,而对表达egfr-viii靶抗原的ct26-egfrviii、e0771-egfrviii细胞表现出较强的杀伤作用。在效靶比3:1的时候,egfrviii-28zcar-t细胞对两种细胞的杀伤分别为71%和67.8%;未感染t细胞则对靶细胞均无明显的杀伤活性。且egfrviii-28zcart与未感染t细胞对egfr-viii靶抗原阳性细胞的杀伤效果存在显著性差异。这些结果表明我们构建的egfrviii-28zcart淋巴细胞在体外可以特异性杀伤egfrviii表达阳性的肿瘤细胞。
实施例3.egfrviii-28zcar-t联合polyi:c在小鼠乳腺癌模型中的抗肿瘤作用
接种1×106e0771-egfrviii细胞于6周龄的雌性c57小鼠(体重18g-24g,购自上海灵畅生物科技有限公司)的第四对乳腺脂肪垫;肿瘤接种13天,将荷瘤小鼠分为4组,分为ut细胞组、ut+polyi:c组、egfrviii-28zcar-t细胞组和egfrviii-28zcar-t+polyi:c组,每组肿瘤体积平均值约为150mm3;分组后,通过尾静脉输注5.0×106egfrviii-28zcar-t细胞(注射日为第0天),同时以ut细胞组作为对照,car-t细胞回输后第3、6天瘤内注射50ugpolyi:c,ut细胞组为瘤内注射相同剂量的生理盐水。观察移植瘤的生长,结果如图4a所示。
结果显示,回输5×106egfrviii-28z虽然能够抑制e0771-egfrviii移植瘤的生长;而联合polyi:c后,对e0771-egfrviii移植瘤生长的抑制效果则更加显著,表明polyi:c进一步增强了car-t细胞的抗肿瘤能力。相对于ut组,在第16天时egfrviii-28zcar-t细胞组抑瘤率为36.1%,而联用polyi:c组则达到69.6%,差异具有显著性(p<0.05),抑瘤率提高超过30%。
待对照组小鼠肿瘤大小达到2000mm3时,即将实验处死,分离肿瘤后,测定肿瘤重量,结果如图4b所示,与单独给予car-t相比,联合给予poly:ic组的肿瘤重量降低77.8%
处死后的小鼠,取外周血测定ifnγ水平,结果如图4c所示,取脾脏和肿瘤组织,测定car-t细胞拷贝数,结果如图4d所示。
实施例4.egfrviii-28zcar-t联合polyi:c在小鼠结肠癌模型中的抗肿瘤作用
6周龄雌性balb/c小鼠(购自上海灵畅生物科技有限公司)采用3gygamma射线辐照(即进行淋巴细胞清除)后,当天皮下接种3×105ct26-egfrviii细胞;肿瘤接种13天,将荷瘤小鼠分为4组,分为ut细胞组、ut+polyi:c组、egfrviii-28zcar-t细胞组和egfrviii-28zcar-t+polyi:c组,每组肿瘤体积平均值约为150mm3;分组后,通过尾静脉输注5.0×106egfrviii-28zcar-t细胞,同时以ut细胞组作为对照,car-t细胞回输后第3、6天瘤内注射50ugpolyi:c。gfrviii-28zcar-t联合polyi:c对ct26-egfrviii移植瘤的治疗效果如图5所示。
结果显示单独回输5×106ct26-egfrviii可以明显抑制ct26-egfrviii移植瘤的生长;而联合polyi:c后,对ct26-egfrviii移植瘤生长的抑制效果则更加显著,表明polyi:c进一步增强了car-t细胞的抗肿瘤能力。相对于ut组,在第16天时egfrviii-28zcar-t细胞组抑瘤率为36.1%,而联用polyi:c组则达到74.3%,差异具有显著性(p<0.05,p<0.01),抑瘤率提高超过30%。
待对照组小鼠肿瘤大小达到2000mm3时,即将实验处死,分离肿瘤后,测定肿瘤重量,结果如图5b所示,与单独给予car-t相比,联合给予poly:ic组的肿瘤重量降低了48.5%。
处死后的小鼠,取外周血测定ifnγ水平,结果如图5c所示,取脾脏和肿瘤组织,测定car-t细胞拷贝数,结果如图5d所示。
实施例5表达flt3lcar-t细胞与polyi:c的联用
参照常规的car-t细胞制备方法,将小鼠muflt3l基因片段(seqidno:6)与实施例1中构建的egfrviii-28z的基因序列通过通过f2a(seqidno:7)连接,即将f2a-flt3l基因插入egfr-28z基因中cd3ζ片段后,构建egfrviii-28z-flt3l逆转录病毒载体mscv-egfrviii-28z-flt3l,质粒图见图6,感染小鼠脾脏t淋巴细胞,制备得到表达egfrviii-28z-flt3lcart细胞。
参照实施例4的操作,构建小鼠结肠癌模型,将荷瘤小鼠分为egfrviii-28zcar-t细胞+polyi:c组和egfrviii-28z-flt3lcar-t+polyi:c细胞组
结果如图7所示,在balb/c小鼠ct26-egfrviii移植瘤模型中,egfrviii-28z-flt3lcar-t+polyi:c细胞组的肿瘤抑制效果明显优于egfrviii-28zcar-t细胞+polyi:c组,egfrviii-28z-flt3lcar-t+polyi:c联合治疗组的抑瘤率在cart细胞输注后第7、10、14天分别达到47.8%、50.1%和54.0%。
实施例6干扰素抑制剂对car-t+polyi:c的抗肿瘤作用的影响
参照实施例3和4,分别构建小鼠乳腺癌模型和结肠癌模型。采用干扰素受体α链的抗体(克隆号mar1-5a3,购自bioxcell)作为封闭剂封闭i型干扰素的释放。
取小鼠肠癌模型分为ut组(注射生理盐水)、egfrviii-28zcar-t细胞+polyi:c组、以及egfrviii-28zcar-t细胞+polyi:c组+干扰素受体α链封闭剂。car-t细胞回输后第3、6天瘤内注射50ugpolyi:c,在给予polyi:c或生理盐水后第0天和第2天,瘤内注射给予50ug干扰素受体α链封闭剂。测量肿瘤的生长情况,结果如图8a所示。待对照组小鼠肿瘤大小达到2000mm3时,即将实验处死,分离肿瘤后,测定肿瘤重量,结果如图8b所示。
取小鼠乳腺癌模型分为ut组(注射生理盐水)、egfrviii-28zcar-t细胞+polyi:c组、以及egfrviii-28zcar-t细胞+polyi:c组+干扰素受体α链封闭剂。car-t细胞回输后第3、6天瘤内注射50ugpolyi:c,在给予polyi:c或生理盐水后第0天和第2天,瘤内注射给予干扰素受体α链封闭剂。测量肿瘤的生长情况,结果如图9a所示。待对照组小鼠肿瘤大小达到2000mm3时,即将实验处死,分离肿瘤后,测定肿瘤重量,结果如图9b所示。
以上结果显示,封闭i型干扰素后,给予car-t细胞和polyi:c,引起抗肿瘤活性降低,即i型干扰素的存在将有利于car-t细胞和polyi:c的抗肿瘤作用。
实施例7mdsc抑制剂对car-t+polyi:c的抗肿瘤作用的影响
参照实施例4,构建小鼠结肠癌模型。采用mdsc清除剂anti-gr1抗体(购自bioxelle,克隆号rb6-8c5),抑制mdsc。
mdsc为骨髓来源的抑制性细胞,呈cd11b+gr1+阳性。单独给予anti-gr1抗体与ut组相比,没有明显的抗肿瘤活性。
取小鼠肠癌模型分为ut组(注射生理盐水)、ut+anti-gr1组(给予anti-gr1抗体和生理盐水)、car-t+polyi:c组(给予egfrviii-28z-car-t和polyi:c)、car-t+anti-gr1组(给予egfrviii-28z-car-t和anti-gr1抗体)、car-t+polyi:c+anti-gr1组(给予egfrviii-28z-car-t、polyi:c和anti-gr1抗体)。
car-t细胞回输后第2天,按照10mg/kg小鼠腹腔注射anti-gr1抗体,接下来每周3次注射,共计两周。car-t细胞回输后第3、6天瘤内分别注射50ugpolyi:c。
测量肿瘤的生长情况,结果如图10a所示。待对照组小鼠肿瘤大小达到2000mm3时,即将实验处死,分离肿瘤后,测定肿瘤重量,结果如图10b所示。分离肿瘤后进行拍照,结果如图10c所示。
作为示例性的,上述实施例选择靶向egfr的car-t细胞,应理解,选择作用于其他靶点的car-t细胞也具有相同的效果,如gpc3、cld18a2、cd19、bcma等。所采用的抗体可以是鼠抗也可以是人源化的,采用的跨膜域、胞内域也可以根据目的不同采用不同种属的,如采用人的。
作为示例性的,上述实施例虽然采用的是car-t细胞,但该t细胞还可以表达有其他增强car-t细胞功能的细胞因子,如car和i型干扰素共表达的car-t细胞、car和pd1共表达的car-t细胞等。
作为示例性的,上述实施例虽然采用的是car-t细胞,但还可以选择其他免疫细胞,如nk细胞、nk-t细胞,还可以具体选择免疫细胞的特定亚型,如γ/δt细胞等。
作为示例性的,上述实施例选择鼠源的car,但其信号肽、铰链区、跨膜区等可以根据目的的不同选用其他种属。包括但不限于人的信号肽、铰链区、跨膜域、胞内区。抗体也可以根据不同的目的,选择针对不同靶点的鼠抗或者人源化的抗体或者全人的抗体。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>科济生物医药(上海)有限公司
上海市肿瘤研究所
<120>toll样受体激动剂与免疫效应细胞的联用
<130>p2018-0911
<150>cn201710561825.4
<151>2017-07-11
<150>cn201710344558.5
<151>2017-05-16
<160>8
<170>patentinversion3.5
<210>1
<211>81
<212>dna
<213>小鼠(musmusculus)
<400>1
atggcctcaccgttgacccgctttctgtcgctgaacctgctgctgctgggtgagtcgatt60
atcctggggagtggagaagct81
<210>2
<211>720
<212>dna
<213>人工序列(artificialsequence)
<400>2
gacatcctgatgacccaatctccatcctccatgtctgtatctctgggagacacagtcagc60
atcacttgccattcaagtcaggacattaacagtaatatagggtggttgcagcagagacca120
gggaaatcatttaagggcctgatctatcatggaaccaacttggacgatgaagttccatca180
aggttcagtggcagtggatctggagccgattattctctcaccatcagcagcctggaatct240
gaagattttgcagactattactgtgtacagtatgctcagtttccgtggacgttcggtgga300
ggcaccaagctggaaatcaaacgtggtggaggcggttcaggcggaggtggctctggcggt360
ggcggatcggccgatgtgcagcttcaggagtcgggacctagcctggtgaaaccttctcag420
tctctgtccctcacctgcactgtcactggctactcaatcaccagtgattttgcctggaac480
tggatccggcagtttccaggaaacaagctggagtggatgggctacataagttatagtggt540
aacactaggtacaacccatctctcaaaagtcgaatctctatcactcgagacacatccaag600
aaccaattcttcctgcagttgaattctgtgactattgaggacacagccacatattactgt660
gtaacggcgggacgcgggtttccttattggggccaagggactctggtcactgtctctgca720
<210>3
<211>216
<212>dna
<213>小鼠(musmusculus)
<400>3
actactaccaagccagtgctgcgaactccctcacctgtgcaccctaccgggacatctcag60
ccccagagaccagaagattgtcggccccgtggctcagtgaaggggaccggattggacttc120
gcctgtgatatttacatctgggcacccttggccggaatctgcgtggcccttctgctgtcc180
ttgatcatcactctcatctgctaccacaggagccga216
<210>4
<211>123
<212>dna
<213>小鼠(musmusculus)
<400>4
aatagtagaaggaacagactccttcaaagtgactacatgaacatgactccccggaggcct60
gggctcactcgaaagccttaccagccctacgcccctgccagagactttgcagcgtaccgc120
ccc123
<210>5
<211>321
<212>dna
<213>小鼠(musmusculus)
<400>5
agcaggagtgcagagactgctgccaacctgcaggaccccaaccagctctacaatgagctc60
aatctagggcgaagagaggaatatgacgtcttggagaagaagcgggctcgggatccagag120
atgggaggcaaacagcagaggaggaggaacccccaggaaggcgtatacaatgcactgcag180
aaagacaagatggcagaagcctacagtgagatcggcacaaaaggcgagaggcggagaggc240
aaggggcacgatggcctttaccagggtctcagcactgccaccaaggacacctatgatgcc300
ctgcatatgcagaccctggcc321
<210>6
<211>696
<212>dna
<213>小鼠(musmusculus)
<400>6
atgacagtgctggcgccagcctggagcccaaattcctccctgttgctgctgttgctgctg60
ctgagtccttgcctgcgggggacacctgactgttacttcagccacagtcccatctcctcc120
aacttcaaagtgaagtttagagagttgactgaccacctgcttaaagattacccagtcact180
gtggccgtcaatcttcaggacgagaagcactgcaaggccttgtggagcctcttcctagcc240
cagcgctggatagagcaactgaagactgtggcagggtctaagatgcaaacgcttctggag300
gacgtcaacaccgagatacattttgtcacctcatgtaccttccagcccctaccagaatgt360
ctgcgattcgtccagaccaacatctcccacctcctgaaggacacctgcacacagctgctt420
gctctgaagccctgtatcgggaaggcctgccagaatttctctcggtgcctggaggtgcag480
tgccagccggactcctccaccctgctgcccccaaggagtcccatagccctagaagccacg540
gagctcccagagcctcggcccaggcagctgttgctcctgctgctgctgctgctgcctctc600
acactggtgctgctggcagccgcctggggccttcgctggcaaagggcaagaaggaggggg660
gagctccaccctggggtgcccctcccctcccatccc696
<210>7
<211>66
<212>dna
<213>人工序列(artificialsequence)
<400>7
gtgaaacagactttgaattttgaccttctgaagttggcaggagacgttgagtccaaccct60
gggccc66
<210>8
<211>235
<212>prt
<213>智人(homosapiens)
<400>8
metthrvalleualaproalatrpserprothrthrtyrleuleuleu
151015
leuleuleuleuserserglyleuserglythrglnaspcysserphe
202530
glnhisserproileserseraspphealavallysilearggluleu
354045
serasptyrleuleuglnasptyrprovalthrvalalaserasnleu
505560
glnaspglugluleucysglyglyleutrpargleuvalleualagln
65707580
argtrpmetgluargleulysthrvalalaglyserlysmetglngly
859095
leuleugluargvalasnthrgluilehisphevalthrlyscysala
100105110
pheglnproproprosercysleuargphevalglnthrasnileser
115120125
argleuleuglngluthrsergluglnleuvalalaleulysprotrp
130135140
ilethrargglnasnpheserargcysleugluleuglncysglnpro
145150155160
aspserserthrleuproproprotrpserproargproleugluala
165170175
thralaprothralaproglnproproleuleuleuleuleuleuleu
180185190
provalglyleuleuleuleualaalaalatrpcysleuhistrpgln
195200205
argthrargargargthrproargproglygluglnvalproproval
210215220
proserproglnaspleuleuleuvalgluhis
225230235
- 还没有人留言评论。精彩留言会获得点赞!