一种具有抑制肥胖和脂肪肝作用的罗汉果提取物及其制备方法与流程
本发明属于生物医药技术领域,具体涉及一种具有抑制肥胖和脂肪肝作用的罗汉果提取物及其制备方法。
背景技术:
肥胖是由长期能量摄取与代谢失衡引起的,包括营养过剩和生活方式的改变。随着人们生活水平的提高,肥胖已经在全球范围内广泛流行,发达国家如美国肥胖率在1980年后急速上升但现在已经趋于平稳,但是发展中国家的肥胖率正在迅速增长。在世界范围内,现在肥胖人数达到了1980年的两倍,已经超过了5亿人次。除去肥胖本身所带来的身形、代谢、心理等问题,它本身所引起的并发症更是成了人类的“隐形杀手”。高血压、糖尿病、全球慢性肾病、心血管疾病、脂肪肝等并发症均可以由肥胖引起。
目前在肥胖治疗药物中使用较多的非处方药物为脂肪酶抑制剂奥利司他(orlistat)[1]。奥利司他是fda批准的第一个胃肠道脂肪酶抑制剂[2],它通过抑制脂肪酶活性降低人体对脂肪的吸收从而达到减肥的目的,同时对血压、血脂及胰岛素耐受性等方面有一定调节作用[3]。但是,奥利司他不仅会引起胃肠道胀气、腹泻、消化不良等副作用,而且被报道可能会引起急性肝肾损伤[4]。而其他的减肥药物均有严重副作用,现今仍缺乏理想的防治药物。
有研究表明,肥胖往往会并发脂肪肝的发生[5]。脂肪肝已成为慢性肝病的最常见病因,是全球主要的健康问题之一[6]。脂肪肝所引起的胰岛素抵抗、慢性全身炎症和血脂异常,使得脂肪肝与许多慢性病,如糖尿病和心血管疾病有关[7]。其中脂肪肝严重时引起的肝脏炎症,会使血液中的ast、alt酶活升高,事实上,大多数肝细胞损伤都会导致血液中两种酶的酶活升高[8]。肥胖和脂肪肝的形成与高脂或高热量食物摄取过多,代谢减慢有关[9]。目前脂肪肝的防治也缺乏理想的药物。
肝脏是脂肪氧化代谢的主要器官之一。腺苷酸激酶(ampk)是能量代谢调节的关键因子,ampk激活如ampk的磷酸化可以促进脂质或能量代谢。线粒体和过氧化物酶体是导致脂肪氧化代谢的主要细胞器。烯酰辅酶a水合酶1(ech1)是一种脂质代谢的关键酶,在过氧化物酶体中主导脂肪氧化代谢[10],ech1的上调意味着肝脏中过氧化物酶体中脂肪氧化代谢的增加,从而减少肝脏脂肪的积累,达到减肥和治疗脂肪肝的作用。
罗汉果为葫芦科多年生藤本植物的果实,具有润肺止咳、生津止渴和润肠通便的功效[11]。罗汉果皂苷v为其有效成分之一,但在肥胖和脂肪肝应用方面缺乏相关报道。
[1]narayanaswamiv,dwoskinlp.obesity:currentandpotentialpharmacotherapeuticsandtargets[j].pharmacology&therapeutics,2016,170:116.
[2]mcneelyw,benfieldp.orlistat.[j].drugs,1998,56(2):241-249.
[3]siebenhofera,jeitlerk,bergholda,etal.long-termeffectsofweight-reducingdietsinhypertensivepatients.[m]//thecochranelibrary.johnwiley&sons,ltd,2009:cd008274.
[4]andcfde.postmarketdrugsafetyinformationforpatientsandproviders-fdadrugsafetycommunication:completedsafetyreviewofxenical/alli(orlistat)andsevereliverinjury[j].
[5]maherjj.newinsightsfromrodentmodelsoffattyliverdisease[j].antioxidants&redoxsignaling,2011,15(2):535-50.
[6]mikolasevici,milics,turkwt,etal.nonalcoholicfattyliverdisease-amultisystemdisease?[j].worldjournalofgastroenterology,2016,22(43):9488-9505.
[7]bangkb,kyuncy.comorbiditiesandmetabolicderangementofnafld[j].journaloflifestylemedicine,2015,5(1):7-13.
[8]gianninie,bottaf,fasolia,etal.progressiveliverfunctionalimpairmentisassociatedwithanincreaseinast/altratio[j].digestivediseases&sciences,1999,44(6):1249-1253.
[9]gortmakersl,swinburnba,levyd,etal.changingthefutureofobesity:science,policy,andaction[j].lancet,2011,378(9793):838-847.
[10]xiew,zhangs,leif,etal.ananascomosusl.leafphenolsandp-coumaricacidregulateliverfatmetabolismbyupregulatingcpt-1expression[j].evidence-basedcomplementrayandalternativemedicine,2014,(2014-8-12),2014,2014(15):903258.
[11]liudd,jixw,lirw.effectsofsiraitiagrosvenoriifruitsextractsonphysicalfatigueinmice[j].iranianjournalofpharmaceuticalresearch,2013,12(1):115-121.
技术实现要素:
本发明的一个目的是提供一种罗汉果提取物。
本发明所提供的罗汉果提取物是按照包括下述步骤的方法制备得到的:
1)取鲜罗汉果洗净,置于碎果机中,加入水进行打浆,得到浆液;
2)向所述浆液中加入复合果胶酶进行酶解1;然后再加入活性酵母菌进行酶解2;酶解2结束后,离心收集上清液;再向所述上清液中加入活性炭进行吸附处理,过滤,收集滤液,即得罗汉果提取物溶液。
上述方法,步骤1)中所述水为50~100℃的热水。所述鲜罗汉果与加入的水的质量比为1:0.5-5,优选为1:1-2,具体如1:1.5。
上述步骤1)中优选能保证果子充分破碎,又能保证罗汉果种子的完整性的碎果机。
上述方法,步骤2)中所述复合果胶酶由果胶酶、纤维素酶及复合植物水解酶组成;所述果胶酶、纤维素酶及复合植物水解酶的质量比为1-7:0.1-4:0.1-4,具体如7:2:1。
所述果胶酶的酶活为14000-20000u/g;所述纤维素酶的酶活为700-1000u/g,所述复合植物水解酶的酶活为800-1000u/g。
所述果胶酶、纤维素酶及复合植物水解酶均购自于诺维信(novozymes)或日本天野酶公司(amanoenzyme)。
如诺维信公司(novozymes),商品目录号为pectinexultrasp-l的果胶酶;诺维信公司(novozymes),商品目录号为celluclast的纤维素酶;诺维信公司(novozymes),商品目录号为viscozymel的复合植物水解酶。
所述复合果胶酶的加入量为0.5-15kg/每吨鲜罗汉果,优选加入5-12kg/每吨鲜罗汉果,具体如10kg/每吨鲜罗汉果。
所述酶解1的条件为:20-55℃(优选50-55℃)酶解1~2小时。
所述活性酵母菌可为用于酿酒、食品发酵等食用级活性干酵母或鲜酵母均可。所述活性酵母菌具体可购自安琪酵母公司。
所述活性酵母菌的加入量为0.5-20kg/每吨鲜罗汉果,优选5-15kg/每吨鲜罗汉果。
所述酶解2的条件为:20-55℃(优选40-50℃)酶解1~10小时(优选3小时)。
所述活性炭的用量为所述上清液质量的0.5~5%,优选1%。
所述吸附处理的条件为:30-100℃(优选80-90℃)搅拌保温10~60分钟(优选保温30分钟)。
所述方法还包括下述纯化步骤:将罗汉果提取物溶液趁热通过板框过滤设备,待药液冷却至常温时通过离子交换树脂lx-t5,收集流出液,浓缩、干燥得罗汉果提取物产品(go-luo)。
本发明的另一个目的是保护上述罗汉果提取物的应用。
本发明所提供的罗汉果提取物具有如下至少一方面的应用:
1)制备预防和/或治疗肥胖的产品;
2)制备预防和/或治疗脂肪肝的产品;
3)制备脂肪代谢促进剂;
4)制备保肝产品;
5)制备降低肝脏重量的产品;
6)制备降低腹部脂肪重量的产品;
7)制备促进p-ampk(磷酸化腺苷酸活化蛋白激酶)表达的产品;
8)制备促进ech1(烯酰水合酶辅酶1)蛋白表达的产品。
本发明主要提供一种天然药物活性组分罗汉果提取物(go-luo),该提取物含有45~55%的罗汉果皂苷v,该提取物可作为脂肪代谢的促进剂,用于抑制肥胖和脂肪肝的形成。该组分作用机制可能涉及激活ampk,促进ech1表达,以促进能量及脂肪代谢,降低肥胖小鼠腹部脂肪重量和体重。并且该组分能够减少肝损伤,使血液中alt、ast酶活下降,达到保肝的目的。
此外,本发明还保护以所述的罗汉果提取物为活性成分制备的各种产品;所述产品具体可为药品或保健品。
上述本发明提供的罗汉果提取物的给药途径为口服。需要的时候,在上述罗汉果提取物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂、增效剂。该药物可以液体、干粉或浸膏的形式存在,并与各种常规辅料制备成胶囊、片剂、注射液、丸剂、颗粒剂、散剂等各种具有保健或药用功效的剂型,可单独或与其它药物组合用于预防肥胖及肝脏的保护。
本发明具有如下有益效果:本发明提供的罗汉果提取物作用机制主要通过激活肝脏ampk使ech1上调,促进能量和脂肪代谢,从而达到预防肥胖和脂肪肝的目的;并且降低了血清alt、ast酶活,有保肝效果。该提取物是一种天然药物活性成分,副作用低,使用较为安全。
附图说明
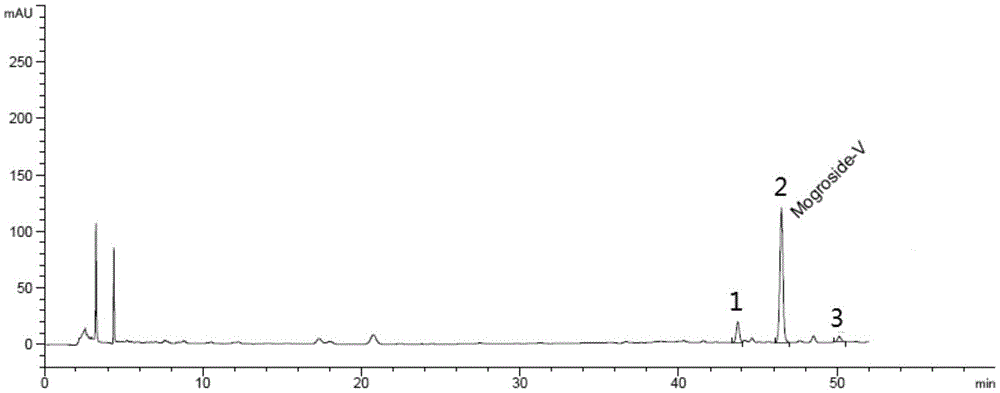
图1为go-luo(lh)的hplc图;1、11-氧-罗汉果皂苷v,2、罗汉果皂苷v,3、罗汉果皂苷ⅳ。
图2为各组小鼠平均体重,数据表示为平均数±标准差(n=10),*p<0.05,**p<0.01vsmodel,##p<0.01vsnormal。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图3为各组小鼠肝脏平均重量,数据表示为平均数±标准差(n=10),*p<0.05,**p<0.01vsmodel,##p<0.01vsnormal。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图4为各组小鼠腹部脂肪平均重量,数据表示为平均数±标准差(n=10),*p<0.05,**p<0.01vsmodel,##p<0.01vsnormal。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。。
图5为各组小鼠平均摄食量,数据表示为平均数±标准差(n=10),*p<0.05vsmodel。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg);ncd,正常食物;hfd,高脂食物。
图6为各组小鼠血糖值,数据表示为平均数±标准差(n=10),##p<0.01vsnormal。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图7为各组小鼠血清总胆固醇含量,数据表示为平均数±标准差(n=10),##p<0.01vsnormal。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图8为各组小鼠血清甘油三酯含量,数据表示为平均数±标准差(n=10)。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图9为各组小鼠每mg粪便中甘油三酯含量,数据表示为平均数±标准差(n=10),##p<0.01vsmodel。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图10为各组脂肪肝情况。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图11为各组小鼠肝脏病理切片情况。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图12为各组小鼠腹部脂肪病理切片情况。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
图13为各组肝脏ampk和ech1蛋白表达情况。normal,正常对照组;model,高脂模型组;lh200,罗汉果提取物小剂量组(200mg/kg);lh400,罗汉果提取物中剂量组(400mg/kg);lh800,罗汉果提取物大剂量组(800mg/kg);ol60,奥利司他(60mg/kg)。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例所使用的果胶酶购自于诺维信公司(novozymes),商品目录号为pectinexultrasp-l,酶活力14000~20000u/g;所使用的纤维素酶购自于诺维信公司(novozymes),商品目录号为celluclast,酶活力700u/g;所使用的复合植物水解酶购自于诺维信公司(novozymes),商品目录号为viscozymel,酶活力10000~20000u/g;所使用的活性酵母菌购自于安琪酵母公司,商品目录号为bv818。
实施例1、罗汉果提取物(命名为go-luo,以下文中以lh代替)的制备
1.1制备步骤:
取5000g鲜罗汉果用清水冲洗干净,放入碎果机中,加入1.5倍90℃的热水打浆。然后加入50g的复合果胶酶(果胶酶:纤维素酶:复合植物水解酶=7:2:1,质量比),50℃酶解1~2小时,自然放置至40度左右时加入60g的活性酵母菌,并于40度保温3小时。将酶解后的药液通过离心机离心去除固体不溶物,然后在滤液中加入活性炭(用量为滤液质量的1%),于80度搅拌保温30分钟。将药液趁热通过板框过滤设备,待药液冷却至常温时通过大孔丙烯酸型离子交换树脂lx-t5,收集流出液,浓缩、干燥得罗汉果提取物产品(go-luo)45g。
1.2含量检测
用高效液相色谱(hplc)法测定lh中罗汉果皂苷含量,主要依据《中华人民共和国药典》2015年版四部通则0512高效液相色谱进行检测。经检测,此提取物中罗汉果皂苷v的含量为46%,罗汉果皂苷iv含量为3.2%,11-氧-罗汉果皂苷v的含量为6.8%。hplc结果见图1。
实施例2、go-luo(lh)抗肥胖和脂肪肝活性测试
1.实验材料
1.1实验动物和食物:
nih雄性小鼠(20g左右)购自广东省医学实验动物中心(spf级,许可证号:粤监证字,scxk(粤)2013-0002);spf级食物购自广东省医学实验动物中心;高脂食物(h10141)购自北京华阜康生物科技股份有限公司。
1.2实验用药品
go-luo(lh)提取物按实施案例一进行制备,由桂林莱茵生物科技股份有限公司提供;奥利司他(orlistat,下文中以ol代替)片购自浙江海正药业股份有限公司,生产批号为21607031。
1.3实验试剂:
无水乙醇购自西陇科学股份有限公司;柠檬酸钠、无水甲醇购自天津市百世化工有限公司;tritonx-100购自生工生物工程(上海)有限公司。
1.4实验用试剂盒
1.5westernblot抗体试剂:
gapdh抗体(abs118936a),兔抗,购于absin公司;ampk抗体(2532s)、p-ampk抗体(2535s)兔抗,购于cst公司;ech1抗体(arp43561),兔抗,购于avivasysbio公司。
兔二抗(074-1506)购自kpl公司。
1.6实验耗材:
96孔板、移液管、离心管均购自于biofil公司;1.5mlep管购自于axygen公司。
2实验方法
2.1高脂动物模型制作及体内药物活性测试
选取60只雄性四周龄spf级nih小鼠,动物随机编号,随机分为6组,保证每组平均体重均等,每组十只,分组情况见下表,药物用蒸馏水溶解,g1给予正常食物,g2至g5给予高脂食物,饲养四周时间,并每天一次定时、定量灌胃给药,给药量,见下表。
主要评价指标:主要评价指标有体重,体内脂肪含量,脂肪细胞体积大小,血脂水平,脂肪肝,食物和水摄取等情况。
2.2.1收集各项待检测样品
灌胃进行的第2-4周,收集2小时内粪便冻存于-80备用。灌胃四周后,小鼠禁食6h后,称重对实验动物用10%乌来糖进行麻醉,眼眶取血,离心取血清冻存于-20℃备生化检测用;动物颈椎脱臼致死,取动物的肝脏组织、腹部脂肪称重,取100mg左右的上述组织放入10%福尔马林溶液中固定,之后进行常规的病理切片分析;将其余组织液氮瞬时冷冻后,放入24孔板内,塑封后于-80℃保存,之后进行western-blot实验。
2.2.2生化实验
2.2.2.1测定血糖
1)取血清2μl,用蒸馏水为空白,加标准孔,再加入200μl工作液,混匀后于37℃孵育10min,于505nm波长处测定其吸光度;
2)计算公式:葡萄糖含量(mmol/l)=(样本od值-空白od值)/(标准品od值-空白od值)×标准品浓度(5mmol/l)。
2.2.2.2测定血液中胆固醇
1)取血清2μl,用蒸馏水为空白,加标准孔,再加入200μl工作液,混匀后于37℃孵育10min,于505nm波长处测定其吸光度;
2)计算公式胆固醇含量(mmol/l)=(样本od值-空白od值)/(标准品od值-空白od值)×标准品浓度(5.17mmol/l)。
2.2.2.3测定血液中甘油三酯含量
1)取血清2μl,用蒸馏水为空白,加标准孔,再加入200μl工作液,混匀后于37℃孵育10min,在酶标仪510nm波长的光下检测其吸光度值;
2)计算公式:甘油三酯含量(mmol/l)=(样本od值-空白od值)/(标准品od值-空白od值)×标准品浓度(2.26mmol/l)。
2.2.2.4测定血液中alt含量
1)制作标准曲线:分别加入0μl、2μl、4μl、6μl、8μl、10μl的2μmol/l的丙酮酸钠标准液,加入20μl基质液,混匀后37℃孵育30min,重复步骤3)、4),得出标准曲线;
2)测定孔加入5μl血清,空白孔加入5μl双蒸水,加入20μl37℃预热20mi的基质液,充分混匀,37℃孵育30min;
3)测定孔、空白孔加入2,4二硝基苯肼液20μl,混匀,37℃孵育20min;
4)加入0.4mol/l氢氧化钠溶液终止反应,室温放置15min,在酶标仪510nm波长的光下检测其吸光度值;
5)计算公式:绝对od值=测定孔od值-空白孔od值,查标准曲线,求得相应的alt活力值。
2.2.2.5测定血液中ast含量
1)制作标准曲线:分别加入0μl、2μl、4μl、6μl、8μl的2μmol/l的丙酮酸钠标准液,加入20μl基质液,混匀后37℃孵育30min,重复步骤3)、4),得出标准曲线;
2)测定孔加入5μl血清,空白孔加入5μl双蒸水,加入20μl37℃预热20mi的基质液,充分混匀,37℃孵育30min;
3)测定孔、空白孔加入2,4二硝基苯肼液20μl,混匀,37℃孵育20min;
4)加入0.4mol/l氢氧化钠溶液终止反应,室温放置15min,在酶标仪510nm波长的光下检测其吸光度值;
5)计算公式:绝对od值=测定孔od值-空白孔od值,查标准曲线,求得相应的ast活力值。
2.2.2.6测定粪便中甘油三酯含量
收集少量粪便,60℃烘箱内烘30min完全烘干,测定重量,加入100μlpbs后放置一段时间,使其充分湿润后加入800μl氯仿-甲醇混合液(体积比2:1)匀浆,上下震荡混匀,室温放置5min,4℃,12000rpm下离心取200μl于ep管中,在40℃烘箱中1h后烘干,甘油三酯贴于ep管底部管壁处,加入250μl甘油三酯测定工作液,充分吹打,使管底甘油三酯充分溶解于工作液,37℃孵育30min,吸取200μl,用酶标仪在505nm波长处测定其吸光度值,计算公式同2.2.2.3。
2.2.3westernblotting蛋白表达实验
1)蛋白样品制备:每组挑选3个样品,取60mg肝脏,用pbs洗涤两次,加入800ul细胞裂解液后匀浆,在4℃,12000rpm条件下离心10min后,小心挑出管底dna,上清即为收集到的蛋白样品。
2)蛋白浓度测定:于96孔板每孔加入考马斯亮蓝g250200μl,然后分别加入2μl蛋白样品后混匀,使用酶标仪于595nm检测吸光度。同样的,测定一系列已知浓度bsa标准品的吸光度,绘制浓度与吸光度的标准曲线,计算未知蛋白样品的浓度。
3)电泳样品制备:通过上一步浓度测定所得的结果,配制相同蛋白含量且相同体积的电泳样品,并加入5×上样缓冲液,100℃金属浴10min使蛋白变性。
4)凝胶电泳:将提前配制的胶板置于电泳槽,加入电泳液,点样并加蛋白marker后开始跑胶。恒压80v跑30min,待跑过上层浓缩胶后,恒压120v电泳直至完成。
5)转膜:按海绵、滤纸、凝胶、膜、滤纸、海绵的三明治结构从负极至正极,顺序组装转膜夹,置于转膜槽中,倒入转膜液,恒压69v转膜1.5h,若跑分子量超过90kd的蛋白,则恒压80v转膜1.5h。
6)封闭:取出转好的膜,用tbst于120rpm洗涤5min,加入5%的脱脂牛奶/tbst封闭液中,室温80rpm震荡,封闭1h;孵育一抗:倒掉封闭液,根据目的蛋白的大小,剪下所需的目的条带,加入用3%bsa/tbst稀释的一抗,于80rpm室温震荡30min,而后于4°g孵育过夜。
7)洗膜:回收一抗,加入tbst于120rpm洗膜10min,重复4次。
8)孵育二抗:根据一抗的来源分别孵育小鼠、兔、山羊的二抗,二抗用5%牛奶/tbst稀释,80rpm室温摇1h。
9)洗膜:回收二抗,加入tbst于120rpm洗膜10min,重复5次。
10)孵育底物:从tbst中将膜小心夹出,在超纯水中轻轻洗涤,在吸水纸上虹吸微微沥干,将配置好的ecl底物均匀滴加到蛋白膜上,反应2min后将膜置于曝光夹中进入暗室显影。
11)显影:向曝光夹中放入胶片,曝光数分钟不等,取出胶片,先后置于显影液与定影液中,之后用清水冲洗后烘干。
12)分析结果:标注显影完成的胶片,扫描为彩色模式图片,分析结果。
3实验结果
3.1go-luo(lh)和阳性药对小鼠体重、肝脏重量、腹部脂肪重量、摄食量的影响
如图2,我们发现模型组小鼠出现肥胖,体重较正常组出现显著升高(p<0.01);每天给予200mg/kglh组(lh200)组体重较模型组有所降低,但未产生显著性差异;每天给予400mg/kglh组(lh400)、800mg/kglh组(lh800)体重较阴性对照的高脂模型组出现显著性下降;每天给予60mg/kg的ol组(ol60)组体重出现显著性下降。
如图3,模型组小鼠肝脏重量较正常组出现显著性升高(p<0.01);lh200、lh400、lh800组肝脏重量较模型组产生显著性下降(p<0.05);ol60组肝脏重量较模型组出现显著性下降(p<0.01)。
如图4,模型组小鼠腹部脂肪重量较正常组出现显著性升高(p<0.01);lh200、lh400组腹部脂肪重量较模型组有所下降,但未产生显著性变化;lh800组腹部脂肪重量较模型组出现显著性下降(p<0.05);ol60组腹部脂肪重量较模型组出现显著性下降(p<0.01)。
如图5,3种剂量的lh组小鼠24h内摄食量同模型组相比没有显著性差异;ol60组小鼠24h内摄食量较模型组出现显著性升高(p<0.05)。
3.2go-luo(lh)和阳性药对小鼠糖脂代谢的影响
高脂诱导4周后,如图6-8,模型组小鼠出现高血糖、高胆固醇血症,未出现高三酰甘油血症。各给药组小鼠血糖、胆固醇较模型组并没有显著性差异。
图9为小鼠粪便中甘油三酯含量,与正常组相比,模型组粪便中油脂未出现显著性上升;与模型组比较,lh组并未影响粪便中油脂水平,但ol60组粪便中油脂出现了极显著性上升,这一现象和它的抑制胃肠道脂肪酶的作用机理一致。
3.3go-luo(lh)和阳性药对小鼠脂肪肝的影响以及保肝作用
图10中lh组和ol60组肝脏颜色更加趋于正常。图11为各组小鼠的肝脏he切片,对照组小鼠肝脏切片未发现明显脂肪肝改变,模型组小鼠肝脏则出现了明显的脂肪变性,脂质产生的空泡占据了其中大部分空间,肝细胞被挤向细胞一侧,而3种剂量的lh组和ol60组的小鼠肝脏脂质空泡明显减少。
3.4go-luo(lh)和阳性药对小鼠腹部脂肪细胞体积的影响
如图12所示,模型组腹部脂肪细胞较正常组体积增大,lh组和ol组脂肪细胞较模型组体积略有减少。
3.5go-luo(lh)和阳性药对肝脏中ampk及ech1代谢相关蛋白的影响
如图13,lh可激活肝脏中ampk,促进p-ampk的表达,并促进ech1蛋白的表达。
lh可以降低高脂食物诱导的肥胖小鼠的体重和抑制脂肪肝的形成,且效果与阳性药类似;结合肝脏重量、腹部脂肪重量、腹部脂肪he切片、摄食量和小鼠粪便甘油三酯数据我们可以知道,lh产生减肥和抑制脂肪肝形成的作用,并不是依赖于通过减少小鼠的摄食,也不是抑制小鼠胃肠道对油脂的吸收,而可能与促进能量代谢有关。
肝脏是机体重要的能量代谢场所,当肝脏中脂肪酸的及甘油三酯的合成、转运、分解等途径收到阻碍是时,脂质就可能会沉积在肝脏中逐渐形成脂肪肝。肝脏重量、照片、肝脏he切片、血液alt和ast数据表明,lh可以减轻高脂诱导小鼠的肝脏重量,使其肝脏变小,通过减少肝脏中脂肪的形成,抑制脂肪肝的形成;并可减少肝损伤,使血液中alt和ast酶活性降低,达到保肝效果。
lh可激活ampk的磷酸化,还可以增加ech-1的表达。apmk被激活后可促进能量代谢,而ech-1是脂肪酸β氧化的关键酶。这些结果表明lh可促进肝脏中的能量代谢和脂肪酸β氧化来减少肝脏脂肪沉积,抑制脂肪肝的形成,同时也可能因此而抑制肥胖的发生。
- 还没有人留言评论。精彩留言会获得点赞!