用于治疗癌细胞的组合物及其方法与流程
本发明涉及用于治疗受试者体内癌细胞的组合物及其方法。
技术实现要素:
本发明的一个方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物。该组合物包括具有至少一个突变的亚塔痘病毒属病毒。该至少一个突变导致TNF结合蛋白的表达受到病毒的抑制。
本发明的另一方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,所述组合物包括亚塔痘病毒属病毒,其中,所述病毒具有至少一个突变,所述至少一个突变:导致胸苷激酶(TK)的表达受到抑制;导致具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达受到抑制;导致模拟神经调节蛋白(NRG)的15L编码蛋白的表达受到抑制;和/或导致作为T细胞生长因子的白细胞介素-2(IL-2)的表达。
在本发明的另一方面,用于治疗具有免疫系统的受试者的体内癌细胞的组合物包括痘病毒,该痘病毒编码表达细菌鞭毛蛋白的转基因。
在本发明的又一方面,一种治疗体内有癌细胞的受试者的方法包括给受试者施用组合物,其中,该组合物包括:亚塔痘病毒属病毒,其具有至少一个突变,该突变导致具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达受到病毒的抑制;亚塔痘病毒属病毒,其具有至少一个突变,该突变导致胸苷激酶(TK)的表达受到抑制;亚塔痘病毒属病毒,其具有至少一个突变,该突变导致模拟神经调节蛋白(NRG)的15L编码蛋白的表达受到抑制;和/或亚塔痘病毒属病毒,其具有至少一个突变,该突变导致作为T细胞生长因子的IL-2的表达。
根据本发明的又一方面,通过将病毒突变为:抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达;抑制胸苷激酶(TK)的表达;抑制模拟神经调节蛋白(NRG)的15L编码蛋白的表达;和/或表达作为T细胞生长因子的IL-2,来修饰亚塔痘病毒属病毒,从而将至少一个基因递送至受试者体内癌细胞。还通过编码病毒中的至少一个基因来修饰病毒,其中,在病毒中编码的所述至少一个基因导致癌细胞凋亡增加或激活受试者的免疫应答。将经修饰的病毒施用于受试者。
本文所述的用于治疗癌性肿瘤的药物组合物和方法可以对癌细胞进行潜在有效的治疗,限制传统治疗方法可能存在的严重感染的风险或副作用,并且在某些情况下可以与传统治疗方法结合使用。与未修饰的痘病毒相比,本文所述的修饰的痘病毒显示出更高的肿瘤选择性和肿瘤杀伤力,并且预期保持优选的OV特征,例如在受感染的受试者中仅引起轻度和自限性发热性疾病。
通过研究以下说明书、权利要求书和附图,本领域技术人员将进一步理解本设备的这些和其他特征、优点和目的。
附图说明
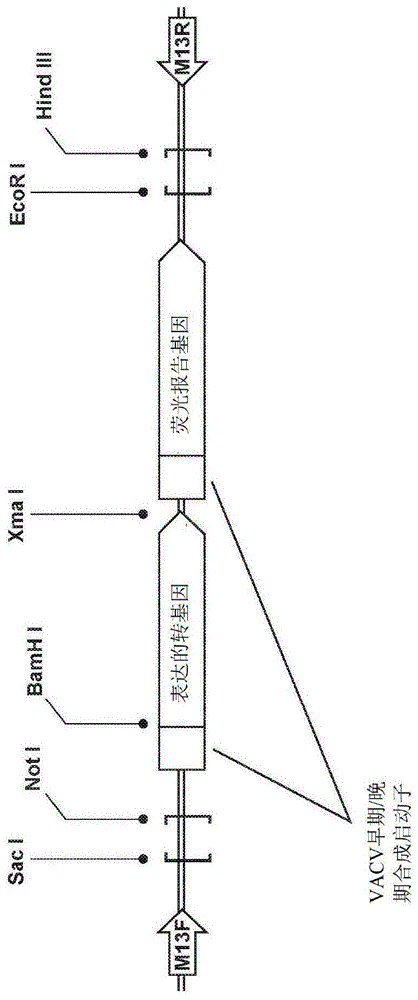
图1是重组塔纳痘病毒(TPV)的一个实施例的示意图,所述重组TPV被p2KO方法改变以插入表达的转基因和荧光报告基因;
图2A示出了异种移植HCT 116细胞并用纯载体对照溶液处理的无胸腺裸鼠的平均肿瘤体积;
图2B示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV/egfp)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2C示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mMCP-l)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2D示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mGM-CSF)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2E示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/fliC)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2F示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2G示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ2L)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图2H示出了异种移植HCT 116细胞并用重组TPV的一个实施例(TPV-p2KO/Δ2L/Δ66R/fliC)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图3包括病毒斑的一个实施例在2天、4天和6天的视图,所述病毒斑是由感染重组TPV的一个实施例产生的,所述重组TPV已被改变以表达荧光报告基因;
图4A示出了异种移植SK-MEL-3细胞并用野生型TPV(wtTPV)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图4B示出了异种移植SK-MEL-3细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图4C示出了异种移植SK-MEL-3细胞并用重组TPV的一个实施例(TPV-p2KO/Δ15L)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图4D示出了异种移植SK-MEL-3细胞并用重组TPV的一个实施例(TPV-p2KO/Δ15LΔ66R)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图4E示出了异种移植SK-MEL-3细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mIL-2)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5A示出了异种移植MDA-MB-231细胞并用野生型TPV(wtTPV)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体对照溶液处理形成对比;
图5B示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mCCL2)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5C示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5D示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mIL2)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5E示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/mGMCSF)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5F示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ2L)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5G示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/FliC)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5H示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/Δ2L)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;
图5I示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ66R/Δ2L/FliC)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比;以及
图5J示出了异种移植MDA-MB-231细胞并用重组TPV的一个实施例(TPV-p2KO/Δ15L)处理的无胸腺裸鼠的平均肿瘤体积,与用纯载体溶液处理形成对比。
具体实施方式
出于本文描述的目的,术语“上”、“下”、“右”、“左”、“后”、“前”、“垂直”、“水平”及其派生词应当涉及方位如图1所示的组合物。然而,应该理解的是,组合物可以采取各种替代方向,并且方法可以包括各种步骤顺序,除非有明确相反的指定。还应当理解,附图中示出的以及以下说明书中描述的特定设备和过程仅仅是所附权利要求中定义的发明概念的示例性实施例。因此,除非权利要求明确声明,否则与本文公开的实施例相关的特定尺寸和其他物理特征不应被认为是限制性的。
本文所使用的术语“和/或”,当用于两个或多个项目时,意味着可以单独使用所列项目中的任何一个,或者可以使用所列项目中的两个或多个的任意组合。例如,如果组合物被描述为包含组分A、B和/或C,则该组合物可以单独包含A;单独包含B;单独包含C;包含A和B的组合;包含A和C的组合;包含B和C的组合;或者包含A、B、C的组合。
尽管在一些病毒如VACV的溶瘤变体中显示了对癌细胞和/或转化细胞感染的一些偏好,但是野生型痘病毒如亚塔痘病毒属病毒,包括但不限于塔纳痘病毒(TPV),通常不被认为具有高度的天然肿瘤特异性。在没有明显天然肿瘤特异性的病毒中,通过基因工程增加癌细胞的选择性。
虽然不一定具有高度的天然肿瘤特异性,但痘病毒,更具体地说是亚塔痘病毒属痘病毒,具有几个固有的特性,使其非常适合作为OV进行修饰。痘病毒具有病毒基因组,能够容纳大量增加的基因材料,并具有一系列内在的进攻和防御能力。痘病毒基因组编码多种免疫调节蛋白,用于隐藏感染相关的细胞表面表位,使其免受宿主免疫监视,抑制和逃避某些宿主免疫和炎症反应,并通过模拟宿主细胞因子和细胞因子受体的病毒编码肽破坏细胞外环境的信号。痘病毒还产生两种不同类型的子代病毒颗粒,即成熟病毒颗粒(MV)形式和包膜病毒颗粒(EV)形式。病毒的MV形式被包裹在一个脂双层中,仅通过细胞溶解从宿主细胞中释放出来。在获得第二个外包膜后,EV形式从宿主细胞主动导出,可能从宿主细胞反式高尔基体网络导出,并被称为包裹病毒颗粒(WV),直至从受感染细胞导出,这之后被称为EV形式。痘病毒EV形式是病毒的一种特殊形式,负责通过血流和淋巴网络将痘病毒传播到宿主体内的远处。EV形式非常适合这项任务,因其只有6种跨膜蛋白质暴露于细胞外环境,而MV形式约为20种。暴露的表位较少意味着EV形式比MV形式更能逃避中和免疫。
此外,TPV是亚塔痘病毒属和野生痘病毒属的成员,具有有利于开发OV的其他特征,从而使其成为开发OV的亚塔痘病毒属的优选成员。被TPV病毒感染的人只会经历一种轻度和自限性发热性疾病,这可能是因为TPV病毒感染通常局限于身体的外围区域。除赤道非洲地区(地方病流行的地方),人类对TPV的免疫力还不成熟。此外,还从未观察到TPV在人与人之间传播,这是OV非常理想的安全特征。
本文公开了痘病毒的基因工程样本,包括亚塔痘病毒属的样本,用作OV,其可以掺入用于治疗癌细胞的组合物中,并用于治疗癌细胞的方法中。本文还描述了几个优选实施例,包括结合重组TPV的几个优选实施例。
总之,如下文进一步描述的,本发明的一个方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物。在一个方面,该组合物包括具有至少一个突变的亚塔痘病毒属病毒。该至少一个突变导致TNF结合蛋白的表达受到病毒的抑制。本发明的另一方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,包括亚塔痘病毒属病毒,其中,所述病毒具有至少一个突变,导致胸苷激酶(TK)的表达受到抑制。本发明的另一方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,包括亚塔痘病毒属病毒,其中,所述病毒具有至少一个突变,导致模拟神经调节蛋白(NRG)的15L编码蛋白的表达受到抑制。本发明的又一方面是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,包括亚塔痘病毒属病毒,其中,所述病毒具有至少一个突变,导致作为T细胞生长因子的白细胞介素-2(IL-2)的表达。在另一方面,所述组合物包括痘病毒,所述痘病毒编码表达细菌鞭毛蛋白的转基因。如本文所使用的,术语“受试者”包括人类和动物受试者,优选哺乳动物受试者。
同样如下文更详细描述的,治疗具有癌细胞的受试者的方法包括给受试者施用组合物,其中,该组合物如本文所述。例如,在一个实施例中,该组合物包括亚塔痘病毒属病毒,该病毒具有至少一个突变,该突变导致TNF结合蛋白的表达受到病毒的抑制。在另一个实施例中,该组合物包括亚塔痘病毒属病毒,该病毒具有至少一个突变,该突变导致TK的表达受到抑制。在另一个实施例中,该组合物包括亚塔痘病毒属病毒,该病毒具有至少一个突变,该突变导致模拟神经调节蛋白(NRG)的15L-编码蛋白的表达受到抑制。在另一个实施例中,该组合物包括亚塔痘病毒属病毒,该病毒具有至少一个突变,该突变导致作为T细胞生长因子的白细胞介素-2(IL-2)的表达。在又一个实施例中,所述组合物包括痘病毒,所述痘病毒编码表达细菌鞭毛蛋白的转基因。这些突变中的任何一个或全部可以单独或以任何组合存在于组合物中。此外,该组合物可以靶向递送至一组癌细胞,或者可以递送至受试者全身。
根据本发明的又一方面,如下文更详细描述的,通过将病毒突变为:抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达;抑制胸苷激酶(TK)的表达;抑制模拟神经调节蛋白(NRG)的15L-编码蛋白的表达;和/或表达作为T细胞生长因子的白细胞介素-2(IL-2),来修饰亚塔痘病毒属病毒,从而将至少一个基因递送至受试者体内癌细胞。还通过编码病毒中的至少一个基因来修饰病毒,其中,在病毒中编码的所述至少一个基因导致癌细胞凋亡增加或激活受试者的免疫应答。将经修饰的病毒施用于受试者。
在某些实施例中,痘病毒被基因修饰以抑制具有TNF结合活性的宿主范围因子的表达,该因子在本文中也被称为TNF结合蛋白。被抑制的TNF结合蛋白在结构上类似于MHC-1重链蛋白,编码的TNF结合蛋白可以与MHC-1轻链相互作用。在TPV中,TNF结合蛋白在2L基因中编码。2L基因被消融或以其他方式突变以抑制TNF结合蛋白表达的重组TPV在本文中有时被称为“2L缺失”或“Δ2L”。在正常痘病毒感染中,分泌的TNF结合蛋白通过结合并有效减少与受感染细胞相互作用的TNF的量来减弱宿主的炎症和抗病毒免疫应答。虽然这是痘病毒的理想结果,但是当痘病毒用作OV时,增加而不是减少所治疗肿瘤的炎症的量可能是有利的。在用基于作为痘病毒的重组TPV的OV治疗肿瘤的人受试者中,消融重组TPV中的2L基因可导致肿瘤部位TNF浓度的有效增加(与感染了携带2L的TPV的肿瘤相比)。TNF水平的增加可以最终增加肿瘤清除率。因为2L基因已被发现与人TNF结合,但不与小鼠TNF结合,所以在小鼠实验中,本文所述的一些重组TPV中2L基因的消融不被认为是肿瘤清除的重要因素,而在灵长类动物和人类的肿瘤清除中,却是很重要的因素。由于小鼠测试是在更相关的癌症病毒治疗灵长类动物模型中进一步测试痘病毒基OV的重要步骤,如本文所述,在异种移植无胸腺裸鼠中使用的重组TPV的具体示例中进行了2L基因的消融,其中,异种移植物由人癌细胞组成。
在某些实施例中,痘病毒的肿瘤选择性通过修饰痘病毒以抑制胸苷激酶(TK)的表达而增加。在TPV中,TK编码基因被称为66R。66R基因被消融或以其他方式突变以抑制TK表达的重组TPV在本文中有时被称为“66R缺失”或“Δ66R”。由于癌细胞中TK1细胞的作用,肿瘤细胞中的TK活性高。这与正常细胞形成对比,正常细胞的TK活性水平在细胞周期的S期达到峰值,在其他时间几乎检测不到。细胞TK1催化核苷酸合成的一个步骤,即胸苷向胸苷一磷酸的转化。因此,癌细胞在整个细胞周期中表达TK1,因此在细胞周期的所有阶段都有大量胞质胸苷一磷酸池可用。通过抑制TK编码基因,特别是在亚塔痘病毒属的痘病毒中,痘病毒比TK编码基因保持完整时具有更大的癌细胞选择性。尽管小鼠通常不是TPV的动物宿主,但是在本文描述的异种移植无胸腺裸鼠中使用的重组TPV的一些具体示例中进行了66R基因的消融。在这种环境中66R基因的消融证明66R基因的消融不会导致许可细胞(例如人类癌性肿瘤细胞)中出现非复制性TPV。
在一些实施例中,痘病毒被基因修饰以抑制模拟神经调节蛋白(NRG)的15L编码蛋白的表达。15L基因被消融或以其他方式突变以抑制模拟神经调节蛋白的蛋白表达的重组TPV在本文中有时被称为“15L缺失”或“Δ15L”。15L编码蛋白在生物学上模拟神经调节蛋白,并可作为表皮生长因子(EGF)。15L编码蛋白和/或NRG可作为ErbB3和ErbB4的配体,ErbB3和ErbB4与许多癌症如黑色素瘤、乳腺癌和前列腺癌的治疗抗性相关。配体与ErbB受体的结合导致同型或异型二聚体的形成和内在激酶结构域的激活。这些活动反过来启动信号转导级联,最终导致DNA合成和细胞增殖。通过抑制模拟NRG的15L编码蛋白的表达,特别是在亚塔痘病毒属的痘病毒中,与保持完整的15L编码基因相比,痘病毒具有使肿瘤生长倒退的能力。尽管小鼠通常不是TPV的宿主,但是在本文描述的异种移植无胸腺裸鼠中使用的重组TPV的一些具体示例中进行了15L基因的消融。在重组TPV中消融15L基因,无论是单独消融还是与其他基因修饰联合消融,都表明消融15L基因可以使裸鼠中的人黑色素瘤、乳腺和结肠直肠肿瘤退化。
在其他实施例中,痘病毒被基因修饰以表达作为T细胞生长因子的白细胞介素-2(IL-2)。作为T细胞生长因子的白细胞介素-2(IL-2)在激活先天免疫系统和适应性免疫系统中的T细胞、自然杀伤细胞(NK)和巨噬细胞中起关键作用。引入(mIL-2)基因的重组TPV可增加痘病毒抗肿瘤活性,从而实现比野生型TPV更显著的黑色素瘤退化。IL-2是一种多效性细胞因子,在先天免疫系统和适应性免疫系统中都起着关键作用。IL-2由T细胞分泌,诱导胸腺淋巴细胞分化和发育成为效应性T细胞。IL-2已被证明能促进记忆CD8+T细胞的存活,并增强肿瘤细胞上MHC-II的表达。在已显示出治疗黑色素瘤的一致功效的过继性T细胞转移疗法中,IL-2已被用于在将T细胞再注入癌症患者体内之前在体外扩增T细胞。此外,IL-2在激活先天免疫系统方面具有显著的功效。已经证明,IL-2激活自然杀伤细胞(NK)细胞以获得增强的细胞毒性功能(称为淋巴因子激活杀伤[LAK])。由IL-2激活的NK细胞已被证明以更宽范围的肿瘤细胞为靶,穿孔素对肿瘤细胞的亲和力增加,这导致更显著的细胞裂解。此外,已经证明巨噬细胞在被IL-2激活后,变得更大、颗粒性更强并聚集在癌细胞上,具有更强的细胞毒性。IL-2还显示出能激活巨噬细胞以诱导肿瘤坏死因子(TNF)和其他细胞毒性分子,如自由基。通过添加和表达mIL-2基因,特别是在亚塔痘病毒属的痘病毒中,痘病毒具有增加痘病毒抗肿瘤活性的能力,从而实现更显著的黑色素瘤退化。尽管小鼠通常不是TPV的宿主,但是在本文所述异种移植无胸腺裸鼠中使用的重组TPV的一些具体示例中进行了mIL-2基因的引入。在重组TPV中添加mIL-2基因,无论是单独添加还是与其他基因修饰相结合,都表明mIL-2基因的引入可以增加对人黑色素瘤、乳腺和裸鼠结肠直肠肿瘤的抗肿瘤活性。
在其他实施例中,痘病毒可以被基因修饰以表达其他免疫刺激蛋白,例如单核细胞趋化蛋白1(mCCL2)和/或粒细胞单核细胞集落刺激因子(mGMCSF)。单核细胞趋化蛋白1可以作为记忆性T细胞(CD29+和CD45RO+)、B细胞、树突状细胞、单核细胞和/或巨噬细胞的有效炎性化学引诱剂。粒细胞单核细胞集落刺激因子可以诱导抗肿瘤细胞毒性淋巴细胞(CTL)反应。通过添加和表达mCCL2和/或mGMCSF基因,特别是在亚塔痘病毒属的痘病毒中,痘病毒具有增加痘病毒抗肿瘤活性的能力,从而实现更显著的肿瘤退化。尽管小鼠通常不是TPV的宿主,但是在本文所述异种移植无胸腺裸鼠中使用的重组TPV的一些具体示例中进行了mCCL2和/或mGMCSF基因的引入。在重组TPV中添加mCCL2和/或mGMCSF基因,无论是单独添加还是与本文提到的其他基因修饰相结合,都表明mCCL2和/或mGMCSF基因的引入可以增加对人黑色素瘤、乳腺和裸鼠结肠直肠肿瘤的抗肿瘤活性。
此外,痘病毒的溶瘤性可以通过用转基因编码痘病毒来增加癌细胞的凋亡或激活受试者的免疫系统来增加。可用于编码痘病毒的转基因的示例包括但不限于表达细胞因子、趋化因子、抗原呈递多肽或细菌抗原的基因。如本文所使用的,细胞因子是指具有免疫细胞或系统调节作用的蛋白质或多肽,例如刺激免疫细胞、促进免疫细胞生长或引导免疫细胞至特定位点。在某些优选的实施例中,使用的痘病毒是重组TPV(武装有粒细胞-单核细胞集落刺激因子(GM-CSF)、巨噬细胞趋化蛋白1(CCL2,也称为MCP-1和MCF-1)或细菌鞭毛蛋白(FliC,肠道沙门氏菌fliC基因的产物)。当用重组TPV对小鼠进行实验时,这些转基因的小鼠(m)版本在重组TPV中相关的地方使用,即,mGM-CSF、mCCL2、mMCPl、mMCF-1。优选对将要进行测试或治疗的受试者使用这些转基因的合适或有效版本。
聚合鞭毛蛋白是本公开使用的细菌鞭毛的主要成分。用于本文所述特定实验的鞭毛蛋白是肠炎沙门氏菌血清型鼠伤寒基因fliC的产物。FliC和其他细菌鞭毛蛋白是toll样受体5(TLR5)的同源配体,是哺乳动物细胞先天免疫应答的强激活剂,通过依赖MyD88的细胞内信号传递,最终激活转录因子NFKB。鞭毛蛋白是有效的多效性毒力因子,在细菌致病中具有其他重要作用。
除了上述痘病毒实施例中基因组的修饰之外,荧光报告转基因任选地插入痘病毒的基因组中。荧光报告转基因的加入极大地促进了培养细胞中病毒感染的可视化,从而促进了使用本文所述痘病毒变体的研究。优选的荧光报告转基因包括报告基因mCherry(激发/发射587nm/610nm)和增强型绿色荧光蛋白(GFP,激发/发射475nm/509nm)。
痘病毒的优选实施例包括具有任何或所有上述突变或插入的病毒,优选亚塔痘病毒属病毒,并且突变和插入优选使用p2KO载体方法进行。在一个优选的实施例中,作为亚塔痘病毒属成员的重组TPV通过本文所用的p2KO方法改变,如图1所示。如图所示,两种源自痘苗病毒(VACV)的早期/晚期合成启动子用于驱动需要表达的转基因的表达,以编码病毒(例如,mGM-CSF、mCCL2、mMCPl、mMCF-1、fliC)和任选的荧光报告转基因。图1中描述的p2KO载体方法的实施例包括在转染/感染过程中通过同源重组双交叉事件将p2KO表达盒(包括左翼和右翼,至少一个插入的开放阅读框(ORF),所述ORF包括表达的转基因或荧光报告转基因,以及至少一个启动子)转移到TPV病毒基因组,如下文更详细描述的。这样,通过使用病毒基因组侧翼序列,p2KO表达盒被引导至TPV病毒基因组中的特定点,导致所需基因的靶向消融,同时在重组TPV中表达需要表达的转基因和任选的荧光报告转基因。
在如图1所示的TPV p2KO表达盒的实施例中,多个痘病毒早期/晚期合成启动子允许多种转基因的表达。p2KO表达盒通过使用来源于靶基因的病毒基因组侧翼序列引导插入到病毒基因组中的特定点,导致所需基因的靶向消融,同时表达荧光报告转基因和表达的转基因来武装病毒。在图1所示的实施例中,显示了荧光报告转基因和表达的转基因。在替代实施例中,荧光报告转基因或表达的转基因可以存在于p2KO表达盒中,用于插入病毒基因组。左右翼由成对的独特限制位点限定。侧翼区连接到位于5'-(左)翼的Sac I限制性位点和非I限制性位点之间,以及位于3'-(右)翼的EcoR I限制性位点和Hind III限制性位点之间的p2KO载体中。要表达的基因(荧光报告基因和/或表达的转基因)由独特的5'-BamH I限制性位点和3'-Xma I限制性位点结合。从而实现由合适的限制性位点结合的简单和定向的PCR扩增子连接。
下表1显示了p2KO方法中用于本文所述示例的相关引物。在每种情况下,插入的限制性内切酶位点用下划线标出。如果适用,在正向引物中,起始密码子用灰色阴影粗体表示,在反向引物中,终止密码子用灰色阴影粗体表示。本文所述示例中使用的左翼和右翼引物不包括起始密码子或终止密码子。
表1:用于制备p2KO消融/插入载体的引物
p2KO方法的不同实施例中用于表达的转基因插入位点的ORF包括mCCL2转基因、mGM-CSF转基因和fliC转基因。在下面引用的示例中使用的mCCL2转基因是使用购买的作为携带ORF质粒的mCCL2cDNA克隆ORF(购自北京义翘神州科技有限公司)生产的。下面引用的示例中使用的mGM-CSF转基因是使用格兰特·麦克法登(Grant McFadden)博士提供的mGM-CSF的cDNA克隆ORF生产的。通过PCR从载体中扩增出mCCL2、mGM-CSF和fliC ORF,并分别在产物扩增子的5'端和3'端给出BamHI限制性序列和Xmal限制性序列。将mCCL2、mGM-CSF和fliC ORF连接到p2KO消融/插入载体中。
如下表2所示,以下缩写在本文中用于描述使用p2KO方法生产的重组TPV的各种实施例。尽管本文描述了p2KO消融/插入方法,但是应当理解,任何已知的用于消融基因组中的基因或将转基因插入基因组中的方法都可以用于形成本文所述的重组TPV。
表2:重组TPV缩写
为了选择在小鼠宿主中测试重组TPV的合适细胞系,针对一组人结肠直肠癌细胞系测试最小改变的重组TPV/egfp,以选择实现最佳病毒复制的细胞系,从而最大化直接病毒肿瘤细胞裂解的效果。检测TPV/egfp复制的hCRC细胞系包括HCT 116、COLO205、SW1463和WiDr。在某些情况下,肿瘤细胞的病毒裂解对肿瘤清除很重要,但是病毒细胞裂解只是影响肿瘤存活和清除的许多因素之一,免疫细胞浸润也可以发挥作用。尽管HCT 116产生的子代病毒颗粒比对照细胞系OMK少,但HCT 116是测试的hCRC细胞系中产量最高的。此外,许多OV的特征在于用HCT 116诱导的肿瘤。由于这些原因,HCT 116被用于进一步表征重组TPV体内溶瘤潜力的实验。
为了评价重组TPV的各种实施例,通过皮下注射5×106HCT 116细胞到无胸腺裸鼠的背侧面上,用HCT 116细胞系在无胸腺裸鼠中诱导肿瘤。当肿瘤大小达到75mm3时,将小鼠随机分成对照组或实验组,每组5只小鼠。在第0天(达到75mm3的肿瘤体积后)进行仅含有100μL载体(a组)或重组TPV(b至h组)的单次注射,此后每隔三天测量肿瘤体积。使用以下公式计算平均肿瘤体积:
平均肿瘤体积=(长)x(宽)x(高)xπ/6 (1)
在用重组TPV治疗期间,HCT 116诱导的肿瘤异种移植物的体积没有增加到预期水平。然而,在接受重组TPV治疗的小鼠中出现了多种继发性肿瘤。此外,在一些体外研究中,包括HCT 116原位异种移植模型,报告显示HCT 116细胞具有高活动性和侵入性。
图2A描述了在36天(从肿瘤质量超过75mm3时开始)的观察周期内,异种移植5×106HCT 116细胞并随后用纯载体对照溶液处理的无胸腺裸鼠中的平均肿瘤发展。以开口圆表示的平均肿瘤体积一直增加到大约第15天,自此体积稳定在大约100mm3。平均值的标准误差用条形(+/-1SEM)表示。肿瘤体积的稳定与以前的一些研究形成对比,这些研究表明,当在最初的异种移植物中使用相同或相似数量的HCT 116细胞时,裸鼠中未治疗的HCT 116肿瘤在相同的时间间隔内体积逐渐增加。例如,有报告表明HCT 116诱导的肿瘤具有大约8天的倍增时间。此外,最近的一项研究将VACV作为针对裸鼠HCT 116异种移植物的OV疗法进行了检验,显示HCT 116肿瘤在与图2A所示时间间隔相似的时间间隔内生长高达4000mm3。
在图2B所示的实施例中,黑色填充的方块表示用TP/egfp处理的组B小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组B肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2C所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mMCP-l处理的组C小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组C肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2D所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mGM-CSF处理的组D小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组D肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2E所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/fliC处理的组E小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组E肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2F所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R处理的组F小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组F肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2G所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ2L处理的组G小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组G肿瘤体积的平均值的标准误差(+/-1SEM)。
在图2H所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ2L/Δ66R/fliC处理的组H小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组H肿瘤体积的平均值的标准误差(+/-1SEM)。
参考图4A至4E,在体内显示了突变病毒在黑素瘤肿瘤模型中抑制肿瘤的效果。黑素瘤是通过皮下注射5×106SK-MEL-3细胞到背侧面在6至8周龄无胸腺裸鼠中诱导的。当肿瘤大小达到45±4.5mm3时,将小鼠随机分成对照组或实验组,每组包含5只小鼠(n=5)。实验组小鼠接受5×106pfu病毒瘤内注射,而模拟组小鼠仅接受培养基瘤内注射。每天用数字卡尺测量肿瘤体积。在所示的每个图表中,y轴代表肿瘤生长的平均百分比(%),x轴代表时间(病毒治疗天数)。将所有实验组与仅用培养基注射治疗小鼠的模拟组进行比较。条形表示平均值的标准误差(±1SEM)。标有星号(*)的点指的是与对照组相比明显减少的肿瘤生长(P≤0.05)。必要的话,每3天标记一次星号。
在图4A所示的实施例中,黑色的X表示用wtTPV处理的组A小鼠的肿瘤生长百分比和对照组A小鼠的平均肿瘤生长。条形表示对照组A肿瘤生长和组A肿瘤生长的平均值的标准误差(+/-1SEM)。
在图4B所示的实施例中,黑色填充的方块表示用TPV/p2KO/Δ66R处理的组B小鼠的肿瘤生长百分比和对照组A小鼠的肿瘤生长百分比。条形表示对照组A肿瘤生长和组B肿瘤生长的平均值的标准误差(+/-1SEM)。
在图4C所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ15L处理的组C小鼠的肿瘤生长百分比和对照组A小鼠的肿瘤生长百分比。条形表示对照组A肿瘤生长和组C肿瘤生长的平均值的标准误差(+/-1SEM)。
在图4D所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ15LΔ66R处理的组D小鼠的肿瘤生长百分比和对照组A小鼠的肿瘤生长百分比。条形表示对照组A肿瘤生长和组D肿瘤生长的平均值的标准误差(+/-1SEM)。
在图4E所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mlL-2处理的组E小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组E肿瘤体积的平均值的标准误差(+/-1SEM)。
参考图5A至5J,在体内显示了突变病毒在黑素瘤肿瘤模型中抑制肿瘤的效果。黑素瘤是通过皮下注射5×106MDA-MB-231细胞到背侧面在6至8周龄无胸腺裸鼠中诱导的。当肿瘤大小达到45±4.5mm3时,将小鼠随机分成对照组或实验组,每组包含5只小鼠(n=5)。实验组小鼠接受5×106pfu病毒瘤内注射,而模拟组小鼠仅接受培养基瘤内注射。每天用数字卡尺测量肿瘤体积。在所示的每个图表中,y轴代表肿瘤生长的平均百分比(%),x轴代表时间(病毒治疗天数)。将所有实验组与仅用培养基注射治疗小鼠的模拟组进行比较。条形表示平均值的标准误差(±1SEM)。标有星号(*)的点指的是与对照组相比明显减少的肿瘤生长(P≤0.05)。必要的话,每3天标记一次星号。
在图5A所示的实施例中,黑色填充的方块表示用wtTPV处理的组A小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组A肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5B所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mCCL2处理的组B小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组B肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5C所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R处理的组C小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组C肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5D所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mlL2处理的组D小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组D肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5E所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/mGMCSF处理的组E小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组E肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5F所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ2L处理的组F小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组F肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5G所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/FliC处理的组G小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组G肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5H所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/Δ2L处理的组H小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组H肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5I所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ66R/Δ2L/FliC处理的组I小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组I肿瘤体积的平均值的标准误差(+/-1SEM)。
在图5J所示的实施例中,黑色填充的方块表示用TPV-p2KO/Δ15L处理的组J小鼠的平均肿瘤体积和对照组A小鼠的平均肿瘤体积。条形表示对照组A肿瘤体积和组J肿瘤体积的平均值的标准误差(+/-1SEM)。
本文使用的重组TPV的一个特别优选的实施例是将fliC转基因添加到双敲除背景(Δ66R和Δ2L)的重组TPV。我们的结果表明,表达fliC转基因的2L和66R缺失的重组TPV对HCT 116肿瘤异种移植物产生了强有力和持久的治疗效果。本文使用的重组TPV的另一个优选实施例是将fliC转基因添加到单敲除病毒(Δ66R)的重组TPV。两个单敲除重组TPV实施例(TPV-p2KO/Δ66R和TPV-p2KO/Δ2L)显示肿瘤体积在至少两个时间点有统计学上的显著减少,并且在每种情况下,观察到的肿瘤体积的显著减少在时间上远离病毒治疗接种点。两种单敲除重组TPV似乎都倾向于在以后的时间点发挥作用。事实上,除了TPV/egfp病毒,所有测试的重组TPV的实施例似乎都产生了一定程度的肿瘤消融,优选上述重组TPV。由于裸鼠中依赖于T细胞的适应性免疫应答严重受损,本文所述的示例证明先天免疫应答有可能减轻受试者的肿瘤负担,因此,预计武装有先天免疫应答激活剂的重组TPV对患有免疫缺陷综合征的受试者有用。因此,我们得出结论,武装有先天免疫应答激活剂的OV对于患有免疫缺陷综合征的个体也是有用的。
作为一种高度保守的病原体相关分子模式(PAMP),鞭毛蛋白是参与细胞溶质免疫监测的检测分子的靶标。例如,Nod样受体NCLR4(也称为Ipaf)对鞭毛蛋白的检测触发Ipaf炎症体的激活,进而激活半胱天冬酶-1和巨噬细胞中细胞因子白细胞介素1β(IL-1β)的成熟。尽管在OV感染过程中产生的FliC的量预计很小,但在小鼠中,通过尾静脉注射给药的微量的细菌鞭毛蛋白(≤5μg/动物)都会引起细胞因子TNF、IL-1β、IL-6和趋化因子MIP-2(IL-8)的整体(即,在器官和血浆中)升高,以及MEK细胞内信号通路的变化。因此,FliC在哺乳动物细胞中的作用部分独立于基于TLR的PAMP检测器,目前尚未完全阐明。然而,基于本文所述的结果,表达FliC的重组TPV激活先天免疫应答似乎有助于减小具有完整先天免疫应答的裸鼠的肿瘤质量。
如表2、本文的描述和附图所示,每个TPV重组体可以用p2KO名称表示,也可以不用p2KO名称表示。例如,TPV-p2KO/Δ66R在本文中也可以同样称为TPV/Δ66R。本文描述的用于消融/插入的p2KO方法并不是限制性的,应当理解,任何已知的用于消融基因组中的基因或将转基因插入基因组中的方法都可以用于形成TPV重组体。如示例和详细描述中所述,本文提供的任何基因可以以任何顺序消融和/或添加到TPV基因组中。例如,痘病毒,特别是亚塔痘病毒属的痘病毒,可能消融了66R、2L和/或15L基因;此外,还可能添加了例如mGM-CSF、mMCP-1、fliC、mlL-2、mCCL2和/或mGMCSF转基因。本文所述基因的任何组合都可以被消融和/或添加到所需的TPV重组体中。在一些实施例中,皮肤癌或黑素瘤可以如本文所述用wt-TPV、TPV/Δ66R、TPV/Δ66R/mGMCSF、TPV/Δ15L、TPV/Δ66R/Δ15、TPV/Δ66R/mIL-2和/或其组合来治疗。在其他实施例中,乳腺癌可以如本文所述用wt-TPV、TPV/Δ66R、TPV/Δ2L、TPV/Δ66R/Δ2L、TPV/Δ66R/FliC、TPV/Δ66R/Δ2L/FliC、TPV/Δ66R/mGMCSF、TPV/Δ66R/mCCL2(mMCPl)、TPV/Δ15L、TPV/Δ66R/Δ15、TPV/Δ66R/mIL-2和/或其组合来治疗。在其他实施例中,结肠直肠癌可以如本文所述用TPV/Δ66R、TPV/Δ2L、TPV/Δ66R/Δ2L、TPV/Δ66R/FliC、TPV/Δ66R/Δ2L/FliC、TPV/Δ66R/mGMCSF、TPV/Δ66R/mCCL2(mMCPl)和/或其组合来治疗。
非限制性实施例列表
实施例A是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,其包括:亚塔痘病毒属病毒,其具有至少一个突变,其中,所述至少一个突变导致所述病毒抑制TNF结合蛋白的表达。
根据实施例A所述的组合物,其中,抑制TNF结合蛋白的表达的病毒具有能够结合MHC-1轻链的结构。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,病毒是亚塔痘病毒,其编码表达细菌鞭毛蛋白的转基因。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,聚合的鞭毛蛋白是细菌鞭毛蛋白的主要成分。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,转基因是鼠伤寒沙门氏菌肠道血清型基因(“fliC”)的产物。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,所述病毒是塔纳痘病毒(TPV),并且其中,所述至少一个突变抑制由TPV的2L基因编码的TNF结合蛋白的表达。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,所述病毒具有第二突变,并且其中,第二突变导致所述病毒抑制胸苷激酶的表达。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,所述病毒是塔纳痘病毒(TPV),并且其中,第二突变抑制由TPV的66R基因编码的胸苷激酶的表达。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,病毒进一步编码转基因以增加癌细胞的凋亡。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,病毒进一步编码转基因以激活受试者的免疫系统。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,病毒进一步编码转基因以引入mCherry荧光报告基因。
根据实施例A或具有一个或多个中间特征的实施例A所述的组合物,其中,病毒进一步编码转基因以引入绿色荧光蛋白荧光报告基因。
实施例B是用于治疗具有免疫系统的受试者的体内癌细胞的组合物,其包括:亚塔痘病毒属病毒,其具有至少一个突变,其中,所述至少一个突变导致胸苷激酶(TK)的表达受到抑制。
根据实施例B所述的组合物,其中,病毒是痘病毒,其编码表达细菌鞭毛蛋白的转基因。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,转基因是鼠伤寒沙门氏菌肠道血清型基因(“fliC”)的产物。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,所述病毒是塔纳痘病毒(TPV),并且其中,所述至少一个突变抑制由TPV的66R基因编码的胸苷激酶的表达。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,所述病毒具有第二突变,并且其中,第二突变导致所述病毒抑制TNF结合蛋白的表达。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,所述病毒是塔纳痘病毒(TPV),并且其中,第二突变抑制由TPV的2L基因编码的TNF结合蛋白的表达。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,抑制TNF结合蛋白的表达的病毒具有能够结合MHC-1轻链的结构。
根据实施例B或具有一个或多个中间特征的实施例B所述的组合物,其中,病毒进一步编码转基因以增加癌细胞的凋亡。
根据实施例B或具有一个或多个中间特征的实施例B,其中,病毒进一步编码转基因以激活受试者的免疫系统。
实施例C是一种将至少一个基因递送至受试者体内癌细胞的方法,包括:通过突变亚塔痘病毒属病毒来抑制具有能够结合MHC-1轻链的结构的TNF结合蛋白的表达,以修饰病毒;以及对受试者全身施用修饰的亚塔痘病毒属病毒。
实施例C所述的方法进一步包括:通过编码病毒中的至少一个基因来修饰病毒,其中,所述至少一个基因导致癌细胞凋亡增加或激活受试者的免疫应答。
实验的详细描述:
使用来自美国典型培养物保藏中心的OMK(枭猴肾)细胞、HCT 116、SK-MEL-3、MDA-MB-231、COLO 205、SW1463和WiDr细胞系(美国典型培养物保藏中心产品编号分别是CRL-1556、CCL-247、CCL-222、CCL-234和CCL-218)。OMK细胞用于本文所述的病毒扩增和病毒滴定。细胞系在完整的生长培养基中繁殖,该培养基由DMEM(可从Gibco/Life Technologies公司获得)补充10%(体积/体积)胎牛血清(可从Atlanta Biologicals公司获得)、2mM L-谷氨酰胺(可从Sigma-Aldrich公司获得)和50μg/ml硫酸庆大霉素(可从AMRESCO公司获得)组成。病毒感染后,细胞系的细胞单层保持在维持培养基中,该培养基与生长培养基相同,除了胎牛血清的浓度降低到2%。细胞在37℃和5%CO2气氛中培养。使用0.2%(重量/体积)台盼蓝,用改进的Neubauer血细胞计数器进行细胞计数和细胞活力测定。SK-MEL-3黑素瘤细胞在由McCoy's 5A培养基(Sigma-Aldrich)和15%FBS组成的生长培养基中培养。McCoy's 5A无血清培养基被用作黑素瘤生长的饥饿培养基。
实验1:对照
野生型TPV(肯尼亚菌株)由(美国佐治亚州亚特兰大疾病控制中心的)约瑟夫·埃斯波西托(Joseph Esposito)博士提供。如本文所述对野生型TPV进行了修饰,以形成表达荧光报告基因EGFP的对照重组TPV(没有其他基因修饰)。简而言之,使用p2KO方法,使用两种相同的痘苗病毒(VACV)衍生的早期/晚期合成启动子来驱动荧光报告基因在对照重组TPV中的表达。(包括左翼和右翼,加上中间的开放阅读框(ORF)和启动子的)p2KO表达盒在转染/感染过程中通过同源重组双交叉事件转移到野生型TPV病毒基因组,形成对照重组TPV。用于重组的侧翼区连接到位于5'-(左)翼的Sac I限制性位点和非I限制性位点之间,以及位于3'-(右)翼的EcoR I限制性位点和Hind III限制性位点之间的P2ko载体中。
实验2:转染/感染程序
使用转染/感染程序来生产在这些示例性实施例中使用的重组TPV。简而言之,根据转染试剂的转染方案制造商的规定,使用(可从PolyPlus Transfection SA公司获得的)jetPRIME转染试剂以每μg纯化p2KO载体1μl转染试剂的浓度转染OMK细胞。转染后约5小时,用(非荧光的)野生型TPV-肯尼亚菌株的每个细胞1个噬斑形成单位(pfu/细胞)接种OMK单层。接种后5天,用橡胶细胞刮棒在冰上刮擦受感染的单层,在-80℃下进行三次冻融循环,在4℃下进行15秒的超声处理,连续稀释并以大约90%的覆盖率铺在新接种的OMK单层上,并覆盖有含有0.5%甲基纤维素的维持培养基。挑选荧光的、分离良好的噬斑,并对每个挑选的噬斑进行至少三轮的纯化,以产生不含可见野生型(非荧光)噬斑的病毒制剂。只有在培养物中看不到野生型噬斑,并且通过PCR检测不到野生型TPV DNA时,样本才被认为是纯的。
实验3:病毒转基因表达的确认
FliC表达的验证通过蛋白质印迹完成。mCCL2和mGM-CSF表达的验证(由马里兰大学细胞因子核心实验室)通过Luminex多分析细胞因子检测分析完成。通过使半融合OMK细胞单层在60mm(具有22.1cm2的可用于细胞生长的表面积的)组织培养皿中基于10pfu/细胞感染TPV-p2KO/Δ66R/mCCL2、TPV-p2KO/Δ66R/mGM-CSF和TPV-p2KO/Δ2L/Δ66R/fliC来制备用于分析的样本。在感染后的指定时间制备上清液(3ml/皿)和细胞质提取物。对于FliC检测,通过蛋白质印迹分析提取的裂解物。将蛋白质转移到PVDF膜上(可从Millipore公司获得),并以1:2000的稀释度(体积/体积)用抗FliC单克隆抗体(可从BioLegend公司获得)进行探测。奶粉5%(重量/体积)用作封闭剂。二级抗体是一种与辣根过氧化物酶(可从Abeam公司获得)结合的单克隆抗小鼠IgG,以1:2500的稀释度使用。可视化是由ECL(Thermo Scientific/Pierce)完成的。含有p2KO载体但没有fliC、mGM-CSF或mCCL2插入物的TPV重组体的实施例用作对照。
实验4:细胞密度测定
将四个人结肠直肠癌细胞系和OMK细胞对照分别接种到12孔板(每个细胞系3个孔)中,使得一天后细胞达到90%的融合。将(具有3.8cm2的可用于细胞生长的表面积的)每个孔胰蛋白酶化、计数,并通过台盼蓝排除法对生存力评分。这样做是为了确保每种细胞系在特定数量的病毒pfu/细胞时的实验是准确的。
对于人黑素瘤癌细胞系,细胞在37℃下5%CO2气氛中培养。所有细胞计数和生存力测定均使用改良的Neubauer血细胞计数器和0.2%(w/v)台盼蓝在生理盐水溶液中进行。
对于人乳腺癌细胞系,细胞在37℃下5%CO2气氛中培养。通过用于测量细胞增殖的细胞计数试剂盒-8进行所有细胞计数和生存力测定。该试剂盒替代了3H-胸腺嘧啶核苷掺入法(Dojindo Molecular Technologies公司的CCK-8,马里兰州洛克维尔市西古德路30号260室,邮编20850)。
实验5:病毒滴定
为了测定样本中存在的活的重组TPV病毒颗粒的数量,使用了噬斑测定法。简而言之,病毒样本在冰上超声处理15秒,在维持培养基中连续稀释,并接种到6孔板中几乎融合的OMK单层上(样本每次稀释n=3)。在室温下温和摇动1小时,让病毒吸附。然后移除接种物,每个孔用1ml预热的维持培养基轻轻洗涤两次。洗涤后,加入2ml覆盖培养基,将感染的OMK单层在37℃下培养10天。然后除去覆盖培养基并(使用37%甲醛中的0.1%结晶紫)染色单层。用蒸馏水洗涤平板,在空气中干燥,并计算噬斑的数量。
实验6:动物
对于结直肠癌细胞系,雄性新生无胸腺裸(Nude-Foxn1nu/nu)鼠(可通过Harlan实验室获得)在四周大时接受,并在实验开始前让其适应一周。在12小时/12小时的光照/黑暗循环下,小鼠被单独饲养在透明的聚碳酸酯笼子中。食物和水可以随意获得。所有动物的居住条件、操作和治疗都是根据西密歇根大学动物护理和使用机构委员会批准的协议进行的(IACUC协议编号13-07-01)。
对于乳腺癌和黑素瘤癌细胞系,从Charles River公司(美国马萨诸塞州威尔明顿)购买6至8周龄的雄性无胸腺裸鼠(Crl:NU(NCr)-Foxnlnu)。小鼠被单独饲养,食物和水可在无病原体动物设施中获得。所有动物的居住条件、操作和治疗都是根据西密歇根大学动物护理和使用机构委员会批准的协议进行的(IACUC协议编号13-07-01)。
实验7:裸鼠肿瘤异种移植细胞系的选择
在对无胸腺裸鼠进行体内研究之前,我们确定了当感染TPV/egfp时,哪种hCRC细胞系具有最高的病毒增殖力。检测TPV/egfp在四种来源于hCRC的细胞系中的复制能力:HCT 116、SK-MEL-3、MDA-MB-231、WiDr、SW1463和COLO 205。OMK细胞被用作阳性对照。将每个细胞系接种到12孔组织培养板中(具有3.8cm2可用于细胞生长的表面积),并将0.1pfu/细胞的TPV/egfp接种到每个孔中。感染后4天收集裂解物,并通过噬斑试验进行分析。
实验8:肿瘤诱导和测量
肿瘤是通过在背侧面(大约在第一腰椎上方)皮下注射5×106HCT 116细胞在无胸腺裸鼠中产生的。每次注射后,用台盼蓝排除法评估细胞活力,以确保细胞在注射时和注射后是有活力的。一旦可见,使用数字卡尺(匹兹堡型号6ZBTMCO)沿着长轴(长度)、短轴(宽度)和z维(高度)测量肿瘤。然后使用本文给出的公式1估计肿瘤的体积。当肿瘤大小估计值达到或超过75mm3时,将每只动物随机分为对照组(组a)或七个实验组之一(组b至h)。
实验9:裸鼠中HCT 116异种移植物的病毒治疗
每个治疗组由五或六只荷瘤无胸腺裸鼠组成。一旦肿瘤体积达到或超过75mm3,对每只荷瘤小鼠进行单次病毒治疗注射。在5×106pfu的单次注射悬浮在稀释于生理盐水中的100μI OMK细胞裂解粗产物中时,肿瘤内进行病毒治疗注射。此后每隔三天测量并记录每只小鼠的体重和肿瘤体积。在总共39天内收集了13个时间点的数据。为了控制由施用重组TPV注射液产生的预料之外的炎症或其他注射效果,使用载体对照组,在此表示为组a。该对照组包括接受HCT 116细胞但仅接受模拟重组TPV注射(仅100μI载体)的动物。该组被称为“模拟病毒疗法”组或组A。所有实验组均与组A进行比较,以评估重组TPV的治疗效果。
为了评估治疗效果,使用曼-惠特尼U检验(有时称为威尔科克森秩和检验)将每个实验组与对照组a进行比较。如果与模拟注射对照相比,一组中的平均肿瘤体积显著减少,则认为用重组TPV治疗产生了显著的治疗效果。在整个研究中使用了显著性水平p<0.05。
结果:p2KO痘病毒消融/插入载体
p2KO痘病毒消融/插入载体的设计和构建为同时消融任何所需的TPV基因和用所需表达的荧光报告基因和/或所需表达的转基因替换消融的基因提供了快速和可靠的方法。荧光报告基因mCherry和EGFP的加入极大地促进了培养细胞中病毒感染的可视化。使用两个荧光报告基因使得鉴定和分离带有fliC插入的双缺失重组TPV(TPV-p2KO/Δ2L/Δ66R/fliC)成为可能。通过在OMK细胞单层上感染TPV-p2KO/Δ2L/Δ66R/fliC病毒而产生的病毒噬斑显示在图3中,并显示分别与mCherry和EGFP相关的亮橙红色和绿色的同时表达。
碱基载体的整个序列(即,有荧光报告基因但没有要表达的任选转基因)通过扩增子的DNA测序来验证,所述扩增子是通过M13正向和反向引物结合序列之间区域的PCR扩增产生的。编码mCCL2、mGM-CSF或fliC的ORF的插入通过p2KO载体的DNA测序来验证,以确保其在用于转染/感染程序前被正确放置和定向。通过使用重组病毒DNA作为模板对PCR产物进行琼脂糖凝胶分析,证实重组TPV中2L、66R或两者都被敲除。
结果:转染/感染
接种后4至5天,荧光报告基因在OMK细胞单层中的表达明显,表明p2KO载体的基因在野生型TPV感染细胞的胞质室中表达。在用p2KO载体转染但随后没有用野生型TPV接种的对照培养物中,没有观察到荧光。然后,在进一步使用之前,使用重组病毒基因组DNA作为模板,通过PCR验证病毒样本的纯度。检测所有病毒DNA样本中氨苄青霉素抗性基因的存在,结果是在任何重组TPV中都没有检测到。这表明所有重组TPV都是由双交叉事件而不是单交叉事件产生的。
结果:病毒转基因表达的确认
为了证明插入的ORF在感染了重组TPV(包括TPV p2KO/Δ66R/mCCL2、p2KO/Δ66R/mGM-CSF和TPV-p2KO/Δ2L/Δ66R/fliC)的细胞中表达,用相关的重组TPV接种60mm培养皿(生长面积为20cm2)中的OMK单层,并如上所述分析细胞裂解物和培养上清液中的转基因表达。用单克隆抗FliC抗体检测接种TPV-p2KO/Δ2L/Δ66R/fliC的OMK细胞裂解物的蛋白质印迹。正如预期的那样,观察到表观分子量为50kDa的单个条带,与FliC阳性对照一样。在感染后的第三天和第六天之间,该条带的强度逐渐增加。在模拟感染细胞中未检测到FliC转基因。分析受感染的细胞裂解物及其培养上清液,以确定mCCL2和mGM-CSF的存在。两种转基因均高度表达,并大量存在于感染细胞上清液中(4.9ng/ml的mCCL2,以及大于10.0ng/ml的mGM-CSF)。在感染细胞或对照未感染细胞的细胞质提取物中,以及在感染了不表达这些转基因的TPV的细胞中,都只能微弱地检测到或检测不到mGM-CSF和mCCL2。这些数据表明,正如预期的那样,mCCL2和mGM-CSF都是由感染细胞分泌的,FliC也是在感染细胞的细胞质中积累的。
结果:细胞密度测定
对本研究中使用的每种细胞系在接近融合处测定其融合密度(细胞/cm2)。OMK对照细胞系具有大约1.0x105细胞/cm2的融合密度。结肠直肠癌细胞系的密度测定如下:HCT 116的融合密度约为1.4×105细胞/cm2;COLO205的融合密度约为6.9×105细胞/cm2;SW1463的融合密度约为4.5×105细胞/cm2;WiDr的融合密度约为2.5×105细胞/cm2。这些值用于计算接种这些细胞系时使用的pfu的数量。
结果:裸鼠中HCT 116异种移植物的病毒治疗
如上所述,在对无胸腺裸鼠进行体内研究之前,当感染TPV/egfp时,发现OMK细胞是具有最高病毒增殖力的hCRC细胞系。OMK细胞是最好的宿主细胞,可以产生大约3×106个子代pfu/孔。在测试的hCRC细胞系中,HCT 116产生的子代病毒颗粒最多,平均产量(n=3)约为7×105个子代pfu/孔。因此,我们为本研究的体内阶段选择了HCT 116。
为了评估重组TPV的溶瘤潜力,在无胸腺裸鼠中诱导肿瘤(Nude-Foxn1nu/nu)。HCT 116细胞的生存力计数表明,注射时大于99%是有生存力的。肿瘤通常在注射HCT 116后一至三周内达到75mm3。与模拟注射对照相比,用TPV/Δ66R(组F)、TPV/Δ2L(组G)和TPV/Δ2L/Δ66R/fliC(组H)治疗时,在两个或更多时间点都可以显著减小肿瘤大小。在治疗后的两个时间点,即33天(减小47.6%)和36天(减小65.2%),TPV/Δ2L治疗的肿瘤(组G)明显小于模拟注射的肿瘤。在治疗后的两个时间点,即27天(减小34.9%)和36天(减小52%),TPV/Δ66R治疗的肿瘤(组F)明显小于模拟注射的肿瘤。在治疗后的6个时间点,即15天(减小56.1%)、21天(减小62.0%)、24天(减小63.8%)、27天(减小59.5%)、33天(减小55.3%)和36天(减小69.6%)时,TPV/Δ2L/Δ66R/fliC治疗的肿瘤(组H)显示出强大和持久的治疗效果,并且体积显著减小。
结果:裸鼠中SL-MEL-3异种移植物的病毒治疗
通过在肩胛间区背侧面皮下注射5X106SK-MEL-3细胞,在无胸腺裸鼠中诱导黑素瘤。当肿瘤大小发展到45±4.5mm3时,将小鼠随机分为4组,分别用瘤内注射模拟(仅培养基)、wtTPV、TPVΔ66R、TPVΔ15L、TPVΔ15LΔ66R和TPVΔ66R/mIL-2进行治疗。如图4A至4E所示,用TPVΔ66R/mIL-2治疗的动物的平均肿瘤大小明显小于用模拟注射治疗的小鼠。此外,用TPVΔ66R/mIL-2治疗的小鼠肿瘤体积小于用wtTPV或TPVΔ66R治疗的小鼠,差异有统计学意义(P<0.05)。用TPVΔ66R/mIL-2治疗的肿瘤的平均肿瘤体积从第0天(治疗当天)的约45mm3增加到第35天的64mm3,而用模拟培养基注射治疗的肿瘤的平均肿瘤体积从第0天的46mm3增加到第35天的310mm3。用wtTPV治疗的肿瘤的平均肿瘤体积从第0天的45mm3增加到第35天的153mm3,而用TPVΔ66R治疗的肿瘤的平均肿瘤体积从第0天的45mm3增加到第35天的155mm3。体外研究表明,与wtTPV和TPVΔ66R相比,TPVΔ66R/mIL-2的复制动力学减弱。基于此,体内结果高度表明,除了直接的病毒细胞溶解之外,IL-2在引发用于肿瘤减少的先天免疫应答中具有免疫刺激作用。
结果:裸鼠中MDA-MB-231异种移植物的病毒治疗
通过在肩胛间区背侧面皮下注射5X106MDA-MB-231细胞,在无胸腺裸鼠中诱导乳腺癌肿瘤。当肿瘤大小发展到45±4.5mm3时,将小鼠随机分为4组,分别用瘤内注射模拟(仅培养基)、wt-TPV、TPV/Δ66R/mCCL2(mMCPl)、TPV/Δ66R、TPV/Δ66R/mIL-2、TPV/Δ66R/mGMCSF、TPV/Δ2L、TPV/Δ66R/FliC、TPV/Δ66R/Δ2L、TPV/Δ66R/Δ2L/FliC和TPV/Δ15L进行治疗。如图5A至5J所示,用重组TPV治疗的动物的平均肿瘤大小明显小于用模拟注射治疗的小鼠。此外,用重组TPV治疗的小鼠肿瘤体积小于用wtTPV和模拟注射治疗的小鼠,差异有统计学意义(P<0.05)。图5A至5J对应每个重组TPV变体治疗的肿瘤的平均肿瘤体积。TPV重组体能够感染人类乳腺癌细胞并在其中复制,尽管TK基因的消融降低了病毒的复制能力。TPV重组体以剂量依赖的方式显著降低了人乳腺癌细胞的细胞活力,并且观察到hTNBC(2L)、TPV/Δ66R/mCCL2(mMCPl)和TPV/Δ66R/mIL-2重组体的显著退化。体外研究表明,重组TPV的复制动力学减弱。基于此,体内结果高度表明,除了直接的病毒细胞溶解之外,这些重组TPV在引发用于肿瘤减少的先天免疫应答中具有免疫刺激作用。
虽然最初的测试是使用人结肠直肠癌细胞系进行的,但是本文所述的药物病毒疗法旨在用于治疗多种癌症。用本文所述的药物组合物治疗的癌症的非限制性列表包括:基底细胞癌、上皮癌、绒毛膜癌、胶质瘤、上皮内肿瘤、白血病、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、黑素瘤、骨髓瘤、神经母细胞瘤、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、胆道癌、膀胱癌、骨癌、脑癌、乳腺癌、中枢神经系统癌、宫颈癌、结肠癌和直肠癌、结缔组织癌、消化系统癌、子宫内膜细胞癌、食道癌、眼癌、胃癌、头颈癌、肾癌、喉癌、肝癌、肺癌、胰腺癌、前列腺癌、口腔癌、卵巢癌、呼吸系统癌、皮肤癌、胃癌、睾丸癌、甲状腺癌、子宫癌和泌尿系统癌。
本文所述的药物组合物将以治疗有效剂量给药。本文使用的术语“治疗有效剂量”是指给药后有效达到所需治疗结果的药物量。根据疾病状态、年龄、性别和个体体重、药物形式和剂型在个体中引发所需反应的能力等因素,治疗有效剂量可以因患者而异。可以通过从低的、安全的剂量开始,然后逐步增加到更高的剂量来确定治疗有效剂量,同时监测治疗效果(例如癌细胞生长的减少)以及是否存在任何有害副作用。药物组合物可以包括痘病毒、病毒核酸或表达载体,以产生所需的病毒治疗效果。
药物组合物可以通过本领域已知的任何合适的剂型或途径给药,包括但不限于胃肠外、口服、肠内、口腔、鼻腔、局部、直肠、阴道、经粘膜、表皮、透皮、皮肤、眼内、肺和皮下给药途径,以提供全身或局部的治疗有效剂量。药物将以适合特定给药途径的剂型或制剂形式施用于受试者。适用于给药的剂型可以包括但不限于:气雾剂、分散体、乳剂、埋植剂、脂质体制剂、滴鼻剂、贴剂、粉剂、溶液、喷雾剂、栓剂和混悬液。制剂可以以单位剂型存在,并且可以通过本领域已知的任何方法制备。制备这些制剂或剂型的方法包括将本发明的痘病毒或核酸与一种或多种药学上可接受的载体结合的步骤,并且还可以包含添加剂,例如但不限于:稳定剂、防腐剂和有助于药物细胞摄取的转染促进剂。合适的稳定剂可以包括但不限于:白蛋白、EDTA、甘氨酸和谷氨酸一钠。合适的防腐剂可以包括但不限于:抗生素、羟基苯甲酸甲酯、苯酚、2-苯氧基乙醇、山梨酸钾、苯甲酸钠和硫柳汞。
药物组合物可以局部递送到需要治疗的受试者的肿瘤部位的靶组织或器官中。将有效剂量的组合物通过受试者的皮肤直接注射到肿瘤部位,或者使用注射器在暴露的外科手术区域注射。在某些实施例中,可以使用可植入给药装置注射药物组合物。
同样需要注意,在示例性实施例中示出和描述的组合物的元件的构造和布置仅仅是说明性的。尽管在本发明中仅详细描述了本发明的几个实施例,但是阅读本发明的本领域技术人员将容易理解,在实质上不脱离所述主题的新颖教导和优点的前提下,许多修改是可能的(例如,各种元件的尺寸、大小、结构、形状和比例、参数值、安装布置、材料的使用、颜色、方向等的变化)。例如,显示为一体形成的元件可以由多个部件构成,或者显示为多个部件的元件可以一体形成,界面的操作可以颠倒或者以其他方式变化,系统的结构和/或构件或连接器或其他元件的长度或宽度可以变化,元件之间提供的调节位置的性质或数量可以变化。应当注意,系统的元件和/或组件可以由具有足够强度或耐久性的多种材料中的任何一种形成,具有多种颜色、纹理和组合中的任何一种。因此,所有这些修改都旨在包括在本发明的范围内。在不脱离本发明的精神的情况下,可以对期望的和其他示例性实施例的设计、操作条件和布置进行其他替换、修改、改变和省略。
应当理解,所描述的过程中的任何所述过程或步骤可以与其他公开的过程或步骤相结合,以形成本设备范围内的结构。本文公开的示例性结构和过程是为了说明的目的,不应被解释为限制。
还应当理解,在不脱离本设备的概念的情况下,可以对上述结构和方法进行变化和修改,并且还应当理解,这些概念旨在由所附权利要求书覆盖,除非这些权利要求书另有明确的语言说明。
以上描述仅被认为是图示实施例的描述。本领域技术人员以及制造或使用该设备的人员将会想到对该设备的修改。因此,应当理解,附图中所示和上面描述的实施例仅仅是为了说明的目的,并不旨在限制设备的范围,设备的范围由根据包括等同原则在内的专利法的原则解释的所附权利要求来限定。
序列表
<110> 西密歇根大学研究基金会
<120> 用于治疗癌细胞的组合物及其方法
<130> WES019 P360
<140> 15/407,912
<141> 2017-01-17
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1500
<212> DNA
<213> 细菌性鼠伤寒沙门氏菌(Bacterial Salmonella typhimurium)
<220>
<221> gene
<222> (1)..(1500)
<223> Fli.C
<400> 1
aaggaaaaga tcatggcaca agtcattaat acaaacagcc tgtcgctgtt gacccagaat 60
aacctgaaca aatcccagtc cgctctgggc accgctatcg agcgtctgtc ttccggtctg 120
cgtatcaaca gcgcgaaaga cgatgcggca ggtcaggcga ttgctaaccg ttttaccgcg 180
aacatcaaag gtctgactca ggcttcccgt aacgctaacg acggtatctc cattgcgcag 240
accactgaag gcgcgctgaa cgaaatcaac aacaacctgc agcgtgtgcg tgaactggcg 300
gttcagtctg ctaacagcac caactcccag tctgacctcg actccatcca ggctgaaatc 360
acccagcgcc tgaacgaaat cgaccgtgta tccggccaga ctcagttcaa cggcgtgaaa 420
gtcctggcgc aggacaacac cctgaccatc caggttggtg ccaacgacgg tgaaactatc 480
gatatcgatc tgaagcagat caactctcag accctgggtc tggatacgct gaatgtgcaa 540
caaaaatata aggtcagcga tacggctgca actgttacag gatatgccga tactacgatt 600
gctttagaca atagtacttt taaagcctcg gctactggtc ttggtggtac tgaccagaaa 660
attgatggcg atttaaaatt tgatgatacg actggaaaat attacgccaa agttaccgtt 720
acggggggaa ctggtaaaga tggctattat gaagtttccg ttgataagac gaacggtgag 780
gtgactcttg ctggcggtgc gacttccccg cttacaggtg gactacctgc gacagcaact 840
gaggatgtga aaaatgtaca agttgcaaat gctgatttga cagaggctaa agccgcattg 900
acagcagcag gtgttaccgg cacagcatct gttgttaaga tgtcttatac tgataataac 960
ggtaaaacta ttgatggtgg tttagcagtt aaggtaggcg atgattacta ttctgcaact 1020
caaaataaag atggttccat aagtattaat actacgaaat acactgcaga tgacggtaca 1080
tccaaaactg cactaaacaa actgggtggc gcagacggca aaaccgaagt tgtttctatt 1140
ggtggtaaaa cttacgctgc aagtaaagcc gaaggtcaca actttaaagc acagcctgat 1200
ctggcggaag cggctgctac aaccaccgaa aacccgctgc agaaaattga tgctgctttg 1260
gcacaggttg acacgttacg ttctgacctg ggtgcggtac agaaccgttt caactccgct 1320
attaccaacc tgggcaacac cgtaaacaac ctgacttctg cccgtagccg tatcgaagat 1380
tccgactacg cgaccgaagt ttccaacatg tctcgcgcgc agattctgca gcaggccggt 1440
acctccgttc tggcgcaggc gaaccaggtt ccgcaaaacg tcctctcttt actgcgttaa 1500
<210> 2
<211> 510
<212> DNA
<213> 无胸腺裸鼠(Athymic nude mouse)
<220>
<221> gene
<222> (1)..(510)
<223> mIL-2
<400> 2
atgtacagca tgcagctcgc atcctgtgtc acattgacac ttgtgctcct tgtcaacagc 60
gcacccactt caagctccac ttcaagctct acagcggaag cacagcagca gcagcagcag 120
cagcagcagc agcagcagca cctggagcag ctgttgatgg acctacagga gctcctgagc 180
aggatggaga attacaggaa cctgaaactc cccaggatgc tcaccttcaa attttacttg 240
cccaagcagg ccacagaatt gaaagatctt cagtgcctag aagatgaact tggacctctg 300
cggcatgttc tggatttgac tcaaagcaaa agctttcaat tggaagatgc tgagaatttc 360
atcagcaata tcagagtaac tgttgtaaaa ctaaagggct ctgacaacac atttgagtgc 420
caattcgatg atgagtcagc aactgtggtg gactttctga ggagatggat agccttctgt 480
caaagcatca tctcaacaag ccctcaataa 510
<210> 3
<211> 426
<212> DNA
<213> 无胸腺裸鼠(Athymic nude mouse)
<220>
<221> gene
<222> (1)..(426)
<223> mGM-CSF
<400> 3
atgtggctgc agaatttact tttcctgggc attgtggtct acagcctctc agcacccacc 60
cgctcaccca tcactgtcac ccggccttgg aagcatgtag aggccatcaa agaagccctg 120
aacctcctgg atgacatgcc tgtcacgttg aatgaagagg tagaagtcgt ctctaacgag 180
ttctccttca agaagctaac atgtgtgcag acccgcctga agatattcga gcagggtcta 240
cggggcaatt tcaccaaact caagggcgcc ttgaacatga cagccagcta ctaccagaca 300
tactgccccc caactccgga aacggactgt gaaacacaag ttaccaccta tgcggatttc 360
atagacagcc ttaaaacctt tctgactgat atcccctttg aatgcaaaaa accaggccaa 420
aaatga 426
<210> 4
<211> 447
<212> DNA
<213> 无胸腺裸鼠(Athymic nude mouse)
<220>
<221> gene
<222> (1)..(447)
<223> mCCL-2
<400> 4
atgcaggtcc ctgtcatgct tctgggcctg ctgttcacag ttgccggctg gagcatccac 60
gtgttggctc agccagatgc agttaacgcc ccactcacct gctgctactc attcaccagc 120
aagatgatcc caatgagtag gctggagagc tacaagagga tcaccagcag caggtgtccc 180
aaagaagctg tagtttttgt caccaagctc aagagagagg tctgtgctga ccccaagaag 240
gaatgggtcc agacatacat taaaaacctg gatcggaacc aaatgagatc agaacctaca 300
actttattta aaactgcatc tgccctaagg tcttcagcac ctttgaatgt gaagttgacc 360
cgtaaatctg aagctaatgc atccactacc ttttccacaa ccacctcaag cacttctgta 420
ggagtgacca gtgtgacagt gaactag 447
<210> 5
<211> 462
<212> DNA
<213> 智人(Homo sapiens)
<220>
<221> gene
<222> (1)..(462)
<223> IL-2
<400> 5
atgtacagga tgcaactcct gtcttgcatt gcactaagtc ttgcacttgt cacaaacagt 60
gcacctactt caagttctac aaagaaaaca cagctacaac tggagcattt actgctggat 120
ttacagatga ttttgaatgg aattaataat tacaagaatc ccaaactcac caggatgctc 180
acatttaagt tttacatgcc caagaaggcc acagaactga aacatcttca gtgtctagaa 240
gaagaactca aacctctgga ggaagtgcta aatttagctc aaagcaaaaa ctttcactta 300
agacccaggg acttaatcag caatatcaac gtaatagttc tggaactaaa gggatctgaa 360
acaacattca tgtgtgaata tgctgatgag acagcaacca ttgtagaatt tctgaacaga 420
tggattacct tttgtcaaag catcatctca acactgactt ga 462
<210> 6
<211> 435
<212> DNA
<213> 智人(Homo sapiens)
<220>
<221> gene
<222> (1)..(435)
<223> GM-CSF
<400> 6
atgtggctgc agagcctgct gctcttgggc actgtggcct gcagcatctc tgcacccgcc 60
cgctcgccca gccccagcac gcagccctgg gagcatgtga atgccatcca ggaggcccgg 120
cgtctcctga acctgagtag agacactgct gctgagatga atgaaacagt agaagtcatc 180
tcagaaatgt ttgacctcca ggagccgacc tgcctacaga cccgcctgga gctgtacaag 240
cagggcctgc ggggcagcct caccaagctc aagggcccct tgaccatgat ggccagccac 300
tacaagcagc actgccctcc aaccccggaa acttcctgtg caacccagat tatcaccttt 360
gaaagtttca aagagaacct gaaggacttt ctgcttgtca tcccctttga ctgctgggag 420
ccagtccagg agtga 435
<210> 7
<211> 300
<212> DNA
<213> 智人(Homo sapiens)
<220>
<221> gene
<222> (1)..(300)
<223> CCL-2
<400> 7
atgaaagtct ctgccgccct tctgtgcctg ctgctcatag cagccacctt cattccccaa 60
gggctcgctc agccagatgc aatcaatgcc ccagtcacct gctgttataa cttcaccaat 120
aggaagatct cagtgcagag gctcgcgagc tatagaagaa tcaccagcag caagtgtccc 180
aaagaagctg tgatcttcaa gaccattgtg gccaaggaga tctgtgctga ccccaagcag 240
aagtgggttc aggattccat ggaccacctg gacaagcaaa cccaaactcc gaagacttga 300
<210> 8
<211> 552
<212> DNA
<213> 塔纳痘病毒(Tanapoxvirus)
<220>
<221> gene
<222> (1)..(552)
<223> 胸苷激酶/66R
<400> 8
atgacatcta aaagtggaca tatacagatt atattaggcc caatgttttc tggtaaaagt 60
acagaattaa ttagaatatt aaaacggtat caaattgcta ggtatacttg ctttgtaata 120
aaatactcaa aagatactag gtacggaaaa ggattagtaa cacacgataa taattcaata 180
cccgcaattc ctgttaactc actaagtgaa attaattgtg ataaaattaa agctgatgta 240
ataggaatag acgaaggaca attttttcca gatattgtag aattttgcga acgtatggca 300
aacgatggaa aaattgtaat agttgctgct ttagacggta catttttaag agagccattt 360
ggaaatattt taaaattaat accatgtgct gagtacgttt caaagcttac agccgtttgc 420
atgaattgtt ttaatagcgc atcgttttct aaacgaattg gagatgaaca agaaatagaa 480
gttataggag gcaaagacaa gtatcaatct gtatgtagaa aatgttactt taaattaaaa 540
ataaataatt ga 552
<210> 9
<211> 1017
<212> DNA
<213> 塔纳痘病毒(Tanapoxvirus)
<220>
<221> gene
<222> (1)..(1017)
<223> 2L
<400> 9
atggataagt tactattatt tagcacaatt gtagcagttt gtaactgcat aactttaaaa 60
tataattata ctgttacgtt aaaagatgat gggttatacg atggagtatt ttacgatcat 120
tacaacgatc agttagtgac gaaaatatca tataaccatg aaactagaca cggaaacgta 180
aattttaggg ctgattggtt taatatttct aggagtcccc acacgccagg taacgattat 240
aactttaact tttggtattc tttaatgaaa gaaactttag aagaaattaa taaaaacgat 300
agcacaaaaa ctacttcgct ttcattaatc actgggtgtt atgaaacagg attattattt 360
ggtagttatg ggtatgtaga aacggccaac gggccgttgg ccagatacca tacaggagat 420
aaaaggttta cgaaaatgac acataaaggt tttcccaagg ttggaatgtt aactgtaaaa 480
aacactcttt ggaaagatgt aaaagcttat ttaggcggtt ttgaatatat gggatgttca 540
ttagctattt tagattacca aaaaatggct aaaggtaaaa taccaaaaga tacaacacct 600
acagtgaaag taacgggtaa tgagttagaa gatggtaaca tgactcttga atgcactgta 660
aattcatttt accctcctga cgtaattact aagtggatag aaagcgaaca ttttaaaggt 720
gaatataaat atgttaacgg aagatactat ccagaatggg ggagaaaatc caattatgag 780
ccaggagagc caggttttcc atggaatatc aaaaaagata aagatgcaaa tacatatagt 840
ttaacagatt tagtacgtac aacatcaaaa atgagtagtc aaccagtatg tgttgttttc 900
catgacactt tagaagcgca agtttatact tgttctgaag gatgcaatgg agagctatac 960
gatcacctat atagaaaaac agaagaaggg gaaggtgaag aggatgaaga agactga 1017
<210> 10
<211> 234
<212> DNA
<213> 塔纳痘病毒(Tanapoxvirus)
<220>
<221> gene
<222> (1)..(234)
<223> 15L
<400> 10
atgaaaaaca aatttatgtt ttttacttta tcatgtgcca ttttagcatt aaattgttta 60
ccgttgctac aaaatatgta cgtaatagag tgtgacacaa gtaacttttg tttaaatgga 120
gggacctgtt ttttaactaa acatgttcct tcgtattcta attttagttt aaaattttgt 180
ttgtgtaaaa ggcaatttaa cggaaaaagg tgtgaaaata aaatagtaaa ttaa 234
- 还没有人留言评论。精彩留言会获得点赞!