两步法筛选线粒体疾病药物的制作方法
本发明涉及线粒体相关技术领域,具体而言,涉及两步法筛选线粒体疾病药物。
背景技术:
线粒体功能障碍特别是氧化磷酸化缺陷导致的一系列临床表型多样性疾病统称为线粒体疾病,保守估计其发病率约为1/6500。狭义的线粒体疾病特指mtdna突变导致的遗传性疾病,主要累及心脏、脑、骨骼肌等高能量需求的组织和器官。线粒体疾病通常呈现遗传异质性和临床异质性,目前尚欠缺特异和有效的治愈手段。
线粒体不仅是细胞能量代谢的重要场所,而且与细胞凋亡、活性氧(ros)产生和ca2+稳态等密切相关。线粒体功能受核基因(ndna)和线粒体基因(mtdna)共同调控,约1500种线粒体蛋白质中,绝大部分由核基因编码,mtdna仅编码13种线粒体电子传递链复合体亚基、22种trna和2种rrna。自1988年wallace等报道m.11778g>a突变是lerber氏遗传性视神经病(lhon)的重要致病因素以来,迄今已发现数百种疾病相关的mtdna突变。这些线粒体疾病主要包括:线粒体肌病、线粒体脑病、线粒体心肌病、聋病、视神经病、线粒体脑肌病合并乳酸血征及卒中发作综合征(melas),肌阵挛癫痫和破碎红纤维病(merrf)等多种临床表型,还与一些代谢疾病(如原发性高血压、糖尿病、高胆固醇血症等),神经退行性疾病(如帕金森症、阿耳茨海默症等)和肿瘤(如前列腺癌、乳腺癌等)的易感性相关。
线粒体疾病的遗传异质性和临床异质性主要表现为同一种mtdna突变可以引发不同的疾病表型,而同一种疾病表型又可以由多种不同的mtdna突变诱导。因此,线粒体疾病的诊断和治疗存在困难。
药物筛选是指对可能具有药用价值的物质进行初步药理活性的检测和试验。传统的以靶点为中心的药物发现一直是制药行业的主流。但是解析疾病相关的药物靶点并不容易,由于存在补偿机制和反馈途径,那些在非细胞体系有效的靶点到了复杂的细胞环境中,其药物的靶向性和药效可能大大降低。这种基于靶点的药物发现过程通常漫长而昂贵。近年来,基于疾病模型的表型药物筛选重新走入人们的视野,并越来越受到大家的广泛重视。由于每个哺乳动物细胞含有数百甚至数千个双层膜结构的线粒体,每个线粒体含有多拷贝数mtdna分子,至今还没有一种特异和高效的遗传操作系统可以对mtdna进行定点突变或修饰。线粒体疾病的细胞模型和动物模型等构建仍困难重重。利用患者外周血淋巴细胞或成纤维细胞,及其衍生的转线粒体细胞模型,是线粒体疾病研究领域的常规方法;由患者体细胞重编程得到的疾病特异性ipscs及其定向分化细胞被认为是一种新的疾病细胞模型。
目前,已知的线粒体疾病药物筛选都为单一模型策略。
技术实现要素:
本发明的第一目的在于提供一种化合物在制备治疗线粒体疾病药物中的应用,该化合物为2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷,本发明公开了该化合物的新用途,也为治疗线粒体疾病提供了新的可能性。
本发明的第二目的在于提供一种治疗线粒体疾病的药物,为治疗线粒体疾病提供更广的途径,以优化现有的治疗手段。
本发明的第三目的在于提供一种治疗线粒体疾病药物的筛选方法,该筛选方法以线粒体功能筛选为基础,细胞表型筛选为辅,能够有效快速地筛选出针对线粒体疾病且药效显著的药物,具有高效率和低成本的优点。
本发明是这样实现的:
本发明提供了化合物在制备治疗线粒体疾病药物中的应用,具体地,化合物为2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷,其结构式如式1所示:
2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷来源于何首乌。目前,2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷已知的用途为治疗动脉粥样硬化、脂代谢、血管和心脏重塑、血管纤维化、心脑缺血、学习和记忆障碍、神经炎症、阿尔茨海默病和帕金森病、糖尿病并发症、毛发生长等。在本申请中,其用于治疗线粒体疾病。优选地,其有助于治疗母系遗传性肥厚型心肌病。
本发明还提供了一种治疗线粒体疾病的药物,其包括有2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
优选地,该线粒体疾病是指m.2336t>c突变相关母系遗传性肥厚型心肌病。
此外,本发明还提供了一种治疗线粒体疾病药物的筛选方法,其包括采用患者特异性转线粒体模型高通量筛选候选药物,然后通过患者特异性ipscs定向分化细胞模型对所述候选药物进行第二步筛选。在本发明实施例中,候选药物包括有2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
进一步地,在进行高通量筛选候选药物时,选择与m.2336t>c突变相关的线粒体功能指标为参数,进一步优选地,与m.2336t>c突变相关的线粒体功能指标包括以下一个或多个指标:线粒体膜电势、atp含量、ros水平和/或氧耗速率;
优选地,在进行所述第二步筛选时,以与线粒体疾病相关的病例生理的细胞表型指标为参数,进行药物筛选;优选地,以与m.2336t>c突变相关病理生理的细胞表型指标为参数,进一步优选地,所述与m.2336t>c突变相关病理生理的细胞表型指标包括以下一个或多个指标:细胞存活率和/或心肌细胞的动作电位。
优选地,在该筛选方法中,线粒体疾病特指m.2336t>c突变相关,进一步优选为肥厚型心肌病(hcm)。
具体地,转线粒体模型的构建包括永生淋巴细胞系和转线粒体细胞系的,而转线粒体细胞系(transferringmitochondriacells)是指将去除了细胞核的患者永生化淋巴细胞、或成纤维细胞等的细胞质,与缺乏mtdna的ρo细胞进行融合、筛选,构建起核基因背景一致的核质杂合细胞。它排除了核基因的干扰,可以直接反应mtdna突变对线粒体功能的影响。bararow等通过对10015种小分子化合物库的筛选,发现一种溴结构域抑制剂i-bet525762a可以显著提高氧化呼吸链复合体im.3796a>g突变(成年发病的肌张力障碍)转线粒体细胞的cox5a蛋白表达水平,使细胞免于死亡。然而,i-bet525762a是否可以改善肌张力障碍仍未可知。
2017年,lorenz等首次报道通过构建mt-atp6基因m.9185t>c突变相关leigh综合征特异性ipscs及其定向分化神经前体细胞模型,高通量筛选出磷酸二酯酶5抑制剂阿凡那非(avanafil),该药物可有效降低线粒体膜电势,提高胞内ca2+浓度,改善患者神经前体细胞和分化神经元功能。
事实上,ipscs的构建、扩增和定向分化不仅需要训练有素的科研人员,而且试剂、耗材等十分昂贵,例如ipscs培养基的成本就是普通培养基的60倍以上。因此,基于ipscs及其定向分化细胞的高通量筛选无论是人力和经费都是巨大负担。
本发明提供的筛选方法,采用患者特异性转线粒体模型高通量筛选候选药物,然后通过患者特异性ipscs定向分化细胞模型对所述候选药物进行第二步筛选,有效降低了药物发现的成本,而且完美地将ipscs与高通量药物筛选结合,增加药物筛选的效率和结果。
本发明通过该筛选方法成功筛选了m.2336t>c突变相关母系遗传性肥厚型心肌病(hcm)特异性药物。
肥厚型心肌病(hcm)是以左心室及室间隔不对称肥厚为基本特征的原发性心脏病,是青少年及运动员心源性猝死的最常见原因之一。家族性hcm主要呈现为心肌肌节蛋白基因突变引起的常染色体显性遗传。部分hcm病例具有母系遗传特征,与线粒体基因(mtdna)突变相关。
1991年zeviani等报道了首例母系遗传性心肌病相关的线粒体trna基因m.3206a>g突变,迄今已经发现多个hcm相关mtdna致病突变位点,主要位于线粒体trna基因和电子传递链复合体亚基,而线粒体rrna基因相关突变鲜见报道。hcm相关的线粒体trna致病基因主要包括mt-th(omim590040)、mt-ti(omim590095)、mt-tk(omim590060)、mt-tl1(omim590050)和mt-tg(omim590035)等;hcm相关的线粒体结构蛋白致病基因主要包括mt-atp6(omim516060)、mt-atp8(omim516070)和mt-cyb(omim516020)等。
发明人鉴定了母系遗传性hcm相关m.2336t>c突变。m.2336t>c位点高度保守,m.2336t>c突变仅见于hcm患者,该突变破坏了线粒体16srrna正常的2336u-a2438碱基配对,降低了16srrna的稳态表达水平,引起线粒体氧耗速率降低和超微结构损伤。构建了m.2336t>c突变转线粒体细胞模型,功能研究证实m.2336t>c突变可导致线粒体膜电势降低、atp合成能力降低和活性氧(ros)水平升高等线粒体功能障碍。
进一步构建hcm患者特异性ipscs及其定向分化心肌细胞(hcm-ipsc-cms)模型,发现它们具有体积增大、动作电位呈现延迟性去极化、动作电位时程延长等类似hcm心肌细胞的相关特征。利用上述细胞模型,从线粒体小分子化合物库和天然产物库中筛选了可显著拯救线粒体功能的候选药物。
该显著拯救线粒体功能的候选药物为:2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
本发明具有以下有益效果:
本发明实施例提供了一种化合物在制备治疗线粒体疾病药物中的应用,该化合物为2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷,本发明公开了该化合物的新用途,为治疗线粒体疾病提供了新的可能性。
本发明实施例还提供了一种治疗线粒体疾病的药物,为治疗线粒体疾病提供更广的途径,以优化现有的治疗手段。
此外,本发明实施例还提供了一种治疗线粒体疾病药物的筛选方法,该筛选方法以线粒体功能筛选为基础,细胞表型筛选为辅,能够有效快速地筛选出针对线粒体疾病且药效显著的药物,具有高效率和低成本的优点。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1中提供的母系遗传性肥厚型心肌病家系图;
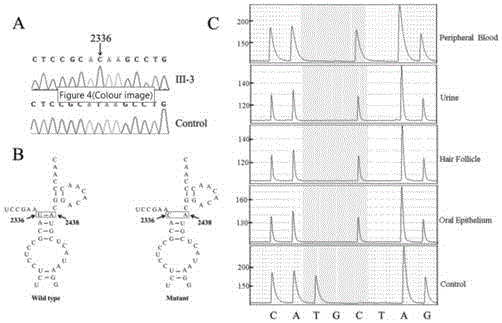
图2为本发明实施例1中16srrna的m.2336t>c突变鉴定;其中,图2a为先证者(iii-3)和正常对照个体16srrna基因pcr产物的部分测序图;图2b为m.2336t>c突变破坏了16srrna正常的2336u-a2438碱基配对;图2c为患者外周血细胞、毛囊细胞、口腔黏膜上皮细胞均呈m.2336t>c同质性突变;
图3为本发明实施例1中转线粒体细胞系构建和鉴定;图3a为在选择培养基中的生长状况;图3b为mtdna拷贝数检测;图3c为细胞倍增时间检测;
图4为本发明实施例1中转线粒体细胞系的线粒体功能分析;其中,图4a为细胞总atp;图4b为线粒体atp水平;图4c-图4d为线粒体膜电势;图4e为活性氧检测;图4f为活性氧定量;
图5为本发明实施例1中ipscs构建和鉴定;其中,图5a为普通光学显微镜观察、碱性磷酸酶染色、和免疫荧光鉴定;图5b为ipscs分化拟胚体的三胚层标志基因表达的荧光定量pcr检测;图5c为ipscs畸胎瘤的免疫组化分析;
图6为本发明实施例1中ipscs定向分化心肌细胞;其中,图6a为心肌细胞分化方案示意图;图6b为心肌细胞标志蛋白的免疫荧光鉴定;
图7为本发明实施例1中hcm-ipscs定向分化心肌细胞体积增大鉴定图;
图8为本发明实施例1中ipsc-心肌细胞动作电位检测;图8a为动作电位的全细胞膜片钳检测;图8b为典型的单个动作电位图;
图9为本发明实施例1中转线粒体细胞模型以膜电势为指标进行初筛线粒体药物部分结果图;
图10为发明实施例1中转线粒体细胞模型以atp产量为指标进行初筛线粒体药物部分结果图;
图11为发明实施例1中ipsc-心肌细胞在半乳糖培养基中的生长情况结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的化合物在制备线粒体疾病药物中的应用进行具体说明。
本发明实施例提供的一种化合物在制备治疗线粒体疾病药物中的应用,所述化合物为2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
进一步地,在该应用中,上述化合物均可提高线粒体疾病患者细胞的线粒体膜电势。
需要说明的是,提高线粒体疾病患者细胞的线粒体膜电势是指对于有线粒体疾病的患者而言提高其线粒体膜电势,尤其是线粒体疾病为由mtdna突变引起的线粒体疾病的患者;更进一步地是指由m.2336t>c突变引起的线粒体疾病的患者;更优选地是指由m.2336t>c突变相关母系遗传性肥厚型心肌病的患者。上述化合物可用于提高患者线粒体膜电势靠近或恢复至正常人的线粒体膜电势水平。
进一步地,在该应用中,上述化合物可提高线粒体疾病患者细胞的atp合成能力。具体地,这里的线粒体疾病患者同上述提高线粒体患者的线粒体模上述的患者一样,在此不再赘述,上述化合物用于提高线粒体疾病患者的atp合成能力至靠近或恢复正常人的atp合成能力的水平。
进一步地,在该应用中,上述化合物可应用于降低线粒体疾病患者的ros水平。这里的线粒体患者同上,不再赘述,上述化合物用于降低线粒体患者的ros水平至靠近或恢复正常人的ros水平。
需要说明的是,在本发明的一些实施例中,线粒体疾病是指由mtdna突变引起的线粒体疾病;优选地,线粒体疾病为由m.2336t>c突变引起的线粒体疾病;进一步优选地,该线粒体疾病为m.2336t>c突变相关母系遗传性肥厚型心肌病。
本发明实施例还提供一种治疗线粒体疾病的药物,该药物中包括有2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
需要说明的是,由2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷组成的药物或者包括有上述化合物且用于治疗线粒体疾病的药物,均属于本申请的保护范围内。
进一步地,治疗线粒体疾病是指提高线粒体疾病患者的线粒体膜电势;
和/或所述治疗线粒体疾病是指提高线粒体疾病患者的atp合成能力;
和/或所述治疗线粒体疾病是指降低线粒体疾病患者的ros水平。
优选地,线粒体疾病为m.2336t>c突变相关母系遗传性肥厚型心肌病。
此外,本发明实施例还提供了一种治疗线粒体疾病药物的筛选方法,该筛选方法为两步法筛选线粒体疾病药物,具体为采用患者特异性转线粒体模型高通量筛选候药物,然后通过患者特异性ipscs定向分化细胞模型对所述候选药物进行第二步筛选;
其中,候选药物包括有2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷。
进一步地,在进行高通量筛选候选药物时,选择与线粒体疾病相关的线粒体功能指标为参数;优选地,选择与m.2336t>c突变相关线粒体功能指标为参数,优选地,与m.2336t>c突变相关线粒体功能指标包括以下一个或多个指标:线粒体膜电势、atp含量、ros水平和/或氧耗速率;
优选地,在进行所述第二步筛选时,以与线粒体疾病相关的病例生理的细胞表型指标为参数,进行药物筛选;优选地,以与m.2336t>c突变相关病理生理的细胞表型指标为参数,进一步优选地,所述与m.2336t>c突变相关病理生理的细胞表型指标包括以下一个或多个指标:细胞存活率和心肌细胞的动作电位。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种治疗线粒体疾病药物的筛选方法,其包括以下步骤:
一、患者特异性转线粒体细胞模型的构建。
1.永生化淋巴细胞系的构建
母系遗传性hcm核心家系的先证者为男性,23岁时诊断为非梗阻肥厚型心肌病。家系共四代,母系成员包括先证者、先证者的母亲、舅舅和哥哥等4人,均患有肥厚型心肌病,请参照附图1,其中箭头所指为先证者iii-3。
对所有母系成员的外周血mtdna进行全序列pcr-测序,发现均存在一个新的尚未报道的16srrna的m.2336t>c突变,请参照附图2a。分子结构解析显示,2336t位于线粒体核糖体16srrna的结构域iii(stem24),该突变破坏了16srrna正常的2336u-a2438碱基配对,请参照附图2b。焦磷酸测序显示,患者外周血细胞、毛囊细胞、口腔黏膜上皮细胞的均呈m.2336t>c同质性突变,请参照附图2c。
分别采集患者(hcm患者)和正常对照个体约6ml外周血于肝素抗凝管中,颠倒混匀,置于放有冰袋的泡沫盒中。在血样采集后24h内分离淋巴细胞,5%co2培养箱内培养,在24h左右即可见到细胞聚集成团生长,4天(3~5天)可见液体ph值发生变化,呈橙黄色。6天(5~7天)后,转化后培养液(rpmi1640+15%fbs+1%双抗+2μg/mlcsa)半量换液。一周左右转化细胞形态发生变化,细胞外壁有不规则的毛刺状突起。2周左右出现肉眼可见的白色细胞团。1月左右可行细胞传代,将得到的突变组和对照组永生化淋巴细胞系转移至液氮罐中冻存备用。
2.转线粒体细胞系的构建
在硝酸纤维素离心管内依次加入不同浓度的ficoll,使之形成梯度胶。将ficoll溶解在含有细胞松弛素b和5%胎牛血清的dmem培养液中,终浓度为12.5%。
分别从步骤1中得到的突变组和对照组永生化淋巴细胞系中取细胞,离心后重悬于5mlficoll溶液中。将两组细胞分别加入相应的离心管中离心,可见供体细胞的胞质位于14%和16%的ficoll界面,而细胞核位于17%和25%的ficoll界面。将胞质层收集并悬浮到胞质液(dmem+20%fbs+50μg/ml尿嘧啶)中离心,用2ml胞质液将其重悬浮,胞质混悬液置于37℃培养箱孵育30分钟使细胞质恢复成球形。
缺乏mtdna的ρ0206细胞来源于溴脱氧尿苷(brdu)耐受的骨肉瘤143b.tk-细胞,培养于(dmem+5%fbs+100μg/mlbrdu+50μg/ml尿嘧啶)培养液中。
胞质混悬液和ρ0206细胞轻柔混合后离心,在40%聚乙二醇(peg)溶液中重新悬浮,常温1分钟后加入(dmem+10%fbs+50μg/ml尿嘧啶)培养液稀释孵育;(dmem+5%透析fbs+50μg/mlbrdu)培养液培养并筛选,分离出状态稳定的单克隆融合细胞系,即转线粒体细胞系。
细胞在选择培养基中的生长状况请参照附图3a;对细胞的mtdna拷贝数进行检测,结果请参照附图3b;对细胞倍增时间进行检测,结果请参照附图3c。
转线粒体细胞系的线粒体功能分析,m.2336t>c突变可导致线粒体膜电势降低、atp合成能力减弱和活性氧(ros)水平升高等线粒体功能障碍,细胞总atp请参照附图4a,线粒体atp水平请参照附图4b;线粒体膜电势请参照附图4c和图4d,活性氧检测结果请参照附图4e,活性氧定量请参照附图4f。
二、患者特异性ipscs及其定向分化心肌细胞模型的构建
1.患者原代细胞系的构建
分别收集对照组和患者(hcm患者)的中段尿液,经离心纯化后,尿液细胞接种至包被gelatin的6孔板,静置3天以上,待有克隆出现,换尿液细胞培养基,隔天换液。等细胞克隆长得较密集或长满孔板即可传代,37℃,5%co2培养箱培养,每2天更换培养液。
2.患者特异性ipscs模型的构建
(1)ipscs的建立:将携带oct-4,sox-2,c-myc和klf4的pmx逆转录病毒载体质粒以及包装质粒pcl-eco转染293t细胞,收集转染48小时后的病毒上清液感染尿液细胞。病毒感染后第4-5天,将形变的原代细胞转移至饲养层细胞中培养,并更换人胚胎干细胞培养基。待细胞感染病毒后第25天,可以观察到类胚胎干细胞(es细胞)样克隆,将此克隆挑出至12孔板中培养。在12孔板中培养2-3代后转移至6孔板中培养。收集细胞(ipscs),用于ipscs的生物学鉴定。
(2)ipscs的鉴定
将步骤(1)得到的ipscs进行以下鉴定步骤:
碱性磷酸酶染色(ap染色):显示碱性磷酸酶活性,细胞经多聚甲醛固定,ap显色液避光显色,显微镜下观察。普通光学显微镜观察、碱性磷酸酶染色、和免疫荧光鉴定结果请参照附图5a,其中h1胚胎干细胞为阳性对照。
免疫荧光检测:分析es细胞特异性细胞表面标志物ssea3,ssea4,肿瘤相关抗原tra-1-60、tra-1-81,和核蛋白nanog等。请参照附图5a,其中,h1胚胎干细胞为阳性对照,con-ipscs为正常对照组的ipscs,hcm-ipscs为hcm患者的ipscs。
荧光定量pcr检测:分析内源多能性基因oct4、sox2、nanog和rex1表达,外源重编程因子oct4、sox2、klf4和c-myc沉默。
多能性基因启动子的甲基化检测:提取基因组dna,ecorⅴ酶切,亚硫酸氢钠处理,巢式pcr扩增nanog和oct4基因启动子区,转化至大肠杆菌,选取阳性克隆测序,找出甲基化位点。
核型分析:将处于指数生长期的细胞用200ng/ml秋水仙素处理,再经过低渗处理和固定,giemsa染色后在显微镜下观察和拍照。
拟胚体的分化:饲养层培养ipscs至80%,消化后悬浮培养,每两天换液。悬浮培养后第8天贴壁培养,细胞长满后收集提取rna。qpcr检测内胚层基因afp、gata4、sox17,中胚层基因tbx1,外胚层基因pax6、sox1,以及内源性多能基因oct4、nanog,以h1胚胎干细胞为阳性对照,ipscs分化拟胚体的三胚层标志基因表达的荧光定量pcr检测结果请参照附图5b。
畸胎瘤的体内分化:无饲养层培养ipscs,长满后收集细胞,注射至免疫缺陷的小鼠体内,分别为200μl的背部/腋下皮下注射,100μl的腿部肌肉注射。8-10周后取畸胎瘤,he染色观察三胚层组织。ipscs畸胎瘤的免疫组化分析结果请参照附图5c。
检测结果显示,该hcm家系的患者特异性诱导多能干细胞(hcm-ipscs)具有多向分化潜能,能够分化成三个胚层的不同组织细胞。体外形成拟胚体实验及荧光定量pcr检测,发现三个胚层的标志基因表达显著升高,而多能性基因几乎不表达。体内分化畸胎瘤实验及he染色观察到三胚层的多种组织细胞。
3、ipscs定向分化心肌细胞模型的构建
(1)心肌细胞的定向分化:将患者特异性ipscs模型构步骤建中得到的ipscs经accutase消化,dmem/f12离心重悬,取45×104细胞铺到包被matrigel的12孔板,用1mlmtesr1+5μmol/ly-27632培养24h;第2-4天,mtesr每天换液;第5天换1640+b27-insulin+12μmol/lchir;第6-7天换1640+b27-insulin;第8-9天换1640+b27-insulin+5μmol/liwp2;第10-11天换1640+b27-insulin;第12天后换1640+b27。37℃,5%co2培养2周能看到心肌细胞跳动,6-8周后心肌细胞成熟。
(2)心肌细胞鉴定
心肌细胞的自主收缩观察和记录:定向分化2周后能看到心肌细胞跳动,倒置显微镜观察并视频记录。
心肌细胞的特异性基因表达及鉴定:采用qpcr方法和免疫荧光检测,主要包括tnni3、α-actinin、mlc2a和mlc2v等,心肌细胞标志蛋白免疫荧光鉴定结果请参照附图6b。hcm-ipscs-分化心肌细胞表达肌钙蛋白(tnni3)、α-辅肌动蛋白(α-actin)、心室肌球蛋白-2(mlc2v)和心房肌球蛋白-2(mlc2a)等心肌细胞标志蛋白。
心肌细胞的电生理检测:30×104细胞铺到24孔板爬片上,培养2天。放置爬片于37℃恒温灌流槽的倒置显微镜凹槽中,细胞外液持续灌流。全细胞膜片钳记录心肌细胞自发性动作电位。pclamp10.2和labchart8.0软件进行数据的记录、分析和作图。
结果显示,hcm-ipscs-心肌细胞具有体积增大(图7)、电生理异常、动作电位呈现延迟性去极化(图8,其中hcm-ipsc心肌细胞动作电位出现延迟性去极化(dad),图8a为动作电位的全细胞膜片钳检测)、动作电位时程延长(图8b为典型的单个动作电位图,其中hcm-ipsc心肌细胞动作电位时程延长)等、l型ca2+电流(ical)显著降低、及无规律的节律跳动等类似肥厚型心肌病的一场心肌细胞表型。
三、两步法筛选线粒体药物
采用患者特异性转线粒体模型高通量筛选候药物
1.基于膜电势的药物筛选(以膜电势为指标进行初筛)
将患者特异性转线粒体细胞模型的构建步骤中得到的转线粒体细胞以8×103个/孔接种到黑色底透的96孔板或384孔板,143b细胞作为对照。在正常和突变转线粒体细胞均加入终浓度为30μmol/l的线粒体药物库(topscience、medchemexpress、biochempartner等)中的药物,每个药物设置3个复孔作为实验组,同时设置空白对照、阴性对照、阳性对照,置于37℃,5%co2培养箱中培养48h。除去培养基,在实验组和空白对照、阴性对照中加入50μl的dmem培养基,在阳性对照孔中加入50μl的cccp溶液(去偶联剂)。置于37℃,5%co2培养箱中培养30-60min。每孔加入25μl配制好的jc-10溶液(用于线粒体膜电位的检测),置于37℃,5%co2培养箱中孵育30~60min。酶标仪检测ex/em=490nm/525nm和540nm/590nm荧光值。每孔减去对应空白对照组后,比较pl590/pl525。
利用m.2336t>c突变线粒体细胞模型,以膜电势为指标,初筛线粒体小分子化合物库得到2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷(druga)。
请参照图9,图9中显示了其他候选药物如川芎嗪(tetramethylpyrazine)、维生素e(vitaminee)、积雪草酸(asiaticacid)等,从中,可知2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷(druga)对线粒体膜电势提高的效果,具有恢复线粒体功能的潜力。
2.基于atp的药物重筛(以atp产量为指标进行初筛)
利用atpbioluminescenceassaykithsⅱ试剂盒,在synergytmh1检测仪检测细胞atp合成。通过在检测缓冲液中加入葡萄糖、或葡萄糖和寡霉素a等分别测定细胞总atp产生、糖酵解atp生成等。
将转线粒体细胞接种于6cm2培养皿中,加入终浓度为30μmol/l药物,置于37℃,5%co2培养箱培养48h。待细胞长至占皿底面积80-90%,加入0.5ml的0.25%胰酶-edta消化,收集细胞。每种细胞分为a、b两管,分别吸取3×105个细胞,用检测缓冲液补齐至1ml,分别在a管加入10μl1md-葡萄糖(终浓度10mmol/l),b管加入10μl2-脱氧-d葡萄糖(终浓度0.5mmol/l)+5μl丙酮酸钠(终浓度5mmol/l),于37℃、5%co2培养箱处理2h,收集细胞悬液。将细胞悬液50μl/孔加入96孔板,按50μl/孔添加atp标准曲线梯度稀释液并混匀,再加50μl/孔检测液,避光混匀10min。室温静置2min,放入荧光酶标仪中进行检测。通过蛋白质定量,计算细胞总atp水平和线粒体氧化磷酸化atp水平(μmol/g蛋白)。
结果请参照图10,可知2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷(druga)对atp产量提高的效果,具有恢复线粒体功能的潜力。
患者特异性ipscs定向分化心肌细胞模型对所述候选药物进行第二步筛选
3.候选药物对细胞生长的影响(以细胞存活率为指标进行筛选)
将4×104细胞/孔接种于12孔板,于半乳糖培养基中37℃、5%co2培养箱至少培养16h让细胞能够贴附于培养皿。实验组细胞(患者特异性ipscs定向分化心肌细胞模型构建的心肌细胞)更换为含30μmol/l候选药物的半乳糖培养基,对照组细胞更换为含30μmol/ldmso的半乳糖培养基,每组处理设置3个复孔。每隔24h收集每个孔的细胞,细胞计数,连续计数3次。
利用半乳糖只能通过线粒体氧化磷酸化产生atp的特性,突变型心肌细胞在半乳糖培养基中培养3天大量死亡,半乳糖培养基中添加候选线粒体药物(2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷),突变型心肌细胞存活率显著提高,提示候选线粒体药物可改善突变型心肌细胞状态或活性,请参照附图11。
因此,可知药物a(2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷)可显著提高hcm-ipsc心肌细胞在半乳糖培养基中的存活率。
4.候选药物对细胞电生理的影响
将细胞爬片铺于用24孔板,加matrigel200μl孵育1h。心肌细胞(患者特异性ipscs定向分化心肌细胞模型构建的心肌细胞)用collagenaseb消化,37℃孵育30min。加两倍体积的1640培养基重悬细胞,1000rpm离心5min;弃上清,再加含30μmol/l候选药物的20%fbs+1640培养基重悬细胞。取30×104细胞铺到24孔板爬片上,37℃、5%co2培养2天。将细胞爬片取出,放置在有37℃恒温灌流槽的倒置显微镜凹槽中,用细胞外液进行持续灌流。用全细胞膜片钳技术记录心肌细胞自发性动作电位。膜片钳放大器采用700b放大器。玻璃微电极内填充电极内液,记录动作电位时使用的电极电阻为3-5mω,在电极与细胞膜之间形成高阻(1-5gω)封接。用负压将细胞膜吸破,调节电容和串联电阻补偿,采样频率为l0khz,低通滤波频率为2khz,让电极内液与细胞内液平衡5min后记录自发跳动的心肌细胞动作电位或l型ca2+电流(ical)。用pclamp10.2和labchart8.0软件对数据进行分析,所有实验数据均用平均数±标准误表示,采用单因素方差分析及t检验,p<0.05时认为差异具有统计学意义。
综上所述,本发明实施例提供了一种化合物在制备治疗线粒体疾病药物中的应用,该化合物为2,3,5,4’-四羟基二苯乙烯-2-o-β-d-葡萄糖苷,本发明公开了该化合物的新用途,为治疗线粒体疾病提供了新的可能性。
本发明实施例还提供了一种治疗线粒体疾病的药物,为治疗线粒体疾病提供更广的途径,以优化现有的治疗手段。
此外,本发明实施例还提供了一种治疗线粒体疾病药物的筛选方法,该筛选方法以线粒体功能筛选为基础,细胞表型筛选为辅,能够有效快速地筛选出针对线粒体疾病且药效显著的药物,具有高效率和低成本的优点。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!