一种麦角甾醇联合吉非替尼的用途的制作方法
本发明涉及一种用于治疗非小细胞肺癌的联合用药,尤其涉及麦角甾醇联合吉非替尼的用途。属于生物医药技术领域。
背景技术:
由于癌症发病率和死亡率的持续增高,目前仍然是世界上最关注的难题之一。据统计,2015年中国大约新增了约430万例癌症病例,以及有约281万例癌症患者死亡,其中肺癌占据首位。国际癌症研究机构(internationalagencyforresearchoncancer)编制的《2018年全球癌症发病率和死亡率估计》提供了一份全球癌症负担状况报告,预计2018年将有1810万新癌症病例和960万癌症死亡病例。其中肺癌是最常见的癌症(占总病例的11.6%),也是癌症死亡的主要原因(占总癌症死亡人数的18.4%)。临床上发现,肺腺癌已经逐渐替代肺鱗癌成为肺癌发病率最高的病理类型,约占nsclc的一半,而nsclc约占全部肺癌的85%。
目前,临床一线化疗用药(铂类,阿霉素,紫杉醇等)在化疗过程中,均会出现多药耐药现象,最终导致疾病进一步进展。gef是最早用于治疗nsclc的分子靶向药物,目前常用于二线治疗药物应用于临床。gef是一种表皮生长因子受体(egfr)酪氨酸激酶抑制剂,针对egfr靶点的nsclc具有较好的临床治疗效果。其作用机制主要通过与三磷酸腺苷(atp)竞争和egfr的结合,通过akt等途径阻断egfr信号传导通路,抑制自身磷酸化以及活化,阻断表达egfr的肿瘤细胞生长,阻断pi3k-akt等下游信号通路,诱导肿瘤细胞凋亡,起到抗肿瘤作用。对于发生egfr突变的患者,gef副作用的发生程度相较于化疗明显减轻。同时研究表明在女性患者、亚裔患者以及不吸烟患者中更多的观察到egfr基因的突变。报道显示,东方国家的肺癌患者在临床上gef的疗效往往都要好于西方国家。可见,gef的深入研究对亚洲nsclc患者有重要意义。
针对肺癌,寻找一种能够与gef产生协同作用的药物,拓展gef的应用范围,改善靶向药物在肺癌治疗方面的临床应用,具有重要价值。
技术实现要素:
本发明要解决上述问题,通过体外培养肺癌a549细胞,pc-9细胞进行药物对肿瘤的抑制作用研究。采用两种细胞系(分别对gef敏感的pc-9细胞和耐药的a549细胞),进行mtt试验;hochest33258细胞凋亡试验;流式细胞术检测细胞凋亡及细胞周期;western-blots试验考察细胞egfr信号通路的影响。初步探讨erg与gef联用是否具有协同抗肺癌的作用,能否针对敏感细胞株达到增效、增敏的效果,能否增加耐药细胞株的敏感性,以及对非小细胞肺癌的治疗作用及机制研究。
本发明解决上述问题的技术方案如下:
麦角甾醇联合吉非替尼在制备治疗非小细胞肺癌药物方面的用途。
作为上述技术方案的优选,治疗机理基于麦角甾醇联合吉非替尼对pc-9细胞和/或a549细胞的协同抑制作用。
作为上述技术方案的优选,治疗机理基于麦角甾醇联合吉非替尼对pc-9细胞和/或a549细胞的协同诱导凋亡作用。
作为上述技术方案的优选,所述协同抑制作用基于麦角甾醇与吉非替尼的联用对a549细胞和/或pc-9细胞,增加g0/g1期阻滞,减少细胞周期s期比例。
作为上述技术方案的优选,所述协同诱导凋亡作用基于麦角甾醇与吉非替尼的联用对a549细胞和/或pc-9细胞,抑制egfr信号通路的表达。
作为上述技术方案的优选,所述egfr信号通路为p13k/akt/mtor信号通路。
作为上述技术方案的优选,所述麦角甾醇的药物浓度为5~320μm,所述吉非替尼的药物浓度为0.625~40μm。
作为上述技术方案的优选,所述麦角甾醇的药物浓度为20~40μm,所述吉非替尼的药物浓度为2.5~5μm。
作为上述技术方案的优选,所述麦角甾醇的药物浓度为20~80μm,所述吉非替尼的药物浓度为5~40μm。
本发明具有以下有益效果:
本发明通过体外培养肺癌a549细胞,pc-9细胞进行药物对肿瘤的抑制作用研究。采用两种细胞系(分别对gef敏感的pc-9细胞和耐药的a549细胞),进行mtt试验;hochest33258细胞凋亡试验;流式细胞术检测细胞凋亡及细胞周期;western-blots试验考察细胞egfr信号通路的影响。得出erg与gef联用具有协同抗肺癌的作用,在一定程度上证明了对gef敏感的pc-9细胞能够起到增效、增敏作用,对gef耐药的a549细胞能够增加其一定的敏感性。
附图说明
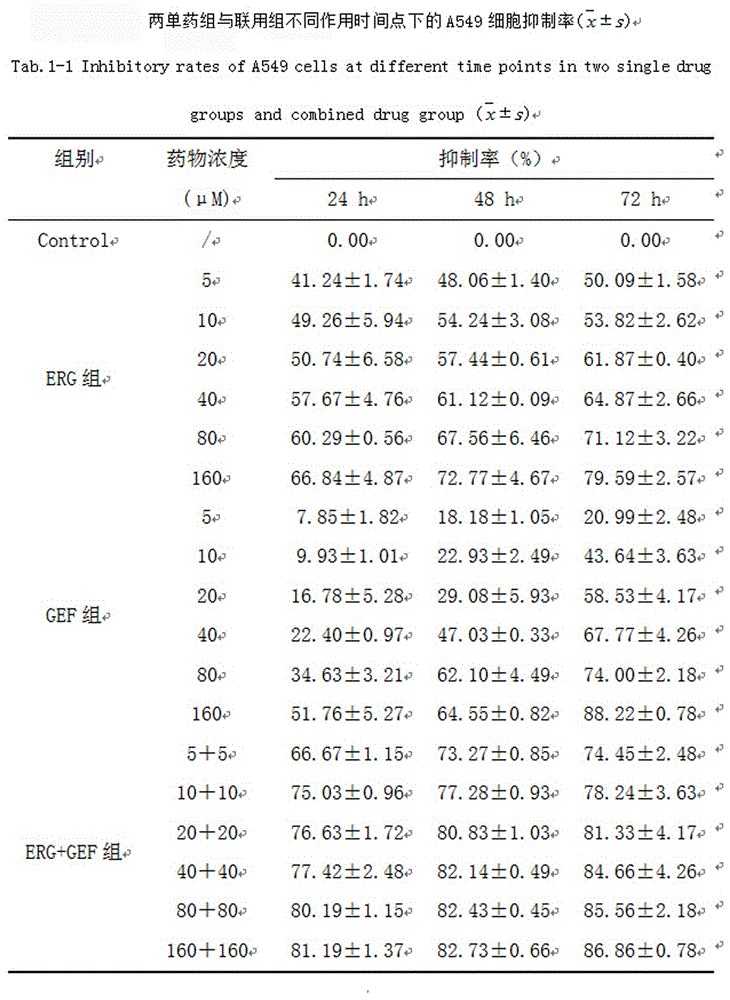
图1为两单药组与联用组不同作用时间点下的549细胞抑制率;
图2为两单药组不同作用时间点下的ic50值;
图3为erg与gef联用对a549细胞协同抑制作用的q值;
图4为两单药组与联用组不同作用时间点下的pc-9细胞抑制率;
图5为两单药组不用作用时间点下的ic50值;
图6为erg与gef联用对a549细胞协同抑制作用的q值;
图7为erg与gef作用a549细胞的细胞凋亡率;
图8为erg与gef作用pc-9细胞的细胞凋亡率;
图9为erg与gef作用a549细胞的周期分布情况;
图10为erg与gef作用pc-9细胞的周期分布情况;
图11为不同药物作用时间对a549肺癌细胞的抑制率;
图12为不同药物作用时间对pc-9肺癌细胞的抑制率;
图13为erg与gef作用a549细胞染色后的细胞核;
图14为erg与gef作用pc-9细胞染色后的细胞核;
图15为erg与gef作用a549细胞后的细胞凋亡情况;
图16为erg与gef作用pc-9细胞后的细胞凋亡情况;
图17为erg与gef作用a549细胞的细胞周期;
图18为erg与gef作用pc-9细胞的细胞周期;
图19为erg与gef给药于a549和pc-9细胞上的蛋白表达情况及定量分析。
具体实施方式
以下结合附图对本发明进行进一步的解释说明。
麦角甾醇联合吉非替尼体外诱导非小细胞肺癌细胞凋亡的作用机理研究
一、实验材料
人肺癌细胞a549来源于中国科学院生命科学研究院细胞库,人肺癌细胞pc-9来源于上海名劲生物科技有限公司。
二、方法与结果
(一)细胞培养
将细胞接入细胞培养瓶中,加入含10%胎牛血清(fbs)的完全培养基5~6ml,吹匀后置于37℃、5%co2培养箱中,每天观察细胞生长状态,2~3天更换一次培养基,待细胞长满至培养瓶底部面积的80%左右时进行细胞传代或冻存。
(二)细胞传代
待细胞长满至80%时进行传代:弃去培养基,用磷酸缓冲盐溶液(pbs)清洗3次,每次2ml左右。弃去pbs后,加入0.25%胰蛋白酶液1ml,待细胞消化完毕加入培养液终止消化。800rpm·min-1离心5min后,弃去上清液,加入含10%fbs的培养基吹匀,用细胞计数板计数后,分瓶传代培养。
(三)细胞冻存
收集细胞,计数后加入冻存液(90%fbs+10%二甲基亚砜)1.0ml移入冻存管,进行程序梯度降温,4℃放置0.5h,-20℃放置1~2h,随后放入-80℃超低温冰箱保存过夜,后转移至-196℃的液氮罐中保存。
(四)erg联合gef对a549以及pc-9细胞的增殖抑制作用研究(mtt试验)
调整对数生长期a549细胞悬液浓度为5×104个·ml-1。800rpm·min-1离心5min后,吹打混匀成单细胞悬液,每孔加入100μl于96孔培养板,于37℃、5%co2培养箱中培养至细胞融合80%后加药处理。其中各个给药组加入100μl不同浓度不含fbs的药物溶液,正常对照组加入100μl不含fbs培养液。每个浓度各设5个复孔,分别于加药后第24、48、72h后进行mtt检测。每孔加入mtt(5mg·ml-1)溶液20μl,37℃孵育4h后,采用酶标仪于492nm处测定各孔吸光度od值,在570nm处验证。计算各组各浓度下的抑制率(ir)值以及药物半数抑制率ic50值,采用q值判断erg和gef联用的性质。本实验重复3次进行。
式中ea和eb为各药单用抑制率,eab为两药合用抑制率。q>1.15为协同作用,0.85-1.15为相加作用,<0.85为拮抗作用。
针对人肺癌a549细胞结果如下。实验考察了erg组,gef组以及erg+gef组在不同的时间点下的细胞抑制率。两药联用的抑制率均要高于单用组,且呈现一定的浓度依赖性,结果见图11,图1和图2。当孵育时间为48h时,erg+gef两药联用组(20+20μm)的q值大于1.15(图3),表明两药联用具有协同作用。而该浓度是两药具有协同作用的最大浓度,浓度加大,两药仅仅只有相加作用。因此,后续实验以该浓度作为中间浓度进行。
针对人肺癌pc-9细胞结果如下。gef组在等浓度下对于pc-9细胞的抑制率极显著高于a549细胞(p<0.01)。加上erg联用后,erg+gef组的抑制率相对比等浓度的药物单用组均有了一定的提高,结果见图12,图4和图5。当孵育时间为48h时,gef+erg两药联用组(5+40μm)的q值大于1.15(图6),表明两药联用具有协同作用。而该浓度是两药具有协同作用的最大浓度,浓度加大,两药仅仅只有相加作用。因此,后续实验以该浓度作为中间浓度进行。
(五)erg联合gef对a549以及pc-9细胞的hoechst33258凋亡染色研究
实验分为4组:a组(正常对照组),b组(erg组20μm),c组(gef组20μm)、d组(erg+gef组20+20μm)。调整对数生长期a549细胞悬液浓度为2×105个·ml-1。800rpm·min-1离心5min后,吹打混匀成单细胞悬液,每孔加入2ml含药培养基于6孔培养板,每个药3个复孔。于37℃、5%co2培养箱中培养至细胞融合80%后加药处理。48h后pbs清洗3次,加入4%的多聚甲醛室温固定20min。吸出4%的多聚甲醛后用pbs小心清洗3次,加入hoechst33258染液,37℃染色30min。弃去染色液后用pbs清洗3次,于荧光显微镜下观察细胞核形态。本实验重复3次进行。
取对数生长期pc-9非小细胞肺癌细胞,实验分为4组:a组(正常对照组),b组(erg单用组浓度为40μm),c组(gef单用组浓度为5μm)、d组(erg+gef组40+5μm),其他操作同上。
hoechst33258对a549细胞染色结果见图13,正常对照组的a549细胞发出均匀的蓝色荧光,仅有几颗凋亡细胞;而给药组凋亡细胞出现较多核浓染、碎裂,同时发出较强的荧光。erg(20μm)与gef(20μm)联用出现浓染凋亡样的细胞数量明显多于二者单用,且发出的荧光与单用组比较更强。
hoechst33258对pc-9细胞染色结果见图14,正常对照组的pc-9细胞发出均匀的蓝色荧光,细胞核无明显的形态学改变,仅有几颗凋亡细胞;而实验组凋亡细胞出现核浓染、碎裂,发出较强的荧光。gef组和erg+gef组的细胞量明显少于空白组和erg组,表明在pbs清洗过程中由于pc-9细胞死亡已无法贴壁,从而导致镜下观察到的细胞减少。erg(40μm)与gef(5μm)联用出现浓染凋亡样的细胞数量明显多于二者单用,且发出的荧光与单用组比较更强。
(六)流式细胞术对erg与gef给药后a549细胞以及pc-9细胞凋亡与细胞周期的研究
1细胞凋亡率测定
采用annexinv-pi双染流式细胞术检测各组凋亡情况。将对数生长期的a549细胞调整数目为1.5×105个·ml-1。800rpm·min-1离心5min后,吹打混匀成单细胞悬液,每孔加入2ml给药培养基于6孔培养板,设置每个药每个浓度3个复孔,erg(10,20,40μm),gef(10,20,40μm),erg+gef(10+10,20+20,40+40μm)。于37℃、5%co2培养箱中培养至细胞融合80%后加药处理48h后收集上清及细胞,pbs洗涤3次,800rpm·min-1离心5min,用100μl1x流式缓冲液重悬,每个给药孔加入5μlfitc与5μlpi荧光染料,于室温下黑暗处孵育15min后,每孔继续加入400μl1x缓冲液,用涡旋混合器低转速下混合均匀,过400目筛网后,1h内采用流式细胞仪检测细胞凋亡率。实验重复3次。
取对数生长期pc-9细胞,设置每个药每个浓度3个复孔,erg(20,40,80μm),gef(2.5,5,10μm),erg+gef(20+2.5,40+5,80+10μm)。其他操作同上。
a549细胞凋亡的流式结果见图15和图7。gef组的细胞凋亡率在各个浓度下均要高于erg组,erg+gef(20+20μm)组与gef(20μm)之间的凋亡率有差异(p<0.1),并无显著性差异(p>0.05)。erg+gef组的凋亡率均极显著高于单用组(p<0.01),且erg与gef的浓度分别为40和40μm,细胞凋亡率最高,达到16.31±0.28%。
pc-9细胞凋亡的流式结果见图16和图8。gef组的细胞凋亡率在各个浓度下均要高于erg组,erg+gef(20+2.5μm)组与gef(2.5μm)之间的凋亡率有差异(p<0.1),并无显著性差异(p>0.05)。erg+gef组的凋亡率均极显著高于单用组(p<0.01),且erg与gef的浓度分别为80和10μm,细胞凋亡率最高,达到26.29±0.91%。
如表1-8所示。erg(80μg·ml-1)、gef(10μg·ml-1)组与erg+gef组(80+10μg·ml-1)相比,**p<0.01,差异有极显著性;erg(40μg·ml-1)、gef(5μg·ml-1)组与erg+gef组(40+5μg·ml-1)相比,##p<0.01,差异有极显著性;erg(20μg·ml-1)组与erg+gef组(20+2.5μg·ml-1)相比,△△p<0.01,差异有极显著性。gef(2.5μg·ml-1)组与erg+gef组(20+2.5μg·ml-1)相比,0.05<p<0.1,有差异。
2细胞周期测定
将对数生长期的细胞调整数目为1.5×105个·ml-1接种于6孔培养板内,于37℃、5%co2培养箱中培养至细胞融合80%后加药处理,设置erg(40μm)组,gef(40μm)组,erg+gef(40+40μm)组。药物作用48h后,收集上清及细胞,800rpm·min-1离心10min,pbs洗涤1次后,用75%冰乙醇固定过夜,离心弃掉乙醇,用pbs洗涤2次。弃去pbs,每个样本加入0.5ml的pi染色液室温避光染色15min,置流式细胞仪上测定各周期细胞比例。本实验重复3次。
取对数生长期pc-9细胞,设置每个药每个浓度3个复孔,erg(40μm),gef(5μm),erg+gef(40+5μm)。其他操作同上。
a549细胞周期的流式结果见图17和图9。当erg浓度为20μm时,对a549细胞产生了s期阻滞(32.05±2.27%),与对照组s期(29.63±2.15%)相比,差异有极显著性(p<0.01)。gef(20μm)会产生明显的g0/g1期(72.60±0.81%)阻滞(p<0.01)。而两药联用以后,由于erg作用下会增加细胞周期中s期的比例,因此a549细胞的g0/g1期比例相较gef给药组减少(p<0.01),和对照组g0/g1期(56.65±0.13)相比,具有极显著差异(p<0.01)。
如图9所示。与control组相比,*p<0.05,差异有显著性,**p<0.01,差异有极显著性。
pc-9细胞周期的流式结果见图18和图10,当erg浓度为40μm时,对pc-9细胞周期产生明显的s期阻滞,s期比例为26.93±2.02%,与对照组s期(19.13±1.20%)相比,差异有极显著性(p<0.01),同时也产生了一定的g2/m期阻滞,g2/m期比例为13.58±1.80%,与对照组g2/m期(9.64±1.25%)相比,差异有显著性(p<0.05)。而5μm的gef可阻滞细胞于g0/g1期,比例为78.35±1.58%,与对照组g0/g1期(71.23±0.44%)相比,具有极显著性差异(p<0.01)。两药联用时,pc-9细胞g0/g1期比例为78.91±1.86%(p<0.01),s期比例为13.18±3.16%(p<0.05)。这提示,两药联用,不仅能在一定程度上增加g0/g1期阻滞,更能减少细胞周期s期比例。
如图10所示。与control组相比,*p<0.05,差异有显著性,**p<0.01,差异有极显著性。
(七)western-blots检测erg与gef给药后akt,p-akt,egfr,p-egfr的表达
将对数生长期的细胞调整数目为2×105个·ml-1接种于6孔培养板内,加药处理48h后提取细胞总蛋白,并用bca试剂盒测定其浓度。调整各组总蛋白浓度相同后将蛋白质样品与5x上样缓冲液混合后于100℃中煮沸5min,加入相应浓度的sds-page胶中电泳至溴酚蓝距离胶底部1cm处即停止电泳,然后转至0.22μm的pvdf膜上,western封闭液封闭1h,稍洗后分别加入适量一抗akt(1:1000),p-akt(1:500),egfr(1:1000),p-egfr(1:500),β-actin(1:4000)于4℃下孵育过夜,western洗涤液漂洗3次,每次5min,加入对应来源的荧光二抗常温孵育2h,western洗涤液洗膜3次,每次5min,采用odyssey红外荧光扫描成像系统扫膜,采用imagej软件计算条带灰度值来进行定量分析。本实验重复3次。
取对数生长期的a549细胞,其他操作同上。
蛋白表达结果见图19所示。给药组的各磷酸化蛋白都在一定程度上降低了表达水平,其中两药联用效果最明显,表明erg和gef联用能在一定程度上抑制egfr,akt相关信号通路的表达。在a549细胞中,相对比空白对照组和erg组,gef组和erg+gef组的p-akt/akt水平和p-egfr/egfr水平均显著降低(p<0.05,p<0.01)。相对比gef组,erg+gef组的p-egfr/egfr水平显著降低(p<0.05)。在pc-9细胞中,相对比空白对照组,其余各给药组的p-akt/akt水平极显著增加(p<0.01),gef组和erg+gef组的p-egfr/egfr水平极显著降低(p<0.01)。相对比erg组,gef组和erg+gef组的p-akt/akt水平和p-egfr/egfr水平均显著降低(p<0.05,p<0.01)。相对比gef组,erg+gef组的p-akt/akt水平和p-egfr/egfr水平均显著降低(p<0.05,p<0.01)。β-actin作为实验中的内参蛋白。
如图19所示。与control组相比,*p<0.05,差异有显著性,**p<0.01,差异有极显著性;与erg组相比,△p<0.05,差异有显著性,△△p<0.01,差异有极显著性;与gef组相比,#p<0.05,差异有显著性,##p<0.01,差异有极显著性。
三、分析与讨论
研究结果显示,erg组,gef组以及两药联用组对a549、pc-9细胞的增殖均有一定的抑制作用,且呈现一定的浓度依赖性。采用流式细胞仪检测细胞凋亡时发现,erg和gef联用在pc-9细胞上的凋亡率要远远高于a549细胞中。可能原因如下:gef对pc-9细胞敏感,对a549细胞不敏感。而erg导致细胞死亡的主要途径可能不是通过凋亡途径。细胞周期试验中,erg组相对于对照组,能引起s期细胞比例极显著增加(p<0.01),erg+gef组能导致两种细胞的g0/g1期阻滞抑制其增殖,从而抑制肿瘤进一步的发展恶化。
在western-blots试验中,erg+gef组的p-akt/akt水平和p-egfr/egfr水平均极显著降低(p<0.01),表明两药联用能在一定程度上抑制egfr信号通路的表达。而pi3k/akt/mtor信号通路是egfr信号通路的下游信号通路,因此我们可以猜想,是否两药联用能够在一定程度上抑制pi3k/akt/mtor信号通路的表达,从而使肿瘤细胞产生凋亡。
四、小结
erg与gef合用,在一定程度上证明了对gef敏感的pc-9细胞能够起到增效、增敏作用,对gef耐药的a549细胞能够增加其一定的敏感性。近年来许多研究表明,pi3k/akt/mtor信号通路在肿瘤细胞中发挥重要的作用,因此,有关erg与gef联用抗肿瘤更全面的分子机制有待进一步研究。
- 还没有人留言评论。精彩留言会获得点赞!