一种抑菌型促进创面修复的自愈合水凝胶敷料的制作方法
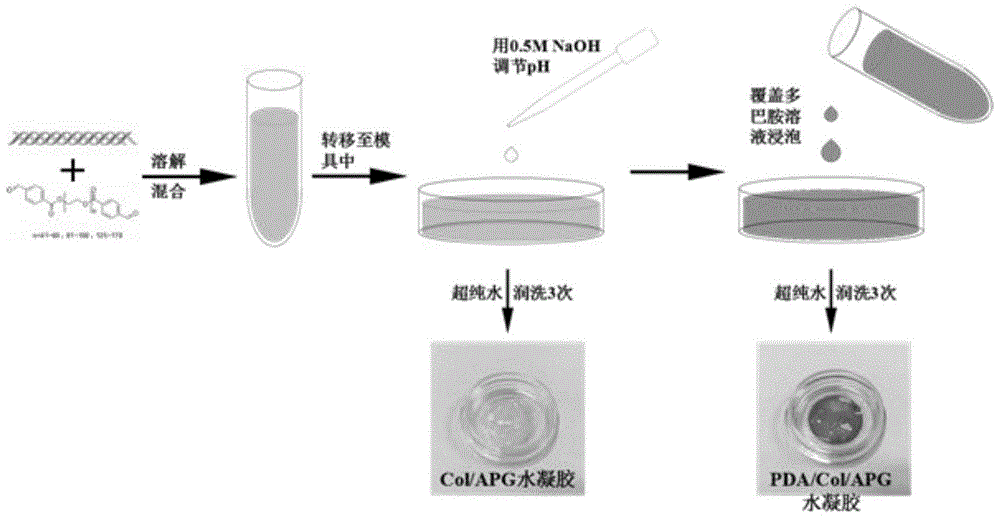
本发明涉及一种抑菌型促进创面修复的自愈合水凝胶敷料,属于医用生物材料领域。
背景技术:
由于手术、烧伤和慢性溃疡,在世界范围内患有急、慢性皮肤伤口,需要进行临床护理的人数超过8000万,全球伤口护理市场规模超过200亿美元。尤其是慢性伤口通常需要频繁换药和长期住院治疗使患者身体受到限制,给患者带来了经济负担,严重降低了他们的生活质量。此外,这也给医疗系统带来了沉重的负担。
基于水凝胶的伤口敷料是伤口护理中最有前景的材料之一,可满足敷料的重要要求,包括:保持伤口湿润,同时吸收大量渗出液,通过冷却减轻疼痛,轻柔覆盖敏感的下层组织,并有可能促进伤口的愈合。尽管市场上已经有许多基于水凝胶的敷料,但迫切需要新的伤口护理治疗方案,以解决当今老龄化社会中越来越多的严重急、慢性伤口问题。复杂的制备工艺,材料的安全性问题以及水凝胶特有的缺乏机械稳定性问题,阻碍了许多新方法的临床实施。为了满足临床需求,将需要开发克服这些缺点的新型水凝胶伤口敷料。
胶原蛋白作为一种天然的生物活性分子,具有可生物降解、生物相容性强、能增强细胞粘附增殖和促进伤口修复等性能,目前已被广泛应用于伤口修复中。由于胶原蛋白本身机械性能不理想,通常可用戊二醛、京尼平和碳二亚胺等物质对胶原蛋白进行交联以提升其机械性能,但这些常用交联剂具有一定的毒性影响材料的后续应用。
为了避免伤口感染,伤口敷料应具有良好的抗菌活性。特别是,抗生素的普遍使用导致越来越严重的细菌耐药性现象。研究人员通过将抗菌剂掺入敷料中或直接使用具有固有抗菌活性的材料来开发抗菌伤口敷料。与具有可释放抗菌剂的敷料相比,具有固有抗菌活性的敷料可能具有持久的抗菌活性,并降低了对组织的细胞毒性。聚多巴胺具有固有的抗菌活性,并在开发水凝胶伤口敷料方面具有提升材料粘附性能等优点。
技术实现要素:
本发明拟解决现有水凝胶敷料机械性能差、粘附性能不佳、本身不具备抗菌性及无法促进伤口愈合等缺点,目的提供一种抑菌型促进创面修复的自愈合水凝胶敷料及其制备方法,本发明提供的水凝胶敷料具有自愈合性能可延长其使用时间,能牢固贴合创面,具有优异的抗菌性和生物相容性,且该水凝胶敷料对创面的修复有明显的促进作用。
本发明的第一个目的是提供一种制备抑菌型促进创面修复的自愈合水凝胶敷料的方法,所述方法为:
(1)将胶原蛋白溶解于水中得到胶原蛋白溶液,并将苯甲醛封端的聚乙二醇(apg)溶解于胶原蛋白溶液中形成胶原蛋白/apg的混合溶液;其中,胶原蛋白的氨基与聚乙二醇醛基的摩尔质量比为(0.4~3.5):1;
(2)将步骤(1)制备的混合溶液上覆盖8~15mm多巴胺溶液,静置一定时间后弃去模具中的多巴胺溶液;
(3)对步骤(2)处理后的水凝胶采用超纯水润洗2~3次,即制备得到具有抑菌功能的水凝胶敷料。
在一种实施方式中,胶原蛋白氨基与修饰后的聚乙二醇的醛基之间的摩尔比为0.4~3.5。
在一种实施方式中,胶原蛋白氨基与修饰后的聚乙二醇的醛基之间的摩尔比为0.4、1.3或3.5。
在一种实施方式中,醛基修饰后的聚乙二醇的浓度为0.3~2.9%。
在一种实施方式中,胶原蛋白溶液的浓度为2~4%。
在一种实施方式中,所述聚乙二醇是不同分子量的聚乙二醇的混合物。
在一种实施方式中,所述聚乙二醇是聚乙二醇2000、聚乙二醇4000、聚乙二醇6000按照质量比为(23~34):(37~55):(80~120)的混合物。
在一种实施方式中,所述步骤(1)是将浓度为2~4%(m/v)的胶原蛋白与浓度为0.23%~0.34%的聚乙二醇2000、浓度为0.37%~0.55%的聚乙二醇4000、浓度为0.8%~1.2%的聚乙二醇6000混合,于ph7.0~7.8静置5~30min。
在一种实施方式中,所述苯甲醛封端的聚乙二醇是在聚乙二醇两端进行醛基化修饰;所述醛基化修饰的步骤为:(1)将聚乙二醇、对醛基苯甲酸按摩尔比(0.5~1.5):(2~6)溶于无水四氢呋喃,向其中加入4-二甲基胺吡啶;(2)将n,n-二环己基碳酸二亚胺溶于无水四氢呋喃,逐滴加入步骤(1)制备的混合液,氮气保护下室温搅拌;(3)搅拌反应18~24h后过滤,取澄清溶液,缓慢滴入至大量无水乙醚中使产物沉淀;(4)过滤收集步骤(3)的沉淀后,将固体沉淀溶于无水四氢呋喃,再滴入至无水乙醚中沉降,重复三次,可纯化得到醛基化修饰的聚乙二醇。
在一种实施方式中,所述方法包括如下步骤:
(1)聚乙二醇的醛基化修饰:
将聚乙二醇、对醛基苯甲酸、4-二甲基胺吡啶溶于无水四氢呋喃,其中聚乙二醇和对醛基苯甲酸的摩尔比为(0.5~1.5):(2~6);随后把与聚乙二醇质量比为(0.5~1.5):(2.5~7.5)的n,n-二环己基碳酸二亚胺溶于无水四氢呋喃,逐滴加入上述混合液,氮气保护下室温搅拌。搅拌反应18~24h后过滤,收集澄清溶液,将澄清溶液缓慢滴入至大量无水乙醚中使产物沉淀。过滤收集沉淀后将固体沉淀溶于无水四氢呋喃,滴入无水乙醚中沉降,此过程重复三次,可纯化得到醛基化修饰的聚乙二醇。
(2)col/apg水凝胶的制备:将胶原蛋白溶解在超纯水中,在室温下形成2%~4%(m/v)的均匀col溶液,并将所需量的醛基修饰的聚乙二醇溶解在胶原蛋白溶液中以形成apg浓度为0.3%~21.2%(m/v)的col/apg混合溶液,将混合溶液转移至模具中,调节凝胶ph至7.0~7.8,静置一定时间后用超纯水润洗三次即可制备得到col/apg水凝胶敷料。
(3)pda/col/apg水凝胶的制备:在步骤(2)制备的col/apg水凝胶敷料表面覆盖用由10mmtris-hcl(ph8.5)配制的0.1~20mg/ml的新鲜多巴胺溶液,静置6~24h后弃去模具中的多巴胺溶液,并用超纯水润洗三次即可制备得到pda/col/apg水凝胶敷料。
本发明还要求保护应用所述方法制备的水凝胶敷料。
本发明还要求保护所述方法在医药、日化领域制备创面修复材料方面的应用。
有益效果:本发明提供的抑菌型促进创面修复的自愈合水凝胶敷料以胶原蛋白和苯甲醛封端的聚乙二醇为水凝胶基质,通过原位聚合的方式修饰以聚多巴胺。敷料具有良好机械性能、自愈合性能、粘附性能和生物相容性,聚多巴胺本身的性能赋予了凝胶抑菌的作用,在短时间内对大肠杆菌和表皮葡萄球菌抑菌率均接近100%,全皮层切除的创面愈合实验也证明了该敷料具有创面修复的潜能。
附图说明
图1为本发明医用创面敷料的制备流程示意图。
图2为col/apg的储存模量和损耗模量,其中(a)为储存模量,(b)为损耗模量。
图3为不同分子量apg联用的col/apg的储存模量和损耗模量,其中(a)为储存模量,(b)为损耗模量。
图4为3%col-apg6000-1.2的宏观自愈合行为观察。
图5为col/apg的临界应变值。
图6为col/apg的交替应力扫描试验。
图7为pda/col/apg的储存模量和损耗模量,其中(a)为储存模量,(b)为损耗模量。
图8为pda/col/apg的表观粘度。
图9为pda/col/apg的临界应变值(a)和交替应力扫描试验(b)。
图10为水凝胶的粘附强度(a)和在关节处粘附的示意图(b)。
图11为水凝胶的溶胀率。
图12为水凝胶样品上的细菌总数(log值),其中(a)为大肠杆菌,(b)为表皮葡萄球菌。
图13为hff-1细胞在水凝胶样品上的存活率。
图14为在不同天数小鼠全层皮肤缺损模型伤口愈合图像。
具体实施方式
下面参照附图1,结合具体的实施例对本发明做进一步的说明,以更好地理解本发明。在不做特别说明的情况下,实施例中涉及的浓度(m/v)均指质量体积浓度,即每100ml溶液中含有按质量(g)计的化合物,例如2%(m/v)表示2g/100ml。
实施例1
将聚乙二醇2000(1.63g,0.815mmol)、对醛基苯甲酸(0.49g,3.26mmol)和4-二甲基胺吡啶(0.025g,0.205mmol)溶于80ml无水四氢呋喃。随后把n,n-二环己基碳酸二亚胺(0.84g,4.075mmol)溶于20ml无水四氢呋喃,逐滴加入上述混合液,氮气保护下搅拌。然后,整个体系在25℃反应20小时。过滤,取澄清溶液,缓慢滴入大量无水乙醚中使产物沉淀,过滤后将固体溶于无水四氢呋喃,滴入无水乙醚中沉降,此过程重复三次,可纯化产物得到醛基化修饰的聚乙二醇2000。
按照制备醛基化修饰的聚乙二醇2000的方法分别对聚乙二醇4000、聚乙二醇6000进行醛基化修饰,其中,聚乙二醇2000(1.63g,0.815mmol)分别替换为聚乙二醇4000(3.26g,0.815mmol)、聚乙二醇6000(4.89g,0.815mmol),产物命名分别为apg2k,apg4k,apg6k。
实施例2
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。再将实施例1制备的apg2k溶解在胶原蛋白溶液中以形成apg2k浓度为2.9%(m/v)、1.0%(m/v)及0.3%(m/v)的col/apg混合溶液,使胶原蛋白氨基与apg醛基摩尔质量分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg2k-0.4、2%col-apg2k-1.2及2%col-apg2k-3.5。
表12%浓度的胶原蛋白与不同apg2k浓度配比的凝胶
实施例3
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。再将实施例1制备的apg4k溶解在胶原蛋白溶液中以形成apg4k浓度为4.8%、2.4%及0.5%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg4k-0.4、2%col-apg4k-1.2及2%col-apg4k-3.5。
表22%浓度的胶原蛋白与不同apg4k浓度配比的凝胶
实施例4
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。再将实施例1制备的apg6k溶解在胶原蛋白溶液中以形成apg6k浓度为10.6%、3.2%及1.2%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg6k-0.4、2%col-apg6k-1.2及2%col-apg6k-3.5。
表32%浓度的胶原蛋白与不同apg6k浓度配比的凝胶
实施例5
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg2k溶解在胶原蛋白溶液中以形成apg2k浓度为4.3%、1.4%及0.5%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg2k-0.4、3%col-apg2k-1.2及3%col-apg2k-3.5。
表43%浓度的胶原蛋白与不同apg2k浓度配比的凝胶
实施例6
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg4k溶解在胶原蛋白溶液中以形成apg4k浓度为7.2%、2.4%及0.8%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.3及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg4k-0.4、3%col-apg4k-1.2及3%col-apg4k-3.5。
表53%浓度的胶原蛋白与不同apg4k浓度配比的凝胶
实施例7
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg6k溶解在胶原蛋白溶液中以形成apg6k浓度为15.9%、5.3%及1.8%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg6k-0.4、3%col-apg6k-1.2及3%col-apg6k-3.5。
表63%浓度的胶原蛋白与不同apg6k浓度配比的凝胶
实施例8
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将所需量的apg2k溶解在胶原蛋白溶液中以形成apg2k浓度为5.7%、1.9%及0.7%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.2及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg2k-0.4、4%col-apg2k-1.2及4%col-apg2k-3.5。
表74%浓度的胶原蛋白与不同apg2k浓度配比的凝胶
实施例9
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将所需量的apg4k溶解在胶原蛋白溶液中以形成apg4k浓度为9.6%、3.2%及1.1%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.3及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg4k-0.4、4%col-apg4k-1.2及4%col-apg4k-3.5。
表84%浓度的胶原蛋白与不同apg4k浓度配比的凝胶
实施例10
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将所需量的apg6k溶解在胶原蛋白溶液中以形成apg6k浓度为21.2%、7.0%及2.4%(m/v)的col/apg混合溶液,胶原蛋白氨基与apg醛基摩尔比分别为0.4、1.3及3.5,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg6k-0.4、4%col-apg6k-1.2及4%col-apg6k-3.5。
表94%浓度的胶原蛋白与不同apg6k浓度配比的凝胶
实施例11
对col/apg水凝胶的机械性能进行测试。储能模量是表征材料变形后回弹的指标。测试实施例2~10制备的中凝胶的储能模量和损耗模量。样品均为均匀圆柱体。通过流变仪(discoverdhr-2)进行流变测试。平行板直径25mm,间距1mm,固定应变γ=1%,扫描角频率范围ω=0.1~100rad/s。测试结果见附图2。
col/apg水凝胶的机械性能对其在创面敷料的应用至关重要,测试结果如图2所示,胶原蛋白浓度为2%的水凝胶储存模量偏小,均低于500pa,其中胶原蛋白氨基和apg6k醛基的摩尔比为0.4的样品机械性能最高,约为300pa;对于4%的胶原蛋白凝胶,整体机械性能水平较高,胶原蛋白氨基与apg2k醛基的摩尔比为3.5的样品机械性能最高约为1300pa。而胶原蛋白浓度为3%的水凝胶样品中,3%col-apg6k-1.2,3%col-apg6k-3.5机械性能最佳,最高为2000pa,推测其原因是胶原蛋白长链与apg6k之间的空间距离合适,在氨基和醛基的摩尔比为1.2和3.5条件下,既不会由于浓度太低无法形成凝胶,也不会因为浓度过高,分子链之间空间位阻过大,导致凝胶内部结构不稳定。
实施例12
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg4k溶解在胶原蛋白溶液中以形成apg2k浓度为0.15%(m/v)、apg4k浓度为0.25%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg2k-4k。
实施例13
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。同时,将所需量的apg4k和apg6k溶解在胶原蛋白溶液中以形成apg4k浓度为0.25%(m/v)、apg6k浓度为0.6%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg4k-6k。
实施例14
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.15%(m/v)、apg6k浓度为0.6%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg2k-6k。
实施例15
将胶原蛋白溶解在超纯水中,在室温下形成2%(m/v)的均匀col溶液。同时,将所需量的apg2k、apg4k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.10%(m/v)、apg4k浓度为0.17%、apg6k浓度为0.20%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为2%col-apg2k-4k-6k。
表102%浓度的胶原蛋白与不同分子量apg联用的凝胶
实施例16
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg4k溶解在胶原蛋白溶液中以形成apg2k浓度为0.25%(m/v)、apg4k浓度为0.40%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg2k-4k。
实施例17
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg4k和apg6k溶解在胶原蛋白溶液中以形成apg4k浓度为0.40%(m/v)、apg6k浓度为0.90%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg4k-6k。
实施例18
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.25%(m/v)、apg6k浓度为0.90%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg2k-6k。
实施例19
将胶原蛋白溶解在超纯水中,在室温下形成3%(m/v)的均匀col溶液。同时,将所需量的apg2k、apg4k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.17%(m/v)、apg4k浓度为0.27%、apg6k浓度为0.30%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为3%col-apg2k-4k-6k。
表113%浓度的胶原蛋白与不同分子量apg联用的凝胶
实施例20
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg4k溶解在胶原蛋白溶液中以形成apg2k浓度为0.34%(m/v)、apg4k浓度为0.55%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg2k-4k。
实施例21
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将apg4k和apg6k溶解在胶原蛋白溶液中以形成apg4k浓度为0.55%(m/v)、apg6k浓度为1.20%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg4k-6k。
实施例22
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将所需量的apg2k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.34%(m/v)、apg6k浓度为1.20%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg2k-6k。
实施例23
将胶原蛋白溶解在超纯水中,在室温下形成4%(m/v)的均匀col溶液。同时,将apg2k、apg4k和apg6k溶解在胶原蛋白溶液中以形成apg2k浓度为0.23%(m/v)、apg4k浓度为0.37%、apg6k浓度为0.80%的col/apg混合溶液,之后将混合溶液转移至模具中,用0.5mnaoh溶液调节凝胶ph至7.0~7.8后静置,凝胶在5~120s内形成,静置30min后用超纯水润洗三次即可制备得到水凝胶敷料,将该凝胶命名为4%col-apg2k-4k-6k。
表124%浓度的胶原蛋白与不同分子量apg联用的凝胶
实施例24
测定不同分子量apg联用的col/apg水凝胶的机械性能,具体为实施例12~23制备的凝胶的储能模量和损耗模量。样品均为均匀圆柱体。通过流变仪(discoverdhr-2)进行流变测试。平行板直径25mm,间距1mm,固定应变γ=1%,扫描角频率范围ω=0.1~100rad/s。测试结果见图3。
在胶原蛋白氨基与apg醛基的摩尔比为3.5的基础上,制备不同分子量apg联用的水凝胶,通过调节胶原蛋白的浓度、不同分子量apg的组合,分别得到实施例12到23这12个配方的水凝胶。将12种不同分子量apg联用的col/apg水凝胶进行机械性能表征,图3结果表明,与两种分子量聚乙二醇联用的凝胶样品相比,三种分子量聚乙二醇的联用,对浓度为3%和4%的胶原蛋白水凝胶的机械性能有显著提高,储存模量分别达1291.29pa和1116.87pa,两种聚乙二醇联用制备的胶原蛋白水凝胶储存模量为126~412pa综上所述,三种聚乙二醇联用比两种聚乙二醇联用的效果较强,其中对3%和4%浓度胶原蛋白的效果最为显著,但是对单一聚乙二醇凝胶的机械性能没有增强作用。
实施例24
为了检验col/apg的自愈合性能,使用刀片将3%col-apg6k-1.2凝胶分别切碎和切断,再将处理后的水凝胶聚拢在一起,室温下放置半个小时,拍照记录凝胶的自愈合行为。为了更直观地观察凝胶的自愈合现象,在玻璃片上放置切断的凝胶,将断面拼接,用光学显微镜记录在不同时间的自愈合行为。测试结果见附图4。
经过对凝胶重新拼接1分钟、10分钟和30分钟后的观察,图4中可明显看出凝胶发生自愈合行为,黑色阴影面积逐级缩小,表明凝胶切口逐渐缩小。
实施例25
采用应变幅度扫描法记录4%col-apg4k-1.2、4%col-apg2k-3.5、4%col-apg2k-4k-6k、3%col-apg6k-0.4、3%col-apg6k-1.2、3%col-apg2k-4k-6k的临界应变值,γ范围从1%到800%,固定角频率为1rad/s,使用直径为25毫米的平行板,设置间距为500纳米。测试结果见附图5。
col/apg水凝胶的临界应变值对其自愈合性能至关重要。本专利采用流变测试方法评估水凝胶的临界应变值。如图5所示,六个凝胶样品的临界应变值均大于100%,其中4%col-apg4k-1.2样品的数值为122%;3%col-apgk-0.4、4%col-apg2k-3.5、4%col-apg2k-4k-6k样品的临界应变值均处于150%到200%之间;3%col-apg6000-1.2和3%col-apg2k-4k-6k样品的临界应变值最高,分别达到208%和247%,这表明该两种凝胶可承受较高的外界应变力。
实施例26
通过交替应变扫描测试以固定角频率(1rad·s-1)测试4%col-apg4k-1.2、4%col-apg2k-3.5、4%col-apg2k-4k-6k、3%col-apg6k-0.4、3%col-apg6k-1.2、3%col-apg2k-4k-6k的自愈行为。振幅振荡应变从小到大:分别从γ=1%到γ=200%,γ=1%到γ=400%,γ=1%到γ=800%,间隔60秒。使用直径为25毫米的平行板,设置间距为500纳米。测试结果见附图6。
交替应力扫描试验结果如图6显示,经过不同应力损伤后,3%col-apg6k-1.2样品的储存模量与起始模量没有太大区别,这说明该凝胶在经历了强大张力的损伤后,机械强度仍能恢复到起始水平。与此相较,其他五个样品的机械性能均有一半的损伤,并且在800%的张力作用下几乎没有储存模量。
实施例27
在3%col-apg6k-1.2上分别用tris-hcl(10mm,ph=8.5)配置的0.1mg/ml,0.5mg/ml、1.0mg/ml、5.0mg/ml、10.0mg/ml及20.0mg/ml的新鲜多巴胺溶液覆盖,静置6h后弃去模具中的多巴胺溶液,并用超纯水润洗三次即可制备得到pda/col/apg-6水凝胶敷料。
实施例28
在3%col-apg6k-1.2上分别用tris-hcl(10mm,ph=8.5)配制的0.1mg/ml,0.5mg/ml、1.0mg/ml、5.0mg/ml、10.0mg/ml及20.0mg/ml的新鲜多巴胺溶液覆盖,静置12h后弃去模具中的多巴胺溶液,并用超纯水润洗三次即可制备得到pda/col/apg-12水凝胶敷料。
实施例29
在3%col-apg6k-1.2上分别用tris-hcl(10mm,ph=8.5)配制的0.1mg/ml,0.5mg/ml、1.0mg/ml、5.0mg/ml、10.0mg/ml及20.0mg/ml的新鲜多巴胺溶液覆盖,静置24h后弃去模具中的多巴胺溶液,并用超纯水润洗三次即可制备得到pda/col/apg-24水凝胶敷料。
实施例30
测试实施例27~29制备的pda/col/apg水凝胶的储能模量和损耗模量。样品均为均匀圆柱体。通过流变仪(discoverdhr-2)进行流变测试。平行板直径25mm,间距1mm,固定应变γ=1%,扫描角频率范围ω=0.1~100rad/s。测试结果见附图7。
pda/col/apg的流变学性能如图7所示,从整体来看,所有凝胶的储存模量均小于1000pa,与col/apg相比有所降低,但聚多巴胺浓度为0.5mg/ml和1mg/ml时的储存模量仍较为乐观。由此表明,聚多巴胺溶液的浓度为0.5mg/ml和1mg/ml时,可承受达600pa的外界压力,呈现相对较好的机械性能。
实施例31
利用流变仪测定实施例27~29制备的pda/col/apg水凝胶的表观粘度,剪切速率范围为0.01-100s-1。测试结果见附图8。
由图8可以看出,在所有浓度聚多巴胺浸没不同时间后的3%col-apg6k-1.2中,随着剪切速率的增加,表观粘度下降,但是在剪切速率达到0.016s-1时,凝胶表观粘度最高。其中,浓度为1mg/ml的聚多巴胺溶液浸没后的pda/col/apg表观粘度最高,可以达到105pa·s。由图8中可直观的得出,相比其他浓度,浓度为1mg/ml的聚多巴胺溶液对pda/col/apg表观粘度的增加更明显,且该浓度聚多巴胺溶液在聚合时间为6h、12h和24h时的表观粘度分别达10271.70、8983.66和5895.66,均高于其他浓度。因此,实验结果表明,pda/col/apg在0.01-100s-1的剪切速率范围内具有良好的剪切稀释性。
实施例31
采用应变幅度扫描法记录实施例27~29制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品的临界应变值,γ范围从1%到800%,固定角频率为1rad/s,使用直径为25毫米的平行板,设置间距为500纳米。测试结果见附图9。
通过交替应变扫描测试以固定角频率(1rad·s-1)测试实施例30制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品的自愈行为。振幅振荡应变从小到大:分别从γ=1%到γ=200%,γ=1%到γ=400%,γ=1%到γ=800%,间隔60秒。使用直径为25毫米的平行板,设置间距为500纳米。测试结果见附图9。
采用流变测试方法评估pda/col/apg的临界应变值,以探究凝胶的自愈合性能。如图9所示,不同聚合时间的pda/col/apg的临界应变值随着时间的增加分别为138%、127%、292%,因此,聚多巴胺的聚合时间在十二小时之内对凝胶的抗应变能力降低,但是在聚合二十四小时后凝胶可以承受的外界应变力略有提升。交替应力扫描试验结果表明,经过800%应力测试后,三种pda/col/apg的储存模量仍可以大致恢复起始水平,但是pda/col/apg-24凝胶的储存模量偏低,只有500pa左右,而其他两块凝胶可达1000pa,与聚多巴胺聚合前的模量相差无几。
实施例32
使用搭接剪切测试评估实施例30制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品的粘合强度。水凝胶对宿主组织的粘附能力是通过使用猪皮进行的。具体步骤为:将皮肤组织切成10mm×40mm的矩形,然后在使用前浸入pbs中。将100μl水凝胶施加到猪皮表面上,并将另一皮肤置于水凝胶溶液上。粘合面积为10mm×10mm。随后,将猪皮在室温下放置3小时。在配备有50n测力传感器的instron材料测试系统(mtscriterion43,mtscriterion)上以5mm/min的速率使用搭接剪切测试来测试粘附性能。每组重复测试三次。测试结果见附图10(a),pda/col/apg-6的粘附强度达6.16kpa,比未覆盖多巴胺溶液的水凝胶强度提高了0.38kpa。附图10(b)为水凝胶在关节处粘附的示意图。
施用后,水凝胶敷料必须完全粘附并密封伤口部位,以防止细菌增殖以及流体渗出。使用搭接剪切测试评估水凝胶的粘合强度。这一系列的水凝胶均表现出理想的粘合强度,并且这些组之间没有显着差异,保持与纤维蛋白胶粘剂
实施例33
测试实施例30制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品在pbs中的溶胀能力,以未聚合多巴胺的3%col-apg6k-1.2凝胶样品为对照,记为col/apg。称取5mg左右的凝胶样品放入ep管中,记录样品质量(w0)。然后,向ep管中加入2mlpbs溶液将样品浸没,37℃恒温,于不同的时间点取出后小心拭去样品表面的水分,用分析天平精确称量每个时间点的质量,并记录样品湿重(wε)。样品的溶胀能力
通常,水凝胶敷料可以保持潮湿的伤口环境,并且可以吸收组织多余的渗出物。在图12中,所有水凝胶都可以急剧膨胀,但未聚合多巴胺水凝胶组的溶胀率要低于其他三个水凝胶组。
实施例34
采用菌落计数法测试实施例27~29制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品对大肠杆菌(atcc25922)和表皮葡萄球菌(atcc12228)的抑菌效果,以未聚合多巴胺的3%col-apg6k-1.2凝胶样品为对照,记为col/apg。无菌条件下,将200μl水凝胶制备于24孔板每孔中。将20μl细菌悬浮液(菌体浓度为105cfuml-1,50%lb培养基)加入到水凝胶盘的表面上。接下来,将该24孔板在37℃下在相对湿润的气氛中放入培养箱中孵育。在2小时后,向每个孔中加入2ml灭菌的以重新悬浮所有存活的细菌。作为阴性对照,将20μl细菌悬浮液(105cfuml-1,50%lb培养基)加入2mlpbs中以获得均匀溶液。将菌悬液稀释100倍后取100μl均匀涂布于凝固的营养琼脂培养基平板表面,在37℃温育12小时后,计数培养皿上的菌落形成单位(cfu)。每组重复测试三次。测试结果见附图12。
样品总菌落数(log值)=log(计数所得培养皿上的菌落形成单位×2×103)。
由图12(a)和(b)可知,本发明的pda/col/apg水凝胶敷料对大肠杆菌和表皮葡萄球菌均具有良好的抑菌效果。相比于col/apg水凝胶,原位聚合了多巴胺的pda/col/apg水凝胶敷料的抑菌效果得到了明显的提升,并且多巴胺的聚合时间为12小时的效果最佳,在2小时内抑菌率接近100%,聚合时间为6h的抑菌率分别为99.5%和99.7%。
实施例35
将实施例27~29制备的pda/col/apg-6,pda/col/apg-12,pda/col/apg-24这三种凝胶样品的细胞毒性用nih3t3细胞存活率测定,评价水凝胶的生物相容性。以未聚合多巴胺的3%col-apg6k-1.2凝胶样品为对照,记为col/apg。首先将nih3t3细胞以5000个/孔的密度接种于96孔细胞培养板中并培养24h。之后将冻干后的凝胶浸泡于含有10%fbs的dmem培养基中,将100μl的样品浸泡液加入到培养板孔中,并在培养板中留出无添加样品的细胞对照孔,然后分别在培养箱中培养1/2/3天。待培养结束后,小心移除培养板中的溶液,加入100μl的mtt的磷酸盐缓冲液溶液(0.5mg/ml),在37℃湿润环境中培育4h,弃去孔中的mtt,各加入100μldmso并在室温下振荡1min混合均匀,之后用酶标仪记录570nm处的吸光值。每组重复测试6次。测试结果见附图13。
细胞相对存活率(%)=添加样品测得的吸光值/无添加样品测得的吸光值×100%。
图13表明,本发明提供的水凝胶敷料对hff-1细胞没有明显的细胞毒性,且水凝胶样品pda/col/apg-6和pda/col/apg-12有一定促进hff-1细胞增殖的效果,在第1天和第2天分别能使细胞存活率提高至111~115%和225~237%。
实施例36
通过全层皮肤缺损模型进行体内伤口愈合实验测试凝胶促进伤口愈合的能力,以未聚合多巴胺的3%col-apg6k-1.2凝胶样品为对照,记为col/apg。在该研究中使用雄性昆明小鼠(30-40g,5-6周龄)。首先,将所有小鼠随机分成3组。这三组是control对照组、col/apg水凝胶和pda/col/apg-12水凝胶,每组含有3只小鼠。所有小鼠在手术前适应环境1周。通过针吸活组织检查产生约0.8cm直径的全厚度皮肤圆形伤口。然后,在对照组中向伤口添加100μlpbs。对于水凝胶组,分别在伤口上施加100μlcol/apg水凝胶和pda/col/apg-12水凝胶。在第0天,第3天,第5天,第9天,第13天,采集所有伤口区域图片。测试结果见附图14。
第3天,各组均出现一定程度的伤口面积减小,而pda/col/apg-12水凝胶表现出最大的伤口收缩面积,表明其对伤口愈合的促进作用相对较高。在第9天,两个水凝胶组均显示出比对照组更好的治疗效果。在第13天,尽管所有组都表现出较小的伤口残留面积,但水凝胶组在伤口收缩面积仍然比空白对照组大。因此,pda/col/apg-12水凝胶的结果通过追踪伤口收缩区域显示出比对照组更好的伤口愈合效果,这归因于聚多巴胺固有抗菌性能的综合作用和胶原蛋白的理想性促进伤口愈合,以及水凝胶敷料提供的湿润伤口环境。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!