一种香豆素衍生物在抑制酪氨酸酶活性中的应用的制作方法
本发明涉及香豆素衍生物的新的用途,具体涉及一种香豆素衍生物在抑制酪氨酸酶活性中的应用。
背景技术:
酪氨酸酶(ec1.14.18.1)是一种含铜离子的多酚氧化酶,广泛分布于动、植物和微生物中。它参与组织黑色素的生物合成过程,是黑色素的限速酶。在黑色素生成过程中,酪氨酸酶将l-酪氨酸催化氧化为l-3,4-二羟基苯丙氨酸(l-dopa),并进一步将l-dopa氧化为邻醌,最终生成黑色素。人体中产生的黑色素可以使人体皮肤免受太阳紫外线的伤害,同时,皮肤中不同黑色素的含量和种类决定人类的肤色和头发颜色,而若黑色素过分积累,则会引起色素沉着,引起严重的美容问题,如色斑、黑斑、老年斑等,甚至导致各种色斑甚至黑色素瘤。此外,过多黑色素分泌会在食品加工过程中,酪氨酸酶由于催化反应导致新鲜水果、蔬菜和饮料产生褐变,从而降低其贮藏周期、营养价值、以及经济价值。因此,抑制酪氨酸酶的酶活性可降低酪氨酸酶的催化速率,从而预防黑色素的异常沉积。
酪氨酸酶抑制剂可以抑制酪氨酸酶的活性,从而降低酪氨酸酶引起的不利影响。目前,人们从低等菌类到高等植物中发现了许多天然酪氨酸酶抑制剂,如曲酸(kojicacid)、苯二酚及从高等植物中获得的多酚类(主要分为黄酮类和二苯乙烯类)酪氨酸酶抑制剂等,而由于受其有效性等因素制约而难于得到广泛应用,目前仅曲酸、苯二酚等有实际的应用。然而,实践研究发现曲酸、苯二酚等仍可引发细胞毒性、皮肤癌、皮炎等副作用。因此,开发一种高效、低毒的酪氨酸酶抑制剂具有重要意义。
天然产物结构修饰是寻找较高活性先导化合物的重要途径,官能团及骨架杂合策略是拓展其生物学活性,提升药理作用,克服耐药性等的关键策略。香豆素和肉桂酸皆属天然产物,原料来源丰富,相对安全低毒,生物活性多样,均对酪氨酸酶具有一定的抑制作用。单独以肉桂酸或香豆素作为酪氨酸酶抑制剂,存在抑制作用弱或无法保证稳定性等问题。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种香豆素衍生物在抑制酪氨酸酶活性中的作用,本发明以羟基香豆素和取代肉桂酸为原料合成一系列衍生物,以期获得良好活性的先导化合物,为研发出新型酪氨酸酶抑制剂提供新思路,经研究推测该类衍生物对酪氨酸酶的抑制是可逆、混合型抑制作用,能够明显抑制酪氨酸酶的活性,具有良好的应用前景。
根据本发明实施例的应用,一种香豆素衍生物在抑制酪氨酸酶活性中的应用,所述香豆素衍生物的化学结构式如式(i)或式(ii)所示:
式中,r1为h、ch3、och3、f、cl、br、cf3或oh;所述r2为h或och3。
根据本发明的一些实施例,所述r2为och3时,所述r1为oh。
根据本发明的一些实施例,将所述香豆素衍生物制备成酪氨酸酶抑制剂组合物。根据本发明的一些实施例,将所述香豆素衍生物制备成抗果蔬酶促褐变抑制剂。
根据本发明的一些实施例,将所述香豆素衍生物制备成美白化妆品。
根据本发明的一些实施例,所述化妆品选自面霜、面膜、乳液、精华、爽肤水、洗面奶或沐浴露。将香豆素衍生物与其他常用化妆品原料制备成各类美白化妆品。
根据本发明的一些实施例,将所述香豆素衍生物制备成用于预防和治疗黑色素异常导致的人体色素沉着性疾病、黑色素瘤以及其他需要抑制酪氨酸酶活性的病症的药物。
根据本发明的一些实施例,所述药物的剂型包括固体粉末、水溶液、醇溶液、巴布剂、注射液、滴注液、粉针剂、颗粒剂、片剂、冲剂、散剂、口服液、糖衣剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、口含剂、丸剂、膏剂、丹剂、喷雾剂、滴丸剂、口崩剂、微丸。以上述香豆素衍生物为活性成分,结合其他药学上可接受载体制备成各类剂型。
根据本发明实施例的应用,至少具有如下有益效果:本发明方案的衍生物是含有香豆素与肉桂酸主体结构单元,对酪氨酸酶活性具有显著的抑制作用,为开发安全高效的酪氨酸酶抑制剂提供了新的方向;还可进一步应用于药物、化妆品及食物保鲜添加剂等产品中,在医药、化妆品、食品、农业等领域具有良好的应用前景。
本发明方案结构的各衍生物可参照以下方法进行制备:
1、对于不含羟基取代基的化合物,其合成路线如下:
其中,r1代表h、ch3、och3、f、cl、br或cf3,a代表socl2,dmf,dcm,室温,6h;b代表4-羟基香豆素,diea,dcm,0℃;c代表7-羟基香豆素,diea,dcm,0℃。
具体合成过程可参照如下步骤:将取代肉桂酸,socl2,dmf加入dcm中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm溶解。将4-羟基香豆素或7-羟基香豆素溶于dcm中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺,用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,即得。
2、对于含羟基取代基的化合物,其合成路线如下:
其中,r2代表oh,r3代表h或och3,a代表tbdmscl,咪唑,dmap,dmf,0℃;b代表k2co3,thf,meoh,室温;c代表socl2,dmf,dcm,0℃;d代表4-羟基香豆素,diea,dcm,0℃;e代表7-羟基香豆素,diea,dcm,0℃;f代表hf,thf,室温。
具体合成过程可参照如下步骤:取含羟基的取代肉桂酸,将取代肉桂酸,咪唑,tbdmsc1和dmap加入dmf中并反应3小时,浓缩后的中间体用meoh/thf溶解,加入k2co3并反应3小时,即可得含有tbdms基团的取代肉桂酸。将含tbdms基团的取代肉桂酸,socl2,dmf加入dcm中并反应5小时,浓缩可得对应的肉桂酰氯,并用dcm溶解。将4-羟基香豆素或7-羟基香豆素溶于dcm中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺,用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
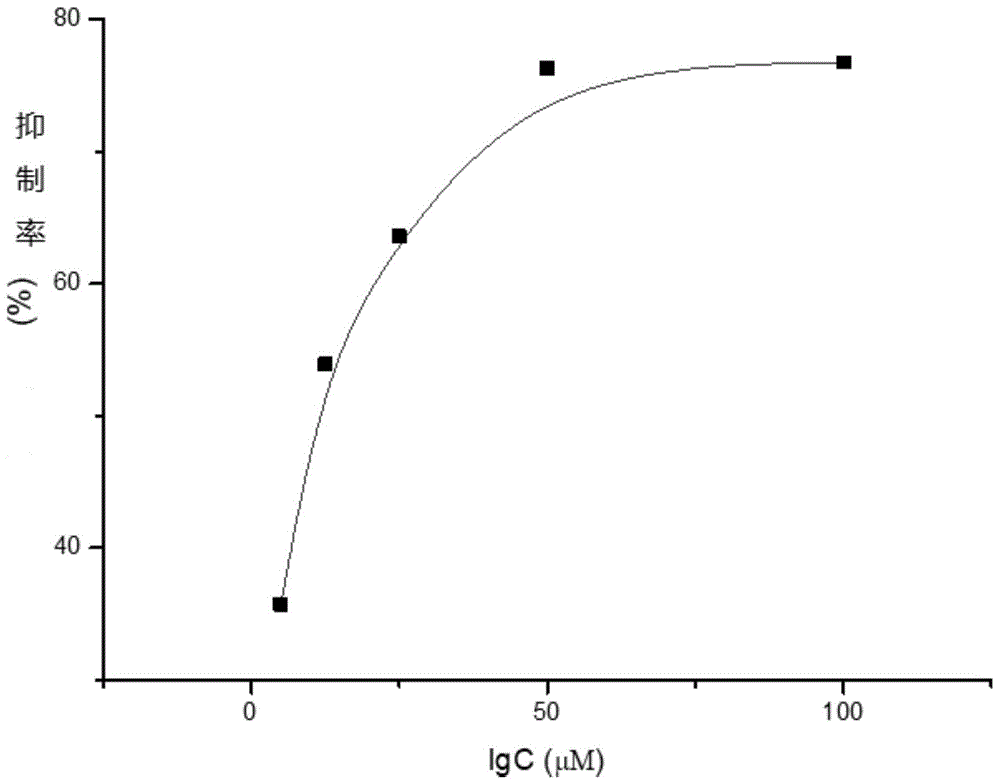
图1为本发明实施例1的香豆素衍生物对酪氨酸酶的抑制效应;
图2为本发明实施例2的香豆素衍生物对酪氨酸酶的抑制效应。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
本发明的实施例一为:香豆素衍生物c1在抑制酪氨酸酶活性中的应用,香豆素衍生物c1的结构式如下:
化合物c1通过以下步骤制备而得:
将对羟基肉桂酸(2mmol),咪唑(9mmol),叔丁基二甲基氯硅烷(tertbutyldimethylsilylchloride,tbdmsc1)(6mmol)和4-二甲氨基吡啶(4-dimethylaminopyridine,dmap)(0.2mmol)加入二甲基甲酰胺(n,n-dimethylformamide,dmf)(5ml)中并反应3小时,浓缩后的中间体用meoh/thf(1/2,12ml)溶解,加入k2co3(0.2g)并反应3小时,即可得含有tbdms基团的取代肉桂酸。将含tbdms基团的取代肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入二氯甲烷(dichloromethane,dcm)(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,并用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为29.7%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,dmso-d6)δ:10.26(s,1h),7.91(d,j=15.9hz,1h),7.79(dd,j=7.9,1.6hz,1h),7.74~7.67(m,3h),7.49(dd,j=8.3,1.0hz,1h),7.40(td,j=7.7,1.1hz,1h),6.87~6.82(m,2h),6.77(d,j=15.9hz,1h),6.62(s,1h);13cnmr(126mhz,dmso)δ:163.75,161.35,161.17,159.30,153.57,149.57,133.72,131.80,130.58,125.25,125.22,124.41,123.73,123.69,117.22,116.86,116.45,116.21,112.03,105.65;esi-ms:m/z330.72[m+na]+.由此表明,制得的产物结构式正确。
为评价该化合物的抑制效果,通过以下步骤进行测试:
首先用二甲基亚砜(dimethylsulfoxide,dmso)将测试物(化合物c1)配置成浓度为10mm的原液,并将其稀释成不同的浓度。在130μl50mmol/l磷酸缓冲溶液(ph=6.8)的测试体系中,先加入以磷酸盐缓冲液溶解的10μl蘑菇酪氨酸酶溶液,再加入10μl含不同浓度的测试物,最后加入50μl底物l-多巴(l-dopa,购于sigma-aldrich公司)溶液,混匀,在25℃恒温条件下使用酶标仪(thermofisherscientific公司)测定波长为490nm的吸光度值,记录1min反应的od值变化。另外,以10μl的dmso替代测试物作为空白加入,以供对照。酪氨酸酶活性抑制率按公式:%抑制率=[(△a-△b)/△a]×100计算,△a代表仅含dmso的空白对照在1min内吸光度变化值,△b代表不同浓度测试样品在1min内的吸光度变化值。
化合物c1对酪氨酸酶的抑制曲线如图1所示,计算ic50值为10.75μm。在同样的测试条件下,阳性对照曲酸的ic50值为28.5μm。根据相关研究,肉桂酸的ic50为0.61mmol/l(610μm),香豆素的ic50为2.0mg/l(13.6μm),而本发明的香豆素衍生物对酪氨酸酶抑制作用远大于肉桂酸母体。另外,本发明的香豆素衍生物分别在香豆素环4碳或7碳位上引入了酯键,有效地改善了原料羟基香豆素易氧化的缺点,使其稳定性明显增加。实验结果表明化合物c1对酪氨酸酶具有显著的抑制作用。
本发明的实施例二为:香豆素衍生物d1在抑制酪氨酸酶活性中的应用,香豆素衍生物d1的结构式如下:
上述实施例2中使用的化合物d1通过以下步骤制备而得:
将对羟基肉桂酸(2mmol),咪唑(9mmol),tbdmsc1(6mmol)和dmap(0.2mmol)加入dmf(5ml)中并反应3小时,浓缩后的中间体用meoh/thf(1/2,12ml)溶解,加入k2co3(0.2g)并反应3小时,即可得含有tbdms基团的取代肉桂酸。将含tbdms基团的取代肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,并用dcm(5ml)溶解。将7-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为29.0%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,dmso-d6)δ:10.17(s,1h),8.10(dd,j=9.6,0.7hz,1h),7.84~7.77(m,2h),7.70~7.65(m,2h),7.36(d,j=2.3hz,1h),7.23(dd,j=8.4,2.2hz,1h),6.88~6.82(m,2h),6.66(d,j=16.0hz,1h),6.49(d,j=9.6hz,1h);13cnmr(126mhz,dmso)δ:165.35,160.96,160.26,154.63,153.59,147.99,144.37,131.40,129.81,125.35,119.24,117.07,116.39,115.96,113.01,110.66;esi-msm/z330.98[m+na]+.由此表明,制得的产物结构式正确。
参照实施例1的操作对该化合物的抑制效果进行评价,化合物d1对酪氨酸酶的抑制曲线如图2所示,计算ic50值为2.22μm。因此,实验结果表明化合物d1对酪氨酸酶具有显著的抑制作用。
本发明方案中的部分其他衍生物的合成及表征可具体参照如下操作:
c2
将对氯肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为43.5%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.95(d,j=15.9hz,1h),7.72(dd,j=8.1,1.6hz,1h),7.59(td,j=7.9,7.2,1.6hz,1h),7.53(d,j=8.0hz,2h),7.38(d,j=8.4hz,1h),7.32(t,j=7.6hz,1h),7.29~7.25(m,2h),6.63(d,j=16.0hz,1h),6.60(s,1h),2.42(s,3h);13cnmr(126mhz,cdcl3)δ:162.96,161.64,158.73,154.09,153.72,149.40,142.38,132.74,130.86,129.96,128.73,124.33,122.92,117.12,115.74,114.14,105.15,21.66;esi-msm/z329.07[m+na]+.
c3
将对甲氧基肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为52.8%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.93(d,j=15.8hz,1h),7.72(dd,j=7.9,1.6hz,1h),7.62~7.57(m,3h),7.38(dd,j=8.4,1.1hz,1h),7.32(td,j=7.7,1.2hz,1h),7.00~6.95(m,2h),6.59(s,1h),6.54(d,j=15.8hz,1h),3.88(s,3h);13cnmr(126mhz,cdcl3)δ:163.11,162.49,161.69,158.81,153.72,149.07,132.71,130.59,126.31,124.31,122.95,117.11,115.80,114.67,112.50,105.09,55.53;esi-msm/z344.98[m+na]+.
c4
将对氟肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为54.5%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.93(d,j=15.9hz,1h),7.70(dd,j=8.0,1.6hz,1h),7.67~7.57(m,3h),7.38(dd,j=8.4,1.1hz,1h),7.32(ddd,j=8.1,7.4,1.1hz,1h),7.19~7.12(m,2h),6.64~6.57(m,2h);13cnmr(126mhz,cdcl3)δ:165.68,163.66,162.66,161.55,158.62,153.72,147.96,132.81,130.77,130.70,129.86,129.83,124.36,122.85,117.16,116.58,116.41,115.64,115.09,115.08,105.26;esi-msm/z333.39[m+na]+.
c5
将对氯肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为62.3%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.92(d,j=15.9hz,1h),7.70(dd,j=7.9,1.6hz,1h),7.62~7.55(m,3h),7.46~7.42(m,2h),7.39(dd,j=8.4,1.1hz,1h),7.32(ddd,j=8.2,7.3,1.1hz,1h),6.66(d,j=16.0hz,1h),6.59(s,1h);13cnmr(126mhz,cdcl3)δ:162.55,161.52,158.58,153.73,147.81,137.68,132.84,132.01,129.82,129.56,124.36,122.82,117.19,115.92,115.60,105.31;esi-msm/z348.84[m+na]+.
c6
将对溴肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为61.7%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.91(d,j=16.0hz,1h),7.70(dd,j=7.9,1.6hz,1h),7.65~7.57(m,3h),7.54~7.47(m,2h),7.39(dd,j=8.4,1.1hz,1h),7.35~7.28(m,1h),6.68(d,j=16.0hz,1h),6.59(s,1h);13cnmr(126mhz,cdcl3)δ:162.55,161.51,158.57,153.73,147.89,132.84,132.53,132.43,132.34,129.97,126.11,124.36,122.82,117.19,116.03,115.59,105.31;esi-msm/z393.05[m+na]+.
c7
将对三氟甲基肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将4-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为58.9%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.99(d,j=16.0hz,1h),7.78~7.68(m,5h),7.61(ddd,j=8.8,7.3,1.6hz,1h),7.39(dd,j=8.4,1.1hz,1h),7.36~7.30(m,1h),6.77(d,j=16.0hz,1h),6.60(s,1h);13cnmr(126mhz,cdcl3)δ:162.25,161.44,158.47,153.73,147.27,136.80,133.03,132.91,132.77,128.79,126.20,126.17,124.40,122.78,118.02,117.21,115.49,105.40;esi-msm/z382.78[m+na]+.
d2
将对甲氧基肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将7-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为64.6%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.86(d,j=15.9hz,1h),7.70(d,j=9.5hz,1h),7.59~7.53(m,2h),7.51(d,j=8.5hz,1h),7.20(d,j=2.2hz,1h),7.14(dd,j=8.5,2.2hz,1h),6.98~6.92(m,2h),6.49(d,j=15.9hz,1h),6.40(d,j=9.5hz,1h),3.86(s,3h);13cnmr(126mhz,cdcl3)δ:165.04,162.06,160.49,154.77,153.58,147.45,142.97,130.27,128.55,126.66,118.59,116.56,115.96,114.55,113.71,110.55,55.48;esi-msm/z345.10[m+na]+.
d3
将对氟肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,用dcm(5ml)溶解。将7-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为45.3%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,chloroform-d)δ:7.87(d,j=16.0hz,1h),7.71(d,j=9.6hz,1h),7.64~7.57(m,2h),7.52(d,j=8.4hz,1h),7.21(d,j=2.2hz,1h),7.13(td,j=8.4,2.0hz,3h),6.56(d,j=15.9hz,1h),6.41(d,j=9.6hz,1h);13cnmr(126mhz,cdcl3)δ:164.58,160.41,154.77,153.36,146.39,142.90,130.47,130.40,128.60,118.48,116.43,116.26,116.20,116.19,116.11,110.52;esi-msm/z333.11[m+na]+.
d4
将阿魏酸(2mmol),咪唑(9mmol),tbdmsc1(6mmol)和dmap(0.2mmol)加入dmf(5ml)中并反应3小时,浓缩后的中间体用meoh/thf(1/2,12ml)溶解,加入k2co3(0.2g)并反应3小时,即可得含有tbdms基团的取代肉桂酸。将含tbdms基团的取代肉桂酸(1.0mmol),socl2(1.2mmol),dmf(1滴)加入dcm(5ml)中并反应5小时,浓缩可得对应的肉桂酰氯,并用dcm(5ml)溶解。将7-羟基香豆素(1.2mmol)溶于dcm(5ml)中,冰浴下缓慢滴加至肉桂酰氯中,加入n,n-二异丙基乙胺(3.2mmol),用tlc板监测直至反应完成。反应完成后用饱和nahco3淬灭反应,乙酸乙酯萃取后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,柱层析分离纯化,得白色固体。产率为59.3%。
对制得的化合物的结构进行表征,以验证其结构的正确性。1hnmr(500mhz,dmso-d6)δ:9.77(s,1h),8.11(d,j=0.7hz,1h),7.84~7.76(m,2h),7.45(d,j=2.0hz,1h),7.36(d,j=2.2hz,1h),7.24(dd,j=8.4,2.2hz,2h),6.84(d,j=8.2hz,1h),6.75(d,j=15.9hz,1h),6.49(d,j=9.6hz,1h),3.84(s,3h);13cnmr(126mhz,dmso)δ:165.38,160.26,154.64,153.61,150.51,148.51,148.33,144.38,129.83,125.84,124.39,119.23,117.07,116.06,115.96,113.31,112.03,110.64,56.23;esi-msm/z359.65[m+na]+.
此外,还对其他满足本发明方案结构的香豆素衍生物的抑制效果均进行了验证,结果发现其同样对酪氨酸酶活性具有显著的抑制作用。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!