刺甘草查尔酮在制备抗食管癌药物中的应用的制作方法
本发明属于医药技术领域,具体涉及刺甘草查尔酮在制备抗食管癌药物中的应用。
背景技术:
食管癌是一种比较常见的消化道肿瘤,具有较高的发病率和致死率。目前,食管癌的首选治疗方法是手术完全切除病变和局部淋巴结。然而,由于该病早期无明显异常症状,因此在患者确诊时,多已发展至中晚期,此时为患者实施外科根治性手术治疗,不仅达不到理想的治疗效果,且会严重创伤患者机体。针对该类患者,临床上采用同步化疗法进行治疗,常用化疗药物为顺铂及多烯紫杉醇。但临床经验表明该治疗方法常无法达到预期效果,同时伴有严重的副作用。因此,开发出一种新颖有效的治疗食管癌的方法显得尤为重要。
天然产物以其明确的抗癌有效性、候选资源的丰富性等优势,成为抗癌药物研发的重中之重。例如长春新碱,伊立替康,依托泊苷和紫杉醇都是植物来源的抗癌化合物。甘草提取物能够发挥多种生物学效应,包括抗氧化、抗炎症以及抗肿瘤等,部分是通过调节nrf2,no和nfκb通路来实现的。甘草查尔酮a(licochalconea,lca)是一种从甘草中分离出来的黄酮类化合物。据报道它可以抑制非小细胞肺癌和乳腺癌的细胞活力;甘草查尔酮a通过抑制钙粘蛋白e和mapk通路抑制乳腺癌进展;甘草查尔酮a通过诱导g2/m细胞周期阻滞和内质网应激抑制非小细胞肺癌的增殖。刺甘草查尔酮(echinatin)是从甘草中分离得到的另一种天然化合物,其分子式为c16h14o4,化学结构式如下:
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供刺甘草查尔酮在制备抗食管癌药物中的应用。
本发明的目的通过下述技术方案实现:
刺甘草查尔酮在制备抗食管癌药物中的应用。
所述的抗食管癌是抑制食管癌细胞增殖、转移、侵袭或肿瘤生长。
所述的刺甘草查尔酮的有效浓度优选为10~40μm;更优选为10~20μm。
所述的食管癌细胞为人源性食管癌细胞系kyse30或kyse270。
所述的抗食管癌药物优选还含有5-氟尿嘧啶。
所述的刺甘草查尔酮和5-氟尿嘧啶的配比优选为摩尔比10~40:0.1~2;更优选为摩尔比10~20:0.3~1.25;最优选为,当食管癌细胞为人源性食管癌细胞系kyse30时,为摩尔比20:1.25;当食管癌细胞为人源性食管癌细胞系kyse270时,为摩尔比20:0.3。可根据细胞对药物的敏感性适当调整用药量。
所述的刺甘草查尔酮增加食管癌细胞对5-氟尿嘧啶的敏感性。
所述的刺甘草查尔酮的化学结构式为:
所述的抗食管癌药物含有刺甘草查尔酮或其药物盐中的至少一种或两种混合。
所述的刺甘草查尔酮与服用刺甘草查尔酮的小鼠个体体重的比例是20~50mg/kg。
所述的抗食管癌药物还含有药学上可接受的载体和赋形剂。
所述的载体优选为羧甲基纤维素钠。
所述的羧甲基纤维素钠选为0.5%羧甲基纤维素钠水溶液。
所述的抗食管癌药物为片剂、胶囊、滴丸、冲剂或口服液。
本发明相对于现有技术具有如下的优点及效果:
刺甘草查尔酮是从中草药甘草中分离得到的一种天然化合物,其抗癌的分子机制仍不清楚。本发明发现在在体外水平刺甘草查尔酮对食管癌细胞增殖、转移和侵袭有抑制作用,在体内可以有效抑制食管癌的生长。刺甘草查尔酮显著抑制食管癌细胞成瘤能力,且无明显毒副作用,可为食管癌临床治疗提供一种新的用药选择。
本发明还发现刺甘草查尔酮可以增加食管癌细胞对5-氟尿嘧啶的敏感性,可将刺甘草查尔酮与5-氟尿嘧啶联合用药,用于食管癌临床治疗。
附图说明
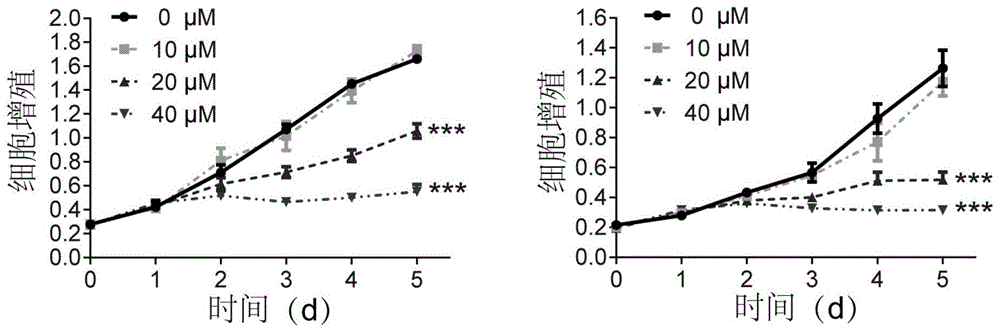
图1为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270cck-8实验结果图。
图2为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270单克隆形成实验结果图。
图3为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270转移实验结果图。
图4为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270侵袭实验结果图。
图5为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270中vimentin、β-catenin和e-cadherin蛋白表达量检测实验结果图。
图6为不同试剂处理下,食管癌细胞kyse30、kyse270cck-8实验结果图。
图7为不同试剂处理下,食管癌细胞kyse30、kyse270单克隆形成实验结果图。
图8为不同试剂处理下,食管癌细胞kyse30、kyse270中cleavedcaspase-3、caspase-3、和cleavedparp蛋白表达量检测实验结果图。
图9为不同刺甘草查尔酮浓度下,瘤体体积的变化结果图。
图10为不同刺甘草查尔酮浓度下,裸鼠体重的变化结果图。
图11为不同刺甘草查尔酮浓度下,重要组织(肾脏、肺、肝)形态的变化结果图。
图12为不同刺甘草查尔酮浓度下,食管癌细胞kyse30、kyse270中p-akt、akt、p-mtor、mtor和lc3蛋白表达量检测实验结果图。
图13为不同刺甘草查尔酮浓度下,裸鼠血液生化常规检测alt和ast结果图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
本发明实施例中涉及的实验材料:
人源性食管癌细胞系kyse30和kyse270细胞购自于atcc;
刺甘草查尔酮购自于上海陶素生化科技有限公司;
cck-8购自于日本同仁化学研究所;
雌性裸鼠(balb/c-nu/nu)购自于南京大学模式动物研究所;
e-cadherin单抗购于美国proteintechgroup,β-catenin,vimentin,caspase-3,cleavedcaspase-3,parp,cleavedparp,phospho-akt,akt,phospho-mtor,mtor,lc3和β-actin都是购于cellsignalingtechnology;
dmem培养基、胎牛血清、青霉素-链霉素购自于美国gibco;
二甲基亚砜(dmso)购自于美国sigma;
刺甘草查尔酮溶于dmso,浓度50mm,储存于-80℃冰箱。
实施例1单药实验
cck-8实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照50μl/1000个细胞的数量接种于96孔板中。隔夜细胞贴壁后,将50mm的刺甘草查尔酮原液用dmem培养基稀释成一定的浓度梯度,每孔加入50μl。设置四个细胞处理组,刺甘草查尔酮的浓度分别为0μm、10μm、20μm和40μm,每组3个复孔,并设置空白孔。于0、24、48、72、96和120h按照cck-8试剂盒说明书每孔加10μlcck-8(加的过程中避光,尽量避免复孔间的差异并尽量避免产生气泡)于37℃、5%co2培养箱中孵育2h后使用多功能酶标仪在450nm波长处读取各孔的吸光值,结果如图1所示。
单克隆形成实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照2ml/1000个细胞的数量接种于6孔板中。隔夜细胞贴壁后,将50mmol/l的刺甘草查尔酮原液用dmem培养基稀释成一定的浓度梯度,每孔加入2ml。设置三个细胞处理组,刺甘草查尔酮的浓度分别为0μm、10μm和20μm,每组3个复孔,于37℃、5%co2培养箱中孵育。14天后,取出6孔板,pbs洗3次,甲醇固定15min,0.4%结晶紫染色10min,在流水下轻轻冲洗去除多余的结晶紫,置于37℃烘箱中烘干后肉眼计数单克隆数目。结果如图2所示。
图1cck-8实验结果和图2单克隆形成实验结果显示,刺甘草查尔酮呈浓度、时间依赖性显著抑制食管癌细胞增殖。
transwell实验:将小室置于24孔板中,在实验前2h对小室进行预处理。迁移的小室中都加入无血清的空白培养基,其中上室200μl,下室加500μl。侵袭的小室则用无血清的空白培养基配制200μl适当浓度的基质胶缓冲液(基质胶:培养基=1:25)于上室,下室则加入500μl空白培养基。都置于37℃、5%co2培养箱中孵育。2h后,取生长状态良好的细胞,消化后收集于15ml离心管中,400g室温离心5min,随后用pbs清洗2次,并重复上述离心,以去掉培养基中残留的血清。用空白培养基计数调整细胞密度,按照200μl/100000个细胞的数量接种于上室(弃去之前的空白培养基),并将下室换成20%血清浓度的完全培养基。设置四个细胞处理组,刺甘草查尔酮的浓度分别为0μm、10μm、20μm和40μm,每组3个复孔,于37℃、5%co2培养箱中孵育。24h后,弃掉上室及下室的培养基,pbs清洗1次,分别在上室及下室加入500μl甲醇固定细胞15min。弃掉甲醇,pbs清洗1次。分别在上室和下室加入500μl0.4%结晶紫染色5min。最后使用超纯水浸泡去除残留的结晶紫,并用棉签擦掉上室中附着的细胞,保留穿过的细胞,置于37℃烘箱中烘干小室,显微镜拍照,计数,根据穿过细胞的数量来确定药物对细胞转移和侵袭能力的抑制作用。结果如图3,4所示。
westernblot实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照2ml/2×105个细胞的数量接种于6孔板中。隔夜细胞贴壁后,将50mmol/l的刺甘草查尔酮原液用dmem培养基稀释成一定的浓度梯度,每孔加入2ml。设置四个细胞处理组,刺甘草查尔酮的浓度分别为0μm、10μm、20μm和40μm,置于37℃、5%co2培养箱中孵育。48h后,收集适量细胞于1.5ml离心管中,加入适量蛋白裂解液(预先按1:100加入蛋白酶抑制剂pmsf),在漩涡振荡器上间歇震荡裂解细胞40min,至细胞完全裂解,4℃12000rpm离心1h,转移上清于新的离心管中。bca法检测裂解样品中的蛋白浓度,用超纯水和loadingbuffer(4×)调整样本至同一浓度,煮沸后,用10%sds-page胶电泳(上样总蛋白量约30μg),thermo蛋白半干转膜系统转膜置pvdf膜上,5%脱脂牛奶室温封闭1h,一抗(vimentin1:1000,β-catenin1:1000,e-cadherin1:5000,β-catenin1:1000)4℃孵育过夜。第二天,回收一抗,将膜用1‰tbst洗涤5次,每次5min;:加入hrp标记的相应二抗(抗体稀释于5%脱脂奶粉中,稀释比例1∶2000-3000),室温摇床孵育lh;1‰tbst洗涤5次,每次5min;ecl显色液于凝胶成像系统中显影,用imagelab软件分析目的蛋白条带。结果如图5所示。
图3迁移实验结果和图4侵袭实验结果显示,刺甘草查尔酮呈浓度依赖性抑制食管癌细胞的迁移和侵袭。图5中e-cadherin表达量的升高以及β-catenin和vimentin表达量的降低,表明了刺甘草查尔酮通过逆转食管癌的emt过程来抑制食管癌细胞的迁移和侵袭。
实施例2联合给药实验
cck-8实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照50μl/1000个细胞的数量接种于96孔板中。隔夜细胞贴壁后,50mm的刺甘草查尔酮原液用dmem培养基稀释成一定的浓度梯度,同时100mm的5-氟尿嘧啶原液用dmem培养基稀释成一定的浓度梯度,每孔加入50μl工作液。设置四个细胞处理组,对照组(dmso)、5-氟尿嘧啶组(kyse30中浓度为1.25μmol/l,kyse270中浓度为0.3μmol/l)、刺甘草查尔酮组(echinatin=20μmol/l)、联用组(kyse30中echinatin+5-fu=20μmol/l+1.25μmol/l和kyse270中echinatin+5-fu=20μmol/l+0.3μmol/l),每组3个复孔。于0、24、48、72、96和120h按照cck-8试剂盒说明书每孔加10μlcck-8(加的过程中避光,尽量避免复孔间的差异并尽量避免产生气泡)于37℃、5%co2培养箱中孵育2h后,使用多功能酶标仪在450nm波长处读取各孔的吸光值。结果如图6所示。
单克隆形成实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照2ml/1000个细胞的数量接种于6孔板中。隔夜细胞贴壁后,同上配置工作液,每孔加入2ml工作液。设置四个细胞处理组,对照组(dmso)、5-氟尿嘧啶组(kyse30中浓度为1.25μmol/l,kyse270中浓度为0.3μmol/l)、刺甘草查尔酮组(echinatin=20μmol/l)、联用组(kyse30中echinatin+5-fu=20μmol/l+1.25μmol/l和kyse270中echinatin+5-fu=20μmol/l+0.3μmol/l)。于37℃、5%co2培养箱中孵育。14天后,取出6孔板,pbs洗3次,甲醇固定15min,0.4%结晶紫染色10min,在流水下轻轻冲洗去除多余的结晶紫,置于37℃烘箱中烘干后肉眼计数单克隆数目。结果如图7所示。
westernblot实验:取生长状态良好的kyse30、kyse270细胞,消化计数调整细胞密度,按照2ml/2×105个细胞的数量接种于6孔板中。隔夜细胞贴壁后,同上配置混合工作液,每孔加入2ml。以下操作同实施例1中的westernblot(涉及一抗浓度caspase-31:1000,cleavedcaspase-31:1000,parp1:1000),结果如图8所示。
图6cck-8实验结果和图7单克隆形成实验结果显示,刺甘草查尔酮与5-氟尿嘧啶联用能够增强5-氟尿嘧啶对食管癌细胞的杀伤效果。图8中,联用组cleavedparp和cleavedcaspase3的蛋白表达量都升高,这表明刺甘草查尔酮可通过诱导细胞凋亡,增加食管癌细胞细胞对5-氟尿嘧啶的敏感性。
实施例3体内实验
皮下模型的构建以及不同药物浓度处理裸鼠
选取18只6-8周龄、雌性裸鼠(balb/c-nu/nu),设置对照组6只和实验组12只,构建肿瘤皮下瘤模型。
(1)按每只裸鼠皮下注射5×106个食管癌细胞kyse270的数量,将细胞重悬于100μlmatrigel混合液中(pbs:matrigel=体积比1:1,pbs(1×)的ph为7.2±0.1)
(2)在实验之前对裸鼠进行麻醉,通过无痛及有痛刺激来评估麻醉程度,确定裸鼠处于麻醉状态;
(3)用25g针头的微注射器对18只裸鼠进行皮下注射重悬细胞。
刺甘草查尔酮处理:裸鼠皮下注射kyse270细胞一周,瘤体直径达到5mm左右时,随机分组,给药。药物配方为将刺甘草查尔酮粉末溶于0.5%羧甲基纤维素钠水溶液(cmc-na)中制成原液,设置刺甘草查尔酮的浓度为0mg/kg,20mg/kg和50mg/kg;给药方式为灌胃,100μl/只,每隔2天给一次药,并测量裸鼠体重和瘤体体积。瘤体体积的变化如图9所示。裸鼠体重的变化如图10所示。重要组织(肾脏、肺、肝)形态的变化如图11所示。
(4)裸鼠肿瘤组织westernblot检测
用剪刀剪取适量的组织样本置于1.5ml离心管中,按照100μl/mg组织的量加入相应量的蛋白裂解液(预先按1:100加入蛋白酶抑制剂pmsf),使用研磨棒在冰上研磨样本至无明显块状组织,冰上静置10min使组织进一步裂解,4℃,12000rpm离心1h。转移上清于新的1.5ml离心管中。bca试剂盒检测蛋白浓度,制样,电泳,转膜,5%脱脂奶粉封闭,一抗((p-akt1:2000,akt1:1000,p-mtor1:1000,mtor1:1000,lc31:1000)孵育过夜,tbst洗5次,二抗孵育1h,ecl发光液曝光显影(详细步骤见上述westernblot操作)。结果如图12所示。
(5)裸鼠血液生化常规检测
给药14天后,收集裸鼠血液,10000g离心1min分离出血清,然后样品送至武汉谷歌生物科技有限公司进行血液生化分析,取0mg/kg组的裸鼠的血液作为对照。结果如图13所示。
图9不同浓度的刺甘草查尔酮处理裸鼠体内皮下瘤体积变化的实验结果,表明刺甘草查尔酮显著抑制食管癌细胞成瘤能力。图12中p-akt、p-mtor的变化,表明刺甘草查尔酮通过akt/mtor通路介导对食管癌生长的抑制作用。图10中裸鼠体重的变化,图11中重要组织(肾脏、肺、肝)形态的变化,以及图13中裸鼠血常规检测alt、ast的变化都无明显差异,表明刺甘草查尔酮对裸鼠没有明显的毒副作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一类水溶性含双苯并三氮唑‑查尔酮二联体的有机磺酸盐衍生物合成与应用的制作方法与工艺
- 一种从甘草渣制备甘草查尔酮A的方法与流程
- 一种氟化查尔酮的制备方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A二氢氨基嘧啶类化合物及其合成方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A硫脲嘧啶类衍生物及其合成方法与流程
- 一种具抗肿瘤活性的甘草查尔酮A二氢吡唑甲酰胺类化合物及其合成方法与流程
- 3‑去氧苏木查尔酮在制备预防和治疗结直肠癌药物中的应用的制作方法与工艺
- 具有2’‑羟基查尔酮结构Diels‑Alder产物的制备方法与流程
- 一种海南龙血树查尔酮异构酶DcCHIL1及其编码基因和应用的制造方法与工艺
- 一类具抗肿瘤活性的甘草查尔酮A二氢嘧啶类化合物及其合成方法与流程