钙蛋白酶抑制剂在制备治疗内毒素导致的急性肾损伤的药物中的应用的制作方法
本发明涉及钙蛋白酶抑制剂在制备治疗内毒素导致的急性肾损伤的药物中的应用。
背景技术:
急性肾损伤是重症监护室患者常见的并发症之一,其中,脓毒症是导致急性肾损伤的重要原因。脓毒症状态下,许多因素可导致急性肾损伤,包括:血流动力学不稳定、微循环障碍、内皮损伤等。正常情况下,肾脏可接受20%的心输出量,肾脏中丰富的毛细血管在维持肾小球滤过率的过程中发挥重要作用。血管内皮细胞在维持机体稳态、血-肾屏障中扮演重要角色。在脓毒症中,血管内皮细胞暴露至许多刺激下,包括内毒素、炎症因子等。血管内皮发生结构性的改变,如内皮细胞凋亡、细胞-细胞间粘附改变等,导致内皮通透性增加、屏障功能下降,进而导致白蛋白等大分子渗漏进入尿液中,同时伴随白细胞从血管游出增加,进入肾间质中,导致实质性肾损伤。因此,内皮细胞在脓毒症导致的急性肾损伤中扮演重要角色,而目前针对脓毒症中内皮细胞损伤的机制尚不完全明确,给针对性制定干预措施造成了困难。
技术实现要素:
calpain是钙依赖性的半胱氨酸家族的蛋白酶,广泛存在于全身各组织中,广泛参与多种病理和生理过程。我们前期研究发现,calpain活化与活性氧、过氧硝酸盐的产生增加相关,而内皮细胞对于这些血管活性物质十分敏感,可能影响了急性肾损的的病理发展过程,而目前对于这一内容尚无报道,明确内皮细胞在脓毒症急性肾损伤中的病理机制,可为临床治疗提供方向。而针对性应用calpain的抑制剂钙蛋白酶抑制剂iii来干预,从而发挥保护内毒素所致的肾损伤则可能为治疗提供了一个切实可用的备选物。
本发明使用calpain的抑制剂钙蛋白酶抑制剂iii,并结合使用多种细胞特异性calpain敲除鼠,一者来研究内皮细胞calpain在急性肾损伤中的作用及可能的作用机制,二者研究钙蛋白酶抑制剂iii做为治疗措施备选物的可能性。
本发明应用钙蛋白酶抑制剂iii抑制calpain活性后,可抑制p38磷酸化,进而降低inos表达及no和ros的产生,抑制内皮细胞凋亡,从而在lps导致的肾损伤中发挥保护作用。
附图说明
图1:内皮细胞capn4特异性敲除在lps肾损伤中的作用展示图。
图2:lps(i.p,4mg/kg)刺激18小时后calpastatin过度表达(tg-cast)和淋巴细胞capn4特异性敲除(lyz/capn4-/-)小鼠肾脏损伤的变化展示图。
图3:钙蛋白酶在lps诱导pmecs凋亡中的作用展示图。
图4:mapk家族成员在pmecs诱导lps凋亡中的作用展示图。
图5:lps(i.p,4mg/kg)刺激内皮细胞capn4特异性敲除(ko)小鼠18小时后肾脏no和ros浓度的变化展示图。
图6:lps(i.p,4mg/kg)刺激内皮细胞capn4特异性敲除(ko)小鼠18h后肾脏inos、enosmrna及蛋白水平的变化展示图。
图7:不同剂量lps(0.1-10ug/ml)刺激pmecs18h后inos表达和no生成的变化展示图。
图8:钙蛋白酶对脂多糖刺激的pmecsp38激活、诱导inos表达和no生成的作用展示图。
图9:钙蛋白酶和p38激活对脂多糖刺激的pmecs一氧化氮生成的作用展示图。
图10为内毒素血症小鼠肾功能损害的信号转导途径示意图。
具体实施方式
材料和方法
从杰克逊实验室购买了一对c57bl/6小鼠,法国巴黎国家圣母院劳伦特·鲍德博士(drlaurentbaud)提供了calpastatin(tg-cast)过度表达的转基因小鼠。从jackson实验室购买了内皮细胞特异性capn4基因敲除(tek/capn4-/-)和淋巴细胞特异性capn4基因敲除(lyz/capn4-/-)的转基因小鼠,并在我们的动物护理机构实施了一项育种计划。
所有的动物都被按时提供食物和水,并被安置在一个温度和湿度控制的设施中,有12小时的光和暗循环。western大学的动物使用小组委员会批准了所有实验方案,并按照加拿大动物护理委员会的指导方针使用了所有的动物。
内毒素血症动物模型的建立
根据我们先前的研究,内毒素血症动物模型是以lps(4mg/kg,i,p,sigma)或生理盐水为对照制备的。18小时后,用心脏穿刺对动物实施安乐死和失血。根据madorin等人公布的方法对血液进行处理以获得血浆。此外,收集尿液和肾组织作进一步检查。
小鼠肺微血管内皮细胞-pmecs培养及处理
从成年c67bl/6小鼠中分离pmecs,并按上述方法培养,所有pmecs在5代内用于本研究,calpain抑制剂iii、sb203580、pd98059和sp600125购自sigma、calbiochem或lifetechnology。所有抑制剂均在其他治疗前使用1小时。用指示浓度的lps处理细胞18小时,或用上述抑制剂预处理1小时,然后用lps刺激(1ug/ml)再处理18小时。
肾功能测定
血尿素氮(bun)根据试剂盒制造商的说明进行测定(生物测定系统,加利福尼亚州海沃德)。在动物被安乐死前收集小鼠尿液。根据制造商的说明(德克萨斯州蒙哥马利市bethyl实验室)测量尿白蛋白。
caspase-3活性
使用caspase-3荧光检测试剂盒,根据制造商的协议(生物醇研究实验室)测量组织和细胞caspase-3活性。
dna片段
在其他处理之前,用brdu预标记细胞24小时。根据制造商的说明,使用细胞dna片段elisa试剂盒(罗氏应用科学)测量dna片段。
凋亡细胞的原位检测
采用末端脱氧核苷酸转移酶介导的dutp缺口末端标记(tunel)法。肾组织用10%福尔马林固定,石蜡包埋。固定的肾组织被切成3毫米厚的块。组织块用石蜡包埋,切成5毫米的薄片。脱蜡(使用二甲苯和乙醇稀释液)和再水化后,用凋亡标记过氧化物酶原位凋亡检测试剂盒(chemicon,ca,usa)对切片进行tunel染色,如先前的研究所述。在200倍镜下,从10个视野中随机选取tunel阳性细胞计数,定量分析凋亡细胞死亡。结果显示每200倍视野中tunel阳性细胞数。
钙蛋白酶活性
如我们之前的研究所述,使用荧光底物n-琥珀酰-llvy-amc(加拿大安大略省伯林顿市cedarlane实验室)测定钙蛋白酶活性。
pmecs的腺病毒感染
以含有大鼠calpastatin基因的腺病毒载体(美国布法罗大学adcast)或ha(ad-ha,载体生物实验室)感染培养的pmecs作为对照,检测了10个pfu/细胞的多重感染。腺病毒介导的基因转移如前所述。所有实验均在腺病毒感染24小时后进行。
westernblot
从肾组织或体外培养的pmecs中提取蛋白,用sds-page法检测蛋白含量。用过氧化物酶结合的二级抗体(羊抗兔igg-hrp,bio-rad实验室)和增强化学发光法(amersham)检测一级抗体的结合,并用密度法定量条带。抗体和稀释液的来源如下:兔抗钙蛋白酶1和2抗体、兔抗磷酸-p38、抗磷酸-jnk1/2和抗磷酸-erk1/2抗体、兔抗总p38、jnk1/2和erk1/2抗体、兔抗inos抗体、兔抗enos抗体(均按1:1000稀释,细胞信号转导)。以兔抗gapdh(1:1000稀释,sant-cruz)为内对照。
一氧化氮(no)和活性氧产物(ros)产量测量
根据制造商的说明,使用商用试剂盒(cayman化学公司)测量血浆、组织裂解液和细胞培养基中的no生成量。简言之,每个样品20μl在室温下与硝酸还原酶混合物孵育1小时。通过检测2,3-二氨基萘酞反应生成的荧光产物1(h)-萘并三氮唑来检测no的含量。
用活性氧敏感染料2',7'-二氯二氢荧光素二乙酸酯(dcf-da)作为指示剂(分子探针)测定了血浆和组织溶解液中活性氧的形成。
实时逆转录聚合酶链反应(rt-pcr)
实时逆转录聚合酶链反应分析inos和enos的mrna。按照制造商的说明,使用trizol试剂(lifetechnologiesinc.burlington,ontario,canada)从肾组织中提取总rna。如前所述,实时rt-pcr用于分析小鼠inos、enos和gapdh的mrna表达。小鼠inos、enos和gapdhmrna的引物分别为:
inos:5'-acaggaggacgaact-3'(正向);
5'-ggctggacttttcactctgc-3'(反向);
enos:5'-acccctcacctcaacat-3'(正向);
5'-ctggccttctgctcatttcattctctc-3'(反向);
gapdh:5'-aaagggccctggctaca-3'(正向)
5'-caggttggggggggtgtgtgtgtgtgtgtg-3'(反向)。
统计分析
所有数据均为平均值±标准差(sd)。完成两样本均数差别的显著性检验比较两组间的差异。对于多组比较,进行方差分析,然后进行学生纽曼-基尔斯检验。p<0.05被认为具有统计学意义。
结果
capn4基因敲除可减轻lps诱导的小鼠肾损伤。
腹腔注射lps(4mg/kg)建立内毒素血症模型,测定血尿素氮(bun)浓度和尿蛋白,观察肾功能损害。结果表明,lps给药后18h血浆和尿蛋白bun浓度显著升高,说明lps可引起肾功能不全。此外,肾组织中caspase-3活性和tunel阳性细胞显著升高,提示肾功能损害远不止是功能性损伤,而是器质性损害。
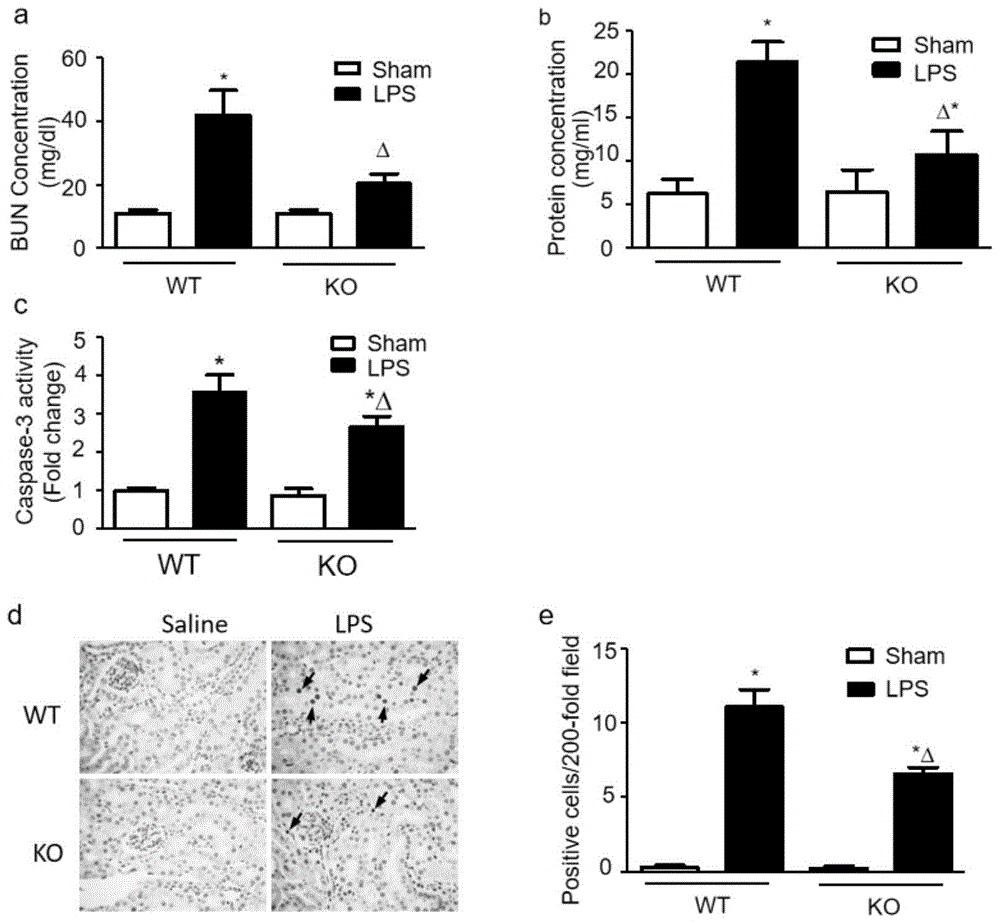
图1:内皮细胞capn4特异性敲除在lps肾损伤中的作用。用lps(i.p,4mg/kg)刺激野生型和内皮型capn4特异性敲除(ko)小鼠18小时。检测肾组织中bun浓度(a)、尿蛋白(b)、caspase-3活性(c)和tunnel染色(d,箭头为凋亡细胞),定量分析肾组织中tunel阳性细胞数(e)。*与wt-sham组相比p<0.05;与wt-lps组相比,δp<0.05,n=6-8。
由于calpain参与了炎症过程的发展,内皮功能障碍在脓毒症相关器官功能障碍中起着重要作用。为了确定内皮细胞钙蛋白酶对脂多糖诱导的肾损伤的影响,我们使用内皮细胞capn4(编码钙蛋白酶-1和钙蛋白酶-2的小亚单位)特异性敲除小鼠(tek/capn4-/-)。与野生型小鼠相比,注射lps后18h,tek/capn4-/-小鼠血浆和尿蛋白bun浓度显著降低(图1中a图和b图)。ko小鼠肾细胞凋亡也减少,caspase-3活性和tunel阳性细胞率下降(图1中c图、d图和e图)
图2:lps(i.p,4mg/kg)刺激18小时后calpastatin过度表达(tg-cast)和淋巴细胞capn4特异性敲除(lyz/capn4-/-)小鼠肾脏损伤的变化。检测血浆bun浓度(a、c)和肾组织caspase-3活性(b、d)。*与wt-sham组相比p<0.05;与wt-lps组相比,δp<0.05,n=6-8。
calpastatin是calpain的内源性抑制剂,对calpain-1和calpain-2活性具有全局抑制作用。为进一步证实calpain对lps所致肾损伤的影响,用相同剂量的lps处理calpastatin过度表达(tg-cast)小鼠,测定血浆bun浓度和caspase-3活性,结果与tek/capn4-/-小鼠相似,即内毒素血症tg-cast小鼠bun浓度较低血浆和肾组织中caspase-3活性降低(图2中a图和b图)。然而,这种保护作用在淋巴结capn4特异性敲除(lyz/capn4-/-)小鼠(图2中c图和d图)中没有观察到,表明内皮细胞钙蛋白酶在lps诱导的肾损伤中起主导作用。
综上所述,lps注射可引起明显的肾功能不全和细胞凋亡,内皮细胞钙蛋白酶活性下降可减轻这种现象。
钙蛋白酶激活参与lps诱导pmec凋亡
图3:钙蛋白酶在lps诱导pmecs凋亡中的作用。用calpain抑制剂iii(ci-iii,5mol/l)处理pmecs1h,lps(1ug/ml)刺激18h,测定calpain活性(a)、calpain1和calpain2表达(b)。检测caspase-3活性(c)和dna片段(d)。以calpastain高表达腺病毒(ad-cast)和ad-gal为对照,在lps刺激前感染pmecs,检测caspase-3活性。数据为3个不同实验的平均值±标准差。*与假载体/生理盐水组相比,p<0.05。与lps载体/生理盐水组比较,δp<0.05。
为了进一步阐明钙蛋白酶对内皮细胞的作用,我们采用pmecs作为体外模型。lps刺激后,calpain活性显著升高(图3中a图),但蛋白表达无变化,calpain-1和calpain-2均无变化(图3中b图)。此外,脂多糖治疗还可引起caspase-3活性和dna断裂的增加,提示细胞凋亡,而这种作用可通过给予钙蛋白酶活性抑制剂ci-iii(图3中c图和d图)或过表达钙蛋白酶抑制剂来预防,calpain的内源性抑制剂(图3中e图),提示calpain参与lps诱导的pmecs凋亡。
capn4基因敲除通过抑制p38mapk的磷酸化来阻止lps诱导的细胞凋亡。
我们先前的研究发现,钙蛋白酶通过调节丝裂原活化蛋白激酶(mapk)的磷酸化参与细胞凋亡。通过westernblot检测mapk家族成员p38、erk和jnk的磷酸化水平,探讨calpain在lps诱导内皮细胞凋亡中的作用机制。结果表明,lps处理能促进p38和jnk的磷酸化,但不能促进erk的磷酸化(图4中a图和b图)。我们进一步探讨了mapks在lps诱导的pmecs凋亡中的作用。结果表明,p38磷酸化抑制剂sb205380处理组caspase-3活性降低(图4中c图)。同样,sb205380治疗也能减少脂多糖诱导的pmecsdna断裂(图4中d图)。值得注意的是,我们发现在tek/capn4-/-小鼠中,p38的磷酸化被显著抑制(图4中e图),这些结果表明,capn4基因敲除的保护作用依赖于p38mapk磷酸化的降低。
图4:mapk家族成员在pmecs诱导lps凋亡中的作用。用(1ug/ml)刺激pmecs18小时。(a)westernblot检测p38、jnk(46和54kda)和erk1/2(42和44kda)的表达水平。(b)相应的条带用密度计定量(磷酸化蛋白/总蛋白,以倍数变化表示)。同时,用mpaks抑制剂(10umol/lsb203580、10umol/lpd98059和20umol/lsp600125)分别处理pmecs1小时,然后用lps(1ug/ml)刺激18小时。检测caspase-3活性(c)和dna片段(d)。(e)用westernblot法检测lps刺激内皮细胞capn4蛋白敲除小鼠(ko)p38磷酸化a的变化,并给出一个有代表性的图像。数据为3个不同实验的平均值±标准差。*与假载体组比较,p<0.05。δ表示与lps载体组相比p<0.05。
图5:lps(i.p,4mg/kg)刺激内皮细胞capn4特异性敲除(ko)小鼠18小时后肾脏no和ros浓度的变化。检测血浆(a、b)和肾组织(c、d)中no和ros浓度,与wt-sham组比较,p<0.05,与wt-lps组比较,p<0.05,n=5-8。
图6:lps(i.p,4mg/kg)刺激内皮细胞capn4特异性敲除(ko)小鼠18h后肾脏inos、enosmrna及蛋白水平的变化。实时pcr检测inos(a)和enos(b)mrna水平,westernblot检测inos和enos蛋白水平(c);(d)用密度法(protein/gapdh)对westernblot相应条带进行定量分析,并与假手术对照。*与假手术组相比,p<0.05;与wt-lps组相比,p<0.05,n=6-8。
内皮细胞capn4缺乏通过抑制inos的表达减少内毒素血症小鼠肾脏no和ros的产生。
no和ros参与了肾脏损伤的病理过程,我们先前的研究发现,在糖尿病模型中,通过过表达calpastain抑制calpain可以降低no的水平。本研究以tek/capn4-/-小鼠为实验对象,进一步探讨了calpain对内毒素血症模型no水平和ros生成的影响。与野生型小鼠相比,血浆(图5中a图和b图)和肾组织(图5中c图和d图)中的no水平和ros生成均降低。由于一氧化氮和活性氧的产生与一氧化氮合酶(nos)有关,我们测量了肾组织中诱导型一氧化氮合酶(inos)和内皮型一氧化氮合酶(enos)的mrna和蛋白(图6中a图和b图)。内毒素血症小鼠肾组织中inos和enos的mrna均增加,内皮细胞capn4基因敲除可抑制这种上调(图6中a图和b图)。然而,在tek/capn4-/-小鼠中,只有inos蛋白表达显著增加,其上调降低(图6中c图和d图)。提示内皮细胞capn4缺乏通过抑制inos的表达,降低内毒素血症小鼠肾脏no和ros的产生。
抑制calpain活性和p38磷酸化可降低pmec中inos和no的表达。
为探讨钙蛋白酶、p38mapk与inos的关系,以lps处理的pmecs为体外模型。
图7:不同剂量lps(0.1-10ug/ml)刺激pmecs18h后inos表达和no生成的变化。刺激pmecs,测定inos表达(a)。(b)用密度计(protein/gapdh)对相应的westernblot条带进行定量,然后在sham上显示折叠变化。数据为3个不同实验的平均值±标准差。*与假载体组比较,p<0.05。与lps载体组比较,δp<0.05。
图8:钙蛋白酶对脂多糖刺激的pmecsp38激活、诱导inos表达和no生成的作用。(a)用calpain抑制剂iii(ci-iii,5umol/l)或sb203580(10umol/l)治疗pmecs1小时,然后用lps(1ug/ml)刺激18小时。(a)westernblot检测inos表达水平、p38表达总量及磷酸化水平。(b)相应的条带用密度计定量(p-p38/总p38或inos/gapdh,然后在sham上呈现折叠变化)。pmecs感染calpastain腺病毒(ad-cast)或对照腺病毒(ad-ha)24小时,lps(1ug/ml)刺激18小时。(c)westernblot检测calpastain、inos和gapdh的表达水平。(d)westernblot检测p38磷酸化表达。数据为3个不同实验的平均值±标准差。*平均p<0.05。
图9:钙蛋白酶和p38激活对脂多糖刺激的pmecs一氧化氮生成的作用。用calpain抑制剂iii(ci-iii,5umol/l)或sb203580(10umol/l)治疗pmecs1小时,然后用lps(1ug/ml)刺激18小时。上清液中未检测到任何产物。数据为3个不同实验的平均值±标准差。*平均p<0.05。
westernblot检测结果显示,1μg/mllps可诱导pmecsinos表达显著上调,而enos表达无明显变化(图7),当细胞用calpain抑制剂或p38磷酸化抑制剂预处理时(图8中a图和b图),lps诱导的inos上调被抑制,no水平也降低(图9)。类似的结果也发现在细胞与钙蛋白酶过度表达(图8中c图和d图)。结果表明,lps通过影响inos的表达而诱导no的产生与calpain活性和p38磷酸化有关。
因此,本技术方案通过使用calpain的抑制剂钙蛋白酶抑制剂iii,并结合使用多种细胞特异性calpain敲除鼠,一者来研究内皮细胞calpain在急性肾损伤中的作用及可能的作用机制,二者研究钙蛋白酶抑制剂iii做为治疗措施备选物的可能性,具有以下特征:
1.内毒素血症模型中,内皮特异性calpain敲除小鼠肾损伤指标及细胞凋亡较野生型小鼠下降。
2.calpain内源性抑制剂calpastatin特异性过表达小鼠内毒素血症模型肾损伤指标及细胞凋亡较野生型小鼠下降。
3.髓系细胞calpain特异性敲除小鼠内毒素血症模型肾损伤指标及细胞凋亡与野生型小鼠无明显差异。
4.内毒素刺激后calpain活性增加,给予calpain抑制剂钙蛋白酶抑制剂iii处理可显著降低内皮细胞凋亡。
5.内皮细胞中过表达calpain内源性抑制剂calpastatin,可降低内毒素刺激导致的内皮细胞凋亡。
6.内毒素刺激后,内皮细胞中丝裂原活化蛋白激酶家族分子磷酸化水平显著增加,抑制p38磷酸化可抑制内皮细胞凋亡。敲除calpain通过抑制p38磷酸化发挥抗凋亡作用。
7.内皮特异性calpain敲除小鼠内毒素血症模型中,血浆及肾组织中no和ros的产生均较野生型下降。
8.内皮特异性calpain敲除小鼠内毒素血症模型中,肾组织中诱导型一氧化氮合酶和内皮型一氧化氮合酶mrna及蛋白均较野生型小鼠下降(附图8)。
9.内毒素刺激可显著上调内皮细胞中诱导型一氧化氮合酶的表达,而对内皮型一氧化氮合酶无明显影响。
10.应用钙蛋白酶抑制剂iii抑制calpain活性或抑制p38磷酸化,均可降低内毒素刺激后的诱导型一氧化氮合酶表达。
11.应用钙蛋白酶抑制剂iii抑制calpain活性或抑制p38磷酸化,可降低内皮细胞中no的产生。
综上,通过本技术方案发现,应用钙蛋白酶抑制剂iii抑制calpain活性后,可抑制p38磷酸化,进而降低inos表达及no和ros的产生,抑制内皮细胞凋亡,从而在lps导致的肾损伤中发挥保护作用,图10为内毒素血症小鼠肾功能损害的信号转导途径示意图:lps通过calpain激活p38mapk,增加内皮细胞inos的表达和no/ros的产生,进而通过caspase3途径诱导内皮细胞凋亡,导致内毒素血症小鼠肾功能不全。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!