一种增强抗肿瘤免疫反应的组合物及应用的制作方法
本发明涉及生物医药领域,尤其涉及一种增强抗肿瘤免疫反应的组合物及应用。
背景技术:
肿瘤是目前影响人类健康的典型疾病之一,直到现在,医学界无不为消灭癌症倾力研发,从外科手术、化疗、放疗,到标靶药物发明,在众多方法中,免疫治疗的成功率与治疗效果,明显优于其他治癌方法,越来越得到认可。
肿瘤免疫疗法是一类通过激活免疫系统来治疗肿瘤的方法,靶向和恢复宿主的肿瘤免疫力可作为一种治愈肿瘤患者强有力的治疗策略。肿瘤免疫疗法可通过使用免疫辅助剂增加肿瘤微环境的免疫原性,最终募集更多的树突状细胞;或通过阻断免疫检查点,减轻免疫抑制,从而增加细胞毒性cd8+t细胞对肿瘤的浸润及增加效应记忆t细胞数量。目前fda批准的免疫抑制剂的靶点分子有pd-1,pd-l1和ctla4,其对t细胞调节非常重要,主要用于治疗实体瘤,转移瘤以及血液瘤。然而,由于肿瘤细胞表面缺乏可供识别的抗原分子、细胞毒性t淋巴细胞浸润不足、严重的t细胞衰竭及肿瘤微环境对免疫耐受等等,导致现有的检查点抑制剂对癌症病人尤其是实体瘤患者的疗效非常有限。
巨噬细胞作为癌症免疫疗法的效应细胞,由于其强大的吞噬能力,可能具有更巨大的治疗前景。
cd47是一种重要的自我识别分子,在人的大多数细胞表达,在多种不同的肿瘤细胞大量表达。cd47可以与巨噬细胞表面的“别吃我”信号—sirpα相互作用,因此肿瘤细胞借此抑制巨噬细胞吞噬功能的发挥,逃逸机体的固有免疫以及随后的获得性免疫功能。现有的cd47/sirpα抑制剂,比如cd47抗体(acd47),已经被证明对实体瘤和淋巴瘤等具有显著的疗效。然而,大多数情况下,单方面阻断cd47/sirpα的相互作用并不能有效诱导足够的吞噬活性和抗肿瘤免疫反应。目前几项临床试验涉及评估acd47与其他抗癌药物联合的功效,例如,acd47与利妥昔单抗联合治疗淋巴瘤(ntc02953509),与阿扎胞苷联合治疗急性髓细胞性白血病或高危骨髓增生异常综合征(ntc03248479),或与西妥昔单抗联合治疗晚期大肠癌(ntc02953782)。
虽然目前能够证明有部分抑制剂对肿瘤治疗有一定的效果,但是由于通过肿瘤抗原的治疗手段所取得的有效应答率非常低,在治疗过程中,无法较好地激活肿瘤免疫功能,导致了肿瘤的生物治疗收到了一定的限制。
技术实现要素:
本发明的目的在于提供一种增强抗肿瘤免疫反应的组合物及应用,旨在解决现有技术中免疫抑制剂的有效应答率较低而无法较好地激活肿瘤细胞免疫功能的问题。
为实现上述发明目的,本发明采用的技术方案如下:
一种增强抗肿瘤免疫反应的组合物,所述组合物包括黑磷光热材料和免疫抑制剂。
以及,一种试剂盒,所述试剂盒包括所述的增强抗肿瘤免疫反应的组合物。
本发明所提供一种增强抗肿瘤免疫反应的组合物,所述组合物包括黑磷光热材料和免疫抑制剂。添加黑磷光热材料,所述黑磷光热材料一方面具有良好的光热转换效率,将所述黑磷光热材料导入生物体内,黑磷光热材料的光热效转换效率较高,保证黑磷光热材料具有较高的温度,可直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统,同时协同免疫抑制剂的使用,阻断肿瘤细胞免疫位点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫抑制剂的抗肿瘤免疫反应;另一方面,所述黑磷光热材料具有优异的生物相容性,在生物体内使用,对生物体的创伤小且并发症少,同时能够自行在生物体内能够分解成无毒的小分子,无明显毒副作用,与免疫抑制剂协同作用,使肿瘤细胞更容易受到攻击,增强免疫抑制剂抗肿瘤的作用。
本发明所提供的一种试剂盒,所述试剂盒包括所述的增强抗肿瘤免疫反应的组合物,由于所述增强抗肿瘤免疫反应的组合物能够先对肿瘤细胞进行杀伤,释放肿瘤特异性抗原,激活固有免疫和适应性免疫系统,进而协同合作,阻断肿瘤细胞免疫点的信号通路,激活巨噬细胞的吞噬功能,增强抗肿瘤免疫反应,因此,所述试剂盒具有增强抗肿瘤免疫反应的优异效果。
附图说明
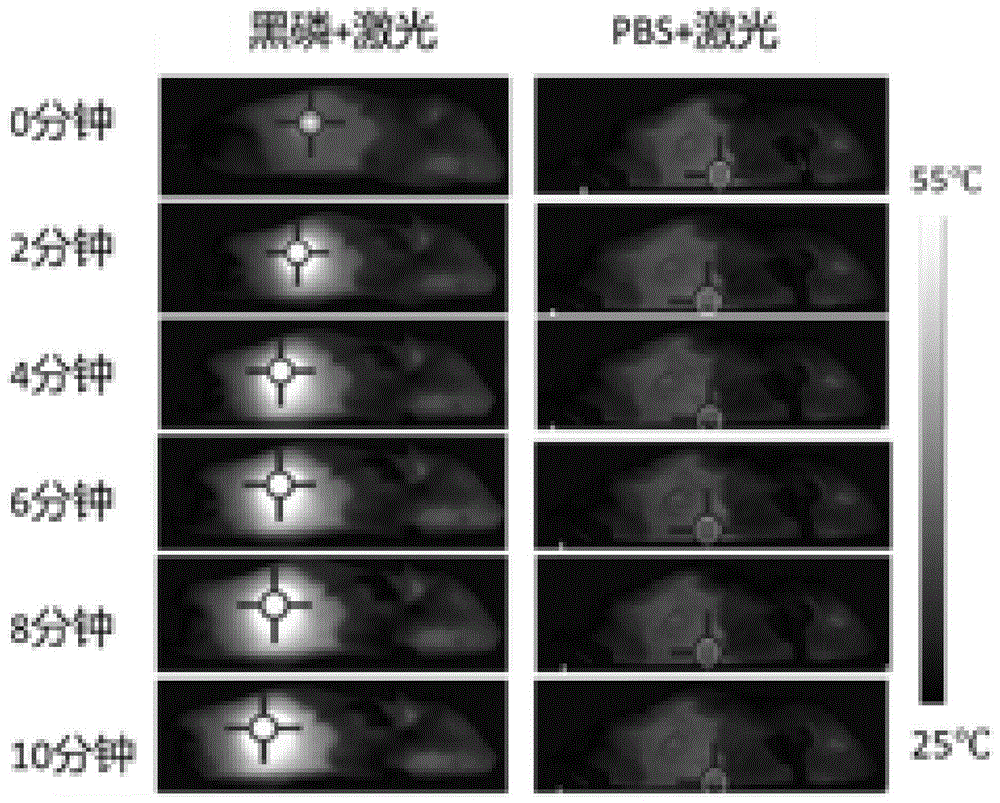
图1是本发明实施例提供的第一组空白对照组和第二组黑磷光热治疗组激光照射的红外热成像图。
图2是本发明实施例提供的第一组空白对照组和第二组黑磷光热治疗组激光照射的温度变化图。
图3是本发明实施例提供的五组处理组的肿瘤体积增长曲线。
图4是本发明实施例提供的五组处理组不同处理组实验终点时收集的肿瘤照片。
图5是本发明实施例提供的五组处理组的第19天的荷瘤小鼠的代表性照片。
图6是本发明实施例提供的五组处理组的小鼠体重变化曲线图。
具体实施方式
为使本发明实施例的目的、技术方案和技术效果更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。结合本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
本发明实例提供一种增强抗肿瘤免疫反应的组合物,所述组合物包括黑磷光热材料和免疫抑制剂。
本发明所提供一种增强抗肿瘤免疫反应的组合物,所述组合物包括黑磷光热材料和免疫抑制剂。添加黑磷光热材料,所述黑磷光热材料一方面具有良好的光热转换效率,将所述黑磷光热材料导入生物体内,黑磷光热材料的光热效转换效率较高,保证黑磷光热材料具有较高的温度,可直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统,同时协同免疫抑制剂的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫抑制剂的抗肿瘤免疫反应;另一方面,所述黑磷光热材料具有优异的生物相容性,在生物体内使用,对生物体的创伤小且并发症少,同时能够自行在生物体内能够分解成无毒的小分子,无明显毒副作用,与免疫抑制剂协同作用,使肿瘤细胞更容易受到攻击,增强免疫抑制剂抗肿瘤的作用。
具体的,所述组合物包括黑磷光热材料,黑磷是一种由金属光泽的晶体材料,其晶格是由双原子层组成的。黑磷光热材料具有良好的光热转换效率,在近红外激光照射的条件下,能够将光能转换为热能,进而提高自身温度,保证黑磷光热材料具有较高的温度,可直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统;另一方面,所述黑磷光热材料具有优异的生物相容性,在生物体内使用,对生物体的创伤小且并发症少,同时能够自行在生物体内能够分解成无毒的小分子,无明显毒副作用,适用性较广,安全性能高。
优选的,以肿瘤体积为100mm3为标准,所述黑磷光热材料的添加量为10~30μg。若黑磷光热材料的添加量过少,则会导致肿瘤细胞无法被完全杀伤,进而无法完全释放肿瘤细胞的特异性抗原,导致生物体固有的免疫和适应性免疫系统不能够完全被激活,影响了免疫抑制剂的作用;若黑磷光热材料的添加量过多,则会导致生物体内的黑磷光热材料过量,影响除了肿瘤细胞以外其他正常组织的正常生理功能,进而影响生物体的健康。
进一步优选的,所述黑磷光热材料为片状材料。在本发明优选实施例中,所述黑磷光热材料为直接购买后进行使用。
具体的,所述组合物包括免疫抑制剂。优选的,所述免疫抑制剂选自cd47抗体acd47。本发明通过协同黑磷光热材料和cd47抗体acd47,利用黑磷光热材料具有优异的光热转换效率,保证表现较高的温度,直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统,同时协同cd47抗体acd47的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫检查抗肿瘤免疫反点抑制剂的应答,增强抗肿瘤的效果。cd47是一种重要的自我识别分子,在人的大多数细胞表达,在多种不同的肿瘤细胞大量表达。cd47可以与巨噬细胞表面的“别吃我”信号—sirpα相互作用,因此肿瘤细胞借此抑制巨噬细胞吞噬功能的发挥,逃逸机体的固有免疫以及随后的获得性免疫功能。现有的cd47/sirpα抑制剂,比如cd47抗体(acd47),已经被证明对实体瘤和淋巴瘤等具有显著的疗效,具有较好的抗肿瘤的效果。
优选的,以肿瘤体积为100mm3为标准,所述cd47抗体acd47的添加量为30~80μg。若抗体acd47的添加量过少,则无法全面地阻断肿瘤细胞免疫检查点的信号通路,进而影响了生物体内巨噬细胞的免疫功能,导致抗肿瘤效果较弱;若抗体acd47的添加量过多,则会造成药物在生物体内残留,影响生物体后续的正常活动。
在本发明优选实施例中,以肿瘤体积为100mm3为标准,所述黑磷光热材料的添加量为20μg,所述cd47抗体acd47的添加量为50μg。当控制所述黑磷光热材料的添加量为20μg,所述cd47抗体acd47的添加量为50μg时,能够保证体积大小为100mm3的肿瘤得到杀伤及处理。
相应的,本发明实施例还提供了一种增强抗肿瘤免疫反应的组合物的使用方法,所述使用方法包括如下步骤:
s01.获取所述的增强抗肿瘤免疫反应的组合物,
s02.将所述黑磷光热材料注射至肿瘤内部后,进行激光照射处理得到第一肿瘤;
s03.将所述第一肿瘤静置处理后,将所述免疫抑制剂注射至所述第一肿瘤内部,进行观察分析。
所述使用方法是先将所述黑磷光热材料注射至肿瘤内部后,进行激光照射处理得到第一肿瘤,通过激光照射处理,提高黑磷光热材料转换效率,保证黑磷光热材料具有较高的温度,可直接杀伤肿瘤细胞;再将所述第一肿瘤静置处理,静置处理以保证肿瘤细胞的特异性抗原能够被释放出来,进而激活生物体固有的免疫和适应性免疫系统,再协同所述免疫抑制剂的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫抑制剂的抗肿瘤免疫反应。
具体的,在上述步骤s01中,获取所述的增强抗肿瘤免疫反应的组合物,所述组合物的选择种类以及添加量如上所述,为了节省篇幅,此处不再进行赘述。
具体的,在上述步骤s02中,将所述黑磷光热材料注射至肿瘤内部后,进行激光照射处理得到第一肿瘤。优选的,以肿瘤体积为100mm3为标准,所述黑磷光热材料的添加量为10~30μg。在本发明优选实施例中,以肿瘤体积为100mm3为标准,所述黑磷光热材料的添加量为20μg。
优选的,进行激光照射处理的目的是为了使黑磷将光能转换为热能,提高材料的温度,进而杀伤肿瘤细胞。优选的,进行激光照射处理的步骤中,所述激光照射的条件为激光波长为808~810nm,功率为1~2w/cm,激光照射时间为5~20分钟。在本发明优选实施例中,进行激光照射处理的步骤中,所述激光照射的条件为激光波长为808nm,功率为1w/cm,激光照射时间为10分钟;保证生物体中得到的第一肿瘤的温度为50℃左右,若温度过高,会对生物体的其他组织造成伤害,若温度过低,则无法达到杀伤肿瘤细胞的目的。
具体的,在上述步骤s03中,将所述第一肿瘤静置处理,目的在于,通过高温对肿瘤细胞达到杀伤处理,再经过静置处理,保证肿瘤细胞的特异性抗原能够被释放出来,进而激活生物体固有的免疫和适应性免疫系统。优选的,将所述第一肿瘤静置处理的步骤中,所述静置处理的时间为2~12小时,静置处理一段时间,确保肿瘤细胞的特异性抗原能够完全释放,若静置处理时间过短,则会导致肿瘤细胞的特异性抗原能够释放不完全,进而导致抗肿瘤效果较差;若静置处理时间过长,则肿瘤细胞的特异性抗原暴露时间过久,影响了抗肿瘤效果。在本发明优选实施例中,将所述第一肿瘤静置处理的步骤中,所述静置处理的时间为2小时。
具体的,再将所述免疫抑制剂注射至所述第一肿瘤内部,保证肿瘤细胞的特异性抗原能够被释放出来,进而激活生物体固有的免疫和适应性免疫系统,再协同所述免疫抑制剂的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫抑制剂的抗肿瘤免疫反应。
优选的,所述免疫抑制剂选自cd47抗体acd47。本发明通过协同黑磷光热材料和cd47抗体acd47,利用黑磷光热材料具有优异的光热转换效率,保证表现较高的温度,直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统,同时协同cd47抗体acd47的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫检查抗肿瘤免疫反点抑制剂的应答,增强抗肿瘤的效果。cd47是一种重要的自我识别分子,在人的大多数细胞表达,在多种不同的肿瘤细胞大量表达。cd47可以与巨噬细胞表面的“别吃我”信号—sirpα相互作用,因此肿瘤细胞借此抑制巨噬细胞吞噬功能的发挥,逃逸机体的固有免疫以及随后的获得性免疫功能。现有的cd47/sirpα抑制剂,比如cd47抗体(acd47),已经被证明对实体瘤和淋巴瘤等具有显著的疗效,具有较好的抗肿瘤的效果。
优选的,以肿瘤体积为100mm3为标准,所述cd47抗体acd47的添加量为30~80μg。若抗体acd47的添加量过少,则无法全面地阻断肿瘤细胞免疫检查点的信号通路,进而影响了生物体内巨噬细胞的免疫功能,导致抗肿瘤效果较弱;若抗体acd47的添加量过多,则会造成药物在生物体内残留,影响生物体后续的正常活动。
在本发明优选实施例中,以肿瘤体积为100mm3为标准,所述黑磷光热材料的添加量为20μg,所述cd47抗体acd47的添加量为50μg。当控制所述黑磷光热材料的添加量为20μg,所述cd47抗体acd47的添加量为50μg时,能够保证体积大小为100mm3的肿瘤得到杀伤及处理。
具体的,对处理后的肿瘤进行观察分析。进一步观察肿瘤的大小,分析所述组合物具有增强抗肿瘤免疫反应的效果。
相应的,本发明还提供一种试剂盒,所述试剂盒包括所述的增强抗肿瘤免疫反应的组合物。本发明所提供的一种试剂盒,所述试剂盒包括所述的增强抗肿瘤免疫反应的组合物,由于所述增强抗肿瘤免疫反应的组合物能够先对肿瘤细胞进行杀伤,释放肿瘤特异性抗原,激活固有免疫和适应性免疫系统,进而协同合作,阻断肿瘤细胞免疫检查点的信号通路,激活巨噬细胞的吞噬功能,增强抗肿瘤免疫反应,因此,所述试剂盒具有增强抗肿瘤免疫反应的优异效果。
以及,一种试剂盒的使用方法,所述试剂盒的使用方法采用所述的增强抗肿瘤免疫反应的组合物的使用方法进行使用。本发明所提供的一种试剂盒的使用方法,所述试剂盒的使用方法采用所述的增强抗肿瘤免疫反应的组合物的使用方法进行使用,由于所述增强抗肿瘤免疫反应的组合物的使用方法抗肿瘤效果优异,因此采用所述试剂盒进行使用能够较好地增强抗肿瘤免疫反应,具有优异的抗肿瘤效果。
下面以具体实施例进一步进行说明。
实施例1
(1)试验材料准备:
试验材料包括b细胞淋巴瘤、acd47抗体和雌性balb/c小鼠;其中,b细胞淋巴瘤(a20,购于atcc),在含有10%fbs及1%双抗的rpmi1640培养基、含5%co2的37℃细胞培养箱中培养;acd47抗体购于biolegend(cat.no.127519,clonemiap301);雌性balb/c小鼠(5-6周龄)购于北京维通利华实验动物技术有限公司。
(2)体内抗肿瘤作用实验
①提供皮下肿瘤模型:小鼠皮下接种5×106个a20细胞,当肿瘤体积长到约100mm3,将小鼠随机分成5个组,每组6只。
②提供五组试验,具体如下:
第一组:空白对照组:瘤内注射pbs溶液;随后用808nm激光、1wcm-2功率照射10分钟
第二组:黑磷光热治疗组:瘤内注射20μg黑磷,随后用808nm激光、1wcm-2功率照射10分钟;
第三组:acd47治疗组:瘤内注射50μgacd47;
第四组:黑磷光热与acd47联合组1:瘤内注射20μg黑磷,随后用808nm激光、1wcm-2功率照射10分钟,2小时后瘤内注射50μgacd47;
第五组:黑磷光热与acd47联合组2:瘤内注射20μg黑磷,随后用808nm激光、1wcm-2功率照射10分钟,12小时后瘤内注射50μgacd47。
对上述五组试验,分别进行:使用红外热成像仪(flirsystem)监测肿瘤表面温度;定期监测肿瘤体积大小及生物体体重;治疗27天后,收集肿瘤组织,记录重量并拍照。
结果分析:
(1)分析第一组空白对照组和第二组黑磷光热治疗组
由图1可得,第二组黑磷光热治疗组中,当a20荷瘤小鼠注射黑磷之后,采用808nm激光、1wcm-2功率照射10分钟之后,可发现随着照射时间的增加,所述a20荷瘤小鼠体内肿瘤位置的温度逐渐升高;而第一组空白对照组中,当a20荷瘤小鼠注射pbs之后,采用808nm激光、1wcm-2功率照射10分钟之后,可发现随着照射时间的增加,所述a20荷瘤小鼠体内肿瘤位置的温度并没有上升,说明黑磷材料具有较优异的光热转换效率。
由图2可得,当经过激光照射处理后,第二组黑磷光热治疗组的小鼠的温度随着照射时间的增加,温度逐渐升高,待光照时间为10分钟时,小鼠的温度达到51℃;而第一组空白对照组中,随着照射时间的增加,温度并没有改变,仍然保持为原始体温30℃。
(2)分析五组试验中各小鼠体内的肿瘤体积大小及生物体体重
由图3可分析不同处理时间条件下,各组的小鼠体内的肿瘤体积的大小如下:当治疗20天时,第一组空白对照组的小鼠体内的肿瘤体积最大,达到800mm3;第二组黑磷光热治疗组的小鼠体内的肿瘤体积,达到400mm3;第三组acd47治疗组的小鼠体内的肿瘤体积,大约为380mm3左右;第四组黑磷光热与acd47联合组1的小鼠体内的肿瘤体积,几乎接近于0;第五组黑磷光热与acd47联合组2的小鼠体内的肿瘤体积,大约为20mm3左右。由图4可知,不同处理组实验终点时收集的肿瘤照片,可以发现,第四组黑磷光热与acd47联合组1的小鼠体内和第五组黑磷光热与acd47联合组2的小鼠体内已经收集不到肿瘤。由图5可知,不同处理组第19天的荷瘤小鼠的代表性照片,第四组黑磷光热与acd47联合组1的小鼠体内和第五组黑磷光热与acd47联合组2的小鼠体内能够显著抑制肿瘤的生长,其中6只小鼠中有5只在宏观上已观察不到肿瘤。
进一步分析各小鼠的生物体体重,由图6可知,五组试验中,当治疗天数达到20天时,各小鼠的生物体体重比原来小鼠的体重略有上升,各组小鼠的体重保持大致相同。
综上,以1wcm-2的功率给予808nm激光照射肿瘤区域10分钟,黑磷组肿瘤温度可高达51℃,当由于微血管血栓形成、局部缺血和缺氧,该温度足以使肿瘤细胞坏死。与第一组空白对照组相比,第二组黑磷处理组和第三组acd47组的肿瘤生长速度略有延迟,而第四组和第五组黑磷+acd47联合处理组显著抑制肿瘤的生长,其中6只小鼠中有5只在宏观上已观察不到肿瘤。相比较第四组和第五组,当黑磷光热处理后,静置2h相对静置12h给予acd47对于肿瘤的生长抑制效果更好一点,但统计数据无显著差别。各处理组的体重变化无显著差别。
本发明所提供一种增强抗肿瘤免疫反应的组合物,所述组合物包括黑磷光热材料和免疫抑制剂。添加黑磷光热材料,所述黑磷光热材料一方面具有良好的光热转换效率,将所述黑磷光热材料导入生物体内,黑磷光热材料的光热效转换效率较高,保证黑磷光热材料具有较高的温度,可直接杀伤肿瘤细胞,进而释放肿瘤细胞的特异性抗原,激活生物体固有的免疫和适应性免疫系统,同时协同免疫抑制剂的使用,阻断肿瘤细胞免疫检查点的信号通路,激活生物体内巨噬细胞的吞噬功能,增强免疫抑制剂的抗肿瘤免疫反应;另一方面,所述黑磷光热材料具有优异的生物相容性,在生物体内使用,对生物体的创伤小且并发症少,同时能够自行在生物体内能够分解成无毒的小分子,无明显毒副作用,与免疫抑制剂协同作用,使肿瘤细胞更容易受到攻击,增强免疫抑制剂抗肿瘤的作用。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!