MDM4抑制剂作为治疗鼻咽癌的药物的应用的制作方法
本发明涉及生物医药领域,具体涉及mdm4抑制剂作为治疗鼻咽癌的药物的应用。
背景技术:
鼻咽癌(nasopharyngealcarcinoma,npc)是指发生于鼻咽腔顶部和侧壁的恶性肿瘤。是我国高发恶性肿瘤之一,发病率为耳鼻咽喉恶性肿瘤之首。放疗(即辐射治疗,在本方案中具体是指电离辐射)是鼻咽癌(未发生局部转移)的首选和主要的治疗方法,单纯放疗对早期鼻咽癌有良好的控制效果。然而诸如鼻咽癌之类的实体瘤在初期的辐射治疗后,会对辐射产生一定的耐受性。这是由于在前期辐射作用下,dna出现大量单链断裂或双链断裂的损伤,激活了细胞的dna修复通路,增强了癌细胞的自我修复功能,从辐射引起的细胞凋亡、坏死或者自噬等过程中逃逸,辐射治疗效果变差。后期即便使用较大剂量的辐射治疗,仍然不能阻止实体瘤的发展,反倒会对正常组织造成较大的损伤,对患者带来较大的负担,影响治疗后患者生活质量和存活率。因此,需要寻找一种能够针对鼻咽癌肿瘤组织靶向性增强癌细胞辐射敏感性的方法或药物,以增加辐射治疗的效果,减轻患者负担,延长患者生存时间。
技术实现要素:
本发明意在提供mdm4抑制剂作为治疗鼻咽癌的药物的应用,通过对辐射敏感的关键因子mdm4的抑制,来解决鼻咽癌细胞对辐射治疗的敏感性低的问题。
为达到上述目的,本发明采用如下技术方案:
mdm4抑制剂作为治疗鼻咽癌的药物的应用。
本方案的原理及优点是:mdm4全称为murinedoubleminute4(鼠双微体4),又叫做mdmx或hdmx。mdm4蛋白的表达量的增加会增加鼻咽癌细胞的放疗抗性,使用mdm4抑制剂,抑制mdm4蛋白的表达或者翻译,可极大地减少mdm4蛋白介导的鼻咽癌细胞的辐射敏感性的产生。鼻咽癌呈浸润生长,与周围组织分界不清,手术很难完全切除,严重影响患者生活治疗。鼻咽癌大多对放疗敏感,因此放疗是治疗鼻咽癌的主要疗法。但如果鼻咽癌早期发生向远处转移或者产生放疗抵抗(在原有放疗剂量及频率下,肿瘤细胞继续生长,不被抑制),放疗就会失效,从而导致患者疾病快速进展甚至死亡。发明人发现mdm4的激活是引起鼻咽癌放疗抵抗的关键机制,以抑制剂抑制mdm4可恢复鼻咽癌对放疗的敏感性。mdm4抑制剂不但可以应用于产生放疗抵抗的鼻咽癌中,还可以应用于辐射敏感的鼻咽癌中,进一步增强辐射敏感性,降低放疗剂量。
现有文献报道mdm4具有抑制dna修复(针对dna链断裂类型的dna损伤)的功能,而细胞dna修复功能的增强与该细胞辐射抵抗的增强呈正相关(电离辐射会导致dna损伤,进而引起癌细胞的凋亡、自噬或者坏死;dna修复功能越强,越多的dna损伤被修复,癌细胞将逃避上述凋亡、自噬或者坏死过程,即癌细胞会大量存活),所以mdm4的表达上调会增加细胞的辐射敏感性(辐射抗性降低)。但是发明人经过长期研究发现事实并非如此,在鼻咽癌中,mdm4蛋白的表达量的增加会屏蔽p53功能,抑制p53相关凋亡途径的激活,增加鼻咽癌细胞的放疗抗性(辐射抗性),导致放疗失败。
发明人通过高通量筛选的手段研究了鼻咽癌基因和蛋白表达的特点,发现在具有放疗抗性的鼻咽癌细胞中,上百种蛋白的表达出现了明显上调的情况。发明人进而对这些上调的蛋白进行了研究,发现大量的表达上调的蛋白均与鼻咽癌的辐射敏感性(放疗抗性)无直接关系。发明人经过大量检测发现mdm4蛋白与鼻咽癌细胞的辐射敏感性有较强相关性。具体详见实施例1,mdm4蛋白对鼻咽癌细胞的辐射敏感性有较大的影响:mdm4蛋白表达量增加,鼻咽癌细胞的辐射抗性增强;mdm4蛋白表达量减少,鼻咽癌细胞的辐射抗性变弱,因此,mdm4蛋白是鼻咽癌发生放疗抵抗的关键因子,可以作为药物作用的靶点来抑制鼻咽癌放疗抵抗的产生,从而增强鼻咽癌对电离辐射的敏感性,增强放疗的治疗效果。
进一步,所述mdm4抑制剂为抑制mdm4蛋白的表达的物质,或者所述mdm4抑制剂为抑制mdm4蛋白的活化的物质。
在本方案中,mdm4抑制剂是指抑制mdm4基因的转录的物质,抑制mdm4的mrna的翻译的物质,抑制mdm4蛋白的激活(或者活化)的物质(前两项又可以合称为抑制mdm4蛋白的表达的物质)。mdm4蛋白的激活(活化)包括蛋白质的磷酸化等多种方式。mdm4抑制剂在鼻咽癌的治疗中,可作为鼻咽癌细胞的辐照敏感程度的促进剂。
采用上述方案,鼻咽癌细胞的辐照敏感程度的促进剂通过直接或间接地抑制mdm4基因的转录,或抑制mdm4的mrna的翻译,或抑制mdm4蛋白的表达,或抑制mdm4蛋白的激活,来增加鼻咽癌细胞对辐照的敏感程度,通过促进辐照敏感程度来实现降低化疗剂量的作用,即小剂量的化疗就可以杀灭癌细胞,用以抵抗鼻咽癌细胞出现的放疗抵抗现象。放疗抵抗(辐射治疗抵抗)在本方案中具体是指:原有放疗剂量及频率下,肿瘤细胞继续生长,不被抑制,从而导致放疗失效,该现象的出现会导致患者疾病快速进展甚至死亡。
进一步,所述mdm4抑制剂为azd1390、chir-124、milciclib或nsc207895中的一种物质或者多种物质形成的混合物。
采用上述方案,azd1390(casno.2089288-03-7)是一种高度选择性的、口服生物利用的、可渗透脑的atm抑制剂;chir-124(casno.405168-58-3)是一种新型有效的chk1抑制剂;pha-848125(milciclib)(casno.802539-81-7)是一种有效的,atp竞争性cdk抑制剂;nsc207895(casno.58131-57-0)可直接抑制mdm4活性。发明人研究发现上述几种物质均能抑制mdm蛋白活性,从而增加细胞的辐射敏感性,增加放疗效果。
进一步,azd1390的体外作用浓度为10nm,体外作用时间为24h。
采用上述方案,azd139010nm浓度处理24h可以恢复cne对辐照的敏感性(实施例4)。
进一步,azd1390的小鼠每日给药剂量为20mg/kg,azd1390的小鼠给药时长为6天。
采用上述方案,以每日20mg/kgazd1390诱导治疗6天,充分抑制鼻咽癌组织中mdm4通路后,再进行辐照,可恢复小鼠肿瘤对辐照的敏感性(实施例5)。
进一步,nsc207895的体外作用浓度为10μm,体外作用时间为24h。
采用上述方案,10μmnsc207895处理cne细胞24h,对抑制mdm4蛋白的表达(实施例2)。
进一步,milciclib的体外作用浓度为5μm,体外作用时间为24h。
采用上述方案,5μmmilciclib处理cne细胞24h,可抑制mdm4蛋白的表达,提示milciclib可作为mdm4抑制剂(实施例3)。
进一步,chir-124的体外作用浓度为5μm,体外作用时间为24h。
采用上述方案,5μmchir-124处理cne细胞24h,可抑制mdm4蛋白的表达,提示chir-124可作为mdm4抑制剂(实施例3)。
进一步,所述mdm4抑制剂为用于降解mdm4蛋白的mrna的shrna组合。
采用上述方案,shrna可降解mdm4的mrna,阻断mdm4蛋白的翻译过程,降低mdm4蛋白的表达量。shrna(shorthairpinrna,短发夹rna)克隆到表达载体中并送入细胞体内后,可形成“双链rna”(dsrna),并被rnai通道处理,介导了目的mrna序列的降解。
进一步,shrna组合包括序列为seqidno:1的第一shrna、序列为seqidno:2的第二shrna、序列为seqidno:3的第三shrna、序列为seqidno:4的第四shrna、序列为seqidno:5的第五shrna和序列为seqidno:6的第六shrna中的三种或者三种以上。
采用上述方案,三种或三种以上的shrna同时转入目的细胞中,可保证对mdm4的mrna的充分降解(详见实施例1和表1)。
附图说明
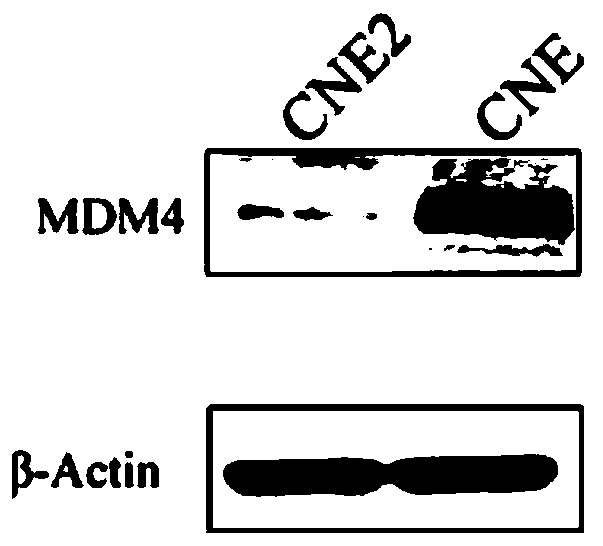
图1展示了本发明实施例1的mdm4蛋白在cne2和cne中的表达情况。
图2展示了本发明实施例1的流式荧光筛选实验结果(gfp荧光蛋白,cne-vector细胞系)。
图3展示了本发明实施例1的流式荧光筛选实验结果(gfp荧光蛋白,cne-shmdm4细胞系)。
图4展示了本发明实施例1的wb检测mdm4蛋白表达量(cne-vector细胞系和cne-shmdm4细胞系)。
图5展示了本发明实施例1的mtt检测结果(cne-vector细胞系和cne-shmdm4细胞系)。
图6展示了本发明实施例1的平板培养结果(cne-vector细胞系和cne-shmdm4细胞系)。
图7展示了本发明实施例1的平板培养sf统计结果(cne-vector细胞系和cne-shmdm4细胞系)。
图8展示了本发明实施例1的流式细胞术实验统计结果(cne-vector细胞系和cne-shmdm4细胞系)。
图9展示了本发明实施例2的wb结果。
图10展示了本发明实施例2的qpcr结果。
图11展示了本发明实施例3的wb结果(使用azd1390)。
图12展示了本发明实施例3的wb结果(使用chir-124)。
图13展示了本发明实施例3的wb结果(使用milciclib)。
图14展示了本发明实施例4的dna彗星实验结果。
图15展示了本发明实施例5的小鼠生存曲线(预实验)。
图16展示了本发明实施例5的小鼠生存曲线(正式实验)。
具体实施方式
在实施例1-5中,本方案使用的细胞系包括cne2和cne:鼻咽癌放疗敏感cne2细胞系(expasy,cvcl_6889),鼻咽癌放疗抵抗cne细胞系(实验室构建)。本方案中wb使用的抗体:check1(货号:2360)、p-check1(货号:2348)、cdk2(货号:18048)均购自于cst公司;mdm4(货号:ab49993)购自abcam公司。本方案中使用的milciclib(货号:s2751)、nsc207895(货号:s2678)、azd1390(货号:s8680)、chir-124(货号:s2683)均购自selleck公司。
cne细胞系的构建方法为:
接种cne2细胞系于含10%小牛血清、3%谷氨酰胺氨的rpmi1640培养液,在37℃、5%c02饱和湿度的培养箱内培养。以下照射的基本条件为:用直线加速器6mv的x线照射,放射源离细胞的距离为100cm,细胞表面覆1cm厚组织补偿胶。取指数生长期cne2细胞,消化成单细胞悬液种植于25cm2培养瓶中,种植细胞密度为1.0×104/cm2,贴壁后照射2gy,继续常规培养2~3代。待照射后细胞稳定生长后重复以上过程给予4、6、8gy各1次以及10gy3次照射,20gy3次,50gy辐照3次,100gy辐照3次,整个照射及培养过程历时24个月。对存活细胞单克隆化得到放疗抵抗细胞系cne。cne细胞常规传代大于5代后用于本实验研究。将构建好的cne细胞系送检(细胞遗传质量鉴定检测),该菌株的dna分型与crc数据库中的cne细胞株匹配,证明诱导获得的细胞株为cne细胞系。
实施例1:鼻咽癌发生放疗抵抗的关键因子研究
发明人通过对鼻咽癌放疗敏感cne2细胞系和放疗抵抗cne细胞系中大量蛋白因子进行筛选和比较,发现了在cne细胞系中mdm4蛋白的表达量明显上调。具体的,发明人使用了westernblot的方法检测了mdm4在鼻咽癌放疗敏感cne2细胞系和鼻咽癌放疗抵抗cne细胞系的表达情况,实验结果如图1所示,cne细胞系中mdm4蛋白表达量显著高于cne2细胞系中mdm4蛋白表达量。
以msnm-ires-gfp为载体,设计mdm4shrna序列(表1)在cne中抑制mdm4,以流式荧光筛选有荧光表达的细胞,筛选出转入msnm-ires-gfp的对照细胞系cne-vector(图2),以及转入msnm-shmdm4-ires-gfp、稳定干扰mdm4表达的细胞系cne-shmdm4(图3)。两种细胞系的mdm4蛋白的表达量的wb检测结果如图4所示,可见cne-shmdm4中mdm4蛋白表达量减少,稳定干扰mdm4表达的细胞系cne-shmdm4构建成功。
以不同剂量对cne-vector,cne-shmdm4细胞进行辐照,以mtt检测辐照后对细胞的抑制率,发现辐照对cne-shmdm4细胞抑制率较cne-vector细胞高(图5)。
以50gy辐照后,将cne-vector,cne-shmdm4各5000个细胞加入培养基中制成单细胞悬液,在培养皿中培养,待细胞形成克隆后停止实验,染色后计算克隆数,以克隆形成率(pe)%=形成克隆数/种植细胞数×100%计算克隆形成率,以sf=实验组克隆形成数/(该组细胞接种数×pe)计算存活分数,发现cne-shmdm4细胞sf小于cne-vector细胞(图6和图7)。以annexinv加pi染色计算凋亡率,发现cne-shmdm4细胞凋亡率大于cne-vector(图8)。说明干扰mdm4表达可使cne转为放疗敏感鼻咽癌细胞。在本实验中,需要使用表1中的三钟以及三种的shrna转入细胞中,才能实现对mdm4的抑制(降解mdm4的mrna)。具体过程为:使用表1中所示的任意三种shrna的序列分别构建质粒(空质粒为msnm-ires-gfp),形成三种含编码shrna的双链dna的质粒;将构建好的质粒转入目的细胞中,即可形成对mdm4的mrna抑制。上述具体过程为现有技术中的分子克隆的常规手段,在此不做赘述。在本实施例中,具体使用的是seqidno:1、seqidno:2和seqidno:3。
表1.mdm4shrna干扰序列(展示的是shrna的dna序列)
通过本实施例的研究,发明人发现了mdm4蛋白对鼻咽癌细胞的辐射敏感性有较大的影响:mdm4蛋白表达量增加,鼻咽癌细胞的辐射抗性增强;mdm4蛋白表达量减少,鼻咽癌细胞的辐射抗性变弱,因此,mdm4蛋白是鼻咽癌发生放疗抵抗的关键因子,可以作为药物作用的靶点来抑制鼻咽癌放疗抵抗的产生,从而增强鼻咽癌对电离辐射的敏感性,增强放疗的治疗效果。
实施例2:mdm4蛋白影响鼻咽癌细胞的辐射敏感性的机制研究
利用免疫荧光共聚焦,发现mdm4与p53在cne细胞质和细胞核内均共定位,且使p53更多分布于胞浆(结果图像未示)。以mdm4特异性抑制剂nsc20789510μm24h抑制mdm4后,p53表达虽然稍下降,但发生磷酸化(wb检测结果见图9,使用dmso作为阴性对照,并在不使用辐照和使用50gy辐照的条件下观测蛋白表达量)。说明nsc207895可以抑制mdm4并引起p53磷酸化水平的变化。
以qpcr检测p53下游因子p21,p53aip1表达(引物序列见表2),实验分为单纯dmso处理组、dmso以及50gy辐照处理组、单纯nsc207895处理组和nsc207895以及50gy辐照处理组。nsc207895的处理时间为24h,浓度为10μm。结果发现抑制mdm4后可激活p53下游关键因子p21,p53aip1表达(图10)。提示mdm4可通过与p53结合影响p53磷酸化及其对下游因子的激活,从而影响鼻咽癌对辐照的敏感性。
表2p53下游因子qpcr引物序列
实施例3:azd1390、chir-124和milciclib抑制mdm4蛋白表达的实验验证
以azd1390、chir-124和milciclib分别处理cne细胞系,使用westernblot的方法研究三种药物对mdm4蛋白表达的影响。具体实验过程如下,将细胞消化后混匀,制成均匀细胞悬液,接种于10cm培养皿中,铺板后待细胞长到80%时进行试验,然后将药物溶解于5μmdmso中,加入培养基,使药物终浓度达到各自浓度:10μmazd1390(分别处理24h和48h)、5μmchir-124(分别处理24h和48h)、5μmmilciclib(分别处理24h和48h)。阴性对照使用的是5μmdmso(分别处理24h和48h)。实验结果显示,在cne中,azd1390(图11)、chir-124(图12)和milciclib(图13)均可抑制mdm4蛋白的表达,提示azd1390,chir-124,milciclib可作为mdm4抑制剂。
实施例4:azd1390细胞生长抑制实验
观察azd1390对cne2,cne细胞生长的影响。本实施例以mtt实验观察给药后24h对细胞生长的抑制率,细胞给药后以1.5×104个/孔接种于96孔板中,以没有加药的空白孔为对照,观察10nmazd1390对cne2,cne细胞生长均只有轻微影响(表3)。实验使用dmso为阴性对照,在10nm的dmso的作用下,cne2和cne的存活率分比为97.25%和97.25%。
表3:不同浓度的azd1390处理鼻咽癌细胞后的存活率(以空白对照为100%的存活率)
利用流式细胞学凋亡检测,观察azd1390对cne2,cne凋亡的影响:我们观察到以azd1390以azd139010nm浓度处理24h,不会诱发cne2(dmso9.41±1.59%,vsazd139010.27±2.89%,p=0.675)及cne凋亡(dmso9.56±2.03%vsazd139012.23±2.05%,p=0.1844)。
为了解azd1390对cne2和cne辐照敏感性的影响,我们以不同浓度azd1390浓度处理24h,再以x射线进行不同剂量辐照。辐照对cne2,cne生长的抑制率见表4。azd139010nm浓度处理24h后,50gy辐照对cne2生长的抑制率为43.46%,100gy辐照后对细胞生长的抑制率为58.04%,200gy辐照后对细胞生长的抑制达77.90%;azd139010nm浓度处理24h后,50gy辐照对cne生长的抑制率为由19.48%提升至43.49%,100gy辐照后对细胞生长的抑制率由21.71%提升至53.46%,200gy辐照后对细胞生长的抑制由27.81%上升至70.54%,与辐照对cne2抑制率相似。可见azd139010nm浓度处理24h可以恢复cne对辐照的敏感性。
表4.azd1390和x射线处理之后的细胞生长抑制率(相对于空白对照组)
利用流式细胞学凋亡检测,在50gy的辐照剂量下,cne2的凋亡率为24.06±2.75%;100gy的辐照剂量下为32.97±3.11%;以azd139010nm浓度处理24h再辐照,50gy辐照下cne的凋亡率由9.60±0.87%增加到24.25±2.04%;100gy的辐照剂量下,cne的凋亡率由10.97±0.29%增加到39.39±3.02%,进一步证明以azd139010nm浓度处理24h可恢复cne对辐照敏感性。
利用彗星电泳实验检测药物和dna损伤的关系,设置10nmdmso对照组、10nmazd1390处理组,10nmdmso+100gy辐照处理组,10nmazd1390+100gy处理组,使用dmso或azd1390处理cne细胞24h后,对10nmdmso+100gy辐照处理组和10nmazd1390+100gy处理组施加100gy的辐照处理。彗星尾距(olivetilemoment)统计结果如图14所示,观察azd1390对cen中dna损伤修复的影响,发现azd1390可明显加重cne细胞内dna损伤,抑制dna修复,最终从而促使cne细胞凋亡(p<0.001)。
实施例5:体内实验
将放疗过程中原位复发的鼻咽癌患者肿瘤组织剪成小块,接种于ncg小鼠(小鼠免疫缺陷模型)右后腿皮下,建立放疗抵抗的鼻咽癌pdx模型。接种肿瘤组织后,小鼠中位生存时间为8天。所有小鼠肿瘤均成浸润生长,向上破坏皮肤,向内侵犯大腿肌肉,保留了患者原位复发鼻咽癌特性。接种后第五天,肿瘤组织长到100mm3体积,将ncg小鼠分均分为4组,每组6只进行实验。
以剂量xray(5gy,10gy,20gy,预实验)分别对小鼠右后腿肿瘤进行辐照,观察不同辐照剂量对小鼠肿瘤的影响。对照组(不加辐射)小鼠中位生存时间是8天,5gy7.5天,10gy9天,20gy7天。20gy辐照的老鼠辐照后后腿肿胀,不能行走,4只小鼠肿瘤液化破溃(66.7%),考虑辐照对小鼠后腿组织损伤破坏,产生无菌性炎症,诱发小鼠衰竭死亡。根据死亡时间及解剖结果,10gy,5gy辐照剂量不会影响小鼠死亡时间(p=0.0722),亦无辐照所致的严重组织损伤,选取10gy进行后续实验(图15)。图15中,黑色线段表示control(无辐照处理),黄色线段表示5gy辐照,绿色线段表示10gy辐照,橙色线段表示20gy辐照。
将放疗过程中原位复发的鼻咽癌患者肿瘤组织剪成小块,接种于ncg小鼠右后腿皮下,建立放疗抵抗的鼻咽癌pdx模型。接种成功后,待肿瘤组织长到100mm3体积后,将ncg小鼠分均分为5组,每组6只进行实验(正式实验)。与单辐照(10gy)相比,单给药组(azd139020mg/kg)中位生存时间延长至12天,长于对照组(8天),单10gy辐照组(9天)及给药的同时辐照组(11天)。死亡时解剖结果示,小鼠死亡时虽有同侧或对侧淋巴结肿胀,但病理切片he染色示淋巴结结构皮髓质分别清晰,未见成巢生长的肿瘤细胞,ck5/6染色阴性,提示小鼠均无淋巴结转移。小鼠肺和肝脏同样形态正常,ck5/6阴性,提示无肺及肝脏转移。
单给药组原位肿瘤浸润生长,范围无缩小;对照组,单10gy辐照组及给药的同时辐照组(11天)原位肿瘤浸润生长,范围扩大(图16)。图16中,黑色线段表示control(无辐照和药物处理),蓝色线段表示azd139020mg/kgpoqd(只使用药物处理),绿色线段表示xray10gy(只是用辐照处理),黄色线段表示azd139020mg/kgpoqd+xray10gy(给药后立即辐照),红色线段表示azd139020mg/kgpoqdaddxray10gy(给药一段时间后再进行辐照)。实验结果提示:小鼠死亡原因为接种肿瘤原发灶浸润破坏;单给药组可延缓肿瘤浸润,但不能杀死肿瘤;给药的同时辐照(第四天给药,第五天开始辐照,图16中的azd139020mg/kgpoqd+xray10gy)并不能增加肿瘤细胞对辐照的敏感性。
将辐照前给药时间延长,接种后第4-9天给药(单给药6天)再以10gy辐照(第10天),辐照后继续给药(图16中的azd139020mg/kgpoqdaddxray10gy),小鼠中位生存时间明显延长(15天),是对照组的近2倍。且解剖死亡小鼠发现,右后腿接种原位肿瘤明显缩小,甚至消失,且无同侧及对侧淋巴结肿胀。由此得出结论:
1.azd1390可以恢复放疗抵抗鼻咽癌pdx模型荷瘤组织对辐照的敏感性;
2.口服azd1390和辐照同时进行不能有效恢复肿瘤敏感性,患者可能无法获益;
3.以azd1390诱导治疗6天,充分抑制鼻咽癌组织中mdm4通路后,再进行辐照,可恢复肿瘤对辐照的敏感性,且不会因为单独喂药造成病情的明显进展,也无明显的药物副作用。
给药6天再以10gy辐照,辐照后继续给药,该方案可能取得最佳疗效,使患者获益(结果与细胞实验吻合)。
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
sequencelisting
<110>四川大学
<120>mdm4抑制剂作为治疗鼻咽癌的药物的应用
<130>2020.05.22
<160>10
<170>patentinversion3.5
<210>1
<211>64
<212>dna
<213>人工序列
<400>1
tgctgataatgtggtaagtgaacggagttttggccactgactgactccgttcataccaca60
ttat64
<210>2
<211>64
<212>dna
<213>人工序列
<400>2
cctgataatgtggtatgaacggagtcagtcagtggccaaaactccgttcacttaccacat60
tatc64
<210>3
<211>64
<212>dna
<213>人工序列
<400>3
tgctgttatatacgcatctttaggtcgttttggccactgactgacgacctaaatgcgtat60
ataa64
<210>4
<211>64
<212>dna
<213>人工序列
<400>4
cctgttatatacgcatttaggtcgtcagtcagtggccaaaacgacctaaagatgcgtata60
taac64
<210>5
<211>64
<212>dna
<213>人工序列
<400>5
tgctgatttatgctctgaggtaggcagttttggccactgactgactgcctaccagagcat60
aaat64
<210>6
<211>64
<212>dna
<213>人工序列
<400>6
cctgatttatgctctggtaggcagtcagtcagtggccaaaactgcctacctcagagcata60
aatc64
<210>7
<211>19
<212>dna
<213>人工序列
<400>7
tgtccgtcagaacccatgc19
<210>8
<211>21
<212>dna
<213>人工序列
<400>8
aaagtcgaagttccatcgctc21
<210>9
<211>19
<212>dna
<213>人工序列
<400>9
ggtgcccaagttcacggag19
<210>10
<211>21
<212>dna
<213>人工序列
<400>10
ctggagagacctagaccaagg21
- 还没有人留言评论。精彩留言会获得点赞!