一种干细胞制剂及其制备方法和应用与流程
[0001]
本发明涉及生物学技术领域,具体涉及一种干细胞制剂及其制备方法和在线粒体靶向移植中的应用。
背景技术:
[0002]
线粒体是细胞内的主要供能单位,在维持细胞正常的生理功能中发挥着重要作用。近年来的一系列研究都表明,许多疾病,如阿尔茨海默症,急性肺损伤、心肌缺血、糖尿病肾病、以及脊髓损伤等的发生或发展都与病理刺激引起的线粒体损伤和随后导致的细胞生理功能紊乱密切相关。当细胞因外界因素刺激受到损伤时,其线粒体功能往往会发生异常,导致胞内正常的呼吸链电子传递效率降低,活性氧(ros)产生增多,线粒体生物生成减少,线粒体dna受损,线粒体自噬受到抑制等。最终,使得胞内ros的产生与消耗的动态平衡被打破,无法继续维持细胞正常的生理功能,并逐渐导致细胞的病变和凋亡。
[0003]
通过向上述线粒体受损的细胞移植健康线粒体,来重新恢复这些细胞的有氧呼吸功能和电子传递链效率,减少受损细胞的ros产生,提高atp供能和钙缓冲能力,保护和修复受损细胞,进而实现疾病治疗或者缓解疾病病程发展的线粒体移植治疗在近年被逐渐证明是一种可行的新型疾病治疗方案。然而,如何将健康的线粒体在体内靶向运输至受损细胞,并且保持这些健康线粒体在体内传递过程中的活性和对受损细胞的高效线粒体转运却成为当前线粒体移植治疗策略面临的一个重要瓶颈问题。
[0004]
目前,国内外主要的线粒体移植治疗方案是:体外从健康细胞内提取和纯化线粒体,再通过一定的技术将这些线粒体注射至疾病部位,从而实现线粒体的移植治疗。但是,这一治疗方案在实际临床应用中却面临着许多问题和诸多限制。首先,线粒体自身的提取和纯化过程对于线粒体的活性会带来一定的不利影响,且游离的线粒体在体外的存活时间很短,往往只有数小时,这就使得需要尽快将新鲜线粒体注射至患者体内以保证疗效,这也极大限制了这一治疗策略在临床上应用的灵活性和可操作性。此外,向疾病部位注射线粒体的方式,其移植效率并不十分高效。并且,这种直接注射线粒体方式并不能有效保证线粒体只被移植至疾病部位的受损细胞,还有可能被一些其他细胞摄取,引起潜在的安全风险。
[0005]
一些最新研究结果显示,在病理条件下线粒体可以在不同细胞间进行自发的转运,从而起到对受损细胞一定的保护和修复作用。并且,这种线粒体转运在正常细胞间通常发生概率很低,只有当细胞受到病理性刺激后才会引起线粒体的转运。这一生理机制为通过细胞间的线粒体转运来实现靶向受损细胞的选择性线粒体移植提供了新的可能。另一方面,已有许多研究显示,一些干细胞,如间充质干细胞或者神经干细胞等具有向受损组织进行归巢的特性,因而可以利用干细胞来作为新型的细胞载体靶向递送系统实现对受损细胞的高效药物传递。目前也有研究显示,干细胞不但具有高效的线粒体生物生成能力,还具有向受损细胞单向转运健康线粒体的能力。上述这些特性为利用干细胞来制备线粒体的供体细胞制剂,实现体内对受损细胞的靶向线粒体移植提供了可能,从而巧妙地解决上述线粒体移植治疗面临的主要瓶颈问题。
[0006]
但是,干细胞在生理条件下的线粒体转运效率却并不十分高效。有研究显示其转运效率通常不足10%。这种较低的线粒体转运效率使得无法使用天然的干细胞来制备干细胞制剂进行线粒体的移植治疗。而另一方面,线粒体受损导致的细胞生理功能紊乱往往是一个快速发展的过程,需要健康线粒体的高效补充才有可能有效补偿不断丧失的线粒体功能,挽救持续凋亡的受损细胞。
[0007]
因此,研发一种具有高效线粒体转运能力的干细胞制剂,来实现体内靶向受损细胞的高效线粒体移植,就有望为解决当前线粒体移植治疗面临的诸多难题提供一种切实可行的解决方案。同时,有望为临床一些难治性疾病的治疗提供一种新的基于线粒体移植的治疗策略和可行的干细胞制剂,具有十分重要的科学研究价值和临床治疗意义。
技术实现要素:
[0008]
本发明的目的在于针对现有的线粒体移植治疗技术面临的线粒体活性保持、对受损细胞的选择性转运和线粒体转运效率低下等瓶颈问题,提供了一种干细胞制剂及其制备方法和应用,通过氧化铁纳米粒刺激培养制备具有选择性向损伤细胞进行高效线粒体转运能力的干细胞制剂。
[0009]
本发明解决上述技术问题所提供的技术方案为:
[0010]
一种干细胞制剂的制备方法,包括如下步骤:将目的干细胞与氧化铁纳米粒共孵育刺激培养一定时间后,通过外磁场分离去除未摄取氧化铁纳米粒的目的干细胞后,制得干细胞制剂,所述的干细胞制剂具有针对损伤细胞进行选择性高效线粒体转运的能力。
[0011]
所述目的干细胞为多能性干细胞或成体干细胞。
[0012]
所述氧化铁纳米粒为四氧化三铁纳米粒或含有四氧化三铁的复合纳米粒。
[0013]
上述技术方案中,对于氧化铁纳米粒的尺寸,形貌和表面聚合物修饰等无特殊要求,但要求氧化铁纳米粒为四氧化三铁纳米粒或者含四氧化三铁的复合纳米粒,以保证氧化铁纳米粒被干细胞摄取和降解后在胞内产生一定量的亚铁离子。同时,所使用的氧化铁纳米粒还需能够在水相体系中稳定分散,并能被干细胞高效摄取,且对干细胞具有良好的相容性,无细胞毒性和不影响干细胞分化和迁移等基本干细胞功能。
[0014]
所述的氧化铁纳米粒的尺寸为1~800nm。
[0015]
所述氧化铁纳米粒优选为表面带正电荷的单分散四氧化三铁纳米粒,所述氧化铁纳米粒的尺寸优选为5~50nm。
[0016]
所述氧化铁纳米粒进一步优选为表面带正电荷的亚铁磁性四氧化三铁纳米立方体,所述氧化铁纳米粒的尺寸进一步优选为10~25nm。
[0017]
所述的尺寸为球形氧化铁纳米粒的直径或者正方形氧化铁纳米粒的边长。
[0018]
所述的共孵育的具体步骤为:
[0019]
(1)将浓度不超过100μg/ml的氧化铁纳米粒与目的干细胞在无血清或者有血清的条件培养基下进行刺激培养1~6h;
[0020]
(2)在刺激培养后,用缓冲液洗去多余的氧化铁纳米粒,更换为新鲜的含血清条件培养基继续培养目的干细胞12h以上;
[0021]
(3)消化步骤(2)中继续培养后的目的干细胞,并重悬于中性磷酸缓冲液(pbs)中,收集得到细胞悬液,细胞悬液置于外磁场下20~40min,除去未摄取氧化铁纳米粒的目的干
细胞后,获得所述的干细胞制剂。
[0022]
所述氧化铁纳米粒与干细胞共孵育刺激培养,指将适宜浓度的氧化铁纳米粒加入目的干细胞,在37℃,5%二氧化碳下进行共孵育培养,一定时间后,换回新鲜的条件培养基继续培养,获得具有高效线粒体转运能力的干细胞制剂。
[0023]
所述氧化铁纳米粒浓度优选为5~80μg/ml,以避免引起细胞毒性。所述氧化铁纳米粒浓度更优选为8~12μg/ml,制得的干细胞制剂具有最优的线粒体转运效率。
[0024]
所述氧化铁纳米粒与目的干细胞之间的比例为0.2~2μg氧化铁纳米粒对应每一万个目的干细胞。
[0025]
所述的刺激培养的时间优选为1~4h,以实现氧化铁纳米粒被目的干细胞的有效摄取。
[0026]
所述继续培养12h以上为继续培养12~48h;优选为24~48h,以使得摄取的氧化铁纳米粒被充分降解为亚铁离子,进而刺激目的干细胞向损伤细胞进行高效的线粒体转运。
[0027]
本发明还提供了所述的干细胞制剂在靶向治疗与线粒体受损相关疾病中的应用。
[0028]
将干细胞与氧化铁纳米粒进行共孵育刺激培养一定时间后,换成新鲜的条件培养基继续培养,制备具备高效线粒体转运能力的干细胞制剂。将该干细胞制剂回输入体内后,可以实现对受损细胞的选择性高效线粒体移植,达到疾病治疗的目的。
[0029]
所述的与线粒体受损相关疾病可为肺纤维化、脑卒中或脊髓损伤等。
[0030]
本发明还提供一种所述的干细胞制剂在线粒体移植治疗中的应用,具体包括如下步骤:将本发明所述的干细胞制剂输入体内,该干细胞制剂可以自主向疾病部位归巢,并选择性地向受损细胞进行线粒体移植,进行相应疾病的治疗。
[0031]
所述干细胞制剂输入体内的途径可以是疾病部位的原位注射、系统注射、介导输入、颈动脉注射以及呼吸道吸入等。
[0032]
同现有技术相比,本发明的有益效果体现在:
[0033]
(1)本发明利用了氧化铁纳米粒的特殊生物效应,通过与干细胞在一定条件下简单的共孵育刺激,即可制备具有线粒体高效转运能力的干细胞制剂。其相比目前基因重组等其他方法,具有制备方法简单、效果稳定、成本低廉,可用于干细胞制剂的规模化生产,适用性广,推广性强。
[0034]
(2)本发明中制备的具有高效线粒体转运能力的干细胞制剂,可以有效保证移植的线粒体活性,并能在体外长期冻存和远距离运输;同时,还能实现靶向受损细胞的选择性线粒体移植,从而克服了当前线粒体移植治疗面临的线粒体的稳定性、体外的活性保持和储存运输以及体内靶向受损细胞的选择性移植等难题,可广泛应用于科学研究及临床治疗。
附图说明
[0035]
图1~图2为实施例1采用超顺磁性四氧化三铁纳米粒制备的干细胞制剂通过普鲁士蓝和核固红双染色后的显微照片及其放大图。
[0036]
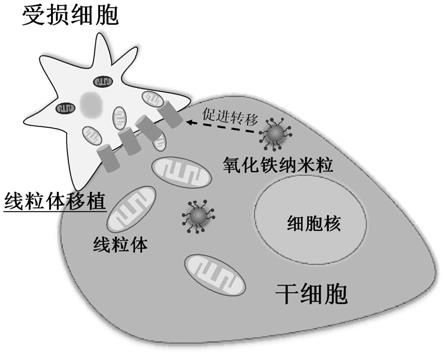
图3为本发明制备得到的干细胞制剂用于选择性向受损细胞进行线粒体高效转运的示意图。
[0037]
图4为测试例1中采用实施例1制备的干细胞制剂向受损的肺泡上皮细胞的线粒体
转运的荧光照片图。
[0038]
图5为测试例2中采用实施1制备的干细胞制剂向受损的肺泡上皮细胞的线粒体转运效率,以及与普通干细胞制剂的线粒体转运效率的比较统计图。
[0039]
图6为测试例2中采用实施2制备的干细胞制剂向健康和受损肺泡上皮细胞的线粒体转运效率的比较统计图。
[0040]
图7为测试例3中实施例4采用不同浓度亚铁磁性四氧化三铁纳米粒制备的干细胞制剂对受损的神经元细胞的线粒体转运的效率统计图。
[0041]
图8为测试例4中实施例5制备的干细胞制剂与受损的肺泡上皮细胞在不同孵育时间后的线粒体转运效率的统计图。
[0042]
图9为应用例1本发明的干细胞制剂体外对受损的肺泡上皮细胞进行线粒体移植治疗后的细胞活力恢复结果。
[0043]
图10为应用例1本发明的干细胞制剂体外对受损的肺泡上皮细胞进行线粒体移植治疗后的胞内线粒体ros水平。
[0044]
图11为应用例1本发明的干细胞制剂体外对博来霉素诱导受损的肺泡上皮细胞进行线粒体移植治疗后的胞内atp恢复水平。
[0045]
图12为应用例2本发明的干细胞制剂静脉注射后在小鼠体内对纤维化受损的肺泡上皮细胞的线粒体移植的荧光照片图。
[0046]
图13为应用例3本发明的干细胞制剂对肺纤维化模型小鼠进行线粒体移植治疗后的生存率统计图。
[0047]
图14为应用例3本发明的干细胞制剂对肺纤维化模型小鼠进行线粒体移植治疗后对小鼠肺部纤维化发展的干预治疗结果图。
具体实施方式
[0048]
下面结合具体的实施例、应用例和说明书附图对本发明作进一步说明。
[0049]
实施例1:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0050]
以人脐带血来源的间充质干细胞(hmscs)为例,采用超顺磁性的氧化铁纳米粒(spion)共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0051]
具体步骤如下:
[0052]
1)将5
×
105个hmscs(浙江大学医学院附属第一医院提供,伦理批件号为2013第272号)接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0053]
2)弃去上述1)中的培养基,磷酸缓冲液(pbs,ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加30μg/ml(1ml)聚乙烯亚胺修饰的超顺磁性四氧化三铁纳米粒(直径为10nm,参照int j pharm,552,2018,443-452制备),5%co2,37℃下进行共孵育刺激培养1h。
[0054]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下继续培养24h。
[0055]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的hmscs,细胞悬液置于外磁场下30分钟,除去未摄取氧化铁纳米粒的hmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0056]
实施例2:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0057]
以hmscs为例,采用spion共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0058]
具体步骤如下:
[0059]
1)将5
×
105个hmscs接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0060]
2)弃去上述1)中的培养基,pbs(ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加10μg/ml(1ml)聚乙烯亚胺修饰的超顺磁性四氧化三铁纳米粒(直径为10nm,参照int j pharm,552,2018,443-452制备),5%co2,37℃下进行共孵育刺激培养1h。
[0061]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下培养继续培养48h。
[0062]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的hmscs,细胞悬液置于外磁场下30分钟,除去未摄取氧化铁纳米粒的hmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0063]
实施例3:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0064]
以hmscs为例,采用spion组成的复合纳米球共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0065]
具体步骤如下:
[0066]
1)将5
×
105个hmscs接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0067]
2)弃去上述1)中的培养基,pbs(ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加30μg/ml(1ml)普鲁兰多糖修饰的超顺磁性氧化铁纳米球(直径为100nm,参照中国专利zl201610173934制备),5%co2,37℃下进行共孵育刺激培养3h。
[0068]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下培养继续培养24h。
[0069]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的hmscs,细胞悬液置于外磁场下30分钟,除去未摄取氧化铁纳米粒的hmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0070]
实施例4:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0071]
以hmscs为例,采用亚铁磁性的四氧化三铁纳米粒(fion)共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0072]
具体步骤如下:
[0073]
1)将5
×
105个hmscs接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0074]
2)弃去上述1)中的培养基,pbs(ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加10μg/ml(1ml)聚乙烯亚胺修饰的亚铁磁性四氧化三铁纳米粒(边长为22nm,参照adv funct mater,2019,1900603制备),5%co2,37℃下进行共孵育刺激培养1h。
[0075]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下培养继续培养24h。
[0076]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的hmscs,细胞悬液置于外磁场下10分钟,除去未摄取氧化铁纳米粒的hmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0077]
实施例5:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0078]
以hmscs为例,采用fion共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0079]
具体步骤如下:
[0080]
1)将5
×
105个hmscs接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0081]
2)弃去上述1)中的培养基,pbs(ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加30μg/ml(1ml)聚乙烯亚胺修饰的亚铁磁性四氧化三铁纳米粒(边长为22nm,参照adv funct mater,2019,1900603制备),5%co2,37℃下进行共孵育刺激培养3h。
[0082]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下培养继续培养48h。
[0083]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的hmscs,细胞悬液置于外磁场下10分钟,除去未摄取氧化铁纳米粒的hmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0084]
实施例6:本发明所述具有高效线粒体转运能力的干细胞制剂的制备
[0085]
以大鼠骨髓来源的间充质干细胞(rmscs)为例,采用spion共孵育刺激培养来制备具有高效线粒体转运能力的干细胞制剂。
[0086]
具体步骤如下:
[0087]
1)将5
×
105个rmscs接种于直径为100mm培养皿中,5%co2,37℃下培养24h。
[0088]
2)弃去上述1)中的培养基,pbs(ph 7.4)漂洗两次后,加入10ml不含血清的新鲜干细胞条件培养基。然后,逐滴滴加30μg/ml(1ml)聚乙烯亚胺修饰的超顺磁性四氧化三铁纳米粒(直径为10nm,参照int j pharm,552,2018,443-452制备),5%co2,37℃下进行共孵育刺激培养1h。
[0089]
3)弃去上述2)中的无血清条件培养基,pbs(ph 7.4)漂洗两次后,加入含血清的新鲜干细胞条件培养基,5%co2,37℃下培养继续培养24h。
[0090]
4)采用0.25wt.%胰酶(含0.02wt.%edta)消化和收集上述3)中氧化铁纳米粒刺激培养后的rmscs,细胞悬液置于外磁场下30分钟,除去未摄取氧化铁纳米粒的rmscs后,获得具有高效线粒体转运能力的干细胞制剂。
[0091]
表征实验
[0092]
(1)氧化铁纳米粒共孵育刺激培养后制备的干细胞制剂的形态表征
[0093]
取实施例1制备的具有高效线粒体转运能力的干细胞制剂,4%多聚甲醛固定后,进行普鲁士蓝和核固红双染色,光学显微镜下观察制备的干细胞制剂的形态。
[0094]
图1~2为采用spion制备的干细胞制剂经普鲁士蓝和核固红双染色后的显微镜图及其放大图。由图可知,本发明的干细胞制剂其细胞内含有许多氧化铁成分,并且这些氧化铁成分只分布在细胞质中。本发明制备得到的干细胞制剂用于线粒体移植的示意图如图3所示。
[0095]
测试例1:本发明所述干细胞制剂向损伤细胞的线粒体转运
[0096]
取实施例1制备的具有高效线粒体转运能力的干细胞制剂,采用线粒体染色试剂mitored cmxros(激发波长579nm,发射波长599nm)标记后,按3
×
104个细胞接种于预先接种有线粒体受损细胞(1
×
105个)的直径为35mm共聚焦皿内。受损细胞预先采用线粒体染色试剂mitogreen fm(激发波长490nm,发射波长516nm)标记。5%co2,37℃下共孵育培养4h。共聚焦激光扫描显微镜观察本发明的干细胞制剂向线粒体受损细胞的线粒体转运。
[0097]
结果如图4所示,共聚焦激光扫描显微镜观察结果显示,本发明的干细胞制剂可以向受损细胞实现高效的线粒体转运。
[0098]
测试例2:本发明所述干细胞制剂针对损伤细胞的选择性线粒体转运
[0099]
以博来霉素(blm)诱导受损的鼠源肺泡上皮细胞(tc-1)为例,利用实施例1或2制备的具有高效线粒体转运能力的干细胞制剂来考察其针对受损细胞的选择性线粒体转运的能力和效率。
[0100]
取实施例1或2制备的具有高效线粒体转运能力的干细胞制剂,采用线粒体染色试剂mitored cmxros(激发波长579nm,发射波长599nm)标记后,按3
×
104个细胞接种于预先接种有线粒体受损细胞(1
×
105个)的6孔板内,同时以普通干细胞和线粒体未受损的健康细胞作为对照。受损细胞预先采用线粒体染色试剂mitogreen fm(激发波长490nm,发射波长516nm)标记。5%co2,37℃下共孵育培养4h。消化和收集共孵育的细胞,流式细胞术分析上述两种线粒体染色试剂双阳性细胞群在总细胞群中的比例,定量检测本发明的干细胞制剂向线粒体受损细胞或健康细胞的线粒体转运效率,结果如图5和6所示。
[0101]
由图5可见,本发明的干细胞制剂相比天然干细胞制剂可以提升2倍以上的线粒体转运效率。
[0102]
由图6可见,本发明的干细胞制剂具有更倾向于向线粒体受损细胞进行线粒体转运的特性。
[0103]
测试例3:不同浓度fion制备的本发明的干细胞制剂向损伤细胞的线粒体转运
[0104]
以糖氧剥夺的受损小鼠原代神经元细胞为例,利用实施例4和5使用不同浓度fion制备的具有高效线粒体转运能力的干细胞制剂来考察其向受损细胞的选择性线粒体转运的能力和效率。
[0105]
取实施例4和5制备的具有高效线粒体转运能力的干细胞制剂,采用线粒体染色试剂mitored cmxros(激发波长579nm,发射波长599nm)标记后,按3
×
104个细胞接种于预先接种有受损神经细胞(1
×
105个)的6孔板内。受损神经细胞预先采用线粒体染色试剂mitogreen fm(激发波长490nm,发射波长516nm)标记。5%co2,37℃下共孵育培养4h。消化和收集共孵育的细胞,流式细胞术分析上述两种线粒体染色试剂双阳性细胞群在总细胞群中的比例,定量检测本发明使用不同浓度fion制备的干细胞制剂向受损神经细胞或健康细胞的线粒体转运效率,结果如图7所示。
[0106]
由图7可见,本发明使用不同浓度fion制备的干细胞制剂相比普通干细胞制剂均具有更高效的线粒体转运效率,最优的,使用10μg/ml的fion可以制备线粒体转运效率最高
的干细胞制剂。
[0107]
测试例4:本发明所述干细胞制剂在不同共孵育刺激培养时长后针对损伤细胞的选择性线粒体转运
[0108]
以blm诱导受损的鼠源tc-1细胞为例,利用实施例4制备的具有高效线粒体转运能力的干细胞制剂与受损肺泡上皮细胞进行不同时长的共孵育刺激培养,考察其针对受损细胞的线粒体转运的能力和效率。
[0109]
取实施例4制备的具有高效线粒体转运能力的干细胞制剂,采用线粒体染色试剂mitored cmxros(激发波长579nm,发射波长599nm)标记后,按3
×
104个细胞接种于预先接种有线粒体受损细胞(1
×
105个)的6孔板内,同时以普通干细胞和线粒体未受损的健康细胞作为对照。受损细胞预先采用线粒体染色试剂mitogreen fm(激发波长490nm,发射波长516nm)标记。5%co2,37℃下分别共孵育培养4~48h后,消化和收集共孵育的细胞,流式细胞术分析上述两种线粒体染色试剂双阳性细胞群在总细胞群中的比例,定量检测本发明的干细胞制剂在不同时间点向受损细胞的线粒体转运效率,结果如图8所示。
[0110]
由图8可见,本发明的干细胞制剂与受损细胞进行不同时长的共孵育刺激培养后都相比普通干细胞制剂具有更高效的线粒体转运效率,最优的,共孵育时长超过24h具有相对最高效的线粒体转运效率。
[0111]
应用例1:本发明所述干细胞制剂体外对损伤细胞的线粒体移植治疗
[0112]
以blm诱导受损的鼠源tc-1细胞为例,利用实施例1制备的具有高效线粒体转运能力的干细胞制剂来进行线粒体的移植治疗。
[0113]
1)将tc-1细胞按1
×
105个细胞每孔的密度接种于六孔板内,待细胞贴壁后,使用10μg/ml的blm处理24h,诱导tc-1细胞的线粒体损伤。
[0114]
2)取实施例1制备的具有高效线粒体转运能力的干细胞制剂,按3
×
104个细胞每孔的密度种至上述tc-1细胞的培养系统中,5%co2,37℃下进行共孵育培养24h。
[0115]
3)用annexin v-pi细胞凋亡检测试剂盒和流式细胞术检测blm处理后的损伤tc-1细胞在线粒体移植治疗后的存活率。
[0116]
4)用线粒体超氧化物荧光探针和atp检测试剂盒分别检测tc-1细胞的线粒体ros和胞内atp水平,考察blm处理后的损伤tc-1细胞使用本发明的干细胞制剂进行线粒体移植治疗后的线粒体功能的恢复,结果如图9~11所示。
[0117]
由图9~11可见,本发明所述具有高效线粒体转运能力的干细胞制剂可以有效提高tc-1细胞损伤后的存活率,并显著改善胞内过高的ros水平,恢复正常的线粒体atp供能。由此说明,本发明的干细胞制剂可以用于线粒体的移植治疗,有效恢复受损细胞的线粒体功能,维持胞内的线粒体的稳态,提高受损细胞的存活率。
[0118]
应用例2:本发明所述干细胞制剂体内靶向损伤细胞的线粒体移植
[0119]
以blm诱导的小鼠肺纤维化模型为例,采用实施例1制备的具有高效线粒体转运能力的干细胞制剂来实现靶向受损肺泡上皮细胞的线粒体移植。
[0120]
1)取18~22g雄性c57bl/6小鼠,按0.8mg/kg剂量采用经典的气管内注射blm的方式构建肺纤维化小鼠模型。
[0121]
2)将稳定表达绿色荧光蛋白(gfp)的hmscs按实施例1制备具有高效线粒体转运能
力的干细胞制剂,采用线粒体荧光探针(mitotracker red cmxros)标记该干细胞制剂的线粒体后,在上述1)造模后第7天按每只小鼠5
×
105个细胞剂量尾静脉注射给药。给药后24h,安乐死处死小鼠,取肺部组织,固定切片后,分别采用anti-cytokeratin7标记肺泡上皮细胞和dapi标记细胞核。共聚焦激光扫描显微镜下观察本发明所述干细胞制剂在肺部的分布和向肺泡上皮细胞的线粒体移植,结果如图12所示。
[0122]
由图12可见,本发明的干细胞制剂在尾静脉注射后可以靶向迁移至肺泡上皮细胞周围,并在部分肺泡上皮细胞中可见代表干细胞线粒体的红色荧光,说明本发明制备的具有高效线粒体转运能力的干细胞制剂可通过系统注射靶向迁移至疾病组织,并选择性地向疾病部位的损伤细胞进行线粒体移植。
[0123]
应用例3:本发明所述干细胞制剂体内对肺纤维化的干预治疗
[0124]
以blm诱导的小鼠肺纤维化模型为例,利用实施例1制备的具有高效线粒体转运能力的干细胞制剂来对肺部损伤上皮细胞进行线粒体移植治疗,从而实现对肺纤维化的干预治疗。
[0125]
1)将实施例1制备的具有高效线粒体转运能力的干细胞制剂,按每只小鼠5
×
105个细胞剂量尾静脉注射入上述应用例2构建的肺纤维化小鼠模型。
[0126]
2)每天观察上述治疗后的肺纤维化模型小鼠的生存情况,绘制生存曲线。在治疗后第28天,安乐死处死模型小鼠,取肺部组织,固定切片后,进行masson三色染色,观察和计算肺部纤维化面积,评估疗效,结果如图13~14所示。
[0127]
由图13所示,本发明制备的干细胞制剂用于线粒体移植治疗后可以明显提高肺纤维化模型小鼠的生存率。
[0128]
由图14所示,本发明制备的干细胞制剂用于线粒体移植治疗后可以明显缓解肺泡上皮细胞的纤维化病变,减少肺部的胶原沉积,具有良好的用于肺纤维化干预治疗的潜力。
[0129]
以上所述实施例对本发明的技术方案和有益效果进行了详细说明,应理解的是以上所述仅为本发明的具体实施例和应用例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改,补充和等同替换等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1