一种仿生纳米乳剂及其制备方法与应用与流程
[0001]
本发明涉及医用纳米材料领域,尤其涉及一种仿生纳米乳剂及其制备方法与应用。
背景技术:
[0002]
肿瘤的光动力治疗通过光照激活光敏药物,从而将组织中的氧气转化为有毒的单线态氧,杀伤肿瘤细胞,达到治疗目的。光动力治疗由三个主要因素构成:光敏剂、光和氧气。其中,氧气作为单线态氧产生的反应底物,其浓度显著影响光动力治疗的效率。然而,实体肿瘤的深部均有不同程度的乏氧,限制了光动力治疗的疗效。多种液态全氟化碳(如全氟己烷,全氟三丁胺,全氟-15-冠-5-醚等)对氧气具有较高的亲和力,通过预先灌充纯氧,并将其封装于纳米载体中,可实现在实体肿瘤的乏氧部位中缓慢释放氧气,提供光动力治疗的原料,从而改善其治疗效果。
[0003]
光动力治疗作为一种局部的肿瘤治疗方式,难以对肿瘤全身转移灶进行有效抑制。光动力治疗后产生的肿瘤细胞裂解物内含有大量肿瘤特异性抗原,从而产生类似原位疫苗的作用,引发下游的肿瘤特异性免疫反应,有望抑制远端肿瘤转移灶,但是,该免疫反应会受到免疫抑制的肿瘤微环境抑制。目前,将免疫检查点抑制剂(如pd-1/pd-l1抗体)与光动刀联用已被证实能增强光动力治疗引起的免疫反应,从而实现对远端肿瘤转移灶的有效抑制。然而,目前的研究中均采用分开注射光敏药物和免疫检查点抑制剂的方式,游离的免疫检查点抑制剂是全身散漫分布,对肿瘤部位的靶向能力有限,具有较高的全身毒副作用。
[0004]
因此,现有技术有待改进和发展。
技术实现要素:
[0005]
鉴于上述现有技术的不足,本发明的目的在于提供一种仿生纳米乳剂及其制备方法与应用,旨在解决现有免疫检查点抑制剂全身散漫分布,对肿瘤部位的靶向能力有限的问题。
[0006]
本发明的技术方案如下:
[0007]
一种仿生纳米乳剂的制备方法,其中,包括步骤:
[0008]
提供白蛋白-全氟化合物纳米乳剂;
[0009]
在所述白蛋白-全氟化合物纳米乳剂表面结合华卟啉钠(dvdms),得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂;
[0010]
将pd-1高表达细胞膜包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上,得到所述仿生纳米乳剂(phd@pm)。
[0011]
所述的仿生纳米乳剂的制备方法,其中,所述白蛋白-全氟化合物纳米乳剂的制备方法,包括步骤:
[0012]
将人血清白蛋白(hsa)和水混合,然后加入全氟化合物,并搅拌,将搅拌后得到的
混合液用探头超声处理,获得所述白蛋白-全氟化合物纳米乳剂。
[0013]
所述的仿生纳米乳剂的制备方法,其中,在所述白蛋白-全氟化合物纳米乳剂表面结合华卟啉钠,得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂的步骤,具体包括:
[0014]
将华卟啉钠加入到所述白蛋白-全氟化合物纳米乳剂中,并搅拌,得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂。
[0015]
所述的仿生纳米乳剂的制备方法,其中,所述pd-1高表达细胞膜通过以下方法提取得到:
[0016]
胰酶消化hek293t细胞,在冰浴的条件下用均质仪均质,离心后取上清液,得到细胞膜碎片,所述细胞膜碎片依次过0.8μm、0.45μm、0.22μm的滤膜,得到所述pd-1高表达细胞膜。
[0017]
所述的仿生纳米乳剂的制备方法,其中,将所述pd-1高表达细胞膜包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上,得到所述仿生纳米乳剂的步骤,具体包括:
[0018]
将所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂与pd-1高表达细胞膜各过0.22μm的滤膜之后将二者混合均匀得到混合物,再用0.2μm滤膜的脂质体挤出仪来回挤压20次,得到所述仿生纳米乳剂。
[0019]
所述的仿生纳米乳剂的制备方法,其中,所述全氟化合物选自全氟三丙胺、全氟三丁胺、全氟己烷、全氟-15-冠-5醚中的一种。
[0020]
一种如上所述的仿生纳米乳剂,其中,所述仿生纳米乳剂包括:表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂、包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上的pd-1高表达细胞膜;
[0021]
一种如上所述的仿生纳米乳剂,由本发明所述制备方法制得。
[0022]
一种如上所述的仿生纳米乳剂,其中,所述仿生纳米乳剂的直径为100~160nm。
[0023]
一种如上所述的仿生纳米乳剂在制备治疗肿瘤制剂中的应用,其中,所述治疗为同时采用光动力治疗和免疫治疗。
[0024]
有益效果:本发明提供一种仿生纳米乳剂,可同时实现肿瘤的荧光成像以及肿瘤的光动力治疗与免疫治疗相结合的协同治疗,在肿瘤的诊断与治疗领域将具有良好的应用前景。同时,本发明的制备工艺简单、操作方便,不需要复杂昂贵的设备,易于实现工业化生产。
附图说明
[0025]
图1为本发明实施例1中仿生纳米乳剂的tem图;
[0026]
图2为本发明实施例2中光动力/免疫协同治疗对4t1肿瘤细胞的杀伤效果图;
[0027]
图3为本发明实施例3中phd@pm在肿瘤部位的被动蓄积效果图;
[0028]
图4为本发明实施例4中光动力/免疫协同治疗对4t1肿瘤生长的抑制效果图;
[0029]
图5为本发明实施例5中光动力/免疫协同治疗引发的肿瘤细胞部位免疫细胞浸润效果图。
具体实施方式
[0030]
本发明提供一种仿生纳米乳剂及其制备方法与应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0031]
本发明实施例提供一种仿生纳米乳剂的制备方法,其中,包括步骤:
[0032]
s10、提供白蛋白-全氟化合物纳米乳剂;
[0033]
s20、在所述白蛋白-全氟化合物纳米乳剂表面结合华卟啉钠,得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂;
[0034]
s30、将pd-1高表达细胞膜包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上,得到所述仿生纳米乳剂。
[0035]
本实施例中,所述白蛋白-全氟化合物纳米乳剂中,白蛋白是已经在临床中使用的药物,具有很好的生物相容性,全氟化合物也具有很好的生物相容性。白蛋白通过乳化作用将全氟化合物装载在纳米乳剂内部,白蛋白在纳米乳剂表面。其中所述全氟化合物,具有良好的生物相容性,对氧气具有较高的亲和力,通过预先灌充纯氧,并将其封装于纳米载体中,可实现在实体肿瘤的乏氧部位中缓慢释放氧气,提供光动力治疗的原料,从而改善其治疗效果。
[0036]
本实施例中,利用白蛋白与华卟啉钠之间强的吸附作用,以白蛋白-全氟化合物纳米乳剂作为载体材料,将华卟啉钠作为光敏剂结合在所述载体材料的白蛋白上。其中所述华卟啉钠是新一代光敏剂,生物相容性好,性质稳定,单线态氧产率高,具备良好的光动力治疗效果。
[0037]
本实施例中,pd-1高表达细胞膜同样具有好的生物相容性,作为免疫检查点抑制剂可与光动刀联用能增强光动力治疗引起的免疫反应,实现对远端肿瘤转移灶的有效抑制。
[0038]
本实施例仿生纳米乳剂可同时实现肿瘤的荧光成像以及肿瘤的光动力治疗与免疫治疗相结合的协同治疗,因此在肿瘤的诊断与治疗领域将具有良好的应用前景。同时,本发明的制备工艺简单、操作方便,不需要复杂昂贵的设备,易于实现工业化生产。
[0039]
步骤s10中,在一种实施方式中,所述白蛋白-全氟化合物纳米乳剂的制备方法,包括步骤:
[0040]
将人血清白蛋白和水混合,然后加入全氟化合物,并搅拌,将搅拌后得到的混合液用探头超声处理,获得所述白蛋白-全氟化合物纳米乳剂。
[0041]
本实施例中,人血清白蛋白是已经在临床中使用的药物,具有很好的生物相容性,全氟化合物也具有很好的生物相容性。人血清白蛋白通过乳化作用将全氟化合物装载在纳米乳剂内部。
[0042]
在一种实施方式中,所述白蛋白-全氟化合物纳米乳剂的制备方法,具体包括步骤:
[0043]
将人血清白蛋白和水混合,混合所得溶液浓度为40mg/ml,其中人血清白蛋白240mg,然后缓慢加入200-400μl全氟化合物并搅拌。将上述混合液用探头超声(250-400w)处理8分钟,获得白蛋白-全氟化合物纳米乳剂。
[0044]
在一种实施方式中,所述全氟化合物可以选自全氟三丙胺、全氟三丁胺、全氟己
烷、全氟-15-冠-5醚等中的一种,但不限于此。
[0045]
在一种实施方式中,所述水为超纯水,超纯水几乎没有杂质,更有利于形成纯净的白蛋白-全氟化合物纳米乳剂。
[0046]
在一种实施方式中,步骤s20具体包括:将20mg/ml华卟啉钠加入到所述白蛋白-全氟化合物纳米乳剂中并搅拌1
–
24h,白蛋白与华卟啉钠的质量比例为1:400-60:400,得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂。
[0047]
步骤s30中,在一种实施方式中,所述pd-1高表达细胞膜通过以下方法提取得到:
[0048]
胰酶消化hek293t细胞,在冰浴的条件下用均质仪均质,离心后取上清液,得到细胞膜碎片,所述细胞膜碎片依次过0.8μm、0.45μm、0.22μm的滤膜,得到所述pd-1高表达细胞膜。
[0049]
在一种实施方式中,所述pd-1高表达细胞膜通过以下具体方法提取得到:
[0050]
用胰酶消化hek293t细胞,1500rpm离心5min,得到细胞后用pbs洗3遍,用hm缓冲液重悬之后,在冰浴的条件下用均质仪均质100下,并在1500rpm离心5min后除去未裂解干净的细胞沉淀,并用7500rpm离心20min除去细胞器沉淀,最后用20000rpm离心60min得到细胞膜碎片,并依次过0.8μm、0.45μm、0.22μm的滤膜得到pd-1高表达细胞膜,冻干后储存在-80℃冰箱。
[0051]
本实施例中,在冰浴的条件下,能够使得均质过程在接近0摄氏度的环境下进行,更有利于保持细胞各部分的活性,均质的目的是为了分离细胞膜,胰酶消化hek293t细胞经过均质后裂解,然后进行离心去除细胞器沉淀,得到pd-1高表达细胞膜。
[0052]
在一种实施方式中,步骤s30具体包括:
[0053]
将所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂与pd-1高表达细胞膜各过0.22μm的滤膜之后将二者混合均匀得到混合物,再用0.2μm滤膜的脂质体挤出仪来回挤压20-100次,得到所述仿生纳米乳剂。其中,所述pd-1高表达细胞膜包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上。
[0054]
本发明实施例提供一种如上所述的仿生纳米乳剂,其中,所述仿生纳米乳剂包括:表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂、包裹在所述表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂上的pd-1高表达细胞膜;
[0055]
一种如上所述的仿生纳米乳剂,由本发明所述制备方法制得。
[0056]
本实施例中,所述仿生纳米乳剂是一种联合荧光成像、光动力治疗与免疫治疗的仿生纳米乳剂。其中,所述华卟啉钠作为光敏剂,可以实现荧光成像,pd-1高表达细胞膜作为免疫检查点抑制剂可与光动力联用能增强光动力治疗引起的免疫反应,实现对远端肿瘤转移灶的有效抑制。
[0057]
在一种实施方式中,所述仿生纳米乳剂的直径为100~160nm,在此粒径范围内,能够使仿生纳米乳剂更好地实现肿瘤的荧光成像以及肿瘤的光动力治疗与免疫治疗相结合的协同治疗。
[0058]
本发明实施例还提供一种如上所述的仿生纳米乳剂在制备治疗肿瘤制剂中的应用。其中,具体所述肿瘤治疗为同时采用光动力治疗和免疫治疗。
[0059]
通过本实施例所述仿生纳米乳剂可同时实现肿瘤的荧光成像以及肿瘤的光动力治疗与免疫治疗相结合的协同治疗,因此在肿瘤的诊断与治疗领域将具有良好的应用前
景。同时,本实施例所述仿生纳米乳剂的制备工艺简单、操作方便,不需要复杂昂贵的设备,易于实现工业化生产。
[0060]
下面通过具体的实施例对本发明作进一步地说明。
[0061]
实施例1
[0062]
本实施例仿生纳米乳剂(pd-1高表达细胞膜包裹的白蛋白-全氟三丁胺-华卟啉钠)的制备步骤如下:
[0063]
将人血清白蛋白和水混合,混合所得溶液浓度为30mg/ml,其中人血清白蛋白240mg,然后缓慢加入300μl全氟化合物并搅拌。将上述混合液用探头超声260w处理7分钟,获得白蛋白-全氟化合物纳米乳剂。
[0064]
将20mg/ml华卟啉钠加入到所述白蛋白-全氟化合物纳米乳剂中并搅拌12h,白蛋白与华卟啉钠的质量比例为30:400,得到表面结合华卟啉钠的白蛋白-全氟化合物纳米乳剂。
[0065]
提取pd-1高表达的细胞膜:将胰酶消化hek293t细胞,1500rpm离心5min得到细胞后用pbs洗3遍,用hm缓冲液重悬之后,在冰浴的条件下用均质仪均质100下,并在1500rpm离心5min后除去未裂解干净的细胞沉淀,并用7500rpm离心20min除去细胞器沉淀,最后用20000rpm离心60min得到细胞膜碎片,并依次过0.8μm、0.45μm、0.22μm的滤膜得到pd-1高表达的细胞膜,冻干后储存在-80℃冰箱。
[0066]
将pd-1高表达细胞膜包裹在表面结合华卟啉钠的白蛋白-全氟三丁胺纳米乳剂的表面:将表面结合华卟啉钠的白蛋白-全氟三丁胺纳米乳剂与pd-1高表达的细胞膜各过0.22μm的滤膜之后将二者混合均匀得到混合物,二者的质量比为1:5,再用0.2μm滤膜的脂质体挤出仪来回挤压20次。
[0067]
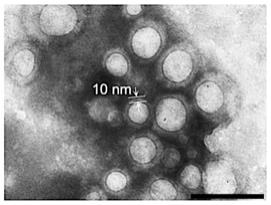
得到的pd-1高表达细胞膜包裹的表面结合华卟啉钠的白蛋白-全氟三丁胺纳米乳剂的tem图如图1所示。从图1可知,pd-1高表达细胞膜包裹在表面结合华卟啉钠的白蛋白-全氟三丁胺纳米乳剂上,其厚度约为10nm。
[0068]
实施例2
[0069]
光动力治疗和免疫治疗协同治疗对4t1肿瘤细胞的毒性评价
[0070]
采用标准的mtt法,评价光动力治疗和免疫治疗协同治疗对4t1细胞存活率的影响。4t1细胞以每孔5
×
103密度接种到96孔板中,并置于37℃、5%co2条件下培育24h。接着,吸出96孔板中的旧培养基,分别加入含有200ng/ml dvdms、pftba@hsa-dvdms(phd)、pftba@hsa-dvdms@pd-1nvs(phd@pm)的dmem培养基。继续培养2h后,吸出96孔板中的旧培养基,在每个孔加入100μl dmem培养基,然后对光照孔的每一个孔都使用635nm的激光器照射细胞5分钟,功率为200mw/cm2。照射完后,吸出96孔板中的旧培养基,在每个孔中加入100μl含5mg/ml mtt的培养基溶液,继续培养12个小时。然后在bio-tel el
×
800型酶标仪上检测每孔的od值(检测波长为490nm),用如下公式计算细胞存活率。细胞存活率(%)=(样品的od490值/空白od490值)
×
100%,实验结果见图2。
[0071]
如图2a所示,各药物组在0-200ng/ml浓度范围内对4t1细胞均无明显毒性;而图2b显示635nm激光照射5分钟后,4t1细胞存活率会显著降低,说明光照使光敏剂产生了活性氧,杀死大量的肿瘤细胞。而由于全氟三丁胺的携氧能力以及pd-1细胞膜与肿瘤细胞pd-l1的亲和力,phd和phd@pm组激光处理后细胞存活率会更显著地降低。
[0072]
实施例3
[0073]
低频超声照射促进仿生纳米乳剂在皮下瘤蓄积的效果评价
[0074]
雌性balb/c小白鼠(3周,15-20g),在小白鼠右后腿皮下注射2
×
1064t1肿瘤细胞,建立小鼠皮下瘤模型。当双侧肿瘤体积超过100mm3时,进行荧光成像实验。在荷瘤小鼠体内尾静脉注射药物后1,4,8,12,24,48,72h,通过华卟啉钠的荧光成像观测其肿瘤蓄积的变化情况,并定量分析。结果见图3。
[0075]
图3a中,给药后随着时间的延长,药物在肿瘤中的蓄积逐渐增强,并且在24-72h肿瘤部位的荧光衰减很慢,说明有一个短暂的停留时间。图3b是注射后24h小鼠离体脏器中的荧光强度值,由图可知,肝脏中的华卟啉钠在注射24h后迅速代谢,而肿瘤部位的华卟啉钠有一个长达2天的滞留。
[0076]
实施例4
[0077]
光动力/免疫治疗协同治疗对4t1肿瘤生长的抑制效果评价
[0078]
雌性balb/c小白鼠(3周,15-20g),在小白鼠后腿皮下注射2
×
1064t1肿瘤细胞,建立小鼠皮下瘤模型。当肿瘤体积达60mm3时,进行治疗实验。单侧瘤模型中,荷瘤小鼠随机分为六组:(1)生理盐水组(空白对照);(2)注射phd组;(3)注射phd@pm组;(4)注射dvdms+激光组;(5)注射phd+激光组;(6)注射phd@pm+激光组。双侧瘤模型中,荷瘤小鼠随机分为五组:(1)生理盐水组(空白对照);(2)注射phd@hm组;(3)注射phd@hm+激光组;(4)注射phd+激光组;(5)注射phd@pm+激光组;每隔一天用游标卡尺测量肿瘤体积,同时监测小鼠的体重,并按照公式v=ab2/2计算肿瘤体积(tumor volume),其中a是肿瘤的长径,b是肿瘤的短径(mm)。每次测量结果均通过处理前的起始肿瘤体积归一化,实验结果见图4。
[0079]
图4的a和b图分别表示单侧瘤和双侧瘤模型中,不同治疗组肿瘤体积(normalized tumor volume)随时间(day)的变化情况。如图4a所示,注射phd@pm+激光组能够显著抑制单侧皮下4t1乳腺癌肿瘤的生长,注射dvdms+激光组和注射phd+激光组的抑瘤效果相当。如图4b所示,注射phd@pm后能显著抑制对侧肿瘤的生长,但肿瘤仍然会复发,而加入激光治疗后,能几乎完全抑制肿瘤的生长和复发。
[0080]
实施例5
[0081]
经过不同治疗组处理后14天,将各组小鼠解剖分离肿瘤组织,剪碎后用胶原酶i、胶原酶iv、dna酶和透明质酸酶消化30min,随后加入红细胞裂解液,离心重悬后用细胞培养基淋洗,最终得到的细胞悬液中加入5%bsa后冰浴封闭10min。分别在肿瘤组织的淋巴细胞中加入荧光标记的抗体(anti-cd3、anti-cd4、anti-cd8),利用流式分析仪检测肿瘤组织的cd
4+
/cd
8+
t淋巴细胞浸润情况,实验结果见图5。
[0082]
如图5所示,生理盐水组的cd
4+
/cd
8+
t淋巴细胞含量均较低,而注射phd@pm+激光组的肿瘤组织内cd
4+
/cd
8+
t淋巴细胞的含量分别提高了2.7倍和9.59倍。其他组也均相对生理盐水组有不同程度的提高,但低于phd@pm+激光组。
[0083]
综上所述,本发明仿生纳米乳剂可同时实现肿瘤的荧光成像以及肿瘤的光动力治疗与免疫治疗相结合的协同治疗,因此在肿瘤的诊断与治疗领域将具有良好的应用前景。同时,本发明的制备工艺简单、操作方便,不需要复杂昂贵的设备,易于实现工业化生产。
[0084]
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保
护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种用于金属表面制备镍纳米线的电镀装置的制造方法
- 一种沥青基硬炭纳米片的制备方法及其应用
- 一种掺氧GeSb纳米相变薄膜及其制备方法和应用
- 一种上引连续ecap拉拔制备纳米高强度铜扁线的方法
- 一种热生长Al<sub>2</sub>O<sub>3</sub>或Cr<sub>2</sub>O<sub>3</sub>膜型M?Cr?Al纳米复合镀层及制备和应用
- 一种生物纳米复合汽油燃料及其制备方法
- 一种用于防治雾霾的耐膨胀纳米建筑材料及其制备方法
- 一种纳米硼化铬增强的瓷砖及其制备方法
- 纳米防尘自洁表层结构及其制备方法
- 一种Zn<sub>3</sub>(OH)<sub>2</sub>V<sub>2</sub>O<sub>7</sub>·2H<sub>2</sub>O纳米片的制备方法