用于调节血管生成和血管发生的方法和组合物与流程
用于调节血管生成和血管发生的方法和组合物
[0001]
本申请是中国发明专利申请cn201380006611.0的分案申请。
[0002]
相关申请的交叉参考
[0003]
本申请要求2012年1月27日提交的美国临时专利申请号61/591,486、2012年4月24日提交的美国临时专利申请号61/637,740和2012年10月4日提交的美国临时专利申请号61/709,619的利益;为了所有目的将所述美国临时专利申请的说明书和附图通过引用整体并入本文。
[0004]
关于联邦政府资助的声明
[0005]
不适用的。
[0006]
领域
[0007]
本公开内容在血管生成和血管发生的领域内;例如用于治疗缺血性事件例如中风。其也在干细胞和通过基因操作从干细胞衍生的细胞的领域内。
[0008]
背景
[0009]
在稳定的中风中,恢复血管流量是恢复脑的营养物供应所必需的。为了修复长期缺血后血管损伤,需要至少两个连续步骤。第一步骤是内皮细胞(ec)的芽生式血管生成;该过程必需内皮细胞的初始增殖和周围细胞外基质的重塑。vegf-介导的ec的增殖和基质金属蛋白酶属于血管生成性萌芽的主要组成部分。第二步骤是血管稳定化,该过程依赖于血管平滑肌细胞的募集以包围新生成的血管。单核细胞和周细胞也参与血管稳定化,其产生适当的动脉生成因子(arteriogenic factor)和细胞外基质蛋白。在利用平滑肌细胞和周细胞的血管稳定化不存在的情况下,可发生新生血管的退化。
[0010]
已显示骨髓基质细胞(msc,也称为间充质干细胞))在脑动脉闭塞和创伤性脑损伤后促进血管再生(revascularization)(参见omori等人(2008)brain res.1236:30-38;onda等人(2008)j.cereb.blood flow metab.28:329-340;pavlichenko等人(2008)brain res.1233:203-213;xiong等人(2009)brain res.1263:183-191)。sb623细胞是通过用包含编码notch细胞内结构域(nicd)的序列的载体转染骨髓基质细胞获得的骨髓基质细胞的衍生物(参见例如,美国专利号7,682,825和dezawa等人(2004)j.clin.investig.13:1701-1710)。sb623细胞引发实验性中风模型中的功能改善(参见,例如,美国专利号8,092,792和yasuhara等人(2009)stem cells and development 18:1501-1514)。虽然sb623细胞的分泌蛋白质组与亲代msc的分泌蛋白质组是相当的;但已观察到相较于sb623细胞,msc分泌不同水平的特定营养因子(参见,例如,tate等人(2010)cell transplantation 19:973-984;美国专利申请公布号2010/0266554。此外,已报导许多其表达水平在msc与sb623细胞之间相异的因子参与血管再生。
[0011]
因为中风是美国成人失能的首要原因,是世界范围内死亡的第二大原因,因此仍然存在治疗的需要以恢复对中风诱发的脑的缺血性损伤的区域的血液供应和促进该区域的再灌注。
[0012]
概述
[0013]
本发明人已发现利用编码notch细胞内结构域的序列转染的间充质干细胞的后代
(即,sb623细胞)具有令人惊讶的能够合成和分泌促进血管生成的因子的性质。因为血管生成即新血管的形成是在脑损伤和疾病中内源性修复过程的至关重要的部分,所以该发现提供了新的用于治疗血管障碍例如中风的方法。
[0014]
因此,本公开内容除其它以外提供了:
[0015]
1.一种用于增强受试者的血管生成的方法,所述方法包括给所述受试者施用sb623细胞的群体;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0016]
2.实施方案1的方法,其中血管生成的增强在中枢神经系统中发生。
[0017]
3.实施方案2的方法,其中血管生成的增强在脑中发生。
[0018]
4.一种用于修复受试者的缺血性损伤的方法,所述方法包括给所述受试者施用sb623细胞的群体;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0019]
5.实施方案4的方法,其中所述缺血性损伤在中枢神经系统中发生。
[0020]
6.实施方案5的方法,其中所述缺血性损伤在脑中发生。
[0021]
7.实施方案6的方法,其中所述缺血性损伤因中风引起。
[0022]
8.一种用于增强内皮细胞的存活的方法,所述方法包括将内皮细胞与sb623细胞的群体接触;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0023]
9.实施方案8的方法,其中所述方法阻止内皮细胞死亡。
[0024]
10.实施方案8或9的任一个的方法,其中所述内皮细胞存在于受试者中。
[0025]
11.实施方案10的方法,其中所述内皮细胞存在于受试者的中枢神经系统中。
[0026]
12.实施方案11的方法,其中所述内皮细胞存在于受试者的脑中。
[0027]
13.一种用于刺激内皮细胞的增殖的方法,所述方法包括将内皮细胞与sb623细胞的群体接触;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0028]
14.实施方案13的方法,其中所述内皮细胞存在于受试者中。
[0029]
15.实施方案14的方法,其中所述内皮细胞存在于受试者的中枢神经系统中。
[0030]
16.实施方案15的方法,其中所述内皮细胞存在于受试者的脑中。
[0031]
17.一种用于增加血管分支的方法,所述方法包括将血管与sb623细胞的群体接触;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多
核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0032]
18.实施方案17的方法,其中所述血管存在于受试者中。
[0033]
19.实施方案18的方法,其中所述血管存在于受试者的中枢神经系统中。
[0034]
20.实施方案19的方法,其中所述血管存在于受试者的脑中。
[0035]
21.一种用于增强受试者的血管生成的方法,所述方法包括给所述受试者施用(1)sb623细胞的群体;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞;和(2)促血管生成剂。
[0036]
22.实施方案21的方法,其中血管生成的增强在中枢神经系统中发生。
[0037]
23.实施方案22的方法,其中血管生成的增强在脑中发生。
[0038]
24.实施方案21的方法,其中所述促血管生成剂是核酸。
[0039]
25.实施方案21的方法,其中所述促血管生成剂是多肽。
[0040]
26.实施方案25的方法,其中所述促血管生成剂是激活促血管生成蛋白的表达的转录因子。
[0041]
27.实施方案26的方法,其中所述促血管生成蛋白是血管内皮生长因子(vegf)。
[0042]
28.实施方案27的方法,其中所述转录因子是激活vegf基因的转录的非天然存在的锌指蛋白。
[0043]
29.一种用于修复受试者的缺血性损伤的方法,所述方法包括给所述受试者施用(1)sb623细胞的群体;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞;和(2)促血管生成剂。
[0044]
30.实施方案29的方法,其中所述缺血性损伤在中枢神经系统中发生。
[0045]
31.实施方案30的方法,其中所述缺血性损伤在脑中发生。
[0046]
32.实施方案31的方法,其中所述缺血性损伤因中风引起。
[0047]
33.实施方案29的方法,其中所述促血管生成剂是核酸。
[0048]
34.实施方案29的方法,其中所述促血管生成剂是多肽。
[0049]
35.实施方案34的方法,其中所述多肽是激活促血管生成蛋白的表达的转录因子。
[0050]
36.实施方案35的方法,其中所述促血管生成蛋白是血管内皮生长因子(vegf)。
[0051]
37.实施方案36的方法,其中所述转录因子是激活vegf基因的转录的非天然存在的锌指蛋白。
[0052]
38.一种用于治疗受试者的中风的方法,所述方法包括给所述受试者施用(1)sb623细胞的群体;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞;和(2)促血管生成剂。
[0053]
39.实施方案38的方法,其中所述促血管生成剂是核酸。
[0054]
40.实施方案38的方法,其中所述促血管生成剂是多肽。
[0055]
41.实施方案40的方法,其中所述多肽是激活促血管生成蛋白的表达的转录因子。
[0056]
42.实施方案41的方法,其中所述促血管生成蛋白是血管内皮生长因子(vegf)。
[0057]
43.实施方案42的方法,其中所述转录因子是激活vegf基因的转录的非天然存在的锌指蛋白。
[0058]
44.实施方案8、9或13的任一项的方法,其还包括将促血管生成剂与sb623细胞一起施用。
[0059]
45.实施方案44的方法,其中所述内皮细胞存在于受试者中。
[0060]
46.实施方案45的方法,其中所述内皮细胞存在于受试者的中枢神经系统中。
[0061]
47.实施方案46的方法,其中所述内皮细胞存在于受试者的脑中。
[0062]
48.实施方案44的方法,其中所述促血管生成剂是核酸。
[0063]
49.实施方案44的方法,其中所述促血管生成剂是多肽。
[0064]
50.实施方案49的方法,其中所述多肽是激活促血管生成蛋白的表达的转录因子。
[0065]
51.实施方案50的方法,其中所述促血管生成蛋白是血管内皮生长因子(vegf)。
[0066]
52.实施方案51的方法,其中所述转录因子是激活vegf基因的转录的非天然存在的锌指蛋白。
[0067]
53.实施方案17的方法,其还包括将促血管生成剂与sb623细胞一起施用。
[0068]
54.实施方案53的方法,其中所述血管存在于受试者中。
[0069]
55.实施方案54的方法,其中所述血管存在于受试者的中枢神经系统中。
[0070]
56.实施方案55的方法,其中所述血管存在于受试者的脑中。
[0071]
57.实施方案53的方法,其中所述促血管生成剂是核酸。
[0072]
58.实施方案53的方法,其中所述促血管生成剂是多肽。
[0073]
59.实施方案58的方法,其中所述多肽是激活促血管生成蛋白的表达的转录因子。
[0074]
60.实施方案59的方法,其中所述促血管生成蛋白是血管内皮生长因子(vegf)。
[0075]
61.实施方案60的方法,其中所述转录因子是激活vegf基因的转录的非天然存在的锌指蛋白。
[0076]
62.一种用于给受试者提供血管生成因子的方法,其中所述方法包括给所述受试者施用sb623细胞的群体接触;其中所述sb623细胞通过如下步骤获得:(a)提供间充质干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0077]
63.实施方案62的方法,其中所述受试者患有缺血性障碍。
[0078]
64.实施方案63的方法,其中所述受试者患有中枢神经系统的疾病或障碍。
[0079]
65.实施方案62的方法,其中所述营养因子选自血管生成素、血管生成素-2、表皮生长因子、碱性成纤维细胞生长因子、肝素结合上皮生长因子样生长因子、肝细胞生长因子、瘦素、血小板衍生生长因子-bb、胎盘生长因子和血管内皮生长因子的一种或多种。
[0080]
66.实施方案65的方法,其中所述营养因子是血管内皮生长因子。
[0081]
67.一种用于给受试者提供血管内皮生长因子的方法,其中所述方法包括给所述受试者施用sb623细胞的群体接触;其中所述sb623细胞通过如下步骤获得:(a)提供间充质
干细胞的培养物,(b)将步骤(a)的细胞培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触,其中所述多核苷酸不编码全长notch蛋白,(c)选择包含步骤(b)的多核苷酸的细胞,和(d)在选择不存在的情况下进一步培养步骤(c)的选择的细胞。
[0082]
68.实施方案67的方法,其中所述受试者患有缺血性障碍。
[0083]
69.实施方案68的方法,其中所述受试者患有中枢神经系统的疾病或障碍。
[0084]
附图概述
[0085]
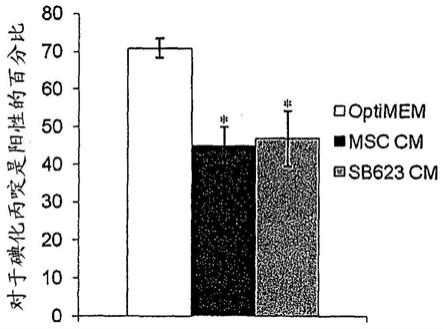
图1显示已针对血清和生长因子进行饥饿的huvec的培养物中碘化丙啶可透过的细胞的分数的测量。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自msc的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果。显示的值为3个单独的msc和sb623细胞的供体的平均值
±
sd;*表示相较于对照组p<0.05。
[0086]
图2显示已进行了血清和生长因子饥饿的huvec的培养物中表达bcl-2的细胞的分数的测量。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自msc的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果。通过测量利用缀合有荧光素的抗-bcl-2抗体染色的细胞的荧光,随后扣除暴露于缀合有荧光素的igg的细胞的荧光来获得结果。显示的值为3个单独的msc和sb623细胞的供体的平均值
±
sd;*表示相较于对照组p<0.05。
[0087]
图3显示已针对血清和生长因子进行饥饿的huvec的培养物中表达ki67的细胞的分数的测量。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自msc的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基存在的情况下培养7天的血清/生长因子饥饿的huvec的结果。通过测量利用缀合有荧光素的抗-ki67抗体染色的细胞的荧光,随后扣除暴露于缀合有荧光素的igg的细胞的荧光来获得结果。显示的值为3个单独的msc和sb623细胞的供体的平均值
±
sd;*表示相较于对照组p<0.05。
[0088]
图4显示在于来自msc或sb623细胞的条件培养基中培养16小时后huvec的相差显微照片。最左边的照片显示在来自msc的条件培养基中培养的细胞;中间的照片显示在于来自sb623细胞的条件培养基中培养的细胞;以及最右边的照片显示在未添加条件培养基的商业培养基中培养的细胞。
[0089]
图5显示条件培养基对于huvec的管形成的作用的测量。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自msc的条件培养基存在的情况下培养16小时的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基存在的情况下培养16小时的血清/生长因子饥饿的huvec的结果。显示的值为3个单独的msc和sb623细胞的供体的平均值+sem。
[0090]
图6a-6c显示在于非条件培养基(a)、msc条件培养基(b)或sb623细胞条件培养基(c)中培养10天后主动脉环的照片。
[0091]
图7a和7b显示主动脉环测定中血管萌芽和分枝的测量。图7a显示新血管的计数和新血管中分支点的计数。对于3对条块的每一对条块,左边的条块显示新血管形成的测量,
右边的条块显示血管分支的测量。最左边对的条块(“对照”)显示从对照主动脉环获得的结果;中间对的条块(“msc cm”)显示从在msc条件培养基中培养10天的主动脉环获得的结果;以及最右边对的条块(“sb623 cm”)显示从在sb623细胞条件培养基中培养10天的主动脉环获得的结果。图7b显示对照主动脉环(左边条块)、在msc条件培养基中培养10天的环(中间条块)和在sb623细胞条件培养基中培养10天的环(右边条块)的分支点对新血管的比率。
[0092]
显示的值为7个供体对的平均值
±
sem;*表示相较于对照组p<0.05。
[0093]
图8显示来自msc(浅色条块)和sb623细胞(深色条块)的条件培养基中4种不同营养因子的水平。蛋白质水平表达为皮克/ml的条件培养基/106个细胞。如图中所指示的,测试来自4个不同人供体的msc(和来源于其的sb623细胞)的条件培养基。显示了血管生成素,血管生成素-2,肝素结合表皮生长因子样生长因子(hb-egf)和胎盘生长因子(pigf)的水平。
[0094]
图9显示来自msc和sb623细胞的条件培养基中10种不同细胞因子的水平。用于产生条件培养基的细胞获自4个不同的供体(d1、d2、d3和d4),如图中所指示的。本图突出显示了相较于测试的其它营养因子的水平非常大量的由msc和sb623细胞产生的vegf。表1(实施例6)的图例中给出了缩写词。
[0095]
图10a和10b显示vegf受体抑制剂对通过sb623细胞条件培养基促进的huvec存活力的改善的作用。图10a显示已针对血清和生长因子进行饥饿的huvec的培养物中碘化丙啶可透过的细胞的分数。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自sb623细胞的条件培养基存在的情况下培养5天的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基和50nm su5416存在的情况下培养5天的血清/生长因子饥饿的huvec的结果。结果为两个供体的平均值;“*”表示相对于对照培养物p<0.05;“#”表示相对于暴露于sb623细胞条件培养基和su5416的培养物p<0.05。
[0096]
图10b显示已针对血清和生长因子进行饥饿的huvec的培养物中表达bcl-2的细胞的分数的测量。最左边的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间的条块显示在来自sb623细胞的条件培养基存在的情况下培养5天的血清/生长因子饥饿的huvec的结果,以及最右边的条块显示在来自sb623细胞的条件培养基和50nm su5416存在的情况下培养5天的血清/生长因子饥饿的huvec的结果。通过测量利用缀合有荧光素的抗-bcl-2抗体染色的细胞的荧光,随后扣除暴露于缀合有荧光素的igg的细胞的荧光来获得为一式两份供体的平均值的结果。
[0097]
图11显示在vegfr2抑制剂su5416存在和不存在的情况下暴露于sb623细胞条件培养基的huvec培养物中表达ki67的细胞以及在cm不存在的情况下培养的对照细胞表达ki67的细胞的分数的测量。最左边(空白)的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间(黑色)的条块显示在来自sb623细胞的条件培养基存在的情况下培养的血清/生长因子饥饿的huvec的结果,以及最右边(灰色)的条块显示在来自sb623细胞的条件培养基和50nm su5416存在的情况下培养的血清/生长因子饥饿的huvec的结果。显示的值为两个单独的sb623细胞的供体的平均值+sem;“*”表示相对于阴性对照培养物(无条件培养基)p<0.05;“#”表示相对于su5416处理的培养物p<0.05。
[0098]
图12显示vegf受体抑制剂对通过msc-和sb623细胞条件培养基促进的huvec的管
形成的增强的作用。顶行显示在抑制剂不存在的情况下培养的细胞。顶行的最左边的图框(“neg”)显示在opti-mem培养基中培养16小时后的对照huvec的相差显微照片。从左边开始的第二图框(“+10ng vegf”)显示在向其添加了10ng/ml vegf的opti-mem培养基中培养16小时后的huvec的相差显微照片。从左边开始的第三图框(“+msc-cm”)显示在于msc条件培养基中培养16小时后huvec的相差显微照片。最右边的图框(“+sb623-cm”)显示在sb623细胞条件培养基中培养16小时后的huvec的相差显微照片。底行中的图框显示在与顶行中的条件相同但添加了50nm su5416的条件下huvec的显微照片。
[0099]
图13显示在vegfr2抑制剂su5416存在和不存在的条件下暴露于sb623细胞条件培养基的huvec的,和在cm不存在的情况下培养的对照细胞的管形成的定量。
[0100]
对于每一个时间点,最左边(空白)的条块显示从对照血清/生长因子饥饿的huvec获得的结果;中间(黑色)的条块显示在来自sb623细胞的条件培养基存在的情况下培养的血清/生长因子饥饿的huvec的结果,以及最右边(灰色)的条块显示在来自sb623细胞的条件培养基和50nm su5416存在的情况下培养的血清/生长因子饥饿的huvec的结果。显示的值为3个单独的sb623细胞的供体的平均值+sem;“*”表示相较于阴性对照培养物(无条件培养基)p<0.05;“#”表示相对于su5416处理的培养物p<0.05。
[0101]
图14显示在主动脉环测定中vegf受体抑制剂对通过sb623细胞条件培养基促进的血管长出和分支的增强的作用。在顶行中,左边的图框显示在optimem培养基(“阴性对照”)中于rgf-基底凝胶上培养10天后主动脉环的显微照片。中间图框显示在sb623细胞条件培养基(“+sb623-cm”)中培养10天后主动脉环的显微照片。右边的图框显示在包含50nm su5416的sb623细胞条件培养基(“+sb623-cm+su5416”)中培养10天后主动脉环的显微照片。每一张显微照片的某些区域的放大示于下行中。
[0102]
详述
[0103]
本文中公开了用于调节血管生成的新方法和组合物。具体地,由sb623细胞(源于已用包含编码notch细胞内结构域的序列的载体转染的msc的细胞)分泌的因子在去除血清和生物因子的条件下在体外促进内皮细胞的存活和增殖,并且刺激人脐静脉内皮细胞形成血管。此外,来自sb623细胞的条件培养基在啮齿类动物主动脉环测定中促进内皮萌芽和分枝。
[0104]
除非另有所指,否则本公开内容的实践使用细胞生物学、毒理学、分子生物学、生物化学、细胞培养、免疫学、、肿瘤学、重组dna的领域以及相关领域中的标准方法和常规技术,这在本领域技术人员的能力之内。这样的技术描述于文献中,从而可被本领域技术人员获得。参见,例如,alberts,b.等人,“molecular biology of the cell,”第5版,garland science,new york,ny,2008;voet,d.等人“fundamentals of biochemistry:life at the molecular level,”第3版,john wiley&sons,hoboken,nj,2008;sambrook,j.等人,“molecular cloning:a laboratory manual,”第3版,cold spring harbor laboratory press,2001;ausubel,f.等人,“current protocols in molecular biology,”john wiley&sons,new york,1987以及定期更新资料;freshney,r.i.,“culture of animal cells:a manual of basic technique,”第4版,john wiley&sons,somerset,nj,2000;和系列“methods in enzymology,”academic press,san diego,ca。
[0105]
为了本公开内容的目的,“血管生成”是指新脉管系统(例如,血管;例如,静脉、动
脉、小静脉、小动脉、毛细血管)的形成。血管生成可通过新血管从现有血管的萌芽,和/或通过血管的分支发生。血管生成还包括基质重塑和细胞募集(例如平滑肌细胞、单核细胞和/或周细胞的募集)的伴随而来的过程。
[0106]“msc”是指获自骨髓的粘附非造血干细胞。这些细胞被不同地称为间充质干细胞、间充质基质细胞、骨髓粘附基质细胞、髓粘附干细胞和骨髓基质细胞。
[0107]
中风
[0108]“中风”是赋予因脑中血流的病损而引起的病况的名称。这样的脑血管病损可因例如颅内出血或因脑中血流的减少或阻断(即,脑缺血症)而引起。缺血性阻断可因血栓(即,颅部血管或供应脑的血管中原位凝块的形成)形成或因脑栓塞(即,凝块至脑中部位的迁移)而引起。因缺血或出血性中风而引起的损伤通常导致神经系统功能的病损。关于不同类型的中风以及它们的特征的额外信息见于共同拥有的美国专利号8,092,792;为了描述不同类型的中风及其特征的目的,将所述美国专利的公开内容通过引用整体并入本文。
[0109]
间充质干细胞(msc)
[0110]
本公开内容提供了通过将sb623细胞移植至受试者的缺血性损伤的部位来促进血管生成的方法。通过在msc中表达notch蛋白的细胞内结构域来从也称为间充质干细胞(msc)的骨髓粘附基质细胞获得sb623细胞。通过从骨髓选择粘附细胞(即,附着于组织培养塑料的细胞)来获得msc。
[0111]
msc的示例性公开内容提供于美国专利申请公布号2003/0003090;prockop(1997)science 276:71-74和jiang(2002)nature 418:41-49中。用于msc的分离和纯化的方法可见于例如美国专利号5,486,359;pittenger等人(1999)science284:143-147和dezawa等人(2001)eur.j.neurosci.14:1771-1776中。人msc是商购可得的(例如,biowhittaker,walkersville,md)或可通过例如骨髓抽吸,随后选择粘附骨髓细胞来获得。参见,例如,wo2005/100552。
[0112]
msc还可从脐带血分离而来。参见,例如,campagnoli等人(2001)blood 98:2396-2402;erices等人(2000)br.j.haematol.109:235-242和hou等人(2003)int.j.hematol.78:256-261。
[0113]
notch细胞内结构域
[0114]
notch蛋白是在所有后生动物中发现的跨膜受体,其通过细胞内信号转导影响细胞分化。notch细胞外结构域与notch配体(例如,delta,serrate,jagged)的接触导致notch蛋白的两个蛋白水解切割,所述切割的第二切割由γ-分泌酶催化并将notch细胞内结构域(nicd)释放入细胞质。在小鼠notch蛋白中,该切割在氨基酸gly1743与val1744之间发生。nicd转移至细胞核,在细胞核中其用作转录因子,招募另外的转录调节蛋白(例如,mam、组蛋白乙酰化酶)以解除各种靶基因(例如,hes 1)的转录阻遏。
[0115]
关于notch信号转导的其它细节和信息见于例如artavanis-tsakonas等人(1995)science 268:225-232;mumm和kopan(2000)develop.biol.228:151-165和ehebauer等人(2006)sci.stke 2006(364),cm7.[doi:10.1126/stke.3642006cm7]中。
[0116]
细胞培养和转染
[0117]
用于细胞培养的标准方法在本领域是已知的。参见,例如,r.i.freshney“culture of animal cells:a manual of basic technique,”第5版,wiley,new york,2005。
[0118]
用于将外源dna引入细胞(即,转染)的方法在本领域也是公知的。参见,例如,sambrook等人“molecular cloning:a laboratory manual,”第3版,cold spring harbor laboratory press,2001;ausubel等人,“current protocols in molecular biology,”john wiley&sons,new york,1987及定期更新资料。
[0119]
sb623细胞
[0120]
在用于制备sb623细胞的一个实施方案中,将msc的培养物与包含编码notch细胞内结构域(nicd)的序列的多核苷酸接触;例如通过转染;随后通过药物选择和进一步培养富集转染的细胞。参见,例如,美国专利号7,682,825(2010年3月23日);美国专利申请公布号2010/0266554(2010年10月21日);和wo 2009/023251(2009年2月19日);将所有的其公开内容通过引用整体并入本文,以描述间充质干细胞的分离和间充质干细胞至sb623细胞的转化(在这些文献中称为“神经前体细胞”和“神经再生细胞”)。
[0121]
在这些方法中,可使用任何编码notch细胞内结构域的多核苷酸(例如,载体),以及可使用任何用于选择和富集转染的细胞的方法。例如,在某些实施方案中,用包含编码notch细胞内结构域的序列并且还包含编码抗药性标记(例如对g418的抗性)的序列的载体转染msc。在其它实施方案中,将两个载体(一个包含编码notch细胞内结构域的序列,另一个包含编码抗药性标记的序列)用于转染msc。在这些实施方案中,在用载体转染细胞培养物后,通过以足以杀死不含所述载体的细胞但不伤害含所述载体的细胞的量向细胞培养物添加选择剂(例如,g418)来实现选择。选择的不存在使得必需除去所述选择剂或将其浓度降至不杀死不包含所述载体的细胞的水平。选择(例如,进行7天)后,除去选择剂,进一步培养细胞(例如,进行2次传代)。
[0122]
sb623细胞的制备从而包括在msc中瞬时表达外源notch细胞内结构域。为此目的,可用包含编码notch细胞内结构域的序列的载体转染msc,其中所述序列不编码全长notch蛋白。所有这样的序列是公知的并且可被本领域技术人员容易地获得。例如,del amo等人(1993)genomics 15:259-264提供了小鼠notch蛋白的全氨基酸序列;而mumm和kopan(2000)devel.biol.228:151-165提供了来自小鼠notch蛋白的围绕所谓的s3切割位点(该位点释放细胞内结构域)的氨基酸序列。总之,这些参考资料为本领域技术人员提供了每一个包含notch细胞内结构域、不为全长notch蛋白的肽;从而也为本领域技术人员提供了每一个包含编码notch细胞内结构域,但不编码全长notch蛋白的序列的多核苷酸。将上述文献(del amo和mumm)通过引用整体并入本文,以分别公开全长notch蛋白的氨基酸序列和notch细胞内结构域的氨基酸序列。
[0123]
来自另外的物种的notch蛋白和核酸的类似信息是可获得的,所述物种包括大鼠、爪蟾、果蝇和人。参见,例如,weinmaster等人(1991)development 113:199-205;schroeter等人(1998)nature393:382-386;ncbi参照序列no.nm_017167(和其中引用的参考资料);swissprot p46531(和其中引用的参考资料);swissprot q01705(和其中引用的参考资料);和genbank cab40733(和其中引用的参考资料)。将上述参考资料通过引用整体并入本文以公开许多不同物种的全长notch蛋白的氨基酸序列和notch细胞内结构域的氨基酸序列。
[0124]
在其它实施方案中,通过将包含编码notch细胞内结构域的序列的核酸引入msc(以便msc不表达外源notch细胞外结构域)来制备sb623细胞。这可以例如通过用包含编码
notch细胞内结构域的序列的载体转染msc来实现,其中所述序列不编码全长notch蛋白。
[0125]
关于sb623细胞的制备以及用于制备具有与sb623细胞的那些性质相似的性质的细胞(所述细胞可用于本文中公开的方法)的方法的其它细节见于美国专利号7,682,825;和美国专利申请公布号2010/0266554(2010年10月21日)和2011/0229442(2011年9月22日);将所述专利和专利申请公布的公开内容通过引用并入本文,以提供关于sb623细胞的其它细节和用于sb623细胞的制备的可选择方法,以及用于提供用于制备具有与sb623细胞的那些性质相似的性质的细胞的方法。也参见dezawa等人(2004)j.clin.invest.113:1701-1710。
[0126]
用途
[0127]
如本文中所述,本发明人已发现其中已瞬时表达notch细胞内结构域的间充质干细胞的后代(即,sb623细胞)具有血管生成活性;以及所述细胞合成和分泌血管生成因子。因此,sb623细胞的移植对于其中治疗益处可通过增加受试者的血管生成来实现的障碍的治疗是有用的。这样的障碍包括但不限于脑缺血症(例如,中风)、心肌缺血(例如,缺血性心脏病)、肠的缺血(例如,缺血性结肠炎、肠系膜缺血)、肢体的缺血、皮肤缺血、眼缺血综合征(例如,视网膜缺血)和脑瘫。
[0128]
因此,本文中描述的sb623细胞可用于许多与血管生成的刺激相关的方法。这些方法包括但不限于前面段落中提及的障碍的任何障碍的治疗、血管生成的增强、缺血性损伤的修复、阻止内皮细胞死亡、增强内皮细胞的存活、刺激内皮细胞的增殖和/或增加血管的分支。
[0129]
这样的方法可在体外或在受试者中进行。受试者可以是哺乳动物,优选人。sb623细胞对血管生成的刺激以及如本文中所述的这样的刺激的伴随而来的作用,可以例如在中枢神经系统(例如,在脑中)发生。
[0130]
sb623细胞的移植还可用于给受试者提供一种或多种血管生成营养因子的方法。这样的因子包括但不限于血管生成素、血管生成素-2、表皮生长因子、碱性成纤维细胞生长因子、肝素结合上皮生长因子样生长因子、肝细胞生长因子、瘦素、血小板衍生生长因子-bb、胎盘生长因子和血管内皮生长因子。
[0131]
在另外的实施方案中,可将sb623细胞与第二促血管生成剂组合用于联合治疗以增加受试者的血管生成。所述联合治疗可用于上文所示的所有目的。第二促血管生成剂可以是例如小分子药物、核酸或多肽(例如,抗体、转录因子)。示例性核酸是激活血管生成蛋白的表达和/或阻断抗血管生成蛋白表达的三链形成核酸、核酶和sirna。示例性抗体是结合血管生成蛋白(或其它血管生成剂)和/或抑制其活性的那些抗体。示例性转录因子是抑制编码一种或多种抗血管生成蛋白的基因的转录的那些转录因子,以及激活一种或多种促血管生成蛋白的转录的那些转录因子。抗血管生成和促血管生成蛋白在本领域是已知的。示例性抗血管生成蛋白包括色素上皮衍生因子(pedf)和胎盘生长因子(pigf)。示例性促血管生成蛋白包括血管内皮生长因子(vegf)、血管生成素和肝细胞生长因子(hgf)。
[0132]
在某些实施方案中,上文中公开的转录因子是非天然存在的(工程化)转录因子。这样的非天然存在的转录因子的实例是已被工程化以结合细胞染色质中的调节靶基因(例如,vegf基因)的转录的dna序列的非天然存在的锌指蛋白。所述工程化锌指转录因子除工程化锌指dna结合结构域外还包含转录调节结构域(例如,转录激活结构域或转录抑制结构
and gilman’s the pharmacological basis of therapeutics,”mcgraw-hill,2005;university of the sciences in philadelphia(eds.),“remington:the science and practice of pharmacy,”lippincott williams&wilkins,2005;和university of the sciences in philadelphia(eds.),“remington:the principles of pharmacy practice,”lippincott williams&wilkins,2008。
[0141]
可将本文中描述的细胞悬浮于生理上相容的载体以用于移植。如本文中所用,术语“生理上相容的载体”是指与sb623细胞和与制剂的任何其它成分相容的载体,并且对其受体无害。本领域技术人员熟知生理上相容的载体。适当的载体的实例包括细胞培养基(例如,伊格尔最小必需培养基)、磷酸缓冲盐溶液、hank’s平衡盐溶液+/-葡萄糖(hbss)和复方电解质溶液例如plasma-lyte
tm a(baxter)。
[0142]
给患者施用的sb623细胞悬浮液的体积将取决于植入部位、治疗目的和溶液中细胞的数目而变化。通常地,给患者施用的细胞的量将是治疗有效量。如本文中所用,“治疗有效量”或“有效量”是指实现特定障碍的治疗,即产生与该障碍相关的症状的量和/或严重度的减少所需的移植细胞的数目。例如,在中风的情况下,治疗有效量的sb623细胞的移植导致例如在被缺血损伤的区域中新血管生长、血管萌芽和血管分支。治疗有效量随缺血性损伤的类型和程度的变化而变化,并且还可取决于受试者的总体状况而变化。
[0143]
公开的治疗性组合物还可包含药学上可接受的材料、组合物或媒介物,例如液体或固体填料、稀释剂、赋形剂、溶剂或封装材料,即载体。这些载体可以例如稳定sb623细胞和/或促进sb623细胞在体内存活。每一种载体在与制剂的其它成分是可相容并且对受试者无害的意义上应当是“可接受的”。可用作药学上可接受的载体的材料的一些实例包括:糖类,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;粉末黄蓍胶;麦芽;明胶;滑石;赋形剂,例如可可脂和栓剂蜡;油,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇类,例如丙二醇;多元醇,例如甘油、山梨醇、甘露醇和聚乙二醇;酯类,例如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,例如氢氧化镁和氢氧化铝;藻朊酸;无热原水;等渗盐溶液;林格氏溶液;乙醇;磷酸缓冲盐溶液;和其它用于药物制剂的无毒相容性物质。湿润剂、乳化剂和润滑剂例如月桂硫酸钠和硬脂酸镁以及着色剂、脱离剂、包衣剂、增甜剂、调味剂和芳香剂、防腐剂和抗氧化剂也可存在于组合物中。
[0144]
示例性制剂包括但不限于适合用于胃肠外施用例如肺内、静脉内、动脉内、眼内、颅内、脑膜下或皮下施用的制剂,包括封装在微胶粒、脂质体或药物释放胶囊中(掺入生物相容性包衣内被设计用于缓释的活性剂)的制剂;可摄取制剂;用于局部使用的制剂,例如滴眼剂、乳膏剂、软膏和凝胶;以及其它制剂例如吸入剂、气雾剂和喷雾剂。本公开内容的组合物的剂量将根据治疗所需的程度和严重度、施用的组合物的活性、受试者的一般健康状况和本领域技术人员公知的其它考虑而变化。
[0145]
在其它实施方案中,本文中描述的组合物被局部递送至缺血性损伤的部位。局部递送允许组合物非全身性地递送,从而相较于全身性递送减轻组合物的身体负荷。这样的局部递送可以例如通过颅内注射,或通过使用各种医学植入装置包括但不限于支架和导管来实现,或可通过吸入、静脉切开术或手术来实现。用于将期望的试剂涂覆、植入、包埋以及另外地附着于医疗装置例如支架和导管的方法在本领域已被建立并且在本文中得到考虑。
[0146]
本公开内容的另一个方面涉及用于给受试者施用sb623细胞(任选地与另一种治疗剂组合)的试剂盒。在一个实施方案中,试剂盒包括于药物载体中配制的sb623细胞的组合物,所述组合物任选地包含例如促血管生成剂(参见下文),视情况而定配制于一种或多种单独的药物制剂中。
[0147]
联合治疗
[0148]
在某些实施方案中,可将sb623细胞组合物与包含刺激血管生成的物质(“促血管生成剂”)的其它组合物组合使用,例如以治疗中风。可以以任何顺序相继地施用或同时施用组合物。因此,本文中公开的治疗组合物可包含sb623细胞和促血管生成剂。在其它实施方案中,可将分开的治疗性组合物(一种包含sb623细胞,另一种包含促血管生成剂)分开地或一起给受试者施用。
[0149]
在某些实施方案中,促血管生成剂为蛋白质(例如,成纤维细胞生长因子、血小板衍生生长因子、转化生长因子α、肝细胞生长因子、血管内皮生长因子、音猬因子(sonic hedgehog)、magp-2、hif-1、pr-39、rtef-1、c-myc、tfii、egr-1、ets-1)或编码这样的蛋白质的核酸。参见,例如,vincent等人(2007)gene therapy 14:781-789。在其它实施方案中,促血管生成剂可以是靶向编码血管生成的抑制剂的核酸的小rna分子(例如,sirna、shrna、microrna)或核酶。在其它实施方案中,促血管生成剂可以是三链形成核酸,其结合调节抑制血管生成的蛋白质表达的dna序列,以阻断编码所述蛋白质的转录。
[0150]
在其它实施方案中,促血管生成剂是激活促血管生成分子(例如,蛋白质)表达的转录因子。调节促血管生成蛋白的表达的天然存在的转录因子(例如,hif-1α)是已知的。此外,合成的转录调节蛋白可通过基因工程来构建。例如,已描述了用于设计结合目标序列的锌指dna-结合结构域的方法和用于将这样的锌指dna-结合结构域融合于转录激活和抑制结构域的方法。参见,例如,美国专利6,534,261;6,607,882;6,785,613;6,794,136;6,824,978;6,933,113;6,979,539;7,013,219;7,177,766;7,220,719和7,788,044。这些方法可用于合成激活编码促血管生成蛋白的任何基因的转录的非天然存在的蛋白。此外,已描述了血管内皮生长因子(vegf)基因的合成的锌指转录激活因子。参见,例如,美国专利号7,026,462;7,067,317;7,560,440;7,605,140和8,071,564。因此,可将激活vegf基因的转录的非天然存在的(即,合成的)锌指蛋白与sb623细胞组合用于例如在中风治疗中增强血管生成。
[0151]
在其它实施方案中,抑制抗血管生成分子的转录的天然或合成转录调节蛋白(例如,合成的锌指转录调节蛋白)可用作促血管生成剂。
实施例
[0152]
实施例1:条件培养基
[0153]
如所描述的获得和/或制备msc和sb623细胞。参见,例如,美国专利号7,682,825(2010年3月23日)和美国专利申请公布号2010/0266554(2010年10月21日)、2010/0310529(2010年12月9日)、2011/0229442(2011年9月22日)和2011/0306137(2011年12月15日);将所述专利和专利申请公布的公开内容通过引用整体并入本文,以描述sb623细胞(这些文献中其被不同地称为“神经前体细胞”和“神经再生细胞”)的制备。将细胞在生长培养基中培养,所述培养基含有补充有10%胎牛血清(fbs,hyclone,logan,ut)、2mm l-谷氨酰胺和1%青霉素/链霉素(两者来自invitrogen,carlsbad,ca)的α-mem(mediatech,herndon,va)。
msc和sb623细胞通常表达cd29、cd90和cd105;并且不表达cd31、cd34或cd45,如通过流式细胞术测定的。
[0154]
为了用于本文中描述的实验,将来自相同人供体的冷冻的msc和sb623细胞解冻,再涂板于生长培养基中,让其恢复将近1周。为了获得条件培养基,将细胞生长至约90%的汇合(~15,000个细胞/cm2),用磷酸缓冲盐溶液(pbs)漂洗板一次,随后用培养基(invitrogen,carlsbad,ca)替换培养基,维持相同细胞密度。72小时后收集条件培养基。将条件培养基的冷冻样品缓慢地加温至37℃,随后使用。
[0155]
实施例2:sb623细胞分泌的因子对huvec存活的作用
[0156]
脑缺血症可导致受影响区域的营养物供应的丧失。为了确定来自sb623细胞和msc的可溶性因子是否对除去了营养物的内皮细胞具有恢复作用,将人脐静脉内皮细胞(huvec)在耗尽了血清和生长因子的培养基中培养24小时,随后暴露于来自msc或sb623细胞的条件培养基(cm)。对照培养物仍然保留在未添加cm的血清和生长因子耗尽的培养基中。随后评估huvec的存活力和增殖能力。
[0157]
为了进行这些实验,将人脐静脉内皮细胞传代2次,随后将7.5x105个细胞于ebm-2/ecgs培养基(内皮细胞基础培养基-2/内皮细胞生长补充剂;lonza,walkersville,md)中涂板在涂覆有0.1%明胶的t-75培养瓶上,培养24小时。用温pbs漂洗huvec单层2次,用12ml新鲜ebm-2培养基在37℃,5%co2条件下温育过夜。随后通过从每一个培养瓶取出6ml培养基,用6ml新鲜optimem(对照)、6ml msc条件培养基或6ml sb623细胞条件培养基(如实施例1中所述制备条件培养基)替代其来评估cm的作用。7天后,收集非粘附和粘附细胞,以1400rpm离心5min,将其分成3个部分以用于随后染色分析(pi、bcl-2和ki67)。
[0158]
为了定量细胞死亡,用碘化丙啶(pi)对细胞进行染色,因为死亡细胞对pi是可渗透的。在室温用5ug/ml pi对细胞染色30min,随后使用bd facscalibur cellquest程序(bd biosciences,san jose,ca)的fl-2对数型通道进行流式细胞术获取和分析。对于该测定,测试了3个不同的人供体对。结果示于图1中。在对照huvec培养物中(其在去除了营养物的培养基中维持了7天),超过70%的细胞对于碘化丙啶染色是阳性的。sb623-或msc-条件培养基的添加显著降低了碘化丙啶阳性细胞的百分比(p<0.05)。
[0159]
这些结果表明msc条件培养基和sb623细胞条件培养基显著减少因血清和生长因子饥饿而引起的内皮细胞死亡(即,减少碘化丙啶阳性huvec的数目)。
[0160]
bcl-2是最初被鉴定为在某些b细胞淋巴瘤中过表达的抗细胞凋亡蛋白。因此,表达bcl-2蛋白的细胞的分数在血清/生长因子饥饿的huvec中被测量为它们的细胞凋亡潜能的指标。为了进行bcl-2测量,将细胞于4%多聚甲醛中固定,用0.1%triton-x100透化1小时。透化后,将细胞在冰上用缀合有荧光素的抗-bcl-2抗体染色1小时,随后洗涤样品,获取样品,在bd facscalibur的fl-1通道上进行分析。暴露于缀合有荧光素的igg的细胞用作阴性对照。对于这些测定,测试3个不同的人供体对。
[0161]
图2中显示的结果表明msc条件培养基或sb623细胞条件培养基的存在显著增加了bcl-2阳性细胞在血清饥饿的内皮细胞的培养物中的分数。
[0162]
来自msc或来自sb623细胞的条件培养基减少死亡(pi-阳性)细胞的数目和增加表达抗-细胞凋亡bcl-2蛋白的细胞的数目的事实显示msc和sb623细胞都分泌增强内皮细胞存活的因子。
[0163]
实施例3:sb623细胞分泌的因子对huvec增殖的作用
[0164]
ki67是存在于从细胞周期的g0(静止)期脱离的细胞中的蛋白质;因此ki67水平可用作细胞增殖的量度。测量已针对血清和生长因子进行了饥饿,随后利用来自msc或sb623细胞的条件培养基进行培养的huvec中表达ki67蛋白的细胞的分数。
[0165]
为了进行ki67测量,培养huvec,如实施例2中所述将其暴露于cm。将细胞在4%多聚甲醛中固定,利用0.1%triton-x100透化1小时。透化后,将细胞在冰上用缀合有荧光素的抗-ki67抗体染色1小时,随后洗涤样品,获取样品,在bd facscalibur的fl-1通道上进行分析。暴露于缀合有荧光素的igg的细胞用作阴性对照。对于这些测定,测试3个不同的人供体对。
[0166]
图3显示在来自msc或sb623细胞的条件培养基存在的情况下培养饥饿的huvec导致相较于未暴露于条件培养基的对照huvec增加的表达ki67的细胞的分数。来自msc或sb623细胞的条件培养基增加表达增殖相关ki67蛋白的细胞的数目的事实显示msc和sb623细胞都分泌增强内皮细胞增殖的因子。
[0167]
本实施例和先前实施例中提供的结果显示了当用msc-或sb623细胞条件培养基培养这些内皮细胞7天时,相较于在非条件培养基中的培养,huvce的存活和增殖显著增加(p<0.05)。
[0168]
实施例4:sb623细胞分泌的因子对内皮细胞的管形成的作用
[0169]
huvec管形成测定用于测试msc和sb623细胞加工刺激血管形成的因子的能力。参见,例如,ej smith&ca staton,“tubule formation assays,”in angiogenesis assays-a critical appraisal of current techniques,(staton,lewis&bicknell,eds.).john wiley&sons,ltd.,west sussex,uk,pp.65-87,2006;和goodwin(2007)microvasc.res.74:172-183。
[0170]
将huvec在ebm-2/ecgs培养基中传代5次,随后以1x 105个细胞/ml的密度转移至α-mem/0.5%fbs/2mm谷氨酰胺/pen-strep。24小时后,使用0.25%胰蛋白酶-edta收获huvec,漂洗,以1x105个细胞/ml的密度重悬浮于α-mem/2mm谷氨酰胺/pen-strep中。将75ul huvec+75ul msc-或sb623-条件培养基(实施例1)或75ul optimem培养基(作为阴性对照)的混合物添加至96孔板的每一个孔中,所述板已通过添加每孔50ul的降低生长因子(rgf)-基底凝胶(invitrogen,carslsbad,ca)并在37℃将板温育45分钟来进行了预处理。为了进行该测定,从3个不同的人供体获得msc,将一部分来自每一个供体的msc转化成sb623细胞。
[0171]
16小时后,通过相差显微镜检查培养物并拍照。由对组不知情的实验者定量完全管(由连续细胞形成的)的数目。显示来自3个供体之一的结果的照片示于图4中。使用来自所有3个供体的msc和sb623细胞的测定的结果(概述于图5中)显示来自msc或sb623细胞的条件培养基显著增强管的形成。因此,msc和sb623细胞分泌促进血管生成的因子。
[0172]
实施例5:sb623细胞分泌的因子对血管长出和分支的作用
[0173]
缺血性损伤后脉管系统的恢复需要存活的内皮细胞接受促进它们迁移和侵入的信号。这样的信号可产生自血管平滑肌细胞、单核细胞和/或巨噬细胞等。为了测试参与血管萌芽和分支的因子的分泌,使用主动脉环测定。参见,例如,nicosia&ottinetti(1990)lab.invest.63:115-122和nicosia(2009)j.cell.mol.med.13:4113-4136。
[0174]
为了制备主动脉环,将成年sprague-dawley大鼠无痛致死,随后解剖。在夹断其两
个末端后,取出主动脉,将其置于冰冷的α-mem/pen-strep培养基中,随后除去外部脂肪层。用冰冷的ebm-2/pen-strep培养基漂洗无脂肪主动脉2次,随后将其横切成1.0mm厚的环。随后将主动脉环转移至包含ebm-2/pen-strep培养基的板,并在37℃,5%co2温育6天,在第3天用新鲜ebm-2/pen-strep培养基替换培养基,以耗尽任何内源性大鼠血管生成因子。在那时,用α-mem/pen-strep培养基替代培养基,继续培养24小时。
[0175]
在主动脉环测定的第0天(培养开始后7天),在24孔板的每一个孔加入50μl降低生长因子(rgf)基底凝胶。将单个主动脉环置于每一个凝胶涂覆的孔的中央,覆盖另外的25μl rgf-基底凝胶。在于37℃/5%co2进行30分钟的凝胶固化后,将500μlα-mem/2mm谷氨酰胺/pen-strep添加至每一个孔,继续温育另外30分钟。随后,添加500ul msc-或sb623-来源的条件培养基(实施例1)。作为阴性对照,使用500μl optimem培养基替代条件培养基。
[0176]
为了评估msc-和sb623-来源的因子的血管生成活性,在第10天拍摄相差照片,由对组不知情的实验者通过计数血管长出和分支来定量结果。通过测量从环长出的血管的数目定量新血管的生长;通过测量存在于从主动脉环长出的血管中的分支点的数目来定量血管分支。对于该测定,测试7个不同的人供体对。
[0177]
来自第10天样品的代表性结果示于图6中,来自7组10天培养基物的结果概述和定量于图7中。图7a显示来自msc和sb623细胞的条件培养基刺激新萌芽的血管的数目以及分支程度的增加(相较于对照主动脉环)。此外,相较于在msc-条件培养基(图6b,图7a)中培养的环或在非条件培养基(图6a,图7a)中培养的环,在sb623细胞条件培养基(图6c,图7a)中培养的环中观察到血管分支的显著增加。这些结果表明msc和sb623细胞分泌增强血管萌芽和血管分支的因子。特别地,sb623细胞分泌极大地增强血管分支的因子(参见图7b)。
[0178]
上述实施例中提供的数据表明sb623细胞分泌的可溶性因子促进血管生成的几个方面,其促成了受损大脑中的恢复。
[0179]
实施例6:统计数据
[0180]
对于每一个实验(其包括3-4个孔/组),获得如下条件的平均值:(1)每一个细胞类型的处理条件(msc-或sb623细胞来源的条件培养基;每测试的人供体一个值)和(2)未处理组(每一轮测试一个值)。对于统计比较(sigmastat,systatsoftware,chicago,il),使用这些值的每一个值,使用单因素anova进行下列组的比较:(1)对照(非条件培养基;n=3),(2)msc条件培养基(n=3-5);和(3)sb623细胞条件培养基(n=3-5)。使用tukey’s检验进行其它配对比较。0.05的α值用于确定平均值是否差异显著。
[0181]
实施例7:由msc和sb623细胞分泌的血管生成因子的鉴定
[0182]
测量来自msc和sb623细胞的条件培养基中的某些细胞因子和营养因子的水平。为了获得条件培养基,将msc或sb623细胞在生长培养基中培养至~90%的汇合(~15,000个细胞/cm2),在那时除去培养基,将细胞于pbs中进行漂洗,添加培养基(invitrogen,carlsbad,ca)以获得~150,000个细胞/ml的浓度。72小时后收集条件培养基,按照制造商的说明书,使用人血管生成阵列1(raybiotech,norcross,ga)进行分析。对于msc的每一个来源,将一部分细胞直接作为msc培养,和将一部分转化成sb623细胞。因此,来自特定供体的msc的培养物和从那些msc制备的sb623细胞的培养物被称为匹配的“供体对”。在本实验中,测定4个供体对。将表达为蛋白质浓度的结果针对当收
集条件培养基时存在于培养物中的细胞的数目进行标准化。图8显示供体的血管生成素、ang-2、hb-egf和pigf的结果。图9显示这4个因子和也是供体的6个其它因子的结果,并且突出显示了由msc和sb623细胞产生的大量的vegf。
[0183]
表1显示在4个供体对中平均的10个测试因子的蛋白质水平。虽然分泌的营养因子的水平在不同供体间是可变的(如例如图8和9中显示的),但其中4个因子(血管生成素、血管生成素-2、hb-egf和pigf)的水平在msc与sb623细胞之间始终不同。血管生成素、ang-2和hb-egf由sb623细胞更高地表达,然而更高浓度的pigf由msc表达。
[0184]
表1:来自msc和sb623细胞的条件培养基中的血管生成营养因子的水平
[0185][0186]
缩写如下。ang-2:血管生成素-2;egf:表皮生长因子;bfgf:碱性成纤维细胞生长因子/成纤维细胞生长因子2;hb-egf:肝素结合表皮生长因子样生长因子;hgf:肝细胞生长因子;pdgf-bb:血小板衍生生长因子-bb;pigf:胎盘生长因子;vegf:血管内皮生长因子。数字是指表达为pg/ml/106个细胞的细胞因子的水平。“avg”是指来自条件培养基所获自的4个msc来源和4个sb623细胞来源的平均值;“sd”是指标准差。
“-”
表示水平(如果有的话)低于测定的检测限;“n/a”表示“不适用的”[0187]
实施例8:vegf信号转导的抑制剂对huvec存活力和增殖的作用
[0188]
鉴于由msc和sb623细胞分泌的大量vegf,使用vegf信号转导的抑制剂测试vegf对msc-和sb623条件培养基的促血管生成活性的贡献。su5416(vegfr2激酶抑制剂iii,emd millipore,billerica,ma)阻断通过vegf受体2(flk-1)的下游信号转导和在更低的程度上阻断通过vegf受体1(flt-1)和其它受体酪氨酸激酶的下游信号转导,从而抑制血管生成。
[0189]
除在测定之前将细胞培养5天而非7天外,如实施例2中所述,在50nm su5416存在和不存在的情况下,对两批sb623细胞条件培养基进行huvec存活力测定(碘化丙啶吸收和bcl-2表达)。在添加cm之前30分钟将抑制剂添加至培养物。由于更高浓度的su5416可抑制受体酪氨酸激酶而非vegfr2,因此选择该su5416浓度以便vegfr2信号转导(但非通过例如pdgf受体、egf受体或flt3的信号转导)被抑制。显示于图10a和10b中的结果表明当在sb623条件培养基和su5416中培养huvec时,相较于当在单独的sb623细胞条件培养基中培养它们时,更多细胞摄入pi(图10a),更少的细胞表达抗细胞凋亡bcl-2蛋白(图10b)。因此,vegf受
体活性的抑制部分地减弱sb623细胞条件培养基对huvec的存活力的正作用,从而指出vegf蛋白在这些作用中的作用。
[0190]
还评估了vegf受体抑制剂对sb623细胞因子刺激的huvec增殖的作用。除在添加条件培养基之前30分钟将50nm su5416添加至培养物和在测定之前将细胞培养5天而非7天外,如实施例3中所述进行ki67表达的测定。图11中显示的、来自两个供体平均的结果表明,在来自sb623细胞的条件培养基存在的情况下观察到的huvec增殖的增强被vegfr2的抑制部分地逆转。
[0191]
这些结果指出了,除其它sb623细胞来源的因子以外,vegf在msc和sb623细胞条件培养基的促存活和促增殖活性中的作用。
[0192]
实施例9:vegf信号转导的抑制剂对人脐静脉内皮细胞(huvec)的管形成的作用
[0193]
在vegf2受体抑制剂su5416存在和不存在的情况下,如实施例4中所述利用来自msc和sb623细胞的条件培养基进行huvec管形成测定。将在条件培养基不存在的情况下培养的细胞用作阴性对照;以及将在vegf(10ng/ml)存在的情况下培养的细胞用作阳性对照。图12中显示的结果表明vegf、msc条件培养基和sb623细胞培养基全都促进管形成;然而vegfr2抑制剂su5416减弱所有这些因子对管形成的刺激。
[0194]
如实施例4中所述,在涂板后16和40小时,在su5416存在和不存在的情况下对暴露于sb623细胞条件培养基的huvec进行管形成的定量。图13中显示的结果表明,在两个时间点上,vegfr2的抑制完全逆转了cm对管形成的正作用。
[0195]
实施例10:vegf信号转导的抑制剂对主动脉环测定中血管长出和分支的作用
[0196]
在50nm su5416存在和不存在的情况下,如实施例5中所述,在一批sb623细胞条件培养基上进行主动脉环血管生成测定。在添加cm之前30分钟,将抑制剂添加至培养物,在10天的培养后测定环。结果显示因sb623细胞条件培养基中主动脉环的培养而导致的血管长出和分支(图14,比较左图框与右图框)在vegf受体抑制剂su5416存在的情况下减少(图14,比较中间与右边图框)。这些结果为vegf在sb623细胞条件培养基的促血管生成活性中的作用提供了其它证据。
[0197]
使用vegf受体抑制剂(上文中描述的)获得的结果,虽然确认了vegf对这些过程(特别地管形成、血管长出和血管分支)的重要性,但不排除其它因子(除vegf外)参与msc-和sb623细胞-条件培养基的促血管生成活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1