鉴定SMARCA2/4降解剂的应答者的方法与流程
鉴定smarca2/4降解剂的应答者的方法
1.相关申请
2.本技术要求2019年9月12日提交的印度临时专利申请第201941036639号的权益;所述专利申请的内容特此通过引用整体并入本文。
技术领域
3.本发明涉及用于治疗可能对smarca2/4降解剂治疗有应答的受试者的疾病或病症的方法。本发明还涉及确定受试者对smarca2/4降解剂治疗的反应性的方法。
4.发明背景
5.前列腺癌(prca)是男性最常见的癌症,是美国男性癌症死亡的第二大原因,并且是全球男性癌症死亡的第五大原因。本发明是基于预测前列腺癌细胞的敏感性以及因此前列腺癌患者对smarca2/4降解剂的治疗反应性的生物标志物的鉴定,smarca2/4是swi/snf染色质重塑复合物的催化亚基。具体来说,本发明是基于以下新发现:smarca2/4降解功能阻断了前列腺癌细胞的生长,存在一种或多种以下情况:a)雄激素受体(ar)的存在,b)肿瘤抑制基因pten的突变,和c)tmprss2-erg基因融合的存在。本发明代表了相比于本领域当前知识的显著进步,因为迄今为止尚未系统地鉴定出此类生物标志物来预测细胞对smarca2/4降解剂的敏感性。
6.雄激素受体(ar)是睾酮和二氢睾酮的类固醇受体转录因子。ar在prca中起关键作用,尤其是去势抵抗性前列腺癌(crpc)。雄激素剥夺疗法可抑制未使用激素的前列腺癌,但前列腺癌会改变ar并适应在雄激素去势水平下生存。这些机制包括ar点突变、ar过表达、雄激素生物合成的变化、无配体结合的组成型活性ar剪接变体以及雄激素辅因子的变化。对crpc中ar的研究揭示,ar在crpc中仍然活跃,并且它仍然是治疗crpc的潜在靶标。恩杂鲁胺(enzalutamide)是一种第二代抗雄激素药物,对基于紫杉烷的化学疗法前后的crpc患者有效。然而,crpc仍然无法治愈并且会产生耐药性。了解这种耐药性的机制可以实现crpc的新一代疗法(tan等人,acta pharmacol sin.2015年1月;36(1):3-23)。
7.研究表明,swi/snf复合物在前列腺癌细胞系中调控雄激素受体介导的基因表达和增殖(jin等人,biochem biophys res commun.2018,10月28日;505(2):618-623)。然而,没有关于靶向swi/snf复合物组分的治疗剂的可用数据。
8.遗传和表观遗传改变,包括但不限于磷酸酶和张力蛋白同源物(pten)的缺失、tmprss2-erg易位、spop突变和myc扩增,促进了prca疾病进展。pten的丧失和pi3k/akt信号传导的过度激活被认为是与prca病理上相关的肿瘤驱动因素。大约30%的原发性肿瘤和高达70%的转移性癌症在pten基因座处表现出杂合性缺失。类似地,基因工程小鼠(gem)揭示了pten信号传导在prca中的关键作用。pten的前列腺特异性缺失(ptenpc-/-)在长潜伏期后导致前列腺腺癌的发展。此外,pten损失与其他信号改变(例如tp53或nkx3.1的缺失以及erg或krasg12d的过表达)在功能上协同作用,从而在小鼠中产生全面的疾病。总之,这些结果突出了pten在前列腺肿瘤发生中的功能重要性。然而,靶向pten或pi3k/akt通路的药理学仍然是疾病干预的主要障碍。
9.一份出版物(ding等人,j clin invest.2019;129(2):759-773)表明,低pten表达的肿瘤中的较高smarca4表达与较差的临床结果相关。基因工程小鼠(gem)和类器官测定证实pten消融使细胞对smarca4耗竭敏感。从机制上讲,pten损失通过抑制akt-gsk3b-fbxw7轴而稳定了smarca4蛋白。pten缺陷型prca细胞中smarca4表达增加导致染色质重塑为驱动促肿瘤发生转录组的构型,导致细胞进一步沉迷于smarca4。此外,他们在临床前模型中显示,brg1拮抗剂选择性地抑制了pten缺陷型前列腺肿瘤的进展。然而,使用已报道的smarca4溴结构域抑制剂,我们无法观察到pten缺陷型前列腺癌细胞系的敏感性,这与许多群体使用smarca2/4抑制剂时缺乏抗增殖活性一致。
10.所有前列腺癌中大约一半在转录因子erg和雄激素调控基因tmprss2之间存在易位。结果,erg在未正常表达的前列腺中以高水平表达。若干小鼠模型表明在前列腺癌发展中的因果作用,然而,tmprss2-erg在肿瘤发生中的确切作用尚不清楚,因此难以在治疗上靶向其功能。此外,转录因子在历史上一直难以用小分子在药理学上靶向。
11.最近的一项研究(sandoval等人,2018,molecular cell 71,1-13)表明,erg转录因子与swi/snf复合物的结合驱动了全基因组的重新靶向和基因调控。他们还表明,在细胞系和类器官模型中,erg介导的靶基因调控需要swi/snf复合物(存在于所存在的smarca2和smarca4中)的atp酶活性,这证明了erg和baf复合物在前列腺癌中的相互依赖性。然而,没有报道描述选择性降解smarca2/4作为靶向前列腺癌的治疗方法。
12.上述发现强调了ar、pten缺失和存在tmprss2-erg融合在前列腺癌中的作用,以及需要功能性swi/snf复合物(包括功能性smarca2/4)的改变来支持前列腺癌进展。然而,没有报道表明smarca2/4的降解可导致因合成致死关系所产生的抗增殖活性。
13.文献中有许多报道表明,患者的遗传特征可能决定患者对任何特定治疗性治疗的反应性。鉴于患有癌症的个体可以使用众多疗法,确定影响对特定药物的应答的患者遗传因素可用于为此患者提供个性化治疗方案。此类个性化治疗方案向患者提供了获得最大治疗益处的潜力,同时最大限度地减少了可能与替代性和不太有效的治疗方案相关的相关副作用。因此,需要鉴定可用于预测患者是否可能对治疗性治疗有应答的因素。特别地,重要的是,在癌症生物学领域确定此类预测因素,并在治疗上利用与前列腺癌中关键合成致死节点有关的发现。
技术实现要素:
14.本发明基于以下新发现:通过smarca2/4降解剂(式(i)化合物)抑制smarca2/4功能阻断了具有肿瘤特异性改变的前列腺癌细胞的生长,所述肿瘤特异性改变包括雄激素受体(ar)依赖性、pten中的突变、tmprss2-erg基因融合的存在,这是由于相应基因中的失活突变或通过除失活突变以外的替代机制导致相应基因表达的丧失。本发明提供了相比于本领域当前知识的显著进步,因为迄今为止尚未系统地鉴定雄激素受体、pten、tmprss2和erg的肿瘤特异性改变来预测细胞对smarca2/4降解剂的敏感性。本发明提供了基于肿瘤特异性改变或修饰确定受试者对smarca2/4降解剂治疗的反应性的方法。
15.在一个方面,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
16.a)通过以下步骤将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的
应答者:
17.i.从所述受试者中分离生物样品;
18.ii.确定肿瘤特异性改变的存在;
19.iii.如果存在所述肿瘤特异性改变中的至少一者,则将所述受试者鉴定为所述治疗的应答者;以及
20.b)将治疗有效量的至少一种smarca2/4降解剂施用于经鉴定对所述治疗有应答的受试者,从而治疗所述疾病或病症。
21.在另一方面,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
22.a)从所述受试者中分离生物样品;
23.b)如果所述样品中存在至少一种肿瘤特异性改变,则将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的应答者;以及
24.c)向所述受试者施用治疗有效量的至少一种smarca2/4降解剂,从而治疗所述疾病或病症。
25.在又一方面,本发明提供了一种选择前列腺癌患者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
26.a)从所述患者中分离生物样品;
27.b)确定所述生物样品中至少一种肿瘤特异性改变的存在;其中所述肿瘤特异性改变包括;
28.雄激素受体(ar)基因的突变、扩增或过表达;
29.磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;或
30.导致tmprss2和erg基因之间易位的基因组重排;
31.c)选择存在至少一种肿瘤特异性改变的所述患者用于用所述smarca2/4降解剂进行治疗;以及
32.d)对所选择的患者施用治疗有效量的至少一种smarca2/4降解剂。
附图说明
33.图1:本发明的smarca2/4降解剂在正常rwpe细胞中的作用
34.图2:本发明的smarca2/4降解剂在不存在本文所述的肿瘤特异性改变的du145细胞中的抗增殖活性
35.图3a:本发明的smarca2/4降解剂在22rv1细胞中的抗增殖活性,其中满足肿瘤特异性改变pten-突变(-)、ar依赖性(+)、tmprss2-erg融合(-)
36.图3b:本发明的smarca2/4降解剂在pc3细胞中的抗增殖活性,其中满足肿瘤特异性改变pten-突变(+)、ar依赖性(-)、tmprss2-erg融合(-)。
37.图4a:本发明的smarca2/4降解剂在vcap细胞中的抗增殖活性,其中满足肿瘤特异性改变pten-突变(-)、ar依赖性(+)、tmprss2-erg融合(+)。
38.图4b:本发明的smarca2/4降解剂在lncap细胞中的抗增殖活性,其中满足肿瘤特异性改变pten-突变(+)、ar依赖性(+)、tmprss2-erg融合(-)。
具体实施方式
39.提供每个实施方案是为了解释本发明,而不是为了限制本发明。事实上,对于本领域技术人员来说显而易见的是,可以对本文所述的化合物、组合物和方法进行各种修改和变化而不偏离本发明的范围或精神。例如,作为一个实施方案的一部分示出或描述的特征可以应用于另一实施方案以产生又一个实施方案。因此,本发明旨在包括这样的修改和变化以及它们的等同物。本发明的其他目的、特征和方面在以下详细描述中公开或从以下详细描述中显而易见。本领域普通技术人员应当理解,本讨论仅是对示例性实施方案的描述,而不应被解释为限制本发明的更广泛的方面。
40.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
41.a)通过以下步骤将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的应答者:
42.i.从所述受试者中分离生物样品;
43.ii.确定肿瘤特异性改变的存在;
44.iii.如果存在所述肿瘤特异性改变中的至少一者,则将所述受试者鉴定为所述治疗的应答者;以及
45.b)将治疗有效量的至少一种smarca2/4降解剂施用于经鉴定对所述治疗有应答的所述受试者,从而治疗所述疾病或病症。
46.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
47.a)从所述受试者中分离生物样品;
48.b)如果所述样品中存在至少一种肿瘤特异性改变,则将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的应答者;以及
49.c)向所述受试者施用治疗有效量的至少一种smarca2/4降解剂,从而治疗所述疾病或病症。
50.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,其中,
51.a.如果存在一种肿瘤特异性改变,则所述受试者被鉴定为用所述smarca2/4降解剂进行的治疗的中度应答者;并且
52.b.如果存在至少两种肿瘤特异性改变,则所述受试者被鉴定为用所述smarca2/4降解剂进行的治疗的高应答者。
53.在某些实施方案中,本发明的肿瘤特异性改变是:
54.a)雄激素受体(ar)基因的突变、扩增或过表达;
55.b)磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;或
56.c)导致tmprss2和erg基因之间易位的基因组重排。
57.在某些实施方案中,所述肿瘤特异性改变是:
58.磷酸酶和张力蛋白同源物(pten)功能丧失或有害突变;以及以下中的至少一者:
59.雄激素受体(ar)基因的突变、扩增或过表达;以及导致tmprss2和erg基因之间易位的基因组重排。
60.在某些实施方案中,所述肿瘤特异性改变是:
61.雄激素受体(ar)基因的突变、扩增或过表达;以及以下中的至少一者:
62.磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变以及导致tmprss2和erg基因之间易位的基因组重排。
63.在某些实施方案中,所述肿瘤特异性改变是:
64.导致tmprss2和erg基因之间易位的基因组重排;以及以下中的至少一者:
65.雄激素受体(ar)基因的突变、扩增或过表达;以及磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变。
66.在某些实施方案中,本发明中所述的方法,还包括确定患有癌症的受试者包括以下中的任一者:
67.雄激素受体(ar)基因的突变、扩增或过表达;
68.磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;和
69.导致tmprss2和erg基因之间易位的基因组重排。
70.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
71.a)通过以下步骤将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的应答者:
72.i.从所述受试者中分离生物样品;
73.ii.确定肿瘤特异性改变的存在;其中肿瘤特异性改变选自:
74.雄激素受体(ar)基因的突变、扩增或过表达;
75.磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;和
76.导致tmprss2和erg基因之间易位的基因组重排;
77.iii.如果存在所述肿瘤特异性改变中的至少一者,则将所述受试者鉴定为所述治疗的应答者;以及
78.b)将治疗有效量的至少一种smarca2/4降解剂施用于经鉴定对所述治疗有应答的受试者,从而治疗所述疾病或病症。
79.在某些实施方案中,雄激素受体(ar)是野生型ar。在某些实施方案中,雄激素受体(ar)是突变型ar。
80.在某些实施方案中,雄激素受体(ar)基因的突变、扩增或过表达被称为条件a。
81.在某些实施方案中,磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变被称为条件b。
82.在某些实施方案中,导致tmprss2和erg基因之间易位的基因组重排被称为条件c。
83.在某些实施方案中,称为条件a的肿瘤特异性改变还包括组成型活性ar变体的表达、肿瘤内雄激素合成和由另一因素引起的混杂的ar激活。在某些实施方案中,条件a是失调(导致ar的过表达)、ar的突变(功能获得)、选择性剪接(导致ar是组成型活性的)、共激活因子功能获得或共抑制因子功能丧失,和胞内分泌雄激素合成。
84.在某些实施方案中,条件a是功能获得ar突变或功能丧失ar突变。
85.在某些实施方案中,雄激素受体(ar)的肿瘤特异性改变存在于:
86.i.ar的氨基末端激活结构域(ntd);
87.ii.ar的dna结合结构域(dbd);
88.iii.ar的铰链区(hr)和(iv);或
89.iv.ar的羧基配体结合结构域(lbd)。
90.在某些实施方案中,ar基因突变选自:导致氨基酸取代或过早终止密码子的单点突变;最常导致移码和过早反刍(rumination)的核苷酸插入或缺失;完全或部分基因缺失;和内含子突变从而导致选择性剪接。
91.在某些实施方案中,雄激素受体的肿瘤特异性改变是基于rna的雄激素受体(ar)剪接变体(ar-v),包括但不限于ar-v1、ar-v2、ar-v3、ar-v4、ar-v5、ar-v6、ar-v7、ar-v567es、ar-v9或ar-v12以及其他肿瘤特异性改变,包括但不限于来自生物样品例如血浆、血清、尿液和唾液等的基于dna和/或rna的突变、插入缺失、拷贝数变异、基因融合。
92.在某些实施方案中,突变型ar是剪接变体和/或截短的ar。在另外的实施方案中,突变型ar可以是剪接变体和/或截短的ar,其具有c末端缺失并因此缺乏配体结合结构域(lbd)。示例性突变包括例如e43g、l54s、q58l、l57q、q64r、aq86、q112h、g142v、e166s、k180r、l192f、q198g、e211e、d221h、n222d、t227c、m266t、p269s、a251v、e253k、s296r、p334f、p340l、a356v、p390l、g414s、w433l、t438p、t438i、l444s、g449d、g451d、g456s、g457d、r484c、t497i、a498t、p499p、v508l、g524s、g524d、d528g、al547、δρ554、t573a、l574p、k580r、a586v、a587s、l594m、k609e、r629q、k630t、s646d、s647n、e665d、q670r、i672t、g683a、v716m、v715m、l701h、l720e、a721t、v730m、r726l、l744v、a748v、m749i、g750s、f754l、t755a、v757a、s759p、y763c、w741c、f747l、n756a、v757i、r760k、w741x、ag743、w751x、s782n、r786x、w796o、l797p、q798e、s791p、i799p、l830p、r846g、q867x、h874y、t877a、t877s、v866m、l880q、l872p、d879g、m886i、a896t、q902r、f891l、g909q、q919r、d890n、m895v和k910r。例如,氨基酸取代是:t877a(t878a)、d879g(d878g)、w741c、w741l、m749l、r629q、g142v、p533s、t575a、h874y或f876l。这些点突变可分为类固醇受体蛋白的三个主要区域:
93.1)lbd突变体(t877a、d879g、w741c.w741l、m749l、h874y、f876l)和lbd中的突变可能由于受体蛋白构象变化或配体结合袋中氨基酸r基团的变化或构象的变化而改变了配体结合,从而导致配体结合丧失、配体识别丧失、拮抗剂转换为激动剂和/或配体混杂;
94.2)ntd或铰链区突变体(r629q、g142v、p533s),其可能影响受体反式激活、与转录机制或辅因子/调节因子相互作用的能力,并导致受体功能改变,例如dna结合、调控基因表达或核易位;或者
95.3)可能影响受体调控基因表达能力的dbd突变体(t575a)。实例包括:雄激素受体中的h874y突变已被证明允许雌二醇、孕酮、氢化可的松、氟他胺和比卡鲁胺在22rv1和cwr22rv1细胞中结合;d878g已被证明导致dht和睾酮结合和活性丧失;w741c突变导致比卡鲁胺和氟他胺作为激动剂;f876l将arn-509和恩杂鲁胺从拮抗剂转变为激动剂;m749l导致对雌二醇的过敏性;t575a导致优先结合于ar非特异性基序,即gre;r629q导致dht的功能获得。
96.在某些实施方案中,剪接变体包括外显子跳跃、隐秘剪接供体/受体使用和隐秘外显子包涵。已鉴定的变体包括ar-v1、ar-v2、ar-v3、ar-v4.ar-v5、ar-v6、arv7、ar-v567es、ar-v7、ar-v9、ar-v12、ar-v13和ar-v14。(参见例如美国专利申请第2011/0110926号、美国
专利第8,133,724号和美国专利申请第2013/0130241号)。通常,雄激素受体变体缺少一些或全部的lbd和/或雄激素受体蛋白的赋予配体结合的羧基末端部分。
97.在其他实施方案中,ar肿瘤特异性改变是ar-t878a或其他相关突变、拷贝数增加、rna过表达等。
98.在某些实施方案中,ar基因中的突变是单点突变。在一些其他实施方案中,突变型ar可以携带点突变,例如t877a(t878a)、d879g、(d878g)、w741c、w741l、m749l、r629q、g142v、p533s、t575a、h874y或f876l。
99.在某些实施方案中,本发明提供了一种方法,所述方法包括:在来自受试者的生物样品中测定一个或多个雄激素受体基因剪接变体(ar-v)的存在和另外的肿瘤特异性改变,例如突变、插入缺失、拷贝数变异、基因融合等。
100.在某些实施方案中,本发明的肿瘤特异性改变包括ar扩增。在某些实施方案中,ar扩增是在雄激素剥夺疗法后导致的肿瘤特异性改变。这种ar扩增有时可能与ar过表达有关。
101.在某些实施方案中,肿瘤特异性改变是pten基因的功能丧失突变。
102.在某些实施方案中,pten基因中的突变包括外显子1、外显子2、外显子3、外显子4、外显子5、外显子6、外显子7、外显子8或外显子9中的突变。在一些实施方案中,pten基因中的突变包括g20stop、r55g、t38g、e91q、r387stop、h118y、i101a、i135v、q150g、q110stop、p95s、a164stop、564、c.761
–
765del、c.672
–
673ins、c.224ins、d223n、e201stop、d326n、h272y、t348i、k344r或t382s。
103.在某些实施方案中,pten基因中的突变包括外显子5或外显子8中的突变。在一些实施方案中,pten基因中的突变包括e91q、r387stop、h118y、i101a、i135v、q150g、q110stop、p95s、a164stop、e201stop、d326n或h272y。
104.在某些实施方案中,本发明的肿瘤特异性改变是具有来自雄激素调控基因(arg)的转录调控区的5'部分和来自ets家族成员基因的3'部分的基因融合,其中存在基因融合表明受试者患有前列腺癌。
105.在某些实施方案中,雄激素调控基因(arg)是tmprss2或psa。在某些特定实施方案中,雄激素调控基因(arg)是tmprss2。
106.在某些实施方案中,ets家族成员基因是erg、etvl(er81)、flil、etsl、ets2、elkl、etv6(tell)5etv7(tel2)、gabpα、elfl、etv4(elaf;pea3)、etv5(erm)、erf、pea3/e1af、pu.l、ese1/esx、sapl(elk4)、etv3(mets)、ews/fli1、esel、ese2(elf5)、ese3、pdef、net(elk3;sap2)、nerf(elf2)或fev。在某些实施方案中,ets家族成员基因是erg。
107.在某些实施方案中,具有来自雄激素调控基因(arg)的转录调控区的5'部分和来自ets家族成员基因的3'部分的基因融合导致erg在前列腺中的过表达。
108.在一些实施方案中,生物样品是血液、血浆、血清、尿液、痰液、脊髓液、脑脊液、胸膜液、乳头抽吸物、淋巴液、呼吸道、肠道和泌尿生殖道的液体、泪液、唾液、母乳、来自淋巴系统的液体、精液、脑脊液、器官内系统液体、腹水、肿瘤囊液、羊水或其组合的样品。在一个实施方案中,生物样品是血液、血浆、血清、尿液、痰液、脊髓液、脑脊液、胸膜液、淋巴液、呼吸道、肠道和泌尿生殖道的液体、唾液、来自淋巴系统的液体、精液、脑脊液、腹水、肿瘤囊液、羊水或其组合的样品。
109.在某些实施方案中,本发明的肿瘤特异性改变通过使用(但不限于)如下方法确定:下一代测序(ngs)、免疫组织化学、质谱(ms)、液相色谱质谱(lc-ms)、定量pcr、rna测序(rnaseq)或荧光激活细胞分选(facs)分析、荧光原位杂交(fish)分析。在某些实施方案中,肿瘤特异性改变通过使用下一代测序(ngs)来确定。
110.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的前列腺癌的方法,所述方法包括:
111.a)从所述受试者中分离生物样品;
112.b)如果所述样品中存在至少一种肿瘤特异性改变,则将所述受试者鉴定为用至少一种smarca2/4降解剂进行的治疗的应答者;以及
113.c)向所述受试者施用治疗有效量的至少一种smarca2/4降解剂,从而治疗所述前列腺癌。
114.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述方法包括:
115.a)通过以下步骤将所述受试者鉴定为用至少一种smarca2/4降解剂与另一种治疗剂组合进行的治疗的应答者:
116.i.从所述受试者中分离生物样品;
117.ii.确定肿瘤特异性改变的存在;
118.iii.如果存在所述肿瘤特异性改变中的至少一者,则将所述受试者鉴定为所述治疗的应答者;以及
119.b)将治疗有效量的至少一种smarca2/4降解剂施用于经鉴定对所述治疗有应答的受试者,从而治疗所述疾病或病症。
120.在一个实施方案中,潜在的治疗剂包括但不限于生物剂、免疫检查点调节剂和化学治疗剂,例如细胞毒剂。
121.如本文所用,免疫检查点调节剂是拮抗pd-1、pd-l1或ctla-4活性的拮抗剂分子。示例性免疫检查点调节剂包括但不限于:
122.i.pd-1抑制剂,例如派姆单抗(pembrolizumab)(以前的mk-3475或兰博利珠单抗(lambrolizumab)、)、纳武单抗(nivolumab)匹地利珠单抗(pidilizumab)、amp-224、amp-514、pdr001和西米普利单抗(cemiplimab)。
123.ii.pd-l1抑制剂,例如阿特珠单抗(atezolizumab)阿维鲁单抗(avelumab)德瓦鲁单抗(durvalumab)bms-936559、ck-301(iwai等人,journal of biomedical science,(2017)24:26)
124.iii.ctla4拮抗剂,例如伊匹单抗(ipilimumab),也称为mdx-010或mdx-101,一种人类抗ctla4抗体,优选以约10mg/kg的剂量施用,以及曲美木单抗(tremelimumab),一种人类抗ctla4抗体,优选以约15mg/kg的剂量施用。还参见sammartino等人,clinical kidney journal,3(2):135-137(2010),2009年12月在线发表。
125.在一个实施方案中,化学治疗剂是可用于治疗癌症的化合物。在一个实施方案中,本发明的化合物或其药学上可接受的组合物与如下化学治疗剂组合施用,所述化学治疗剂包括厄洛替尼(erlotinib)(genentech/osi pharm.)、硼替佐米
(bortezomib)(millennium pharm.)、双硫仑(disulfiram)、表没食子儿茶素没食子酸酯、salinosporamide a、卡非佐米(carfilzomib)、17-aag(格尔德霉素(geldanamycin))、根赤壳菌素(radicicol)、乳酸脱氢酶a(ldh-a)、氟维司群(fulvestrant)(astrazeneca)、舒尼替布(sunitib)(pfizer/sugen)、来曲唑(novartis)、甲磺酸伊马替尼(novartis)、非那舒酯(finasunate)(novartis)、奥沙利铂(oxaliplatin)(sanofi)、5-fu(5-氟尿嘧啶)、甲酰四氢叶酸、雷帕霉素(rapamycin)(西罗莫司(sirolimus),wyeth)、拉帕替尼(lapatinib)(gsk572016,glaxo smith kline)、洛那非布(lonafamib)(sch 66336)、索拉非尼(sorafenib)(bayer labs)、吉非替尼(astrazeneca)、ag1478、烷化剂如噻替派(thiotepa)和环磷酰胺;烷基磺酸盐,例如白消安(busulfan)、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶类,例如苯多巴(benzodopa)、卡波醌(carboquone)、美妥多巴(meturedopa)和脲多巴(uredopa);乙烯亚胺和甲基三聚氰胺,包括阿曲他胺(altretamine)、三乙烯三聚氰胺、三乙烯磷酰胺、三乙烯硫代磷酰胺和三甲基三聚氰胺;多聚乙酰(acetogenin)(尤其是布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(包括拓扑替康(topotecan)和伊立替康(irinotecan));苔藓抑素(bryostatin);卡利他汀(callystatin);cc-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);隐藻素(cryptophycin)(特别是隐藻素1和隐藻素8);肾上腺皮质激素(包括泼尼松(prednisone)和泼尼松龙(prednisolone));醋酸环丙孕酮;5a-还原酶,包括非那雄胺(finasteride)和度他雄胺(dutasteride));伏立诺他(vorinostat)、罗米地辛(romidepsin)、帕比司他(panobinostat)、丙戊酸、莫西司他(mocetinostat)多拉司他汀(dolastatin);阿地白介素(aldesleukin)、滑石多卡霉素(包括合成类似物kw-2189和cb1-tm1);艾植塞洛素(eleutherobin);水鬼蕉碱(pancrati statin);匍枝珊瑚醇(sarcodictyin);海绵抑素(spongistatin);氮芥,例如苯丁酸氮芥、萘氮芥(chlomaphazine)、氯磷酰胺、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、甲氯乙胺(mechlorethamine)、盐酸甲氯乙胺氧化物、美法仑(melphalan)、诺维贝辛(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫司汀(prednimustine)、曲磷酰胺(trofosfamide)、尿嘧啶芥;亚硝基脲类,例如卡莫司汀(carmustine)、氯脲佐菌素(chlorozotocin)、氟替莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)和雷尼司汀(ranimnustine);抗生素,例如烯二炔抗生素(例如,加利车霉素(calicheamicin),尤其是加利车霉素和加利车霉素coll(angew chem.intl.ed.engl.1994 33:183-186);达内霉素(dynemicin),包括达内霉素a;双膦酸盐,例如氯膦酸盐;埃斯波霉素(esperamicin);以及新制癌菌素发色团和相关的色蛋白烯二炔抗生素发色团)、阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、安曲霉素(authramycin)、重氮丝氨酸(azaserine)、博来霉素(bleomycin)、放线菌素c(cactinomycin)、卡拉霉素(carabicin)、卡米霉素(caminomycin)、嗜癌素(carzinophilin)、色霉素(chromomycinis)、放线菌素d(dactinomycin)、柔红霉素
(daunorubicin)、地托比星(detorubicin)、6-重氮-5-氧代-l-正亮氨酸、(多柔比星(doxorubicin))、吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉-多柔比星和脱氧多柔比星)、表柔比星(epirubicin)、埃柔比星(esorubicin)、伊达比星(idarubicin)、马赛霉素(marcellomycin)、丝裂霉素(mitomycin)如丝裂霉素c、霉酚酸(mycophenolic acid)、诺加拉霉素(nogalamycin)、橄榄霉素(olivomycin)、佩洛霉素(peplomycin)、紫红霉素(porfiromycin)、嘌呤霉素(puromycin)、克拉霉素(quelamycin)、罗多比星(rodorubicin)、链霉素(streptonigrin)、链脲佐菌素(streptozocin)、结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);抗代谢物,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸(denopterin)、甲氨蝶呤(methotrexate)、蝶罗呤(pteropterin)、三甲氨蝶呤(trimetrexate);嘌呤类似物,例如氟达拉滨(fludarabine)、6-巯基嘌呤、硫咪嘌呤(thiamiprine)、硫鸟嘌呤(thioguanine);嘧啶类似物,例如安西他滨(ancitabine)、阿扎胞苷(azacitidine)、6-氮杂尿苷、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、双脱氧尿苷(dideoxyuridine)、多西氟尿苷(doxifluridine)、依西他滨(enocitabine)、氟尿苷(floxuridine);雄激素,例如卡鲁睾酮(calusterone)、丙酸屈他雄酮(dromostanolone propionate)、表甾烷醇(epitiostanol)、美雄烷(mepitiostane)、睾酮内酯(testolactone);抗肾上腺素,例如氨鲁米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂,例如亚叶酸;醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamide glycoside);氨基酮戊酸(aminolevulinic acid);恩尿嘧啶(eniluracil);安吖啶(amsacrine);百垂布西(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate;);地磷酰胺(defofamine);秋水仙胺(demecolcine);地吖醌(diaziquone);依氟鸟氨酸(elfomithine);醋酸艾立替铵(elliptinium acetate);埃坡霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖(lentinan);洛尼达宁(lonidainine);美登素类,例如美登素(maytansine)和安丝霉素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidamnol);尼曲吖啶(nitraerine);喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基酰肼;丙卡巴肼(procarbazine);多糖复合物(jhs natural products,eugene,oreg.);雷佐生(razoxane);力索新(rhizoxin);西佐喃(sizofiran);锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2"-三氯三乙胺;单端孢霉烯毒素(尤其是t-2毒素、疣孢霉素a、漆斑菌素a和蛇形菌毒素);尿烷;长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿拉伯糖苷("ara-c");环磷酰胺;塞替派(thiotepa);紫杉烷,例如taxol(太平洋紫杉醇;bristol-myers squibb oncology,princeton,nj)、(不含cremophor)、白蛋白工程化的太平洋紫杉醇纳米颗粒制剂(american pharmaceutical partners,schaumberg,111.)和(多西他赛(docetaxel)、多西他赛(doxetaxel);sanofi-aventis);苯丁酸氮芥;(吉西他滨);6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,例如顺铂和卡铂;长春碱;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新
碱;(长春瑞滨);诺凡曲酮(novantrone);替尼泊苷(teniposide);依达曲沙(edatrexate);道诺霉素(daunomycin);氨基蝶呤;卡培他滨伊班膦酸盐;cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);类视色素,例如维甲酸;以及药学上可接受的上述任何一者的盐、酸和衍生物。
126.在一个实施方案中,生物剂包括抗体,例如阿仑单抗(alemtuzumab)(campath)、贝伐单抗(bevacizumab)(agenentech);西妥昔单抗(cetuximab)(imclone);帕尼单抗(panitumumab)(amgen)、利妥昔单抗(rituximab)(genentech/biogen idee)、帕妥珠单抗(pertuzumab)(2c4,genentech)、曲妥珠单抗(trastuzumab)(genentech)、托西莫单抗(tositumomab)(bexxar,corixia)和抗体药物缀合物,吉妥珠单抗奥佐米星(gemtuzumab ozogamicin)(wyeth)。具有作为与本发明化合物组合的药剂的治疗潜力的其他人源化单克隆抗体包括:阿泊珠单抗(apolizumab)、阿塞珠单抗(aselizumab)、阿特利珠单抗(atlizumab)、巴匹珠单抗(bapineuzumab)、比妥珠单抗美坦辛(bivatuzumab mertansine)、坎妥珠单抗美坦辛(cantuzumab mertansine)、西地珠单抗(cedelizumab)、赛妥珠单抗聚乙二醇(certolizumab pegol)、西非妥珠单抗(cidfusituzumab)、西妥珠单抗(cidtuzumab)、达克珠单抗(daclizumab)、依库珠单抗(eculizumab)、依法珠单抗(efalizumab)、依帕珠单抗(epratuzumab)、厄利珠单抗(erlizumab)、泛维珠单抗(felvizumab)、芳妥珠单抗(fontolizumab)、吉妥珠单抗奥佐米星、奥英妥珠单抗奥佐米星(inotuzumab ozogamicin)、伊匹单抗(ipilimumab)、拉贝珠单抗(labetuzumab)、林妥珠单抗(lintuzumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、莫他珠单抗(motavizumab)、莫托维珠单抗(motovizumab)、那他珠单抗(natalizumab)、尼妥珠单抗(nimotuzumab)、诺维珠单抗(nolovizumab)、努马维珠单抗(numavizumab)、奥瑞珠单抗(ocrelizumab)、奥马珠单抗(omalizumab)、帕利珠单抗(palivizumab)、帕可珠单抗(pascolizumab)、培妥珠单抗(pecfusituzumab)、派妥珠单抗(pectuzumab)、培克珠单抗(pexelizumab)、拉利珠单抗(ralivizumab)、雷珠单抗(ranibizumab)、瑞思维珠单抗(reslivizumab)、瑞利珠单抗(reslizumab)、瑞希维珠单抗(resyvizumab)、罗维珠单抗(rovelizumab)、鲁普利单抗(ruplizumab)、西布妥珠单抗(sibrotuzumab)、西普利单抗(siplizumab)、松妥珠单抗(sontuzumab)、泰坦-克利妥珠单抗(tacatuzumab tetraxetan)、他度组单抗(tadocizumab)、他利珠单抗(talizumab)、替非组单抗(tefibazumab)、托珠单抗(tocilizumab)、托利珠单抗(toralizumab)、西莫白介素单抗(tucotuzumab celmoleukin)、图库西珠单抗(tucusituzumab)、乌玛珠单抗(umavizumab)、乌妥珠单抗(urtoxazumab)、优特克单抗(ustekinumab)、维西珠单抗(visilizumab)和抗白介素-12(abt-874/j695,wyeth research和abbott laboratories),它是一种重组的完全人类序列的全长iggiλ抗体,其经过基因修饰以识别白介素-12p40蛋白。
127.在某些实施方案中,本发明涉及通过使用至少一种smarca2/4降解剂来抑制肿瘤的进展、减小肿瘤大小、肿瘤聚集、减小肿瘤体积和/或以其他方式抑制肿瘤生长的方法。本
文还提供了用于治疗潜在疾病例如前列腺癌并由此延长受试者存活期的方法。
128.在某些实施方案中,本发明提供了一种抑制有需要的受试者中肿瘤生长的方法,所述受试者是用smarca2/4降解剂进行的治疗的应答者,其中所述方法包括向所述受试者施用有效量的smarca2/4降解剂。
129.在某些实施方案中,本发明提供了一种抑制肿瘤生长的方法,其中肿瘤生长减少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、14%、16%、18%、20%、22%、24%、26%、28%、30%、32%、34%、36%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或100%,如通过肿瘤体积所测量。
130.在某些实施方案中,本发明提供了一种抑制肿瘤生长的方法,其中肿瘤生长减少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、14%、16%、18%、20%、22%、24%、26%、28%、30%、32%、34%、36%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或100%,如通过肿瘤的绝对大小所测量。
131.在某些实施方案中,本发明提供了一种抑制肿瘤生长的方法,其中肿瘤生长减少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、14%、16%、18%、20%、22%、24%、26%、28%、30%、32%、34%、36%、38%、40%、42%、44%、46%、48%、50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%、82%、84%、86%、88%、90%、92%、94%、96%、98%或100%,如通过所述肿瘤类型的肿瘤标志物的表达水平所测量。
132.在某些实施方案中,本发明提供了一种抑制前列腺癌生长的方法。在特定实施方案中,本发明提供了一种抑制去势抵抗性前列腺癌生长的方法。
133.因此,本发明还提供了一种治疗有需要的受试者中的前列腺癌的方法,所述受试者被鉴定为对有需要的smarca2/4降解剂进行的治疗有应答,其中所述方法包括向所述受试者施用有效量的smarca2/4降解剂。
134.在某些实施方案中,公开了用于治疗前列腺癌或去势抵抗性前列腺癌的方法。
135.雄激素受体活性和基因表达谱分析已在前列腺癌中进行了研究。在寻找生物标志物时,首先要鉴定上调的基因并测试该基因产物是否可以成为候选生物标志物。holzbeierlein等人,am.j.path.164(1),第217-227页,2004描述了基因表达谱分析并将表达与治疗抗性机制联系起来。虽然已鉴定某些基因的表达增强或降低,但某些基因的基因组改变也可能发生在前列腺癌中,并且这些包括:重排(ets转录因子、raf、kras);突变(雄激素受体、pik3ca、akt、raf、kras);扩增(雄激素受体、pik3ca、myc、aurka);损失(pten、rbi)。其他已知的肿瘤特异性改变发生在spop、foxa1、aurka、med 12、magi-1和chd1基因中。可发现ets融合超过prca的50%,并且靶向疗法或生物标志物可能是有用的,例如靶向parp或dnapk的抑制或分析患者样品的ets融合。癌基因表达、ras/raf、myc以及肿瘤抑制基因rbi可能是有用的生物标志物。
136.已知雄激素受体调控对前列腺癌细胞的身份和行为至关重要的大量基因。长链非编码rna(例如pcgem1和prncr1)的过表达与前列腺癌相关并且已经与前列腺癌的易感性相关联。最近有报道称,pcgem1和prncr1在crpc中高度过表达,并且它们结合并激活配体依赖
性和配体非依赖性ar介导的基因激活程序,并可能导致前列腺癌细胞中未受抑止的增殖。(yang等人,nature 2013,500(7464):598-602)。
137.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法;其中所述疾病或病症包括至少一种选自以下的肿瘤特异性改变:
138.a)雄激素受体(ar)基因的突变、扩增或过表达;
139.b)磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;和
140.c)导致tmprss2和erg基因之间易位的基因组重排。
141.在某些实施方案中,受试者患有前列腺疾病。
142.在某些实施方案中,前列腺疾病是前列腺癌。
143.在某些实施方案中,前列腺疾病是去势抵抗性前列腺癌。
144.在某些实施方案中,受试者已接受去势。
145.在某些实施方案中,受试者已接受抗雄激素疗法。
146.在某些实施方案中,本发明提供了一种选择患有前列腺疾病的受试者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
147.a)从所述受试者中分离生物样品;
148.b)确定所述生物样品中至少一种肿瘤特异性改变的存在;
149.c)选择所述样品中存在至少一种肿瘤特异性改变的所述患者用于用所述smarca2/4降解剂进行治疗;以及
150.d)向所选择的受试者施用治疗有效量的至少一种smarca2/4降解剂。
151.本发明中使用的化合物
152.在某些实施方案中,本发明提供了一种治疗有需要的受试者中的疾病或病症的方法,所述受试者经鉴定对根据本文所述方法的治疗有应答,所述方法包括向所述受试者施用治疗有效量的smarca2/4降解剂;其中所述smarca2/4降解剂由式(i)化合物表示:
[0153][0154]
或其药学上可接受的盐或其立体异构体;
[0155]
其中,
[0156]
r1是氢、卤基、烷基、烯基、烷氧基、羟基、羟烷基、-coora、-con(ra)2或芳基;其中所述芳基任选独立地被羟基、烷氧基、卤基、烷基、氨基、-ona、-coora和-ocora中的至少一者取代;其中ra在每次出现时是氢和烷基;
[0157]
r2是-nr3r4或-or3;其中,r3和r4独立地选自氢和烷基;
[0158]
环a是任选独立地被羟基、卤基和烷基中的至少一者取代的杂环;
[0159]
l是具有以下化学结构的接头:
[0160][0161][0162]
其中,
[0163]
所述接头的左侧与环a连接并且所述接头的右侧与靶向配体(tl)连接;
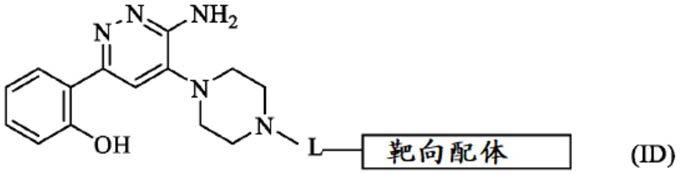
[0164]
rb是氢或烷基;
[0165]
rc是烷基;
[0166]
‘
n’是0至10并且
‘
p’是1至5;
[0167]
靶向配体(tl)是
[0168][0169]
其中,
[0170]
r6选自氢、烷基、酰基和卤代烷基;
[0171]
r7选自-o-r5和卤基;其中r5选自氢、烷基、酰基和na;并且
[0172]
r8是氢或烷基。
[0173]
在本发明的另一个实施方案中,它提供了一种治疗有需要的受试者中的疾病或病症的方法,所述受试者经鉴定对根据本文描述的方法的治疗有应答,所述方法包括向所述受试者施用治疗有效量的smarca2/4降解剂;其中所述smarca2/4降解剂由式(ia)化合物表示:
[0174]
[0175]
或其药学上可接受的盐或其立体异构体;
[0176]
其中,r1、环a、l和靶向配体与式(i)中所定义相同。
[0177]
在本发明的另一个实施方案中,它提供了一种治疗有需要的受试者中的疾病或病症的方法,所述受试者经鉴定对根据本文描述的方法的治疗有应答,所述方法包括向所述受试者施用治疗有效量的smarca2/4降解剂;其中所述smarca2/4降解剂由式(ib)化合物表示:
[0178][0179]
或其药学上可接受的盐或其立体异构体;
[0180]
其中,环a、l和靶向配体与式(i)中所定义相同。
[0181]
在本发明的另一个实施方案中,它提供了一种治疗有需要的受试者中的疾病或病症的方法,所述受试者经鉴定对根据本文描述的方法的治疗有应答,所述方法包括向所述受试者施用治疗有效量的smarca2/4降解剂;其中所述smarca2/4降解剂由式(ic)化合物表示:
[0182][0183]
或其药学上可接受的盐或其立体异构体;
[0184]
其中,l和靶向配体与式(i)中所定义相同。
[0185]
在本发明的另一个实施方案中,它提供了一种治疗有需要的受试者中的疾病或病症的方法,所述受试者经鉴定对根据本文描述的方法的治疗有应答,所述方法包括向所述受试者施用治疗有效量的smarca2/4降解剂;其中所述smarca2/4降解剂由式(id)化合物表示:
[0186][0187]
或其药学上可接受的盐或其立体异构体;
[0188]
其中,l和靶向配体与式(i)中所定义相同。
[0189]
在本文公开的方法的某些实施方案中,其中所述smarca2/4降解剂是具有以下化学结构的化合物:
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212][0213]
或其药学上可接受的盐或立体异构体。
[0214]
在某些实施方案中,本发明提供了一种选择前列腺癌患者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
[0215]
a)从所述患者中分离生物样品;
[0216]
b)确定是否存在一种或多种肿瘤特异性改变;其中所述肿瘤特异性改变包括;以及
[0217]
c)选择样品中存在所述肿瘤特异性改变中的至少一者的所述患者用于用所述smarca2/4降解剂进行治疗。
[0218]
在某些实施方案中,本发明提供了一种选择前列腺癌患者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
[0219]
a)从所述患者中分离生物样品;
[0220]
b)确定是否存在一种或多种肿瘤特异性改变;其中所述肿瘤特异性改变包括;和
[0221]
c)选择样品中存在所述肿瘤特异性改变中的至少一者的所述患者用于用所述smarca2/4降解剂进行治疗;以及
[0222]
d)将包含治疗有效量的至少一种smarca2/4降解剂的所述治疗施用于所选择的患者。
[0223]
在某些实施方案中,本发明提供了一种选择前列腺癌患者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
[0224]
a)从所述患者中分离生物样品;
[0225]
b)确定是否存在一种或多种肿瘤特异性改变;其中所述肿瘤特异性改变包括;
[0226]
雄激素受体(ar)基因的突变、扩增或过表达;
[0227]
磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;或
[0228]
导致tmprss2和erg基因之间易位的基因组重排;以及
[0229]
c)选择样品中存在所述肿瘤特异性改变中的至少一者的所述患者用于用所述smarca2/4降解剂进行治疗。
[0230]
在某些实施方案中,本发明提供了一种选择前列腺癌患者用于用smarca2/4降解
剂与另一种治疗剂组合进行治疗的方法,其中所述方法包括:
[0231]
a)从所述患者中分离生物样品;
[0232]
b)确定是否存在一种或多种肿瘤特异性改变;其中所述肿瘤特异性改变包括;和
[0233]
c)选择样品中存在所述肿瘤特异性改变中的至少一者的所述患者用于用所述smarca2/4降解剂与另一种治疗剂的组合进行治疗;以及
[0234]
d)将包含治疗有效量的至少一种smarca2/4降解剂与另一种治疗剂组合的所述治疗施用于所选择的患者。
[0235]
在某些实施方案中,本发明提供了一种选择患有前列腺疾病的受试者用于用smarca2/4降解剂进行治疗的方法,其中所述方法是体外的。
[0236]
在一个实施方案中,本发明提供了一种抑制受试者中的前列腺癌细胞增殖的方法,所述方法包括:
[0237]
i.从所述受试者中分离生物样品;
[0238]
ii.确定是否存在选自以下的肿瘤特异性改变:
[0239]
雄激素受体(ar)基因的突变、扩增或过表达;
[0240]
磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;和
[0241]
导致tmprss2基因和erg基因之间易位的基因组重排;
[0242]
iii.如果存在所述肿瘤特异性改变中的至少一者,则向所述受试者施用治疗有效量的至少一种smarca2/4降解剂。
[0243]
在某些实施方案中,本发明提供了一种抑制前列腺癌细胞增殖的方法,所述方法包括使所述前列腺癌细胞与至少一种smarca2/4降解剂接触的步骤;其中所述smarca2/4降解剂由式(i)化合物表示。
[0244]
在某些实施方案中,本发明提供了一种抑制具有一种或多种肿瘤特异性改变的前列腺癌细胞增殖的方法,所述方法包括使所述前列腺癌细胞与至少一种smarca2/4降解剂接触的步骤;其中所述smarca2/4降解剂由式(i)化合物表示。
[0245]
在某些实施方案中,本发明提供了一种抑制前列腺癌细胞增殖的方法,所述方法包括使所述前列腺癌细胞与至少一种smarca2/4降解剂接触的步骤;其中所述smarca2/4降解剂是表a中描述的化合物。
[0246]
在某些实施方案中,本发明提供了一种抑制具有一种或多种肿瘤特异性改变的前列腺癌细胞增殖的方法,所述方法包括使所述前列腺癌细胞与至少一种smarca2/4降解剂接触的步骤;其中所述smarca2/4降解剂是表a中描述的化合物。
[0247]
在某些实施方案中,本发明提供了一种抑制前列腺癌细胞增殖的方法,其中所述前列腺癌细胞包括受试者中的前列腺肿瘤。
[0248]
在某些实施方案中,本发明提供了一种抑制前列腺癌细胞增殖的方法,其中所述方法是体外的。
[0249]
在某些实施方案中,本发明提供了一种选择患有前列腺疾病的受试者用于用smarca2/4降解剂进行治疗的方法,所述方法包括:
[0250]
a)从所述受试者中分离生物样品;
[0251]
b)确定所述生物样品中是否存在一种或多种肿瘤特异性改变;
[0252]
c)选择样品中存在至少一种肿瘤特异性改变的所述受试者用于用所述smarca2/4
降解剂进行治疗;以及
[0253]
d)将包含治疗有效量的至少一种smarca2/4降解剂的所述治疗施用于所选择的受试者。
[0254]
在某些实施方案中,本发明提供了一种选择患有前列腺疾病的受试者用于用smarca2/4降解剂与另一种治疗剂组合进行治疗的方法,所述方法包括:
[0255]
a)从所述受试者中分离生物样品;
[0256]
b)确定所述生物样品中是否存在一种或多种肿瘤特异性改变;
[0257]
c)选择样品中存在至少一种肿瘤特异性改变的所述受试者用于用所述smarca2/4降解剂和另一种治疗剂的组合进行治疗;以及
[0258]
d)将包含治疗有效量的至少一种smarca2/4降解剂与另一种治疗剂组合的所述治疗施用于所选择的受试者。
[0259]
在某些实施方案中,smarca2/4降解剂是式(ia)、(ib)、(ic)或(id)的化合物:
[0260][0261]
或其药学上可接受的盐或其立体异构体。
[0262]
在某些实施方案中,本发明提供了一种用于选择患有前列腺癌的受试者的方法中的化合物,其中所述化合物由式(i)化合物表示:
[0263]
[0264]
或其药学上可接受的盐或其立体异构体;
[0265]
其中,
[0266]
r1是氢、卤基、烷基、烯基、烷氧基、羟基、羟烷基、-coora、-con(ra)2或芳基;其中所述芳基任选独立地被羟基、烷氧基、卤基、烷基、氨基、-ona、-coora或-ocora中的至少一者取代;其中ra在每次出现时是氢或烷基;
[0267]
r2是-nr3r4或-or3;其中,r3和r4独立地是氢或烷基;
[0268]
环a是任选独立地被羟基、卤基或烷基中的至少一者取代的杂环;
[0269]
l是具有以下化学结构的接头:
[0270][0271]
其中,
[0272]
所述接头的左侧与环a连接并且所述接头的右侧与靶向配体(tl)连接;
[0273]
rb是氢或烷基;
[0274]
rc是烷基;
[0275]
‘
n’是0至10并且
‘
p’是1至5;
[0276]
靶向配体(tl)是
[0277][0278]
其中,
[0279]
r6是氢、烷基、酰基或卤代烷基;
[0280]
r7是-o-r5或卤基;其中r5是氢、烷基、酰基或na;并且
[0281]
r8是氢或烷基。
[0282]
在某些实施方案中,用于选择患有前列腺癌的受试者的方法中的化合物,其中所述化合物由式(ia)化合物表示:
[0283][0284]
或其药学上可接受的盐或其立体异构体。
[0285]
在某些实施方案中,用于选择患有前列腺癌的受试者的方法中的化合物,其中所述化合物由式(ib)化合物表示:
[0286][0287]
或其药学上可接受的盐或其立体异构体。
[0288]
在某些实施方案中,用于选择患有前列腺癌的受试者的方法中的化合物,其中所述化合物由式(ic)化合物表示:
[0289][0290]
或其药学上可接受的盐或其立体异构体。
[0291]
在某些实施方案中,用于选择患有前列腺癌的受试者的方法中的化合物,其中所述化合物由式(id)化合物表示:
[0292][0293]
或其药学上可接受的盐或其立体异构体。
[0294]
定义:
[0295]
必须注意,如在本说明书和所附权利要求中使用的,单数形式“一个”、“一种”和“所述”包括复数个指示物,除非内容另有明确规定。因此,例如,对“生物标志物”的提及包括两种或更多种生物标志物的混合物等。
[0296]
如本文所用,术语“包含”、“包括”、“含有”及其任何变体旨在涵盖非排他性的包涵,使得包含、包括或含有一个要素或要素列表的工艺、方法、工艺产物或物质组合物不仅包括那些要素,还可包括未明确列出的或此类工艺、方法、工艺产物或物质组合物固有的其他要素。
[0297]
如本文所用,术语“肿瘤特异性改变”是指基因组中导致dna序列、mrna序列、蛋白
质序列的改变、基因表达(mrna或蛋白质丰度)的改变或其组合的任何改变。肿瘤特异性改变包括但不限于有害突变(例如,降低或消除基因功能或基因表达的突变)、功能丧失突变、功能获得突变等。肿瘤特异性改变包括将病毒遗传物质插入受感染宿主细胞(例如人乳头瘤病毒)的基因组中。肿瘤特异性改变还包括微卫星或其他重复的dna片段(例如,短串联重复或简单序列重复)。
[0298]
如本文所用,关于任何特定基因或基因产物的短语“功能获得突变”是指一种突变类型,其中改变的基因产物具有新的分子功能或新的基因表达模式。
[0299]
如本文所用,“功能丧失”(lof)突变是指基因的突变或等位基因,其结果是基因产物(例如所编码的蛋白质)在细胞或有机体(包括人类细胞或人类)中具有低于正常的功能或没有功能。当等位基因完全丧失功能(无效等位基因)时,通常称为无定形突变。与功能丧失突变相关的表型通常是隐性的。
[0300]
如本文所用,术语“过表达”当指代基因(例如,致癌驱动基因)时,是指与正常水平相比对应于基因的mrna、蛋白质或其组合的任何增加。例如,术语“ar基因的过表达”是指对应于ar基因的mrna水平、蛋白质水平或其组合的任何增加。
[0301]
如本文所用,术语“tmprss2和erg基因的基因组重排”是指与前列腺癌相关的tmprss2和erg基因的任何重排,并且可包括tmprss2基因和erg之间的基因融合。这种基因组重排可能导致tmprss2和erg基因之间的易位。
[0302]
如本文所用,医药剂或药剂组合的术语“治疗有效量”旨在指在适用于任何医学治疗的合理益处/风险比下,赋予所治疗受试者治疗效果的药剂的量。治疗效果可以是客观的(即,可通过一些测试或标志物来测量)或主观的(即,受试者给出指示或感觉到效果)。治疗有效量通常以可包含多个单位剂量的给药方案施用。对于任何特定的医药剂,治疗有效量(和/或有效给药方案内的适当单位剂量)可以变化,例如,取决于施用途径,取决于与其他医药剂的组合。此外,任何特定受试者的特定治疗有效量(和/或单位剂量)可能取决于多种因素,包括所治疗的病症和病症的严重程度;所用的特定医药剂的活性;采用的具体组合物;受试者的年龄、体重、一般健康状况、性别和饮食;所用的特定医药剂的施用时间、施用途径和/或排泄或代谢速率;治疗的持续时间;以及医学领域中众所周知的类似因素。
[0303]
如本文所用,术语“治疗(treatment)”(也称为“治疗(treat)”或“治疗(treating)”)是指部分或完全减轻、改善、缓解、抑制特定疾病、病症、综合征和/或疾患,延迟其发作,降低其严重程度和/或降低其一种或多种症状或特征的发生率的医药剂、补救措施或药物的任何施用。此类治疗可以针对不表现出相关疾病、病症和/或疾患的迹象的受试者和/或仅表现出疾病、病症和/或疾患的早期迹象的受试者。或者或另外地,此类治疗可以针对表现出相关疾病、病症和/或疾患的一种或多种确定迹象的受试者。
[0304]
如本文所用,术语“任选的”或“任选地”是指随后描述的事件或情况可能发生或可能不发生,并且所述描述包括事件或情况发生的实例以及不发生的实例。例如,“任选取代的烷基”是指烷基可被取代以及烷基未被取代的事件或情况。
[0305]
术语“被取代的”是指在主链的一个或多个碳上具有代替氢的取代基的部分。应当理解,“取代”或“被
……
取代”包括隐含的前提条件,即这种取代符合被取代原子和取代基的允许化合价,并且取代产生稳定的化合物,例如,其不会自发地例如通过重排、环化、消除等进行转化。如本文所用,预期术语“被取代的”包括有机化合物的所有允许的取代基。在广
泛的方面,允许的取代基包括有机化合物的无环和环状、支链和无支链、碳环和杂环、芳族和非芳族取代基。对于适当的有机化合物,允许的取代基可以是一种或多种并且相同或不同。为了本发明的目的,杂原子例如氮可具有氢取代基和/或本文所述的满足杂原子化合价的有机化合物的任何允许的取代基。取代基可包括本文所述的任何取代基,例如卤素、羟基、羰基(例如羧基、烷氧羰基、甲酰基或酰基)、硫代羰基(例如硫酯、硫代乙酸酯或硫代甲酸酯)、烷氧基、氧代基、磷酰基、磷酸酯基、膦酸酯基、次膦酸酯基、氨基、酰胺基、脒、亚胺、氰基、硝基、叠氮基、巯基、烷硫基、硫酸酯基、磺酸酯基、氨磺酰基、磺酰氨基、磺酰基、杂芳基、杂环烷基、芳烷基、或芳族或杂芳族部分。本领域技术人员将理解,适当时,取代基本身可被取代。除非特别陈述为“未被取代的”,否则本文对化学部分的提及应理解为包括被取代的变体。例如,对“芳基”基团或部分的提及隐含地包括被取代的和未被取代的变体。
[0306]
如本文所用,术语“烷基”是指饱和脂族基团,包括但不限于c
1-c
10
直链烷基或c
3-c
10
支链烷基。优选地,“烷基”是指c
1-c6直链烷基或c
3-c6支链烷基。最优选地,“烷基”是指c
1-c4直链烷基或c
3-c8支链烷基。“烷基”的实例包括但不限于甲基、乙基、1-丙基、2-丙基、异丙基、正丁基、仲丁基、叔丁基、1-戊基、2-戊基、3-戊基、新戊基、1-己基、2-己基、3-己基、1-庚基、2-庚基、3-庚基、4-庚基、1-辛基、2-辛基、3-辛基和4-辛基。“烷基”可任选被取代。
[0307]
如本文所用,术语“卤代烷基”是指被一个或多个卤素原子取代的烷基,其中卤基和烷基如上文所定义。“卤代烷基”的实例包括但不限于氟甲基、二氟甲基、氯甲基、三氟甲基和2,2,2-三氟乙基。
[0308]
如本文所用,术语“羟基烷基”或“羟烷基”是指如上文所定义的烷基,其中烷基的一个或多个氢原子已被羟基代替。羟基烷基部分的实例包括但不限于-ch2oh、-ch2ch2oh、-ch2ch2ch2oh、-ch2ch(oh)ch2oh、-ch2ch(oh)ch3、-ch(ch3)ch2oh。
[0309]
如本文所用,术语“杂环烷基”是指具有至少一个选自o、n、s、s(o)、s(o)2、nh和c(o)的杂原子或杂基的3至15元非芳族、饱和或部分饱和、桥连双环、螺环、单环或多环环系统,其余环原子独立地选自由碳、氧、氮和硫组成的组。术语“杂环烷基”还指具有至少一个选自o、n、s、s(o)、s(o)2、nh和c(o)的杂原子或杂基的桥连双环系统。“杂环烷基”的实例包括但不限于其氮杂环丁烷基、氧杂环丁烷基、咪唑烷基、吡咯烷基、噁唑烷基、噻唑烷基、吡唑烷基、四氢呋喃基、哌啶基、二氢吡啶基、哌嗪基、四氢吡喃基、吗啉基、硫代吗啉基、1,4-二噁烷基、二氧硫代吗啉基、氧杂哌嗪基、氧杂哌啶基、四氢呋喃基、四氢吡喃基、四氢噻吩基、二氢吡喃基、二氢吲哚基、二氢吲哚甲基、异吲哚啉基、氧代异吲哚啉基、二氧代异吲哚啉基、氮杂-二环辛基、二氮杂二环辛基、吖辛因基、色满基、异色满基氧杂蒽基、2-氧杂-6-氮杂螺[3.3]庚基。杂环烷基取代基的连接可通过碳原子或杂原子发生。杂环烷基可任选地被一个或多个上述基团取代为一个或多个合适的基团。优选地,“杂环烷基”是指选自由其氮杂环丁烷基、氧杂环丁烷基、咪唑烷基、吡咯烷基、噁唑烷基、噻唑烷基、吡唑烷基、四氢呋喃基、哌啶基、哌嗪基、四氢吡喃基、吗啉基和硫代吗啉基组成的组的5至6元环。所有杂环烷基任选地被一个或多个上述基团取代。
[0310]
如本文所用,单独或与其他术语组合使用的术语“杂芳基”是指含有总共5至14个环原子的完全不饱和环系统。至少一个环原子是杂原子(即氧、氮或硫),其余环原子/基团独立地选自碳、氧、氮或硫。杂芳基可以是稠合在一起或共价连接的单个环(单环)或多个环(双环、三环或多环)。优选地,“杂芳基”是5至6元环。环可含有1至4个选自n、o和s的额外杂
原子,其中n原子任选地被季铵化。杂芳基部分的任何合适的环位置可以共价连接到确定的化学结构。“杂芳基”的实例包括但不限于呋喃基、噻吩基、吡咯基、吡唑基、咪唑基、噁唑基、噌啉基、异噁唑基、噻唑基、异噻唑基、1h-四唑基、噁二唑基、三唑基、吡啶基、3-氟吡啶基、嘧啶基、吡嗪基、哒嗪基、苯并噁唑基、苯并异噁唑基;苯并噻唑基、苯并呋喃基、苯并噻吩基、苯并三嗪基、酞嗪基、噻蒽、二苯并呋喃基、二苯并噻吩基、苯并咪唑基、吲哚基、异吲哚基、吲唑基、喹啉基、异喹啉基、喹唑啉基、喹喔啉基、嘌呤基、蝶啶基、9h-咔唑基、α-咔啉基、吲哚嗪基、苯并异噻唑基、苯并噁唑基、吡咯并吡啶基、呋喃并吡啶基、嘌呤基、苯并噻二唑基、苯并噁二唑基、苯并三唑基、苯并三二唑基、咔唑基、二苯并噻吩基、吖啶基等。杂芳基可任选地被进一步取代。
[0311]
如本文所用,术语“烯基”是指含有至少一个碳碳双键并且可以是直链或支链或其组合的碳链。“烯基”的实例包括但不限于乙烯基、烯丙基、异丙烯基、戊烯基、己烯基、庚烯基、1-丙烯基、2-丁烯基和2-甲基-2-丁烯基。
[0312]
如本文所用,术语“氨基”是指-nh2基团。
[0313]
如本文所用,单独或与其他术语组合使用的术语“卤基”或“卤素”是指氟、氯、溴或碘。
[0314]
如本文所用,单独或与其他术语组合使用的术语“羟基(hydroxy)”或“羟基(hydroxyl)”是指-oh。
[0315]
如本文所用,术语“氧代”是指=o基团。
[0316]
如本文所用,术语“烷氧基”是指基团-o-烷基,其中烷基如上文所定义。示例性c
1-c
10
烷氧基包括但不限于甲氧基、乙氧基、正丙氧基、正丁氧基或叔丁氧基。烷氧基可任选地被一个或多个合适的基团取代。
[0317]
如本文所用,术语“芳基”是具有约6至14个碳原子的任选取代的单环、双环或多环芳族烃环系统。c
6-c
14
芳基的实例包括但不限于苯基、萘基、联苯基、蒽基、芴基、茚满基、联苯基和苊基。芳基可以未被取代或被一个或多个合适的基团取代。
[0318]
术语“酰基”是指基团r-co-或-co-r,其中r是上文定义的任选取代的烷基。“酰基”的实例包括但不限于ch3co-、ch3ch2co-、ch3ch2ch2co-或(ch3)2chco-。术语
“‑
o-酰基”是指-o-co-r,其中r是如上文所定义的烷基。
[0319]
如本文所用,术语“杂原子”是指硫、氮或氧原子。
[0320]
术语“受试者”表示哺乳动物,例如人类。在本发明的一个实施方案中,受试者是指任何患有前列腺疾病的受试者。在本发明的另一个实施方案中,术语“受试者”是指任何患有前列腺癌的受试者。在本发明的另一个实施方案中,术语“受试者”是指任何患有去势抵抗性前列腺癌的受试者。在本发明的另一个实施方案中,术语“受试者”是指任何已接受去势的受试者。在本发明的另一个实施方案中,术语“受试者”是指任何已接受抗雄激素疗法的受试者。在另一个实施方案中,术语“受试者”是指任何患有去势抵抗性前列腺癌并接受smarca2/4降解剂一线疗法的受试者。在另一个实施方案中,术语“受试者”是指任何患有去势抵抗性前列腺癌的受试者并接受smarca2/4降解剂和任何其他治疗剂的组合疗法的受试者。
[0321]
当提及本发明的受试者时,术语用smarca2/4降解剂进行的治疗的“中度应答者”应指具有本发明的任何一种肿瘤特异性改变的受试者。
[0322]
当提及本发明的受试者时,术语用smarca2/4降解剂进行的治疗的“高应答者”应指具有至少两种本发明的肿瘤特异性改变的受试者。例如,当存在以下改变时,受试者可被称为用smarca2/4降解剂进行的治疗的“高应答者”:
[0323]
i.雄激素受体(ar)基因的突变、扩增或过表达;以及磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;
[0324]
ii.磷酸酶和张力蛋白同源物(pten)的功能丧失或有害突变;以及导致tmprss2和erg基因之间易位的基因组重排;
[0325]
和
[0326]
iii.雄激素受体(ar)基因的突变、扩增或过表达;以及导致tmprss2和erg基因之间易位的基因组重排。
[0327]
实验
[0328]
用于制备本发明化合物的合成程序描述于国际申请pct/ib2019/053443中,所述国际申请特此整体并入。
[0329]
实施例
–
1:
[0330]
通过cell titer(promega)测定法测定细胞中smarca2/4降解剂的抗增殖活性:
[0331]
将前列腺癌细胞系vcap(atcc#crl-2876)、lncap-fgc(atcc crl-1740)、22rv1(atcc crl-2505)、pc-3(atcc crl-1435)、du-145(atcc htb-81)和rwpe-1(atcc crl-11609)使用相应的完整培养基接种在96孔板黑色透明底平板(corning,目录号3904)中。同时接种细胞以用于第0天测量。
[0332]
第二天,将本发明的化合物43加入到来自在dmso(sigma目录号d2650)中制备的10mm原液的细胞中。dmso单独用作载体对照。使用50μl cell titer试剂(promega,目录号g7572)在添加化合物的当天终止第0天板。将化合物温育8天,其中例外为22rv1温育6天。在第4天用新鲜化合物补充培养基。化合物温育后,使用50μl celltiter试剂终止测定。celltiter发光试剂基于存在的atp的定量来确定活细胞的数量,atp是细胞数量和代谢活性的指标。在荧光读板器中读取发光读数。
[0333]
第0天ctg测量被指定为时间零(tz),载体对照中的最终ctg测量被指定为对照生长dmso(c),并且在九个浓度水平的药物存在下的测试生长被指定为(ti)。
[0334]
使用测量值[时间零(tz)、生长对照dmso(c)和在九个浓度水平的药物存在下的测试生长(ti)],计算每个药物浓度水平的生长百分比。应答百分比计算为:
[0335]
[(ti-tz)/(c-tz)]x 100,对于ti≥tz的浓度
[0336]
[(ti-tz)/tz]x 100,对于ti《tz的浓度
[0337]
计算每种实验剂的三个剂量反应参数。50%的生长抑制(gi
50
)由[(ti-tz)/(c-tz)]x 100=50计算,这是导致药物温育期间对照细胞中净发光增加(测量的atp)减少50%的药物浓度。结果在表ii中给出。
[0338]
指示治疗后细胞净损失的lc
50
(导致药物治疗结束时测量的atp与开始时相比减少50%的药物浓度)由[(ti-tz)/tz]x 100=-50计算。
[0339]
测定前列腺癌细胞系对smarca2/4降解剂的敏感性
[0340]
针对代表正常和前列腺癌细胞的若干细胞系分析了本发明的化合物43。本发明中使用的细胞系具有一种或多种肿瘤特异性改变,例如ar、pten突变或tmprss2-erg融合的存在,如下文所呈现。
[0341]
表i
[0342][0343]
‘
+’号指示相应细胞系中存在特定的肿瘤特异性改变
[0344]
‘‑’
号指示相应细胞系中不存在特定的肿瘤特异性改变
[0345]
在正常细胞(rwpe)中,观测到所述化合物没有显示出任何抑制和细胞杀伤(图1)。在不存在任何肿瘤特异性改变的前列腺癌细胞系du145中,既未观测到细胞生长抑制也未观察到细胞杀伤,因此du145被确定为对smarca2/4降解剂的无应答者或不良应答者(图2)。存在具有所述肿瘤特异性改变之一的细胞系22rv1和pc3的生长被有效抑制,没有细胞杀伤或有中度细胞杀伤(图3a和图3b)。并且,在具有所述三种肿瘤特异性改变中的两者的细胞系vcap和lncapfgc中,生长和细胞杀伤都受到强烈影响(图4a和图4b)。
[0346]
这些观测结果支持使用ar依赖性、pten突变和tmprss2-erg基因融合的存在作为生物标志物来确定前列腺癌细胞系对smarca2/4降解剂的敏感性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1