温胃阿亚然及片、片芯原料、制备方法及其质量控制方法与流程
1.本发明涉及一种温胃阿亚然及片、片芯原料、制备方法及其质量控制方法。
背景技术:
2.本品原标准收载于《中华人民共和国卫生部药品标准
·
维吾尔药分册》(ws-bw-0192-98)。具有清除胃中异常黑胆质,消肿开胃的作用。用于胃满疼痛,食欲减少。该药是由芦荟200g、菟丝草40g、药西瓜57g、盒果藤97g、穆库没药50g五味药材组成,其中前四位药材粉碎成细粉,穆库没药加水提取并将滤液浓缩成膏状,加入上述细粉、单糖浆与淀粉适量,混匀,制粒,干燥,压制成1000片。
3.原质量标准中药材提取加水量、浓缩工艺参数未明确,辅料种类与用量未确定,且经预试验,加单糖浆与淀粉不适宜本品的制备操作与成型。制剂处方待优化,且原为素片,味苦、服用量大,患者服用顺应性差,另外由于素片防潮性差,导致药物不稳定。
4.芦荟苷具有良好的抗菌、抗氧化、促进排便、调节肿瘤细胞凋亡等作用,但其质量控制标准较低,有待提高,缺乏含量控制方法。对生产过程和制剂产品缺乏现代科学的控制手段。
技术实现要素:
5.为解决现有技术中存在的温胃阿亚然及片的稳定性差、服用量大、和产品可加工性差等问题,本发明提供一种温胃阿亚然及片、片芯原料、制备方法及其质量控制方法。本发明通过处方筛选确定处方,制剂处方合理和工艺参数确切;产品硬度大,稳定性好和可加工性好;制备工艺简单稳定,操作易成型,可以有效控制生产过程,适合大批量生产;质量标准高,质量控制方法快速精密度高、稳定性、重现性好回收率高,可有效控制产品质量。
6.本发明是采用如下技术方案来解决上述技术问题的:
7.本发明提供了一种用于温胃阿亚然及片的片芯原料,其包括活性成分和辅料,其中,所述活性成分由活性成分a和活性成分b组成,其中所述活性成分a由质量比为200:40:57:97的芦荟、菟丝草、药西瓜和盒果藤组成;所述活性成分b为穆库没药,所述活性成分a和所述活性成分b的质量比为394:50;以所述活性成分a的质量份数为375份计,所述辅料包括以下质量份数的组分:填充剂10-100份;崩解剂0-80份;润滑剂1-60份。
8.本发明中,所述填充剂可为本领域常规,较佳地包括淀粉和/或微晶纤维素,更佳地为淀粉。
9.本发明中,所述填充剂的含量较佳地为20-80份,例如为30份,47.5份,50份,60份或75份。
10.本发明中,所述崩解剂可为本领域常规,较佳地包括交联聚维酮和/或羧甲基淀粉钠,更佳地为交联聚维酮。
11.本发明中,所述崩解剂的含量较佳地为15-60份,例如20份,25份,30份,40份或50份。
12.本发明中,所述润滑剂可为本领域常规,较佳地包括二氧化硅和/或硬脂酸镁,更佳地为二氧化硅及硬脂酸镁合用。
13.本发明中,所述润滑剂的含量较佳地为5-30份,例如27.5份。
14.较佳地,所述润滑剂为硬脂酸镁,所述硬脂酸镁的含量为5份。
15.较佳地,所述润滑剂为二氧化硅及硬脂酸镁合用,其中,所述硬脂酸镁的含量为2.5份,所述二氧化硅的含量为25份。
16.在本发明某些优选实施方案中,所述辅料包括以下质量份数的组分:填充剂20-80份;崩解剂15-60份;润滑剂5-30份。
17.较佳地,所述辅料包括以下质量份数的组分:填充剂75份;崩解剂25份;润滑剂5份。
18.较佳地,所述辅料包括以下质量份数的组分:填充剂50份;崩解剂50份;润滑剂5份。
19.较佳地,所述辅料包括以下质量份数的组分:填充剂50份;崩解剂30份;润滑剂27.5份。
20.在本发明某些优选实施方案中,所述辅料包括以下质量份数的组分:填充剂80-100份;润滑剂1-10份。
21.较佳地,所述辅料包括以下质量份数的组分:填充剂100份;润滑剂5份。
22.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:淀粉75份;羧甲基淀粉钠25份;硬脂酸镁5份。
23.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:淀粉75份;交联聚维酮25份;硬脂酸镁5份。
24.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:淀粉50份;交联聚维酮50份;硬脂酸镁5份。
25.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:淀粉47.5份;交联聚维酮30份;二氧化硅25份,硬脂酸镁份2.5份。
26.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:淀粉100份;硬脂酸镁5份。
27.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:微晶纤维素100份;硬脂酸镁5份。
28.在本发明一具体实施方案中,所述辅料包括以下质量份数的组分:微晶纤维素50份;淀粉50份;硬脂酸镁5份。
29.本发明提供了一种温胃阿亚然及片的制备方法,其包括采用所述用于温胃阿亚然及片的片芯原料制备片芯。
30.较佳地,所述制备片芯包括以下步骤:
31.(1)将所述活性成分a混合、粉碎、过筛,记为细粉a;
32.(2)将所述活性成分b加水煎煮,过滤,合并滤液并浓缩,记为浸膏b;
33.其中(1)和(2)的顺序不分先后;
34.(3)向所述浸膏b中加入所述细粉a及所述填充剂、部分所述崩解剂,混匀,制粒,干燥;
35.(4)再加入所述润滑剂和剩余所述崩解剂,混匀,压片,得所述片芯。
36.步骤(1)中,所述混合可采用本领域常规的混合方法。
37.步骤(1)中,所述粉碎可采用本领域常规的粉碎方法,在本领域常规使用的粉碎机中进行。所述过筛较佳地过100目筛。
38.步骤(2)中,较佳地,所述加水的加水量较佳地为所述穆库没药的质量的6-12倍,更佳地为8倍。
39.步骤(2)中,较佳地,所述煎煮的次数为3次。所述煎煮的时间为每次一小时。
40.步骤(2)中,所述过滤可采用本领域常规的过滤方法。
41.步骤(2)中,所述浓缩可采用本领域常规的浓缩方法。
42.步骤(2)中,较佳地,所述浸膏b的相对密度较佳地为1.0-1.15g/ml。
43.步骤(3)中,所述制粒可采用本领域常规的制粒方法进行,较佳地为湿法制粒,更佳地为采用乙醇水溶液进行所述湿法制粒。其中,所述乙醇水溶液的浓度较佳地为80%。
44.步骤(3)中,所述干燥可采用本领域常规的干燥方法,例如烘干。所述干燥的温度较佳地为55~65℃,更佳地为60℃。
45.步骤(3)中,所述干燥后一般还包括过筛步骤,使得到的颗粒具有均匀的粒径。所述过筛后颗粒的粒径较佳地为16~50目,更佳地为16目。
46.步骤(3)中,所述部分所述崩解剂的质量占所述崩解剂的总质量的百分比为0~100%。步骤(3)的所述部分所述崩解剂与步骤(4)的所述剩余所述崩解剂的质量总和等于所述崩解剂的总质量。
47.步骤(3)中,当所述部分所述崩解剂的质量占所述崩解剂的总质量的百分比为0时,是指所述崩解剂在步骤(3)中不添加,而只在步骤(4)中添加,称为外加法。
48.步骤(3)中,当所述部分所述崩解剂的质量占所述崩解剂质量的百分比为100时,是指所述崩解剂只在步骤(3)中添加,而在步骤(4)中不添加,称为内加法。
49.步骤(3)当所述部分所述崩解剂的质量占所述崩解剂质量的百分比既不为0,也不为100时,是指所述崩解剂既在步骤(3)中添加,也在步骤(4)中添加,称为内外加法。
50.步骤(4)中,所述压片可采用本领域常规的压片方法,在本领域常规的压片机中进行即可。
51.本发明中,所述的温胃阿亚然及片的制备方法较佳地还包括包衣。
52.本发明中,所述包衣可采用本领域常规的包衣方法进行。
53.较佳地,所述包衣包括以下步骤:
54.(1)制备所述包衣的原料的水溶液作为包衣液;并且
55.(2)将所述片芯加至包衣锅中,喷入所述包衣液,控制片芯增重。
56.步骤(1)中,所述包衣液的浓度较佳地为22%,百分比为所述包衣的所述原料占所述包衣液的质量百分比。
57.步骤(1)中,所述包衣的所述原料可采用药剂中常用的包衣原料,较佳地为薄膜包衣预混剂。
58.步骤(2)中,所述片芯增重是指所述包衣质量占所述片芯质量的百分比。所述片芯增重较佳地为1-3%。
59.本发明提供了一种温胃阿亚然及片,其由所述的温胃阿亚然及片的制备方法制备
得到。
60.较佳地,所述温胃阿亚然及片包括片芯和包衣。其中,所述包衣可为本领域常规包衣,较佳地为胃溶型薄膜包衣。
61.本发明中,所述温胃阿亚然及片的规格可为本领域常规,例如每片0.51g。
62.本发明提供了一种所述的温胃阿亚然及片的质量控制方法,其测定芦荟苷含量,每片所述温胃阿亚然及片中芦荟苷含量不少于17mg。
63.本发明中,较佳地,所述芦荟苷含量的测定方法为照高效液相色谱法测定:
64.(1)色谱条件:色谱柱:shimadzu c
18
(4.6
×
150mm,5μm);流动相:乙腈-水(24:76);检测波长:359nm;流速:1.0ml/min;柱温:25~40℃,进样量由自动进样器定量环控制为10μl;理论塔板数按芦荟苷峰计不应低于2000;
65.(2)对照品溶液的制备:取芦荟苷对照品适量,精密称定,加甲醇溶解,得对照品溶液;
66.(3)供试品溶液的制备:取所述的温胃阿亚然及片,除去所述包衣,研细,取粉末适量,精密称定,置棕色量瓶中,加甲醇,超声处理(59khz)15~60min,放冷,用所述甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;
67.(4)测定:按进样量分别吸取所述对照品溶液与所述供试品溶液,注入所述高效液相色谱仪,记录色谱图并计算含量。
68.步骤(1)中,所述高效液相色谱法采用的所述柱温较佳地为40℃。
69.步骤(2)中,所述对照品溶液的质量浓度较佳地为0.005g/ml。
70.步骤(3)中,所述供试品溶液中,所述温胃阿亚然及片在所述甲醇中的质量浓度较佳地为0.00065-0.0011g/ml,更佳地为0.00077g/ml。
71.步骤(3)中,所述超声处理的时间较佳地为30min。
72.步骤(3)中,所述棕色量瓶的容量较佳地为100ml。
73.步骤(3)中,所述甲醇的体积较佳地为70ml。
74.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
75.本发明所用试剂和原料均市售可得。
76.本发明的积极进步效果在于:
77.1.本发明优化了制剂处方,产品硬度大,稳定性好和可加工性好。进一步地,经过包衣得到的片剂,具有改善外观、防潮性好、稳定性好、和改善患者服用顺应性差的优点。本发明的温胃阿亚然及片对于功能性便秘的患者,能有效缓解排便艰难、不畅。
78.2.本发明的温胃阿亚然及片的制备方法中,工艺参数确切有利于生产的标准化操作和产品质量的控制;操作易成型,工艺简单,样品存放更稳定;制备工艺稳定,可以有效控制生产过程,适合大批量车间生产。
79.3.本发明通过芦荟中芦荟苷含量测定对温胃阿亚然及片进行质量控制,可以有效保证药品安全性和有效性。对每片所述温胃阿亚然及片中芦荟苷的标准定为含量不少于17mg,提高了温胃阿亚然及片质量控制标准;另外,该质量控制方法精密度高、稳定性、重现性好回收率高,从而能保证药品的质量均一性,可有效控制产品质量,使生产过程能得到有效控制。总之,本发明的质量控制方法是一种快速简便、安全可靠的评价方法。
附图说明
80.图1为质量控制实施例的色谱条件中检测波长的选择实验中芦荟苷对照品的紫外扫描图谱。
81.图2为质量控制实施例的线性关系试验中芦荟苷浓度和峰面积的线性关系图。
82.图3为质量控制实施例的专属性试验中芦荟苷对照品hplc图谱。
83.图4为质量控制实施例的专属性试验中供试品hplc图谱。
84.图5为质量控制实施例的专属性试验中阴性样品hplc图谱。
具体实施方式
85.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
86.以下实施例和对比例中采用的实验材料和实验仪器如下:
87.1、实验材料
88.淀粉:安徽山河药用辅料股份有限公司,产品标准:《中国药典》2010年版二部。
89.交联聚维酮:安徽山河药用辅料股份有限公司,产品标准:《中国药典》2010年版二部。
90.硬脂酸镁:安徽山河药用辅料股份有限公司,产品标准:《中国药典》2010年版二部。
91.二氧化硅:安徽山河药用辅料股份有限公司,产品标准:《中国药典》2010年版二部。
92.胃溶型薄膜包衣预混剂:北京英茂药业有限公司。
93.芦荟苷对照品:中国药品生物制品检定所。
94.色谱甲醇:fisher chemical。
95.色谱乙腈:fisher chemical。
96.2、实验仪器
97.bs124s型电子天平(北京赛多利斯仪器系统有限公司)。
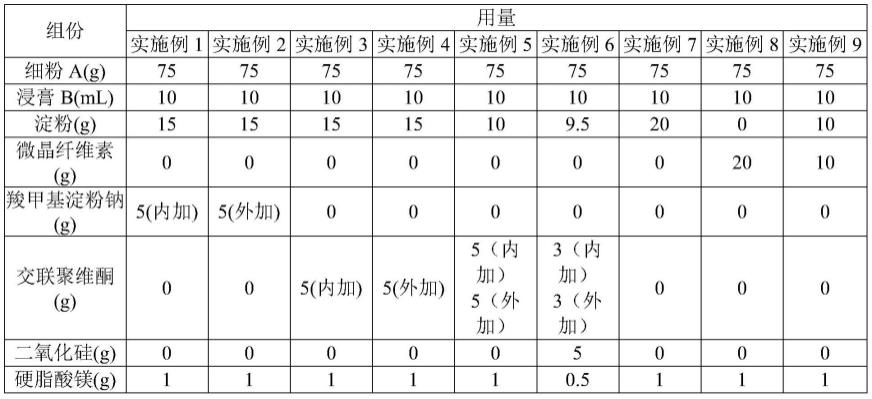
98.dt500a型电子计数天平(常熟市金羊砝码仪器有限公司金羊天平仪器厂)。
99.dfy-300摇摆式高速中药粉碎机(温岭市大德中药机械有限公司)。
100.dztw型调温电热套(北京市光明医疗仪器厂)。
101.hn101-2电热鼓风干燥箱(南通沪南科学仪器有限公司)。
102.vfp-7型旋转式变速压片机(常州市龙城晨光药化机械有限公司)。
103.ypj-200a型片剂硬度仪(上海黄海药检仪器有限公司)。
104.ft-2000a脆碎度检查仪(天津大学无线电厂)。
105.zb-1d型智能崩解仪(天津大学精密仪器厂)。
106.jj-1增力电动搅拌器(金坛市医疗仪器厂)。
107.by-400型糖衣机(江苏泰兴中制药机械厂)。
108.色谱柱shimadzu c
18
(4.6
×
150mm,5μm)。
109.制备实施例1-9
110.按照如下制备过程制备实施例1-9的温胃阿亚然及片的片芯,以下用量为1个处方量的五分之一,其中细粉量为药材粉碎损失后得量:
111.表1.实施例1-9的制备配方
[0112][0113]
按照以下步骤制备温胃阿亚然及片的片芯:
[0114]
(1)按照质量比为200:40:57:97称取活性成分a的各组分,即芦荟、菟丝草、药西瓜和盒果藤,混合,在粉碎机中粉碎,过100目筛,记为细粉a;
[0115]
(2)按照活性成分a和活性成分b的质量比394:50称取穆库没药,向穆库没药加如8倍量的水,煎煮3次,每次一小时,过滤,合并滤液并浓缩,记为浸膏b;浸膏b的相对密度为1.06g/ml;
[0116]
(3)按照表1的配方,向浸膏b中加入细粉a及填充剂、部分崩解剂,混匀,采用80%的乙醇水溶液进行湿法制粒,经烘箱60℃烘干20分钟;将颗粒过筛,过筛后颗粒的粒径为16目;
[0117]
(4)再加入润滑剂和剩余崩解剂,混匀,采用压片机进行压片,得片芯。
[0118]
制备实施例10
[0119]
原标准未要求包衣,但片芯味极苦,并且服用量较大,每次服用3~5片,这会使患者服用顺应性降低,另外考虑到本片芯的吸湿性,为增加其稳定性,故研究制备包衣。
[0120]
本实施例10的包衣按照以下步骤制得:
[0121]
(1)取1只500ml烧杯,加入173ml蒸馏水,置搅拌器上。开启搅拌器,调节转速使液面刚好形成一个漩涡,按照用量称取38g胃溶型薄膜包衣预混剂,缓慢加入烧杯中水形成的漩涡内,加入完毕后,调整转速使不出现旋涡为止,搅拌45分钟,即得。将配好的包衣液溶液转移至喷雾枪内,备用。所述包衣液的浓度为18%,百分比为包衣原料占包衣液的质量百分比。
[0122]
(2)将按实施例6的配方及制备方法制得的片芯1kg置于包衣锅中,打开热风,调整转速,预热至片面温度约为40-50℃;打开压缩空气开关,调整包衣液的流速和空气压力,使成雾状;对准片床,均匀喷射,直至包衣液喷完。关闭压缩空气,片面吹干后,关闭热风,降温,出片,即得。
[0123]
制得的片芯增重=包衣质量/片芯质量=(173g+38g)/1000g=2.11%
[0124]
效果实施例1
[0125]
测定制备实施例1-9所制得的温胃阿亚然及片的片芯的硬度、脆碎度、崩解时限等性能,结果见表2。
[0126]
表2.实施例1-9的片芯性能结果
[0127][0128]
由以上结果可得出,上述实施例1-9制得的片芯效果从硬度、脆碎度、崩解时间来说,均达到了标准要求。
[0129]
更优地,从实施例7、8、9可以看出,三者制备的片芯的硬度、脆碎度、崩解时间效果相当,从成本考虑,实施例2中加入的填充剂微晶纤维素成本较高,选择淀粉可作为更优的填充剂。
[0130]
更优地,从实施例7和实施例3可以看出,实施例3中加入崩解剂交联聚维酮,相比实施例7,实施例3制得片芯的崩解时间显著缩短,硬度也有所提高;
[0131]
更优地,从实施例3、实施例4和实施例5可以看出,实施例3中的交联聚维酮属于内加法,实施例4中的交联聚维酮属于外加法,实施例5的交联聚维酮属于内外加法,实施例5相对于实施例3和实施例4制得的片芯崩解时间显著缩短,硬度更高,脆碎度更低。
[0132]
另外,从实施例5和实施例6可以看出,在都添加润滑剂硬脂酸镁条件下,实施例6比实施例5多加了二氧化硅压片,实施例6片芯的硬度显著提高,并且崩解时间也可控制在合格范围内。
[0133]
从片面光滑、磨损程度,是否存在麻点、裂片以及崩解时间等因素综合考察实施例10的包衣效果。本实施例10制得的薄膜包衣片面光滑,磨损程度小,麻点、裂片等坏片现象少,成功率高。崩解时间30分钟,崩解延时小。
[0134]
效果实施例2
[0135]
按照实施例10对片芯包衣的工艺进行了连续3个批次的中试放大生产,中试规模为100个处方量,并对这对三批中试样品进行了6个月的加速(温度40
±
2℃,相对湿度75
±
5%)和6个月的长期(温度25
±
2℃,相对湿度60
±
10%)稳定性考察,考察项包括:性状、鉴别、崩解时限、含量测定、微生物限度检查,各项测定指标均未见明显变化,说明本品生产工艺合理,药品质量稳定,标准可控。
[0136]
效果实施例3
[0137]
本实施例对本发明温胃阿亚然及片治疗便秘功能实验
[0138]
1对象和方法:
[0139]
(1)采用本发明实施例10工艺制备的温胃阿亚然及片作为受试样品,0.51g/片。人体推荐用量为每日2次,每次3片,服用量为3.06g/日。
[0140]
(2)选择符合以下条件的人群作为受试人群:
[0141]
a.参照《便秘中医诊疗专家共识意见》(2017年版)标准:患者入组前存在排便次数减少,即随机化前1周自主排便次数<3次;
[0142]
b.年龄18-65周岁(含18及65),男女不限;
[0143]
并且排除以下人群:
[0144]
a.消化道器质性病变(如肿瘤、克罗恩病、消化道结核等)或其他累及消化道的系统疾病(如神经肌肉病变、神经精神障碍、代谢内分泌障碍)所致便秘者;
[0145]
b.出口梗阻型便秘或肛门病变引起的排便障碍者;
[0146]
c.药物因素所致便秘,或其他明确病因的继发性便秘者;
[0147]
d.伴有肠易激综合征或大便潜血实验阳性者;
[0148]
e.筛选前6个月内接受过腹部、骨盆或腹膜后手术者;
[0149]
f.筛选前3个月内有反酸、消化道溃疡、胃食管反流病等胃酸分泌过多引起的相关症状或疾病者;
[0150]
g.随机化前3天使用过治疗便秘药物者;
[0151]
h.实验室安全性指标:alt、ast≥正常值上限1.5倍,cr>正常值上限;
[0152]
i.合并有肿瘤或严重的心脑血管、肝、肾、内分泌、造血及神经系统严重原发疾病者,伴有严重精神疾病患者;
[0153]
j.对试验药物组成成分过敏者;
[0154]
k.试验期间处于生理期妇女,妊娠或计划妊娠妇女,哺乳期妇女;
[0155]
(3)实验设计与分组:将受试人群随机分为实验组和对照组,试验组:温胃阿亚然及片试验药,规格:0.51g/片,由新疆维吾尔药业有限责任公司提供;对照组:温胃阿亚然及片安慰剂,规格:0.51g/片,由新疆维吾尔药业有限责任公司提供。
[0156]
(4)给药方法与周期:
[0157]
服药方法:口服,一次3片,一日2次,连续服用6次(约3天),饭后2小时服用。
[0158]
停药标准:女性如遇生理期,停止服用试验药物;服药后日排便次数>4次,停止服用试验药物。
[0159]
2.观察指标:
[0160]
2.1主要疗效指标
[0161]
受试者首次服药后24h内发生完全自主排便比例;(完全自主排便(complete spontaneous bowel movement,csbm)定义为:不服用补救性泻药或手法辅助情况下的自主地且具有完全排尽感的排便。(本试验中,排便前24内未服用补救性泻药或其他辅助治疗,认为是自主排便))
[0162]
3.结果分析
[0163]
主要疗效指标:
[0164]
受试者首次服药后24h内发生完全自主排便比例。
[0165]
按服药后24h内是否发生完全自主排便分别计算例数和百分数。
[0166]
统计分析均采用spss.22版本统计分析软件完成。凡自身对照资料采用配对t检验,两组均数比较采用成组t检验,后者需进行方差齐性检验,对非正态分布或方差不齐的数据进行适当的变量转换,待满足正态方差齐性后,用转换的数据进行t检验;若转换数据
仍不能满足正态方差齐性要求,改用t’检验或秩和检验;但变异系数太大如(cv>50%)的资料应用秩和检验。功效指标有效率及总有效率采用x2检验进行检验。四格表总例数小于40,或总例数等于或大于40但出现理论数等于或小于1时,应改用确切概率法。
[0167]
4.实验结果
[0168]
受试人群随机分为实验组和对照组,符合标准者70例,每组35例。受试者试验前检查项如下:
[0169]
(1)体格检查、生命体征(心率、呼吸、体温和血压)
[0170]
(2)实验室检查:大便常规+潜血实验、血常规(hgb、rbc、wbc、plt)、尿常规(glu、pro、leu、ery)、肝功能(alt、ast、tbil、alp、γ-gt)、肾功能(cr、bun)、血电解质(na+,k+,cl-,ca++,ph),血妊娠试验。
[0171]
(3)心电图检查
[0172]
检查结果均在正常范围,分组情况见表3,两组患者年龄、性别、病程、便秘情况均无明显差异(p>0.05),具有可比性。受试者服用药物前后精神、睡眠、饮食、大小便、血压等无明显变化。一般资料比较如表3所示。
[0173]
表3两组患者情况
[0174]
项目试验组对照组例数3535男/女13/2212/23
[0175]
服用试验药后疗效结果如表4所示
[0176]
表4两组数据对比情况
[0177][0178]
由以上实验结果可以看出,70例符合要求的便秘受试者,随机分为试验组和对照组,试验组按要求服用本发明药物温胃阿亚然及片3天后,35例中,总有效21例,总有效率80%。服用药物前后,试验病例除便秘外的各项检查指标均在正常范围,说明本发明药物对受试者身体健康无不良影响;在服用过程中未观察到过敏及其它不良反应,本发明药物温胃阿亚然及片具有治疗便秘的作用。
[0179]
质量控制实施例
[0180]
一、建立质量控制方法
[0181]
仪器与试剂:
[0182]
色谱柱shimadzu c
18
(4.6
×
150mm,5μm)。
[0183]
芦荟苷对照品:中国药品生物制品检定所
[0184]
色谱甲醇:fisher chemical
[0185]
色谱乙腈:fisher chemical
[0186]
供试品:温胃阿亚然及片,参照实施例10的工艺进行制备。
[0187]
阴性样品:缺芦荟温胃阿亚然及片片芯,参照实施例10的工艺进行制备,但缺少芦荟药材。
[0188]
1、供试品溶液的制备
[0189]
(1)提取溶媒及提取方式的选择
[0190]
芦荟苷易溶于吡啶,溶于冰乙酸、甲醇、丙酮、水及乙醇中,考虑到芦荟苷的溶解性及其在流动相中的分配,参照药典方法选择甲醇作为溶媒,采用超声提取的方式来提取样品中的芦荟苷。
[0191]
(2)提取浓度的选择
[0192]
设置3组实验,按照实施例10制备温胃阿亚然及片,除去包衣,取同一批样品粉末3份,每份55mg,精密称重,分别置100ml量瓶中,分别加入甲醇50ml、70ml、90ml,超声提取30分钟,放冷,用甲醇定容至刻度,摇匀,用微孔滤膜(0.45μm)滤过,弃去初滤液,取续滤液注入液相仪中测定,计算含量,结果见表5。
[0193]
表5供试品溶液的提取浓度测定结果
[0194]
编号称样量(g)溶剂体积(ml)峰面积含量(mg/g)10.05425060124473.3920.05367060612974.8130.05889066364474.67
[0195]
结论:从表5可以看出,不同提取浓度时测定的芦荟苷含量相差很小,优选测定含量相对较高的0.00077g/ml作为提取浓度。
[0196]
(3)提取时间的选择
[0197]
取步骤(2)中同一批样品粉末4份,每份55mg,精密称重,分别置100ml量瓶中,各加入甲醇70ml,分别超声处理15、30、45和60分钟,放冷后,用甲醇稀释至刻度,摇匀,用微孔滤膜(0.45μm)滤过,弃去初滤液,取续滤液注入液相仪中测定,计算含量,结果见表6。
[0198]
表6供试品溶液的提取时间测定结果
[0199]
编号称样量(g)超声时间(min)峰面积含量(mg/g)10.05631564422375.5420.05613066785378.5930.05884566125074.2440.05876065375773.52
[0200]
结论:从表6可以看出,不同提取时间测定的芦荟苷含量相差很小,为了保证提取充分并节约时间,优选超声提取30min。
[0201]
最终确定的供试品溶液制备方法为:按照实施例10制备的温胃阿亚然及片后,取20片,除去包衣,精密称定,研细,取约55mg,精密称定,置100ml棕色量瓶中,加甲醇70ml,超声处理(59khz)30min,放冷,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。
[0202]
2、色谱条件
[0203]
(1)检测波长的选择
[0204]
经过对芦荟苷对照品溶液进行紫外扫描发现,在359
±
2nm处有最大吸收,见图1,故选择359nm作为检测波长。图1为质量控制实施例1的色谱条件中检测波长的选择样品的紫外扫描图谱。
[0205]
3、线性关系试验
[0206]
精密称取芦荟苷对照品18.7mg,置100ml量瓶中,加甲醇溶解并定容至刻度,摇匀,
使成浓度为187μg/ml的溶液,作为对照品储备液。精密量取对照品储备液1、2、3、4、5、6ml,分别置10ml量瓶中,加甲醇至刻度,摇匀,制成浓度分别为18.7、37.4、56.1、74.8、93.5、112.2μg/ml的溶液,精密吸取上述对照品系列溶液各10μl,注入液相色谱仪,记录峰面积。以进样浓度(μg/ml)为横坐标,峰面积为纵坐标绘制标准曲线,得标准曲线方程为:y=15024x+3843.5,r=0.9998。结果表明,芦荟苷在18.7ug/ml~112.2ug/ml范围内呈良好的线性关系,结果见表7和图2。图2为质量控制实施例1的线性关系试验中芦荟苷浓度和峰面积的线性关系图。
[0207]
表7芦荟苷浓度和峰面积关系表
[0208][0209]
4、精密度试验
[0210]
吸取步骤3中的对照品溶液(56.1μg/ml)溶液10μl,重复进样6次,测得芦荟苷峰面积分别为:852307、847974、847657、844766、847394、845168。计算rsd值(n=6)为0.32%。结果表明,精密度良好(rsd《2%),结果见表8。
[0211]
表8对照品芦荟苷峰面积和rsd数据
[0212][0213]
5、稳定性试验
[0214]
取同一份供试品溶液分别在制备后0、2、4、6、8、24h进行测定,计算rsd(%),结果表明样品在24h内稳定(rsd《4%),见表9。
[0215]
表9供试品芦荟苷峰面积和rsd数据
[0216][0217]
6、重复性试验
[0218]
分别精密称取供试品7份,按供试品溶液的制备和测定方法进行操作,计算芦荟苷的含量,结果见表10。由表10可见,重复性良好(rsd《4%)。
[0219]
表10供试品芦荟苷含量和rsd数据
[0220][0221][0222]
7、回收率试验
[0223]
釆用标准添加法测定回收率。取供试品样品粉末10份,每份0.03g,精密称重。以第一份为空白,其余分三组,分别精密加入浓度为1.122mg/ml的对照品溶液,第一组每份加入1ml、第二组每份加入2ml、第三组每份加入3ml,挥干甲醇。每份样品均按照供试品溶液制备方法制备样品溶液,吸取各样品溶液10μl注入液相仪中测定,计算各样品含量与加样回收率,结果见表11。由表11可知,回收率良好(85%~110%,rsd《4%)
[0224]
表11样品溶液含量和加量回收率数据
[0225][0226]
8、专属性试验
[0227]
供试品溶液:取供试品20片,除去包衣,精密称定,研细,取约55mg,精密称定,置100ml棕色量瓶中,加甲醇70ml,超声处理(59khz)30min,放冷,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。
[0228]
阴性样品对照溶液:参照实施例10的工艺进行制备,但缺少芦荟药材。按照供试品溶液的制备方法制成阴性样品溶液。
[0229]
精密吸取对照品溶液、供试品溶液、阴性样品对照溶液各10μl,注入高效液相色谱仪,测定,即得。结果见图3~5,图3为质量控制实施例1的专属性试验中芦荟苷对照品hplc
图谱,图4为质量控制实施例1的专属性试验中供试品hplc图谱,图5为质量控制实施例1的专属性试验中阴性样品hplc图谱。可见供试品色谱相应色谱峰的光谱与对照品芦荟苷一致,并且阴性无干扰。
[0230]
9、检测限试验
[0231]
(1)芦荟苷对照品
[0232]
芦荟苷对照品溶液的制备:精密称取芦荟苷对照品适量,置棕色量瓶中,加甲醇制成每1ml含60μg的溶液。
[0233]
精密吸取芦荟苷对照品溶液,加甲醇溶液逐级稀释,测定色谱图,使芦荟苷的信噪比约为2:1或3:1,即得芦荟苷对照品检测限溶液。
[0234]
结果见表12,芦荟苷对照品的检测限为0.01566μg/ml。
[0235]
表12芦荟苷对照品的检测限值
[0236]
名称浓度(μg/ml)s/n检测限0.015662.2
[0237]
二、测定温胃阿亚然及片中芦荟苷含量
[0238]
(1)色谱条件:流动相:乙腈-水(24:76);检测波长:359nm;流速:1.0ml/min;柱温:40℃,进样量由自动进样器定量环控制为10μl;理论塔板数按芦荟苷峰计不应低于2000;
[0239]
(2)对照品溶液的制备:精密称取芦荟苷对照品适量,置棕色量瓶中,加甲醇制成每1ml含60μg的溶液,即得;
[0240]
(3)供试品溶液的制备:取供试品20片,除去包衣,精密称定,研细,取约55mg,精密称定,置100ml棕色量瓶中,加甲醇70ml,超声处理(59khz)30min,放冷,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;
[0241]
(4)测定:分别精密吸取对照品溶液与供试品溶液各10μl,注入高效液相色谱仪,记录色谱图并计算含量按照以上测定方法对参照实施例10制备的温胃阿亚然及片的10批样品进行测定,结果见表13。
[0242]
表13十批样品测定结果(mg/片)
[0243]
样品批号含量(mg/片)11060137.2111060241.1211060340.6511060438.0611060538.2211060637.6811060736.6011100129.3411100231.3711100329.65
[0244]
根据上表测定结果,将温胃阿亚然及片中每片含量,以芦荟苷计,定为每片不得少于17mg/片。
[0245]
以上所述仅为本发明的实施例,对本发明而言仅仅是说明性的,而非限制性的。本
专业技术人员理解,在本发明权利要求所限定的精神和范围内可对其进行许多改变,修改,甚至等效,但都将落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1