眼部递送装置及其制备方法
1.本技术涉及药物递送技术领域,尤其是涉及眼部递送装置及其制备方法。
背景技术:
2.眼部复杂的屏障结构(角膜、结膜、血液-房水等结构)以及清除系统导致眼部用药的生物利用度通常低于5%。因此,需要发展新型递送系统输运眼科药物以提高治疗效果。电穿孔是在细胞或组织水平实现外源物质递送的一种技术。通过瞬时高电场作用,提高细胞膜的通透性,从而促进细胞对周围介质中外源分子的吸收,由此在细胞内发挥调控以及基因转染的目的。多年来,由于操作简便、安全、高效的特点,电穿孔技术被广泛应用于生物医疗领域。然而,目前的市售电极直接作用于眼部时,电穿孔效率和物质递送效率低。同时这类电极需要施加高电压进行电穿孔,直接与人眼接触容易造成严重的电损伤,反而违背了治疗的本意。因此,有必要提供一种能够实现安全、高效递送的眼部递送装置。
技术实现要素:
3.本技术旨在至少解决现有技术中存在的技术问题之一。为此,本技术提出一种眼部递送装置,能够实现安全、高效递送的物质递送。
4.本技术还提出一种眼部递送装置的制备方法。
5.本技术的第一方面,提供眼部递送装置,该眼部递送装置包括电穿孔组件,电穿孔组件包括:
6.支撑部,支撑部包括相对设置且为曲面的第一表面和第二表面,第一表面为凸面,第二表面为凹面;
7.电极图案,电极图案位于第二表面,电极图案包含液态金属材料。
8.根据本技术实施例的眼部递送装置,至少具有如下有益效果:
9.本技术所提供的眼部递送装置以支撑部模拟隐形眼镜,同时结合具有强导电性、柔性、可塑性的液态金属材料,在支撑部的第二表面上形成导电电路,消除了现有刚性电极与角膜之间可能存在的较大的机械差异,实现了与角膜的共形接触,赋予其原位电穿孔的功能,有效提高了电穿孔的效率。而且,由于液态金属材料的高导电性,可以在较低的电压下完成电穿孔,避免了可能对眼部造成的电损伤,从而达成了安全、高效的眼部活体原位电穿孔。
10.在本技术的一些实施方式中,第二表面的曲率半径为5~12mm。优选地,第二表面的曲率半径为6~10mm,7~9mm,7~8mm。正常人的角膜曲率半径通常在7.8mm左右,而近视或远视人群由于角膜的形状、大小位置等异常而使其曲率半径发生变化。在本技术中,将第二表面的曲率半径控制在上述范围内,可以在将其覆盖于眼球角膜上时形成更好的共形接触,从而提高电穿孔效率,实现更好的物质递送效果。
11.在本技术的一些实施方式中,第一表面的曲率半径为4~15mm。
12.在本技术的一些实施方式中,第一表面和第二表面的间距为0.01~1mm。优选地,
第一表面和第二表面的间距为0.01~0.1mm,0.01~0.07mm。第一表面和第二表面的间距也可以指代支撑部的厚度,当两者的间距或支撑部的厚度满足以上条件时,受试者在将该电穿孔组件佩戴于眼部时具有一定的舒适性,而间距越大,受试者的不适感就可能越强烈。
13.在本技术的一些实施方式中,电极图案包括:
14.第一电极,第一电极包括具有缺口的第一环状部,第一环状部位于第二表面的外沿;
15.第二电极,第二电极包括由缺口向内的直线部和与直线部相连的第二环状部,第二环状部的半径小于第一环状部的半径。
16.通过上述电极图案的结构设置,可以使其以有效的方式进行电穿孔。
17.在本技术的一些实施方式中,第一表面和第二表面的曲面分别独立选自球面、椭球面、多个不同曲率半径的弧面组成的连续曲面等其中任一种。可以理解的是,球面或椭球面并不限定第一表面或第二表面为完整的球面或椭球面,同样也可以是以完整的球面或椭球面截取其中部分形成的曲面或其它近似的情况。
18.在本技术的一些实施方式中,支撑部包含聚合物材料。
19.在本技术的一些实施方式中,聚合物材料选自聚甲基丙烯酸甲酯、聚醋酸丁酸纤维素、聚硅酸盐、聚甲基丙烯酸-2-羟乙酯、聚二甲基硅氧烷、聚对苯二甲酸乙二醇酯、聚原酸酯中的至少一种。上述聚合物材料具有良好的生物相容性,因而优选作为电穿孔组件的支撑部使用。
20.在本技术的一些实施方式中,液态金属材料包括镓、镓铟合金、镓铟锡合金中的至少一种。
21.在本技术的一些实施方式中,第二表面负载有递送物质。
22.在本技术的一些实施方式中,眼部递送装置还包括滴注组件,滴注组件包括用于容纳递送物质的滴注室,滴注组件被配置为能够将递送物质滴入角膜表面或注入角膜内。
23.向眼部递送的外源物质包括大分子药物、质粒、蛋白以及核酸(如mrna、sirna)等多种不同类型。从递送物质本身的性质考虑,对于质粒、蛋白、大分子药物等较为稳定的物质,可以通过诸如冻干等方式以粉末形态负载于第二表面,在眼部递送装置的电穿孔组件覆于角膜位置时直接电穿孔将其导入;对于其它以冻干形式可能会造成污染或因为易降解导致浓度下降影响穿孔后的疗效的递送物质,可以通过额外设置的滴注组件直接滴加到角膜表面或直接注入角膜内之后再进行电穿孔实现递送。
24.本技术的第二方面,提供前述眼部递送装置的制备方法,该制备方法包括以下步骤:
25.提供支撑部;
26.将液态金属油墨通过印刷形成电极图案,利用弹性材料将电极图案直接印刷或转印到支撑部,干燥后得到电穿孔组件。
27.本技术实施例所提供的制备方法通过印刷形成电极图案,再通过弹性材料作为柔性基底材料将电极图案直接印刷或转印到支撑部的第二表面的曲面上,解决了液态金属曲面图案化的难题。
28.在本技术的一些实施方式中,还包括在干燥后通过细胞外基质对电极图案进行修饰的步骤。通过细胞外基质对电极图案进行修饰,从而在稳定电穿孔组件的支撑部和电极
图案的同时提高其细胞和组织相容性。
29.在本技术的一些实施方式中,细胞外基质包括胶原蛋白、纤连蛋白、层粘蛋白中的至少一种。利用这些蛋白材料对第二表面及其上的电极图案进行修饰,有效改善其相容性,进一步避免在第二表面及其上的电极图案接触眼球时出现毒性反应或炎症反应等。
30.在本技术的一些实施方式中,弹性材料为硅胶。
31.在本技术的一些实施方式中,印刷方式为丝网印刷、喷墨打印、3d打印等其中至少一种。
32.综上所述,目前市售电转仪所用电极大多为刚性金属电极,此类电极与细胞、组织之间存在较大的机械差异,并且与角膜不能实现共形接触,眼部电穿孔效率低。同时该类电极需要施加高电压进行电穿孔,由此会造成严重的电损伤。而本技术实施例所提供的眼部递送装置利用液态金属的强导电性以及可塑性,通过赋予类似隐形眼镜的支撑部以电穿孔功能,以此引入外源大分子药物、基因或蛋白等调节眼部组织,从而可以用来治疗眼科疾病。另外本技术实施例中所使用的材料满足柔软、导电的特性,能实现与角膜共形接触,达到电穿孔高效递送外源物质的效果,实现眼科疾病高效治疗的目的。
33.此外,常规技术通常是将材料图案化于平面,但这与图案化于曲面有明显差异,难于将液态金属曲面化,存在很大的技术难度,而本技术实施例通过诸如丝网印刷的方式以及转印技术将液态金属图案化于曲面,解决了上述问题。
34.本技术的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本技术的实践了解到。
附图说明
35.图1是本技术的一个实施例中眼部递送装置的电穿孔组件的截面侧视图。
36.图2是本技术的一个实施例中眼部递送装置的电穿孔组件的俯视图。
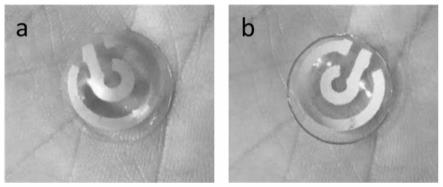
37.图3是本技术的实施例1中眼部递送装置的电穿孔组件的照片,a为上部视图(第一表面),b为下部视图(第二表面)。
38.图4是本技术的实施例2中眼部递送装置对阿霉素的递送结果的荧光照片。
39.图5是本技术的实施例2中眼部递送装置对sirna的递送结果的荧光照片。
40.图6是本技术的实施例2中眼部递送装置对mrna的递送结果的荧光照片。
41.图7是本技术的实施例2中眼部递送装置对质粒的递送结果的荧光照片。
42.图8是本技术的实施例3中眼部递送装置将质粒递送到角膜(a)和结膜(b)的荧光和明场照片。
43.图9是本技术的实施例6中不同电极间距的眼部递送装置对质粒的递送效率的结果,a为大间距电极的荧光照片,b为小间距电极的荧光照片。
44.附图标记:支撑部100、第一表面110、第二表面120、电极图案200、第一环状部210、直线部221、第二环状部222。
具体实施方式
45.以下将结合实施例对本技术的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本技术的目的、特征和效果。显然,所描述的实施例只是本技术的一部分实施
例,而不是全部实施例,基于本技术的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本技术保护的范围。
46.下面详细描述本技术的实施例,描述的实施例是示例性的,仅用于解释本技术,而不能理解为对本技术的限制。
47.在本技术的描述中,若干的含义是一个以上,多个的含义是两个以上,大于、小于、超过等理解为不包括本数,以上、以下、以内等理解为包括本数。如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
48.本技术的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本技术的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
49.参考图1和图2,示出了本技术的一个实施例的眼部递送装置,该眼部递送装置包括电穿孔组件,该电穿孔组件包括支撑部100和电极图案200。支撑部100包括相对的第一表面110和第二表面120,第一表面110和第二表面120均为曲面,且第一表面110为凸面而第二表面120为凹面。电极图案200位于第二表面120上,电极图案200中包含作为原料使用的液态金属材料。在本技术的实施例中的眼部递送装置中,以具有曲面的支撑部100作为基底,通过这种曲面设置使其在使用时可以与接触的角膜发生共形接触,相比于现有的电极,能够更加地紧密贴合,从而提高后续电穿孔的效率。此外,由于液态金属材料的高导电性,因而可以在较低的电压下完成电穿孔,从而避免对眼部可能造成的电损伤,进行安全、高效的眼部活体原位电穿孔。
50.为了使支撑部在使用时能够更紧密地与角膜共形接触,支撑部的第二面的曲率半径需要与人眼的角膜曲率半径接近,在其中一些实施方式中,第二表面的曲率半径为5~12mm,例如5.0mm、5.5mm、6.0mm、6.5mm、7.0mm、7.5mm、8.0mm、8.5mm、9.0mm、9.5mm、10.0mm、10.5mm、11.0mm、11.5mm、12.0mm。优选地,第二表面的曲率半径在6~10mm,7~9mm,7~8mm。正常人的角膜曲率半径通常在7.8mm左右,但考虑到近视或远视人群,角膜发生变化,因而将第二表面的曲率半径限制在稍大的范围内使眼部递送装置在面对不同人群时都能够实现较好的共形接触。同理,为了避免第一表面的曲率半径过大或过小使支撑部的厚度过大引起佩戴时的舒适性问题,因而第一表面的曲率半径与第二表面的曲率半径接近,在其中一些具体的实施方式中,第一表面的曲率半径为4~15mm,优选为5~12mm,6~10mm,7~9mm。需要说明的是,上述第一表面和第二表面的曲率半径指的是曲率半径的绝对值,两者接近指的同样是两者的绝对值接近,而并不直接通过曲率半径的正负来表示表面为凸面或凹面。上述曲率半径可以是单一曲面的曲率半径,也可以是多个不同曲率半径的弧面组成的连续曲面中的至少一个弧面的曲率半径。
51.在其中一些实施方式中,第一表面110和第二表面120的曲面分别独立选自球面、椭球面、多个不同曲率半径的弧面所组成的连续曲面等其中的任一种。可以理解的是,球面或椭球面并不限定第一表面或第二表面为完整的球面或椭球面,同样也可以是以完整的球面或椭球面截取其中部分形成的曲面或其它近似球面或近似椭球面的情况。
52.在其中一些实施方式中,第一表面110和第二表面120的间距h为0.01~1mm,具体可以是0.01mm、0.02mm、0.03mm、0.04mm、0.05mm、0.06mm、0.07mm、0.08mm、0.09mm、0.1mm、0.15mm、0.2mm、0.3mm、0.5mm、1mm。优选地,间距h为0.01~0.1mm,0.01~0.08mm,0.01~0.07mm。其中,间距h进一步也可以指第一表面110和第二表面120的中心厚度。
53.电极图案200可以以任意方式进行设计,只要满足利用该电极图案能够在第二表面120附近形成一定的电场并能够在电场施加到细胞上之后改变其通透性完成穿孔和递送即可,例如可以是任选的规则或不规则的阵列或非阵列图案。
54.在其中一些具体的实施方式中,电极图案200包括第一电极210和第二电极220。第一电极210包括具有缺口的第一环状部,第一环状部位于第二表面120的外沿。第二电极220包括由缺口向第一电极210内部方向的直线部221和与直线部221相连的第二环状部222,第二环状部222的半径r2小于第一环状部的半径r1。通过这种电极图案的设置,电穿孔组件中形成的电场更为均匀,不同位置的细胞的通透性的改变程度较为接近,因而可以更均匀地将外源物质递送到细胞内。可以理解的是,为了实现对不同位置细胞的差异化递送,可以改变电极图案的设置(例如相邻的间距、图案结构)、不同位置的电压等因素从而实现更精准的递送效果。
55.在其中一些实施方式中,支撑部的组成材料包含聚合物材料。由于该递送装置主要应用于眼部,因而要求聚合物材料满足一定的生物相容性等基本的安全性要求。在其中一些具体实施方式中,聚合物材料包括但不限于聚甲基丙烯酸甲酯、聚醋酸丁酸纤维素、聚硅酸盐、聚甲基丙烯酸-2-羟乙酯、聚二甲基硅氧烷、聚对苯二甲酸乙二醇酯、聚原酸酯中的至少一种。这些聚合物材料具有良好的生物相容性,因而优选作为电穿孔组件的支撑部使用。此外,为了保证支撑部的力学、生物学方面的性质,还可以选择进一步改性、修饰等处理后的聚合物材料。同时,电极图案所使用的液态金属材料包括镓、镓铟合金、镓铟锡合金等。
56.在其中一些具体的实施方式中,第二表面120上负载有递送物质。而在另一些实施方式中,眼部递送装置还提供滴注组件,滴注组件用来容纳递送物质,例如具有容纳递送物质的滴注室,并在需要电穿孔时,将递送物质从中送出,以诸如滴入患者的角膜表面继而覆盖电穿孔组件使其位于第二表面和角膜之间,或者直接注入到患者的角膜内的方式,然后通过电穿孔组件施加电压进行电穿孔完成递送物质到细胞内的递送。这一眼部递送装置设置多种不同递送方式的原因在于,眼部递送物质的类型存在多种多样,除常规的质粒、蛋白或大分子药物之外,还包括小核酸药物如sirna,然而这类药物不稳定易降解,如果采用冻干的方式直接负载在电极图案上,不仅冻干粉的制备过程耗时长,并且可能引起酶污染,从而造成sirna降解,影响递送效果。而采用本技术实施例所提供的眼部递送装置,可根据不同递送物质的理化性质选择合适的方式,从而最大程度保证递送物质的活性。滴注组件的具体构成例如可以是注射器等结构。
57.本技术还涉及上述眼部递送装置的制备方法,该制备方法包括以下步骤:
58.提供支撑部;
59.将液态金属油墨通过印刷形成电极图案,利用硅胶将电极图案转印到支撑部,干燥后得到电穿孔组件。
60.在其中一些实施方式中,支撑部可以自制或直接购买成品材料,而支撑部的制备可以通过本领域熟知的任意方式进行制备,例如通过模具成型制备支撑部,具体可以将支
撑部的制备原料投加到第一半模中,随后用第二半模与第一半模复合从而将模具闭合,使闭合的模具的模腔中的原料发生聚合,聚合固化完全后从中剥离出支撑部。
61.在其中一些实施方式中,液态金属油墨由液态金属材料与溶剂混合形成,例如将液态金属材料置于溶剂中,超声混匀,得到液态金属油墨。其中的溶剂可任选具有挥发性的液态溶剂,例如挥发性的液态有机溶剂,包括但不限于正癸醇、无水乙醇、松油醇、n,n-二甲基甲酰胺、丙酮等其中至少一种。超声混匀的时间可以是1~10min,具体可以是1min、2min、3min、4min、5min、6min、7min、8min、9min、10min等。
62.在其中一些实施方式中,印刷方式为丝网印刷、喷墨打印、3d打印等其中至少一种。通过以上方式首先形成电极图案,然后通过弹性材料将其直接印刷或转印到支撑部的第二表面,弹性材料可以是任选的能够在支撑部的曲面上直接或间接改变为贴合曲面的形态从而将电极图案印刷或转印到曲面上的材料,具体包括但不限于硅胶材料等。
63.以下结合具体实施例对本技术进行说明。
64.实施例1
65.本实施例提供一种眼部递送装置,该装置包括电穿孔组件,该电穿孔组件的制备过程具体如下:
66.(1)设计用于眼部电穿孔的导电图案
67.参考图2,利用auto cad设计构建了适合于不同角膜大小的圆弧状电极图案。将此电极图案1:1制备成丝网印刷的掩模版,其中第一电极包括具有缺口的第一环状部,第一电极和第二电极的宽度为1mm,间距为2mm,用于后续液态金属油墨的转印。
68.(2)支撑部的制备
69.参考图1和图2的结构选择由凸模和凹模分别作为半模组成的模具,将柔性高分子溶液(本实施例中采用聚二甲基硅氧烷)加入到凹模半模中,随后与凸模半模复合从而将模具闭合,待高分子溶液合固化后,然后将其从模具上剥离,得到支撑部。
70.(3)电极图案的印刷
71.取5g镓铟合金与1ml正癸醇混合,超声4min后,制备得到液态金属颗粒油墨,将所制备的液态金属颗粒油墨通过丝网印刷绘制出电极图案,然后利用硅胶将电极图案直接印刷或转印到步骤2制备的支撑部的第二表面上,转印完将样品置于室温干燥6~12h或者在80℃的环境中干燥10~30min。
72.待液态金属颗粒中的溶剂全部挥发后,在支撑部的第二表面上形成液态金属颗粒组成的图案。
73.(4)纤连蛋白修饰
74.将纤连蛋白溶解于tris缓冲液中得到纤连蛋白溶液(100μg/ml,ph7.4),然后将步骤3中制备的电穿孔组件在37℃条件下浸入其中放置6小时,完成修饰,在稳定电穿孔组件结构的同时提高其细胞和组织相容性。
75.参考图3,是本实施例制备得到的眼部递送装置的照片,左图为上视图(即第一表面的视图),右侧为下视图(即第二表面的视图)。参考图3并结合图1和图2,眼部递送装置包括电穿孔组件,电穿孔组件包括支撑部和电极图案。支撑部具有相对设置且为曲面的第一表面和第二表面,第一表面为凸面,第二表面为凹面,第一表面和第二表面的曲率半径的绝对值在7.5mm左右。电极图案位于第二表面,包括位于第二表面的第一电极和第二电极。其
中,第一电极位于第二表面的外沿,第一电极包括具有缺口的第一环状部,第二电极包括由缺口向内的直线部和与直线部相连的第二环状部,第二环状部的半径小于第一环状部的半径。
76.实施例2
77.电穿孔递送的细胞实验
78.将2
×
107个细胞分散于100μl的电转缓冲液中,分别加入阿霉素、cy5标记的sirna、绿色荧光蛋白mrna以及荧光标记质粒,混匀后加入到实施例1制备的眼部递送装置的第二表面向上形成放置形成的槽中,第一电极和第二电极分别连接延长的电极导线连接电穿孔仪,进行电穿孔实验,然后利用荧光显微镜进行观察,结果分别如图4~7所示,均有明显的红色或绿色荧光出现,表明利用实施例1提供的眼部递送装置可以对大分子药物、蛋白、质粒、核酸等完成递送。
79.实施例3
80.电穿孔递送的角膜/结膜实验
81.解剖新西兰兔以获得离体角膜及结膜。将角膜、结膜分别与荧光标记质粒共孵育,然后参考实施例2所提供的方法放置于实施例1制备的眼部递送装置中,进行电穿孔实验,随后置于培养基中培养48h,利用荧光显微镜进行观察。结果如图8所示,a为荧光显微镜下和明场下的角膜照片,b为荧光显微镜下和明场下的结膜照片。从图中可以看出,角膜和结膜中都有明显的绿色荧光,表明利用实施例1提供的眼部递送装置可以将待递送物质递送到角膜或结膜中。
82.实施例4
83.本实施例提供一种眼部递送装置,与实施例1的区别在于,电极图案的表面负载有待递送的质粒,其制备过程如下:
84.将实施例1制备得到的电穿孔组件进行辐照灭菌,然后滴加60μg/ml质粒溶液2ml于电极图案的表面,然后在-20℃下冻结,随后在冻干机中冷冻干燥后得到负载有质粒的电穿孔组件,该电穿孔组件的第一电极和第二电极用来与电穿孔仪相连接。
85.利用该眼部递送装置进行质粒递送时,可以直接将电穿孔组件以第二表面覆盖于受试者眼中的方式与角膜贴合,然后接通电穿孔仪进行电穿孔,从而将质粒递送到受试者的角膜中。
86.实施例5
87.本实施例提供一种眼部递送装置,与实施例1的区别在于,还包括滴注组件,滴注组件具有容纳递送物质的滴注室。
88.该眼部递送装置在进行递送时,首先将滴注室内的递送物质溶液以滴加或注入的方式滴入角膜表面或注入到角膜/结膜等眼部结构的内部,然后将电穿孔组件以第二表面覆盖于受试者眼中的方式与角膜贴合,随后接通电穿孔仪进行电穿孔,从而将待递送的物质递送到角膜或其它眼部结构中。
89.该眼部递送装置的优势在于,相对于质粒、蛋白等物质,如sirna不稳定易降解,如果采用实施例4中冻干的方式直接负载到电极图案上,不仅制备过程耗时长,而且在负载过程中可能造成酶污染等问题,从而导致sirna降解,使得负载的量远低于预期,进而影响递送和治疗效果。因此,可以针对性的将待递送的物质直接滴入眼部或注射到角膜或其它待
递送的部位,随后将电穿孔组件佩戴于眼部进行眼部电穿孔完成递送。
90.实施例6
91.不同电极图案间距的电穿孔效果比较实验
92.按照实施例1的方式制备眼部递送装置,使r1-r2的值(即电极的间距)分别为2mm和2.5mm,按照实施例3中的方法进行质粒的递送,结果如图9所示,左侧为眼部递送装置的电极间距在2.5mm时递送的荧光照片,右侧为眼部递送装置的电极间距在2mm时递送的荧光照片。从图中可以看出,右侧荧光数量明显高于左侧,表明右侧递送效率明显高于左侧。因此,通过调控电极的间距能够调控电穿孔递送的效率,在一定范围内,电极的间距越小,电穿孔递送效率更高。
93.上面结合实施例对本技术作了详细说明,但是本技术不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本技术宗旨的前提下作出各种变化。此外,在不冲突的情况下,本技术的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1