一种超氧化物歧化酶嵌入硫化锰纳米药物及其制备方法与应用与流程
1.本发明属于帕金森疾病药物技术领域,具体地,尤其涉及一种超氧化物歧化酶嵌入硫化锰纳米药物及其制备方法与应用。
背景技术:
2.超氧化物歧化酶(sod)在炎症治疗以及组织工程材料领域广泛应用,酶固定化技术越来越受到人们越来越多的关注。近些年发展的超氧化歧化酶抗炎中仍然存在问题,如:1.体内易降解;2.酶催化剂醇耐受性较差。
3.目前发展的主要固定化酶技术包括“诱捕”和“单酶纳米粒子”技术,虽然这些固定化酶相比于游离酶具有更高的稳定性,但是他们的活性往往都会降低很多,这主要有以下原因:
4.1)固定化过程中有机溶剂的使用;
5.2)固定材料与蛋白质之间发生的化学反应;
6.3)酶与固定化材料之间的明显传质。
技术实现要素:
7.本发明的目的在于通过绿色高效的仿生矿化方式合成纳米杂化材料sod@mns,该材料显著提高sod酶环境耐受性,提高sod酶活性,能够通过清除自由基实现帕金森疾病的治疗。其技术方案如下:
8.本发明一方面提供了一种超氧化物歧化酶嵌入硫化锰纳米药物,以超氧化物歧化酶作为有机部分,并以mn
2+
和s
2-作为无机部分。
9.本发明另一方面提供了一种超氧化物歧化酶嵌入硫化锰纳米药物的制备方法,包括以下步骤:
10.s1:将mncl2的溶液加入到溶有超氧化物歧化酶的超氧化物歧化酶去离子水分散液中,搅拌均匀;
11.s2:加入na2s溶液孵育,孵育后离心分离;
12.s3:将分离后的产物用去离子水清洗,冻干后储存。
13.进一步地,所述超氧化物歧化酶与mncl2质量比为1:0.075-3,所述超氧化物歧化酶与na2s质量比为1:0.007-2.8。
14.进一步地,mncl2溶液的浓度为30-120mm,na2s溶液浓度为30-120mm。
15.予以说明,在本发明的一个实施例中,mncl2的溶液取0.1-1ml,加入到溶有5-50mg超氧化物歧化酶的10-100ml去离子水中;
16.浓度为30-120mm的na2s溶液取0.15-1.5ml。
17.进一步地,所述s1中,搅拌时间为5-30min。
18.进一步地,所述s1中,孵育温度为3-5℃,孵育时间为20-30h。
19.进一步地,所述s3中,冻干后储存的温度为-15℃
‑‑
20℃。
20.在另一方面,本发明还提供了该无机-有机杂化纳米药物在制备缓解帕金森疾病药物中的应用。
21.与现有的技术相比,本发明具有以下显著优点:
22.本技术方案利用仿生矿化技术以超氧化物歧化酶(sod)作为有机部分,mn
2+
和s
2-作为无机部分合成的sod@mns杂化纳米材料在保留sod活性方面获得了很大的成功,主要因为这种技术合成环境完全绿色(水溶液)。
23.相比与超氧化物歧化酶(sod):
24.通过该种仿生矿化的sod@mns材料具有明显的优于游离sod的酶活性,温度、ph和离子环境稳定性。在生物体内稳定而不易降解,对催化剂醇具有更好的耐受性。
25.通过该种仿生矿化的sod@mns材料由于其更优的酶活性和稳定性,在治疗氧化损伤引起的帕金森疾病小鼠模型方面具有明显优于游离sod酶的效果。
26.生产过程中,无需固定材料,有助于产物保留更佳的生物活性。
附图说明
27.图1是本发明小鼠分组实验部分操作图。
28.图2是本发明的sod-无机杂化纳米药物活性测定数据结果图。
29.图3是本发明的水迷宫实验结果图。
30.图4是本发明中免疫组化分析通过荧光显微镜对组织切片的观察图。
31.图5是本发明的sod@mns的电镜图,表征其形貌。
具体实施方式
32.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
33.以下结合图1-5说明本发明的技术方案,本发明提供了一种超氧化物歧化酶嵌入硫化锰纳米药物sod@mns,该药物以超氧化物歧化酶作为有机部分,并以mn
2+
和s
2-作为无机部分。此药物的合成方法如下:
34.将浓度为30-120mm的mncl2的溶液取0.1-1ml,加入到溶有5-50mg超氧化物歧化酶的10-100ml去离子水中,搅拌5-30min;
35.加入0.15-1.5ml na2s(浓度为30-120mm)在4℃下孵育24h,离心分离;
36.将分离后的产物用去离子水清洗三次,冻干后于-20℃下储存;
37.在上述纳米药物的制备过程中,蛋白质与mn
2+
之间的配位作用是无机纳米花催化剂形成的主要驱动力。
38.实施例一:
39.将浓度为30mm的mncl2的溶液取1ml,加入到溶有5mg超氧化物歧化酶的100ml去离子水中,搅拌5min;
40.加入0.15ml na2s(浓度为120mm)在3℃下孵育20h,离心分离;
41.将分离后的产物用去离子水清洗二次,冻干后于-25℃下储存。
42.实施例二:
43.将浓度为30mm的mncl2的溶液取0.1ml,加入到溶有50mg超氧化物歧化酶的100ml去离子水中,搅拌30min;
44.加入0.15ml na2s(浓度为30mm)在4℃下孵育24h,离心分离;
45.将分离后的产物用去离子水清洗三次,冻干后于-20℃下储存。
46.实施例三:
47.将浓度为120mm的mncl2的溶液取1ml,加入到溶有5mg超氧化物歧化酶的10ml去离子水中,搅拌30min;
48.加入1.5ml na2s(浓度为120mm)在4℃下孵育24h,离心分离;
49.将分离后的产物用去离子水清洗三次,冻干后于-20℃下储存。
50.实施例四:
51.将浓度为120mm的mncl2的溶液取0.1ml,加入到溶有5-50mg超氧化物歧化酶的10ml去离子水中,搅拌30min;
52.加入1.5ml na2s(浓度为30mm)在5℃下孵育30h,离心分离;
53.将分离后的产物用去离子水清洗四次,冻干后于-15℃下储存。
54.实施例五:
55.将浓度为90mm的mncl2的溶液取0.5ml,加入到溶有30mg超氧化物歧化酶的50ml去离子水中,搅拌25min;
56.加入1ml na2s(浓度为50mm)在4℃下孵育24h,离心分离;
57.将分离后的产物用去离子水清洗三次,冻干后于-20℃下储存。
58.在上述过程中,得到了杂化纳米药物,其中,实施例五中得到的药物sod@mns的电镜图如图5所示,表征其形貌。其形貌近似为球形,粒径在400nm左右。并对药物进行了以下分析:
59.一、sod-无机杂化纳米药物活性测定:
60.对照组吸光度δa1的测试条件:
[0061][0062][0063]
酶标仪550nm测1min,调试黄嘌呤氧化酶浓度,使δa1稳定在0.0225左右;
[0064]
实验组吸光度的δa2的测试条件:
[0065][0066]
酶标仪550nm测1min,梯度稀释样品,比如:1、1/5、1/5^2、1/5^3、1/5^4、1/5^5、1/5^6;紫外分光光度计550nm测1minδa2。
[0067]
本实施例中,使用如下的公式计算抑制率:
[0068]
抑制率=(0.0225-δa2)/0.0225*100%。
[0069]
然后以稀释比率或样品浓度为横坐标抑制率为纵坐标做抑制率曲线。
[0070]
本实施例中,可使用如下的两种方法用于酶活计算:
[0071]
方法(1):以最接近半数抑制的左右两点做直线,求半数抑制时稀释比率或样品浓度。
[0072]
方法(2):以稀释比率或样品浓度为横坐标抑制率为纵坐标做非线性回归曲线,求半数抑制时稀释比率或样品浓度。
[0073]
公式:1/0.03/浓度/10=u/mg。(u表示在最适条件下,1秒钟能使1摩尔底物转化的酶量)。
[0074]
二、sod活性测定:
[0075]
对照组吸光度δa1的测试条件:
[0076][0077]
酶标仪550nm测1min,调试黄嘌呤氧化酶浓度,使δa1稳定在0.0225左右;
[0078]
实验组吸光度的δa2的测试条件:
[0079][0080]
酶标仪550nm测1min,梯度稀释样品,比如:1、1/5、1/5^2、1/5^3、1/5^4、1/5^5、1/5^6;紫外分光光度计550nm测1minδa2。
[0081]
本实施例中,使用如下的公式计算抑制率:
[0082]
抑制率=(0.0225-δa2)/0.0225*100%。
[0083]
然后以稀释比率或样品浓度为横坐标抑制率为纵坐标做抑制率曲线。
[0084]
本实施例中,可使用如下的两种方法用于酶活计算:
[0085]
方法(1):以最接近半数抑制的左右两点做直线,求半数抑制时稀释比率或样品浓度。
[0086]
方法(2):以稀释比率或样品浓度为横坐标抑制率为纵坐标做非线性回归曲线,求半数抑制时稀释比率或样品浓度。
[0087]
公式:1/0.03/浓度/10=u/mg。(u表示在最适条件下,1秒钟能使1摩尔底物转化的酶量)。
[0088]
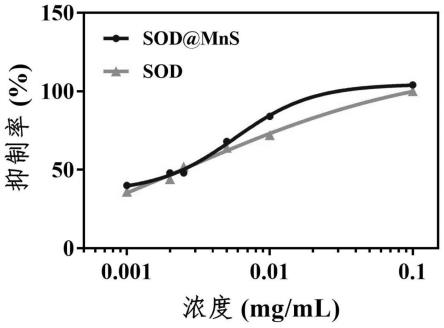
图2显示了活性测定数据的结果,利用黄嘌呤氧化酶法测定sod@mns和游离sod的活性,抑制率越高说明活性越强。从图中可以看出,在0.001-0.1mg/ml的浓度范围内,sod@mns的酶活性均优于游离sod。
[0089]
三、帕金森小鼠模型的构建
[0090]
小鼠首先在转棒仪上依次进行5次8、16、24rpm的匀速练习以及4-44rpm的匀加速练习,选用在转棒仪上行为一致的小鼠用于帕金森模型的构建。小鼠随机分为5组,分别命名为control,mptp,sod,bsa@mns以及sod@mns。除control组外,其余5组小鼠均通过腹腔注射mptp(35mg/kg/day)的方式构建帕金森模型,连续注射5天。从mptp注射的最后一天开始,尾静脉注射含有相同sod和zif-8当量的sod、zif-8以及sod@zif-8(sod@zif-8的剂量为6.5mg/kg/day),每隔一天注射一次,连续注射5次。control组和mptp组小鼠注射相同体积的生理盐水。
[0091]
四、sod@mns治疗帕金森疾病模型的评价
[0092]
水迷宫实验:
[0093]
morris水迷宫试验:迷宫(深度70厘米,宽度150厘米)由四个象限、一个平台和一个用黑色不透明塑料制成的圆形水池组成。圆形水池的水温保持在24-26℃。在前7天,小鼠(n=6)分别被放置在四个象限,并被训练独立到达平台。将找不到平台的小鼠引导至该平台并停留1min。训练过程结束后,对小鼠进行空间记忆测试。简单地将每只小鼠放入平台对
面的水中自由游泳4分钟,并将训练实验使用的固定平台从迷宫中移除。空间敏度表示为游泳速度和鼠标在目标象限(占用目标)上花费的相对时间。
[0094]
水迷宫实验的结果如图3所示,mptp刺激构建的pd模型鼠的行动轨迹杂乱无章,并且不能在规定时间内找到靶标象限的位置,说明其行为学和空间记忆能力受损。而经过sod@mns治疗后,pd小鼠的行动轨迹呈现定向性,且能够快速高效地找到靶标象限的位置,证明其行为学和空间记忆能力在治疗后得到恢复,并且其治疗效果优于有利sod和bsa@mns。
[0095]
五、免疫组化分析:
[0096]
将c57bl/6小鼠的脑部取出,放置于4%多聚甲醛中进行固定处理。接着,根据第三版小鼠脑图谱(mouse brain atlas:c57bl/6coronal)的说明,取小鼠脑部前囟后2.80mm至3.97mm,即ap-2.80mm至ap-3.97mm之间的部分(脑黑质区域)依次进行70%、80%、90%、95%、无水酒精的梯度脱水,随后进行透明、浸蜡和石蜡包埋等处理。结束后,进行切片及烘干操作,然后将组织切片脱蜡至水,pbs缓冲液(ph:7.2-7.4)冲洗3次,每次3-5min,然后在室温下anti-th一抗孵育1-2h,pbs缓冲液冲洗3次后,接着进行二抗的孵育(alexa fluor 488标记的鼠抗,15min),pbs缓冲液冲洗3次,干燥后进行封片处理。最后,通过荧光显微镜对组织切片进行观察并拍照,图片请参见图4所示,在该免疫组化图中,图中可以看出细胞核和抗体标记的酪氨酸羟化酶(th)。此外,从图中能够发现,mptp刺激构建的pd模型鼠的黑质(snpc)和纹状体(st)中th的表达量均降低;而经过sod@mns治疗后,其表达量均有显著的提高。优于th是表示神经细胞活性的重要酶,因此,sod@mns的治疗有助于神经细胞活性的恢复和pd的治疗。
[0097]
综上所述:利用仿生矿化法以超氧化物歧化酶作为有机部分,mn
2+
和s
2-作为无机部分合成无机-有机杂化纳米药物并以其为多功能制剂实现硫化氢协同自由清除治疗帕金森,
[0098]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其改进构思加以等同替换或改变,都应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1