在有机溶剂中选择性浸出和萃取贵金属的方法与流程
相关申请的交叉引用本申请要求共同申请的美国临时专利申请号62/150,513(申请日:2015年4月21日)和美国临时专利申请号62/152,066(申请日:2015年4月24日)的优先权,其内容通过引用整体并入本文。本申请涉及用于浸出和萃取贵金属的方法。例如,本申请涉及使用水混溶的或部分水混溶的有机溶剂从包含这样的贵金属(例如含金矿石或铂族金属(pgm)浓缩物)的物质中浸出金、钯和/或铂的方法。
背景技术:
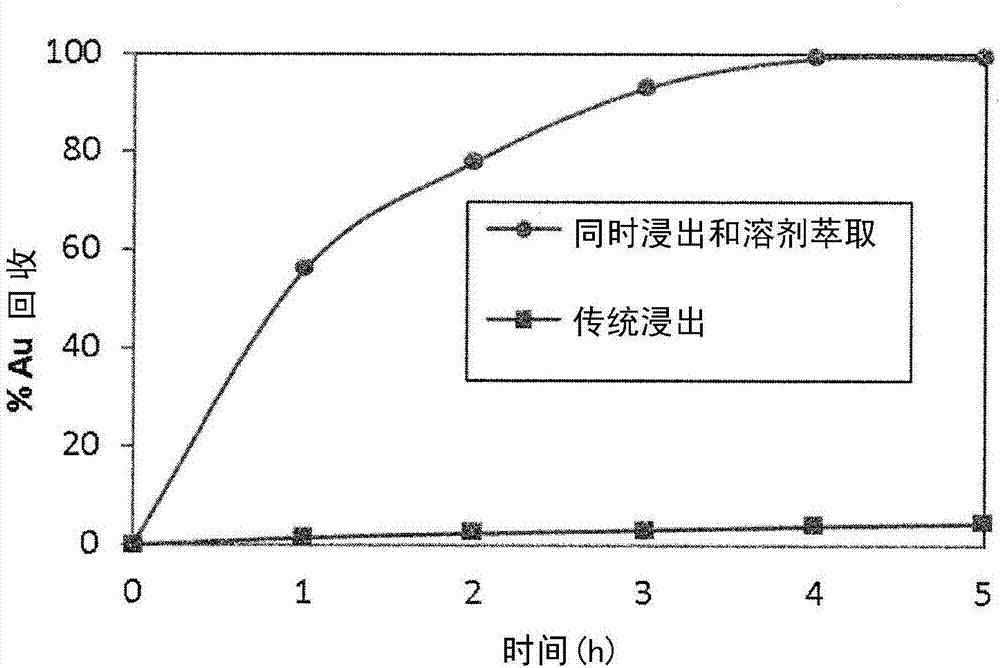
:金是元素周期表中的元素,与银和铜属于同族。通常在矿石中发现金与这些金属一起。地壳中铜和银的平均浓度分别为50和0.07ppm(百万分之一),而黄金则仅为0.005ppm1。浓度为0.5ppm或更高的矿床被认为是经济可采的。由于资源有限,近几十年来,不仅从矿石中,而且从二次资源中回收黄金也变得越来越重要。全球黄金采矿业的黄金年产量超过2500吨2。此外,约有900吨的二次黄金从不同来源回收,例如但不限于阳极残渣和珠宝,牙科和电子废料3。从矿石中回收金的最常用的方法包括使用剧毒无机氰化物(例如nacn,kcn)通过已知为浸出(leaching)的方法将金(0)转化成水溶性的au(cn)2-配位化合物。图1中示出了使用氰化物浸出进行金回收的已知方法10的实例。在方法10中,将低品位矿石12粉碎并研磨14,然后根据矿石类型用nacn的碱性溶液浸出16时间为16-48小时。由于世界各地多个金矿发生了一些环境事故,许多国家禁止通过氰化来浸出金4。因此,已经做了相当多的努力来寻找氰化物的替代物,并且已经研究和提出了各种浸出试剂5,6。通常,在氰化物溶液中金溶解之后,通过活性炭吸附回收金(例如图1的方法10中的步骤18,其中例如使用每吨矿石0.1-1kg活性炭),或者通过锌固结方法。活性炭吸附过程显著地更常见7,8。例如,4-8kg金可以在4-8个步骤中在4-8小时的时间内被1吨活性炭吸附。如图1所示,在碳吸附步骤18之后,负载的活性炭用低浓度hcl洗涤20以除去杂质,例如吸附的zn、ca、fe、cu和ag,然后通过使用例如1%的naoh和0.1-0.2%的nacn溶液在高温(例如110℃)下进行金解吸(洗脱)22处理36-72小时。纯金24可以通过例如电解提取或还原来获得。使用如图1所示的方法10工艺的金回收的全部处理时间是46-110小时。使用活性炭的金回收方法可能具有若干缺点,例如但不限于低选择性、非常长的程序、金产品的损失、高温要求以及氰化物在活性炭解吸金的进一步消耗,所有这些可能会在金回收过程中带来额外成本9。虽然已经付出了相当大的努力取代氰化物,但是没有一个报道的浸出试剂已被用于金生产的工业化,例如是归因于以下缺点,例如(i)高的试剂消耗,(ii)复杂的化学,(iii)缺乏从它们所得的溶液中回收金的工业技术,以及(iv)与氰化物相比低的金回收率。例如毒性、成本、反应时间长和选择性差等缺点也存在于已知的体系中。因此,从环境和经济角度来看,开发更有效的浸出剂可能是合乎需要的,例如具有更高的效率和/或更低的毒性的浸出剂。氰化物浸出一个多世纪以来,氰化一直是从矿石中萃取和回收金的主要方法。在溶解的分子氧存在下,金属金可以溶解在氰化钾或氰化钠的碱性溶液中(反应1):在中性或酸性条件下,超过99%的氰化物将以高度有毒的hcn气体的形式存在。通过增加ph值,将其转化成游离的氰化物离子,从而在ph值为9.3时,cn-和hcn处于平衡,各存在50%。在11的ph下,超过99%的氰化物以cn-的形式保留在溶液中10。在含水溶液中,游离的氰化物离子是能够与金形成非常稳定的配合物的非常强的配体。在化学计量比下,碱金属氰化物溶液中的金溶解缓慢,但是通过增加氰化物浓度,浸出速率将增加直至达到最大值(0.075w/w%kcn或0.06%nacn),然后溶解速率保持不变11。在氰化物处理之前,通常将金矿石粉碎并研磨,以使矿石颗粒的尺寸减小至75微米或更小,以提供金和浸出溶液之间的更大的接触表面积。根据矿石类型的不同,每吨矿石中氰化物的消耗量约为0.25-2kg氰化物,而氰化物中金的溶解速率则需要16-48小时11。当金矿石的耐熔性增加时,氰化物消耗量增加。耐火的金矿是对通过直接氰化回收具有抵抗性的含金矿石。其它矿物质和金属也溶解在碱性氰化物溶液中,并且它们通常会消耗氰化物和氧气,从而降低金浸出的整体效率。例如,诸如辉铜矿(cu2s)和赤铜矿(cu2o)的铜矿物可形成各种氰化物配合物,如cucn、cu(cn)2-、cu(cn)32-和cu(cn)43-以及诸如磁黄铁矿(fe7s8),黄铁矿(fes2)和毒砂(feass)的铁硫化物形成高度稳定的fe(cn)64-和fe(cn)63-配合物12。另外,大多数硫化物矿物对金浸出具有不利影响,因为它们可以钝化金的表面并消耗氰化物和氧。然而,一些其它矿物如方铅矿(pbs)可以通过防止在金表面上形成钝化层来改善金浸出动力学13。尽管氰化物仍然是采矿业中金回收的主要浸出剂,但其具有多种缺点,例如但不限于高毒性、缓慢的浸出动力学以及对耐火的矿石的低的金萃取。因此已经作出了相当大的努力来寻找氰化物的替代物。从氰化物溶液中回收金有几种从氰化物浸出液回收金的技术,如碳吸附法、锌固结法和溶剂萃取法,其中碳吸附法是目前比较常用的技术14,15。在碳吸附技术中,将金浸出至氰化物溶液中后,施加活性炭用于选择性吸附金,以从其它金属和杂质中分离aucn2-。每吨矿石0.1-1kg活性炭通常在4-8个步骤中被施加,以从氰化物溶液中完全吸附au(cn)2-配合物,这需要4-8小时。负载的活性炭通常用低浓度的hcl溶液清洗以除去其它杂质,如fe、cu、zn、ca和ag。然后通过在110℃下用新鲜的碱性氰化钠溶液洗涤负载的活性炭36-72小时,在洗脱步骤中从活性炭中除去二氰酸根合(i)配合物10,16。最终通过电解提取或还原将解吸的au(cn)2-配合物还原为元素金。活性炭方法具有几个缺点,例如但不限于低选择性、非常长的程序、某些金产品的损失以及高温要求17。氰化物的替代品由于氰化物的高毒性和环境问题,有需求寻找有用的替代物。近年来,已经报道一些氰化物的替代物有效地浸出金矿石。一些有用的报道的浸出剂是硫代硫酸盐、硫氰酸盐、硫脲,和氯化物与氧化剂如hno3、h2o2和次氯酸盐的组合。硫代硫酸盐浸出硫代硫酸盐是研究最多的氰化物替代品。在氧化剂如o2和铜(ii)离子的存在下,金可以在硫代硫酸盐的碱性水溶液(ph=9.5-10.5)中浸出。在不存在铜(ii)离子的情况下,金溶解速度变慢18。氨通常用于加速这种介质中金浸出的速度。它能有效地稳定金的中间氧化产物,降低cu2+氧化硫代硫酸盐的速率,防止在金表面形成硫化物等不溶性组分,并通过形成cu(nh3)42+,在浸出过程中保持高浓度的cu2+19,20。氧通过将cu(nh3)2+氧化成cu(nh3)42+或直接氧化金表面而具有双重作用。在下面的反应(2)中示出了在硫代硫酸盐介质中金溶解的总平衡方程21:au+cu(nh3)42++2s2o32-→au(s2o3)23-+cu(nh3)2++2nh3(2)与氰化方法相比,硫代硫酸盐浸出具有一些优点,例如但不限于快速浸出动力学、低毒性和在一些耐火的金矿石中较高的金回收率22,23。然而,它具有一些主要的缺点,例如但不限于复杂的化学反应、氨的毒性、活性炭解吸浸出金的无效性以及硫代硫酸盐的高消耗。例如,铜(ii)本身消耗硫代硫酸盐,导致硫代硫酸盐和铜的高消耗,并且所得连四硫酸盐(s4o62-)分解成元素硫并形成硫化物如cus,这在浸出过程中增加了金的钝化(反应3)24,25。2cu(nh3)42++8s2o32-→2cu(s2o3)35-+8nh3+s4o62-(3)硫脲硫脲是另一种经过深入研究的浸出剂,它可以在以下反应(4)中将金溶解在酸性介质中26:au+2cs(nh2)2→au(sc(nh2)2)2+(4)不同的氧化剂例如但不限于过氧化氢、过氧化钠、氧气、臭氧和三价铁离子可以与硫脲结合使用以溶解金。在这些氧化剂中,硫酸溶液中的三价铁离子是有用的(反应5)27。au+2cs(nh2)2+fe3+→au(sc(nh2)2)2++fe2+(5)然而,硫脲在酸性介质中在铁离子存在下是不稳定的,并分解成硫和氰胺28。添加还原剂如so2通过防止其氧化而降低了硫脲的消耗29。由于使用了非气态氧化剂,例如但不限于过氧化氢和硫酸铁代替氰化方法中使用的氧,所以硫脲溶液中金浸出的动力学比氰化方法快得多30。但氰化物的金回收和试剂消耗比硫脲更经济31。与普通金属如铜的配合加速了硫脲的消耗并且降低了金浸出动力学。热降解,被硫酸铁和空气氧化是硫脲高消耗的另一个原因32。硫脲的商业应用由于其高消耗以及不存在从其解决方案中回收金的适用工业技术而受到阻碍。尽管硫脲与氰化物相比具有较低的毒性,但被怀疑是一种致癌物质,应谨慎处理33。含有氧化剂的氯化物溶液已知浓盐酸与强氧化剂结合是用于浸出例如来自废料和二次来源的贵金属的强浸出剂34。与浓hno3混合的浓hcl的热溶液(称为王水)或与过氧化氢混合的浓hcl的热溶液可以根据以下化学反应溶解金(参见反应6和7),结果形成稳定的aucl4-配合物35。au+4hcl+hno3→haucl4+2h2o+no(6)2au+3h2o2+8hcl→2haucl4+6h2o(7)除了这些氧化剂之外,还可以使用形成相同金物质的氯气36。19世纪下半叶,氯被用来溶解矿石和精矿中的金,直到逐渐被更经济的碱性氰化物浸出所取代。在所有情况下,与氰化物相比,溶解速度更快,但是由于高浓度的hcl,所有这些溶液具有强烈的腐蚀性和毒性,并且在金矿石处理的情况下,它们的消耗是不经济的37。氯化物/次氯酸盐氯化物/次氯酸盐溶液已经被认为是氰化物的另一种替代浸出剂,其能够在宽范围的ph值下溶解金38。取决于溶液的ph值,可以在次氯酸盐溶液中形成三种不同的氧化物质。在ph>7.5时,次氯酸根离子(ocl-)是优势种类,而当ph值在3.5和7.5之间时,次氯酸(hocl)作为氧化剂,而当ph小于3.5时,形成初生氯气(cl2)。在这三种物质中,hocl是作为[aucl4]-浸出金的最有效的氧化剂(反应8)39。2au+3hocl+3h++5cl-→2[aucl4]-+3h2o(8)在含有100g/lnacl的溶液中,[aucl4]-在0-8的ph范围内稳定,并且电势大于0.9v40。氯-次氯酸盐溶液是一种有用的浸出剂,例如用于耐火的金矿石。由于酸度低,不会产生腐蚀介质;然而试剂消耗量仍然很高41,42。这种浸出剂的主要缺点是浸出金的百分比通常小于85%43。有机溶剂中浸出金已经研究了极性和水混溶的有机溶剂来溶解一些过渡金属如银和铜44,45,46。在某些情况下,特别是水-溶剂或纯溶剂的混合物已经实现更好的浸出效率。在有机溶剂如dmso、甲醇、丙酮、n,n-二甲基甲酰胺和乙腈中也有一些浸出金的实例45,47,48。例如,yukimichi研究了金、银和钯在不同的卤素-卤化物-极性有机溶剂体系中的溶解速率,并且在金的情况下,他证明金可以溶解在卤化物源、卤素如氯气、溴、碘和有机溶剂如甲醇或mecn的混合物中。在所研究的体系中,氯气、乙腈和me3nhcl(作为氯化物源)的混合物溶解金最有效;甚至比王水更快48。技术实现要素:本发明公开了使用极性的、水混溶的或部分水混溶的有机溶剂与传统浸出剂的组合。传统的浸出试剂,例如含有氧化剂的酸化氯化物溶液,尚未被研究直接在有机溶剂中金浸出。例如,这种新的回收体系可以简化回收过程、节省大量的时间和能量、并且由于有机溶剂的可回收性,产生更少的废物。因此,本申请包括从包含金、钯和/或铂的物质中浸出金、钯和/或铂的方法,所述方法包括在从所述物质中浸出金、钯和/或铂条件下,使所述物质与包含以下物质的混合物接触:(a)酸;(b)氧化剂;和(c)水混溶的或部分水混溶的有机溶剂。在本申请的另一个实施方案中,从所述物质中浸出金、钯和/或铂的条件包括将所述物质和所述混合物在约10℃-约80℃的温度下搅拌约0.1分钟-约30分钟的时间。在一个实施方案中,混合物中的酸选自hcl、h2so4、hbr、hno3、h3po4和hi。在另一个实施方案中,酸是浓度为约0.01m-约2.5m的盐酸水溶液。在一个实施方案中,混合物中的氧化剂选自h2o2、cl2、br2、i2、ca(clo)2、hno3、mno2、kmno4和k2cr2o7。在另一个实施方案中,氧化剂是h2o2或ca(clo)2。在本申请的另一个实施方案中,混合物中的水混溶的或部分水混溶的有机溶剂选自乙酸、乙酸乙酯和乙腈。在一个实施方案中,混合物还包含金属卤化物、卤化铵、四烷基卤化铵或其组合。在另一个实施方案中,混合物进一步包含金属卤化物,并且金属卤化物为cacl2。在另一个实施方案中,混合物中的cacl2具有约0.05m-约1.5m的浓度。本申请的一个实施方案是混合物中的试剂(a)是hcl,混合物中的试剂(b)是h2o2,混合物中的试剂(c)是乙酸。在一个实施方案中,包含金、钯和/或铂的物质是含金的物质。在一个实施方案中,含金物质还包含铁、铜、钴或镍或其组合,并且该方法选择性地从含金物质中溶解金。在本申请的另一个实施方案中,含金物质是含金矿石。在一个实施方案中,所述方法提供至少500gm-2h-1,至少1000gm-2h-1,或至少5000gm-2h-1的金溶解速率。在另一个实施方案中,所述方法提供约500gm-2h-1-约9500gm-2h-1,或约1000gm-2h-1-约9500gm-2h-1的金溶解速率。在另一个实施方案中,包含金、钯和/或铂的物质是是铂族金属浓缩物。在一个实施方案中,该方法还包括:将含有浸出的金、钯和/或铂的水混溶的或部分水混溶的有机溶剂与不溶性杂质分离;和从浸出的金、钯和/或铂中蒸发所述水混溶的或部分水混溶的有机溶剂。在另一个实施方案中,所述方法在蒸发之后还包括在式i的化合物与浸出的金和/或钯之间形成配合物的条件下,用式i的化合物处理浸出的金、钯和/或铂:其中r1是-nr4r5或芳基;r2和r3各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r2和r3与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;r4和r5各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r4和r5与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;x是o或s;y是s、nr6或cr6r7;和r6和r7各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在一个实施方案中,式i的化合物是式i(a)的化合物:其中r2、r3、r4、r5和y如对式i的化合物所定义。在一个实施方案中,在式i的化合物与浸出的金和/或钯之间形成配合物的条件包括用式i的化合物在水不混溶的有机溶剂中在约10℃-约40℃的温度下处理浸出的金、钯和/或铂约2分钟-约30分钟的时间。在另一个实施方案中,水不混溶的有机溶剂是二氯甲烷、氯仿、氯苯或甲苯。在一个实施方案中,所述方法进一步包括通过如下方法从式i的化合物与浸出的金和/或钯之间的配合物中提取金和/或钯,所述方法包括在获得含有金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相的条件下,使用包含酸和硫脲的水溶液处理含有式i的化合物和浸出的金和/或钯之间的配合物的水不混溶的溶剂。在另一个实施方案中,该方法进一步包括从含有式i的化合物的还原的金和/或钯的有机相中分离出含有金和/或钯的提取溶液,并通过电解或还原从含有金和/或钯的提取溶液中回收金和/或钯。在另一个实施方案中,该方法还包括:将含有浸出的金、钯和/或铂的水混溶的或部分水混溶的有机溶剂与不溶性杂质分离;在获得金、钯和/或铂的条件下用还原剂处理水混溶的或部分水混溶的有机溶剂中浸出的金、钯和/或铂;和从水混溶的或部分水混溶的有机溶剂中分离金、钯和/或铂。在一个实施方案中,还原剂选自nabh4、二茂铁、fe粉末和zn粉末。在另一个实施方案中,该方法还包括回收水混溶的或部分水混溶的有机溶剂。在一个实施方案中,在从水混溶的或部分水混溶的有机溶剂中分离金、钯和/或铂之后,所述方法进一步包括:在王水中溶解金、钯和/或铂;和在式i的化合物与溶解的金和/或钯之间形成配合物的条件下,用式i的化合物处理溶解的金、钯和/或铂:其中r1是-nr4r5或芳基;r2和r3各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r2和r3与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;r4和r5各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r4和r5与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;x是o或s;y是s、nr6或cr6r7;和r6和r7各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在一个实施方案中,式i的化合物与溶解的金和/或钯之间形成配合物的条件包括用式i的化合物在水不混溶的有机溶剂中在约10℃-约40℃的温度下处理溶解的金、钯和/或铂约2分钟-约30分钟的时间。在另一个实施方案中,水不混溶的有机溶剂是二氯甲烷、氯仿、氯苯或甲苯。在一个实施方案中,所述方法进一步包括通过如下方法从式i的化合物与溶解的金和/或钯之间的配合物中提取金和/或钯,所述方法包括在获得含有金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相的条件下,使用包含酸和硫脲的水溶液与含有式i的化合物和溶解的金和/或钯之间的配合物的水不混溶的溶剂接触。在另一个实施方案中,该方法进一步包括从含有式i的化合物的还原的金和/或钯的有机相中分离出含有金和/或钯的提取溶液,并从含有金和/或钯的提取溶液中通过电解提取或还原回收金和/或钯。根据以下详细描述,本申请的其它特征和优点将变得显而易见。然而,应该理解的是,虽然指出了本申请的实施方案,但是详细描述和具体示例仅仅是以示例的方式给出的,并且权利要求的范围不应该受这些实施方案的限制,而应该给予与整体描述一致的最宽的解释。附图说明现在将参考附图更详细地描述本申请,其中:图1示出了根据现有技术的使用氰化物浸出的金回收工艺的示意图。图2是显示根据本申请的方法的实施方案,与传统浸出相比,au回收率(%)作为用于同时浸出和萃取的时间(小时)的函数的曲线图。图3显示了从含金物质浸出和萃取金的方法的示意图。图4示出了根据本申请的方法的一个实施方案从含金物质中浸出金的方法的示意图。图5是显示王水、浓hcl/h2o2和乙酸体系之间的金溶解速率比较研究的图。图6显示了金与普通金属在如下的溶解速率的竞争研究:(a)浓hcl/h2o2混合物(四份hcl(37%)和一份h2o2(30%))相对于乙酸(包含1.5mhcl、0.6mh2o2和0.6mcacl2)(b)乙腈溶液(包含1mhcl和0.2mh2o2)相对于乙酸(包含0.5mhcl、0.2mh2o2和0.2mcacl2)。具体实施方式i.定义除非另外指明,否则在这个和其它部分中描述的定义和实施方案旨在适用于本文描述的本申请的所有实施方案和方面,正如本领域技术人员所理解的。如本文所用的术语“本申请的化合物”等是指如本文所定义的式i的化合物。在理解本申请的范围时,如本文所使用的术语“包括”及其派生词旨在是开放式术语,其指定所述特征、要素、组分、组、整数和/或步骤的存在,但是不排除其它未陈述的特征、要素、组分、组、整数和/或步骤的存在。前述内容也适用于具有类似含义的词语,如术语“包含”、“具有”及其派生词。本文使用的术语“由......组成”及其派生词旨在是封闭式术语,其指明所述特征、要件、组分、组、整数和/或步骤的存在,但排除其它未说明的特征、要素、组分、组、整数和/或步骤的存在。如本文所用,术语“基本上由......组成”旨在说明所陈述的特征、要素、组分、组、整数和/或步骤的存在以及那些不实质上影响基本和新颖特性的特征、要素、组分、组、整数和/或步骤的存在。诸如本文中使用的“基本上”、“约”和“近似”的程度术语是指修正的术语的合理偏差量,使得最终结果不会显著改变。如果这种偏差不会否定它所修饰的词语的含义,则这些程度术语应该被解释为包括至少±5%的所修饰术语的偏差。本文使用的术语“和/或”是指列出的项目单独地或组合地存在或使用。实际上,这个术语是指使用或存在的所列项目中的“至少一个”或“一个或多个”。如在本申请中所使用的,单数形式的“一”,“一个”和“该”包括复数指代,除非内容明确地另外指出。例如,包含“一种化合物”的实施方案应理解为具有一种化合物或两种或更多种另外的化合物的本发明的某些方面。在包含“另外的”或“第二”组分的实施方案中,例如另外的或第二化合物,如本文所用的第二组分与其它组分或第一组分在化学上不同。“第三”组分与其它、第一和第二组分不同,并且进一步列举的或“另外的”组分也是类似地不同。在本申请的实施方案中,本文所述的化合物具有至少一个不对称中心。当化合物具有多于一个不对称中心时,它们可以以非对映体的形式存在。应该理解,任何比例的所有这些异构体及其混合物都包括在本申请的范围内。应当进一步理解的是,尽管所述化合物的立体化学可以如本文列出的任何给定化合物中所示,但是这样的化合物也可以包含一定量(例如,小于20%,合适地小于10%,更合适地小于5%)具有交替立体化学的本申请的化合物。意图是任何光学异构体,作为分离的、纯的或部分纯化的旋光异构体或其外消旋混合物都包括在本申请的范围内。本文所用的术语“合适的”意指特定试剂或条件的选择将取决于正在进行的反应以及期望的结果,但是无论如何,一旦所有相关信息是已知的,通常可由本领域技术人员做出。当涉及两种液相时,本文所用的术语“不混溶的”是指两种液相在所用条件下不能混合形成具有单一相的溶液,例如两种液相的相对比例和/或温度等。两种不混溶的液相例如在混合后将分成两个液相。这两个液相中的每一个可以例如含有少量的其它液相。因此,“水不混溶的”液体如“水不混溶的有机溶剂”是在所用条件下不能与水混合形成具有单一相的溶液的液体,但是例如可以在与水混合后含有少量的水。当涉及两个液相时,如本文所用的术语“部分混溶的”是指两个液相例如在混合后将分离成两个液相,每个液相包含一部分处于溶解状态的另一液相。因此,“部分水混溶的有机溶剂”是与水混合后分成两个液相的液体,其中一相是水相,含有例如约10%(v/v)的处于溶解状态的部分水混溶的有机液体,另一相是部分水混溶的有机液体,其中含有例如约10%(v/v)的处于溶解状态的水。本文使用的术语“混溶的”当涉及两个液相时意味着两个液相可以例如以所有比例混合以形成均匀的溶液。例如两种混溶的液相在混合后不会分离成两个液相。因此,“水混溶的”液体如“水混溶的有机溶剂”是可以与水混合形成均匀溶液的液体。本文使用的术语“烷基”,无论其是单独使用还是作为另一基团的一部分使用,是指直链或支链的饱和烷基。所提及的烷基中可能的碳原子数用数字前缀“cn1-n2”表示。例如,术语c1-10烷基是指具有1、2、3、4、5、6、7、8、9或10个碳原子的烷基。本文使用的术语“亚烷基”,无论其是单独使用还是作为另一基团的一部分使用,是指直链或支链的饱和亚烷基,即在其两个末端含有取代基的饱和碳链。所提及的亚烷基中可能的碳原子数用数字前缀“cn1-n2”表示。例如,术语c1-6亚烷基是指具有1、2、3、4、5或6个碳原子的亚烷基。本文使用的术语“环烷基”,无论其是单独使用还是作为另一基团的一部分使用,是指具有至少一个环的饱和烷基。所提及的环烷基中可能的碳原子数用数字前缀“cn1-n2”表示。例如,术语c3-10环烷基是指具有3、4、5、6、7、8、9或10个碳原子的环烷基。本文使用的术语“杂环烷基”,无论其是单独使用还是作为另一基团的一部分使用,是指具有一个或多个独立地选自n、o和s的多价杂原子作为环结构一部分的非芳族含环基团,并且在环中包括至少3个并且至多20个原子。杂环烷基基团是饱和的或不饱和的(即含有一个或多个双键)并且可以含有多于一个环。本文使用的术语“芳基”,无论其是单独使用还是作为另一基团的一部分使用,是指具有至少一个芳香环的环基。在本申请的一个实施方案中,芳基含有6、9、10或14个原子,如苯基、萘基、茚满基或蒽基。本文使用的术语“杂芳基”,无论其是单独使用还是作为另一基团的一部分使用,是指具有一个或多个独立地选自n、o和s的多价杂原子作为环结构一部分的芳族含环基团,并且在环中包括至少5个并且至多20个原子。杂芳基可以含有多于一个的环。ii.本申请的方法本发明公开了极性的、水混溶的或部分水混溶的有机溶剂与传统浸出剂的组合。传统的浸出剂,例如含有氧化剂的酸化氯化物溶液,尚未研究直接在有机溶剂中用于金浸出。在本研究中研究了许多浸出剂。使用hcl与h2o2或ca(clo)2在乙酸乙酯或乙腈中的混合物,使用很低浓度的氧化剂,在短时间内用1mhcl达到大于99.9%的金浸出。结果表明,尽管浸出物相关浓度低得多,但这些新的浸出体系甚至可以比王水更迅速地溶解金。然后可以将浸出的金从乙酸乙酯或乙腈溶液中沉淀出来,例如通过用nabh4、锌或二茂铁直接还原aucl4-。因为在金还原过程中可以还原一些其它杂质,所以可以通过使用例如本文所定义的式i的化合物的溶剂萃取来纯化所得的金沉淀物。在一些实施方案中,例如,这种新的回收体系简化了回收过程、节省了大量的时间和能量、并且由于有机溶剂的可回收性,产生更少的浪费。因此,本申请包括从包含金、钯和/或铂的物质中浸出金、钯和/或铂的方法,所述方法包括在从所述物质中浸出金、钯和/或铂的条件下,使所述物质与包含以下物质的混合物接触:(a)酸;(b)氧化剂;和(c)水混溶的或部分水混溶的有机溶剂。在一个实施方案中,该方法还包括:将含有浸出的金、钯和/或铂的水混溶的或部分水混溶的有机溶剂与不溶性杂质分离;和从浸出的金、钯和/或铂中蒸发所述水混溶的或部分水混溶的有机溶剂。可以通过任何合适的方式分离包含浸出的金、钯和/或铂以及不溶性杂质的水混溶的或部分水混溶的有机溶剂,其选择可以由本领域技术人员进行。可以通过任何合适的手段,从浸出的金、钯和/或铂中蒸发水混溶的或部分水混溶的有机溶剂,其选择可以由本领域技术人员进行。在一个实施方案中,蒸馏用于从浸出的金、钯和/或铂中蒸发水混溶的或部分水混溶的有机溶剂。在另一个实施方案中,所述方法在蒸发之后还包括在式i的化合物与浸出的金和/或钯之间形成配合物的条件下,用式i的化合物处理浸出的金、钯和/或铂:其中r1是-nr4r5或芳基;r2和r3各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r2和r3与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;r4和r5各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r4和r5与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;x是o或s;y是s、nr6或cr6r7;和r6和r7各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在这样的条件下,铂不与例如式i的化合物形成配合物。在一个实施方案中,r1是-nr4r5。在另一个实施方案中,r1是芳基。在另一个实施方案中,r1是c6-10芳基。在又一个实施方案中,r1是苯基。在另一个实施方案中,式i的化合物是式i(a)的化合物:其中r2、r3、r4、r5和y如对式i的化合物所定义。在本申请的一个实施方案中,例如,在式i(a)的化合物中,r2、r3、r4和r5中仅一个是h。在本申请的另一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成杂环烷基、杂芳基或取代的杂环烷基或取代的杂芳基。在一个实施方案中,例如,在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成杂环烷基或取代的杂环烷基。在另一个实施方案中,例如,在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成杂环烷基或取代的杂环烷基,其中杂环烷基选自氮杂环丙基、氮杂环丁烷基、吡咯烷基、哌啶基、氮杂环庚烷基(azepanyl)、氮杂环辛烷基(azocanyl)、咪唑烷基、噁唑烷基、噻唑烷基、哌嗪基、六氢嘧啶基、吗啉基、1,3-噁嗪烷基、硫代吗啉基、1,3-噻嗪烷基、1,3-二氮杂环庚烷基、1,3-氧杂氮杂环庚烷基、1,3-硫氮杂环庚烷基、1,4-二氮杂环庚烷基、1,4-氧杂氮杂环庚烷基、1,4-硫氮杂环庚烷基、1,3-二氮杂环辛烷基、1,3-氧杂氮杂环辛烷基、1,3-硫氮杂环辛烷基、1,4-二氮杂环辛烷基、1,4-氧杂氮杂环辛烷基、1,4-硫氮杂环辛烷基、1,5-二氮杂环辛烷基、1,5-氧杂氮杂环辛烷基和1,5-硫氮杂环辛烷基。在另一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成吗啉基、吡咯烷基或4-甲基哌啶基。在另一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成吗啉基。在另一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成吡咯烷基。在又一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成4-甲基哌啶基。在一个实施方案中,例如,在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成杂芳基或取代的杂芳基。在本申请的另一个实施方案中,例如,在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成杂芳基。在另一个实施方案中,例如在式i(a)的化合物中,r2和r3与它们所连接的氮原子一起形成选自以下的杂芳基:吡咯基、咪唑基、吡唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、1,2,3-三唑基、1,2,4-三唑基、呋咱基、吡啶基、吡嗪基、嘧啶基、哒嗪基、1,2,3-三嗪基、1,2,4-三嗪基和1,3,5-三嗪基。在一个实施方案中,例如在式i(a)的化合物中,r4选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在另一个实施方案中,例如在式i(a)的化合物中,r4选自h、c1-6烷基、c3-8环烷基、c1-4亚烷基c3-8环烷基、杂环烷基和苯基。在又一个实施方案中,例如在式i(a)的化合物中,r4选自h、c1-6烷基、c3-8环烷基。在一个实施方案中,例如在式i(a)的化合物中,r4选自h和c1-4烷基。在本申请的另一个实施方案中,例如,在式i(a)的化合物中,r4是h。在一个实施方案中,例如在式i(a)的化合物中,r5选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在另一个实施方案中,例如在式i(a)的化合物中,r5选自c3-10烷基、c3-8环烷基、c1-4亚烷基c3-8环烷基、杂环烷基和苯基。在又一个实施方案中,例如在式i(a)的化合物中,r5选自c1-6烷基和c3-8环烷基。在一个实施方案中,例如在式i(a)的化合物中,r5是异丙基或环己基。在另一个实施方案中,例如在式i(a)的化合物中,r5是异丙基。在又一个实施方案中,例如在式i(a)的化合物中,r5是环己基。在一个实施方案中,r1-r7中至少一个是芳基。在另一个实施方案中,r1-r7中至少一个是苯基。在一个实施方案中,例如在式i(a)的化合物中,r4是h或c1-4烷基并且r5是c1-6烷基或c3-8环烷基。在另一个实施方案中,例如在式i(a)的化合物中,r4是h并且r5是c1-6烷基或c3-8环烷基。在本申请的另一个实施方案中,例如在式i(a)的化合物中,r4是h并且r5是c1-6烷基。在一个实施方案中,例如在式i(a)的化合物中,r4是h并且r5是c3-8环烷基。在另一个实施方案中,例如在式i(a)的化合物中,r4是h并且r5是异丙基。在又一个实施方案中,例如在式i(a)的化合物中,r4是h并且r5是环己基。在一个实施方案中,x是o。在另一个实施方案中,x是s。在一个实施方案中,y是nr6。在一个实施方案中,r6选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在另一个实施方案中,r6选自h、c1-6烷基、c3-8环烷基、c1-4亚烷基c3-8环烷基和杂环烷基。在又一个实施方案中,r6是h、c1-6烷基或c3-8环烷基。在一个实施方案中,r6是h。在另一个实施方案中,r6是是c1-6烷基。在本发明的另一个实施方案中,r6是c3-8环烷基。在又一个实施方案中,r6是异丙基。在一个实施方案中,r6是环己基。在一个实施方案中,y是cr6r7。在一个实施方案中,r6和r7各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在另一个实施方案中,r6和r7各自独立地选自h、c1-6烷基、c3-8环烷基、c1-4亚烷基c3-8环烷基和杂环烷基。在又一个实施方案中,r6和r7各自独立地选自h、c1-6烷基或c3-8环烷基。在一个实施方案中,式i的化合物是式i(a)(i)、i(a)(ii)、i(a)(iii)或i(a)(iv)的化合物:在本申请的另一个实施方案中,式i的化合物是式i(a)(i)的化合物:在本申请的另一个实施方案中,式i的化合物是式i(a)(ii)的化合物:在本申请的另一个实施方案中,式i的化合物是式i(a)(iii)的化合物:在本申请的另一个实施方案中,式i的化合物是式i(a)(iv)的化合物:在另一个实施方案中,式i的化合物是式i(b)(i)的化合物:在另一个实施方案中,式i的化合物是式i(c)(i)、i(c)(ii)、i(c)(iii)或i(c)(iv)的化合物:其中在每个式i(c)(i)、i(c)(ii)、i(c)(iii)或i(c)(iv)的化合物中,z1和z2之一是o,z1和z2中的另一个是s。在一个实施方案中,式i的化合物可商购获得或者使用文献中已知的方法由市售材料制备。例如,通过将适当取代的胺加入cs2和碳化二亚胺在合适的极性溶剂,例如醇溶剂中的混合物中,在形成式i(a)的化合物的条件下而制备式i(a)的化合物。式i(a)的化合物通常从反应混合物中沉淀出来并被分离,并且任选地使用已知的方法纯化。在一个实施方案中,使用稍微过量,例如1.05-1.5,合适的1.1当量的胺和cs2。在一个实施方案中,合适的溶剂是甲醇或乙醇,合适的是甲醇。在一个实施方案中,反应在室温或室温附近进行,然而,本领域技术人员可以根据需要调整温度。在一个实施方案中,式i的化合物与浸出的金和/或钯之间形成配合物的条件包括用式i的化合物在水不混溶的有机溶剂中在约10℃-约40℃的温度下处理浸出的金、钯和/或铂约2分钟-约30分钟。本领域技术人员将会理解,铂保留在水相中,并且不会被式i的化合物萃取到有机相中。铂可以通过任何合适的方法从水相中回收,其选择可以由本领域技术人员做出。在一个实施方案中,式i的化合物与金和/或钯的摩尔比为约1:10-约50:1。在另一个实施方案中,式i的化合物与金和/或钯的摩尔比为约1:1-约20:1。在又一个实施方案中,式i的化合物与金和/或钯的摩尔比为约2:1-约10:1。在一个实施方案中,式i的化合物与金和/或钯的摩尔比为约3:1-约4:1。在另一个实施方案中,式i的化合物与金和/或钯的摩尔比为约3:1。在又一个实施方案中,式i的化合物与金和/或钯的摩尔比为约4:1。在一个实施方案中,水不混溶的有机溶剂是二氯甲烷、氯仿、氯苯或甲苯。在另一个实施方案中,水不混溶的有机溶剂是二氯甲烷。在另一个实施方案中,所述方法进一步包括通过包括以下方法从式i的化合物与浸出的金和/或钯之间的配合物中提取金和/或钯,所述方法包括在获得含金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相的条件下,用含酸和硫脲的水溶液处理含有式i的化合物与浸出的金和/或钯之间的配合物的水不混溶的有机溶剂。在一个实施方案中,获得含金和/或钯的提取溶液和还原的金和/或钯的有机相的条件包括将水不混溶的有机溶剂与包含h2so4例如1mh2so4和硫脲,例如0.7m硫脲的水溶液在约10℃-约40℃或约20℃-约25℃的温度下搅拌约5分钟-约1小时或约15分钟的时间。其它合适的酸例如但不限于hcl可用于提取步骤中。然而,本领域技术人员将会理解,hcl具有腐蚀性,并且在随后的还原或电解提取期间hcl气体可能从溶液中排出。在另一个实施方案中,该方法进一步包括从含有式i的化合物的还原的金和/或钯的有机相中分离出含有金和/或钯的提取溶液,并从含有金和/或钯的提取溶液中通过电解提取或还原回收金和/或钯。包含金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相通过任何合适的方式分离,可以用于本申请的方法中的方式的选择由本领域技术人员来完成。在另一个实施方案中,该方法还包括:将含有浸出的金、钯和/或铂的水混溶的或部分水混溶的有机溶剂与不溶性杂质分离;在获得金、钯和/或铂的条件下,用还原剂处理水混溶的或部分水混溶的有机溶剂中的浸出的金、钯和/或铂;和从水混溶的或部分水混溶的有机溶剂中分离金、钯和/或铂。可以通过任何合适的方式分离包含浸出的金、钯和/或铂以及不溶性杂质的水混溶的或部分水混溶的有机溶剂,其选择可以由本领域技术人员进行。金、钯和/或铂以及水混溶的或部分水混溶的有机溶剂通过任何合适的方式分离,其选择可以由本领域技术人员进行。还原剂可以是任何合适的还原剂。在本申请一个实施方案中,还原剂选自nabh4、二茂铁、fe粉末和zn粉末。在另一个实施方案中,该方法还包括回收水混溶的或部分水混溶的有机溶剂。在一个实施方案中,所述方法在从水混溶的或部分水混溶的有机溶剂中分离金、钯和/或铂之后,进一步包括:在王水中溶解金、钯和/或铂;和在式i的化合物与溶解的金和/或钯之间形成配合物的条件下,用式i的化合物处理溶解的金、钯和/或铂:其中r1是-nr4r5或芳基;r2和r3各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r2和r3与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;r4和r5各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基;或r4和r5与它们所连接的氮原子一起形成杂环烷基或杂芳基,或一起形成在一个或多个碳原子上被c1-4烷基取代的杂环烷基或杂芳基;x是o或s;y是s、nr6或cr6r7;和r6和r7各自独立地选自h、c1-10烷基、c3-10环烷基、c1-6亚烷基c3-10环烷基、杂环烷基和芳基。在这样的条件下,铂不会例如与式i的化合物形成配合物。式i的化合物可以如本文所详述的那样变化。在一个实施方案中,式i的化合物与溶解的金和/或钯之间形成配合物的条件包括用式i的化合物在水不混溶的有机溶剂中在约10℃-约40℃的温度下处理溶解的金、钯和/或铂约2分钟-约30分钟。本领域技术人员将会理解,铂保留在水相中,并且不会被式i的化合物萃取到有机相中。铂可以通过任何合适的方法从水相中回收,其选择可以由本领域技术人员做出。在一个实施方案中,水不混溶的有机溶剂是二氯甲烷、氯仿、氯苯或甲苯。在另一个实施方案中,水不混溶的有机溶剂是二氯甲烷。在一个实施方案中,所述方法进一步包括通过包括以下的方法从式i的化合物与溶解的金和/或钯之间的配合物中提取金和/或钯,所述方法包括在获得含金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相的条件下,将含有式i的化合物与溶解的金和/或钯之间的配合物的水不混溶的有机溶剂与含酸和硫脲的水溶液接触。在一个实施方案中,获得含金和/或钯的提取溶液和还原的金和/或钯的有机相的条件包括将水不混溶的有机溶剂与包含h2so4例如1mh2so4和硫脲,例如0.7m硫脲的水溶液在约10℃-约40℃或约20℃-约25℃的温度下搅拌约5分钟-约1小时或约15分钟的时间。其它合适的酸例如但不限于hcl可用于提取步骤中。然而,本领域技术人员将会理解,hcl具有腐蚀性,并且在随后的还原或电解提取期间hcl气体可能从溶液中排出。在另一个实施方案中,该方法进一步包括从含有式i的化合物的还原的金和/或钯的有机相中分离出含有金和/或钯的提取溶液,并从含有金和/或钯的提取溶液中通过电解提取或还原回收金和/或钯。包含金和/或钯的提取溶液和包含式i的化合物的还原的金和/或钯的有机相通过任何合适的方式分离,可以用于本申请的方法中的方式的选择由本领域技术人员来完成。在一个实施方案中,通过电解提取从含金和/或钯的提取溶液中回收金和/或钯。在另一个实施方案中,通过还原从含金和/或钯的提取溶液中回收金和/或钯。还原剂可以是任何合适的还原剂。在一个实施方案中,还原剂是草酸、zn粉末、fe粉末或nabh4。在一个实施方案中,还原剂是nabh4,并且使用约10℃-约35℃或约20℃-约25℃的温度。在另一个实施方案中,还原剂是草酸,并且使用约40℃-约60℃或约50℃的温度。在一个实施方案中,从含金、钯和/或铂的物质中浸出金、钯和/或铂的条件包括将含金、钯和/或铂的物质在约10℃-大约80℃、大约10℃-大约40℃或约20℃-约25℃的温度下与混合物搅拌约0.1分钟-约4小时、约0.1分钟-约2小时、约0.1分钟-约30分钟或小于约15分钟。混合物中的酸可以是任何合适的酸;即混合物中的酸可以是任何合适的质子供体。在一个实施方案中,酸为卤化氢(例如hcl、hbr或hi)、亚氯酸、氯酸、亚溴酸、溴酸、亚碘酸、碘酸、高氯酸、硫酸、硝酸、草酸、磷酸、有机酸(例如苯磺酸)或其组合。在一个实施方案中,酸选自hcl、h2so4、hbr、hno3、h3po4和hi。在另一个实施方案中,酸选自hcl、h2so4、hbr和hi。在另一个实施方案中,酸是hcl。酸的浓度可以是任何合适的浓度。在一个实施方案中,所述酸是浓度约0.01m-约4m的hcl水溶液。在另一个实施方案中,所述酸是浓度约0.5m-约4m的hcl水溶液。在一个实施方案中,酸是浓度约1m-约2.5m、约0.1m-约2.5m或约0.01m-约2.5m的hcl水溶液。在另一个实施方案中,酸为浓度约2m的hcl水溶液。在本申请的另一个实施方案中,酸是浓度约1m的hcl水溶液。混合物中的氧化剂可以是任何合适的氧化剂。在一个实施方案中,氧化剂是臭氧、硝酸(hno3)、过氧化氢(h2o2)、o2、鼓泡空气、i2、br2、cl2、oxonetm、铵多原子盐(例如亚氯酸铵、高碘酸铵(nh4io3)、过硼酸铵(nh4bo3)、氯酸铵(nh4clo3)、过硫酸铵(nh4)2s2o8)、次氯酸铵或硝酸铵)、次氯酸钙、多原子钠盐(例如过硫酸钠(na2s2o8)、硝酸钠或次氯酸钠)、多原子钾盐(例如高锰酸钾、过硫酸钾、碘酸钾、次氯酸钾或硝酸钾)、氧化锰,四烷基铵盐(例如亚氯酸四甲铵n(nh3)4)clo2)或高碘酸四甲铵(n(nh3)4)io4))、过氧单硫酸、尿素、过乙酸、链烷磺酸(例如甲磺酸)、芳族磺酸(例如苯磺酸)或其组合。在另一个实施方案中,氧化剂选自h2o2、cl2、br2、i2、ca(clo)2、hno3、mno2、kmno4和k2cr2o7。在另一个实施方案中,氧化剂是h2o2或ca(clo)2。在又一个实施方案中,氧化剂是h2o2。在一个实施方案中,氧化剂是ca(clo)2。氧化剂的浓度可以是任何合适的浓度。例如,水可能会降低本申请从含金物质中浸出金的方法中的浸出效率。在另一个实施方案中,氧化剂是浓度约0.01m-约1.0m的h2o2水溶液。在另一个实施方案中,氧化剂是浓度约0.05m-约0.5m的h2o2水溶液。一个实施方案中,氧化剂为浓度约0.1m-约0.3m的h2o2水溶液。在另一个实施方案中,氧化剂为浓度约0.005m-约0.5m的caclo2水溶液。在另一个实施方案中,氧化剂为浓度约0.01m-约0.2m的caclo2水溶液。在一个实施方案中,氧化剂为浓度约0.03m-约0.1m的caclo2水溶液。水混溶的或部分水混溶的有机溶剂可以是任何合适的水混溶的或部分水混溶的有机溶剂,包括有机酸如乙酸。在一个实施方案中,混合物中的水混溶的或部分水混溶的有机溶剂选自乙酸、乙酸乙酯、乙腈、四氢呋喃(thf)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)和甲醇(meoh)。在另一个实施方案中,水混溶的或部分水混溶的有机溶剂选自乙酸、乙酸乙酯、乙腈和thf。在又一个实施方案中,水混溶的或部分水混溶的有机溶剂选自乙酸、乙酸乙酯和乙腈。在另一个实施方案中,水混溶的或部分水混溶的有机溶剂是乙酸乙酯或乙腈。在一个实施方案中,水混溶的或部分水混溶的有机溶剂包含乙酸乙酯、基本由乙酸乙酯组成或由其组成。在另一个实施方案中,水混溶的或部分水混溶的有机溶剂包含乙腈、基本由乙腈组成或由其组成。在又一个实施方案中,水混溶的或部分水混溶的有机溶剂包含乙酸、基本由乙酸组成或由其组成。在一个实施方案中,混合物还包含金属卤化物、卤化铵或四烷基卤化铵、或其组合。在一个实施方案中,混合物包含金属卤化物,并且所述金属卤化物为碱金属卤化物、碱土金属卤化物或卤化铝或其组合。在一个实施方案中,金属卤化物是卤化钠、卤化钾、卤化锂、卤化钙、卤化镁或卤化铝,或其组合。在一个实施方案中,四烷基卤化铵是四(c1-4烷基)卤化铵,如四甲基氯化铵。在一个实施方案中,卤化铵是溴化铵或氯化铵,或其组合。在本申请的另一个实施方案中,混合物还包含选自nacl、kcl、nabr、kbr、nai、ki、cacl2、mgcl2、nh4br、nh4cl和n(ch3)4cl,或其组合的试剂。在另一个实施方案中,混合物进一步包含金属卤化物,并且所述金属卤化物为cacl2。在一个实施方案中,混合物中的cacl2具有约0.05m-约1.5m,约0.3m-约0.8m或约0.6m的浓度。在另一个实施方案中,混合物中的试剂(a)是hcl,混合物中的试剂(b)是h2o2并且混合物中的试剂(c)是乙酸。包含金、钯和/或铂的物质可以是包含金、钯和/或铂的任何合适的物质。在一个实施方案中,包含金、钯和/或铂的物质选自含金矿石、阳极残渣、包含铂族金属(pgm)的物质如pgm浓缩物、电子废料和珠宝废料。在一个实施方案中,包含金和/或钯的物质是含金的物质。在本申请的另一个实施方案中,含金物质是含金矿石。在本申请的另一个实施方案中,金矿石是氧化型金矿石。在另一个实施方案中,金矿石是耐火的金矿石。在一个实施方案中,含金物质还包含铁、铜、钴或镍或其组合,并且该方法选择性地从含金物质中溶解金。在一个实施方案中,所述方法提供至少500gm-2h-1,至少1000gm-2h-1,或至少5000gm-2h-1的金溶解速率。在另一个实施方案中,所述方法提供约500gm-2h-1-约9500gm-2h-1,或约1000gm-2h-1-约9500gm-2h-1的金溶解速率。在一个实施方案中,包含金、钯和/或铂的物质是含钯的物质。在本申请的另一个实施方案中,含钯物质是含钯矿石。在一个实施方案中,包含金、钯和/或铂的物质是含铂的物质。在本申请的另一个实施方案中,含铂物质是含铂矿石。在一个实施方案中,包含金、钯和/或铂的物质是含铂族金属的物质。在另一个实施方案中,含铂族金属的物质是铂族金属浓缩物。本领域技术人员将理解的是,在溶解含铂族金属,包括铂、钯、铑、锇、钌和铱的物质之后,式i的化合物可以选择性地将钯和金两者萃取到有机相中并从其余铂族金属中分离它们49。在本申请的另一个实施方案中,所述方法包括在与混合物接触之前将包含金、钯和/或铂的物质,例如含金矿石粉碎和/或研磨成颗粒。在另一个实施方案中,包含金、钯和/或铂的物质,例如含金矿石的颗粒尺寸小于或等于约75微米。以下非限制性实施例是本申请的说明:实施例实施例1:采用硫基配体选择性萃取和回收金的新的浸出方法通用配体合成通过以下报道的文献方法合成本研究中使用的配体i(a)(i)、i(a)(ii)、i(a)(iii)和i(a)(iv)(示意图2).49。基于报道的方法合成配体i(b)(i)(n-苯基-n'-苯甲酰基硫脲)50。例如,对于配体i(a)(i)-i(a)(iv),在圆底烧瓶中,在室温下在1小时的时间内将1.1当量的取代胺以小份加入到1.3当量cs2和1当量碳二亚胺在甲醇中的溶液。将反应混合物搅拌4小时,然后通过过滤将所得白色沉淀物从溶液中分离出来。最后用水洗涤并真空干燥。合成配体l1在圆底烧瓶中,在室温下,将2.02g吡咯烷在1小时内以小份加入2.80gcs2和5.85g二环己基碳化二亚胺(dcc)在30ml甲醇中的混合物中。反应混合物搅拌4小时,然后通过过滤将所得白色沉淀物从溶液中分离出来。最后用水洗涤并真空干燥。分离出8.93g最终产物(产率:89%)。制备金粉末采用jeffrey等人报道的方法制备金粉末51。将1.000g纯(纯度99.9%)的金属金溶于4ml王水(3ml37%hcl/1ml69%hno3)中,然后通过加入蒸馏水稀释5倍。在缓慢搅拌的同时,将焦亚硫酸钠逐渐加入到溶液中。继续加入na2s2o5,直到所有的金从溶液中沉淀出来(颜色从黄色变成无色溶液)。分离得到的沉淀,用1mhcl洗涤,然后用蒸馏水洗涤,最后在烘箱中干燥。获得0.975g浅棕色金粉末(产量:97.5%)。(a)同时浸出和溶剂萃取盐酸浓度的影响将5.0mg金粉末(0.025mmol)加入到含有5ml不同浓度(0.1、0.5、1、1.5和2m)的hcl溶液和0.22mhno3的小瓶中。然后,将26.8mg(0.075mmol)配体i(a)(i)溶于5ml二氯甲烷中并加入到先前的溶液中。剧烈搅拌反应混合物不同的时间。当反应完成时,分离两相,并用含有0.7m硫脲的5ml1mh2so4溶液将有机相提取15分钟。通过aas分析提取溶液的金含量。初步研究(表1)表明,传统的hcl/hno3浸出与使用二硫代缩二脲配体的同时浸出和萃取(条目3相对于4)之间存在显着差异。虽然不希望受到理论的限制,但最初的微量浸出金被硫基配体萃取到有机相中,推动了金浸出平衡(示意图1),其实现提高的浸出动力学。结果显示在低hcl浓度下没有显著的金回收(条目1,2)。但是,通过增加hcl浓度,可以在1mhcl或更高的浓度下完全回收金。从表1中可以看出,当hcl浓度为1m时,在4小时内达到了99%以上的回收率(条目4),并且在更高的摩尔浓度下回收时间更短(条目5,6)。因此,选择1m(mol/l)hcl作为其它实验的酸浓度。搅拌时间的影响将5.0mg金粉末(0.025mmol)加入到含有5ml1mhcl和0.22mhno3的小瓶中。然后,将26.8mg(0.075mmol)配体l1溶于5ml二氯甲烷中并加入到先前的溶液中。剧烈搅拌反应混合物不同的时间。当反应完成时,分离两相,用5ml含有0.7m硫脲的h2so4(1m)提取有机相15分钟。通过aas分析提取溶液的金含量。得到的结果(图2)表明,同时浸出和萃取体系的金回收百分比迅速增加,直到4小时后达到99%,并保持不变。这比使用相同量的hcl和hno3的传统浸出体系快得多。发现使用本体系的au回收的有效浸出时间在1mhcl溶液中为4小时。传统的浸出体系与本研究的比较表明,二硫代缩二脲配体能用最少量的酸和氧化剂有效地提高金浸出率。除了浸出步骤之外,新技术同时从水溶液中回收金;因此与氰化物浸出和随后的活性炭吸附相比,金回收的总体时间可以短得多。配体浓度的影响将5.0mg金粉末(0.025mmol)加入到含有5ml1mhcl和0.22mhno3的小瓶中。然后,将不同量的配体l1(表2)溶于5ml二氯甲烷中并加入到先前的溶液中。剧烈搅拌反应混合物4h。当反应完成时,分离两相,用5ml含有0.7m硫脲的h2so4(1m)提取有机相15分钟。通过aas分析提取溶液的金含量。表2显示了不同配体与au比例的金回收百分比。以1:1的摩尔比,在优化的hcl和氧化剂浓度下,只有42%的金被回收。金的回收率随着有机溶剂中配体浓度的增加而增加,并在3:1的摩尔比(l:au)时基本完成。不同配体衍生物的效率合成了二硫代缩二脲配体的不同衍生物(i(a)(i)-i(a)(iv)),并研究了它们在hcl介质中同时浸出和萃取金的能力(示意图2)。与单齿硫脲衍生物(l1)和常规金萃取剂二丁基卡必醇(dbc)相比,所有二硫代缩二脲衍生物显示出更高的金回收率。在不同的二硫代缩二脲衍生物(i(a)(i)-i(a)(iv))中,i(a)(i)显示出最高的au回收率%。dbc是用于从酸性溶液中选择性萃取金的最常用的金萃取剂。尽管在传统溶剂萃取技术中它是一种有效的金萃取剂,但是在本发明的同时浸出和萃取条件下,即使在极高浓度的萃取剂下(条目6,表3),它也表现出非常低的金回收率。还研究了配体i(b)(i)。将5.0mg金粉末(0.025mmol)加入到含有5mlhcl(1m)和hno3(0.22m)的小瓶中。然后,将20.3mg(0.075mmol)合成的配体i(b)(i)溶于5ml二氯甲烷中并加入到先前的溶液中。剧烈搅拌反应混合物6小时。当反应完成时,分离两相,并用含有0.7m硫脲的5mlh2so4(1m)溶液将有机相提取15分钟。通过aas分析提取溶液的金含量。结果显示回收了99.0%的金。选择性为了研究本技术的选择性,通过该体系处理氯化物形式的不同金属的混合物。将fe(1000ppm)、cu(2000ppm)、zn(500ppm)、ag(200ppm)和0.5mg金粉末的混合物加入含有1m5mlhcl和0.2mhno3的小瓶中。然后,将26.8mg配体l1溶于5ml二氯甲烷中并加入到先前的溶液中。剧烈搅拌反应混合物不同的时间。当反应完成时,分离两相,用5ml含有0.7m硫脲的1mh2so4提取有机相15分钟。通过aas分析后萃取和提取溶液的金属含量。表4所示的结果表明,采用二硫代缩二脲配体的同时浸出和萃取技术对金具有很高的选择性,因此即使在大量的游离配体存在的情况下也只能萃取痕量的普通金属。与氰化方法相比,本技术可以例如消除将金与其它杂质分离的整个活性炭步骤。有机溶剂的影响在表5中所示的水不混溶的有机溶剂中进行同时的浸出和萃取试验。结果表明许多有机溶剂适用于金的萃取和回收。在所研究的溶剂中,当使用二氯甲烷(dcm)、氯苯或氯仿作为溶剂时,获得最高的au回收率。(b)金矿处理从clauderesources位于saskatchewanlaronge镇东北约125公里处laonil湖北端laronge矿区的seabee金矿运营中心获得平均金含量为7ppm,平均粒度为74微米的粉碎的和研磨的金矿。同时浸出和溶剂萃取的一般实验:图3示出了本实施例的同时浸出和溶剂萃取技术200的方法流程图。在方法200中,将平均粒度为74微米的粉碎并磨碎的金矿202进行同时浸出和萃取步骤204,其中在hno3存在下将矿石202加入到1mhcl溶液中;然后将配体i(a)(i)在二氯甲烷中的溶液加入到水溶液206中。剧烈搅拌得到的两相反应混合物5小时。然后过滤混合物以除去固体残留物208,并相分离210成有机相212和水相214。水相214可被回收用于同时浸取和萃取步骤204中。然后用含有0.7m硫脲218的1mh2so4将有机相212提取21615分钟,并且通过aas分析提取溶液的金含量,表明金回收效率始终在95-97%的范围内。在提取步骤216之后,可以将配体和dcm回收220以用于同时浸出和萃取步骤204中。可进行电解提取或还原步骤222以分离纯金224。或者,代替提取步骤216,可以用诸如草酸或nabh4226等试剂还原有机相212以提供纯金228。如果有机相对还原剂敏感,则可以使用从二硫代缩二脲金配合物中的金的硫脲提取216。然而,负载的有机相的直接还原226可能更经济。例如,在包括提取216有机相的方法200中,使用随后的电解提取或还原步骤222来获得金属金224,而在包括直接还原步骤226的方法200中,可以少用一步得到金属金228。在本实验中,由于使用了样品中的低浓度金,并且测量了体系的效率,分析最终的金溶液。因此,有机相通常被提取,其含金量由aas测量,而不是称重沉淀的金。同时浸出和溶剂萃取的示例性实验:将5.0g平均粒度为74微米的粉碎和磨碎的金矿石加入到含有5ml1mhcl和0.55mhno3的小瓶中。然后将27.8mg溶于5ml二氯甲烷中的配体i(a)(i)加入到水溶液中。剧烈搅拌反应混合物5h。然后过滤两相反应混合物,并且分离有机相。然后用5ml含有0.7m硫脲的h2so4(1m)提取有机相15分钟,并且用aas分析提取溶液的金含量。最终的溶液包含6.7ppm的金(96%的金回收率)。(c)比较例:用氰化物溶液处理金矿石:将5.00g金矿石加入含有10ml碱性溶液(ph=10.5,通过将适量的koh溶于蒸馏水中调节ph)的小瓶中。向溶液中加入0.20gkcn,剧烈搅拌反应混合物(对空气开放)24小时。在开始之前和反应完成之后称重反应混合物以估计在浸出过程中蒸发的水量。然后将适量的水加入到反应混合物中以保持浆料的密度恒定。通过原子吸收光谱法测量所得溶液的金含量。本实验是为了确定矿石样品中的金含量,并比较本研究的溶剂萃取技术与氰化浸出技术的效率。对clauderesources矿区的金矿石重复进行氰化实验20次,结果表明平均含金量在9.5-10ppm之间。(d)讨论:溶剂萃取技术作为浸出技术合适的含硫化合物是从矿石中回收金的有用的候选物,因为根据pearson的“硬酸/软酸和硬碱/软碱”的概念,贵金属如金通常被分类为软酸,而含硫化合物被归类为软碱。因此,合适的含硫配体如螯合配体可以用作高选择性萃取剂用于金的萃取和回收49。式i的化合物,其中,例如,r1是-nr4r5;x是s;并且y和r2-r5如本文所定义,可用于从水溶液中选择性萃取贵金属如金。式i的化合物,其中,例如,r1是芳基;x是o;并且r1-r3如本文所定义,也可用于从水溶液中选择性萃取贵金属如金。例如,当x是s时,配体具有两个强供体位点(硫羰基)与贵金属结合,这使得它成为一个强双齿配体,可以与贵金属如金形成高度稳定的六元环配合物(例如,式ii(a)的化合物,其中m包含贵金属如au;且y和r2-r5如本文所定义)。此外,根据示意图3中描述的共振贡献者,氮原子将增加硫原子上的路易斯碱性,使得硫电子可更多地供给金属中心(当y=n或s而不是c时,存在进一步的共振贡献者)。其中x=o和r1=芳基的配体的表现类似,但发现需要更长时间才能溶解金;例如六个小时才能完全溶解金,而对于二硫代缩二脲配体(x=s)研究的时间则是四个小时。在典型的已知溶剂萃取方法中,所需金属首先在氧化剂如过氧化氢或hno3存在下使用大量酸溶解到水中。在第二步中,金属将被萃取到有机相中。通常需要随后的处理来去除在处理中也被萃取的其它金属杂质。然后将溶剂去除,所需的金属将被还原成其基本金属形式。盐酸与hno3、h2o2和cl2等强氧化剂结合是金和其它过渡金属的著名浸出介质,但只有使用高浓度的酸和氧化剂才能达到高效率。通过降低已知工艺中的盐酸浓度,浸出动力显著降低。但是,通过保持高浓度的氧化剂和hcl,它们的消耗将不经济并产生高度腐蚀性介质。另外,在金矿的情况下,温度也通常增加以获得有效的浸出。示意图4中所示的二硫代缩二脲衍生物已被公开为用于从盐酸介质中选择性萃取金的配体49。在目前的研究中,浸出和萃取步骤都是在温和条件下同时进行的,这提高了整个工艺的效率。如上面示意图1所示,这是通过将溶解的金从含有少量酸和氧化剂的水溶液中排出到含有配体的有机相中,迫使反应平衡向右而实现的。在这样的方法中,使用能够萃取甚至非常少量的溶解的金的高效配体。在已知的方法中,溶剂萃取通常在浸出步骤之后进行。就本发明人所知,同时进行两个步骤以改善浸出步骤(以及总萃取率)从未有过报道过。实施例2:同时浸出和溶剂萃取钯将5.0mg钯粉末(0.047mmol)加入到含有5mlhcl(1m)和hno3(0.22m)的小瓶中。然后,将64.95mg(0.184mmol)配体i(a)(i)溶于5ml二氯甲烷中并加入到先前的溶液中。2小时后,钯完全溶解。分离两相,用5ml含有0.7m硫脲的h2so4(1m)提取有机相(深褐色)15分钟。然后过滤出黄色沉淀物,并在炉中加热至700℃以生成细黑色钯粉末(回收了99.3%的钯)。实施例3:有机溶剂中浸出金选择盐酸和过氧化氢的混合物作为在不同的水混溶的或部分水混溶的有机溶剂中的浸出剂。向含有500mg浓hcl(37%w/w)和60mgh2o2(30%w/w)的5ml有机溶剂中加入5.0mg金粉并搅拌不同时间。反应完成后,溶解的金被沉淀出来,得到的沉淀溶解在王水中并且通过溶剂萃取体系进行纯化49。用aas分析最终溶液的金含量。在金溶解不完全的情况下,通过过滤将负载的有机相与剩余的金分离。在表6中所示的不同溶剂中,尽管hcl(1m)和氧化剂(0.1m)的浓度很低,乙酸乙酯和乙腈都在非常短的时间(14min)内仍显示出最高的%au浸出率。这些结果表明通过含有少量hcl和h2o2的乙酸乙酯或乙腈溶液的浸出时间非常短。表7提供了与使用王水的体系相比,在含有不同浓度的hcl和氧化剂(h2o2orca(clo)2))的乙酸乙酯、乙酸和乙腈中金浸出的结果的综述。在每个试验中,将5.0mg金粉溶解在5ml含有不同量的hcl和氧化剂的有机溶剂中,具体如表7所示。王水体系使用的氧化剂(hno3)和hcl的浓度要比使用有机溶剂的体系高得多。在这些实验中观察到的浸出速度足够快以至于粒度都不是问题。金矿石在乙酸乙酯、乙酸或乙腈中浸出的一般实验细节:图4示出了方法300的方法流程图,其包括在水混溶的或部分水混溶的有机溶剂如乙酸乙酯、乙酸或乙腈中浸出。该技术对于高效金浸出是有用的,例如在乙酸乙酯、乙酸或乙腈中使用低浓度的hcl和h2o2而不是水。在方法300中,通过将粉碎并研磨的金矿石302加入到与1m浓度的hcl和0.1mh2o2306一起的水混溶的或部分水混溶的有机溶剂如乙酸乙酯、乙酸或乙腈中进行浸出步骤304。搅拌得到的混合物4h。将乙酸乙酯或乙腈从固体残余物312中分离出来以获得在乙酸乙酯、乙酸或ch3cn310中溶解的金(haucl4)的溶液,然后在真空下蒸发314。然后将得到的沉淀物溶于0.1mhcl中,并且用溶剂萃取法316,采用i(a)(i)在dcm中萃取金,最后用含0.7m硫脲的h2so4(1m)提取(未示出)49。通过aas测定所得到的金含量,证明了例如最小99%的金回收效率。提取后,可还原有机相318以获得纯金320。在另一种途径中,在乙酸乙酯、乙酸或ch3cn310中溶解的金(haucl4)的溶液用试剂如nabh4、二茂铁、fe粉末或zn粉末322还原。使用包含这种还原步骤322的方法而不是上述包含蒸发步骤314的方法可以提供某些优点,例如,因为蒸发溶剂是额外的花费,例如需要能量和升高的温度来蒸发溶剂。通过用上述还原剂之一还原金,可以省却蒸发步骤314,并且可以直接回收溶剂。由此在还原步骤322之后获得的金然后可以进行溶剂萃取工艺324,采用例如i(a)(i)在dcm中并且用含有0.7m硫脲的1mh2so4提取(未示出)。提取后,可还原有机相326以获得纯金328。在还原步骤322后除去的乙酸乙酯、乙酸或ch3cn可被回收330以用于浸出步骤304。方法300中的溶剂萃取步骤(316,324)可用于例如去除可与金一起还原的杂质如铜。这样的溶剂萃取步骤(316,324)可以包括传统的浸出和溶剂萃取步骤(即在王水中浸出),或者可以包括例如在一个步骤中从含金物质浸出和萃取金的方法,如本文所述。金矿石在乙酸乙酯、乙酸或乙腈中浸出的示例性实验细节:将5.0g平均粒度为74微米的粉碎和磨碎的金矿石加入到含有350mg浓hcl和200mgh2o230%w/w的5ml乙酸乙酯、乙酸或乙腈中。搅拌得到的混合物4h。将乙酸乙酯、乙酸或乙腈从固体残余物中分离并真空挥发。然后将得到的沉淀物溶解于2ml0.1mhcl中,并用2mldcm中的27.2mgi(a)(i)通过溶剂萃取法萃取金,最后用含0.7m硫脲的2ml1mh2so4提取。通过aas测定所得到的金含量,显示出96-97%的金回收效率。实施例4:还原不同有机溶剂中浸出的金对于每个试验,如表8所示,将含有不同量的金的5ml有机溶剂(其含有0.5g的37%hcl;即有机溶剂中的hcl的摩尔浓度为1m)用指定的还原剂处理10分钟。在fe粉末的情况下,搅拌时间为2小时。用aas测量金溶液的浓度。实施例5:在有机溶剂中溶解钯选择盐酸和过氧化氢的混合物作为不同水混溶的或部分水混溶的有机溶剂(乙酸乙酯、乙酸或乙腈)中的浸出剂。将5.0mg钯粉末(200目)在室温下加入到含有500mg浓hcl(37%w/w)和60mgh2o2(30%w/w)的5ml有机溶剂(乙酸乙酯、乙酸或乙腈)的搅拌混合物中。15min后,钯粉末完全溶解,得到澄清的红色溶液。实施例6:在有机溶剂中溶解铂在室温下,向含有500mg浓hcl(37%w/w)和60mgh2o2(30%w/w)的搅拌的有机溶剂(乙酸乙酯、乙酸或乙腈)中加入5mg铂粉末(200目)。90分钟后,铂粉末完全溶解并且得到淡黄色溶液。实施例7:卤化物盐的加入对酸混合物的影响(a)测量金溶解速率将120mg(0.610mmol)直径0.25mm的金丝(99.9%)置于含有所需量的酸、氧化剂和任选的cacl2的20ml乙酸中,并在800rpm(搅拌盘设定)下在不同温度下搅拌不同的时间(10-60分钟)。然后将剩余的金丝从反应混合物中取出、用丙酮洗涤并风干。然后称量剩余的金丝以计算溶解的金的量。根据丝直径、质量变化和溶解时间确定溶解速率。表9显示了在室温下在不同条件下的金溶解速率。图5是显示王水、浓hcl/h2o2和乙酸体系之间的金溶解速率比较研究的图。图5显示了王水、浓hcl/h2o2和和乙酸体系的金溶解速率之间的比较。乙酸中的试剂浓度是hcl(1.5m)、h2o2(0.6m)和cacl2(0.6m)。hcl/h2o2混合物是通过混合4份浓hcl与1份h2o230%而新鲜制备的。(b)金矿处理将5.00g金矿石加入到所需量的含有所需量的hcl、h2o2和cacl2的乙酸(5.0ml或10.0ml)中。所得混合物在800rpm下搅拌不同时间。通过离心(1min)将乙酸从固体残余物中分离并真空挥发。然后将所得残余物溶于2.0ml1mhcl中,并通过icp-oes测定其金含量(表10)。(c)从印刷电路板上选择性提取金将20g没有粉碎的印刷电路板(pcbs)加入到含有0.5mhcl、0.2mcacl2和0.2mh2o2的100ml乙酸溶液中,搅拌2min。将处理的碎片分离并用水洗涤,然后用热王水处理以观察是否有金剩余。icp显示超过99%的金被浸出,而少于5%的镍和1%的铜被溶解。在观察到任何活性损失之前,将同一溶液重复使用75次,以从新pcbs中浸出金(即总共用100mlhoac溶液处理1.5kgpcbs)。使用hoac体系(包含0.5mhcl、0.2mh2o2和0.2mcacl2)室温在不到20秒的时间内从pcbs浸出金导致选择性金溶解(即底层镍仍然存在)。(d)结果和讨论本文公开了迄今发表的具有最高金溶解率的新型金浸出体系。该体系使用乙酸作为溶剂并含有非常低浓度的另外的酸和氧化剂。除了无与伦比的金溶解率外,这种新的浸出体系对金的选择性也高于普通金属,使得金的溶解速度比铁、镍、钴和铜更快。在金矿石、首饰废料和电子废物(废料)上测试了新的浸出体系的效率,结果在室温下分别在仅仅只有25分钟、10分钟和10-20秒下,金浸出量>99%。通过在温和条件下使用乙酸作为溶剂,已经获得室温下金的溶解速率为6020gm-2h-1(快于王水三倍)(表9,11)。这个结果代表了在有机或含水体系中金溶解已知的最快速率记录(比任何其它已知体系快得多)。将体系加热至60℃,金溶解速率进一步增加至9000gm-2h-1(表11)。从表11中的条目13和14也可以看出,与使用水作为溶剂的对比体系获得的金溶解速率(5.1gm-2h-1)相比,使用乙酸作为溶剂进行溶解获得显著提高的金溶解速率(6020gm-2h-1)。除了其快速的溶解动力学之外,与浓hcl/h2o2和王水体系相比,这种新的浸出方法对金的亲和力远远高于普通金属,使得金的溶解速度比大多数普通金属更快(图6)。这种选择性使得试剂消耗减少,并且有助于使得该萃取技术比王水和浓hcl/h2o2都更经济。这种乙酸方法不仅是已知的最快速的金溶解体系,而且例如比王水或氰化物体系更容易操作、节能和安全。通过回收利用,与其它体系相比,乙酸体系产生的废液量最少,而且与氰化方法相比,也消除了大量用水的要求,这使得这种新技术在没有机会获得水源的偏远金矿的广泛应用。表11基于报道的浸出体系的金溶解速率比较了这种萃取方法的效率。乙酸方法实质上比所报道的浸出方法更有效,同时保持温和的操作条件。新的浸出体系的快速动力学以及低的试剂消耗、简单的化学反应、环境温度处理以及使用市售和更环保的试剂使得这种新的浸出体系用于从所有含金材料大规模萃取金的操作。尽管已经参照实施例描述了本申请,但是应当理解的是,权利要求的范围不应该由实施例中阐述的实施方案限制,而是应该给予与整个说明书一致的最宽泛的解释。所有的出版物、专利和专利申请通过引用整体并入本文,以其如同每个单独的出版物、专利或专利申请被具体和单独地指出通过引用整体并入的程度。当在本申请中的术语被发现在以引用的方式并入本文的文件中被不同地定义的情况下,本文提供的定义用作该术语的定义。在申请中提及的文件的全部引用1j.mardsen,i.house,thechemistryofgoldextraction.1992,westsussex,england.2e.b.amey,“gold”usgsmineralyearbook2004(washington,d.c.,usgs,2004),pp.34.1-34.9.3anonymous,“gold”miningjournal,(june11,2004),pp.19-24。4a.c.grosse,g.w.dicinoski,m.j.shaw,p.r.haddad,hydrometallurgy2003,69,1-21。5i.chandra,m.i.jeffrey,hydrometallurgy2005,77,191-201。6g.a.munoz,j.d.miller,mineralsandmetallurgicalprocessing,2000,17,198–204。7dai,x.,breuer,p.l.,jeffrey,m.i.minerals&metallurgicalprocessing,2010,27,190-195。8m.d.adams,b.sceresini,elsevier,2005,789-824。9j.z.jiang,w.j.zhou,h.c.gao,j.g.wu,g.x.xu,andj.chen.j.inorg.chem.2001,17,343–48.10p.d.kondos,g.deschénes,r.m.morrison,hydrometallurgy,1995,39,235-250.11f.habashi,atextbookofhydrometallurgy,métallurgieextractivequébec,québeccity,canada,secondedition,1999.12g.q.lui,w.t.yen,mineralsengineering,1995,8,111-123.13g.deschénes,g.wallingford,mineralsengineering,1995,8,923-931.14grosse,a.c.;dicinoski,g.w.;shaw,m.j.;haddad,p.r.hydrometallurgy,2003,69,1-21.15dai,x.,breuer,p.l.,jeffrey,m.i.minerals&metallurgicalprocessing,2010,27,190-195.16grosse,a.c.dicinoski,g.w.shaw,m.j.haddad,p.r.hydrometallurgy,2003,69,1-21.17j.z.jiang,w.j.zhou,h.c.gao,j.g.wu,g.x.xu,andj.chen.j.inorg.chem.2001,17,343–48.18x.m.zhang,g.senanayake,m.j.nicol,hydrometallurgy,2004,74,243.19g.rabai,i.r.epstein,inorg.chem.1992,31,3239.20s.zhang,m.j.nicol,jappl.electrochem,2003,33,767.21ritchie,i.m.,nicol,m.j.,staunton,w.p.,young,c.(ed.),cyanide:socialandeconomicaspects.tms,warrendale,2001,pp.427–440.22berezowsky,r.m.g.s.,sefton,v.b.,108thaimeannualmeeting,neworleans,louisiana,1979,pp.1–17.23aylmore,m.g.,muir,d.m,miner.eng.2001,14,135–174.24breuer,p.l.,jeffrey,m.i.,hydrometallurgy,2003,70,163–173.25feng,d.,vandeventer,j.s.j.,hydrometallurgy,2006,82,126–132.26kazakov,v.p.;lapshin,a.i.;peshchevitskii,b.i.russ.j.inorg.chem.1964,9,708.27plaskin,i.n.andkozhukhova,m.a,sborniknauchnyhktrudov,instituttsvetnykhmetallov,1960,33,107–119.28preisler,p.w.andberger,l.,journaloftheamericanchemicalsociety,1947,69,322–325.29schulze,r.g.,1984,journalofmetals,1984,36,62–65.30groenewald,t.,hydrometallurgy,1976,1,277–290.31n.,hydrometallurgy,2003,69,169–176.32krzewska,s.andpodsiadly,h.,journalofinorganicandnuclearchemistry,1980,42,83–86.33s.,atalay,.hydrometallurgy,2002,67,71-77.34j.w.mellor,acomprehensivetreatiseofinorganicandtheoreticalchemistry(london:longmangreen&co.,1923),p.499.35f.habashi,principlesofextractivemetallurgy,vol.2nded.(newyork:gordonandbreach,1980),p.39.36finkelstein,n.p.,hoare,r.m.,james,g.s.,howat,d.d.,journalofthesouthafricaninstituteofminingandmetallurgy,1996,67,196–215.37filmer,a.o.,lawrence,p.r.,hoffman,w.,1984.acomparisonofcyanide,thiourea,andchlorineaslixiviantsforgold.gold-mining,metallurgy,andgeology.australasianinstituteofminingandmetallurgy,melbourne,pp.279–287.38ikiz,d.,gulfen,m.,aydin,a.o.mineralsengineering,2006,19,972–974.39jeffrey,m.i.,breuer,p.l.,choo,w.l.metall.mater.trans.2001,b32,979–986.40nesbitt,c.c.,milosavljevic,e.b.,hendrix,j.l.,chem.res.1990,29,1696-1700.41ghobeitihasab,m.,rashchi,f.,raygan,sh.miner.eng.2013,50–51,140–142.42ghobeitihasab,m.,raygan,sh.,rashchi,f.,hydrometallurgy,2013,138,59–64.43cheng,y.shen,s.zhang,j.chen,s.xiong,l.liuj.ind.eng.chem.res.2013,52,16622-16629.44parker,a.j.muir,d.j.smart,y.c.avraamides,j.hydrometallurgy,1981,7,213-233.45yoshimura,a.takai,m.matsuno,y.hydrometallurgy,2014,149,177-182.46gill,j.b.goodall,d.c.jeffreys,b.hydrometallurgy,1984,13,221-226.47lin,w.zhang,r.w.jang,s.s.wong,c.p.hong,j.angew.chem.int.ed.2010,49,7929–7932.48yukimichi,n.j.chem.soc.,chem.commun.1992,426-427.49moradi,l.salimi,h.piltan,m.yavari,i.unitedstatespatent.pub.no.us2012/0228151a1.sep.13,2012.50vest,p.schuster,m.konig,k.h.freseniusjanalchem.1991,341,556-568.51jeffrey,m.breuer,p.l.chu,c.k.int.j.miner.process.2003,72,323-330.52oraby,e.a.&eksteen,j.j.theleachingofgold,silverandtheiralloysinalkalineglycine–peroxidesolutionsandtheiradsorptiononcarbon.hydrometallurgy152,199-203(2015).53geoffroy,n.&cardarelli,f.amethodforleachingordissolvinggoldfromoresorpreciousmetalscrap.jom.57,47-50(2005).54senanayake,g.goldleachinginnon-cyanidelixiviantsystems:criticalissuesonfundamentalsandapplications.miner.eng.17,785-801(2004).55li,j.etal.thiocyanatehydrometallurgyfortherecoveryofgold.partii:theleachingkinetics.hydrometallurgy113–114,10–189(2012).56li,j.&miller,j.d.areviewofgoldleachinginacidthioureasolutions.miner.process.extr.metall.rev.27,177–214(2006).57lin,w.,zhang,r.w.jang,s.s.,wong,c.p.&hong,j.i.“organicaquaregia”—powerfulliquidsfordissolvingnoblemetals.angew.chem.int.ed.49,7929–7932(2010).58nam,k.s.etal.useofchloride–hypochloriteleachantstorecovergoldfromtailing.int.j.miner.process.86,131-140(2008).59nakao,y.&sone,k.reversibledissolution/depositionofgoldiniodine–iodide–acetonitrilesystems.chem.commun.8,897-898(1996).60yoshimura,a.,takai,m.&matsuno,y.novelprocessforrecyclinggoldfromsecondarysources:leachingofgoldbydimethylsulfoxidesolutionscontainingcopperbromideandprecipitationwithwater.hydrometallurgy149,177-182(2014).表1.在不同的hcl浓度下同时浸出和萃取金粉末条目hcl(m)time(h)au回收率(%)10.145.320.5420.73144.6*41499.251.5399.1622.599.3*用hcl/hno3传统的浸出。表2.在不同的配体:au比例下同时浸出和萃取金粉末条目配体:auau回收率%11:142.722:172.433:199.544:199.4表3.在不同的配体下同时浸出和萃取金粉末条目配体au回收率%1i(a)(i)99.72i(a)(ii)72.43i(a)(iii)96.54i(a)(iv)70.45l13.36dbc5.1**纯dbc用作有机相。表4.其它杂质对同时浸出和萃取金的影响(在大量过量fe、cu和zn杂质的情况下萃取113ppm的金)fecuznau水相(ppm)991.82140.3542.80.3提取溶液(ppm)0.40.10.1112.3表5.在不同的水不混溶的有机溶剂中同时浸出和萃取金粉末。条目溶剂au回收率%1dcm99.92氯仿97.43二氯乙烷68.44氯苯98.85二氯苯61.36甲苯56.1表6.在含有hcl和h2o2的不同的水混溶的有机溶剂中的金浸出。条目溶剂搅拌时间(h)金浸出%1thf0.5242thf51003dmf24564dmso24315乙酸乙酯0.251006mecn0.251007meoh2413表7.包含不同hcl和氧化剂浓度的不同溶剂中的金浸出条目溶剂氧化剂(m)hcl(m)搅拌时间(min)金浸出%1乙酸乙酯h2o2(0.10)1141002乙酸乙酯h2o2(0.20)161003乙酸乙酯h2o2(0.30)141004乙酸乙酯h2o2(0.10)241005乙酸乙酯h2o2(0.10)241006mecnh2o2(0.10)1141007mecnh2o2(0.20)161008mecnh2o2(0.30)141009mecnh2o2(0.10)2410010mecnh2o2(0.10)2410011乙酸乙酯ca(clo)2(0.03)1610012乙酸乙酯ca(clo)2(0.05)1410013乙酸乙酯ca(clo)2(0.10)1310014mecnca(clo)2(0.03)1610015mecnca(clo)2(0.05)1410016mecnca(clo)2(0.10)1310017ch3coohh2o2(0.10)11410018ch3coohh2o2(0.20)1610019ch3coohca(clo)2(0.03)1610020ch3coohca(clo)2(0.05)1410021王水hno3(2.92)9.68100表8.还原在不同有机溶剂中浸出的金表9.不同条件下乙酸中的金溶解速率表10.在不同的条件下,室温下氰化方法与乙酸体系进行金矿石浸出的结果*对于样品1-5,溶剂是乙酸,对样品6是ph=10.5的水。**在60℃进行金浸出。***矿石中的金浓度为10.4ppm。表11.不同浸出体系中金溶解速率的比较*rt=室温当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1