得自钴资源的硫酸钴/连二硫酸钴液剂的加工的制作方法
本申请为要求在2016年11月11日提交的临时申请no.62/421,139的优先权的非临时申请。本发明涉及从包含硫酸盐和连二硫酸盐的液剂(liquor)例如由包含钴的资源材料例如来自锂离子电池的正极材料的湿法冶金加工而得到的那些回收水和硫酸盐。
背景技术:
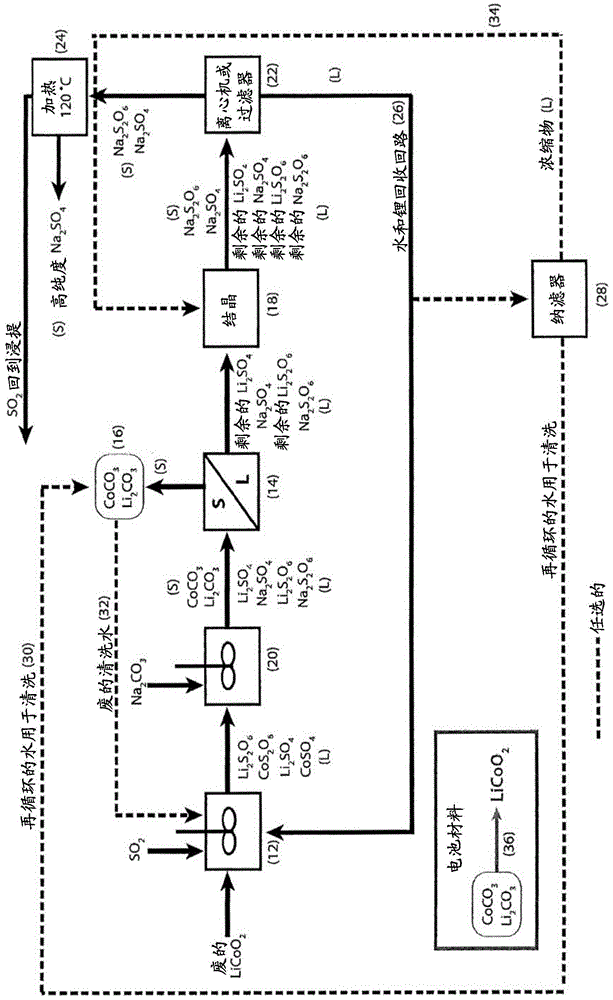
:众所周知,可将还原剂例如二氧化硫与硫酸组合使用而从包含较高价钴的资源材料例如氧化钴(iii)浸提(浸出,leach)钴以产生硫酸钴和连二硫酸钴。这描述于以下反应中:co2o3+so2+h2so4=2coso4+h2oco2o3+2so2+h2so4=2cos2o6+h2o可再充电的锂离子电池正极材料中存在的钴处于三价状态并且预计用二氧化硫和硫酸浸提。锂钴氧化物例如licoo2为用于典型地用在个人电子设备中的高能量锂离子电池的常见的正极材料,预计根据以下反应而浸提:2licoo2+so2+2h2so4=li2so4+2coso4+2h2o2licoo2+3so2+2h2so4=li2so4+2cos2o6+2h2o2licoo2+4so2+2h2so4=li2s2o6+2cos2o6+2h2o关于将锂钴氧化物用二氧化硫和硫酸浸提所进行的实验工作证实,实现了锂和钴的最高达100%提取并且在所进行的所有浸提试验中均检测到连二硫酸盐。锂镍锰钴氧化物例如lini0.33mn0.33co0.33o2是适合用于电动车中的具有高的能量和高的功率两者的新兴正极材料,预计根据以下反应浸提:2lini0.33mn0.33co0.33o2+so2+2h2so4=li2so4+2(ni,co,mn)so4+2h2o2lini0.33mn0.33co0.33o2+3so2+2h2so4=li2so4+2(ni,co,mn)cos2o6+2h2o2lini0.33mn0.33co0.33o2+4so2+2h2so4=li2s2o6+2(ni,co,mn)s2o6+2h2o(ni,co,mn)so4和(ni,co,mn)s2o6分别表示混合金属硫酸盐和混合金属连二硫酸盐。关于将锂镍锰钴氧化物用二氧化硫和硫酸浸提所进行的实验工作证实,实现了锂、镍、锰和钴的最高达100%提取并且在所进行的所有浸提试验中均检测到连二硫酸盐。锂镍钴铝氧化物例如lini0.8co0.15al0.05o2是适合用于电动车中的具有高的能量和高的功率两者的另一种新兴正极材料,预计根据以下反应浸提:2lini0.8co0.15al0.05o2+so2+2h2so4=li2so4+2(ni,co,al)so4+2h2o2lini0.8co0.15al0.05o2+3so2+2h2so4=li2so4+2(ni,co,al)cos2o6+2h2o2lini0.8co0.15al0.05o2+4so2+2h2so4=li2s2o6+2(ni,co,al)s2o6+2h2o(ni,co,al)so4和(ni,co,al)s2o6分别表示混合金属硫酸盐和混合金属连二硫酸盐。关于将锂镍锰钴氧化物用二氧化硫和硫酸浸提所进行的实验工作证实,实现了锂、镍、钴和铝的最高达100%提取并且在所进行的所有浸提试验中均检测到连二硫酸盐。不存在如下的从废的包含钴的锂离子电池正极材料回收有价值的金属的已知现有技术方法:使用利用二氧化硫的还原浸提,同时处理连二硫酸盐和以能量有效的方式回收水。虽然美国专利8,460,631描述了包含硫酸锰和连二硫酸锰的液剂(其还包含硫酸钠和连二硫酸钠)的加工,但是从该发明未显而易见如何可将硫酸钠以及连二硫酸钠与硫酸钴以及连二硫酸钴一起在存在或不存在硫酸锂和连二硫酸锂的情况下加工。此外,已经发现,处理连二硫酸盐和对水进行回收并且将经处理的溶液以闭路循环方式再循环回到该浸提的工艺使锂(当存在时)的回收率显著改善。技术实现要素:因此,本发明的一种实施方式为从由对基本上无锂的钴资源材料进行加工而得到的包含硫酸钠和/或连二硫酸钠的液剂进行除水和/或再循环的工艺,其包括如下步骤:a.将钴全部或部分地沉淀为碳酸钴,之后将它全部或部分地从所述液剂除去,例如通过离心或过滤除去;b.将硫酸钠和连二硫酸钠结晶以将大部分硫酸钠和连二硫酸钠从溶液分离;将硫酸钠和连二硫酸钠晶体除去;c.将硫酸钠和连二硫酸钠晶体加热以形成无水硫酸钠、二氧化硫和水(蒸汽);和d.分离无水硫酸钠。本发明的另一实施方式为从由对包含锂的钴资源材料进行加工而得到的包含硫酸钠和/或连二硫酸钠的液剂进行除水和/或再循环的工艺,其包括如下步骤;a.将钴全部或部分地沉淀为碳酸钴和将锂全部或部分地沉淀为碳酸锂,之后将它们全部或部分地从所述液剂除去,例如通过离心或过滤除去;b.将硫酸钠和连二硫酸钠结晶以将大部分硫酸钠和连二硫酸钠从溶液分离;c.将硫酸钠和连二硫酸钠晶体除去;和e.分离无水硫酸钠。本发明的进一步实施方式为从由对基本上无锂的钴资源材料进行加工而得到的包含硫酸钠和/或连二硫酸钠的液剂进行除水和/或再循环的工艺,其包括如下步骤:a.将钴全部或部分地沉淀为氢氧化钴,之后将它全部或部分地从所述液剂除去,例如通过离心或过滤除去;b.将硫酸钠和连二硫酸钠结晶以将大部分硫酸钠和连二硫酸钠从溶液分离;c.将硫酸钠和连二硫酸钠晶体除去;d.将硫酸钠和连二硫酸钠晶体加热以形成无水硫酸钠、二氧化硫和水(蒸汽);和e.分离无水硫酸钠。本发明的还进一步实施方式为从由对包含锂的钴资源材料进行加工而得到的包含硫酸钠和/或连二硫酸钠的液剂进行除水和/或再循环的工艺,其包括如下步骤:a.将钴全部或部分地沉淀为氢氧化钴,之后将它全部或部分地从所述液剂除去,例如通过离心或过滤除去;b.从4a的脱除了氢氧化钴的液剂将锂全部或部分地沉淀为碳酸锂,之后将它全部或部分地从所述液剂除去,例如通过离心除去;c.将硫酸钠和连二硫酸钠结晶以将大部分硫酸钠和连二硫酸钠从溶液分离;d.将硫酸钠和连二硫酸钠晶体除去;和e.分离无水硫酸钠。附图说明图1-3说明本发明的第一实施方式的工艺流程,其中“s”表示固相并且“l”表示液相。图1说明第一实施方式的用于处理废锂钴氧化物的工艺流程。图2说明第一实施方式的用于处理废锂镍锰钴氧化物的工艺流程。图3说明第一实施方式的用于处理废锂镍钴铝氧化物的工艺流程。图4说明第二实施方式的用于处理废锂钴氧化物的工艺流程。图5说明第二实施方式的用于处理废锂镍锰钴氧化物的工艺流程。图6说明第二实施方式的用于处理废锂镍钴铝氧化物的工艺流程。图7说明第三实施方式的用于处理废锂钴氧化物的工艺流程。图8说明第三实施方式的用于处理废锂镍锰钴氧化物的工艺流程。图9说明第三实施方式的用于处理废锂镍钴铝氧化物的工艺流程。最佳实施方式根据本发明,提供从对包含氧化钴(iii)的资源材料例如从锂离子电池的正极材料回收的那些进行亚硫酸和硫酸浸提而得到的包含硫酸钴和连二硫酸钴的液剂的湿法冶金加工工艺。对于实施方式一,参照图1-3。将包含硫酸钴和连二硫酸钴的液剂用碳酸钠处理以形成碳酸钴固体以及包含硫酸钠和连二硫酸钠的液剂。硫酸锂和连二硫酸锂,如果存在的话,部分地与碳酸钴固体一起沉淀为碳酸锂固体。将包含碳酸钴的固体和碳酸锂固体(如果存在的话)通过过滤或离心从该经碳酸盐处理的液剂除去。将包含碳酸钴的固体和碳酸锂固体(如果存在的话)洗涤以除去可溶性杂质和产生清洁材料用于再利用,例如再利用于锂离子电池用正极材料。将包含硫酸钠及连二硫酸钠连同剩余的硫酸锂及连二硫酸锂(如果存在的话)的滤液或离心液用结晶器处理以结晶大部分硫酸钠和连二硫酸钠晶体。结晶可通过冷却以沉淀(结晶)硫酸钠十水合物和连二硫酸钠二水合物或者通过多效结晶以沉淀(结晶)无水硫酸钠和连二硫酸钠进行。将硫酸钠和连二硫酸钠晶体加热至足以将连二硫酸钠晶体转化为硫酸钠以及可再循环用于对钴资源材料进行浸提的二氧化硫和水的温度。用于将连二硫酸钠转化为硫酸钠和二氧化硫的温度由chow等“(newdevelopmentsintherecoveryofmanganesefromlower-graderesources”,minerals&metallurgicalprocessing,第29卷,第1期,2012年2月,第70-71页)描述。将大部分硫酸钠和连二硫酸钠除去并且将包含硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话)的结晶器液剂再循环到浸提回路中用于进一步回收之前未被回收的锂和钴以及将水以能量有效的方式再利用。替代地,可使大部分硫酸钠和连二硫酸钠除去并且使包含硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话)的结晶器液剂的一部分通过纳滤膜以产生:富含水的没有硫酸盐和连二硫酸盐的液剂,其被输出用于再循环;以及硫酸钠和连二硫酸钠浓缩物连同硫酸锂和连二硫酸锂,其用于再循环至硫酸钠和连二硫酸钠结晶器。所沉淀的包含钴和锂的化合物可用于制造锂离子电池用正极材料。这通过如下进行:将期望比率的包含钴和锂的化合物组合并且对混合物进行热处理程序。jones等(“lixcoo2(0<x≤1):anewcathodematerialforbatteriesofhighenergydensity”,solidstateionics,3/4,1981,第171-174页)描述了通过处理锂和钴化合物而制造锂钴氧化物正极材料的方法。lu等(“美国专利no.8,685,565”,2014年4月)描述了通过处理锂、镍、锰和钴化合物而制造锂镍锰钴氧化物的方法。kim等“(synthesisofhigh-densitynickelcobaltaluminumhydroxidebycontinuouscoprecipitationmethod”,acsappliedmaterials&interfaces,4,2012,第586-589页)描述了通过处理锂、镍、钴和铝化合物而制造锂镍钴铝氧化物的方法。商业电池制造商典型地开发和使用它们自己的专有处理方法来制造锂离子电池用正极材料。将硫酸钴和连二硫酸钴转化为硫酸钠和连二硫酸钠提供了处理连二硫酸盐、提高锂的回收率和将水以能量有效的方式再循环的新型方法。对于实施方式二,参照图4-6将包含硫酸钴和连二硫酸钴的液剂用氢氧化钠处理以形成氢氧化钴固体以及包含硫酸钠和连二硫酸钠的液剂;将包含氢氧化钴的固体通过过滤或离心从该经氢氧化物处理的液剂除去;将包含氢氧化钴的固体洗涤以除去可溶性杂质和产生清洁材料用于再利用,例如再利用于锂离子电池用正极材料;碳酸钠向剩余溶液的添加使锂(如果存在的话)的部分沉淀为碳酸锂;将碳酸锂固体通过过滤或离心从该经碳酸盐处理的液剂除去;将碳酸锂固体洗涤以除去可溶性杂质和产生清洁材料用于再利用,例如再利用于锂离子电池用正极材料;将包含硫酸钠和连二硫酸钠连同剩余的硫酸锂和连二硫酸锂(如果存在的话)的滤液或离心液用结晶器处理以结晶大部分硫酸钠和连二硫酸钠晶体;结晶可通过冷却以沉淀(结晶)硫酸钠十水合物和连二硫酸钠二水合物或者通过多效结晶以沉淀(结晶)无水硫酸钠和连二硫酸钠进行;将硫酸钠和连二硫酸钠晶体加热至足以将连二硫酸钠晶体转化为硫酸钠以及可再循环用于对钴资源材料浸提的二氧化硫和水的温度;将大部分硫酸钠和连二硫酸钠除去并且将包含硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话)的结晶器液剂再循环到浸提回路中用于进一步回收之前未被回收的锂和钴以及将水以能量有效的方式再利用。替代地,可使大部分硫酸钠和连二硫酸钠除去并且使包含硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话)的结晶器液剂的大部分通过纳滤膜以产生:富含水的没有硫酸盐和连二硫酸盐的液剂,其被输出用于再循环;以及硫酸钠和连二硫酸钠浓缩物连同硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话),其用于再循环至硫酸钠和连二硫酸钠结晶器。对于实施方式三,参照图7-9。将包含硫酸钴和连二硫酸钴的液剂用氢氧化锂处理以形成氢氧化钴固体以及包含硫酸锂和连二硫酸锂的液剂;所述氢氧化锂可通过处理通过所述流程的之前操作而回收的碳酸锂而产生。wietelmann等(“lithiumandlithiumcompounds”,ullmann’sencyclopediaofindustrialchemistry,wiley-vchverlaggmbh&co,2013,第24页)描述了通过使碳酸锂与氢氧化钙反应而产生氢氧化锂的方法;将包含氢氧化钴的固体通过过滤或离心从该经氢氧化物处理的液剂除去;将包含氢氧化钴的固体洗涤以除去可溶性杂质和产生清洁材料用于再利用,例如再利用于锂离子电池用正极材料;碳酸钠向剩余溶液的添加使锂(如果存在的话)的部分沉淀为碳酸锂;将碳酸锂固体通过过滤或离心从该经碳酸盐处理的液剂除去;将碳酸锂固体洗涤以除去可溶性杂质和产生清洁材料用于再利用,例如再利用于锂离子电池用正极材料;将包含硫酸钠和连二硫酸钠连同剩余的硫酸锂和连二硫酸锂(如果存在的话)的滤液或离心液用结晶器处理以结晶大部分硫酸钠和连二硫酸钠晶体;结晶可通过冷却以沉淀(结晶)硫酸钠十水合物和连二硫酸钠二水合物或者通过多效结晶以沉淀(结晶)无水硫酸钠和连二硫酸钠进行;将硫酸钠和连二硫酸钠晶体加热至足以将连二硫酸钠晶体转化为硫酸钠以及可再循环用于对钴资源材料浸提的二氧化硫和水的温度;将大部分硫酸钠和连二硫酸钠除去并且将包含硫酸锂和连二硫酸锂(如果在所述资源材料中存在锂的话)的结晶器液剂再循环到浸提回路中用于进一步回收之前未被回收的锂和钴以及将水以能量有效的方式再利用。替代地,可使大部分硫酸钠和连二硫酸钠除去并且使包含硫酸锂和连二硫酸锂的结晶器液剂的一部分通过纳滤膜以产生:富含水的没有硫酸盐和连二硫酸盐的液剂,其被输出用于再循环;以及硫酸钠和连二硫酸钠浓缩物连同硫酸锂和连二硫酸锂,其用于再循环至硫酸钠和连二硫酸钠结晶器。所沉淀的包含钴和锂的化合物可用于制造锂离子电池用正极材料。对于图1中所示的用于处理锂钴氧化物的实施方式一,流程如下描述:在浸提反应器(12)中,将具有化学式licoo2的废锂离子电池正极材料与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或钴的溶液组合和混合。锂和钴被溶解在溶液中,从而产生包含硫酸钴、连二硫酸钴、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(20),在沉淀反应器(20)中添加碳酸钠溶液并且混合以将钴和部分的所溶解的锂沉淀为碳酸钴和碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:coso4+na2co3=coco3+na2so4接近完全转化cos2o6+na2co3=coco3+na2s2o6接近完全转化li2so4+na2co3=li2co3+na2so4部分转化li2s2o6+na2co3=li2co3+na2s2o6部分转化将包含固体混合物和液体的淤浆过滤(14)以分离碳酸锂和碳酸钴,将其清洗以产生收集产物(16)。将滤液转移至结晶器(18),在结晶器(18)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(22)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(24)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环回浸提。母溶液(母液)包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(26)回至浸提以使水消耗最少化并且使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(28)处理以产生清洁水(30),其用于清洗产物和将废的清洗水(32)再利用回至浸提。将来自纳滤的浓缩物(34)再循环回到结晶器以使硫酸钠回收率最大化。将混合的碳酸锂和碳酸钴收集产物(16)热处理(36)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的碳酸锂和或碳酸钴添加至所述收集产物以在热处理之前实现锂和钴的期望比率。对于图2中所示的用于处理锂镍锰钴氧化物的实施方式一,流程如下描述:在浸提反应器(40)中,将废锂镍锰钴氧化物正极材料(例如具有化学式lini0.33mn0.33co0.33o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或锰和/或钴的溶液组合和混合。锂、镍、锰和钴被溶解在溶液中,从而产生包含镍锰钴硫酸盐、镍锰钴连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将该浸提溶液转移至沉淀反应器(48),在沉淀反应器(48)中添加碳酸钠并且混合以使镍、锰和钴以及部分的所溶解的锂沉淀为镍、锰、钴和锂碳酸盐固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:(ni,mn,co)so4+na2co3=(ni,mn,co)co3+na2so4接近完全转化(ni,mn,co)s2o6+na2co3=(ni,mn,co)co3+na2s2o6接近完全转化li2so4+na2co3=li2co3+na2so4部分转化li2s2o6+na2co3=li2co3+na2s2o6部分转化将包含固体混合物和液体的淤浆过滤(42)以分离碳酸锂和镍锰钴碳酸盐,将其清洗以产生收集产物(44)。将滤液转移至结晶器(46),在结晶器(46)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(50)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(52)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(54)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(56)处理以产生清洁水(58),其用于清洗产物和将废的清洗水(60)再利用回至浸提。将来自纳滤的浓缩物(62)再循环回至结晶器以使硫酸钠回收率最大化。将混合的碳酸锂和镍锰钴碳酸盐收集产物(44)热处理(64)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、锰和或钴化合物添加至所述收集产物以在热处理之前实现锂、镍、锰和钴的期望比率。对于图3中所示的用于处理锂镍钴铝氧化物的实施方式一,流程如下描述:在浸提反应器(70)中,将废锂镍钴铝氧化物正极材料(例如具有化学式lini0.8co0.15al0.05o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或钴和/或铝的溶液组合和混合。锂、镍、钴和铝被溶解在溶液中,从而产生包含镍钴铝硫酸盐、镍钴铝连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(78),在沉淀反应器(78)中添加碳酸钠并且混合以使镍、钴和铝以及部分的所溶解的锂沉淀为镍、钴、铝和锂碳酸盐固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:(ni,co,al)so4+na2co3=(ni,co,al)co3+na2so4接近完全转化(ni,co,al)s2o6+na2co3=(ni,co,al)co3+na2s2o6接近完全转化li2so4+na2co3=li2co3+na2so4部分转化li2s2o6+na2co3=li2co3+na2s2o6部分转化将包含固体混合物和液体的淤浆过滤(72)以分离碳酸锂和镍钴铝碳酸盐,将其清洗以产生收集产物(74)。将滤液转移至结晶器(76),在结晶器(76)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(80)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(82)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(84)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(86)处理以产生清洁水(88),其用于清洗产物和将废的清洗水(90)再利用回至浸提。将来自纳滤的浓缩物(92)再循环回至结晶器以使硫酸钠回收率最大化。将混合的碳酸锂和镍钴铝碳酸盐收集产物(74)热处理(94)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、钴和或铝化合物添加至所述收集产物以在热处理之前实现锂、镍、钴和铝的期望比率。对于图4中所示的用于处理锂钴氧化物的实施方式二,流程如下描述:在浸提反应器(100)中,将具有化学式licoo2的废锂离子电池正极材料与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或钴的溶液组合和混合。锂和钴被溶解在溶液中,从而产生包含硫酸钴、连二硫酸钴、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(108),在沉淀反应器(108)中添加氢氧化钠并且混合以选择性地将钴沉淀为氢氧化钴并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:coso4+2naoh=co(oh)2+na2so4接近完全转化cos2o6+2naoh=co(oh)2+na2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(102)以分离氢氧化钴,将其清洗以产生收集产物(104)。将经过滤的溶液转移至第二沉淀反应器(106),在第二沉淀反应器(106)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(118)以分离碳酸锂,将其清洗以产生收集产物(120)。将滤液转移至结晶器(114),在结晶器(114)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(116)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(110)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(112)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(122)处理以产生清洁水(124),其用于清洗产物和将废的清洗水(126,128)再利用回至浸提。将来自纳滤的浓缩物(130)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(120)和氢氧化钴(104)收集产物混合至锂和钴的期望比率并且热处理(132)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂和或钴化合物添加至所述收集产物以在热处理之前实现锂和钴的期望比率。对于图5中所示的用于处理锂镍锰钴氧化物的实施方式二,流程如下描述:在浸提反应器(140)中,将废锂镍锰钴氧化物正极材料(例如具有化学式lini0.33mn0.33co0.33o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或锰和/或钴的溶液组合和混合。锂、镍、锰和钴被溶解在溶液中,从而产生包含镍锰钴硫酸盐、镍锰钴连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(148),在沉淀反应器(148)中添加氢氧化钠并且混合以选择性地将镍、锰和钴沉淀为镍锰钴氢氧化物并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:(ni,mn,co)so4+2naoh=(ni,mn,co)(oh)2+na2so4接近完全转化(ni,mn,co)s2o6+2naoh=(ni,mn,co)(oh)2+na2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(142)以分离镍锰钴氢氧化物,将其清洗以产生收集产物(144)。将经过滤的溶液转移至第二沉淀反应器(146),在第二沉淀反应器(146)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(158)以分离碳酸锂,将其清洗以产生收集产物(160)。将滤液转移至结晶器(154),在结晶器(154)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(156)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(150)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(152)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(162)处理以产生清洁水(164),其用于清洗产物和将废的清洗水(166,168)再利用回至浸提。将来自纳滤的浓缩物(170)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(160)和镍锰钴氢氧化物(144)收集产物混合至锂、镍、锰和钴的期望比率并且热处理(172)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、锰和或钴化合物添加至所述收集产物以在热处理之前实现锂、镍、锰和钴的期望比率。对于图6中所示的用于处理锂镍钴铝氧化物的实施方式二,流程如下描述:在浸提反应器(180)中,将废锂镍钴铝氧化物正极材料(例如具有化学式lini0.8co0.15al0.05o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或钴和/或铝的溶液组合和混合。锂、镍、钴和铝被溶解在溶液中,从而产生包含镍钴铝硫酸盐、镍钴铝连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(188),在沉淀反应器(188)中添加氢氧化钠并且混合以选择性地将镍、钴和铝沉淀为镍钴铝氢氧化物并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。沉淀反应如下发生:(ni,co,al)so4+2naoh=(ni,co,al)(oh)2+na2so4接近完全转化(ni,co,al)s2o6+2naoh=(ni,co,al)(oh)2+na2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(182)以分离镍钴铝氢氧化物,将其清洗以产生收集产物(184)。将经过滤的溶液转移至第二沉淀反应器(186),在第二沉淀反应器(186)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(198)以分离碳酸锂,将其清洗以产生收集产物(200)。将滤液转移至结晶器(194),在结晶器(194)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(196)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(190)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(192)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(202)处理以产生清洁水(204),其用于清洗产物和将废的清洗水(206,208)再利用回至浸提。将来自纳滤的浓缩物(210)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(200)和镍钴铝氢氧化物(184)收集产物混合至锂、镍、钴和铝的期望比率并且热处理(212)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、钴和或铝化合物添加至所述收集产物以在热处理之前实现锂、镍、钴和铝的期望比率。对于图7中所示的用于处理锂钴氧化物的实施方式三,流程如下描述:在浸提反应器(220)中,将具有化学式licoo2的废锂离子电池正极材料与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或钴的溶液组合和混合。锂和钴被溶解在溶液中,从而产生包含硫酸钴、连二硫酸钴、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(228),在沉淀反应器(228)中添加氢氧化锂并且混合以选择性地将钴沉淀为氢氧化钴并且形成主要包含硫酸锂和连二硫酸锂的溶液。沉淀反应如下发生:coso4+2lioh=co(oh)2+li2so4接近完全转化cos2o6+2lioh=co(oh)2+li2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(222)以分离氢氧化钴,将其清洗以产生收集产物(224)。将经过滤的溶液转移至第二沉淀反应器(226),在第二沉淀反应器(226)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(238)以分离碳酸锂,将其清洗(240)。收集碳酸锂的一部分作为产物(242)。将碳酸锂的其它部分进一步与氢氧化钙混合(244)以产生包含溶解的氢氧化锂和固体碳酸钙的淤浆。将所述淤浆过滤(246)以分离碳酸钙固体和氢氧化锂溶液,氢氧化锂溶液将被再用于使钴化合物沉淀(228)。将来自第二过滤器(238)的滤液转移至结晶器(234),在结晶器(234)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(236)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(230)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(232)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(248)处理以产生清洁水(250),其用于清洗产物和将废的清洗水(252,254)再利用回至浸提。将来自纳滤的浓缩物(256)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(242)和氢氧化钴(224)收集产物混合至锂和钴的期望比率并且热处理(258)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂和或钴化合物添加至所述收集产物以在热处理之前实现锂和钴的期望比率。对于图8中所示的用于处理锂镍锰钴氧化物的实施方式三,流程如下描述:在浸提反应器(270)中,将废锂镍锰钴氧化物正极材料(例如具有化学式lini0.33mn0.33co0.33o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或锰和/或钴的溶液组合和混合。锂、镍、锰和钴被溶解在溶液中,从而产生包含镍锰钴硫酸盐、镍锰钴连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(278),在沉淀反应器(278)中添加氢氧化锂并且混合以选择性地将镍、锰和钴沉淀为镍锰钴氢氧化物并且形成主要包含硫酸锂和连二硫酸锂的溶液。沉淀反应如下发生:(ni,mn,co)so4+2lioh=(ni,mn,co)(oh)2+li2so4接近完全转化(ni,mn,co)s2o6+2lioh=(ni,mn,co)(oh)2+li2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(272)以分离镍锰钴氢氧化物,将其清洗以产生收集产物(274)。将经过滤的溶液转移至第二沉淀反应器(276),在第二沉淀反应器(276)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(288)以分离碳酸锂,将其清洗(290)。收集碳酸锂的一部分作为产物(292)。将碳酸锂的其它部分进一步与氢氧化钙混合(294)以产生包含溶解的氢氧化锂和固体碳酸钙的淤浆。将所述淤浆过滤(296)以分离碳酸钙固体和氢氧化锂溶液,氢氧化锂溶液将被再利用于使钴化合物沉淀(278)。将来自第二过滤器(288)的滤液转移至结晶器(284),在结晶器(284)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(286)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(280)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(282)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(298)处理以产生清洁水(300),其用于清洗产物和将废的清洗水(302,304)再利用回至浸提。将来自纳滤的浓缩物(306)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(292)和镍锰钴氢氧化物(274)收集产物混合至锂、镍、锰和钴的期望比率并且热处理(308)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、锰和或钴化合物添加至所述收集产物以在热处理之前实现锂、镍、锰和钴的期望比率。对于图9中所示的用于处理锂镍钴铝氧化物的实施方式三,流程如下描述:在浸提反应器(320)中,将废锂镍钴铝氧化物正极材料(例如具有化学式lini0.8co0.15al0.05o2)与so2和h2so4试剂以及包含水、并且可能包含之前尚未从该流程的最后阶段回收的锂和/或镍和/或钴和/或铝的溶液组合和混合。锂、镍、钴和铝被溶解在溶液中,从而产生包含镍钴铝硫酸盐、镍钴铝连二硫酸盐、硫酸锂和连二硫酸锂的浸提溶液。将所述浸提溶液转移至沉淀反应器(328),在沉淀反应器(328)中添加氢氧化锂并且混合以选择性地将镍、钴和铝沉淀为镍钴铝氢氧化物并且形成主要包含硫酸锂和连二硫酸锂的溶液。沉淀反应如下发生:(ni,co,al)so4+2lioh=(ni,co,al)(oh)2+li2so4接近完全转化(ni,co,al)s2o6+2lioh=(ni,co,al)(oh)2+li2s2o6接近完全转化将包含固体混合物和液体的淤浆过滤(322)以分离镍钴铝氢氧化物,将其清洗以产生收集产物(324)。将经过滤的溶液转移至第二沉淀反应器(326),在第二沉淀反应器(326)中添加碳酸钠并且混合以使部分的所溶解的锂沉淀为碳酸锂固体并且形成主要包含硫酸锂、连二硫酸锂、硫酸钠和连二硫酸钠的溶液。将包含固体混合物和液体的淤浆过滤(338)以分离碳酸锂,将其清洗(340)。收集碳酸锂的一部分作为产物(342)。将碳酸锂的其它部分进一步与氢氧化钙混合(344)以产生包含溶解的氢氧化锂和固体碳酸钙的淤浆。将所述淤浆过滤(346)以分离碳酸钙固体和氢氧化锂溶液,氢氧化锂溶液将被再用于使镍、钴和铝化合物沉淀(328)。将来自第二过滤器(338)的滤液转移至结晶器(334),在结晶器(334)中部分的硫酸钠和连二硫酸钠通过多效结晶或者冷却结晶而被结晶为固体晶体。用离心机或过滤器(336)从溶液收集固体硫酸钠和连二硫酸钠晶体。将硫酸钠和连二硫酸钠晶体加热至大约120℃(330)使连二硫酸钠分解为硫酸钠副产物和so2,so2可被再循环至浸提。母溶液包含剩余的硫酸锂、连二硫酸锂、硫酸钠、连二硫酸钠和水,被再循环(332)回至浸提以使水消耗最少化和使整个流程的锂回收率最大化。替代地,可将母溶液的一部分通过纳滤(348)处理以产生清洁水(350),其用于清洗产物和将废的清洗水(352,354)再利用回至浸提。将来自纳滤的浓缩物(356)再循环回至结晶器以使硫酸钠回收率最大化。将碳酸锂(342)和镍钴铝氢氧化物(324)收集产物混合至锂、镍、钴和铝的期望比率并且热处理(358)以制造用于锂离子电池中的新的正极化合物。如果需要,可将另外的锂、镍、钴和或铝化合物添加至所述收集产物以在热处理之前实现锂、镍、钴和铝的期望比率。实施例对本发明进行举例说明:1.将锂钴氧化物用二氧化硫和硫酸浸提(试验#lt4)将由化学式licoo2构成的锂钴氧化物(alfaaesar)用于该试验工作。通过如下进行浸提:将25克licoo2与250ml的2摩尔/升硫酸混合。将二氧化硫气体连续地鼓泡到该浸提溶液中以保持≤400mv的氧化-还原电位(orp)。浸提容器由三口圆底烧瓶构成,并且用磁力搅拌棒进行搅拌。该烧瓶的一个口用于监测orp,将冷凝器添加至另一个口以将蒸气冷凝回到该容器中并且使用再一个口来测量温度。实验在没有温度控制的情况下进行。该浸提被确定为是放热的,因为在5分钟的浸提之后温度上升至高达71℃并且进一步地在120分钟的实验之后冷却至21c。所述溶液的电感耦合等离子体光谱法(icp)分析显示,在5分钟的浸提之后,100%的锂和钴被提取。2.将锂钴氧化物用焦亚硫酸盐和硫酸浸提(试验#lt6)通过如下进行浸提:将12.5克licoo2与250ml的2摩尔/升硫酸以及0.67摩尔/升焦亚硫酸钠混合。浸提容器由三口圆底烧瓶构成,并且用磁力搅拌棒进行搅拌。该烧瓶的一个口用于监测orp,将冷凝器添加至另一个口以将蒸气冷凝回到该容器中并且使用再一个口来测量温度。实验在没有温度控制的情况下进行。该浸提被确定为是放热的,因为在5分钟的浸提之后温度上升至高达60℃并且进一步地在120分钟的实验之后冷却至25℃。所述溶液的icp分析显示,在5分钟的浸提之后,100%的锂和钴被提取。3.将钴和锂沉淀为碳酸钴和碳酸锂(试验#ptcl1)通过如下制备包含5.59g/l锂和50.01g/l钴、ph1.59的200ml溶液:将锂钴氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:添加31.83克无水碳酸钠(其计算为将所有的锂和钴沉淀为碳酸盐所需要的碳酸钠的化学计量量的1.2倍)。之后,添加10摩尔/升氢氧化钠以将ph提高至11.14。该试验在1000ml烧杯中用高架式搅拌器进行。将淤浆过滤;收集35.33克残渣和118ml滤液。注意蒸发。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,100%的钴和82.11%的锂被沉淀为混合的钴和锂碳酸盐。4.将钴沉淀为氢氧化钴(试验#ptc3-2)通过如下制备包含5.59g/l锂和50.01g/l钴、ph1.59的450ml溶液:将锂钴氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:缓慢地添加10摩尔/升氢氧化钠以将ph提高至10.61以使钴沉淀。该试验在1000ml烧杯中用高架式搅拌器进行。将淤浆过滤;收集46.48克残渣和390ml滤液。将所述残渣用去离子水洗涤,再过滤并且干燥。所述残渣的分析表明,从该包含锂和钴的溶液选择性地将100%的钴沉淀为氢氧化钴。最终残渣包含痕量的锂(大约0.0292%),其能够有可能通过另外的清洗而被进一步纯化。5.将锂沉淀为碳酸锂(试验#ptl3-2)将从在以上试验#ptc3-2之后的滤液剩余的385ml溶液用于该试验。通过如下进行沉淀试验:添加25克碳酸钠一水合物(计算为对于所述溶液,将所有的锂沉淀为碳酸锂所需要的化学计量量的1.2倍)。该试验在1000ml烧杯中用高架式混合器进行。将淤浆过滤;收集7.82克残渣和318ml滤液。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,53.9%的锂被沉淀为碳酸锂。6.从用二氧化硫和硫酸浸提的浸提用锂钴氧化物产生连二硫酸盐将由化学式licoo2构成的锂钴氧化物(alfaaesar)用于该试验工作。通过如下进行大量浸提实验:将36-50克范围的licoo2与范围为0.8摩尔/升-1.5摩尔/升浓度的250ml硫酸混合。将二氧化硫气体连续地鼓泡到该浸提溶液中。所试验的最终氧化-还原电位(orp)的范围在102mv-401mv之间。浸提容器由三口圆底烧瓶构成,并且用磁力搅拌棒进行搅拌。该烧瓶的一个口用于监测orp,将冷凝器添加至另一个口以将蒸气冷凝回到该容器中并且使用再一个口来测量温度。实验在没有温度控制的情况下进行。在浸提120分钟之后,取出样品用于通过离子色谱法分析连二硫酸盐。结果汇总于表1中。表1.试验编号s2o62-(mg/l)lt1827150lt1930294lt2015207lt2123069lt2213290lt2330953lt2419951lt259260lt26103867.用于处理锂钴氧化物的闭路循环试验将由化学式licoo2构成的锂钴氧化物(alfaaesar)用于该试验工作。将锂钴氧化物以闭路循环方式加工以模拟实施方式二中描述的流程中的主要单元操作。该闭路循环试验展现了从如下回路除去硫酸盐和连二硫酸盐:其使得能够将在前一循环的流程结束时未回收的锂和水再循环至后续循环的流程的前端以被回收。浸提条件由如下构成:ph控制为大约1.5;浸提头(head)中1.2mh2so4;8%浆粕密度;并且so2鼓泡,目标orp为350mv。对于在4个循环内的各浸提阶段,在2小时的so2还原浸提之后,所有的浸提头的固体在视觉上消失。将来自前一浸提阶段的浸提液通过10mnaoh调节至ph11以使溶解的钴沉淀为co(oh)2。然后跟着的是2个再制浆洗涤步骤和过滤。将湿的固体在60℃下干燥。然后将来自前一步骤的滤液与相对于通过icp测量的锂浓度的1.2倍化学计量的na2co3混合。然后将该混合溶液加热至95℃达30分钟,之后滤除li2co3沉淀物。将所述沉淀物在95℃下用饱和li2co3洗涤。除了闭路循环#1之外,所有的饱和li2co3洗涤溶液均是通过从前一循环产生的li2co3固体制备的。在所述闭路循环中,预计锂积聚在溶液中,导致提高的li回收率。来自icp和计算的结果证实了该结论。所述流程的各循环的所计算的锂回收率示于表2中。表2.闭路循环编号%锂回收率132%236%368%476%将包含硫酸钠、连二硫酸钠和未回收的锂离子溶液的混合物的来自前一步骤的滤液在用高架式(架空的)混合器温和混合的情况下冷却至5℃达2小时以结晶硫酸钠十水合物和连二硫酸钠二水合物。将所述晶体通过过滤而收集并且在60℃下干燥以收集无水晶体。循环1-4的干晶体的重量示于表3中。表3.闭路循环编号干晶体的重量(g)126.16259.77378.50474.25纳滤步骤的一个实例描述于实施例20中。8.将锂镍锰钴氧化物用二氧化硫和硫酸浸提(试验#nmc3-5)将由化学式lini0.33mn0.33co0.33o2构成的锂镍锰钴氧化物(sigmaaldrich)用于该试验工作。通过如下进行浸提:将30克lini0.33mn0.33co0.33o2与255ml的1.2摩尔/升硫酸混合。将二氧化硫气体连续地鼓泡到该浸提溶液中以保持=550mv的氧化-还原电位(orp)。浸提容器由三口圆底烧瓶构成,并且用磁力搅拌棒进行搅拌。该烧瓶的一个口用于监测orp,将冷凝器添加至另一个口以将蒸气冷凝回到该容器中并且使用再一个口来测量温度。实验在没有温度控制的情况下进行。该浸提被确定为是放热的,因为在30分钟的浸提之后温度上升至高达66℃并且进一步地在120分钟的实验之后冷却至28c。所述溶液的电感耦合等离子体光谱法(icp)分析显示,在120分钟的浸提之后,100%的锂、镍、锰和钴被提取。离子色谱法分析显示,最终的浸提溶液包含24.1g/l连二硫酸盐。9.将镍、锰和钴用naoh沉淀为(ni,mn,co)(oh)2(试验#nmc-2-ptc11)通过如下制备包含7.71g/l锂、19.83g/l镍、18.09g/l锰和19.38g/l钴、ph0.8的200ml溶液:将锂镍锰钴氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:缓慢地添加10摩尔/升氢氧化钠以将ph提高至10.70以使镍、锰和钴沉淀。所述试验在500ml烧杯中用磁力搅拌器进行。将淤浆过滤。收集18.70克干残渣和140ml滤液。将所述残渣用去离子水洗涤,再过滤并且干燥。所述残渣的分析表明,从所述包含锂、镍、锰和钴的溶液,100%镍、100%锰和100%的钴被沉淀为金属氢氧化物。最终的残渣包含少量的锂(大约0.155%),其能够有可能通过另外的清洗而被进一步纯化。10.在将镍、锰和钴用naoh进行氢氧化物沉淀(试验#nmc-2-ptl11)之后将锂沉淀为碳酸锂将来自在试验#nmc-2-ptc-11之后的滤液的剩余物用于该试验。通过如下进行沉淀试验:添加14.12克碳酸钠(计算为对于所述溶液,将所有的锂沉淀为碳酸锂所需要的化学计量量的1.2倍)。所述试验在500ml烧杯中用磁力搅拌器在95℃下进行15分钟。将淤浆过滤;收集2.39克的干残渣和130ml滤液。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,34.6%的锂被沉淀为碳酸锂。11.将镍、锰和钴用lioh沉淀为(ni,mn,co)(oh)2(试验#nmc-2-ct-ptc3)通过如下制备包含7.30g/l锂、18.27g/l镍、17.05g/l锰和18.24g/l钴、ph0.66的200ml溶液:将锂镍锰钴氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:缓慢地添加3.34摩尔/升氢氧化锂以将ph提高至11.07以使镍、锰和钴沉淀。所述试验在500ml烧杯中用磁力搅拌器进行。将淤浆过滤;收集18.24克残渣和206ml滤液。将所述残渣用去离子水洗涤,再过滤并且干燥。所述残渣的分析表明,从所述包含锂、镍、锰和钴的溶液,100%镍、100%锰和100%的钴被沉淀为金属氢氧化物。最终的残渣包含少量的锂(大约0.787%),其能够有可能通过另外的清洗而被进一步纯化。12.在将镍、锰和钴用lioh进行氢氧化物沉淀(试验#nmc-2-ct-ptl3)之后将锂沉淀为碳酸锂将来自在试验#nmc-2-ct-ptc3之后的滤液的剩余物用于该试验。通过如下进行沉淀试验:添加27.74克碳酸钠(计算为对于所述溶液,将所有的锂沉淀为碳酸盐所需要的化学计量量的1.2倍)。所述试验在500ml烧杯中用磁力搅拌器在95℃下进行15分钟。将淤浆过滤;收集12.12克干残渣和184ml滤液。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,49.8%的锂被沉淀为碳酸锂。13.用于处理锂镍锰钴氧化物的闭路循环试验将由化学式lini0.33mn0.33co0.33o2构成的锂镍锰钴氧化物(sigmaaldrich)用于该试验工作。将锂镍锰钴氧化物以闭路循环方式加工以模拟实施方式三中描述的流程中的主要单元操作。该闭路循环试验展现了从如下回路除去硫酸盐和连二硫酸盐:其使得能够将在前一循环的流程结束时未回收的锂和水再循环至后续循环的流程的前端以被回收。浸提条件由如下构成:对100g样品进行处理,其中ph控制为大约1.5;浸提头中1.5mh2so4;10%浆粕密度;并且so2鼓泡,目标orp为550mv。对于在4个循环内的各浸提阶段,在2小时的so2还原浸提之后,浸提头的固体在视觉上消失。将来自前一浸提阶段的浸提液通过饱和lioh调节至ph11以使溶解的镍、锰和钴沉淀为(ni,mn,co)(oh)2。然后跟着的是2个再制浆洗涤步骤和过滤。将湿的固体在60℃下干燥。然后将来自前一步骤的滤液与相对于通过icp测量的锂浓度的1.0倍化学计量的na2co3混合。然后将所述混合溶液加热至95℃达30分钟,之后滤除li2co3沉淀物。将所述沉淀物在95℃下用饱和li2co3洗涤。除了闭路循环#1之外,所有的饱和li2co3洗涤溶液是通过从前一循环产生的li2co3固体制备的。在所述闭路循环中,预计锂积聚在溶液中,导致提高的li回收率。来自icp和计算的结果证实了该结论。所述流程的各循环的所计算的锂回收率示于表4中。表4.闭路循环编号%锂回收率147%267%378%4100%将包含硫酸钠、连二硫酸钠和未回收的锂离子溶液的混合物的来自前一步骤的滤液在使用高架式混合器温和搅拌的情况下冷却至5℃达2小时以结晶硫酸钠十水合物和连二硫酸钠二水合物。将所述晶体通过过滤而收集并且在60℃下干燥以收集无水晶体。循环1-4的干晶体的重量示于表5中。表5.闭路循环编号干晶体的重量(g)153.222108.29371.754236.11纳滤步骤的一个实例描述于实施例20中。14.将锂镍钴铝氧化物用二氧化硫和硫酸浸提(试验#nca-lt8)将由化学式lini0.08co0.15al0.05o2构成的锂镍钴铝氧化物(mticorp)用于该试验工作。通过如下进行浸提:将30克lini0.8co0.15al0.05o2与245ml的1.2摩尔/升硫酸混合。将二氧化硫气体连续地鼓泡到该浸提溶液中以保持=550mv的氧化-还原电位(orp)。浸提容器由四口玻璃反应器构成,并且用高架式混合器进行搅拌。该烧瓶的一个口用于监测orp,将冷凝器添加至另一个口以将蒸气冷凝回到该容器中,使用再一个口测量温度并且最后一个口用于所述高架式混合器。实验在没有温度控制的情况下进行。该浸提被确定为是放热的,因为在30分钟的浸提之后温度上升至高达88℃并且进一步地在120分钟的实验之后冷却至50℃。所述溶液的电感耦合等离子体光谱法(icp)分析显示,在120分钟的浸提之后,100%的锂、镍、钴和铝被提取。离子色谱法分析显示,最终的浸提溶液包含11.3g/l连二硫酸盐。15.将镍、钴和铝用naoh沉淀为(ni,co,al)(oh)2(试验#nca-ptc1)通过如下制备包含8.63g/l锂、57.82g/l镍、10.54g/l钴和1.17g/l铝、ph1.06的200ml溶液:将锂镍钴铝氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:缓慢地添加10摩尔/升氢氧化钠以将ph提高至11.09以使镍、钴和铝沉淀。所述试验在500ml烧杯中用磁力搅拌器进行。将淤浆过滤。收集27.15克干残渣和135ml滤液。将所述残渣用去离子水洗涤,再过滤并且干燥。所述残渣的分析表明,从所述包含锂、镍、锰和钴的溶液,100%镍、100%锰和100%的钴被沉淀为金属氢氧化物。最终的残渣包含少量的锂(大约0.078%),其能够有可能通过另外的清洗而被进一步纯化。16.在将镍、钴和铝用naoh进行氢氧化物沉淀(试验#nca-ptl1)之后将锂沉淀为碳酸锂将来自在试验#nca-ptl1之后的滤液的剩余物用于该试验。通过如下进行沉淀试验:添加15.82克碳酸钠(计算为对于所述溶液,将所有的锂沉淀为碳酸盐所需要的化学计量量的1.2倍)。所述试验在500ml烧杯中用磁力搅拌器在95℃下进行15分钟。将淤浆过滤;收集2.88克干残渣和125ml滤液。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,31.5%的锂被沉淀为碳酸锂。17.将镍、钴和铝用lioh沉淀为(ni,co,al)(oh)2(试验#nca-ct-ptc2)通过如下制备包含6.64g/l锂、46.84g/l镍、8.45g/l钴和0.89g/l铝、ph0.35的200ml溶液:将锂镍钴铝氧化物用与硫酸组合的二氧化硫浸提。通过如下进行沉淀试验:缓慢地添加4.44摩尔/升氢氧化锂以将ph提高至11.03以使镍、钴和铝沉淀。所述试验在500ml烧杯中用磁力搅拌器进行。将淤浆过滤;收集18.55克残渣和202ml滤液。将所述残渣用去离子水洗涤,再过滤并且干燥。所述残渣的分析表明,从所述包含锂、镍、钴和铝的溶液,100%镍、100%钴和100%的铝被沉淀为金属氢氧化物。最终的残渣包含少量的锂(大约0.648%),其能够有可能通过另外的清洗而被进一步纯化。18.在将镍、钴和铝用lioh进行氢氧化物沉淀(试验#nca-ct-ptl2)之后将锂沉淀为碳酸锂将来自在试验#nca-ct-ptc2之后的滤液的剩余物用于该试验。通过如下进行沉淀试验:添加27.31克碳酸钠(计算为对于所述溶液而言,将所有的锂沉淀为碳酸盐所需要的化学计量量的1.0倍)。所述试验在500ml烧杯中用磁力搅拌器在95℃下进行15分钟。将淤浆过滤;收集14.04克干残渣和185ml滤液。将所述残渣用饱和碳酸锂溶液洗涤,再过滤并且干燥。所述残渣的分析表明,55.97%的锂被沉淀为碳酸锂。19.用于处理锂镍钴铝氧化物的闭路循环试验将由化学式lini0.8co0.15al0.05o2构成的锂镍钴铝氧化物(mticorp)用于该试验工作。将锂镍钴铝氧化物以闭路循环方式加工以模拟实施方式三中描述的流程中的主要单元操作。该闭路循环试验展现了从如下回路除去硫酸盐和连二硫酸盐:其使得能够将在前一循环的流程结束时未回收的锂和水再循环至后续循环的流程的前端以被回收。浸提由如下构成:对400g样品进行处理,其中ph控制为大约1.5;在浸提头中1.2mh2so4;10%浆粕密度;并且so2鼓泡,目标orp为550mv。对于在7个循环内的各浸提阶段,在2小时的so2还原浸提之后,浸提头的固体在视觉上消失。将来自前一浸提阶段的浸提液通过饱和lioh调节至ph10.5以使溶解的镍、钴和铝沉淀为(ni,co,al)(oh)2。然后跟着的是2个再制浆洗涤步骤和过滤。将湿的固体在60℃下干燥。然后将来自前一步骤的滤液与相对于通过icp测量的锂浓度的1.2倍化学计量的na2co3混合。然后将所述混合溶液加热至95℃达30分钟,之后滤除li2co3沉淀物。将所述沉淀物在95℃下用饱和li2co3洗涤。除了闭路循环#1之外,所有的饱和li2co3洗涤溶液均是通过从前一循环产生的li2co3固体制备的。在所述闭路循环中,预计锂积聚在溶液中,导致提高的li回收率。来自icp和计算的结果证实了该结论。所述流程的各循环的所计算的锂回收率示于表6中。表6.闭路循环编号%锂回收率151%262%369%470%580%686%7100%将包含硫酸钠、连二硫酸钠和未回收的锂离子溶液的混合物的来自前一步骤的滤液在用高架式混合器温和混合的情况下冷却至5℃达2小时以结晶硫酸钠十水合物和连二硫酸钠二水合物。将所述晶体通过过滤而收集并且在60℃下干燥以收集无水晶体。循环1-4的干晶体的重量示于表7中。表7.闭路循环编号干晶体的重量(g)167.92185.33161.44175.05218.76109.37205.6纳滤步骤的一个实例描述于实施例20中。20.纳滤通过如下进行纳滤试验:将包含32.23g/l硫酸盐和24.0g/l连二硫酸盐的进料溶液泵送通过dowfilmtecnf270-400纳滤膜。将进料流速设置为5.65l/min。所述膜的入口处的压力测得为29.1巴。浓缩物出口处的压力测得为28.5巴。通过所述膜的渗透物流速测得为0.65l/min。收集所述渗透物的样品并且通过离子色谱法测得硫酸盐为2.30g/l并且连二硫酸盐为2.84g/l。浓缩物流速计算为5.0l/min。浓缩物计算为包含36.13g/l硫酸盐和26.80g/l连二硫酸盐。硫酸盐排出率(rejection)计算为92.2%并且连二硫酸盐排出率计算为85.5%。虽然已经出于说明目的而公开了本发明的优选实施方式,但是应理解,在不背离由所附权利要求限定的本发明的精神的情况下,可将各种变化、改动和替代引入所述实施方式中,所要求保护的内容见所附权利要求。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1