α‑烯醇化酶特异性抗体及其在免疫疾病治疗中的使用方法与流程
相关申请的交叉参考
本申请要求2013年12月20日提交的美国临时申请号61/919,391的权益,并将其全文以引用的方式纳入本文。
发明领域
本发明涉及利用针对α-烯醇化酶的特异性抗体治疗多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮和相关的免疫疾病,包括慢性阻塞性肺病(COPD)、哮喘、过敏、牛皮癣、1型糖尿病和骨质疏松。
多发性硬化(MS)是中枢神经系统的慢性炎性疾病。多发性硬化中,神经纤维的髓鞘被破坏,即神经纤维被自身抗体脱髓鞘。多发性硬化的症状相对地为非特异性的,例如疲劳的复发与减轻,麻木,步态及协调问题,肠/膀胱功能障碍,认知功能障碍及疼痛。迄今为止,对病因及病理生理所知有限,有可能是遗传背景、维生素D缺乏和地理环境造成。MS的流行率随地理位置不同而不同。世界上西欧和北美的发病率最高;在美国,每100000人中有100例有症状的MS患者,在英格兰该比例为118/100000。日本和台湾的发病率分别为8.57/10000和1.9/100000(Amino,MJ.等,(2009)纽约:麦格劳希尔医学(McGraw Hill Medical.),第848-911页;Tsai,C-P.等,(2004),中国医学协会(Chinese Med.Assoc.),67:500-505)。MS的发病机理中也涉及到遗传背景。如果家族成员患有MS,则其亲戚患MS的风险与他们与该病患之间的遗传相似性成正比。在环境因素中,已证实维生素D和EB病毒感染是与MS相关的因素。最近提出台湾的MS中有疱疹病毒V和VI型的参与。最早的对MS病理学的理解中,认为髓磷脂特异性CD4+T淋巴细胞从血液迁移至大脑中,结合抗原呈递细胞(包括大脑中小神经胶质细胞)呈递的抗原性肽,无限繁殖,攻击并损伤少突细胞,破坏髓磷脂。最近的假说提出,髓磷脂CD+4T细胞仅参与MS的早期。CNS中MCP-1诱导的循环中的单核细胞负责疾病进展的中后期。趋化因子受体CCR2(其配体为MCP-1)缺陷小鼠耐受实验性自身免疫脑脊髓炎(EAE)。用不同量的来自EAE诱导的CCRC2+小鼠的单核细胞输给CCRC2敲除小鼠时,受体小鼠的临床分值与所输入的来自供体EAE小鼠的单核细胞的量成正比。此结果表明单核细胞对EAE疾病进展非常重要。
迄今为止,还未发现令人满意的对多发性硬化的治疗。美国FDA批准了8种药物,用于治疗MS患者。利比(Rebif)、干扰素β-1a粉针剂Avonex、干扰素β-1b(betaferon)和重组干扰素β-1b(Extavia)是不同类别的β干扰素,它们都是免疫调节剂。克帕松(Copaxon)是髓磷脂类似物,作为Th1CD4+抗原的诱饵受体起作用。芬戈莫德(Gilenya)是鞘氨醇1-磷酸盐(S1P-1)受体调节剂,结构与鞘氨醇非常接近。芬戈莫德在淋巴细胞S1P中作为功能性拮抗剂起作用,其免疫调节作用可能是抑制抗原特异性T细胞从淋巴结中流出。那他珠单抗(Tysabri)是一种抗胞外基质受体整联蛋白(α4β1)的单克隆抗体,对白细胞迁移相当重要。拉喹莫德是NFκB介导的炎症通路的抑制剂,其效应细胞包括T细胞、B细胞和树突细胞。Tecfidera(富马酸二甲酯BG12)是Nrf2转录通路抑制剂,其阻止免疫细胞分泌细胞因子,阻止上皮细胞表达CD 62E。米托蒽醌是蒽二酮(anthracenedion)的类似物,对活化的免疫细胞有毒性。虽然这些药物中有一些非常有效,但这些药物仅使该疾病急性期的频率和强度降低。它们总是有些副作用,例如β干扰素相关的药物导致的感染,和那他珠单抗导致的进行性多灶性白质脑病。
类风湿性关节炎(RA)是影响到患者关节的慢性炎性疾病。RA的症状包括关节的疼痛、肿胀、僵硬和变形。患者通常会感到发热和疲劳。RA的病因尚未完全理解。该疾病起源于针对患者结缔组织的自身抗体,接着发生白细胞(包括单核细胞、巨噬细胞和嗜中性粒细胞)的浸润。然后,淋巴细胞腐蚀和侵袭关节的骨头和软组织。传统的RA治疗药物被称为抗风湿药,包括如甲氨蝶呤和来氟米特。有时使用类固醇类药物。最近,可给予更有效的生物制剂,如RemicadeTM和HumiraTM,它们是TNF-α的抗体,或TNF-α的诱饵受体恩利(Enbrel),或IL-1的受体拮抗剂AnakinraTM。虽然这些药物有效,但存在副作用,例如感染和发热。此外,在许多病例中仍无法令人满意地治疗该疾病及避免对关节的损伤,这甚至会导致关节固定。
在两种疾病(MS和RA)中,文献中的数据表明,血液中的炎性单核细胞和巨噬细胞参与到两种免疫疾病的发展。
α-烯醇化酶(烯醇化酶-1,ENO1)是一种多功能蛋白,最初发现是糖酵解通路中的一个关键的酶。在正常条件下,ENO1表达在细胞溶质中。但是,文献中的最新数据也支持,ENO1可表达在许多癌细胞和活化的造血细胞如嗜中性粒细胞、淋巴细胞和单核细胞的细胞表面上,作为血纤维蛋白溶酶原的受体。已知血纤维蛋白溶酶原受体蛋白的上调可诱导尿激酶血纤维蛋白溶酶原活化信号(uPAS)的级联反应,并导致胞外基质降解。结果导致癌细胞的转移和免疫细胞的浸润增加。使用如LPS进行的炎性刺激,会通过翻译后修饰和移位至细胞表面而上调人血液单核细胞和U937单核细胞的细胞表面上ENO1的表达。
据信ENO1的移位受到MAP激酶信号传导通路的调节。这意味着细胞表面上ENO1表达的增加可能在炎症疾病中起到重要作用。已在不同自身免疫和炎性疾病中发现抗ENO1的自身抗体,包括红斑狼疮、系统性硬化、白塞氏病、溃疡和克罗恩病。Saulot等(Arthritis Aheum.,46:1196-1201(2002))和Wkui等(Clin.Exp.Immunol.,118:445-450(1999))的研究表明,25-66%的RA患者的血清中抗ENO1抗体的水平升高。Bae的研究(J.Immunology,189:365-372(2013))表明,当用抗ENO1抗体处理RA患者的PBMC以刺激ENO1血纤维蛋白溶酶原受体活性时,来自PBMC的单核细胞和巨噬细胞经由p38MAPK和NF-κB通路产生较大量的促炎介体,如TNFα、IL1-α/β、IFN-γ和PGE2。该研究表明,ENO1通过其血纤维蛋白溶酶原受体活性增加单核细胞和巨噬细胞的侵袭活性而在RA患者的疾病进展中起到关键作用。
总之,其细胞表面上作为血纤维蛋白溶酶原受体的ENO1的表达上调的单核细胞对于MS、RA以及相关的免疫疾病的疾病进展是非常重要的。因此,靶向单核细胞细胞表面上的ENO1对治疗炎性疾病如MS、RA、克罗恩病、溃疡性结肠炎、和系统性红斑狼疮或相关的免疫疾病,如慢性阻塞性肺病(COPD)、哮喘、过敏、牛皮癣、1型糖尿病、动脉粥样硬化和骨质疏松,具有良好的潜力。
技术实现要素:
本发明的实施方案涉及炎性疾病或免疫疾病如多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或相关的免疫疾病,如慢性阻塞性肺病(COPD)、哮喘、过敏、牛皮癣、1型糖尿病、动脉粥样硬化和骨质疏松的新疗法。
根据本发明的任一实施方案,治疗炎性疾病或免疫疾病的方法可包括给予有需要的对象抗ENO1的拮抗剂,其中,该拮抗剂结合ENO1并抑制ENO1的血纤维蛋白溶酶原受体活性。根据本发明的任一实施方案,该拮抗剂可以是抗ENO1抗体,或其scFv、Fab或F(ab)2片段。此外,根据本发明的任一实施方案,所述方法可进一步包括给予该对象免疫调节剂。免疫调节剂的例子是富马酸二甲酯。
根据本发明的任一实施方案,治疗炎性疾病或免疫疾病的方法可使用含可特异性结合ENO1血纤维蛋白溶酶原受体的抗体的药剂来实现,用以治疗对象的多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或相关的免疫疾病,以及使用所述抗体制备分别用于治疗对象的多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或相关的免疫疾病的药剂。
根据本发明的任一实施方案,抗体或其scFv、Fab或F(ab)2片段可结合人ENO1上的表位并抑制ENO1血纤维蛋白溶酶原受体活性,其中所述表位可位于由人ENO1的296FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS336(SEQ ID NO:39)序列组成的区域中。根据本发明的任一实施方案,所述抗体或其scFv、Fab或F(ab)2片段可结合人ENO1上的表位并抑制ENO1血纤维蛋白溶酶原受体活性,其中所述表位可位于由人ENO1的296FDQDDWGA WQKFTA309(SEQ ID NO:40)或326KRIAKAVNEKS336(SEQ ID NO:41)序列组成的区域中。
如上文所述,Bae的研究(J.Immunology,189:365-372(2013))表明,当用抗ENO1抗体处理RA患者的PBMC时,ENO1血纤维蛋白溶酶原受体活性被刺激,来自PBMC的单核细胞和巨噬细胞将经由p38MAPK和NF-κB通路产生较大量的促炎介体,如TNFα、IL1-α/β、IFN-γ和PGE2。与此观察相反,本发明人吃惊地发现给予抗ENO1抗体可实现类风湿性关节炎的临床改善。即,发现给予针对的表位不同于Bae等选用的抗体表位的抗ENO1活性的抗体可实现炎性疾病或免疫疾病(如类风湿性关节炎)的临床改善。同样地,发现也可实现多发性硬化的临床改善。这些观察结果表明并非每一种ENO1抗体对免疫疾病都具有治疗效果,这种效果是表位依赖性的。
此外,令人惊讶地发现,在动物模型中,不仅可在疾病发生之初即可进行治疗,而且在疾病已存在明显的临床症状时也可进行治疗。这使得人类临床实践中所需的在相对晚期进行的治疗干预得以进行。
本领域已知人ENO1血纤维蛋白溶酶原受体(见美国国立卫生研究院的网页,GenBank:AAH50642.1)。该受体是血纤维蛋白溶酶原受体,在人中具有两个不同剪切变体,ENO1和Myc结合蛋白。ENO1也已知为人ENO1、α~-烯醇化酶或ENO-1基因。
还已知来自几种其它物种的ENO1的相应直系同源物,且本领域技术人员可容易确定这些同源物,例如基于人ENO1进行序列检索。根据本发明的实施方案,术语“ENO1”指人和动物(如宠物或牲畜)ENO1蛋白。
根据本发明,术语“抗体”应广义理解,包括多克隆抗体、单克隆抗体和重组产生的抗体,包括双特异性抗体及其片段,如Fv、Fab和F(ab)2片段,其中所述Fv可以是单链抗体。优选的是,抗体是IgG同种型中的一种。优选的是,抗体不被对象的免疫系统排斥,或仅低程度排斥。这可通过如将抗体识别抗原(如ENO1蛋白,为血纤维蛋白溶酶原受体)时不需要的某些区域(如Fc区)转变成衍生自该对象所属物种的抗体序列的序列而实现。例如,所谓的人源化抗体是本领域技术人员周知的,特别适合用于人。本发明的上下文所用的术语“抗体”也意图包括修饰的抗体,如双特异性抗体(参见,例如Kontermann,R.E.(编)(2011),《双特异性抗体》(Bispecific antibodies),斯普林格海德堡多德雷赫特伦敦纽约出版社),双体(diabodies),以及所谓的结合剂或适体,可采用例如肽骨架或核酸骨架如RNA制备得到这些抗体。优选的,本文的抗体的分子量低于600kDa,更优选低于300kDa,更优选低于200kDa,最优选约150kDa。本文所用抗体还可包括嵌合抗体、人抗体、亲和力成熟抗体(已进行突变以优化其结合(亲和力)的抗体)。抗体还可与药物偶联,形成抗体-药物偶联物(ADC)。形成抗体和药物偶联物的方法为本领域所周知,例如包括使用高碘酸钠氧化抗体上的碳水化合物,形成醛,然后使其与药物或连接于药物的接头上的胺官能团反应。
制备合适的多克隆抗体、单克隆抗体和重组抗体,包括结合剂和适体的方法是本领域技术人员周知的,例如,参见Jorg Knablein编的《现代生物制药学》(Modern Biopharmaceuticals)第2卷第635页,以及下文所述的实施例。例如,可通过注射ENO1蛋白进行免疫。通过使用相应的分子(抗原)筛选杂交瘤上清,也可鉴定到合适的抗体。鉴定后,可采用本领域技术人员周知的方法制备抗体。
根据本发明的实施方案,抗ENO1抗体可以是EN10mAb或7E5mAb,或其scFv、Fab或F(ab)2片段。抗ENO1抗体EN10mAb和7E5mAb可结合血纤维蛋白溶酶原受体ENO1。优选的是,该抗体结合的解离常数Kd为10-7M或以下,更优选为10-8M或以下,更优选为10-9M或以下,最优选为10-10M或以下。优选的是,结合是特异性的。本发明的特异性结合指在生理条件下(即,例如在生理盐水中,在细胞培养物中或在体内,优选在相应个体的血液或组织中),该抗体与ENO1的亲和力至少是其与其它蛋白质尤其是类似的蛋白质(如Annexin 2,Histone 2B,CK8或其它血纤维蛋白溶酶原受体)的亲和力的10倍,优选至少20倍,更优选至少50倍,最优选至少100倍。但是,与其它蛋白的结合也是可以接受的,只要该结合不干扰该抗体的治疗效果。但是,也可能与来自其它物种的直系同源的ENO1血纤维蛋白溶酶原受体具有交叉反应性,且为了使该抗体在几个物种中使用,这种交叉反应性可能是有利的。这种交叉反应性很常见,本领域技术人员已知如何测定这种交叉反应性。关于此方面的更详细内容也可参见实施例。
优选的是,根据本发明实施方案使用的抗体可抑制ENO1血纤维蛋白溶酶原受体活性。可容易的测定抗体是否抑制ENO1血纤维蛋白溶酶原受体活性。例如,抗体可经由LPS-诱导细胞(如U937细胞)表达的ENO1血纤维蛋白溶酶受体与ENO1的反应而降低血纤维蛋白溶酶蛋白酶活性。示例性的检测在下文实施例中进行描述。
此外,可通过细胞(如U937)中出现的LPS和MCP-1诱导的侵袭活性的抑制来测定ENO1血纤维蛋白溶酶受体活性的抑制。下文实施例描述了示例性的检测。
适合或可模拟修饰抗体的起始点的抗体例子包括单克隆抗体EN10mAb和7E5mAb。抗体EN10mAb和7E5mAb的生产以及它们的特征在下文实施例中描述。
根据本发明实施方案的药物可含有抗体EN10mAb和7E5mAb。此外,药物可含有本领域技术人员认为可接受的任何类型的佐剂。这类佐剂可以是例如载体物质,如淀粉、乳糖、脂肪、硬脂酸、乙醇、生理盐水溶液或其它添加剂。具体而言,可稳定抗体和保持其活性的佐剂是有利的。本发明实施方案的药物还可含有具有偶联于该抗体的其它治疗分子(即抗体-药物偶联物,ADC)的抗体。制备ADC的方法为本领域所知。
可以任何已知的方法给予药物,将药物中所含的抗体EN10mAb和7E5mAb体外或体内递送到靶细胞,如特定的单核细胞。例如,可通过如静脉内(i.v.)、皮下(s.c.)或腹膜内(i.p.)以溶液、悬液或输注液(infusion)的形式注射给予药物。但是,也可采用其它给药形式,例如以微胶囊的形式或植入物的形式给予。优选地,给予药物的方式应使得抗体能进入循环中,或进入各个靶标区域。还可直接给予至靶标区域,例如,对于多发性硬化,可直接给予中枢神经系统(如脑脊液);对于类风湿性关节炎,可直接给予到受影响的关节;对于炎性肠病,可直接给予至小肠;对于SLE,可直接给予到肾,或对于其它炎性疾病,可直接给予到相应的器官。
多发性硬化(MS)和类风湿性关节炎(RA)为本领域技术人员所熟知,且已在前文描述。术语治疗也为本领域技术人员所熟知。在本发明中,治疗涉及引起对象疾病或病症临床改善的任何种类的干预,所述疾病或病症如多发性硬化症,类风湿性关节炎,克罗恩病,溃疡性结肠炎,或系统性红斑狼疮或免疫疾病。临床上的改善,例如对于多发性硬化症而言,可通过测量神经功能缺损的减少(例如,麻痹)来确定。在类风湿性关节炎中,可通过如症状如肿胀,发炎或疼痛的减少来确认临床症状的改善。优选地,改善表现为临床症状的减轻,例如,根据实施例,临床症状的减轻对应于EAE计值至少0.25个单位,优选0.5个单位,更优选至少0.75单位,更优选至少1.0个单位,或最优选至少1.3个单位的改善。优选地,改进为临床症状的减轻,例如,根据实施例,对应于关节炎计值至少0.25个单位,优选至少0.5个单位,更优选至少1.0单位,更优选至少2.0单位,或最优选至少3.0个单位的改善。
评估人临床上的改善的许多参数如用于多发性硬化的临床评分(Avnir,Y.等,2011,PLoS ONE,6:1-13)已为人熟知。另外,治疗尤其可以涉及难以治疗的多发性硬化症和/或类风湿性关节炎,对于这类疾病,迄今已知的药物均不能达成临床上的改善。相当数量对象的病程中,使用已知药物已无法改善临床症状。此外,治疗可涉及患有所述个别疾病的对象,其中,给予该对象迄今已知的治疗方法导致不需要的副作用达不可接受的程度。治疗还可涉及已为晚期的个别疾病。
根据本发明的实施方案,对象可以是脊椎动物,优选为哺乳动物。哺乳动物可以是啮齿动物(如小鼠、大鼠或兔),猪,狗,猫或灵长类动物。优选地,哺乳动物是灵长类动物,如猕猴、普通狨猴或人。尤其优选的是,对象是人。
通常,测定给予的药物的有效剂量。术语“有效剂量”以及该有效剂量的确定为本领域技术人员所熟知。此外,本领域技术人员可经由本文提供的信息来测定有效剂量。当给予某剂量引起所治疗疾病具有临床改善时,该剂量应理解为有效。尤其是,在本发明中,使对象的多发性硬化、类风湿性关节炎、克罗恩病,溃疡性结肠炎,系统性红斑狼疮或免疫疾病的症状减轻的药物剂量应理解为有效剂量。有效剂量是例如这样的剂量,当选用该剂量时,外周血中表达ENO1的单核细胞其至少20%、优选至少30%、更优选至少40%、最优选至少50%的侵袭活性被抑制。
优选地,选择药物的有效剂量,使其与能提供满足治疗多发性硬化症,类风湿性关节炎,克罗恩病,溃疡性结肠炎,系统性红斑狼疮或免疫疾病的最低剂量相似。可通过持续增加测试系列中的剂量直到所需药效与不利副作用达到一定比例来确定特别合适的有效剂量。在本发明中,这种情况可以是,例如,进一步增加剂量未能再在临床上改善所治疗的疾病(甚至加重),和/或不利副作用相对于疗效不再是可接受的。
此外,本发明涉及含有能抑制多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或免疫疾病对象的单核细胞的侵袭活性的抗体的药物,以及所述抗体在制备用于治疗对象的多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或免疫疾病的药物中的用途。
显而易见的是,本发明所有优选实施方案及其变化以及本说明书所描述的定义也涉及所有前述药物及对应方式的用途。
在本发明中,已发现给予能抑制血纤维蛋白溶酶受体ENO1的抗体能影响到表达ENO1的单核细胞的侵袭活性。
本发明者假设,经由表达ENO1的炎性单核细胞的血纤维蛋白溶酶受体活性受损而优先实现多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮或免疫疾病的治疗。
本发明中,表达ENO1的炎性单核细胞的血纤维蛋白溶酶受体活性的抑制应理解为将导致该相应单核细胞的侵袭活性受损。
通过涉及抗体可影响到血纤维蛋白溶酶受体活性的抑制机制。优选地,通过使UPAS(尿激酶型纤溶酶原激活信号)活性受损这一机制实现所述抑制。基于UPAS的抑制可经由例如ENO1蛋白介导。ENO1抗体可阻止单核细胞向炎症组织的迁移。
在本发明抗体的帮助下实现的侵袭活性的抑制可在不同物种中实现。例如,小鼠和人的单核细胞群是相似的。在小鼠中,血液单核细胞可分为炎性单核细胞(CD11b+CCR2+GR1+CD62L+CX3CRl低)和非炎性单核细胞(CD11b+CCR2-GRl-CD62L-CX3CRl高)(Geissmann F.等,2003,Immunity,19:71-82)。在人中,很久以前就已知有两个单核细胞群,这两个细胞群主要是通过其表面标记物CD14和CD16的表达水平加以确定(Ziegler-Heitbrock H.W.等,2000,J.Leukoc.Biol.,67:603-6)。
本发明的实施方案涉及抑制单核细胞侵袭的方法,所述方法包括使单核细胞与能特异性结合血纤维蛋白溶酶受体ENO1的抗体接触。优选地,所述接触在体内或体外进行。本文中,术语“体外”应理解为最广泛的可能形式。它涉及在活体外发生的任何事件,如在细胞培养、组织培养或器官培养中的方法。尤其是,术语“体外”还可理解为包括涉及在对象身体之外的血液的治疗的方法。
本发明还涉及对象多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎、或系统性红斑狼疮或免疫疾病的治疗方法。该方法包括给予能特异性结合血纤维蛋白溶酶受体ENO1的抗体的步骤。
本发明还涉及抑制对象特定单核细胞的侵袭活性的方法。该方法包括给予能特异性结合血纤维蛋白溶酶受体ENO1的抗体的步骤。
显而易见的是,上述已呈述的本发明所有优选实施方式及其变化以及定义也以相应的方式涉及到前述方法。
附图说明
图1显示分离自杂交瘤腹水的小鼠抗ENO1mAb与ENO1结合的ELISA结果。如实施例1所述进行硫酸铵纯化、蛋白A柱纯化和SDS-PAGE纯化。这些数据显示抗人ENO1抗体EN10mAb的Kd。
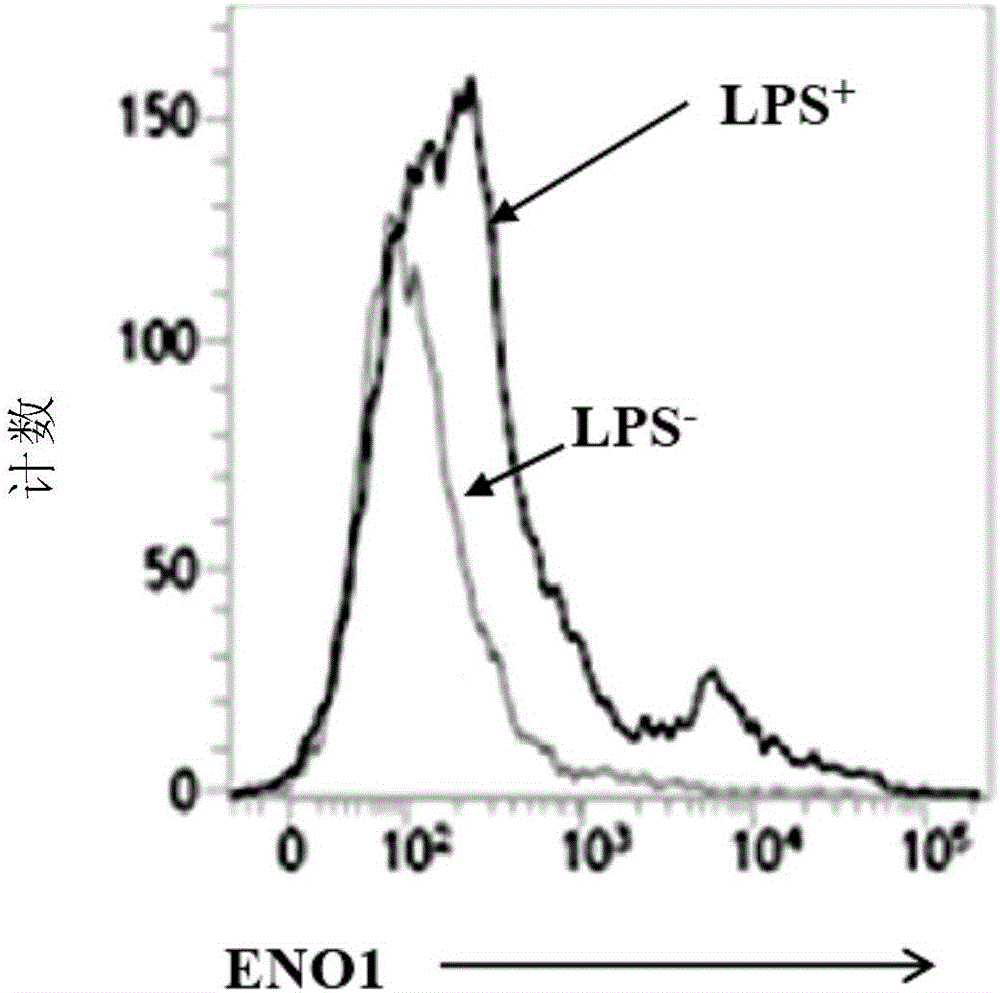
图2A、2B和2C显示使用LPS处理人正常PBMC时CD11b+细胞表面上ENO1的表达结果。采用实施例2所述的方法,使用LPS诱导人正常PBMC的ENO1表达。图1A显示LPS诱导细胞表面上ENO1的表达,如FACS扫描中荧光细胞群的增加及向右偏移所证明。图2B和2C的数据显示,炎性PBMC的CD11b高(图2B)和Mac3高(图2C)细胞中ENO1上调。
图3显示分离自杂交瘤腹水的EN10mAb(抗ENO1抗体)对LPS诱导的U937纤维蛋白溶解活性的影响结果。如实施例3所述使用LPS诱导人U937单核细胞系上ENO1的表达并进行血纤维蛋白溶酶活性测试。这些数据显示EN10mAb可抑制单核细胞上的ENO1血纤维蛋白溶酶原受体功能。
图4显示使用LPS诱导ENO1在人U937单核细胞表面表达后经不同浓度的EN10mAb处理的该细胞系的侵袭活性结果。详细的过程如实施例4所述实施。这些数据显示,EN10mAb以剂量依赖性的方式抑制U937细胞的侵袭活性。
图5显示EN10mAb识别经LPS处理的人U937单核细胞上的细胞表面ENO1。详细的过程如实施例5所述实施。
图6A显示ENO1缺失突变体的EN10mAb结合活性。EN10mAb的结合表位位于人ENO1蛋白氨基酸残基297到434之间,因为此片段的缺失基本上消除了抗体结合。如实施例6所述使ENO1的大部分缺失,以测定EN10mAb的结合区域。
图6B显示纯化自大肠杆菌的ENO1的6个C末端缺失突变体蛋白的12%SDS PAGE。纯化所述ENO1缺失突变体的详细方法如实施例6所述。
图6C显示ENO1的6个C末端缺失突变体的EN10mAb结合活性。EN10mAb的结合表位位于人ENO1蛋白的氨基酸残基296和336之间。如实施例6所述使ENO1的大部分缺失,以测定EN10mAb的结合区域。
图7A描述人ENO1氨基酸296-336之间的晶体结构和表面暴露的氨基酸残基。如实施例7所述进行结构预测。
图7B显示纯化自大肠杆菌的ENO1的11种丙氨酸扫描突变蛋白的12%SDS PAGE。纯化ENO1突变蛋白的详细过程如实施例7所述。
图7C显示11种丙氨酸扫描突变体抗EN10mAb的ENO1结合ELISA和Kd值。结果表明,位于人ENO1氨基酸残基296到336之间的ENO1肽1(FDQDDWGAWQKFTA,SEQ ID NO:40)和肽2(KRIAKAVNEKS,SEQ ID NO:41)序列参与了EN10mAb结合。如实施例7所述进行丙氨酸扫描。
图7D显示人ENO1氨基酸残基296到336之间的ENO1肽1(FDQDDWGAWQKFTA,SEQ ID NO:40)和肽2(KRIAKAVNEKS,SEQ ID NO:41)的序列,其参与到人ENO1与EN10mAb结合。
图8A和8B显示给予非传染性炎症小鼠模型EN10mAb中白细胞浸润的抑制结果。详细过程如实施例8所述。图8A显示EN10mAb对总腹膜细胞计数的影响,图8B显示给予EN10mAb后对嗜中性粒细胞计数无影响。
图9显示给予EN10mAb改善了多发性硬化动物预防模型中实验性自身免疫性脑脊髓炎(EAE)的病程。详细过程如实施例9所述实施。
图10A显示给予EN10mAb缓和了动物治疗模型中EAE多发性硬化的症状。详细过程如实施例10所述实施。
图10B显示给予EN10mAb降低了动物治疗模型中EAE的CNS组织病理学分值。详细过程如实施例10所述实施。
图10C显示给予EN10mAb改善了动物治疗模型中EAE的CNS脱髓鞘分值。详细过程如实施例10所述实施。
图10D显示给予EN10mAb改善了动物治疗模型中EAE的CNS炎症。详细过程如实施例10所述实施。
图11A显示给予EN10mAb减轻了胶原蛋白抗体诱导的关节炎啮齿动物模型中关节炎的症状。详细过程如实施例11所述实施。
图11B显示用EN10mAb处理下调了胶原蛋白抗体诱导的关节炎啮齿动物模型中滑液IL1-b。详细过程如实施例11所述实施。
图11C显示用EN10mAb处理下调了胶原蛋白抗体诱导的关节炎啮齿动物模型中滑液MMP9。详细过程如实施例11所述实施。
图12A和12B显示大鼠抗小鼠ENO1抗体杂交瘤的制备,以及通过结合性ELISA和竞争性ELISA验证各单克隆抗体克隆。来自ELISA实验的OD读数显示在各克隆之后。产生杂交瘤的过程以及产生各抗体并通过结合性ELISA和竞争性ELISA验证各抗体的过程如实施例12所述。数据显示75个杂交瘤抗体中有5个可识别小鼠ENO1蛋白中EN10mAb的直系同源表位。
图13显示分离自各杂交瘤的上清的5种大鼠抗小鼠ENO1抗体与ENO1结合的ELISA结果。如实施例1所述进行硫酸铵纯化和蛋白A柱纯化。这些数据显示大鼠抗小鼠ENO1 7E5的Kd。
图14A显示给予大鼠抗小鼠ENO1抗体7E5减轻了动物治疗模型中EAE的多发性硬化症状。详细过程如实施例14所述实施。
图14B显示给予大鼠抗小鼠ENO1抗体7E5降低了动物治疗模型中EAE的CNS组织病理学分值。详细过程如实施例14所述实施。
图14C显示给予大鼠抗小鼠ENO1抗体7E5改善了动物治疗模型中EAE的CNS脱髓鞘分值。详细过程如实施例14所述实施。
图14D显示给予大鼠抗小鼠ENO1抗体7E5减轻了动物治疗模型中EAE的CNS炎症。详细过程如实施例14所述实施。
发明详述
本发明的实施方案涉及治疗各种ENO1相关的疾病或病症的方法。ENO1相关的疾病或病症可包括炎性疾病或免疫疾病。炎性疾病的例子包括多发性硬化、类风湿性关节炎、克罗恩病、溃疡性结肠炎和系统性红斑狼疮。免疫疾病的例子包括慢性阻塞性肺病(COPD)、哮喘、过敏、牛皮癣、1型糖尿病、动脉粥样硬化和骨质疏松。该方法使用能结合ENO1以抑制其作为血纤维蛋白溶酶原受体的功能的拮抗剂。通过该抑制,血纤维蛋白溶酶原活性被抑制,从而阻止或减少下游涉及血纤维蛋白溶酶活性的反应。抗ENO1的拮抗剂可以是抗体,其可以是多克隆抗体,单克隆抗体或其它可结合ENO1并抑制ENO1活化血纤维蛋白溶酶原的功能的修饰抗体。
将结合下文所述的具体实施例进一步阐述本发明的实施。本领域技术人员将理解,这些实施例仅仅是阐述性的,并不意图限制,因为在不偏离本发明范围的情况下可做出各种修改和变动。
实施例
实施例1
为了评估抗人ENO1抗体EN10mAb对ENO1的结合亲和力,在含10%胎牛血清(FCS)的RPMI中使杂交瘤生长。培养一周后,收集1×106个细胞,用PBS洗涤,重悬于200微升RPMI培养基中,并IP注射到重症联合免疫缺陷(SCID)小鼠中。三周后,收集小鼠腹水,稀释到15ml。根据本领域周知方法,采用40%硫酸铵和蛋白A柱(Montage抗体纯化试剂盒,密理博公司)进一步纯化抗体。根据制造商(密理博公司)提供的方案,用Amicon Ultra-15离心过滤装置浓缩纯化的抗体。采用12%SDS PAGE分析抗体纯度。
将400ng的人ENO1蛋白包涂在96孔ELISA板上,进一步用PBS洗涤该板。将1×10-12到1×10-8M的系列稀释的EN10mAb抗体加到该板,然后37℃孵育1小时。加入偶联有次黄嘌呤磷酸核糖转移酶(HPRT)的山羊抗小鼠IgG。1小时后,加入3,3′,5,5′-四甲基对二氨基联苯(TMB),读取OD405读数。每个研究重复3次。数据以平均值±SD表示。使用Sigmaplot将OD读数和抗体浓度制作多重分散曲线。由四个参数的逻辑拟合预测Kd值。
此实验的结果如图1所示。抗体EN10mAb的产率从每只小鼠20.4mg到4.6mg不等。EN10mAb抗体的Kd值为2.03±0.12×10-10M(N=3)。此结果表明,EN10mAb抗体可识别人ENO1蛋白,具有良好的亲和力,其Kd值为约2.03±0.12×10-10M(N=3)。
实施例2
已知ENO1蛋白在小鼠炎性单核细胞中在体内和体外情况下都上调(Wygrecka,M.等,2009,Blood,113:5588-5598)。为了评估人炎症状态下PBMC中的ENO1表达水平,遵照台湾生物技术开发中心人体试验委员会通过许可,从正常的捐献者采集新鲜血样。使用Ficoll-Hypaque梯度离心处理血液,纯化PBMC。将Ficoll-Hypaque(法玛西亚公司,法国)的密度调整为约1.077g/ml。使收获的细胞在含10%胎牛血清的RPMI中生长至细胞密度约为1×106个细胞/毫升。使用台盼蓝染色液检查细胞的存活力,以核实淋巴细胞的总%超过90%。使用10微克/毫升的脂多糖(LPS)进一步处理PBMC六小时。用PBS洗涤细胞2次,进行流式细胞分析。用或未用EN10mAb(1:300的稀释度)和大鼠抗人CD11b或Mac3抗体染色完整的细胞。针对EN10mAb,使用FITC偶联的山羊抗小鼠IgG使染色的细胞可见;针对CD11b或Mac3抗体(贝克顿-迪金森公司),使用PE偶联的抗大鼠IgG使染色的细胞可见。然后使用FACSan流式细胞仪(贝克顿-迪金森公司)分析样品。由所产生的荧光强度测量ENO1和CD11b+表达。
这些实验的结果显示在图2A中。与未用LPS但用EN10mAb孵育的细胞相比,用LPS和EN10mAb处理正常PBMC使得曲线向右偏移。该观察结果表明,当细胞处于炎症状态(如用LPS刺激)时,正常PBMC在其细胞表面上表达ENO1。此外,可鉴别出高表达ENO1的细胞群。如图2B和2C所示,与未处理细胞相比,LPS处理的人PBMC中Mac3+和CD11b+细胞群也增加。ENO1高表达细胞群与CD11b高和Mac3高细胞相关(图2B和2C)。这些结果表明ENO1蛋白在活化的单核细胞和巨噬细胞表面上上调。
实施例3
Wygrecka的研究表明ENO1血纤维蛋白溶酶原受体活性对单核细胞迁移至炎症位点而言至关重要(Wygrecka,M.等,2009,Blood.,113:5588-5598)。为了评估EN10mAb抑制人单核细胞ENO1血纤维蛋白溶酶原受体活性的能力,使人U937单核细胞系在含10%FCS的RPMI中生长。用10微克/毫升的LPS处理细胞6小时,以诱导ENO1蛋白在细胞表面上表达。然后分别用1微克/毫升的人Lys-血纤维蛋白溶酶原和10微克/毫升的EN10mAb预培育PBS中的细胞(1.5×106个细胞/毫升)1小时。PBS洗涤样品2次,加入3nM组织特异性血纤维蛋白溶酶原活化剂和0.5mM生色底物S-2251。37℃孵育1小时后,读取OD405。每个研究重复3次,分析拮抗剂活性。数据以平均值±SD表示。采用T-检验比较各组。P<0.05认为是统计学显著。
此实验的结果如图3所示。EN10mAb具有高的ENO1血纤维蛋白溶酶原受体拮抗活性,可对LPS诱导的特异性ENO1活性可达到100%的抑制。因此,EN10mAb具有良好的抑制单核细胞迁移至靶器官的潜力。
实施例4
实施例3的结果表明,EN10mAb可抑制ENO1血纤维蛋白溶酶原受体活性,导致血纤维蛋白溶酶原活化被抑制,以及LPS刺激的人单核细胞的迁移活性被抑制。此结果进一步获得指出无血纤维蛋白溶酶原的小鼠的单核细胞在小鼠非传染性炎症模型中丧失迁移能力和浸润活性的其它文献报道(Ploplis,V.A.等,1998,Blood,91:2005-2009)的支持。
为了评估ENO1血纤维蛋白溶酶原受体活性受损是否能减轻活化的单核细胞的侵袭活性,使人单核细胞U937细胞系在含10%FCS的RPMI中生长。用10微克/毫升LPS处理细胞6小时,诱导ENO1蛋白在细胞表面上表达。与5到50微克/毫升的EN10mAb混合后,将2×104个细胞接种到含15微摩尔Lys-血纤维蛋白溶酶原的两室检测系统的上层腔室中,孵育24小时,下层腔室中含含有10%FBS和10nM MCP-1的培养基。使用抗小鼠IgG作为阴性对照组。两个室经包涂基质胶Matrigel的微孔过滤器(孔径为8微米)隔开。培养期后,在显微镜下用血球计统计下层腔室的细胞。每个研究重复三次。数据以平均值±SD表示。采用T-检验比较各组。P值<0.05时被认为是统计学显著。
结果显示在图4中。当LPS处理的U937细胞经5-50微克/ml的EN10mAb处理时,U937的侵袭活性为对照IgG的90.2±2%到49.1±1%(N=3)。这些结果表明,EN10mAb可以剂量依赖性的方式损害ENO1血纤维蛋白溶酶原受体活性而减轻活化的U937单核细胞的侵袭能力。通过靶向炎性单核细胞表面上的ENO1蛋白,可使用EN10mAb抑制细胞进入侵犯部位。
实施例5
为了了解炎症刺激后细胞表面上ENO1的表达水平,使人U937单核细胞在含10%FCS的RPMI中生长。用10微克/毫升LPS处理细胞6小时,诱导ENO1蛋白在细胞表面上表达。对于流式细胞分析,用或不用EN10mAb(1:300的稀释度)染色完整的全细胞,用FITC偶联的山羊抗血清(杰克逊实验室,Jackson Lab)使其可见,并使用FACSsan流式细胞仪(贝克顿-迪金森公司)分析。根据所获得的荧光强度计算ENO1表达。
这些实验的结果如图5所示。与未用LPS但用EN10mAb培育的U937细胞相比,用LPS和EN10mAb培育U937细胞使得其曲线向右偏移。该结果表明当U937细胞受到LPS的刺激时在其表面上表达ENO1。这些数据支持这一观点,即EN10mAb识别单核细胞表面上LPS诱导的ENO1。
实施例6:表位作图
抗体表位作图
为测定人ENO1蛋白上EN10mAb的表位,设计两条正向引物,其核苷酸序列为5’-GGATCCGCAGCAAACTTCAGGGAAGCCATG-3’(SEQ ID NO:1)和5’-GGATCCTCGAAGATCCCTTTGACCAGGATG-3’(SEQ ID NO:2),和反向引物5’-TCAGGCTGAAAATCTCTCATCCGC-3(SEQ ID NO:3)。使用含人ENO1cDNA基因的大肠杆菌表达质粒pTRC-HIS ENO1作为模板扩增ENO1缺失突变体。使用SEQ ID NO:1和2作为正向引物,使用SEQ ID NO:3作为反向引物,分别扩增缺失突变体Δ1-189(图6A)和Δ1-297(图6A)。使用其它组引物(序列为5’-GGATCCTATCTATTCTCAAGATCCATGCC-3’(SEQ ID NO:4)和5’-CTCGAGGTCATGGTGTCTCATCGTTCGCTCGAG-3’(SEQ ID NO:5))扩增缺失突变体Δ297-434(图6A)。对于各突变体的扩增,制备含1微升1:1000稀释度的模板DNA(约0.1ng)、5微升10×反应缓冲液、1微升10mM dNTP混合物、1微升2.5单位的Taq聚合酶、1微升正向引物和1微升反向引物的反应溶液,并用二次蒸馏的水使其最终体积为50微升,进行PCR。进行一轮94℃、10分钟的反应,然后进行94℃、1分钟,52℃、1分钟和72℃、1分钟的反应,重复35轮,最后72℃孵育10分钟以上。将反应溶液进行2%琼脂糖凝胶电泳,分析反应产物。根据所附指导手册,将具有正确分子量的反应产物连接到pCR2.1-TOPO载体(英杰公司制造),进行亚克隆。然后使用M13正向引物(5'-GTAAACAACGACGGCGAG-3',SEQ ID NO:6)和M13反向引物(5'-CAGGAAACAGCTATGAC-3',SEQ ID NO:7)测定核苷酸序列。使用限制性内切酶BamHI和XhoI消化具有正确序列的每个突变克隆,将消化产物进行2%琼脂糖凝胶电泳。从琼脂糖凝胶切下各突变子的插入片段,使用Gene Clean试剂盒,根据所附的制造商(BIO101)提供的指导手册纯化。将各突变体的BamHI和XhoI DNA片段连接到大肠杆菌表达载体pTRC His A(英杰公司)的BamHI和XhoI位点。将所得质粒转化到大肠杆菌BL21Rosseta中。经IPTG诱导使ENO1突变蛋白在大肠杆菌中表达,超声处理细菌沉淀物后,根据制造商(恰根)提供的附带指导手册采用Ni-琼脂糖进行纯化。采用12%SDS PAGE分析各突变体的纯度。为了测定各突变蛋白的结合活性,将400ng的各人ENO1突变蛋白包被到96孔ELISA板上,用PBS洗涤该板。将10微克EN10mAb加到该板上,在37℃孵育1小时。用PBS洗涤结合复合物2次后,加入偶联了HPRT的山羊抗小鼠IgG。孵育1小时后,加入TMB。根据OD405读数测定结合亲和力。各研究重复3次。数据以平均值±SD表示。采用T-检验比较各组之间的活性。P值<0.05时被认为是统计学显著。
结果显示在图6A中。ENO1突变体Δ1-189和Δ1-297的OD405读数约为1.43±0.18和1.56±0.08(N=3)(图6A),分别约为野生型ENO1(2.87±0.08,N=3)的42%和39%。但是,当删除氨基酸残基297到434时,与BSA背景相比,此突变的ENO1对EN10mAb的结合活性丧失。这些结果表明氨基酸残基297到434是ENO1蛋白结合EN10mAb所需,突变体Δ1-182和Δ1-297结合活性的下降可能是这些突变蛋白的不稳定或构象变化所致。
为了进一步研究ENO1蛋白中EN10mAb的表位,设计5条反向引物,分别具有以下序列:5’-CTCGAGAGGGATCTTCGATAGACACCACTGGG-3’(SEQ ID NO:8),5’-CTCGAGCTACCTGGATTCCTGCACTGGCTG-3’(SEQ ID NO:9),5’-CTCGAGACTTCTCGTTCACGGCCTTGGCGATC-3’(SEQ ID NO:10),5’-CTCGAGACTTCTCGTTCACGGCCTTGGCGATCC-3’(SEQ ID NO:11),5’-CTCGAGCAGTCTCCCCCGAACGATGAGACACC-3’(SEQ ID NO:12)和5’-CTCGAGCACCAGTCTTGATCTGCCCAGTGCAC-3’(SEQ ID NO:13)。使用含人ENO1cDNA基因的大肠杆菌表达质粒pTRC-HIS ENO1作为模板扩增ENO1缺失突变体。SEQ ID NO:4用作正向引物,分别与引物SEQ ID NO:8、SEQ ID:9、SEQ ID:10、SEQ ID:11、SEQ ID:12、SEQ ID:13扩增缺失突变体296-434、316-434、336-434、376-434和396-434。对于各突变体的扩增,制备含1微升1:1000稀释度的模板DNA(约0.1ng)、5微升10×反应缓冲液、1微升10mM dNTP混合物、1微升2.5单位的Taq聚合酶、1微升正向引物和1微升反向引物的反应溶液,并用二次蒸馏的水使其最终体积为50微升,进行PCR。进行一轮94℃、10分钟的反应。然后进行94℃、1分钟,52℃、1分钟和72℃、1分钟的反应,重复35轮,最后72℃孵育10分钟以上。将反应溶液进行2%琼脂糖凝胶电泳,分析反应产物。根据所附指导手册,将具有正确分子量的反应产物连接到pCR 2.1-TOPO载体(英杰公司制造),进行亚克隆。使用M13正向引物(5'-GTAAACAACGACGGCGAG-3',SEQ ID NO:6)和M13反向引物(5'-CAGGAAACAGCTATGAC-3',SEQ ID NO:7)测定核苷酸序列。使用限制性内切酶BamHI和XhoI消化具有正确序列的每个突变克隆,将消化产物进行2%琼脂糖凝胶电泳。从琼脂糖凝胶分离各突变体的DNA片段,使用Gene Clean试剂盒,根据所附的制造商(BIO101)提供的指导手册纯化。将各突变体的BamHI和XhoI DNA片段连接到大肠杆菌表达载体pTRC His A(英杰公司)的BamHI和XhoI位点。将所得质粒转化到大肠杆菌BL21Rosseta中。经IPTG诱导使ENO1突变蛋白在大肠杆菌中表达,超声处理细菌沉淀物后,根据制造商(恰根)提供的附带指导手册采用Ni-琼脂糖进行纯化。采用12%SDS PAGE分析各突变体的纯度。为了测定各突变蛋白的结合活性,将400ng的人ENO1蛋白或突变蛋白包被到96孔ELISA板上,用PBS洗涤该板。加入10微克EN10mAb,37℃孵育1小时。用PBS洗涤结合复合物2次后,加入偶联了HPRT的山羊抗小鼠IgG。孵育1小时后,加入TMB。根据OD405读数测定结合亲和力。各研究重复3次。数据以平均值±SD表示。采用T-检验比较各组之间的活性。P值<0.05时被认为是统计学显著。
各突变体和野生型蛋白的12%SDS PAGE显示在图6B中。各突变体的分子量从突变体296-343增加到野生型。此结果表明我们可从各突变体获得完整蛋白,即便发现突变体336-434和376-434有一些降解。如图6C所示,EN10mAb对野生型ENO1的结合亲和力与对缺失突变体336-434、376-434和369-343的结合亲和力之间无显著差异。但是,当缺失氨基酸残基296-316和317-336时,与大肠杆菌细胞裂解物背景相比,这两种ENO1突变体的EN10mAb结合活性丧失。这些结果表明,296-336左右区域的氨基酸残基(FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS,SEQ ID NO:39)对ENO1蛋白与EN10mAb的结合起重要作用。
实施例7:丙氨酸扫描
为了进一步研究人ENO1残基296到336中哪些残基对EN10mAb结合而言起重要作用,从蛋白质数据库(pdb登陆号:2PSN)下载ENO1的晶体结构。经结构分析后,预测氨基酸残基D300、W301、G302、Q305、K306、A309、K326、K330、N333、E334和K335暴露在蛋白表面,作为突变的候选位点,用于分析它们是否确实对EN10mAb结合起重要作用。使用QuickChange II定点突变试剂盒,根据制造商(安捷伦科技有限公司)提供的附带指导手册,将这11个残基中的10个突变为丙氨酸,A309被突变成甘氨酸。由基因组学生物科技有限公司产生下述用于丙氨酸扫描的诱变寡核苷酸(表1)。
表1:寡核苷酸序列
5’-GATCCCTTTGACCAGGATGCCTGGGGAGCTTGGCAG-3’(SEQ ID NO:14)
5’-CTGCCAAGCTCCCCAGGCATCCTGGTCAAAGGGATC-3’(SEQ ID NO:15)
5’-CCCTTTGACCAGGATGACGCGGGAGCTTGGCAGAAG-3’(SEQ ID NO:16)
5’-CTTCTGCCAAGCTCCCGCGTCATCCTGGTCAAAGGG-3’(SEQ ID NO:17)
5’-CTTTGACCAGGATGACTGGGCAGCTTGGCAGAAGTTC-3’(SEQ ID NO:18)
5’-GAACTTCTGCCAAGCTGCCCAGTCATCCTGGTCAAAG-3’(SEQ ID NO:19)
5’-GACTGGGGAGCTTGGGCGAAGTTCACAGCCAGTGCA-3’(SEQ ID NO:20)
5’-TGCACTGGCTGTGAACTTCGCCCAAGCTCCCCAGTC-3’(SEQ ID NO:21)
5’-GGGGAGCTTGGCAGGCGTTCACAGCCAGTGCAGG-3’(SEQ ID NO:22)
5’-CCTGCACTGGCTGTGAACGCCTGCCAAGCTCCCC-3’(SEQ ID NO:23)
5’-GGCAGAAGTTCACAGGCAGTGCAGGAATCCAGGTAG-3’(SEQ ID NO:24)
5’-CTACCTGGATTCCTGCACTGCCTGTGAACTTCTGCC-3’(SEQ ID NO:25)
C5’-TCACAGTGACCAACCCAGCGAGGATCGCCAAGGCC-3’(SEQ ID NO:26)
5’-GCCTTGGCGATCCTCGCTGGGTTGGTCACTGTGAG-3’(SEQ ID NO:27)
5’-CAACCCAAAGAGGATCGCCGCGGCCGTGAACGAGAAG-3’(SEQ ID O:28)
5’-CTTCTCGTTCACGGCCGCGGCGATCCTCTTTGGGTTG-3’(SEQ ID NO:29)
5’-GAGGATCGCCAAGGCCGTGGCCGAGAAGTCCTGCAAC-3’(SEQ ID O:30)
5’-GTTGCAGGACTTCTCGGCCACGGCCTTGGCGATCCTC-3’(SEQ ID NO:31)
5’-GATCGCCAAGGCCGTGAACGCGAAGTCCTGCAACTG-3’C(SEQ ID NO:32)
5’-GCAGTTGCAGGACTTCGCGTTCACGGCCTTGGCGATC-3’(SEQ ID NO:33)
5’-GCCAAGGCCGTGAACGAGGCGTCCTGCAACTGCCTC-3’(SEQ ID NO:34)
5’-GAGGCAGTTGCAGGACGCCTCGTTCACGGCCTTGGC-3’(SEQ ID NO:35)
5’-CAAGGCCGTGAACGCGGCGTCCTGCAACTGCCTCCTG-3’(SEQ ID NO:36)
5’-CAGGAGGCAGTTGCAGGACGCCGCGTTCACGGCCTTG-3’(SEQ ID NO:37)
对于各突变体的扩增,制备含3微升模板DNA(约30ng)、5微升10×反应缓冲液、1微升10mM dNTP混合物、1微升2.5单位的pfu聚合酶、12.5微升125ng正向引物和12.5微升125ng反向引物的反应溶液,并用二次蒸馏的水使其最终体积为50微升,进行PCR。进行一轮95℃、10分钟的反应。然后进行95℃、30秒,55℃、30秒和68℃、6分钟的反应,重复16轮。PCR反应结束后,将1微升DpnI加到各PCR试管中,37℃孵育1小时,然后加热DpnI至80℃20分钟,使其失活。根据所附指导手册(英杰公司制备)用反应产物转化50微升的XL-1蓝感受态细胞。使用ENO1R400-420引物(5'-GCAAGGGGCACCAGTCTTGATCTG-3',SEQ ID NO:38)测定核苷酸序列。将每个具有正确序列的突变克隆质粒转化大肠杆菌BL21Rosseta。经IPTG诱导使ENO1突变蛋白在大肠杆菌中表达,超声处理细菌沉淀物后,根据制造商(恰根)提供的附带指导手册采用Ni-琼脂糖进行纯化。各突变蛋白的纯度采用12%SDS PGE分析。
为了测定各突变蛋白的结合活性,将400ng/100微升的人ENO1蛋白或突变ENO1蛋白包被到96孔ELISA板上,4℃过夜,然后用PBS洗涤该板。室温下用1%BSA(w/v)的PBS溶液封阻该板1小时,然后用1x PBS再次清洗。一抗(EN10mAb)经2倍系列稀释,获得15个不同的浓度,然后加到各板中,37℃放置1小时。反应完成后,用1x PBS洗涤板三次。加入1/8000稀释度的山羊抗-小鼠-HRP抗体,37℃孵育1小时,然后用1x PBS洗涤板三次。然后加入TMB底物,允许反应在室温下进行30分钟。加入1N HCl结束反应,读取OD450测定活性。各研究重复3次。数据以平均值±SD表示。使用SigmaplotTM将OD读数和抗体浓度制作多重分散曲线。由四个参数的逻辑拟合预测Kd值。
根据实施例6所示的ENO1大部分删除研究结果,残基296-336的肽序列(FDQDDWGAWQKFTASAGIQVVGDDLTVTNPKRIAKAVNEKS,SEQ ID NO:39)是ENO1蛋白与EN10mAb紧密结合所需。“紧密结合”在本文中指特异性结合剂(如抗体,scFv或Fab片段)与配体/靶标(如肽、蛋白或细胞)之间结合时解离常数(Kd)为10nM或以下,优选为1.0nM或以下。
上述删除实验鉴定了ENO1的残基296-336是抗体结合的区域。为了进一步表征实际的结合位点(如表位),从蛋白质数据库(pdb登陆号:2PSN)下载ENO1的晶体结构,分析此区域的残基位置。在蛋白表面暴露有以下11个氨基酸残基:D300、W301、G302、Q305、K306、A309、K326、K330、N333、E334和K335(图6A,推定的表位)。通过定点诱变,将这11个氨基酸突变,在大肠杆菌中分别表达所得突变蛋白,并纯化(图7B)。使用ELISA分析每个纯化的ENO1突变蛋白的任何Kd变化(与ENO1结合相比)。
结果显示,这些突变体中存在3种功能类别的氨基酸残基。氨基酸残基W301和K330对ENO1蛋白与EN10mAb的结合是重要的。如果这两个氨基酸残基分别被突变成丙氨酸,这两个ENO1突变体对EN10mAb的结合活性明显被削弱。第二类氨基酸残基包括A309、E334、K335和D300。如果E334、K335和D300分别被突变成丙氨酸或A309被突变成甘氨酸,这些ENO1突变体对EN10mAb的结合活性被削弱。余下的氨基酸残基,包括G302、Q305、K306、N333和K326,属于对ENO1蛋白与EN10mAB的结合无明显结合影响的氨基酸残基组(图7C和表II)。这些结果表明,W301、K330、A309、E334、K335和D300对ENO1和EN10mAb之间的蛋白-蛋白结合是重要的。这些氨基酸残基属于ENO1肽1(296FDQDDWGAWQKFTA 309,SEQ ID NO:40)和肽2(326KRIAKAVNEKS336,SEQ ID NO:41)的序列,它们可能是人ENO1氨基酸残基296-335(图7D,SEQ ID NO:39)中EN10mAb的结合表位。
表II:突变体Kd值
实施例8
实施例3和4的结果表明,EN10mAb可损害ENO1血纤维蛋白溶酶原受体活性。ENO1血纤维蛋白溶酶原受体活性的下降反过来抑制血纤维蛋白溶酶原的活化,导致活化的U937单核细胞的侵袭能力减弱。此结果进一步获得指出无血纤维蛋白溶酶原的小鼠的单核细胞在小鼠非传染性炎症模型中丧失迁移能力和浸润活性的其它文献报道(Ploplis,V.A.等,1998,Blood,91:2005-2009)的支持。
为了证明EN10mAb在体内对白细胞浸润的抑制效果,本研究使用非传染性炎症(NII)小鼠模型。将12只小鼠分成4组,每组3只。第1天,各组分别给予PBS,6mg/kg(mpk)的恩利(Enbrel),10mpk的小鼠IgG,和10mpk的EN10mAb(ip)。2小时后,给各小鼠注射200微克酪蛋白(ip)。使小鼠处在25℃12小时。然后分别用相同剂量的相同药物处理小鼠,2小时后接着用200微克酪蛋白处理。3小时后,剖开小鼠腹膜,收集液体。统计各组的总腹膜细胞。为了鉴别单核细胞和嗜中性粒细胞的细胞群分布,对各组的腹膜液体中的细胞进行染色,其中,针对嗜中性粒细胞,用大鼠1A8抗体进行染色,对单核细胞,用大鼠抗BR1进行染色,然后用FITC偶联的山羊抗大鼠IgG(杰克逊实验室)使其可见,并使用FACSsan流式细胞仪(贝克顿-迪金森公司)分析。数据以平均值±SEM表示。采用T-检验比较各组。P值<0.05时被认为是统计学显著。
此研究的结果如图8A和8B所示。腹膜6mpk的恩利、载剂和10mpk的对照IgG处理的小鼠的平均总细胞计数分别为1.5±0.1×107(N=3),1.8x107和4±0.5×107(N=3)。但是,当给予经相同酪蛋白处理的小鼠10mpk的EN10mAb时,腹膜中的平均细胞计数为5±1.2x106(N=3),明显低于恩利、溶剂和对照IgG组。10mpk EN10mAb处理组和天然组(3.9±1.2x106,N=3)之间无显著差异(图8A)。
分析腹膜中的细胞群时,嗜中性粒细胞占腹膜总细胞数的约73%到85%,本研究各组(除未处理组外)之间无显著差异(图8B)。此结果暗示EN10mAb可损害ENO1血纤维蛋白溶酶原受体活性,这反过来会如无血纤维蛋白溶酶原的小鼠那样组织中血纤维蛋白溶酶原的活化降低,且炎性细胞(例如嗜中性粒细胞)向侵犯部位的浸润受阻。因此,用ENO1抗体靶向ENO1血纤维蛋白溶酶原受体具有治疗免疫疾病的潜在应用。
实施例9
最近的文献报道,EAE动物模型中单核细胞浸润对于多发性硬化的疾病进展至关重要。基于实施例8的数据,推测使用抗ENO1抗体削弱ENO1血纤维蛋白溶酶原受体活性将减轻EAE动物模型中的多发性硬化症状。皮下给予12只7-10周龄的CB57/BL/6雌性小鼠100微克于完全弗氏佐剂中的MOG p35-55,然后腹膜内注射100ng的百日咳毒素。小鼠随机分成2组,每组6只。第2天,各组小鼠分别皮下注射200微升10mpk EN10mAb和小鼠IgG。第3天,腹膜给予另一剂100ng的百日咳毒素。每天观察动物,如下评估临床症状:0,无迹象;1,尾紧张下降;2,轻度单肢轻瘫或局部麻痹;3,严重下肢轻瘫;4,下身麻痹和/或四肢瘫痪;5,垂死或死亡。所有研究按照台湾生物技术开发中心的动物护理及使用委员会所述的规范完成。
结果如图9所示。各组小鼠在第7天开始出现EAE症状,第7到第12天两组的临床分值之间没有显著差异。EN10mAb处理组中,小鼠在第13天疾病达到最严重程度,平均最大临床分值约为2.7±032(N=6)。然后,小鼠进入EAE的消退期,直至第28天,该日研究结束。相反,经小鼠IgG处理的小鼠在第16天疾病达到最严重程度,平均最大临床分值约为3.3±0.21(N=6)。然后,小鼠开始进入消退期。研究结束时,两组具有相同的平均临床分值。
本研究表明,与IgG处理小鼠相比,ENO1抗体处理的小鼠具有较低的最大临床分值,平均低约0.6分。这些数据表明,抗体抑制ENO1血纤维蛋白溶酶原受体活性在EAE小鼠预防模型中具有益处。
实施例10
实施例9中,结果表明给予ENO1抗体在EAE小鼠预防模型中具有益处。为了研究EN10mAb对MS的治疗效果,下一项研究使用小鼠EAE治疗模型。皮下给予28只7到10周龄的CB57/BL/6雌性小鼠100微克于完全弗氏佐剂中的MOG p35-55,然后腹膜内注射100ng的百日咳毒素。第3天,给予另一剂100ng的百日咳毒素。每天观察动物,如下评估临床症状:0,无迹象;1,尾紧张下降;2,轻度单肢轻瘫或局部麻痹;3,严重下肢轻瘫;4,下身麻痹和/或四肢瘫痪;5,垂死或死亡。直到约第10天(此时小鼠的平均临床分值约为0.5),将小鼠随机分成4组,每组7只。第11、13和15天,组1小鼠腹膜内注射5mpk EN10mAb。第11天后,组2小鼠每天喂食15mpk富马酸二甲酯两次。组3小鼠如组2小鼠处理,但在第11、13和15天腹膜內注射5mpk EN10mAb。组4是对照组,注射载剂,即每天腹膜內注射PBS。
研究结束时,获取每一组中临床分值接近平均最大临床分值的3只小鼠,给其全身灌注鲍音液(Bouin’s solution)。用10%福尔马林固定这些小鼠的大脑和脊髓,切片,并用勒克司坚牢蓝(Luxol fast blue),以及苏木精和曙红(H&E)染色。由病理学家基于Shackelford计分法(Toxicologic Pathology,卷30,第1期,pp93-96,2002)如下评估脑膜及脑实质脱髓鞘发炎性病变的组织病理学分数:1,最小;2,轻微;3,中度;4,中/严重;5,严重/重度。数据以平均值±SEM表示。采用T-检验比较各组。P值<0.05视为统计学显著。所有研究按照台湾生物技术开发中心的动物护理及使用委员会所述的规范完成。
结果显示在图10A、10B、10C和10D中。各组小鼠在第10天开始出现EAE综合症,此时平均临床分值约为0.5。第11天小鼠开始接受测试药物,分别接受5mpk的EN10mAb,15mpk的DMF(每天两次),以及EN10mAb和DMF组合的小鼠EAE综合症的发作开始出现减缓。每组小鼠的疾病在大约第27天达最严重程度。此时载剂组、5mpk EN10mAb组、15mpk DMF(每天两次)组、以及EN10mAb和DMF组合组的平均最大临床分值分别是4.1±0.34(N=7)、2.9±0.16(N=7)、2.7±0.47(N=7)和2.4±0.39(N=7)(图10A)。第32天停止研究,研究过程中,载剂组中有3只小鼠由于疾病进展而死亡。虽然5mpk EN10mAb、15mpk DMF(每天两次)、以及EN10mAb和DMF组合处理的小鼠显示治疗益处(与载剂组的平均最大临床分值相比,这三组的平均最大临床分值出现大约1.2、1.4和1.7的下降),但各组的平均最大临床分值没有统计学差异。
这些结果表明,抗体对ENO1血纤维蛋白溶酶原受体活性的抑制在小鼠EAE治疗模型中具有临床益处,3剂5mpk EN10mAb与每天2次的15mpk的DMF具有类似的疗效。EN10mAb和DMF组合治疗组具有一定的协同作用(图10A-10D)。
为了研究用EN10mAb和DMF治疗小鼠EAE疾病的益处,进一步分析这些小鼠CNS切片的病理发生率。分析的项目包括总临床组织病理学,CNS的脱髓鞘和炎症分值,被检测的组织包括大脑、小脑、骨髓、颈椎、胸椎、腰椎和骶骨。结果显示在图10B、10C和10D中。
载剂组、5mpk EN10mAb组、15mpk DMF组(每天两次)和EN10mAb和DMF组合组小鼠的平均总病理发生率分值分别为40.7±7.1(N=3)、15±4.4(N=3)、28±5.2(N=3)和13±11.7(N=3)。与载剂组每只小鼠的平均总病理发生率分值相比,EN10mAb处理组和EN10mAb和DMF组合处理组的每只小鼠的平均总病理发生率分值具有统计学差异,P值分别为0.025和0.004(图10B)。此结果表明,EN10mAb或EN10mAb和DMF组合处理的小鼠对EAE疾病的CNS具有总的病理学和病灶益处。CNS的脱髓鞘分值的比较结果显示在图10C中。载剂组、5mpk EN10mAb组、15mpk DMF组(每天两次)和EN10mAb和DMF组合组每只小鼠CNS中的平均总脱髓鞘分值分别为13±1.8(N=3)、4.3±0.7(N=3)、7±1.0(N=3)和3±2.3(N=3)。与载剂组每只小鼠CNS中的平均总脱髓鞘发生率分值相比,所有药物处理组每只小鼠CNS中的平均总脱髓鞘发生率分值具有统计学显著差异,EN10mAb组的P值为0.01,DMF组的P值为0.04,组合处理组的P值为0.04。此结果表明,本研究中,用EN10mAb或DMF或EN10mAb和DMF组合处理的小鼠在EAE疾病过程中受到药物的保护,免受CNS脱髓鞘损伤。此研究进一步得到报道了DMF对MS患者具有神经元保护效果的文献(Moharregh-Khiabani,D.等,2009,Current Neuropharmacology,7:60-64;Oh,C.J.(2012)等,PLoS ONE,7:1-10)的支持。疾病过程中3剂5mpk的EN10mAb比每日30mpk的DMF更有效。
CNS中白细胞浸润发生率分值是另一检测的参数。结果显示在图10D中。载剂组、5mpk EN10mAb组、15mpk DMF组(每天两次)和EN10mAb和DMF组合组每只小鼠CNS中的平均总炎症分值分别为10.3±1.18(N=3)、6.3±0.9(N=3)、9±1.0(N=3)和2.7±1.3(N=3)。与载剂组每只小鼠CNS中的平均总炎症分值相比,EN10mAb处理组和EN10mAb和DMF组合组每只小鼠CNS中的平均总炎症分值具有统计学差异,P值分别为0.05和0.01(图10D)。但是,在阻止炎症细胞进入患病的CNS位置方面,DMF未具有统计学效果。此结果表明EN10mAb或EN10mAb与DMF的组合能阻止白细胞浸润CNS,从而降低CNS中的病理学发生率,更重要的是缓和MS症状中CNS神经元的脱髓鞘。
实施例11
Bae的结果(Bae,S.等,2013,J.Immunology,189:365-372)显示,类风湿性关节炎(RA)患者中单核细胞表面上ENO1血纤维蛋白溶酶原受体活性的激活增加该患者PBMC中的促炎细胞因子如TNFα和ILβ,使疾病恶化。当比较Bae研究中所用抗体的表位与EN10mAb时,我们发现EN10mAb结合的表位与Bae研究所用抗体的表位不同。Bae研究所用抗人ENO1的表位位于ENO1蛋白的N末端和中间部位。但是,EN10mAb的表位位于氨基酸残基296-336。两种抗体具有不同的血纤维蛋白溶酶原受体激动剂差异。Bae研究所用抗体具有激动剂活性,其活化ENO1的血纤维蛋白溶酶原受体活性。但是,当将EN10mAb给予受刺激的人单核细胞时,EN10mAb显示拮抗剂活性。此研究支持了我们在实施例8、9和10中获得的MS结果,也支持了Presslor在肺炎模型研究中的结果,该研究中单核细胞上ENO1血纤维蛋白溶酶原受体活性的下调阻止了活化的单核细胞浸润炎症部位。两个结果表明,ENO1抗体在免疫疾病中的治疗效果是表位依赖性的,一些ENO1抗体(如Bae研究所用的那种)会导致疾病恶化。为证实我们的EN10mAb在RA中的疗效,使用胶原蛋白抗体诱导的关节炎啮齿动物模型进行研究。给6周龄Balb/c雄性小鼠静脉内注射1.5mg/小鼠的小鼠单克隆抗II型胶原蛋白。4天后,用50微克/小鼠的LPS(大肠杆菌0111B4)腹膜內处理小鼠。将小鼠分成3组,每组3只。第1、3、5、7天,每组小鼠分别用5mpk小鼠IgG、5mpk EN10mAb和6mpk恩利处理。每天观察动物,如下评估临床症状:体重(每天),足垫厚度(第1、3、7和10天),关节炎分值(第3、7和10天),病理学(第10天),和细胞因子(ELISA)。数据以平均值±SEM表示。采用ANOVA和Newman-Keuls多重比较检验比较3组或多组数据。P值<0.05被认为统计学显著。所有研究按照台湾生物技术开发中心的动物护理及使用委员会所述的规范完成。对于细胞因子分析,切开膝盖,用PBS洗涤滑液并收集。用细胞因子ELISA试剂盒分析细胞因子浓度。
结果显示在图11A中。第7天10mpk EN10mAb、6mpk恩利和载剂组的平均关节炎分值分别为10±0.54(N=3)、12±0.8(N=3)和12±0.3(N=3)。EN10mAb处理的小鼠的平均关节炎分值与载剂组具有统计学差异,P值为0.0001。第10天,10mpk EN10mAb、6mpk恩利和载剂组的平均关节炎分值分别为8.9±0.53(N=3)、7.2±0.8(N=3)和11.7±0.3(N=3)。EN10mAb和6mpk恩利处理的小鼠的平均关节炎分值与载剂组具有统计学差异,P值小于0.0001(图11A)。此研究的结果表明,用EN10mAb削弱ENO1血纤维蛋白溶酶原受体活性能减少CAIA啮齿动物模型中RA的症状。当分析CAIA小鼠滑液中的IL1b和MMP9细胞因子时,EN10mAb处理组、恩利处理组和载剂组的平均MMP9浓度为62.5±5、34±9.4和92.5±11.25ng/ml(N=3)。对于IL1b细胞因子,EN10mAb处理组、恩利处理组和载剂组的平均浓度分别为91±15.8、68.9±31和115.6±20pg/ml(N=3)。两种细胞因子在EN10mAb处理组和恩利处理组中都下调。基于图11A、11B和11C的结果,可得出以下结论:在两种情况中,3剂10mpk EN10mAb和恩利在减少RA症状方面具有疗效。
实施例12
实施例9、10和11的结果表明,用ENO1拮抗剂抗体削弱ENO1活性能减轻小鼠EAE和CAIA模型中MS和类风湿性关节炎的症状。
我们推测小鼠ENO1的类似表位对类似的小鼠自身免疫疾病也有效。订购10mg小鼠ENO1蛋白,由金斯瑞有限公司(Genescript Inc.,皮斯卡塔市,新泽西州,美国)产生大鼠抗小鼠ENO1抗体。为了筛选分泌大鼠抗小鼠ENO1抗体的杂交瘤,用400ng的小鼠ENO1蛋白包被96孔ELISA板,进一步用PBS洗涤该板。将从各杂交瘤上清获得的系列稀释液加到该板中,37℃孵育该板1小时。加入偶联有次黄嘌呤磷酸核糖转移酶(HPRT)的山羊抗大鼠IgG。1小时后加入3,3′,5,5′-四甲基对二氨基联苯(TMB),读取OD405。30000个杂交瘤中,将75个具有显著的小鼠ENO1结合亲和力的阳性克隆进行EN10mAb竞争性实验(图12A)。用小鼠ENO1蛋白包被ELISA平板,将其用于结合各阳性杂交瘤克隆的上清(约100微升)。PBS洗涤平板两次后,将100ng的EN10mAb加到该平板中,37℃孵育该平板1小时。加入偶联有次黄嘌呤磷酸核糖转移酶(HPRT)的山羊抗大鼠IgG。1小时后加入3,3′,5,5′-四甲基对二氨基联苯(TMB),读取OD405。结果显示在图12B中。75个杂交瘤上清中,仅5个上清在EN10mAb竞争下具有小鼠ENO1结合活性。此结果表明这5种大鼠抗小鼠ENO1抗体在小鼠ENO1中的表位可能与人ENO1中EN10mAb的表位类似。
实施例13
为评估5种抗小鼠ENO1抗体针对小鼠ENO1的结合亲和力,使杂交瘤在25ml的SFM培养基(吉科有限公司,Gibco Inc)中生长。培养1周后,收集每一种上清。采用40%硫酸铵和蛋白A柱(Montage抗体纯化试剂盒,密理博公司)进一步纯化抗体。根据制造商(密理博公司)提供的方案,用Amicon Ultra-15离心过滤装置浓缩纯化的抗体。
用400ng的小鼠ENO1蛋白包被96孔ELISA板,进一步用PBS洗涤该平板。将每一种抗体从1×10-12到1×10-8M系列稀释的溶液加到该平板中,37℃孵育该平板1小时。加入偶联有次黄嘌呤磷酸核糖转移酶(HPRT)的山羊抗大鼠IgG。1小时后加入3,3′,5,5′-四甲基对二氨基联苯(TMB),读取OD405。每个研究重复3次。数据以平均值±SD表示。使用Sigmaplot将OD读数和抗体浓度制作多重分散曲线。由四个参数的逻辑拟合预测Kd值。
此实验的结果显示在图13中。每一种抗体的Kd值从3.90±0.66x10-10M(N=3)到3.39±1.89X10-8M(N=3)。由于克隆12D9的产率低,选用7E5进行进一步的研究。
实施例14
实施例9和10的结果表明给予ENO1抗体赋予EAE小鼠预防和治疗模型临床益处。为研究7E5对MS是否具有类似于EN10mAb的治疗效果,接下来的研究中使用小鼠EAE治疗模型。给18只7到10周龄的雌性CB57/BL/6小鼠皮下提供100微克于完全弗氏佐剂中的MOG p35-55,然后腹膜内注射100ng的百日咳毒素。第3天,给予另一剂100ng的百日咳毒素。每天观察动物,如下评估临床症状:0,无迹象;1,尾紧张下降;2,轻度单肢轻瘫或局部麻痹;3,严重下肢轻瘫;4,下身麻痹和/或四肢瘫痪;5,垂死或死亡。直到约第10天(此时小鼠的平均临床分值约为0.5),将小鼠随机分成3组,每组6只。第11、13和15天,组1小鼠皮下注射5mpk 7E5mAb。组2小鼠皮下注射20000单位的干扰素β-1b(Betaferon)。组3为对照组,皮下注射PBS载剂。
研究结束时,获取每一组中临床分值接近平均最大临床分值的3只小鼠,给其全身灌注鲍音液(Bouin’s solution)。用10%福尔马林固定这些小鼠的大脑和脊髓,切片,并用勒克司坚牢蓝(Luxol fast blue),以及苏木精和曙红(H&E)染色。由病理学家基于Shackelford计分法(Toxicologic Pathology,卷30,第1期,第93-96页,2002)如下评估脑膜及脑实质脱髓鞘发炎性病变的组织病理学分数:1,最小;2,轻微;3,中度;4,中/严重;5,严重/重度。数据以平均值±SEM表示。采用T-检验比较各组。P值<0.05视为统计学显著。所有研究按照台湾生物技术开发中心的动物护理及使用委员会所述的规范完成。
结果显示在图14A、14B、14C和14D中。各组小鼠在第10天开始出现EAE综合症,此时平均临床分值约为0.5。第11天小鼠开始接受测试药物,分别接受5mpk的7E5mAb和20000单位干扰素β-1b的小鼠EAE综合症的发作开始出现减缓。每组小鼠的疾病在大约第27天达最严重程度。此时载剂组、5mpk 7E5mAb组和20000单位干扰素β-1b组的平均最大临床分值分别是2.6±0.9(N=6)、1.6±0.5(N=6)和2.1±0.4(N=6)(图14A)。虽然7E5mAb和20000单位干扰素β-1b处理的小鼠显示治疗益处(与载剂组的平均最大临床分值相比,这两组的平均最大临床分值分别出现大约1.0和0.5的下降),但各组的平均最大临床分值没有统计学差异。这些结果表明,与在小鼠EAE治疗模型中显示的临床益处的EN10mAb类似,7E5抗体也能抑制ENO1血纤维蛋白溶酶原受体活性,虽然它们结合具有类似表位但来自不同物种的ENO1。
为了研究7E5mAb和干扰素β-1b治疗小鼠EAE疾病的益处,进一步分析这些小鼠CNS切片的病理发生率。分析的项目包括总临床组织病理学,CNS的脱髓鞘和炎症分值,被检测的组织包括大脑、小脑、骨髓、颈椎、胸椎、腰椎和骶骨。结果显示在图14B、14C和14D中。
载剂组、5mpk 7E5mAb组和20000单位干扰素β-1b组小鼠的平均总病理发生率分值分别为40.7±6.8(N=3)、14.7±9.(N=3)和41.8±3.4(N=3)。与载剂组每只小鼠的平均总病理发生率分值相比,7E5mAb处理组每只小鼠的平均总病理发生率分值具有统计学差异,P值为0.025(图14B)。此结果表明,7E5mAb处理的小鼠对EAE疾病的CNS具有总的病理学和病灶益处。CNS的脱髓鞘分值的比较结果显示在图14C中。载剂组、5mpk 7E5mAb组和20000单位干扰素β-1b组每只小鼠CNS中的平均总脱髓鞘分值分别为12.2±0.8(N=3)、5.1±1.4(N=3)和9.1±1.1(N=3)。与载剂组每只小鼠CNS中的平均总脱髓鞘发生率分值相比,7E5mAb组每只小鼠CNS中的平均总脱髓鞘发生率分值具有统计学显著差异,P值为0.01。此结果表明,本研究中,用7E5mAb处理的小鼠在EAE疾病过程中受到测试药物的保护,免受CNS脱髓鞘损伤。
CNS中白细胞浸润发生率分值是另一检测的参数。结果显示在图14D中。载剂组、5mpk 7E5mAb组和20000单位干扰素β-1b组每只小鼠CNS中的平均总炎症分值分别为10.±1.9(N=3)、4.6±2.7(N=3)和9.2±2.6(N=3)。与载剂组每只小鼠CNS中的平均总炎症分值相比,7E5mAb处理组每只小鼠CNS中的平均总炎症分值具有统计学差异,P值为0.05(图14D)。但是,在阻止炎症细胞进入患病的CNS位置方面,干扰素β-1b看起来不具有统计学效果。此结果表明,与EN10mAb相同,7E5mAb能阻止白细胞浸润CNS,从而降低CNS中的病理学发生率,更重要的是缓和MS症状中CNS神经元的脱髓鞘。我们的结果表明,人ENO1氨基酸296-336(SEQ ID NO:39)肽区域(该区域包括FDQDDWGA WQKFTA(SEQ ID NO:40)和KRIAKAVNEKS(SEQ ID NO:41)的肽序列)对抗体抑制血纤维蛋白溶酶原受体活性并作为治疗免疫性单核细胞相关的免疫疾病的治疗剂起非常重要的作用,即使在小鼠中MOA也是有效的。
实施例9、10、11和14的结果表明,不论何种物种,用ENO1抗体抑制ENO1血纤维蛋白溶酶原受体活性可降低血纤维蛋白溶酶原活化,抑制UPAS级联反应,减少胞外基质活性的降解。结果,炎性单核细胞向受损病患细胞的浸润被抑制,且这种抑制减轻了CAIA模型中的RA、EAE中的MS以及NII的炎症症状。因此,可靶向活化细胞(如单核细胞)表面上的ENO1血纤维蛋白溶酶原受体,以治疗炎性疾病;抗人ENO1氨基酸296-336(SEQ ID NO:39)的肽区域(该区域包括FDQDDWGA WQKFTA(SEQ ID NO:40)和KRIAKAVNEKS(SEQ ID NO:41)的肽序列)的ENO1抗体可用作免疫疾病患者的治疗药物。
虽然已结合一定数量的实施例描述了本发明,本领域技术人员在阅读了本公开的内容之后将理解,在不偏离本文所公开的本发明范围的情况下可设计其它实施方案。因此,本发明的范围应仅由所附权利要求书限定。
- 还没有人留言评论。精彩留言会获得点赞!