GPR45基因的用途的制作方法
本发明涉及生物
技术领域:
,更具体地涉及GPR45基因的用途。
背景技术:
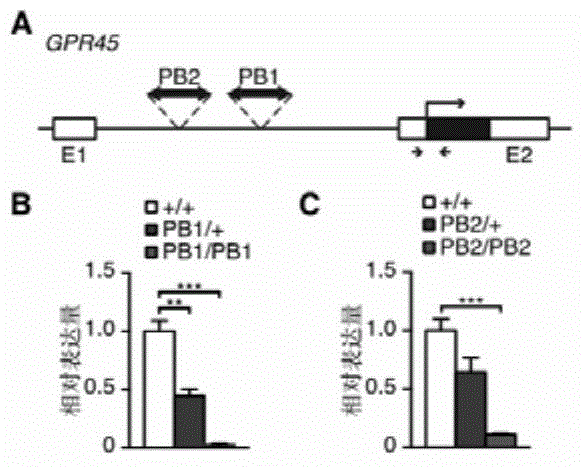
:肥胖可以导致2型糖尿病、脂肪肝、高血压、冠心病以及多种肿瘤,危害健康与生活质量。儿童和青少年肥胖还可能影响青春期发育和性成熟。据世界卫生组织统计,全球有35%的成人超重(BMI≥25),超过10%的成人肥胖(BMI≥30),每年有至少2,800万人死于肥胖或超重。随着生活方式的改变,我国肥胖和超重人口增长迅速,按世界卫生组织标准测算,我国2013年有约28%的成人超重,4~5%的成人肥胖,肥胖人口总数已位列世界第二。按现有趋势预计,我国2030年肥胖人口比例可达12.6%。肥胖的根本原因在于个体能量代谢失衡。遗传因素对肥胖的贡献度可达65%,但已知肥胖相关基因的变异只能解释一小部分病例,新的肥胖相关基因仍有待发现。由于对肥胖发生发展的生物学知识了解有限,目前仍缺乏普遍有效的肥胖干预方法。饮食和行为校正往往难以持久,不同个体效果差异显著。赛尼克、Lorcaserin和Qsymia等药物对胃肠道、心血管系统有副作用,效果有限。因此,肥胖发生后往往迁延终身,给个人、家庭和社会带来持续危害。疾病动物模型可以为了解疾病发生发展机制,发展疾病预防和干预方法提供巨大帮助。作为哺乳动物,小鼠遗传操作和表型分析技术最为成熟,在各种疾病动物模型培育研究中占主导地位。但长期以来,肥胖小鼠模型的选择极为有限。饮食诱导模型能较好地模拟环境对肥胖的影响,但诱导产生的肥胖与小鼠的品系背景和饲料中脂肪与碳水化合物的组成与来源密切相关,保证不同实验室工作的重复性有一定困难。与饮食诱导模型相比,自发突变、转基因或基因诱变等遗传学动物模型的表型稳定性更高,对研究疾病机理和干预方法的价值更大。常用的小鼠遗传学肥胖模型包括瘦素或其受体突变ob和db小鼠、agouti基因突变Ay小鼠和MC4R基因剔除小鼠等。ob和db小鼠哺乳期结束后即逐渐肥胖,进而发生胰岛素抵抗和脂肪肝,但不同遗传背景肥胖程度不一。同时,具有瘦素或其受体突变的肥胖患者比例非常低,瘦素信号的缺失也使这两种小鼠难以用于相关信号通路干预研究。Ay和MC4R基因剔除小鼠存在过度进食,但肥胖发生晚于ob和db小鼠,体重增加也较少。MC4R突变在北欧肥胖患者高达6%,但罕见于亚洲和地中海人群。MC4R突变小鼠肥胖的同时体长明显增加,且胰岛素抵抗等肥胖相关表型随不同小鼠品系遗传背景变化较大。Ay小鼠脑内表达具有MC4R拮抗剂功能的突变agouti蛋白。它具有与MC4R突变小鼠类似的肥胖相关表型,但容易发生肿瘤而干扰相关研究。因此,培育发现新的肥胖动物模型一直是肥胖生物学、疾病机理与干预研究的迫切需要。技术实现要素:为了克服现有技术中所存在的问题,本发明的目的在于提供GPR45基因的新用途,并将GPR45基因用于构建肥胖动物模型。为了实现上述目的及其他相关目的,本发明采用如下技术方案:本发明的第一方面,提供了GPR45基因在构建肥胖动物模型中的用途。优选地,所述动物为哺乳动物。更优选地,所述哺乳动物为鼠。更优选为小鼠。将分离的GPR45基因用于构建肥胖动物模型,具体是指通过敲除动物体内GPR45基因,或抑制GPR45基因的表达,来构建肥胖动物模型。将分离的GPR45基因用于构建肥胖动物模型,具体是指通过敲除动物体内GPR45基因,或抑制GPR45基因的表达,进而抑制POMC基因表达,来构建肥胖动物模型。本发明的一个优选例中,通过PB转座子插入诱变抑制GPR45基因的表达。更具体的,通过PB[Act-RFP]转座子插入诱变抑制GPR45基因的表达。优选地,所述肥胖动物模型还可进一步发展成为脂肪肝动物模型或糖尿病动物模型。本发明的第二方面,提供了一种构建肥胖动物模型的方法,包括如下步骤:敲除动物体内GPR45基因,或抑制动物体内GPR45基因的表达,获得肥胖动物模型。优选地,所述动物为哺乳动物。更优选地,所述哺乳动物为鼠。更优选为小鼠。可以采用现有的基因编辑方法敲除所述GPR45基因或抑制GPR45基因的表达。例如可以通过在GPR45基因序列中插入转座子或病毒等外源DNA片段、或ENU等化学诱变方法、或X射线等物理诱变方法、或基于胚胎干细胞或CRISPR/Cas9技术的基因打靶等方法介导的基因操作来实现GPR45基因敲除、或降低GPR45基因表达。在本发明的实施例中,通过PB转座子插入诱变抑制动物体内GPR45基因的表达。具体地,通过PB[Act-RFP]转座子插入诱变抑制动物体内GPR45基因的表达。更具体地是,将带有单拷贝的由PB转座子引起的PB[Act-RFP]插入的动物品系与带有PB转座酶Act-PBase的转基因动物品系作为亲代进行交配,然后在子一代动物中用反向PCR鉴定PB插入位点,鉴定筛选出在GPR45基因内含子插入了PB转座子的动物品系,即可获得肥胖动物模型。优选地,PB转座子插入GPR45基因的第二个外显子上游34,038bps处或插入GPR45基因的第二个外显子上游54,466bps处。在本发明的另外一个实施例中,采用RNA干扰的手段来抑制GPR45基因的表达。还可采用现有技术中的其他方法实现GPR45基因的基因敲除或基因表达抑制,并不限于实施例所列举的方式。进一步地,所述肥胖动物模型还可进一步发展成为脂肪肝动物模型或糖尿病动物模型。本发明的第三方面,提供了一种肥胖动物模型,由上述方法构建获得。优选地,所述动物为哺乳动物。更优选地,所述哺乳动物为鼠。更优选为小鼠。优选地,所述肥胖动物模型还可进一步发展成为脂肪肝动物模型或糖尿病动物模型。本发明的第四方面,提供了上述肥胖动物模型在筛选减肥药物中的用途。本发明的第五方面,提供了一种筛选减肥候选药物的方法,所述方法包括以下步骤:将测试候选药物施用于由前述方法构建的肥胖动物模型,并与未施用测试候选药物的肥胖动物模型进行比较,其中施用后导致肥胖症状改善或治愈的测试化合物就是减肥药物的候选药物。上述筛选出的候选药物可构成一个筛选库,可对这些物质进行进一步的细胞实验、动物实验、和/或临床试验,以进一步确证所述潜在物质的减肥作用。由于本发明采用抑制GPR45基因表达进行诱导,所构建的模型更类似于人类的发病过程,因而在药物的筛选上比以往的模型更为精准,效率更高。本发明的第六方面,提供了GPR45基因作为作用靶标在筛选肥胖治疗药物或制剂中的用途。优选地,所述用途具体是指:将GPR45基因作为药物或制剂的作用靶标(或作用对象),对药物或制剂进行筛选以找到能够促进或提高GPR45基因表达的物质作为肥胖治疗药物或制剂。所述肥胖治疗药物或制剂为能够特异性促进或提高GPR45基因的转录或翻译,或能够特异性促进或提高GPR45蛋白的表达或活性的分子,从而提高GPR45基因的表达水平,达到治疗肥胖的目的。所述通过GPR45基因作为作用靶标筛选获得的候选肥胖治疗药物或制剂包括但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或病毒。所述肥胖治疗药物或制剂的施用量为足够促进或提高GPR45基因的转录或翻译,或者足够促进或提高GPR45蛋白的表达或活性的剂量。以使GPR45基因的表达至少被提高50%、80%、90%、95%或99%。采用前述肥胖治疗药物或制剂治疗肥胖的方法,主要是通过以GPR45基因作为作用靶标促进或提高GPR45基因的表达水平来达到治疗肥胖的目的。具体的,治疗时,将能有效促进或提高GPR45基因表达水平的物质给药于患者。本发明的第七方面,提供了一种筛选候选肥胖治疗药物或制剂的方法,包括步骤:(1)将待测物质加入表达GPR45基因的体系中;(2)检测所述体系中GPR45基因的转录或表达水平,其中,与未加入待测物质的实验相比,若所述待测物质能够促进或提高GPR45基因的转录或表达,则表明该候选药物可作为候选肥胖治疗药物或制剂。与现有技术相比,本发明的有益效果在于:本发明首次揭示了GPR45与肥胖的相关性,敲除GPR45基因或抑制GPR45基因的表达能够导致肥胖。并首次采用抑制GPR45基因的表达的方法成功构建了小鼠肥胖模型,更类似于人类的发病过程,是肥胖基础和临床应用研究的理想模型,从而可良好地应用于筛选治疗肥胖的药物。此外,所述肥胖动物模型还可进一步发展成为脂肪肝动物模型或糖尿病动物模型。附图说明图1:PB插入导致GPR45表达量下降;其中,(A)为PB转座子在GPR45突变小鼠中的插入示意图:GPR45的编码框用黑色方框表示,两个相对箭头表示用于定量PCR的引物位置,折线箭头指示转录方向,两个PB插入(PB1和PB2)均位于第二外显子(E2)上游;(B)和(C)分别为突变品系1(PB1)和突变品系2(PB2)5日龄GPR45突变全脑定量PCR显示纯合突变小鼠基因表达显著下降,每组中,从左自右,分别代表野生型(+/+)、杂合子(PB1/+或PB2/+)、纯合子(PB1/PB1或PB2/PB2);每组小鼠只数均≥3,选用同窝野生型小鼠对照,GAPDH为内参,**p<0.01;***p<0.001。图2:GPR45PB1突变导致体重增加,其中,(A)从左至右,分别代表1岁雌性纯合子GPR45PB1小鼠(PB1/PB1)、同窝杂合子小鼠(PB1/+)和同窝野生型小鼠(+/+);(B)GPR45PB1小鼠5周龄到11周龄体重的生长曲线,纯合子体重从6周龄开始显著增加,每组中,从上至下,第一条曲线代表野生型(+/+),第三条曲线代表杂合子(PB1/+),第二条曲线代表纯合子(PB1/PB1);每组小鼠只数均≥10,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图3:GPR45PB1突变导致体脂增加,其中,(A)表示小鼠5周龄和12周龄的脂肪肌肉比,5周龄和12周龄纯合子的脂肪肌肉比均显著增加,每组中,从左至右,第一条柱线代表野生型(+/+),第二条柱线代表杂合子(PB1/+),第三条柱线纯合子(PB1/PB1),每组小鼠只数均≥10,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001;(B)小鼠6月龄性腺旁脂肪(gWAT)、腹膜后脂肪(rWAT)和肩胛骨间褐色脂肪(BAT)重量,纯合子的gWAT、rWAT和BAT重量均显著增加,每组中,从左至右,第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥3,选用同窝野生型小鼠做对照,***p<0.001。图4:GPR45PB1突变导致脂肪肝,其中,(A)表示小鼠6月龄肝脏重量,可见6月龄纯合子的肝脏重量显著增加,每组中,自左至右,第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥3,选用同窝野生型小鼠做对照,*p<0.05;(B)为小鼠6月龄肝组织切片油红染色,纯合子肝脏中出现较多脂肪累积(红色脂滴),图中标尺=0.05mm。图5:GPR45PB1突变导致血浆高瘦素和高胰岛素;其中,(A)为12周龄小鼠禁食后血浆瘦素的含量,(B)为12周龄小鼠禁食后血浆胰岛素的含量,每组中,从左自右,第一条柱线是野生型,第二条柱线是指杂合子(PB1/+),第三条柱线是指纯合子(PB1/PB1);12周龄纯合子血浆瘦素和血浆胰岛素含量显著升高;每组小鼠只数均≥6,选用同窝野生型小鼠做对照,**p<0.01;***p<0.001。图6:GPR45PB1突变导致糖代谢紊乱,其中,(A)为12周龄禁食GPR45PB1小鼠葡萄糖耐受实验,纯合子表现为严重的葡萄糖不耐受;(B)为15周龄自由进食GPR45PB1小鼠胰岛素耐受实验,纯合子表现为胰岛素不敏感;每组小鼠只数均≥6,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图7:GPR45PB2突变同样导致肥胖和糖代谢紊乱,其中,(A)为12周龄GPR45PB2小鼠的体重和脂肪肌肉比,纯合子表现为超重和肥胖,(A)中,每一组,从左至右,第一条柱线表示野生型(+/+),第二条柱线表示杂合子(PB2/+),第三条柱线表示纯合子(PB2/PB2);(B)为12周龄禁食GPR45PB2小鼠葡萄糖耐受实验,纯合子表现为严重的葡萄糖不耐受,每组小鼠只数均≥6,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图8:PB1精确切离抑制肥胖和糖代谢紊乱的发生,(A)12周龄回复突变小鼠(Rev/Rev)的体重和脂肪肌肉比,回复突变小鼠肥胖程度减轻,每一组中,从左至右,第一条柱线代表纯合子(PB1/PB1),第二条柱线代表回复突变品系(Rev/Rev);(B)12周龄禁食回复突变小鼠葡萄糖耐受实验,回复突变小鼠表现为改善的葡萄糖耐受能力,每组小鼠只数均≥6,选用同窝PB1未被切离的纯合子做对照,*p<0.05;**p<0.01;***p<0.001。图9:GPR45PB1/PB1肥胖发生于断奶前,为10日龄到28日龄脂肪肌肉比生长曲线,纯合子雌鼠20日龄即发生肥胖,雄鼠18日龄即发生肥胖,每组小鼠只数均≥6,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图10:GPR45PB1/PB1肥胖发生后血浆瘦素浓度升高,(A)2周龄GPR45PB1/PB1血浆瘦素浓度无异常;(B)4周龄GPR45PB1/PB1小鼠血浆瘦素浓度即升高,从左至右,第一条柱线表示野生型(+/+);第二条柱线表示杂合子(PB1/+);第三条柱线表示纯合子(PB1/PB1);每组小鼠只数均≥6,选用同窝野生型小鼠做对照,*p<0.05;***p<0.001。图11:GPR45PB1/PB1肥胖早于脂肪肝和糖尿病的发生,其中,(A)为4周龄小鼠肝脏组织切片油红O染色,4周龄突变体无脂肪肝表型,图中标尺=0.05mm;(B)为4周龄GPR45PB1/PB1血浆胰岛素浓度无异常;(C)9周龄GPR45PB1/PB1小鼠空腹血糖无异常;从左自右,第一条柱线代表野生型(+/+),第二条柱线代表杂合子(PB1/+),第三条柱线代表纯合子(PB1/PB1);每组小鼠只数均≥3,选用同窝野生型小鼠做对照。图12:GPR45PB1/PB1能量摄入无异常,其中,(A)ANCOVA分析21-33日龄小鼠的每日进食量,比较雌性突变体小鼠和野生型小鼠体重均为12.58g时的进食量无异常,比较雄性突变体小鼠和野生型小鼠体重均为15.85g时的进食量也无异常;(B)21日龄小鼠的粪便燃烧值无异常,每一组中,从左至右第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥3,选用同窝野生型小鼠做对照。图13:GPR45PB1/PB1能量消耗下降,(A)ANCOVA分析21-33日龄小鼠的每日总能耗(EE),比较雌性突变体小鼠和野生型小鼠肌肉重量均为9.76g时,或比较雄性突变体小鼠和野生型小鼠体重均为10.155g时,突变体总能耗显著下降;(B)21-33日龄小鼠呼吸熵(RQ)无异常,每一组中,从左至右第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥10,选用同窝野生型小鼠做对照。***p<0.001。图14:GPR45PB1/PB1肥胖后体温下降,3周龄和11周龄小鼠直肠温度,3周龄突变体小鼠体温无异常,11周龄体温明显下降;每组自左至右,第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥3,选用同窝野生型小鼠做对照。*p<0.05。图15:GPR45PB1/PB1活动能力下降,(A)3周龄小鼠运动总路程和睡眠时间,(B)7-9周龄小鼠运动总路程和睡眠时间,3周龄和7-9周龄突变体小鼠运动总路程显著缩短,睡眠时间显著增长,每组自左至右,第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组小鼠只数均≥3,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图16:GPR45PB1/PB1适应性产热减少,2周龄小鼠暴露于4℃低温2小时体温下降曲线,突变体小鼠暴露于4℃低温体温下降迅速;由上自下,上面一条曲线代表野生型(+/+),下面一条曲线代表纯合子(PB1/PB1),每组小鼠只数均≥5,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图17:GPR45表达于中枢神经系统,1月龄小鼠各组织RT-PCR结果;GPR45表达于神经系统和睾丸,在其它外周器官中未检测到GPR45的表达。图18:GPR45表达于下丘脑区域,GPR45抗体免疫荧光染色检测GPR45在14日龄小鼠下丘脑区域的表达,GPR45主要表达于野生型小鼠(+/+)下丘脑的视交叉上核(suprachiasmatic,SCN)、下丘脑背内侧核(DMN),下丘脑腹内侧核(VMN)和弓形核(ARC)中,纯合子(PB1/PB1)中未检测到明显GPR45信号表达,图中标尺=0.2mm。图19:GPR45突变导致POMC表达下调,(A)14周龄小鼠下丘脑神经肽的表达量,RT-PCR结果显示纯合子下丘脑中POMC表达量下降;(B)14周龄小鼠下丘脑中POMC蛋白水平的表达量,WB结果显示纯合子下丘脑中POMC蛋白水平表达量下降;每一组第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1);每组小鼠只数均≥3,选用同窝野生型小鼠做对照,GAPDH作为内参,*p<0.05;**p<0.01。图20:POMC神经元中表达GPR45,14周龄野生型小鼠脑片POMC和GPR45抗体免疫荧光染色,GPR45(绿色)表达于下丘脑背内侧核(DMN),下丘脑腹内侧核(VMN)和弓形核(ARC)中,POMC(红色)表达于ARC中;在弓形核中,约有80%的POMC神经元表达GPR45;下行为上方框内区域放大,细胞核被DAPI(蓝色)着色,图中比例尺=0.05mm。图21:抑制GPR45表达导致POMC表达下调,(A)胎鼠下丘脑原代培养细胞中POMC的表达量,RT-PCR结果显示纯合子胎鼠下丘脑原代培养细胞中POMC表达量下降;从左自右,第一条柱线代表野生型(+/+),第二条柱线代表纯合子(PB1/PB1),每组样品数均≥3,选用同窝野生型胎鼠下丘脑原代培养细胞做对照,GAPDH作为内参,***p<0.001;(B)用RNA干扰技术敲低野生型胎鼠下丘脑原代培养细胞中GPR45的表达,RT-PCR结果显示野生型胎鼠下丘脑原代培养细胞中敲低GPR45的表达,POMC表达量下降,阴性对照(Scramble):白色柱线;GPR45RNA干扰实验组(GPR45RNAi):灰色柱线,每组样品数均≥5,选用GAPDH作为内参,***p<0.001。图22:GPR45突变小鼠第三脑室注射MTII抑制肥胖,(A)成年雄性GPR45纯合小鼠第三脑室注射MTII六天体重下降;(B)成年雄性GPR45纯合小鼠第三脑室注射MTII脂肪含量下降;每一组中,从左自右,第一条柱线代表野生型(+/+)注射生理盐水对照组,第二条柱线代表野生型(+/+)注射MTII实验组,第三条柱线代表纯合子(PB1/PB1)注射生理盐水对照组,第四条柱线代表纯合子(PB1/PB1)注射MTII实验组,每组小鼠只数均≥5,选用同窝野生型小鼠做对照,*p<0.05;**p<0.01;***p<0.001。图23:党参能够降低肥胖小鼠体脂。图24:将抗原稀释到0.5ng仍能被抗血清检测到,且2号豚鼠的免疫信号更强,充分说明,所制备的多克隆抗体具有极高的灵敏度。图25:将抗原稀释到0.5ng仍能被抗血清检测到,且2号豚鼠的免疫信号更强,充分说明,所制备的多克隆抗体具有极高的灵敏度。图26:神经元表达GPR45抑制肥胖,(A)5日龄NSE::GPR45转基因小鼠下丘脑GPR45的表达量,RT-PCR结果显示转基因小鼠下丘脑GPR45的表达量上调;(B)21日龄NSE::GPR45转基因小鼠的体重无异常;(C)21日龄NSE::GPR45转基因小鼠的脂肪肌肉比显著性下降;每组中,从左自由,第一条柱线代表野生型(+/+),第二条柱线代表转基因(NSE::GPR45),每组小鼠只数均≥3,选用同窝野生型小鼠做对照,*p<0.05,**p<0.01;***p<0.001。具体实施方式本发明的发明人经过广泛而深入的研究发现,在GPR45基因(GeneID:93690)突变小鼠具有肥胖、脂肪肝、糖尿病的表型。阻断GPR45的表达导致POMC表达量下降和能量代谢下降,并引起小鼠肥胖。在第三脑室中注射POMC剪切产物的类似物MTII可以有效地抑制GPR45突变导致的肥胖。以上结果表明GPR45在调控能量代谢中具有重要作用。在此基础上完成了本发明。以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECμLARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECμLARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECμLARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。实施例1GPR45失活突变小鼠的培育GPR45失活突变小鼠可以通过在GPR45基因序列中插入转座子或病毒等外源DNA片段、或ENU等化学诱变方法、或X射线等物理诱变方法、或基于胚胎干细胞或CRISPR/Cas9技术的基因打靶等方法改变基因序列、或降低基因表达获得。在本例中,研究思路为:首先使转座子整合入基因组并造成相应的基因突变体,再从中筛选出具有某种特异表型的个体,进一步通过反式PCR技术检测转座子的插入位点,从而研究被突变基因的功能。我们先将带有单拷贝的由PB转座子引起的PB[Act-RFP]插入的小鼠品系与带有PB转座酶Act-PBase的转基因小鼠品系作为亲代进行交配,诱导PB在生殖细胞里转座,然后在子一代小鼠中用反向PCR鉴定PB插入位点,鉴定得到了两个在GPR45基因内含子插入了PB转座子的突变品系。具体的,带有单拷贝的由PB转座子引起的PB[Act-RFP]插入的小鼠品系的构建方法,如下:PB[Act-RFP]的构建方法为:用mRFP的编码序列(Amonomericredfluorescentprotein.CampbellRE,TourO,PalmerAE,SteinbachPA,BairdGS,ZachariasDA,TsienRY.ProcNatlAcadSciUSA.2002Jun11;99(12):7877-82.)代替真核载体pCX-EGFP的0.7kb的EcoRI片段,从而得到pCX-RFP。然后将含有完整的RFP表达原件的SaII-BamHI片段从pCX-RFP上克隆到pBac-AB的BglII位点上,从而得到PB[Act-RFP]。带有单拷贝的由PB转座子引起的PB[Act-RFP]插入的小鼠品系的构建方法详见:EfficienttranspositionofthepiggyBac(PB)transposoninmammaliancellsandmice.DingS,WuX*,LiG,HanM,ZhuangY,XuT*.Cell.2005Aug12;122(3):473-83。带有PB转座酶Act-PBase的转基因小鼠品系的构建方法,如下:(1)Act-PBase的构建方法详见:EfficienttranspositionofthepiggyBac(PB)transposoninmammaliancellsandmice.DingS,WuX*,LiG,HanM,ZhuangY,XuT*.Cell.2005Aug12;122(3):473-83。(2)带有PB转座酶Act-PBase的转基因小鼠品系的构建方法详见:GenerationofgeneticallyengineeredmicebythepiggyBactransposonsystem.DingS,XuT,andWuX.InMouseGenetics:MethodsandProtcols.SinghRSandCoppolaVeds.ISBN978-1-4939-1214-8.Springer.2014。带有单拷贝的由PB转座子引起的PB[Act-RFP]插入的小鼠品系与带有PB转座酶Act-PBase的转基因小鼠品系作为亲代进行交配得到的子一代小鼠,剪鼠尾抽基因组DNA,利用反向PCR鉴定PB插入位点。具体方法如下:剪取小鼠尾巴放入500ul组织裂解液(100mMNaCl,100mMTris,25mMEDTA,0.5%SDS,125ug/ml蛋白酶K,pH8.0),55℃烘箱消化过夜;加入500ul酚/氯仿/异戊醇(25:24:1),剧烈震荡,混匀,4℃,3000rpm离心15min;取上清,加入等体积的氯仿/异戊醇(24:1),剧烈震荡,混匀,13000rpm离心15min;取上清,加入两倍体积无水乙醇沉淀,上下颠倒,室温13000rpm离心30秒;弃上清,加500ul75%乙醇,室温13000rpm离心5min;弃上清,室温干燥;加入100ul双蒸水,55℃溶解1小时以上;用NEB公司的HaeIII酶切基因组DNA,37℃,6小时,电泳检测DNA酶切完全后80℃,20min热失活HaeIII。酶切体系:酶切片段用Takara公司的T4连接酶,16℃自连过夜。连接体系:加40ul3MNaAc和1ml无水乙醇,混匀,-20℃静置2小时,4℃,13000rpm离心15min;弃上清,加200ul75%乙醇,室温13000rpm离心5min;弃上清,室温干燥;加入150ul双蒸水,37℃溶解1小时以上;进行PCR分析。用来获取PB转座子左侧末端的邻接基因组序列的引物为:LF1(5’-CTTGACCTTGCCACAGAGGACTATTAGAGG-3’)(SEQIDNO.1)LR1(5’-CAGTGACACTTACCGCATTGACAAGCACGC-3’)(SEQIDNO.2)用来获取PB转座子右侧末端(PBR)的邻接基因组序列的引物为:RF1(5’-CCTCGATATACAGACCGATAAAACACATGC-3’)(SEQIDNO.3)RR1(5’-AGTCAGTCAGAAACAACTTTGGCACATATC-3’)(SEQIDNO.4)PCR反应体系:反应条件:93℃90秒;(93℃30秒,57℃30秒,65℃3分钟)X40个循环;65℃10分钟。[注:10×GTbuffer配方:166mM(NH4)2SO4,670mMTris(pH6.8),67mMMgCl2,67uMEDTA,50mMβ-巯基乙醇,抽滤灭菌]切胶回收PCR产物,用天根公司的胶回收试剂盒纯化PCR产物,并用将PCR产物克隆到pGEM-T载体(Promega)后进行测序。测序结果用美国国家生物技术信息中心(NCBI)(www.ncbi.nlm.nih.gov)或欧洲生物信息学研究所基因组浏览器Ensembl(www.ensembl.org)中的小鼠的基因组数据库进行BLAST比对分析。GPR45基因由两个外显子组成,编码框位于该基因的第二个外显子中。我们获得的两个突变品系都在GPR45内含子里携带了PB[Act-RFP](DingS,etal,Cell122:473,2005)插入,突变品系一(称之为PB1)的PB被定位在GPR45基因的第二个外显子上游34,038bps,突变品系二(称之为PB2)的PB定位于GPR45基因的第二个外显子上游54,466bps。由于两个突变品系均是将PB插入GPR45基因的唯一的内含子,因此,导致GPR45的RNA转录被阻断。我们检测了两个突变品系中5日龄小鼠全脑内GPR45基因mRNA水平的表达量,具体方法如下:取5日龄小鼠全脑加入1mlTrizol(Ambion公司),将组织块研磨均匀,可保存于-80℃;加200ulCHCl3,震荡15秒,室温放置10分钟;12000rpm,4℃离心15min;吸取上清,加500ul异丙醇,震荡15秒,室温放置10分钟;12000rpm,4℃离心15min;用500ul75%酒精洗涤,7500g,5min;弃上清,室温干燥总RNA;加入50ulddH2O(RNasefree),37℃溶解RNA;取2ul电泳,并测OD,确定RNA浓度。用反转录试剂盒(Takara公司,目录号RR047A)提取基因组DNA并进行反转录,反转录的cDNA用于RT-RCR模板。实时定量PCR体系和反应条件参照Agilent公司或Vazyme公司的SYBRGreenMasterMix反应说明书进行。在Stratagene公司的Mx3000P或Roche公司的LightCycler480II定量PCR仪上进行数据采集和结果分析(每个基因型至少3例,每例3个重复,标准曲线采用二倍或四倍梯度稀释四次)。选用GAPDH基因的转录水平作为内参。所用引物的具体序列如下:用于扩增第一突变品系小鼠体内GPR45基因的引物称之为GPRE2-1,用于扩增第二突变品系小鼠体内GPR45基因的引物称之为GPRE2-2;结果证实,PB的插入均导致了两个突变品系小鼠体内GPR45基因mRNA表达水平的显著下调。如图1所示,与野生型小鼠相比,GPR45在GPR45PB1/PB1纯合突变体中下调了97.3%,在GPR45PB1/+杂合突变体中下调了55.2%;而在GPR45PB2纯合突变体和杂合突变体中,GPR45的表达分别下调了89.4%和35.7%。综上,PB转座子的插入严重破坏了小鼠体内GPR45基因的表达。实施例2GPR45PB1突变导致肥胖我们发现GPR45PB1/PB1纯合突变体表现为严重的肥胖症状(如图2所示)。从5周龄开始每周检测突变体小鼠和同窝野生型小鼠的体重发现,与野生型小鼠相比,GPR45PB1/PB1纯合突变体从6周龄左右开始迅速增重,到小鼠11周时,雌性纯合突变体和雄性纯合突变体的体重比野生型小鼠分别重33.6%和16.9%。杂合突变体与野生型小鼠的体重相比未见有明显差异。为了进一步研究突变体小鼠体重的增长是由于何种组织成分的增多导致的,我们利用核磁仪检测了5周大和12周大的小鼠身体组分(如图3所示)。计算脂肪和肌肉比例发现,5周大的突变体小鼠虽然体重与野生型小鼠比较没有显著差异,但是脂肪肌肉比例已经显著性增高,雌性突变体和雄性突变体分别比野生型小鼠高了1.3倍和1.2倍。12周龄的突变体小鼠的脂肪肌肉比例比相同年龄的野生型更高,雌性和雄性突变体分别升高了3.3倍和3.9倍。杂合突变体小鼠的脂肪肌肉比也有一定程度的明显升高。为了验证以上结果,我们对6个月大的突变体小鼠进行了解剖,发现突变体小鼠的脂肪组织的确比野生小鼠显著性增多。雌性纯合突变小鼠的性腺旁脂肪、腹膜后脂肪以及肩胛骨间的脂肪比野生型小鼠的相应脂肪组织分别增加了3.1倍、4.0倍和2.2倍;雄性小鼠的性腺旁脂肪、腹膜后脂肪以及肩胛骨间的脂肪比野生型小鼠的相应脂肪组织分别增加了2.1倍、2.3倍和1.5倍。以上结果充分表明GPR45PB1/PB1纯合突变体具有严重的肥胖表型。综上,在小鼠中阻断GPR45的表达导致肥胖的发生。实施例3GPR45PB1突变导致脂肪肝在肥胖病人中,脂肪代谢异常通常会导致脂肪在肝脏中的过度累积,从诱发脂肪肝的发生。为了探究GPR45PB1突变体小鼠是否也伴有脂肪肝的发生,我们解剖了突变小鼠的肝脏,6个月大的雌性纯合突变小鼠和雄性的纯合突变小鼠的肝脏比野生型小鼠分别增重14.4%和32.2%。肝脏重量的增加暗示肝脏中有脂肪累积的可能。为了进一步确定突变体小鼠具有脂肪肝的表型,我们用能将脂肪染成红色的染料——油红O对9个月大的小鼠肝脏冰冻切片染色(如图4所示),结果显示,突变体小鼠的肝脏细胞中有较多的脂滴累积。以上结果显示,GPR45PB1突变体小鼠具有严重的脂肪肝。实施例4GPR45PB1突变导致血浆高瘦素和高胰岛素瘦素(Leptin)和胰岛素(Insulin)是平衡脂代谢和糖代谢的两种重要的激素。大部分肥胖症的病人血清中伴随瘦素的升高,同时在肥胖和二型糖尿病的病人中也经常检测到胰岛素升高的症状。为了检测GPR45PB1突变体小鼠体中瘦素和胰岛素的水平,我们用酶联免疫吸附测定(ELISA)的方法检测了12周龄突变小鼠血清中这两种激素的浓度(如图5所示)。雌性突变体小鼠和雄性突变体小鼠饥饿后血清中瘦素水平比野生型小鼠分别高9.9倍和23.8倍;而血清胰岛素水平分别高1.5倍和2倍。实验证明在小鼠体内阻断GPR45的表达将导致高瘦素和高胰岛素的表型。实施例5GPR45PB1导致胰岛素抵抗和葡萄糖不耐受胰岛素抵抗是二型糖尿病糖代谢失衡的一个重要原因。而胰岛素抵抗通常会导致血清中胰岛素的升高,表现为高胰岛素症。为了检测GPR45PB1突变小鼠的胰岛素应答是否受到影响,我们用胰岛素耐受实验(ITT)检测了15周大的突变小鼠的胰岛素应答的敏感性程度(如图6所示)。我们给突变小鼠和野生型小鼠腹腔注射胰岛素后监测小鼠血糖的变化。我们发现,不但突变体小鼠的血糖水平一直处于野生型小鼠之上,而且在注射胰岛素后,血糖的下降速度也明显比野生型小鼠慢。以上实验表明GPR45PB1突变小鼠具有胰岛素抵抗的表型。我们发现在胰岛素耐受试验中,自由饮食的突变体小鼠的血糖明显高于野生型小鼠。血糖升高暗示葡萄糖代谢平衡能力受损。为了证实该推论,我们用葡萄糖耐受实验(GTT)检测了12周大的GPR45PB1突变小鼠的葡萄糖耐受能力(如图6所示)。小鼠饥饿16小时后检测小鼠的空腹血糖,雌性突变小鼠和雄性突变小鼠的血糖分别比野生型小鼠高16.5%和13.7%。随后,给予小鼠腹腔注射葡萄糖并监测小鼠的血糖变化,我们发现注射葡糖糖后,突变体小鼠的血糖迅速升高,血糖上升速度明显比野生型小鼠快。注射葡萄糖30分钟后,血糖水平达到峰值,随后血糖被血清中的胰岛素清除,血糖水平逐渐下降,但是突变小鼠的血糖清除速度明显比野生型小鼠慢。以上结果显示GPR45PB1突变小鼠的葡萄糖代谢能力减弱。实施例6GPR45PB2突变同样导致肥胖和葡萄糖不耐受此外,我们也检测了12周龄的GPR45PB2/PB2突变小鼠的体重,脂肪肌肉比(如图7所示)。结果显示该突变体小鼠与GPR45PB1/PB1突变体小鼠具有类似的肥胖表型。与野生小鼠相比,12周的雌性纯合突变体和雄性纯合突变体的体重分别比野生型小鼠重43.0%和23.4%,而12周的雌性纯合突变体和雄性纯合突变体的脂肪肌肉比分别比野生型高4.8倍和5倍。我们同时检测了12周的GPR45PB2/PB2突变小鼠的葡萄糖耐受能力,也得到了类似的结果(如图7所示)。实施例7GPR45回复突变或转基因表达减轻小鼠肥胖综上实施例1~6,我们观察到GPR45PB1和GPR45PB2突变小鼠均具有类似的肥胖和葡萄糖不耐受的表型。因此,我们推断阻断GPR45的表达与突变小鼠的肥胖表型密切相关。为了进一步验证这个假设,我们将携带PBase转座酶的转基因小鼠与GPR45PB1纯合突变小鼠交配,拿到携带PBase基因的GPR45PB1纯合突变小鼠,再与GPR45PB1纯合突变小鼠交配,得到PB转座子被精确切离的GPR45回复突变品系(GPRrev/GPRrev)。携带PBase转座酶的转基因小鼠的构建方法,如下:(1)Act-PBase的构建方法详见:EfficienttranspositionofthepiggyBac(PB)transposoninmammaliancellsandmice.DingS,WuX*,LiG,HanM,ZhuangY,XuT*.Cell.2005Aug12;122(3):473-83。(2)携带PBase转座酶的转基因小鼠的构建方法详见:GenerationofgeneticallyengineeredmicebythepiggyBactransposonsystem.DingS,XuT,andWuX.InMouseGenetics:MethodsandProtcols.SinghRSandCoppolaVeds.ISBN978-1-4939-1214-8.Springer.2014。我们检测了12周大的回复突变小鼠的体重和脂肪肌肉比发现,纯合回复突变小鼠的体重和脂肪肌肉比GPR45PB1/PB1纯合突变小鼠明显下降,且与野生型小鼠相比没有明显差异;我们同时检测了12周大的回复突变小鼠的葡萄糖耐受能力,与GPR45PB1/PB1纯合突变小鼠相比,回复突变小鼠的葡萄糖耐受能力显著增强,基本与野生型小鼠类似。以上实验证明,阻断GPR45的表达将导致代谢异常(如图8所示)。为了进一步验证以上实验结果,我们利用神经元特异性表达的烯醇酶(NSE)启动子,构建了GPR45转基因小鼠(NSE::GPR45):以成年小鼠全脑cDNA为PCR模板,用mGPR45CDprimer1和2两对引物扩增小鼠GPR45全长编码序列(PCR方法参照TOYOBO公司KOD-Plus-Ver.2高保真酶的使用说明书),连入T载体测序,阳性质粒用EagI酶切后平头连入pcDNA4.0-HA载体得到pcDNA4.0-HA-GPR45。再用NheI/EcoRV双酶切pcDNA4.0-HA-GPR45得到HA-GPR45片段,然后平头连入pNSE载体(SUN1andSUN2playcriticalbutpartiallyredundantrolesinanchoringnucleiinskeletalmusclecellsinmice.LeiK,ZhangX,DingX,GuoX,ChenM,ZhuB,XuT,ZhuangY,XuR,HanM.ProcNatlAcadSciUSA.2009Jun23;106(25):10207-12.)的HindIII位点。用NotI将质粒线性化后注射FVB/NJ小鼠受精卵,注射方法与Act-PBase的转基因小鼠的方法一致。得到的奠基者小鼠用HA-F2和GPR-B4两对引物鉴定(PCR方法同上文GT-PCR反应)。mPBGPR45-CDprimer1ACCATGGCCTGTAACAGCACACSEQIDNO.34mPBGPR45-CDprimer2CTAGACAGCGGATTGGTTTTCGSEQIDNO.35HA-F2CCAACTGGTAATGGTAGCGACCSEQIDNO.36GPR-B4CGAAGGGAGCAAAGAACACTGCSEQIDNO.37与野生型小鼠相比,5日龄转基因小鼠的下丘脑中GPR45表达量上调15.4倍(图26所示)。同时,我们检测了3周龄转基因小鼠的体重和脂肪肌肉比(图26所示)。结果显示,虽然3周龄NSE::GPR45转基因小鼠的体重与同窝野生型小鼠类似,但体脂含量显著降低。雌鼠和雄鼠的脂肪肌肉比分别降低了28.6%和20.6%。该结果表明在神经元中表达GPR45可抑制小鼠脂肪的累积。综上,PB插入突变破坏GPR451表达,导致小鼠肥胖、脂肪肝、葡萄糖不耐受和胰岛素抵抗等代谢紊乱的表型,提示GPR45参与了机体能量代谢平衡的调控。鉴于GPR45PB2/PB2与GPR45PB1/PB1表型类似,以下用于研究的小鼠均选用GPR45PB1/PB1。实施例8肥胖是GPR45突变小鼠的初级表型众所周知,脂代谢异常通常会导致糖代谢异常,糖代谢异常也会影响脂代谢。例如肥胖增加了胰岛素抵抗和二型糖尿病发生的风险,小鼠骨骼肌特异性的胰岛素抵抗也会导致脂肪的过度累积。此外,脂肪肝与胰岛素抵抗和肥胖相关疾病的发生密切相关。探究的GPR45突变小鼠的初级表型,有助于我们找到导致GPR45代谢异常的根本原因。首先,我们监测了小鼠肥胖症发生的时间。前面的实验结果表明,虽然5周大的GPR45PB1/PB1小鼠的体重与野生型小鼠相比没有差异,但是脂肪比例已经显著高于野生型小鼠。为了找到突变小鼠肥胖开始的年龄,我们监测了突变小鼠从第10天到第28天的脂肪肌肉比(如图9所示)。结果显示,尽管一开始突变小鼠的脂肪肌肉比与野生型小鼠相比没有显著差异,但是突变小鼠脂肪比例的增加明显比野生型小鼠迅速。20天的雌性和18天的雄性小鼠的脂肪肌肉比明显高于野生型小鼠,说明雌性突变小鼠和雄性突变小鼠分别在第20天和第18天开始变胖。同时,我们检测了小鼠的饥饿后的血清中的瘦素水平发现,14天的突变小鼠的血清瘦素水平与野生型相差不大,但是2周后,雌性和雄性突变小鼠的血清瘦素水平比野生型小鼠分别升高1.3倍和1.6倍(如图10所示)。以上结果表明,GPR45突变小鼠在断奶前即出现肥胖表型。与肥胖表型不同,我们并没有发现GPR45小鼠在早期就有脂肪肝和糖代谢异常的表型(如图11所示)。我们发现在4周大的突变体小鼠的肝脏中并没有过多的脂肪累积,空腹胰岛素水平也与野生型小鼠相比没有显著性差异。我们也检测了突变小鼠的空腹血糖,直到小鼠第九周都没有发现异常。综上,我们证实了肥胖是GPR45突变小鼠的初级表型,提示GPR45突变小鼠的脂代谢异常导致了脂肪肝的发生和糖代谢异常。实施例9GPR45突变小鼠肥胖原因探讨肥胖是由机体能量代谢失衡导致的,因此能量摄入过多或能量消耗减少都会导致肥胖。能量消耗又分为基础代谢消耗,机体运动产热和适应性产热。为了探究GPR45突变小鼠肥胖的生理学原因,我们分析了突变小鼠肥胖初期的能量摄入和能量消耗水平。首先,我们检测了突变小鼠的进食量。我们了检测了年龄在21天到33天之间的突变小鼠每天的进食量,用协方差分析(ANCOVA)的方法分析了这期间两种基因型的进食量,结果表明,在相同的体重下两种基因型的进食量没有显著性差异(图12所示)。此外,我们还检测了小鼠的粪便燃烧值,也没有发现两种基因型有显著差异。以上实验表明,GPR45小鼠的能量摄入没有受到影响。肥胖GPR45突变小鼠能量摄入没有异常,提示我们突变小鼠的能量消耗异常。因此,我们用代谢笼盒系统检测了年龄在21天到33天的突变小鼠的24小时内总的能量消耗(EE)(图13所示)。协方差分析结果表明,在相同的肌肉重量下,突变体小鼠的能量消耗显著性低于野生型小鼠,表现为雌性突变体小鼠和雄性突变体小鼠分别比野生型小鼠低了10.7%和9.93%。呼吸熵(RQ)是检测代谢燃料利用的重要指标,不同的代谢燃料,如糖,脂肪和蛋白质的呼吸熵各不相同,选择不同的燃料参与能量代谢的产热效率是不一样的。为了检测突变小鼠的代谢燃料是否有差异,我们分析了该年龄段两种基因型小鼠的呼吸熵,结果显示两种基因型小鼠的呼吸熵没有明显差异(图13所示)。该结果表明,GPR45小鼠在肥胖初期对于代谢燃料的利用没有偏好。小鼠静息状态下的能量消耗或体温等指标在一定程度上可以反映机体基础能量代谢水平。考虑到FVB背景的小鼠在正常的亮暗周期下的节律不明显,我们通过检测小鼠的直肠体温来反映基础代谢水平。结果显示3周大的突变体小鼠的直肠体温与野生型小鼠相比没有显著性差异,但是11周大的突变体小鼠的直肠体温显著性低于野生型小鼠,表现为雌性和雄性突变体小鼠的直肠体温分别比野生型小鼠低1.4℃和1.1℃(图14所示)。以上结果,提示肥胖突变体小鼠的基础能量消耗低于野生型小鼠。实验小鼠的机体运动产热约占机体总能耗的40%。为了研究GPR45突变小鼠的运动能力是否下降,我们用小鼠行为活动家居观测系统(Home-cagesystem)检测了3周的小鼠24小时内的运动总路程和睡眠时间(图15所示)。结果显示,雌性突变体小鼠和雄性突变小鼠一天内的运动总路程分别比野生型小鼠缩短47.6%和29.7%;而睡眠时间是野生型的两倍。7周或9周的突变体小鼠也具有运动总路程缩短、睡眠时间延长的类似表型。以上数据表明,肥胖GPR45突变小鼠活动能力的下降一定程度上导致了能量消耗的减少。适应性产热能够保证小鼠在寒冷环境中维持相对稳定的体温。为了检测突变小鼠的适应性产热能力是否存在异常,我们检测了14天大的小鼠的冷适应诱导产热的能力,我们将小鼠置于不提供粮食但提供饮水的4℃寒冷环境中2小时,检测小鼠的直肠体温的变化。2小时后,雌性突变体小鼠和雄性突变体小鼠的直肠体温分别下降了13.7℃和17.3℃,而纯合突变小鼠的体温下降更明显,分别下降25.8℃和25.6℃(图16所示)。实验证明,GPR45纯合突变小鼠不能在寒冷环境中维持体温的相对稳定,提示突变小鼠适应性产热能力的降低某种程度上导致了能量消耗的减少。综上所述,GPR45突变小鼠能量摄入正常,但基础代谢能耗、运动产热和适应性产热能力下降,提示阻断GPR45的表达引起小鼠能量消耗减少,而不是能量摄入增加,导致了突变小鼠肥胖的发生。实施例10GPR45在下丘脑调控能量代谢中的功能研究以上结果表明GPR45在小鼠能量代谢平衡起了重要作用,那么,GPR45是如何调控能量代谢的呢?我们针对GPR45的表达谱、GPR45的代谢相关因子的调控和GPR45可能参与的信号通路等方面进行了研究。首先,我们检测了GPR45的表达谱。之前有研究表明GPR45在鼠脑中特异性表达。我们利用1月龄小鼠的组织器官进行反转录PCR(具体方法同实施例1)发现,GPR45不仅表达于各个脑区,还在睾丸中表达(图17所示)。在鼠脑中,GPR45主要表达于嗅球、大脑皮层、海马、下丘脑、小脑和脑干。该结果显示GPR45在中枢神经系统中发挥重要作用。鉴于下丘脑是神经系统调控能量代谢的中枢,我们利用实验室自制的针对GPR45的抗体对小鼠下丘脑区域进行了免疫荧光染色(如图18所示)。结果显示,GPR45在视交叉上核(suprachiasmatic,SCN)、下丘脑背内侧核(DMN),下丘脑腹内侧核(VMN)和弓形核(ARC)中有高表达。纯合子中GPR45的表达被破坏。以上结果提示GPR45参与了下丘脑对能量代谢的调控。实验室自制的针对GPR45的抗体的制备方法具体如下:(1)由化学合成多肽的方法直接制备氨基酸序列为SEQIDNO:33所示的分离的抗原肽,MACNSTPMGTYEHLLLNVSNTLDPGDTPLSAPLRISGYTEFPAERNTVRKNAVRVHNQSDSLDLRQLTGAGLRRLRRQQQQASLDLSFKTKSAFSRRFYYSASFYTPHTFQILPKVPERIQRKIQPSTIYVCNENQSAVLE(SEQIDNO:33)。(2)用制备好的抗原肽作为免疫抗原对豚鼠进行免疫:以其中两只豚鼠为例:第1日:注射含500微克抗原的完全弗氏佐剂(CFA);第14日:注射含250微克抗原的不完全弗氏佐剂(IFA);第28日:注射含250微克抗原的不完全弗氏佐剂(IFA);第42日:注射含250微克抗原的不完全弗氏佐剂(IFA);第56日:注射含250微克抗原的不完全弗氏佐剂(IFA);第70日:放血处死并制备血清,提供100ul抗血清,抗原按如图24梯度稀释,并进行WesternBlot检测(抗血清浓度1:500)。结果显示,抗原稀释到0.5ng仍能被抗血清检测到,且2号豚鼠的免疫信号更强。充分说明,所制备的多克隆抗体具有极高的灵敏度。第11周:抗体纯化。利用ProteinA/G亲和层析柱纯化抗血清,纯化后的抗体溶解在含有0.02%的叠氮化钠和50%的甘油的PBS中(pH7.3)。提供1ml1号豚鼠纯化后抗体(7.83mg/ml)和1ml2号豚鼠纯化后抗体(8.09mg/ml)。抗原按如图25梯度稀释,并进行WesternBlot检测(纯化后抗体浓度1:1000)。结果显示,抗原稀释到0.5ng仍能被抗血清检测到,且2号豚鼠的免疫信号更强。充分说明,所制备的多克隆抗体具有极高的灵敏度。实施例11GPR45突变影响下丘脑中POMC神经肽的表达AgRP,NPY,POMC,CART,CRH,TRH,BDNF,MCH和orexin等调控能量代谢的神经肽均在下丘脑区域有表达,为了检测上述各神经肽是否参与了GPR45对能量代谢的调控,我们利用14日龄小鼠下丘脑检测了上述神经肽的表达量。RT-PCR(具体方法类似于实施例1),扩增时所用的引物具体序列如下:结果表明,在突变体小鼠下丘脑中,除了POMC的表达量下调了40%,其余各神经肽的表达量都没有显著变化。我们进一步检测了14日龄小鼠下丘脑中POMC蛋白的表达水平,免疫印迹实验结果显示,突变体小鼠下丘脑中POMC蛋白表达量下调了约50%。以上结果提示GPR45能促进POMC的表达(图19所示)。实施例12GPR45细胞自主调控POMC的表达下丘脑中,POMC在ARC区域特异性表达。我们的免疫荧光结果显示,GPR45在ARC中也有表达,因此GPR45可能在POMC神经元中调控POMC的表达。为了验证这个假说,我们用14日龄野生型小鼠检测了下丘脑弓形核区域POMC神经元中GPR45的表达(图20所示)。POMC和GPR45抗体免疫荧光共染结果显示,在野生型小鼠弓形核中,约80%的POMC阳性神经元表达GPR45。该结果提示GPR45细胞能自主调控POMC的表达。为了进一步验证GPR45对POMC表达的自主调控。我们在小鼠下丘脑原代培养细胞中检测了POMC的表达。小鼠下丘脑原代细胞的分离和培养方法如下:将怀孕16.5-18.5天的母鼠断颈处死,迅速取出胚胎,断头剥离脑子,放入装有冰冷1XHBSS(Invitrogen公司)缓冲液中,并置于冰上;待全部脑子剥离出来之后,在体视镜下用尖镊小心剥除脑膜,去掉大脑、小脑、脑干和神经节,取出下丘脑,放入装有冰冷1XHBSS(GIBCO公司)缓冲液中,并置于冰上;待下丘脑集齐后,用维纳斯眼科剪剪碎下丘脑,用5ml0.125%的胰酶37℃消化20-30min;将细胞团块转移至5ml种植培养基:DMEM(Gibco公司)+10%FBS(Hyclone公司)+2mML-glutamine(Gibco公司)+50U/mlP+S(Gibco公司),用滴管轻柔地吹打细胞团块20次,静置细胞10min;将沉降下来的细胞团块再次用新鲜的5ml种植培养基轻柔吹打10-20次,至细胞团块被吹散,静置细胞10min;收集两次吹打的细胞悬液,用70um细胞筛过滤(Corning公司),收集到一个50ml管中;吹散细胞后计数,铺到12孔板中,每孔5X105个细胞。12孔板在铺板前用0.05mg/ml的D多聚赖氨酸(Sigma公司)室温处理4小时,并用灭菌双蒸水清洗三遍;待细胞生长4小时后换液,换用NB培养基:NeurobasalMedium(Gibco公司)+2%B27(Gibco公司)+2mML-glutamine(Gibco公司)+50U/mlP+S(Gibco公司),每孔1ml;每三天用NB培养基半换液1次,即每次换0.5ml;待细胞生长7天后可进行后续处理。POMC表达的检测,抽取原代细胞RNA后反转录成cDNA,后进行实时定量PCR检测,实验步骤同实施例11。结果如图21所示,在突变体胎鼠的下丘脑原代培养细胞中,POMC的表达量下降了84%。利用RNA干扰技术阻断野生型胎鼠下丘脑原代培养细胞中GPR45的表达,具体方法如下:待小鼠下丘脑原代细胞生长7天后,用相同体积的OPTI-MEM培养基(Gibco公司)分别稀释LipofectamineRNAiMAX(Invitrogen公司)和siRNA(吉玛公司),然后1:1混匀,室温静置5min,待其形成siRNA-脂质体复合体。将含有siRNA-脂质体复合体的OPTI-MEMG培养基滴入细胞培养基中,转染72小时后收细胞。每次实验每种siRNA至少做三个复孔。12孔板每孔细胞最终加入100ul含有10pmolsiRNA+3ulLipofectamineRNAiMAX复合物体的OPTI-MEM培养基中。结果显示,当GPR45表达量下调53.4%时,POMC的表达量减少了30.7%。该结果显示下调GPR45能抑制POMC的表达,提示GPR45细胞可以自主性调控POMC的表达。为了进一步验证POMC信号作用于GPR45下游来抑制肥胖的发生。我们通过GPR45突变体小鼠第三脑室中注射MTII来监控GPR45突变小鼠的体重和体脂变化。MTII是MC3R/MC4R的激动剂,能模拟POMC剪切产物α-MSH的功能,起到抑制食欲和促进能量代谢的作用。我们发现,在每天在成年GPR45PB1/PB1肥胖小鼠的脑室中注射MTII,可以抑制GPR45PB1/PB1体重的增加。MTII注射三天后,GPR45PB1/PB1小鼠的体重就能减轻到野生型小鼠的水平。MTII注射六天后,注射MTII的突变体小鼠的体重比注射前减轻13.6%,而注射MTII的野生型小鼠仅比注射前减轻1.8%。对照组突变体小鼠和野生型小鼠注射等量的生理盐水,体重不受影响。给药六天后,与对照组注射生理盐水的小鼠相比,注射MTII的突变体小鼠的性腺旁脂肪、腹膜后脂肪和肩胛骨间褐色脂肪的重量分别下降48.5%、66.7%和50.4%。注射MTII的野生型小鼠的性腺旁脂肪和腹膜后脂肪的重量分别下降44.1%和50.9%,而肩胛骨间褐色脂肪增重0.4%。以上结果显示,GPR45PB1/PB1小鼠对MTII激活POMC信号更敏感,提示POMC信号参与了GPR45对能量代谢的调控(图22所示)。实施例13本发明肥胖小鼠模型的应用本发明前述实施例中所构建的肥胖小鼠模型可用于筛选减肥药物。首先,制备党参母液,方法如下:1)党参5Kg,加6倍药物重量的纯水,浸泡14小时;2)煎制,保持煮沸状态45min;3)过滤,滤液保留,药渣加4倍药物重量的纯水,再次煎制,保持煮沸状态80min;4)过滤,弃药渣,保留滤液;5)步骤3和4中的滤液浓缩至1420ml(即终浓度为3.5g/ml),保存于-80℃。FSHRPB突变小鼠的构建方法如下:FSHR编码促卵泡激素受体,该基因剔除小鼠曾被报道出现雌性性腺发育不良(ANDRE′EDIERICHetal.,PNAS,1998.)和肥胖(NATALIADANILOVICHetal.,Endocrinology,2000.)。我们培育的FSHRPB突变小鼠在基因第一个内含子内插入一个PB转座子,利用小动物核磁共振波谱检测发现该品系与基因剔除小鼠一样出现雌性体脂含量上升等肥胖症状。将上述党参母液施用于FSHRPB突变小鼠和本发明前述实施例中所构建的肥胖小鼠,均能够起到降低肥胖小鼠体脂含量的作用。具体方法如下:动物:FSHRPB纯合突变雌性小鼠/本发明前述实施例中所构建的肥胖小鼠,21天分笼,每笼5只,待7周时上药。党参配制:母液浓度3.5g/ml*28.5ml,溶于300ml酸化水中(母液煎制方法如前所述)。实验组:1笼小鼠(5只),给予配制好的党参溶液300ml。对照组:1笼小鼠(5只),给予酸化水300ml。持续时间:4周。实验内容:每周换笼1次,第4周结束时用小动物核磁共振波谱仪检测体脂含量。结果,如图23所示,两种肥胖小鼠体内的体脂含量均下降,与现有技术中党参可作减肥药物的报道一致。说明,本发明所构建的肥胖小鼠,可用于筛选减肥药物。以上所述,仅为本发明的较佳实施例,上述实施例仅例示性说明本发明的原理及其功效,而并非对本发明任何形式上和实质上的限制,应当指出,对于本
技术领域:
的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1