一种用于土壤宏蛋白组学研究的样品制备处理方法与流程
本发明涉及到以蛋白组学分析为目的的全蛋白提取和处理方法,尤其是一种用于土
壤宏蛋白组学研究的样品制备处理方法。
背景技术:
随着土壤宏基因组学的日益成熟和发展,作为后基因组时代重要技术平台的土壤宏蛋白质组学越来越受到关注。土壤蛋白质在碳氮磷的生物地球化学循环以及有机物的积累方面发挥重要作用,与土壤质量与可持续发展息息相关。蛋白质组本质上指的是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰、蛋白与蛋白相互作用等。宏蛋白质组学是研究整个生态系统内所有微生物来源的蛋白质种类和丰度变化的技术手段。
在过去的10年中,宏蛋白质组学极大地加深了我们对于微生物群落以及它们所处的地球化学环境的理解。蛋白质组学的研究提供了不同微生物类群在凋落物分解过程中所起到的作用,对于胞外酶的研究可以揭示微生物量的限制因素、酶与凋落物分解的关系、酶活性与相关蛋白丰度的关系、酶的微生物起源以及落叶层生物与生物地球化学作用之间的关系。微生物蛋白与其生境的时间分布可以为微生物的多样性与其在生物地球化学作用过程中所扮演的角色的研究提供帮助。宏蛋白质组学将从一个新的水平上提供微生物演替和特定种群分布活动的信息,并且这些信息都能从表达的蛋白上得到解析。土壤微生物生物量巨大、种类繁多、不易分离培养,宏基因组学与蛋白质组学结合为解决这一难题提供了契机,特别是宏蛋白质组学可以深入地研究种群的多样性,可以直接观察蛋白质在环境样本中的变化,能够提供细胞的功能信息,可以细致地分析群落的结构与功能。宏蛋白质组学可以通过分析微生物酶的来源功能和活动来解决不同种类蛋白的混合表达问题,从而克服寻找酶信息与相关生态系统过程联系的困难。土壤宏蛋白质组学的研究是解析土壤宏基因功能的重要手段之一,对于碳氮磷的生物地球化学循环以及土壤有机质积累的研究具有重大价值,可将蛋白信息与相关的生态系统过程联系起来。
目前土壤宏蛋白组学研究面临的主要问题之一就是,蛋白组的提取难度大。主要有以下原因:1.土壤的基质非常复杂,对蛋白提取造成了干扰;2.蛋白质种类繁多,物理性质差异较大,目前使用的方法难以实现对所有蛋白质的高效提取;3.土壤蛋白丰度差异大,有些蛋白含量非常少,现有方法常常会漏提低丰度蛋白质;4.目前的处理方法总体而言过程都比较繁琐,期间容易造成污染和不确定因素;5.随着所需分析样本数量的增加,处理方法的通量也显得尤为重要。
技术实现要素:
本发明的目的在于提供一种操作简单、稳定性强、回收率高、提取全面而且通量高的土壤宏蛋白组学研究样品的制备处理方法。
为实现上述目的,本发明提供一种用于土壤宏蛋白组学研究的样品制备处理方法,其特征在于:其经过下列工艺步骤:
(1)样品预处理:将土壤样品放入冷冻干燥机,干燥至衡重,低温破碎,过100目筛子,称取200-400mg过筛后土壤样品,优选的取300mg土壤样品,按质量比1:10加入裂解缓冲液;;使其混匀,随后水浴加热处理,涡旋,得到第一悬混液;
(2)震荡破碎:按照每0.5ml裂解缓冲液/2颗钢珠的比例将钢珠加入到步骤(1)中得到的第一悬混液,0~4℃下利用研磨机震荡破碎得到破碎后的第一悬混液;
(3)超声提取:将步骤(2)中得到的破碎后的第一悬混液在冰上进行超声,进一步破碎,促使蛋白质充分溶出;离心,收集第一上清液;
(4)冷丙酮沉淀:向步骤(3)中得到的第一上清液加入3-6倍体积的-20℃预冷的丙酮,优选的,加入4倍体积的-20℃预冷的丙酮;在-20℃下静置5小时,高速离心,弃掉溶液,用-20℃的丙酮洗2次,加入50μl裂解缓冲液溶解蛋白质得到蛋白溶液;
(5)蛋白质酶解:精密称取步骤(4)所得含50μg蛋白质的蛋白溶液,加入单一蛋白酶或者蛋白酶组合,其中加入的蛋白质和每种蛋白酶质量比为20-50:1,优选的,按质量比25:1加入蛋白酶;于37℃孵育过夜得到多肽溶液;
(6)肽段的提取和纯化:对于步骤(5)所得多肽溶液,按照每10μg蛋白质对应3-4μl分离剂1的比例,优选的加入17μl分离剂1涡旋5分钟,然后按照每10μg蛋白质对应50-70μl分离剂2的比例,优选的加入300μl分离剂2,涡旋混匀,离心,静置10分钟,在不扰动沉淀和中间相的情况下,将约90%的含肽段的下层相转移到新的离心管中;再按照每10μg蛋白质对应50-70μl分离剂3的比例,优选的加入300μl分离剂3,涡旋混匀后,离心,取下层;合并两次所得肽段溶液;
(7)利用固相萃取离心柱对步骤(6)两次所得肽段溶液进行脱盐处理,收集洗出液;经离心浓缩干燥后,用复溶液充分涡旋重新溶解肽段样品,直接上机分析。
进一步,所述步骤(1)中的土壤为包括普通土壤、淤泥、沉积物在内的各种土壤样品。
进一步,所述步骤(1)中的低温破碎为液氮研磨破碎或其他可保持破碎过程中样品温度在零度以下的破碎装置;
任选的,所述步骤(1)中的称取过筛后的土壤样品的质量为200-400mg。
任选的,所述步骤(1)和(4)中的裂解缓冲液的配方为:70mm溴化四乙铵、0.5%二乙基二硫代氨基甲酸钠、10mm三(2-羧乙基)膦、30mm二氯乙酰胺、0.5%十二烷基硫酸钠,1m尿素,ph值调至8.0-8.2;
任选的,所述步骤(1)中所述的水浴的温度为80-95摄氏度,时间为30分钟-2小时。
进一步,所述步骤(2)中所使用的钢珠直径为1-3mm,使用前经过清洗和400℃高温烘烤去除可能附着的污染物。
进一步,所述步骤(3)中所述的超声破碎时控制超声破碎仪功率80~100w,超声30s,关闭30s,超声破碎时间为5~10min。
进一步,所述步骤(3)、(6)、(7)中离心和步骤(4)中高速离心的条件为温度4℃,转速14000rpm,离心15min。
进一步,所述步骤(5)中单一蛋白酶是指胰蛋白酶、糜蛋白酶、木瓜蛋白酶、lysc、argc、aspn或gluc;蛋白酶组合指的是胰蛋白酶、糜蛋白酶、木瓜蛋白酶、lysc、argc、aspn和gluc中的至少两种酶的组合。
进一步,所述步骤(6)中分离剂1为二甲亚砜,其加入量与蛋白质的比例为:3-4μl:10μg;优选3.5μl:10μg;
任选的,分离剂2为乙酸乙酯、环己烷和甲酸按照体积比5:1:0.01混合制备得到的混合液;其加入量与蛋白质的比例为:50-70μl:10μg;优选60μl:10μg;
任选的,分离剂3配方为:乙酸乙酯和环己烷按照体积比6:1的比例混合制备得到的混合液,其加入量与蛋白质的比例为:50-70μl:10μg;优选60μl:10μg。
进一步,所述步骤(7)中固相萃取离心柱为microspinc18silicacolumn;
任选的,脱盐处理为:先用乙腈溶液润湿萃取柱,弃掉,重复一次;用0.2体积%甲酸平衡萃取柱,重复一次;将步骤(6)两次所得肽段溶液注入萃取柱;用0.1体积%甲酸的2体积%乙腈洗萃取柱,重复一次;用75%乙腈-0.1%甲酸洗脱萃取柱,洗二次,收集合并两次洗出液;
进一步,所述步骤(7)中复溶液配方为:含有2%体积的甲醇溶液,其中含有0.8%体积的甲酸。
所述步骤(5)中蛋白质浓度测定方法为bicinchoninicacid(bca)方法。
本发明所述固相萃取离心柱为microspinc18silicacolumn(nestgroup公司)。
本发明所述的丙酮、二甲亚砜、乙酸乙酯、三氟乙酸、甲酸、甲醇、乙腈均为质谱纯或色谱纯级别试剂。
本发明所提供的用于土壤宏蛋白组学研究样品的制备处理方法,其是将土壤样品冻干粉碎后,加入裂解缓冲液后进行水浴,震荡破碎,超声,丙酮沉淀,重新定溶后得到蛋白提取液;对蛋白提取液进行浓度测量,取适量蛋白质,加入蛋白酶进行酶解,随后依次加入分离剂1、分离剂2、分离剂3,对提取液中蛋白组进行纯化,随后进行除盐处理,用复溶液重新溶解肽段样品。该工艺可从土壤样品中获得种类全面、浓度及纯度均较高的宏蛋白质组学样品。本发明采用新的裂解缓冲液配方和分离剂配方及对应的流程,结合高温裂解和低温超声破碎的方法,能够从土壤中获得种类全面、浓度及纯度高的蛋白质组学样品。本发明所制备的最终产物可以直接进行液相色谱串联质谱分析。本发明工艺合理,操作可靠易行,制备科学,最大限度地提取蛋白质,简化了操作步骤,对大量开展大规模的土壤宏蛋白质组学研究具有重大意义。
附图说明
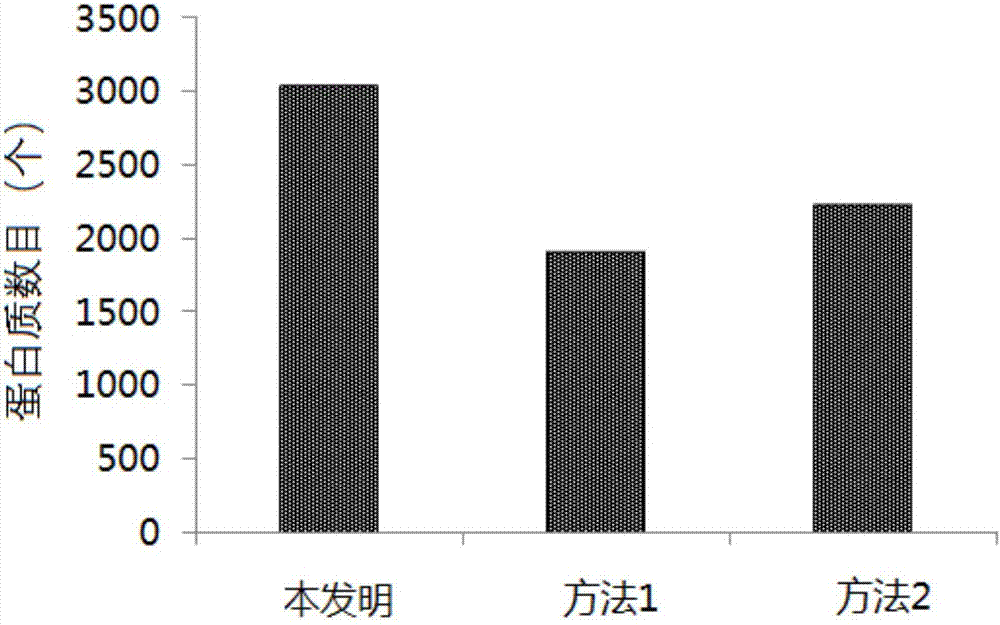
图1是实施例1中采用不同前处理方法从土壤中提取的蛋白质数量比较图。
图2是实施例2中采用不同前处理方法从沉积物样品中提取的蛋白质数量比较图。
图3是实施例3中采用不同前处理方法从淤泥样品中提取的蛋白质数量比较图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。本发明的描述中,“第一”、“第二”、“第三”等为指代或描述方便,不能理解为有顺序关系或者有相对重要性指示,除非另有说明,“多个”、“多组”、“多重”的含义是两个(组或重)或两个(组或重)以上。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:一种用于普通土壤样品中宏蛋白质组学研究样品的制备处理方法
(1)样品预处理:将土壤样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取200mg土壤粉末至离心管内,加入2ml裂解液,使用移液枪吹打,使其混匀,随后95℃水浴30min,涡旋5min。其中,裂解液的配方为:70mm溴化四乙铵(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸钠(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸钠(sds),1m尿素(urea),ph值调至8.0。
(2)震荡破碎:将6颗经过清洗和400℃烘烤后直径为3mm的钢珠加入步骤(1)中得到的悬混液中,低温下震荡破碎,震荡频率为90hz,时间为60s;
(3)超声提取:将步骤(2)中得到的溶液样品在冰上进行超声,进一步破碎,促使蛋白质充分溶出,超声功率为100w,超声30s,关闭30s,超声破碎时间为5min。然后采用低温离心机控制温度4℃,控制转速15000g,离心5min,收集上清液;
(4)冷丙酮沉淀:向步骤(3)得到的上清液中,加入3倍体积的冷丙酮,在-20℃下静置5小时,高速离心,温度4℃,控制转速15000g,离心10min,弃掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解缓冲液重新溶解蛋白质。
(5)蛋白质酶解:利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定,取50μg蛋白质,加入胰蛋白酶和lysc酶,蛋白质和胰蛋白酶和lysc酶质量比25:1:1;37℃下孵育12小时,得到蛋白质酶解多肽溶液;
(6)肽段的提取和纯化:对于步骤(5)所得多肽溶液,加入15μl分离剂3(二甲亚砜),涡旋5分钟,然后加入250μl分离剂2(乙酸乙酯、环己烷和甲酸,体积比5:1:0.01),涡旋混匀,温度10℃,控制转速1000rpm,离心5min,然后静置10分钟,在不扰动任何沉淀和中间相的情况下,将约90%的下层相(含肽段)转移到新的离心管中。再加入250μl分离剂3(乙酸乙酯和环己烷,体积比6:1),涡旋混匀后,采用低温离心机控制温度10℃,控制转速1000rpm,离心5min,取下层,合并两次所得肽段溶液。
(7)肽段溶液的脱盐:利用microspinc18silicacolumn(nestgroup公司)对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,弃掉,重复一次;用100μl0.1%甲酸平衡萃取柱,重复一次;将酶解样品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重复一次;用100μl75%乙腈(0.1%甲酸)洗脱萃取柱,洗二次,收集合并两次洗出液。
(8)回收液经离心浓缩干燥后,用50μl的复溶液(2%甲醇溶液,其中含有0.8%甲酸)充分涡旋溶解,直接上机分析。
对比例1:(方法1)
(1)将土壤样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超声3min,静置30min,然后离心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mm二硫苏糖醇(dtt)的20%tca/丙酮(w/v)溶液,-20℃下静置过夜;
(3)离心30min(4℃,15000g),弃去上清,收集沉淀;
(4)将步骤(4)中沉淀溶解于50μl蛋白质溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低温离心机控制温度4℃,控制转速15000g,离心30min,取上清
(5)利用bradford法,对步骤(5)中得到的全蛋白溶液进行蛋白质浓度的测定,取100μg蛋白质,加入胰蛋白酶,蛋白质和胰蛋白酶质量比50:1,37℃下孵育16小时,得到蛋白质酶解多肽溶液;
(6)利用omixc18tip对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,重复一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重复一次;用100μl0.1%甲酸平衡萃取柱,重复三次;将酶解样品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;将吸附的肽段释放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上机分析。
对比例2:(方法2)
(1)将土壤样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超声3min,静置过夜,然后采用低温离心机控制温度4℃,控制转速15000g,离心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸铵水溶液,静置3小时,低温离心(4℃,15000g)30min,弃去上清,收集沉淀;
(3)向步骤(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定;
(5)从步骤(4)所得溶液中精密量取含100μg蛋白质的溶液,转移至新离心管中,加入10mmdtt(终浓度),37℃变性1小时,然后再加入50mmiaa(终浓度),铝箔纸完全包裹离心管以避免光照,室温反应0.5小时;
(6)将millipore10kd超滤膜加入50μl8m尿素润洗,14,000g离心10分钟,将步骤(5)的蛋白样品转移至超滤管,14,000xg离心20分钟;
(7)向步骤(6)中超滤管中加入200μl8m尿素,14,000xg离心30分钟,重复2次;再加入200μl50mm碳酸氢铵,14,000xg离心30分钟,重复3-4次;
(8)直接将2μg胰蛋白酶加到步骤(7)的超滤管中,用封口膜密封超滤管,置于37℃烘箱中孵育过夜;
(9)更换新的超滤收集管,将步骤(8)中的超滤管14,000xg离心30-40分钟,收集穿透液;再补充80μl50mm碳酸氢铵,14,000xg离心30-40分钟,合并两次穿透液。
(10)步骤(9)的穿透液经离心浓缩干燥后,用50μl的甲醇充分溶解,直接上机分析。
将三种方法制备的样品在相同条件的液相色谱/质谱系统下检测,并经过maxquant进行数据分析,得到的蛋白鉴定数目见图1。从图1可以看出,采用本发明的方法进行蛋白质组学检测前处理,能够在土壤中检出更多种类的蛋白质。
本实施例所提供的普通土壤宏蛋白质组学研究样品的制备处理方法,其工艺合理,操作可靠,制备科学,应用范围广泛,在保证蛋白质提取效率和纯度的情况下最大限度地简化了操作步骤,最终所得样品可以直接利用液相色谱串联质谱的方法进行检测分析。
实施例2:一种用于沉积物样品中宏蛋白质组学研究样品的制备处理方法
(1)样品预处理:将沉积物样品(sediment,为任何可以由流体流动所移动的微粒,并最终成为在水或其他液体底下的一层固体微粒)放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取300mg土壤粉末至离心管内,加入3ml裂解液,使用移液枪吹打,使其混匀,随后90℃水浴1小时,涡旋5min。裂解液的配方为:70mm溴化四乙铵(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸钠(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸钠(sds),1m尿素(urea),ph值调至8.2。
(2)震荡破碎:将6颗经过清洗和400℃烘烤后直径为3mm的钢珠加入步骤(1)中得到的悬混液中,低温下震荡破碎,震荡频率为90hz,时间为60s;
(3)超声提取:将步骤(2)中得到的溶液样品在冰上进行超声,进一步破碎,促使蛋白质充分溶出,超声功率为90w,超声30s,关闭30s,超声破碎时间为8min。然后采用低温离心机控制温度4℃,控制转速15000g,离心5min,收集上清液;
(4)冷丙酮沉淀:向上清液中加入4倍体积的冷丙酮,在-20℃下静置5小时,高速离心,温度4℃,控制转速15000g,离心10min,弃掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解缓冲液重新溶解蛋白质。
(5)蛋白质酶解:利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定,取50μg蛋白质的蛋白质溶液,随后加入胰蛋白酶、木瓜蛋白酶和lysc一起进行酶解,蛋白质和胰蛋白酶,木瓜蛋白酶和lysc的质量比20:1:1:1,得到蛋白质酶解多肽溶液;
(6)肽段的提取和纯化:对于步骤(5)所得多肽溶液,加入17μl分离剂3(二甲亚砜),涡旋5分钟,然后加入300μl分离剂2(乙酸乙酯、环己烷和甲酸,体积比5:1:0.01),涡旋混匀,温度10℃,控制转速1000rpm,离心5min,然后静置10分钟,在不扰动任何沉淀和中间相的情况下,将约90%的下层相(含肽段)转移到新的离心管中。再加入300μl分离剂3(乙酸乙酯和环己烷,体积比6:1),涡旋混匀后,采用低温离心机控制温度10℃,控制转速1000rpm,离心5min,取下层,合并两次所得肽段溶液。
(7)肽段溶液的脱盐:利用microspinc18silicacolumn(nestgroup公司)对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,弃掉,重复一次;用100μl0.1%甲酸平衡萃取柱,重复一次;将酶解样品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重复一次;用100μl75%乙腈(0.1%甲酸)洗脱萃取柱,洗二次,收集合并两次洗出液。
(8)回收液经离心浓缩干燥后,用50μl的复溶液(2%甲醇溶液,其中含有0.8%甲酸)充分涡旋溶解,直接上机分析。
对比例1:(方法1)
(1)将沉积物样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超声3min,静置30min,然后离心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mmdtt的20%tca/丙酮(w/v)溶液,-20℃下静置过夜;
(3)离心30min(4℃,15000g),弃去上清,收集沉淀;
(4)将步骤(4)中沉淀溶解于50μl蛋白质溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低温离心机控制温度4℃,控制转速15000g,离心30min,取上清
(5)利用bradford法,对步骤(5)中得到的全蛋白溶液进行蛋白质浓度的测定,取100μg蛋白质,加入胰蛋白酶,蛋白质和胰蛋白酶质量比50:1,37℃下孵育16小时,得到蛋白质酶解多肽溶液;
(6)利用omixc18tip对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,重复一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重复一次;用100μl0.1%甲酸平衡萃取柱,重复三次;将酶解样品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;将吸附的肽段释放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上机分析。
对比例2:(方法2)
(1)将沉积物样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超声3min,静置过夜,然后采用低温离心机控制温度4℃,控制转速15000g,离心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸铵水溶液,静置3小时,低温离心(4℃,15000g)30min,弃去上清,收集沉淀;
(3)向步骤(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定;
(5)从步骤(4)所得溶液中精密量取含100μg蛋白质的溶液,转移至新离心管中,加入10mmdtt(终浓度),37℃变性1小时,然后再加入50mmiaa(终浓度),铝箔纸完全包裹离心管以避免光照,室温反应0.5小时;
(6)将millipore10kd超滤膜加入50μl8m尿素润洗,14,000g离心10分钟,将步骤(5)的蛋白样品转移至超滤管,14,000xg离心20分钟;
(7)向步骤(6)中超滤管中加入200μl8m尿素,14,000xg离心30分钟,重复2次;再加入200μl50mm碳酸氢铵,14,000xg离心30分钟,重复3-4次;
(8)直接将2μg胰蛋白酶加到步骤(7)的超滤管中,用封口膜密封超滤管,置于37℃烘箱中孵育过夜;
(9)更换新的超滤收集管,将步骤(8)中的超滤管14,000xg离心30-40分钟,收集穿透液;再补充80μl50mm碳酸氢铵,14,000xg离心30-40分钟,合并两次穿透液。
(10)步骤(9)的穿透液经离心浓缩干燥后,用50μl的甲醇充分溶解,直接上机分析。
将三种方法制备的样品在相同条件的液相色谱/质谱系统下检测,并经过maxquant进行数据分析,得到的蛋白鉴定数目见图2。从图2可以看出,利用本发明方法能够在沉积物样品中检出更多种类的蛋白质。
本实施例所提供的沉积物宏蛋白质组学研究样品的制备处理方法,其工艺合理,操作可靠,制备科学,应用范围广泛,在保证蛋白质提取效率和纯度的情况下最大限度地简化了操作步骤,最终所得样品可以直接利用液相色谱串联质谱的方法进行检测分析。
实施例3:一种用于淤泥样品中宏蛋白质组学研究样品的制备处理方法
(1)样品预处理:将淤泥样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取400mg淤泥粉末至离心管内,加入4ml裂解液,使用移液枪吹打,使其混匀,随后80℃水浴2小时,涡旋5min。其中,裂解液的配方为:70mm溴化四乙铵(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸钠(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸钠(sds),1m尿素(urea),ph值调至8.0。
(2)震荡破碎:将8颗经过清洗和400℃烘烤后直径为3mm的钢珠加入步骤(1)中得到的悬混液中,低温下震荡破碎,震荡频率为90hz,时间为60s;
(3)超声提取:将步骤(2)中得到的溶液样品在冰上进行超声,进一步破碎,促使蛋白质充分溶出,超声功率为80w,超声30s,关闭30s,超声破碎时间为10min。然后采用低温离心机控制温度4℃,控制转速15000g,离心5min,收集上清液;
(4)冷丙酮沉淀:向步骤(3)得到的上清液中加入6倍体积的冷丙酮,在-20℃下静置5小时,高速离心,温度4℃,控制转速15000g,离心10min,弃掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解缓冲液重新溶解蛋白质。
(5)蛋白质酶解:利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定,取50μg蛋白质,加入胰蛋白酶,蛋白质和蛋白酶比25:1;37℃下孵育12小时,得到蛋白质酶解多肽溶液;
(6)肽段的提取和纯化:对于步骤(5)所得多肽溶液,加入20μl分离剂3(二甲亚砜),涡旋5分钟,然后加入350μl分离剂2(乙酸乙酯、环己烷和甲酸,体积比5:1:0.01),涡旋混匀,温度10℃,控制转速1000rpm,离心5min,然后静置10分钟,在不扰动任何沉淀和中间相的情况下,将约90%的下层相(含肽段)转移到新的离心管中。再加入350μl分离剂3(乙酸乙酯和环己烷,体积比6:1),涡旋混匀后,采用低温离心机控制温度10℃,控制转速1000rpm,离心5min,取下层,合并两次所得肽段溶液。
(7)肽段溶液的脱盐:利用microspinc18silicacolumn(nestgroup公司)对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,弃掉,重复一次;用100μl0.1%甲酸平衡萃取柱,重复一次;将酶解样品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重复一次;用100μl75%乙腈(0.1%甲酸)洗脱萃取柱,洗二次,收集合并两次洗出液。
(8)回收液经离心浓缩干燥后,用50μl的复溶液(2%甲醇溶液,其中含有0.8%甲酸)充分涡旋溶解,直接上机分析。
对比例1:(方法1)
(1)将淤泥样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超声3min,静置30min,然后离心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mmdtt的20%tca/丙酮(w/v)溶液,-20℃下静置过夜;
(3)离心30min(4℃,15000g),弃去上清,收集沉淀;
(4)将步骤(4)中沉淀溶解于50μl蛋白质溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低温离心机控制温度4℃,控制转速15000g,离心30min,取上清
(5)利用bradford法,对步骤(5)中得到的全蛋白溶液进行蛋白质浓度的测定,取100μg蛋白质,加入胰蛋白酶,蛋白质和胰蛋白酶质量比50:1,37℃下孵育16小时,得到蛋白质酶解多肽溶液;
(6)利用omixc18tip对肽段样品进行脱盐,除盐流程为:先用100μl乙腈润湿萃取柱,重复一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重复一次;用100μl0.1%甲酸平衡萃取柱,重复三次;将酶解样品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;将吸附的肽段释放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上机分析。
对比例2:(方法2)
(1)将淤泥样品放入冷冻干燥机,干燥至衡重,液氮环境下磨碎。精密称取100mg样品粉末至离心管内,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超声3min,静置过夜,然后采用低温离心机控制温度4℃,控制转速15000g,离心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸铵水溶液,静置3小时,低温离心(4℃,15000g)30min,弃去上清,收集沉淀;
(3)向步骤(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,对步骤(4)中得到的全蛋白溶液进行蛋白质浓度的测定;
(5)从步骤(4)所得溶液中精密量取含100μg蛋白质的溶液,转移至新离心管中,加入10mmdtt(终浓度),37℃变性1小时,然后再加入50mmiaa(终浓度),铝箔纸完全包裹离心管以避免光照,室温反应0.5小时;
(6)将millipore10kd超滤膜加入50μl8m尿素润洗,14,000g离心10分钟,将步骤(5)的蛋白样品转移至超滤管,14,000xg离心20分钟;
(7)向步骤(6)中超滤管中加入200μl8m尿素,14,000xg离心30分钟,重复2次;再加入200μl50mm碳酸氢铵,14,000xg离心30分钟,重复3-4次;
(8)直接将2μg胰蛋白酶加到步骤(7)的超滤管中,用封口膜密封超滤管,置于37℃烘箱中孵育过夜;
(9)更换新的超滤收集管,将步骤(8)中的超滤管14,000xg离心30-40分钟,收集穿透液;再补充80μl50mm碳酸氢铵,14,000xg离心30-40分钟,合并两次穿透液。
(10)步骤(9)的穿透液经离心浓缩干燥后,用50μl的甲醇充分溶解,直接上机分析。
将三种方法制备的样品在相同条件的液相色谱/质谱系统下检测,并经过maxquant进行数据分析,得到的蛋白鉴定数目见图3。从图3可以看出,利用本发明方法能够在沉积物样品中检出更多种类的蛋白质。
本实施例所提供的淤泥宏蛋白质组学研究样品的制备处理方法,其工艺合理,操作可靠,制备科学,应用范围广泛,在保证蛋白质提取效率和纯度的情况下最大限度地简化了操作步骤,最终所得样品可以直接利用液相色谱串联质谱的方法进行检测分析。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!