一种质粒标准品及其制备方法和用途与流程
本发明涉及个体化医学基因分型实验质量控制领域,尤其涉及一种预测甲氨蝶呤治疗类风湿关节炎疗效的基因分型质控品。
背景技术:
类风湿关节炎(rheumatoid arthritis,RA)是一种临床常见的自身免疫性疾病,其主要表现为慢性、对称性、破坏性多关节炎,其中双手、腕、膝、踝、和足关节受累最为常见。若不尽早给予合理治疗,病情会逐渐发展,最终可致关节畸形和功能丧失,严重影响患者生活质量。
目前,甲氨蝶呤(methotrexate)是国内外治疗RA的首选药物之一,因其物美价廉而成为RA患者使用最广泛的基础用药。甲氨蝶呤主要通过抑制叶酸代谢,从而抑制细胞增殖和复制,其可作用于氨基咪唑甲酰胺酶(ATIC),减少5-氨基咪唑-4-氨甲酰胺核苷酸(AICAR)转化为5-甲酰氨基咪唑-4-甲酰胺核苷酸(FAICAR),导致AICAR在细胞内蓄积。而AICAR同时又可通过抑制腺苷脱氨酶(ADA)和腺苷单磷酸脱氨酶(AMPD)活性,减少腺苷和腺苷酸分解,从而增加这两种物质在细胞内的浓度。腺苷作为抑制抗炎性介质,通过与相应的腺苷受体的结合,调节甲氨蝶呤的抗炎作用。
近年来,药物基因组学(pharmacogenetics)的,近年来药物基因组学(pharmacogenetics)研究揭示,编码药物代谢酶、药物转运体和药物作用靶点的基因序列的不同是引起药物个体化差异的一个主要原因,20%-95%药物反应和处置的个体差异却是由遗传因素引起的。药物基因组学研究则为实现个体化临床用药提供了新的途径。
氨基咪唑甲酰胺酶(ATIC)基因位于2q35,存在数种多态性标记,其中包含rs4673993(C>T)位点。Lee YC等人对120名接受甲氨蝶呤单药治疗的类风湿关节炎患者开展的研究发现,ATIC rs4673993位点突变与低疾病活性相关(P=0.01)。与基因型为TT的类风湿性关节炎患者相比,基因型为CC的患者接受甲氨蝶呤治疗可获得较好的疗效。基因型为CT的患者则获得中等疗效。因此,类风湿关节炎患者的rs4673993(C>T)基因分型决定其甲氨蝶呤治疗的疗效。 因此,对接受甲氨蝶呤治疗的类风湿关节炎患者进行ATIC rs4673993(C>T)基因分型检测能够预测其治疗疗效,从而为个体化治疗提供依据。
国外开展临床实验室室间质量评价已有60年历史。近十年来,我国临床实验室也已经普遍开展了室间质评活动,用于评价实验室检测的准确性和各实验室间结果的一致性。然而,目前已开展的室间质评项目内容主要限于临床检验,与个体化用药监测相关的仅有治疗药物监测(TDM),且种类和方法有限。随着个体化用药新技术的发展、国家对新药研发的鼓励和投入增多,越来越多的医院、临床实验室陆续开展药物基因检测、药物血中浓度检测项目。由于国家相关政策尚未完善、对机构的监督及核查不足,各个检测机构水平参差不齐,造成了不同实验室监测水平差异显著,严重影响了数据的准确性,数据质量的不可靠可能为药物个体化应用埋下潜在风险。
如果有标准的室间质量评价体系,就可以确定某个实验室进行检测或测量的能力,并监控实验室的持续发展能力;识别实验室中的问题并制定相应的补救措施;确定新的检测和测量方法的有效性和可比性,并对这些方法进行相应的监控;增加实验室用户的信心;识别实验室间的差异,从而可保证个体化用药的有效性和安全性。
全国开展药物基因检测的各家单位在标本采集和保存、DNA提取方法、基因型检测方法、检测结果的分析和解释等方面存在很大差异,而这些差异将直接影响检测结果的准确性,从而影响个体化用药方案制定的可靠性。其中,基因检测方法是影响最终检测结果的关键因素。目前应用的基因检测的方法主要有PCR扩增后限制性片段长度多态性(PCR-RFLP)分析方法、Taqman探针法、DNA测序法、基因分型芯片法以及微测序法等。其中,DNA测序法是目前进行基因检测的金标准,PCR-RFLP法应用较为广泛,但都容易发生样品间交叉污染。另外,探针法操作过程虽然简单,但探针在反复冻融后容易失效。可见,各种基因检测方法各有优劣,其结果难以保证一致。所以,各实验室检测的结果有待一个第三方室间质评标准进行评估。
在卫生部临床检验中心印发的《医疗机构临床药学实验室管理暂行办法》中,将药物基因检测纳入医疗机构临床药学实验室管理,并指出开展检测的实验室每 年必须参加实验室之间的质量评价活动。全国开展药物基因检测的各家单位在标本采集和保存、DNA提取方法、基因型检测方法、检测结果的分析和解释等方面存在很大差异,而这些差异将直接影响检测结果的准确性,从而影响个体化用药方案制定的可靠性。但是,目前国内尚缺乏一个药物基因检测室间质评体系。而基因检测阳性质控品则是药物基因检测室间质评体系一个重要组成部分。因此,本发明提供一种基因检测质控品以供药物基因检测室间质评体系使用,这对开展药物基因检测室间质评具有重大意义,并对提升药物基因检测实验室的竞争力有重大的现实意义。
技术实现要素:
本发明的目的是提供一种新的用于甲氨蝶呤个体化用药检测实验质量控制的标准品解决了现有技术中存在的问题,提供一种基因检测质控品以供药物基因检测室间质评体系使用,这对开展药物基因检测室间质评具有重大意义,并对提升药物基因检测实验室的竞争力有重大的现实意义。
本发明的目的在于提供一种预测甲氨蝶呤治疗类风湿关节炎疗效的基因分型质控品,为甲氨蝶呤治疗类风湿性关节炎的疗效预测提供参考依据。
为实现上述目的,本发明可采取下述技术方案:
本发明所述的质控品核苷酸序列为SEQ ID NO.1:
TACACGCTGGGTACTGTCAGGCTTCAGTGGCTCTGTGGTTTTGGAGGGCAGAGAGGAGATTTCCCTCACACTGCTCCCACAACCATATTTTTAGTGTATAATTATCTGGCTAAATAGATTTCTGTTTAATTTAGCACAGGCACTAGAAAACGTGCTGCGTAGACTGGGTGTTAAGAAAACTGTCTTGATTTAGGAGTTGACAGGTAGTAACTTTAGCTTTCTTTGTTTATGATTTTACTATTTTCTAACCAGGTGCTGCTGTTGGAATTCCACTCAGTGAAGATGAGGCCAAAGTCTGCA
所述质控品模板是含有插入ATIC特异性核苷酸序列的PES质粒载体,该载体可在大肠杆菌中扩增,并采用标准的质粒提取办法进行制备。
本发明的有益效果
提供一种基因检测质控品以供药物基因检测室间质评体系使用,这对开展药物基因检测室间质评具有重大意义,并对提升药物基因检测实验室的竞争力有重大的现实意义。
附图说明
图1是本发明阳性质控品模板的核苷酸序列和质粒载体图。
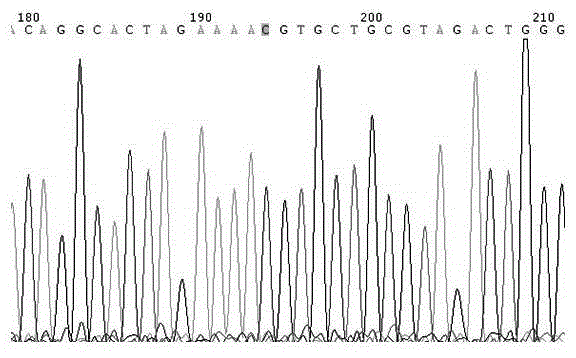
图2是本发明阳性质控品模板的核苷酸序列的测序结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1质粒标准品的制备方法
1、通过PCR方法获得目的基因
根据基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点,本实验中为Smal 1和EcoRV),通过高保真DNA聚合酶PCR循环扩增获得目的基因片段。
PCR反应体系为:
PCR反应条件为:94℃变性5min、94℃变性30s、55℃复性40s、68℃延伸1min(根据片段大小设置,1kb/min),30个循环;68℃延伸10min;16℃ forever。
2、目的基因片段回收纯化
将扩增后的PCR产品通过新鲜的TAE缓冲液进行琼脂糖凝胶电泳跑胶,同时通过MarKerV进行比较,确定片段大小正确后在紫外灯下切胶回收,接着通过胶回收纯化目的基因片段。
3.双酶切反应
将目的基因和质粒载体按照一定的体系分别进行双酶切反应,双酶切体系如下:
双酶切反应2.5-3h左右,进行跑胶回收纯化
4、目的DNA片段和载体的体外连接
分别取1μl左右的目的DNA片段与载体DNA测量他们的浓度,利用T4DNA连接酶将目的基因与载体DNA摩尔比为3:1-8:1左右连接,放置16℃的恒温水浴锅过夜连接。
5、连接产物的转化
感受态细胞的制备
⑴保存于-70℃的DH5α(或其他菌种)用接种环划菌于1.5%琼脂平板上,37℃恒温倒置培养至单菌落出现(约14-16hr)。
⑵挑取单菌落,接种于2.0ml LB液体培养基中,37℃恒温,250g振荡培养过夜(约12hr)。
⑶取0.5ml过夜培养液,接种于100ml LB液体培养基中,37℃振荡培养2-2.5hr,至OD600为0.4-0.5时,放置于4℃冰箱冷却1-2hr。
(注:以下操作均应在冰浴中进行。)
⑷将培养液分入两个50ml离心管中,4℃离心,4000g×10min,弃去上清,用冰浴的0.1M MgCl2 25ml悬浮30min。
⑸4℃离心,4000g×10min,弃去上清,加入冰浴的0.1M CaCl2-甘油溶液1ml悬浮。
⑹以100μl/管分装入1.5ml离心管中,-70℃冻存备用。
连接产物的转化
⑴取100μl贮存于-70℃钙化菌,冰浴化开;
⑵加入适量连接产物(一般不超过10μl,轻轻混匀,冰浴20min;
⑶于42℃热休克90s,迅速转移至冰浴中,继续冰浴2-3min;
⑷加入LB液体培养基500μl,于37℃缓摇孵育45min;
⑸将培养物适量涂于1.5%琼脂LB平板(根据质粒性质添加抗生素AMP即氨苄50μg/ml),待胶表面没有液体流动时,37℃温箱倒置培养12-16hr。
6、重组质粒的鉴定
将过夜培养的长出的菌斑进行菌落PCR鉴定,接着接种于5ml的LB液体培养基过夜振荡培养利用质粒提取试剂盒提质粒,并进行质粒PCR和双酶切验证,确定目的基因大小正确送公司测序进一步的分析验证。
实施例2基于DNA测序法的阳性质控品测试
1.引物设计与合成:
以人ATIC基因序列为模板,使用Primer Premier 5.0设计引物。
所述质控品模板是含有插入ATIC特异性核苷酸序列的PES质粒载体,该载体可在大肠杆菌中扩增,并采用标准的质粒提取办法进行制备。
所述PES质粒载体具有氨苄青霉素抗性片段,在插入目的核苷酸序列后,可产生氨苄青霉素抗性,从而使转化了该质粒载体的大肠杆菌具有耐氨苄青霉素的性质,能够在加入一定氨苄青霉素的LB固体培养基中生长。
所述质控品模板在大肠杆菌中扩增及质粒提取步骤如下:
1.活化:取冻存的甘油菌涂布平板或平板划线,37℃培养过夜。
2.挑取单菌落,接种于5ml LB(含Amp)培养基中,37℃振荡培养过夜。
3.将菌液1.8ml分装至2ml离心管,12000rpm离心1min,弃去上清。
4.向离心管中加入100μl预冷的溶液Ⅰ,悬浮、混匀菌体沉淀。
5.加入200μl溶液Ⅱ,轻柔颠倒数次,静置1min。
6.加入150μl预冷溶液Ⅲ,轻柔颠倒,静置1-2min,12000rpm离心10min。
7.吸取上清至新2ml离心管,加入与上清等体积的酚-氯仿,振荡混匀,冰上静置10min,12000rpm离心2min。
8.上清移至新离心管,加入2倍体积的无水乙醇,振荡混匀,室温静置2-3min,12000g离心5min。
9.弃上清,用75%乙醇洗涤沉淀一次,室温静置干燥10min。
10.用100μl TE(含RNase 20μg/ml)溶解沉淀,37℃水浴30min
11.紫外分光光度计测定OD260(按照在260nm波长产生1个OD值的DNA浓度是50ng/ml换算);琼脂糖凝胶电泳检验结果。
12.溶解后质粒置于-20℃保存。
上述步骤中所述溶液I的成分为:50mM葡萄糖、25mM Tris-HCl(pH8.0)和10mM EDTA(pH8.0)。
上述步骤中所述溶液II的成分为:0.2M NaOH和1%SDS。
上述步骤中所述溶液III的成分为:5M乙酸钾60ml、冰乙酸11.5ml调pH至4.8,加入蒸馏水定容至100ml。
实施例3类风湿关节炎临床治疗药物基因检测室间质评体系的建立
药物基因检测质控品的制备
组织者完成血浆中基因提取和序列测定方法学的建立及验证。
血浆中基因序列标准品:用金标准DNA测序法检测本发明公开的含SNP片断的质粒,作为标准品。
血浆中基因检测质控品:基因标准品→定量→取标准品溶液加入空白血浆→得到目标基因的质控品。
方法学建立:建立血液样本DNA提取、目的基因片段PCR扩增、扩增产物,提纯以及DNA序列测定的方法。
含SNP片断的质粒标准品
方法学验证:考察药物基因检测的特异性、准确度和精密度和稳定性。
作业指导书(SOP)撰写:评价项目和时限要求(发放、回收、评价)、样品保存条件、样本处理方法、检测方法描述、方法学验证的内容、报告格式以及其他注意事项。
药物基因检测质控品的发放和结果回收
面向药物基因检测实验室,发放质控品及相关作业指导书。质控品的发放将 通过严格监控的冷链运输体系,以确保质控品的稳定性。
室间质评参加者须在规定时间内按照作业指导书要求完成测定,结果以标准格式通过网络形式上报至中心,并留存原始记录及结果报告。
结果评价
制定评分标准:对于每一个测定结果,进行评分。
对每一次EQA调查,针对某一项目的得分计算公式为:
该项目的可接受结果数/该项目的总的测定样本数×100%
而对评价的所有项目,其得分计算公式为:
全部项目可接受结果总数/全部项目总的测定样本数×100%
室间质评计划的成绩要求
每次活动每一分析项目未能达到至少100%可接受成绩则称为本次活动该分析项目不满意的EQA成绩。
未参加室间质评活动定为不满意的EQA成绩,该次得分为0。
在规定的回报时间内实验室未能将能室间质评的结果回报给组织者,将定为不满意的EQA成绩,该次活动的得分为0。
- 还没有人留言评论。精彩留言会获得点赞!