用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与流程
本发明涉及生物工程技术领域,尤其涉及对狗肾细胞通过转基因及利用小瓶离心法快速分离流感病毒,从而获得更敏感检测效率更高的细胞产品。
背景技术:
急性呼吸道感染在全球范围都有很高的发病率和病死率,其中病毒感染在各个年龄段的人群中都是重要的病因。引起人类呼吸道感染的病毒种类繁多,至少包括7个科30多种不同的病毒。21世纪以来出现的SARS冠状病毒、人高致病性禽流感病毒,乃至2009年的新甲型H1N1流感病毒,都给临床医学和病毒学研究提出了新的、迫切的现实挑战。应对新发传染病,能否及时做出准确的实验室病原学确诊,是有效控制新发传染病疫情的关键。
作为“金标准”的病毒分离培养由于要求投入比较高、技术较为复杂、见效比较慢而没有受到同等的重视。病毒分离培养是唯一能够获得活病毒的方法,这对相关病毒的后续研究如病毒的遗传与变异的研究、致病机理的探索、药物敏感性的检测、相应疫苗的研制等等都是不可缺少的前提条件。同时也应该是上述免疫学和分子诊断技术方法赖以比较的基础。最近的典例当数现仍在进展中的新甲型流感病毒,由于新发病毒序列一时无法获得,在爆发最初WHO推荐病毒分离为最可靠手段,这也提醒我们应进一步对病毒检测方法作拓展研究。而且是否能够及时分离常见的以及新现的病毒,也是我国防治病毒性传染病综合能力的一种体现。
本发明旨在前期基础上,继续开展适用于快速病毒分离用的商品化细胞的研发和生产,瞄准当今国际上先进的细胞培养和病毒分离技术,建立新型表达干扰素负性调节基因狗肾细胞系,将极大的有利于未来在大型临床医院和CDC中推广先进的病毒快速培养做好技术准备,突发性感染病毒的分离能力将大大提高。
流感病毒的NS1蛋白是一个关键致病因子,它通过多种机制、包括双链RNA的结合和隔离来拮抗宿主的抗病毒反应。把NS1蛋白基因转染到狗肾细胞中可使流感病毒在细胞中快速繁殖。
本发明从两个方面加快流感病毒检测速度,即第一通过小瓶离心法可加快和病毒接触时间,从而快速进入胞内形成包涵体,进而复制递增。第二通过在狗肾细胞内整合流感病毒NS1蛋白基因,抑制宿主细胞抗流感病毒干扰作用,让病毒复制递增通畅无阻,加快检测效率。
技术实现要素:
本发明的在于提供一种用于快速分离及检测流感病毒的细胞产品及其制备方法。
为了实现上述目的,本发明采用了以下技术方案:用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶的制备方法,其是把流感病毒NS1基因转染到狗肾MDCK细胞中,制作狗肾细胞MDCK-NS1,然后将其接种到离心小瓶中。
进一步地来说,用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶的制备方法包括如下步骤:
(1)狗肾细胞MDCK-细胞培养;
(2)NS1基因引物设计,扩增NS1基因;
(3)构建逆转录病毒载体pBabe-puro-NS1;
(4)转化及菌落PCR挑取阳性克隆,然后测序鉴定阳性克隆;
(5)提取质粒pBabe-puro-NS1;
(6)包装产毒;
(7)收集病毒、保种;
(8)靶细胞培养;
(9)逆转录病毒感染靶细胞;
(10)筛选稳定感染细胞株,获得狗肾细胞MDCK-NS1,
(11)将狗肾细胞MDCK-NS1接种至离心小瓶中培养两天。
所述离心小瓶的细胞保存液含浓度为80μM维生素E、3.7μM番茄红素、30mM海藻糖的低糖培养基。
上述步骤(11)后在接种后的离心小瓶中加入低温保护液,4℃低温保存。
由上述任一所述的制备方法所获得的狗肾细胞MDCK-NS1的离心小瓶。从结构上来说,该离心小瓶包括一透明的管状平底离心瓶、及放置于离心瓶内的接种有狗肾细胞MDCK-NS1的玻片和压片柱,所述玻片由压片柱压紧于离心瓶瓶底。
本发明另一目的在于提供一种可快速分离及检测流感病毒的方法。
为了实现上述目的,本发明采用了以下技术方案:应用上述的狗肾细胞MDCK-NS1的离心小瓶于流感病毒快速检测中。具体来说,其包括以下步骤:
(1)制作如上任一所述的狗肾细胞MDCK-NS1的离心小瓶;
(2)对离心小瓶中的MDCK-NS1细胞感染MOI=1的甲型流感病毒,使用3000转/min离心1小时,静置24小时后观察病毒的TCID50的病毒滴度。
细胞内会产生干扰素,抑制外源微生物入侵,从而保护细胞内部结构及功能,但如果把流感病毒NS1基因转染到狗肾MDCK细胞中,细胞转染基因通过病毒做启动子,快速表 达转录翻译NS1蛋白,抑制干扰素形成,可让新进入的胞内的流感基因逆转录表达通畅无阻,从而快速复制增值。在转染NS1基因的MDCK完成后,把转基因细胞培养于离心小瓶中,通过3000转/min,离心一小时,可以做到24小时内检测出多种不同亚型的流感病毒。本发明运用小瓶离心结合转基因MDCK-NS1细胞分离培养流感病毒与传统方法比较,能获得更敏感的CPE病变与更快的检测分离结果。
附图说明
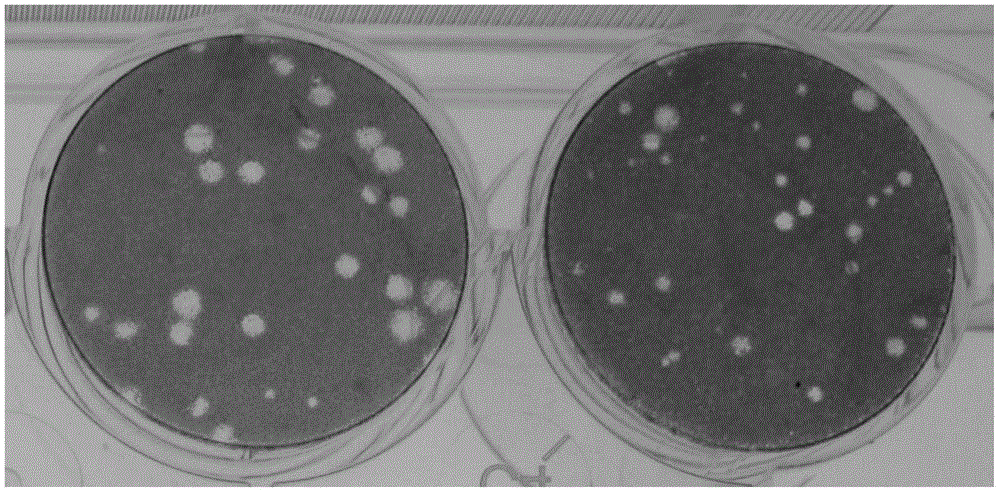
图1在12孔板中,MDCK-NS1(图左)和野生型MDCK(图右)同时感染病毒滴度为MOI=0.0001的流感病毒A/PR/8/34(H1N1),48小时后的比较接种两种细胞的空斑大小,空斑越大说明单个病毒增值速度越快。图中明显看到图左的MDCK-NS1单个病毒增值速度比图右的野生型MDCK单个病毒增值速度要快。
图2含狗肾MDCK-NS1细胞的离心小瓶的结构示意图。
具体实施方式
实施例1
本例为构建表达NS1基因的MDCK细胞系的方法。本发明所涉及的狗肾细胞MDCK NS1,于2015年5月21日提交中国.武汉.武汉大学的中国典型培养物保藏中心,其保藏编号为CCTCC NO:C201561,并于2015年5月26日检测为存活。
构建表达NS1基因的MDCK细胞系的方法包括以下步骤:
(1)MDCK细胞培养
用6孔板接种MDCK细胞,并涨至单层后用于逆转录病毒转染。
(2)流感病毒NS1基因引物设计,扩增NS1基因
引物根据GenBank收录的MDCK NS1基因序列(J02150.1)序列设计上下游引物5’端分别加EcoRI和BamHI酶切位点(下划线所示),序列如下,
NS1-F:5’-CACGCGCGCCGCCAAATGGATCCAAACACTGTGT-3,
NS1-R:5’-CGCGCTCGAGGCAAAGTGAAATGTAG-3,
(3)逆转录病毒载体构建(pBabe-puro-NS1)
以流感H1N1-PR8株的RNA为模版,采用一步法扩增NS1基因片段,扩增后用1%琼脂糖凝胶电泳鉴定和回收,纯化后与pBABE-puro载体分别用EcoRI和BamH1进行酶切,T4DNA连接酶16℃连接过夜后转化到DH5a感受态细胞中,经菌落PCR筛选阳性克隆及扩增后做双酶切鉴定测序。
(4)菌落PCR挑取阳性克隆
(5)测序鉴定
讲重组阳性克隆送于Invitrogen公司作近一步测序证实。
(6)质粒提取
(7)包装产毒(293FT细胞培养,磷酸钙共转染表达质粒和包装质粒)
鉴定正确的重组逆转录病毒载体pBABE-NS1与包装质粒PIK按1:1混合后,用磷酸钙法共转染包装细胞293FT。转染48小时后收集含完整逆转录病毒颗粒的293FT细胞上清,每3小时收集一次,共3-4次,每次收集的上清用0.45μm孔径滤器过滤,混均后取部分滤液进行病毒滴度测定。
(8)收集病毒、保种
(9)靶细胞培养(改良前MDCK细胞)
(10)逆转录病毒感染靶细胞
(11)筛选稳定感染细胞株(puro筛选稳定感染的MDCK细胞)
收获的重组逆转录病毒加入高剂量嘌呤霉素(2μg/mL),混均后加入6孔细胞培养板中的MDCK细胞中,重复感染3-4次。细胞经3-7天培养,待大部分细胞死亡后,改用含最低致死浓度嘌呤毒素(0.5μg/mL)的培养基进行维持筛选1-2周,利用有限稀释法挑取单克隆,继续对单克隆增值培养其中部分冻存,其余继续扩大培养作后续鉴定实验。同时制备转染空载体的阴性对照细胞株MDCK-mock。
(12)稳定株扩增
逆转录病毒载体系统共由两部分组成:包装细胞系(如293FT细胞)和缺陷病毒本身(逆转录病毒载体)。
在逆转录病毒载体中,去除了正常的蛋白编码序列而保留了复制和包装信号,通过分子克隆技术将目的基因插入此载体上;而包装细胞系能提供病毒载体包装成病毒粒子所需的结构蛋白。当重组病毒载体导入包装细胞后,缺陷病毒载体和包装细胞的互补作用共同完成病毒装配,该病毒颗粒可感染其他宿主细胞,此时目的基因进入该细胞并整合到细胞基因组中,导致插入序列在宿主细胞中表达,产生目的蛋白。
宿主细胞(MDCK)不能像包装细胞(293FT)那样为缺失结构基因的逆转录病毒提供结构蛋白,因而在宿主细胞内不会产生新的感染性病毒颗粒,保证了该载体的生物安全性问题。
实施例2
本例为MDCK-NS1的离心小瓶的制备方法。
将实施例1所获得的含有质粒pBaBb-puro-NS1的狗肾细胞MDCK-NS1接种至离心小瓶中,培养2天。
离心小瓶的细胞保存液含浓度为80μM维生素E、3.7μM番茄红素、30mM海藻糖的低糖培养基。
如图2所示为狗肾细胞MDCK-NS1的离心小瓶,其包括一透明的管状平底离心瓶1、瓶盖4及放置于离心瓶内的接种有狗肾细胞MDCK-NS1的玻片3和压片柱2,所述玻片3由压片柱2压紧于离心瓶1瓶底。压片柱为管状空心柱,主要用于压着圆形细胞载玻片,防止产品运输过程玻片上的细胞5脱落。瓶盖4将压片柱固定于离心瓶内。
实施例3
本例是对实施例1所获得的狗肾细胞MDCK-NS1检测其流感NS1蛋白基因。
通过实时荧光定量PCR的方法,采用Sybrgreen染料法,以β-actin为内参基因,对于流感NS1基因在MDCK细胞中的表达量进行检测。
表达量结果整理数据(见表1)。
表1
实施例4
本例是对实施例1所获得的狗肾细胞MDCK-NS1检测其流感NS1蛋白的表达。
对MDCK细胞和MDCK-NS1细胞同时感染滴度为100TCID50/0.1mL的甲型流感病毒A/PR/8/34(H1N1),感染12小时后,用细胞裂解液裂解细胞,10000转离心1分钟,去沉淀,取上清液,用于ELISA NS1蛋白检测。结果见表2。
表2
实施例5
本例是对实施例2所获得的MDCK-NS1的离心小瓶、与MDCK-NS1细胞非离心小瓶及传统MDCK细胞非离心小瓶的离心检测效率比较。
分别对长满单层细胞的MDCK细胞小瓶、MDCK-NS1细胞小瓶及实施例2中所获得的MDCK-NS1离心小瓶分别进行病毒感染,三者所使用的小瓶的瓶底面积相同。其中,实施例2中所获得的MDCK-NS1离心小瓶在感染过程使用了3000转/min离心1小时。
用于感染的病毒包括感染病毒滴度MOI=1的甲型流感病毒A/PR/8/34(H1N1)、甲型流感病毒A/HK/8/68(H3N2)、甲型流感病毒A/China/24/96(H7N3),甲型流感病毒A/HK/Y280/97(H9N2)及乙型流感病毒B/Lee/1940(FluB)。
24后小时后观察各病毒的TCID50的病毒滴度。比较三种细胞的敏感性。具体见表3。
表3
结果表明,甲型流感病毒通过转染NS1基因表达NS1蛋白的MDCK细胞敏感性要强于野生型MDCK细胞,乙型流感病毒MDCK‐NS1细胞与MDCK细胞无显著差异,而使用3000转/min离心1小时的离心小瓶MDCK-NS1细胞敏感性要强于MDCK‐NS1非离心培养感染的细胞及MDCK细胞。
本发明包括但并不限于上述实施例及附图所示的内容,其它一切与本发明的技术方案具有相同实质性内容的产品结构均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!