DC-CIK细胞的制备及其在制备治疗卵巢癌药物中的应用的制作方法
本发明涉及生物医药,具体涉及DC-CIK(树突状细胞-细胞因子诱导的杀伤细胞)细胞的制备及其在制备治疗卵巢癌药物中的应用。
背景技术:
细胞因子诱导的杀伤细胞(Cytokine-induced killer,CIK)是将人外周血单个核细胞(PBMC)在体外用多种细胞因子(抗CD3McAb、IL-2、IFN-γ、IL-1α等)共同培养一段时间后获得的一群异质细胞。其中CD3+/CD56+细胞是CIK细胞群体中主要的效应细胞,被称为NK样T淋巴细胞,兼具有T淋巴细胞强大的抗瘤活性和NK细胞的非MHC(主要组织相容性复合体)限制性杀瘤优点。树突状细胞(Dendritic cells,DC)是机体功能最强的专职抗原递呈细胞(Antigen presenting cells,APC),它能高效地摄取、加工处理和递呈抗原,未成熟DC具有较强的迁移能力,成熟DC能有效激活初始型T细胞,处于启动、调控、并维持免疫应答的中心环节。同时,成熟的DC可以通过II型组织相容性抗原(MHC-II)等途径提呈肿瘤抗原,有效抵制肿瘤细胞的免疫逃逸机制。DC联合CIK(DC-CIK)过继性免疫治疗恶性肿瘤是一种新兴的免疫治疗手段,能有效抑制和杀灭肿瘤细胞且无明显不良反应,降低肿瘤复发及转移风险,提高患者的自身免疫 力及生活质量,其安全性得到了广泛认可。已经明确DC-CIK细胞抗肿瘤作用有以下几点:一,CIK细胞可以通过不同的机制识别肿瘤细胞,释放颗粒酶/穿孔素等毒性颗粒,导致肿瘤细胞的裂解,起到直接杀伤肿瘤细胞的作用;二,CIK细胞可以分泌多种细胞因子,如IFN-γ、TNF-α、IL-2等,不仅对肿瘤细胞有直接抑制作用,还可通过调节机体免疫系统反应性间接杀伤肿瘤细胞;三,CIK细胞在培养过程中表达FasL(II型跨膜糖蛋白)通过与肿瘤细胞膜表达的Fas(I型跨膜糖蛋白)结合,诱导肿瘤细胞凋亡;四,DC-CIK可以杀伤多种肿瘤细胞且对于对多重耐药肿瘤细胞同样敏感;五,DC-CIK杀瘤活性不受CsA(环孢霉素A)和FK506(普乐可复)等免疫抑制剂的影响且对正常骨髓造血前体细胞毒性很小(约为25%)。在DC-CIK治疗手段中,DC就像“雷达”,能识别抗原,激活免疫应答。而CIK就像“导弹”,能通过发挥自身细胞毒性,分泌细胞因子,精确杀伤肿瘤细胞。因而,DC-CIK产生了一个高效的免疫系统,经诱导、增殖、活化后,再回输到患者体内,可以显著抑制肿瘤细胞的生长、增殖,帮助机体恢复同肿瘤细胞作斗争的能力,最大限度地调动人体免疫功能,全方位的防止复发和转移,明显改善患者的生活质量,有效延长生存期。
虽然,DC-CIK细胞治疗存在显著的优点,但是,尚无报道DC-CIK细胞治疗手段对肿瘤干细胞的杀伤作用;其次,异体移植DC-CIK细胞仍然存在很大的免疫排斥风险,因此,制约其临床应用。目前DC-CIK细胞来源主要是从患者静脉穿刺途径获得,但反复收集穿刺收集外周 血,对于免疫力低下的病人来说,创伤大且容易造成二次感染。目前,已发现人卵巢癌干细胞(Ovarian cancer stem cells,OCSCs)是导致卵巢癌细胞对化疗药物耐受以及产生卵巢癌易于转移、复发和预后不佳的主要原因。然而OCSCs增值侵蚀的深层机制尚不清楚,也没有有效的医疗手段进行抑制。本发明人研究发现卵巢癌病人经血中含有足量的PBMC(单个核细胞),在体外用运用IL-2和IFN-γ诱导后获得DC-CIK细胞,对肿瘤干细胞具有显著的杀伤作用,因此,宜进行研究。
技术实现要素:
本发明所要解决的技术问题在于克服上述不足之处,研究设计从卵巢癌病人经血中收集PBMC,进一步获得DC-CIK细胞,设计通过杀伤卵巢癌干细胞的治疗药物。
本发明提供了一种DC-CIK细胞的制备方法。
该方法为:从卵巢癌病人经血中收集PBMC,在体外运用IL-2和IFN-γ诱导后获得DC-CIK细胞。
具体的,该方法包括下列步骤:
(1)从卵巢癌病人经血中获得PBMC细胞:
收集卵巢癌病人的月经倒入内含抗凝液0.2ml的无菌离心管,加入等体积的PBS稀释;吸取稀释血液,加到PBMC分离液,使稀释血液叠于分层液上,保持两者界面清晰;所述稀释血液与分层液体积比例为2:1,于18℃-20℃,水平离心机以2000rpm离心20min,离心 后其中的内容物分为四层,上层为血浆内含血小板,中间层为分层液,底层为红细胞和粒细胞,在上、中层液体界面处即为乳白色混浊的PBMC层(单个核细胞薄层);吸取PBMC层液体,移入另一离心管中,加入5ml的PBS(磷酸缓冲液,购自碧云天生物技术研究所)洗涤2次,1500rpm离心10min,吸弃上清,沉淀即为PBMC细胞;
(2)IL-2和IFN-γ刺激诱导CIK增殖:
A、DC细胞制备:步骤(1)得到的PBMC细胞经过12小时IL-2100U/ml,和IFN-γ1000U/ml刺激后(每5ml反应体系中,PBMC细胞浓度为1×105/ml,IL-2用量为500U,IFN-γ用量为5000U),将PBMC细胞于DMEM+10%胎牛血清+IL-2+IFN-γ的完全培养基,37℃培养12小时,(每5ml DMEM+10%胎牛血清培养体系中,PBMC细胞浓度为1×105/ml,IL-2用量为500U,IFN-γ用量为5000U)即完成细胞刺激,得到细胞悬液,细胞悬液于1500rpm,离心5分钟,弃上清,沉淀用0.1ml的4℃PBS(磷酸缓冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD83(eBioscience)单克隆抗体,一并混匀至反应终浓度为0.01mg/ml,于4℃避光反应30分钟;在原有的细胞悬液中再加入0.4ml PBS(磷酸缓冲液),流式细胞仪分选操作(Flow Cytometric,BD FACS Aria,BD Bioscience,CA,USA),即可获得纯化的CD83+的DC细胞,即DC细胞;(CD83是DC细胞的标志物,CD83+的DC简称为DC细胞)
B、CIK细胞的制备:用与步骤A相同方法得到细胞悬液于1500rpm,离心5分钟,弃上清,沉淀用0.1ml的4℃PBS(磷酸缓 冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD3抗体和4μl碘化丙啶标记的鼠抗人CD56抗体(eBioscience),一并混匀(至反应终浓度为0.01mg/ml),于4℃避光反应30分钟,将细胞悬液0.5ml,进行流式细胞仪分选操作(Flow Cytometric,BD FACS Aria,BD Bioscience,CA,USA),即可获得纯化的CD3+/CD56+CIK细胞,即CIK细胞;(CD3+/CD56+是CIK细胞的标志物,CD3+/CD56+的CIK简称为CIK细胞)
C、将上述步骤A获得的DC细胞与步骤B获得的CIK细胞以1:1比例混合,即为DC-CIK细胞。
本发明的另一目的是提供了DC-CIK细胞在制备治疗卵巢癌干细胞药物中的应用。
本发明通过ELISA检测结果提示,DC-CIK细胞在体外培养过程中,要比单独培养CIK细胞释放更多的杀伤肿瘤细胞的因子。并且应用检测OCSCs(卵巢癌肿瘤干细胞)细胞增值抑制率来检测各种组合对该肿瘤干细胞的细胞毒性(杀伤效率)。实验结果表明,在同一种细胞浓度比例组合下,DC-CIK细胞对OCSCs的细胞毒性最强、杀伤效率最高。证明本发明DC-CIK细胞可以用于制备杀伤卵巢癌干细胞的药物。
本发明所述药物为由DC-CIK细胞作为活性成分与药用辅料组成的药物组合物。
本发明所述药物组合物为口服制剂或注射剂。
本发明提供的DC-CIK细胞的制备方法有以下显著优点:
(1)卵巢癌病人经血中含有足量的PBMC,在体外用运用IL-2和IFN-γ诱导后,获得的DC-CIK细胞对卵巢癌病人自体来源的肿瘤干细胞具有显著的杀伤作用(细胞毒性显著);
(2)通过本发明方法制备的DC-CIK细胞不仅效率不会下降,而且完全无创伤性;
(3)本发明方法可以方便地以卵巢癌病人经血制备获得DC-CIK细胞用于杀伤肿瘤干细胞。
本发明为治疗卵巢癌提供了新的途径,为临床治疗卵巢癌提供了新的药物,有较好的应用前景,有较大的社会效益。
附图说明
图1实施例2.IL-2和IFN-γ刺激诱导CD3+/CD56+CIK增殖。
图中,黑色柱状图为诱导后CIK细胞数,无色柱状图为未诱导的CIK细胞数;横坐标为诱导分组(诱导后组、未诱导组),纵坐标为细胞数(×102/ml)。
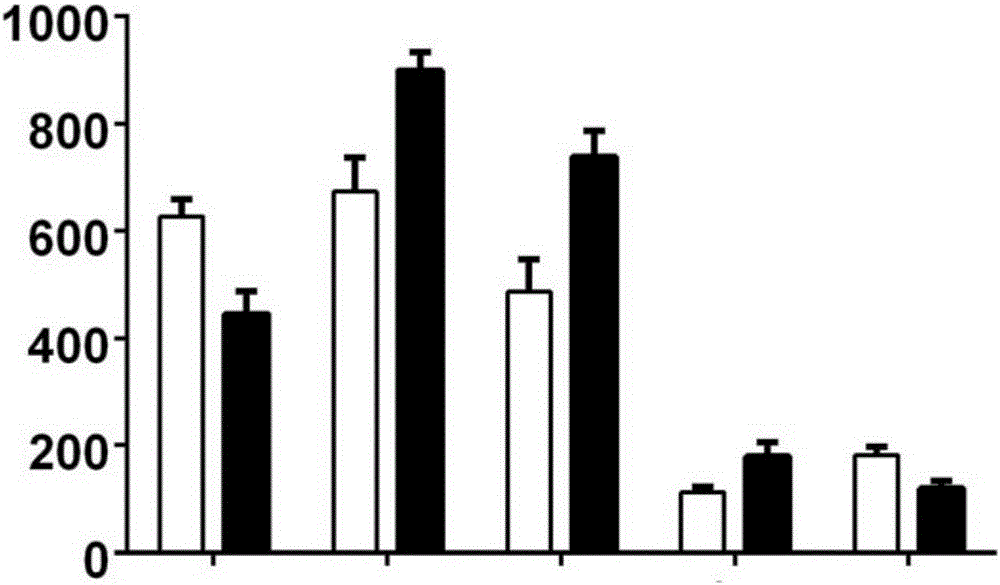
图2实施例3.DC-CIK在体外培养中释放多种肿瘤杀伤因子。
图中,黑色柱状图为诱导后DC-CIK组,灰色柱状图为CIK组;横坐标为细胞因子(从左到右依次为TGF-β、INF-γ、TNF-α、IL-2和IL-10),纵坐标为细胞释放因子浓度(pg/ml)。
图3实施例4.DC-CIK在体外对OCSCs具有典型的细胞毒性。
图中,左上角为1:1细胞数混合;右上角为5:1细胞数混合;左下角为10:1细胞数混合;右下角为50:1细胞数混合;各图中,横坐 标为细胞混合分组(从左到右依次为OCSCs组、DC-OCSCs组、CIK-OCSCs组和DC-CIK-OCSCs组),纵坐标为细胞毒性抑制率(%)。
具体实施方式
以下实施例涉及的卵巢癌病人病例均来自于上海市浦东新区公利医院(2014年2月-2015年4月)
实施例1.
(1)从病人经血中获得PBMC细胞:
分别收集6个卵巢癌病人(病人情况见表1)的10ml月经,通过梯度密度离心方法收集离心液中间层细胞:用6支肝素钠抗凝管(内含抗凝液0.2ml)收集月经血总量达10ml左右,颠倒混匀,4℃放置不超过4小时;取6支无菌的15ml离心管,分别加入冰预冷的人淋巴细胞分离液(碧云天生物技术研究所)各8ml,然后小心的在其上面沿管壁滴加月经血(每管6ml);趁血液未完全渗透到分离液液面下方前,以4℃,水平离心机以1500r/min,离心15min,离心后其中的内容物分为四层,上层为血浆(内含血小板),中间层为分层液,底层为红细胞和粒细胞,在上、中层液体界面处乳白色混浊的PBMC(单个核细胞薄)层;用毛细血管吸取单个核细胞,移入另一离心管中,加入5ml的PBS洗涤2次,1500rpm离心10min,吸弃上清,沉淀即为PBMC细胞(5×104/ml)。
(2)IL-2和IFN-γ刺激诱导CIK增殖:
A、DC细胞制备:步骤(1)利用2ml DMEM细胞培养基(内含10%胎 牛血清)重悬PBMC细胞(5×104/ml),同时加入20μl的IL-2(终浓度100U/ml)以及20μl IFN-γ(终浓度1000U/ml),培养于25cm2细胞培养瓶中12小时(37℃),即完成细胞刺激。并加入4μl异硫氰酸胍标记的兔抗人CD83(eBioscience)单克隆抗体,混匀(至反应终浓度为0.01mg/ml),于4℃避光反应30分钟;反应完毕,细胞悬液加入1ml冰预冷无菌的PBS,并且颠倒混匀数次,于4℃,1500r/min,离心5min;离心完毕,弃上清,细胞沉淀加入1ml冰预冷无菌的PBS,并且吹打混匀,进行流式细胞仪分选操作(Flow Cytometric,BD FACS Aria,BD Bioscience,CA,USA),开启FL1通道分选模式,并且调节补偿,收集CD83-FITC+的细胞亚群;最终,可以获得500μl纯化的DC细胞(5×103/ml)。
B、得到CIK细胞的方法:
取从上述步骤(1)卵巢癌病人经血中获得的PBMC细胞1ml(5×104/ml)于1500rpm,离心5分钟,弃上清,细胞沉淀(5×104)用0.1ml的4℃PBS(磷酸缓冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD3抗体和4μl碘化丙啶标记的鼠抗人CD56抗体(eBioscience),一并混匀(至反应终浓度为0.01mg/ml),于4℃避光反应30分钟;反应完毕,细胞悬液加入1ml冰预冷无菌的PBS,并且颠倒混匀数次,于4℃,1500r/min,离心5min;离心完毕,弃上清,细胞沉淀加入1ml冰预冷无菌的PBS,并且吹打混匀,进行流式细胞仪分选操作(Flow Cytometric,BD FACS Aria,BD Bioscience,CA,USA),开启FL1/FL2双通道分选模式,并且调节补偿,收集CD3-FITC+/CD56-PI+双阳性细胞亚群;最终,可以获得500μl纯化的CIK细胞(为2×103/ml)。
将上述步骤A获得的0.5ml DC细胞(2×103/ml)与步骤B获得的0.5ml CIK细胞(2×103/ml)以1:1比例加入到无菌的15ml离心管内混合,即为DC-CIK细胞(最终体积为1ml,最终细胞数量为4×103/ml)。
表1卵巢癌病人特征
表2卵巢癌病人经血来源PBMC细胞总数
表2为卵巢癌病人经血来源PBMC细胞总数。
取10ul步骤(1)从卵巢癌病人经血中获得PBMC细胞,用1.0ml瑞氏染液染色1分钟后,滴入血球计数板(XB.K.25,上海求精生化试剂仪器),于显微镜下计数得细胞总数在5×105/ml左右,显著低于正常人的数量,推测是由于卵巢癌导致免疫低下的缘故。
实施例2.IL-2和IFN-γ刺激诱导CIK增殖:
实施例1所有病人经血来源的PBMC细胞同上述操作,将PBMC细胞培养于DMEM+10%胎牛血清+IL-2+IFN-γ的完全培养基中12小时,即完成细胞刺激实验,流式细胞术检测:于1500rpm,离心5分钟,弃上清,沉淀用0.1ml的4℃PBS(磷酸缓冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD83(eBioscience)单克隆抗体,一并混匀(至反应终浓度为0.01mg/ml),于4℃避光反应30分钟;在原有的细胞悬液中再加入0.4ml PBS(磷酸缓冲液),将细胞悬液体积控制在0.5ml,然后利用流式细胞仪检测CD3+/CD56+双阳性细胞比例,FC 500三色通道分析性流式细胞仪,贝克曼库尔特生物仪器公司)结果提示,500μl CD3+/CD56+双阳性的PBSC即为CIK细胞(为2×103/ml)。其CIK数量均显著高于未刺激组细胞的数量,并存在显著的统计学差异(p<0.01,n=6),实验结果表明,利用IL-2和IFN-γ 刺激成功在体外诱导经血来源的CIK增殖(图1)。
确定CIK的方法:分别用FITC标记的抗人CD3抗体和PE标记的抗人CD56抗体与PBMC细胞在4℃下共孵育30分钟,然后利用流式细胞仪检测CD3+/CD56+双阳性细胞数量,此细胞群即为CIK细胞。
DC细胞制备:同上述实施例1操作,PBMC细胞5×104/ml经过12小时IL-2100U/ml,和IFN-γ1000U/ml刺激后,将PBMC细胞(5×104/ml,200μg)培养于4ml DMEM+10%胎牛血清+IL-2+IFN-γ的完全培养基接种于25cm2细胞培养瓶中12小时(37℃),即完成细胞刺激,得到细胞悬液,细胞悬液于1500rpm,离心5分钟,弃上清,沉淀用0.1ml的4℃PBS(磷酸缓冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD83(eBioscience)单克隆抗体,一并混匀至反应终浓度为0.01mg/ml,于4℃避光反应30分钟;在原有的细胞悬液中再加入0.4ml PBS(磷酸缓冲液),流式细胞仪分选操作(Flow Cytometric,BD FACS Aria,BD Bioscience,CA,USA),即可获得纯化的CD83+的DC细胞,即DC细胞(100μg;5×103/ml)(CD83是DC细胞的标志物,CD83+的DC简称为DC细胞)。
确定DC的方法:PBMC细胞悬液于1500rpm,离心5分钟,弃上清,沉淀用0.1ml的4℃PBS(磷酸缓冲液)重悬,并加入4μl异硫氰酸胍标记的兔抗人CD83(eBioscience)单克隆抗体,一并混匀(至反应终浓度为0.01mg/ml),于4℃避光反应30分钟;在原有的细胞悬液中再加入0.4ml PBS(磷酸缓冲液),将细胞悬液体积控制在0.5ml,然后利用流式细胞仪检测CD83+细胞数量,此细胞群即 为DC细胞。
将CD3+/CD56+双阳性细胞数和CD83+阳性细胞数相加,即为DC-CIK细胞数量。(200μg)
(通过流式细胞仪将CD83+、CD3+/CD56+的细胞分选出来,参考文献:[1]Shan CC,Shi LR,Ding MQ,Zhu YB,Li XD,Xu B,Jiang JT,Wu CP.Cytokine-induced killer cells co-cultured with dendritic cells loaded with the protein lysate produced by radiofrequency ablation induce a specific antitumor response.Oncol Lett.2015Apr;9(4):1549-1556.
[2]Yang L,Ren B,Li H,Yu J,Cao S,Hao X,Ren X.Enhanced antitumor effects of DC-activated CIKs to chemotherapy treatment in a single cohort of advanced non-small-cell lung cancer patients.ancer Immunol Immunother.2013Jan;62(1):65-73.)
实施例3.DC-CIK细胞在体外培养中释放多种肿瘤杀伤因子:
用实施例2得到的DC-CIK细胞(1×104/ml)1500rpm离心5分钟,收集各组细胞沉淀,根据TGF-β、IL-2、IL-10、TNF-α和INF-γELISA kit(酶联免疫吸附检验试剂盒,武汉博士德生物科技有限公司)的描述来进行检测。各组细胞用蛋白抽提液(碧云天生物公司)裂解后,取100μl总蛋白上清液,分别加入预先包被的96孔检测板中,于37℃孵育60分钟。同时,按照说明书的要求加入梯度稀释后的标准品蛋白,于37℃孵育60分钟。反应完成后,弃液体,利用清洗液洗板3次,加入HRP标记的检测抗体于37℃孵育60分钟。随后,加入反应终止液。96孔板在波长450nm处测定吸光度。
ELISA(酶联免疫吸附检验)检测(使用酶标仪在450nm处测定吸光度,Biotek酶标仪,SynergyH4,美国biotek生化仪器公司)结果提示,DC-CIK细胞在体外培养过程中,要比单独培养CIK细胞释放更多的杀伤肿瘤细胞的因子,且存在显著的统计学差异(p<0.05,n=6)(图2)。
实施例4.DC-CIK在体外对OCSCs具有典型的细胞毒性:
将(实施例2)的DC-CIK细胞与OCSCs(6个卵巢癌病人行手术切除卵巢癌组织10g(表1中的病人卵巢癌组织样本),本实验将手术切下的卵巢癌组织收集在无菌离心管中,用0.25%胰酶10ml消化成单细胞悬液,每100μL卵巢癌细胞悬液加入4μL的CD44(兔抗人CD44-PE,eBioscience公司)和CD117单克隆抗体(小鼠抗人CD117-FITC,eBioscience公司),细胞于4℃条件下孵育30分钟,反应结束后,用磷酸盐缓冲液(PBS)清洗1次,然后用流式细胞仪(BD FACS Aria,BD Bioscience,CA,USA)分离CD44+/CD117+的OCSCs细胞亚群)共培养,以DC-CIK细胞为效应细胞,OCSCs为靶细胞,效应细胞与靶细胞之间的比例为A1:1,B5:1,C10:1,D50:1。将DC-CIK细胞和OCSCs细胞分别以下列体系在15ml无菌离心管中混匀(A组:1ml DC-CIK细胞(浓度为5×104个)加上1ml OCSCs细胞混匀(浓度为5×104个);B组:1ml DC-CIK细胞(浓度为2.5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个);C组:1ml DC-CIK细胞(浓度为5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个);D组: 1ml DC-CIK细胞(浓度为2.5×106个)加上1ml OCSCs细胞混匀(浓度为5×104个)),细胞混悬液于37℃,5%CO2环境下培养24小时,加入MTT试剂(噻唑兰)100μl(碧云天生物科技有限公司),继续培养4小时,弃培养液,每孔加入150微升二甲基亚砜,置摇床上低速振荡10分钟,使结晶物充分溶解。在酶标仪上读出OD=490nm处的吸光值。按照公式:杀伤率(%)=[1-(效应细胞OD490吸光度值/靶细胞OD490吸光度值)]×100%,计算杀伤率。
在体外,将效应细胞(DC-CIK细胞或者单纯的CIK细胞)与靶细胞(OCSCs细胞)之间的比例为A1:1,B5:1,C10:1,D50:1;将DC-CIK细胞或CIK细胞和OCSCs细胞分别以下列体系在15ml无菌离心管中混匀(A组:1ml DC-CIK细胞(浓度为5×104个)加上1ml OCSCs细胞混匀(浓度为5×104个)以及1ml CIK细胞(浓度为5×104个)加上1ml OCSCs细胞混匀(浓度为5×104个);B组:1ml DC-CIK细胞(浓度为2.5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个)以及1ml CIK细胞(浓度为2.5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个);C组:1ml DC-CIK细胞(浓度为5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个)以及1ml CIK细胞(浓度为5×105个)加上1ml OCSCs细胞混匀(浓度为5×104个);D组:1ml DC-CIK细胞(浓度为2.5×106个)加上1ml OCSCs细胞混匀(浓度为5×104个)以及1ml CIK细胞(浓度为2.5×106个)加上1ml OCSCs细胞混匀(浓度为5×104个))细胞混悬液于37℃,5%CO2环境下培养24小时,),通过检测(使用酶标仪在490nm处测定吸光度,Biotek 酶标仪,SynergyH4,美国biotek生化仪器公司)OCSCs细胞增值抑制率来检测各种组合对该肿瘤干细胞的细胞毒性(杀伤效率)。实验结果表明,在同一种细胞浓度比例组合下,DC-CIK对OCSCs的细胞毒性最强、杀伤效率最高(p<0.05,n=6);而随着DC-CIK细胞浓度的增加,其细胞毒性和杀伤效率也增加(图3)。
- 还没有人留言评论。精彩留言会获得点赞!