提升耐温性的纤维素酶的制作方法
本发明涉及一种纤维素酶,尤指一种提升耐温性的纤维素酶。
背景技术:
纤维素是植物细胞壁的主要组成之一,也是地球上主要生物质能(biomass)的来源,因此,现今许多能够有效分解纤维素的酶蛋白在不同工业上的应用也十分广泛。纤维素是由葡萄糖为单位,以β-1,4-糖苷键(β-1,4-glycosidic bond)所键结而成的长链多糖,这些多糖体共同组织排列成紧密的结晶型纤维素,进而抵抗外界的分解作用。然而,生物界中许多草食动物以及微生物等需要藉由将植物细胞壁中的多糖纤维素分解成可以被体内吸收的葡萄单糖,以作为生存能量来源。纤维素酶的催化机制主要是藉由酸碱反应,将连接两个单糖的β-1,4-糖苷键进行水解作用,进而分解多糖纤维素。而纤维素酶基本上可分成三类,分别为内切葡聚糖酶(endo-glucanase)、外切葡聚糖酶(cellobiohydrolase)以及葡萄糖苷酶(β-glucosidase)。内切葡聚糖酶能够随机地将长链纤维素切成许多小片段的寡糖;而外切葡聚糖酶则可从长链纤维素的还原端或非还原端进行分解,其主要产物为纤维二糖;至于葡萄糖苷酶则可把纤维二糖分解为单糖的葡萄糖。
纤维素酶在工业上的应用十分广泛,不论是在食品、饲料或纺织业,甚至可运用到现在最受关注的生物质能源。针对不同工业的应用,纤维素酶也需有符合其不同的适用条件与范围。举例而言:饲料工业上适合偏酸性以及耐温的酶蛋白,然而纺织工业上则是偏好偏碱性的纤维素酶。因此,能够找出更加符合不同工业上所需的酶蛋白也是目前不论是学术或产业界都在努力的目标。目前在许多相关的研究中,为了得到更佳的酶,除了在自然界中筛选出来之外,就是将现有的酶蛋白加以改造。现今主要有两大改造策略,其一是随机突变或是将酶基因随机排列,再于特定的作用条件之下,筛选出更符合其作用条件的酶蛋白。此策略的好处是无须深入研究酶的结构或作用机 制,而是直接在特定的条件下随机去找出更好的酶蛋白;然而,其缺点即是需要大量的人力以及时间去进行大量筛选或是要有很好的大量筛选方法来配合。另一种改造策略则是藉由研究酶结构与作用机制以找出对于酶活性或特性具有关键性的氨基酸,并针对这些特定氨基酸进行突变并测试,进而得到功能性更强的改造酶蛋白。此优点是不需花费时间与人力在大量突变与筛选的步骤,但需要先了解此酶的蛋白结构以及其作用机制,才能找出具改造潜力的特定氨基酸。
不同的工业制程需要符合其不同作用环境的酶蛋白来配合且参与。即便纤维素酶在工业上被广泛应用已久,然而许多工业用酶是从嗜常温菌,如里式木霉(Trichoderma reesei)所筛选出来的,因此耐热性也较差。另一方面,耐热性纤维素酶能够有效地应用于需要高温作用环境的产业上,包含啤酒制成或是生质能源工业等。具耐热性的蛋白相对地其蛋白稳定度也会较高,因此能够在高温环境中稳定存在,甚至作用地更好。不论是在作用环境或是后段处理过程中,也不需担心会因为高温而破坏了酶蛋白本身。此外,酶蛋白的活性也是改良工业酶的一大重点,酶活性愈高就代表成本的下降以及利润的提高。
根据文献研究,双硫键有助于蛋白结构的稳定以及提升耐热性。里式木霉具有许多种纤维素酶,其中属GH family 5的Cel5A纤维素酶,其蛋白结构(ID 3QR3)在2011年发表,结构内部具有四个双硫键位置在C16-C22、C92-C99、C232-C2683以及C273-C323,因此具有较高的溶解温度(Tm值),另外,Cel5A的结构呈现α/β TIM barrel的结构类型(Toni M Lee,Mary F Farrow,Frances H Arnold,and Stephen L Mayo.(2011)Protein Structure Report,nov27;20(11):1935-40.)。而在2004年Simon R.Andrews等人研究发现,Cellvibrio japonicas木聚糖酶蛋白CjXyn10A与Cellvibrio mixtus的CmXyn10B,在其N端与C端增加双硫键键接,能够进一步稳定结构进而提升温度的耐受性,而CjXyn10A与CmXyn 10B其结构也是属于α/β TIM barrel型态(Andrews S.R.,Taylor E.J.,Pell G.,Vincent F.,Ducros V.M.,Davies G.J.,Lakey J.H.,and Gilbert H.J.,(2004)J.Biol.Chem.Dec24;279(52):54369-79.)。
因此,本发明欲藉由改造基因以增加纤维素酶的双硫键键接,藉此提升 纤维素酶对于温度的耐受性,以有效增加纤维素酶在工业上应用的产业价值。
技术实现要素:
本发明的目的在于改造现有纤维素酶,利用结构分析及点突变技术,增加纤维素酶的双硫键键接,以有效提升纤维素酶的耐温性,进而增加纤维素酶的工业应用价值。
为达上述目的,本发明的一个较广义实施方式提供一种纤维素酶,其氨基酸序列是将序列编号2的N端加上半胱氨酸(Cysteine),以及在C端加上甘氨酸(Glycine)及半胱氨酸(Cysteine)或是加上脯氨酸(Proline)及半胱氨酸(Cysteine)的序列。其中编码该序列编号2的基因是从里式木霉(Trichoderma reesei)所分离出来并经优化的基因。
在一实施例中,该纤维素酶的氨基酸序列是序列编号4的氨基酸序列。
在一实施例中,该纤维素酶的氨基酸序列是序列编号6的氨基酸序列。
又,本发明的另一个较广义实施方式提供一种编码该纤维素酶的核酸分子及包含该核酸分子的重组质粒。
附图说明
图1显示WT纤维素酶的核苷酸序列以及氨基酸序列。
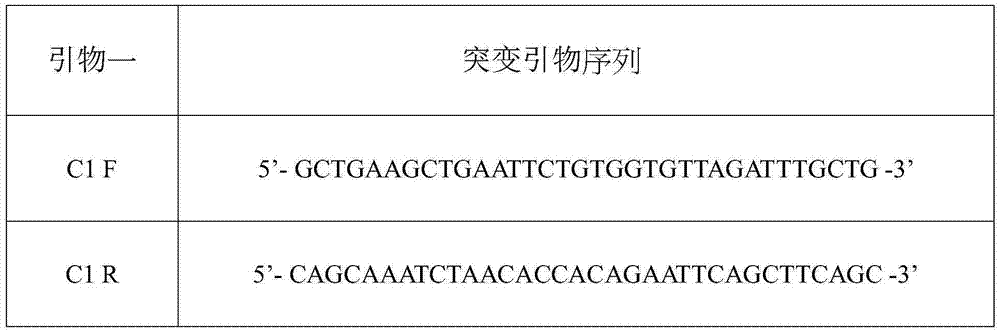
图2显示引物一的突变引物序列。
图3显示引物二的突变引物序列。
图4显示引物三的突变引物序列。
图5显示改造后的CGC纤维素酶的核苷酸序列以及氨基酸序列。
图6显示改造后的CPC纤维素酶的核苷酸序列以及氨基酸序列。
图7显示WT纤维素酶与CGC纤维素酶及CPC纤维素酶两种突变蛋白的耐温性分析。
图8显示评估双硫键接的SDS-PAGE电泳分析。
具体实施方式
体现本发明特征与优点的一些典型实施例将在后段的说明中详细叙述。应理解的是本发明能够在不同的实施方式上具有各种的变化,其皆不脱离本 发明的范围,且其中的说明及图示在本质上应当作说明之用,而非用以限制本发明。
本发明采用的纤维素酶是从里式木霉(Trichoderma reesei)菌株中所分离出来的基因,并经优化且去除N端91个氨基酸的序列,以提升其蛋白表达能力。此基因未经突变处理,故以野生型纤维素酶称之(以下简称WT纤维素酶)。前述WT纤维素酶的两端是以EcoRI与NotI限制酶位置衔接在pPICZαA载体上,并进行定序及蛋白表达。图1即显示WT纤维素酶的核苷酸序列以及氨基酸序列,其中,WT纤维素酶基因包含984个碱基(含终止密码子,核苷酸序列以序列编号1标示)以及327个氨基酸(氨基酸序列以序列编号2标示)。
进一步利用PyMOL软件分析结构,发现WT纤维素酶的N端与C端之间空间距离约大于形成双硫键的距离。因此,本发明尝试将N端与C端两端各加上一个Cysteine(半胱氨酸)之外,更在C端Cysteine前增加一个分子较小的Glycine(甘氨酸)或是让长链产生角度偏转的Proline(脯氨酸),来减少N端与C端的空间距离而产生双硫键相接,藉此稳定蛋白的N端与C端,进而提升蛋白的耐温性。换言之,本发明进行两种突变改造,其中第一种突变改造是在WT纤维素酶的N端加上Cysteine及在C端加上Glycine及Cysteine,第二种突变改造是在WT纤维素酶的N端加上Cysteine及在C端加上Proline及Cysteine。改造后的蛋白包含330个氨基酸,N端的Cysteine位于氨基酸序列的第1个位置,C端的Glycine或Proline位于氨基酸序列的第329个位置,C端的Cysteine则位于氨基酸序列的第330个位置,故本发明的第一种突变改造以C1G329C330表示,简称CGC纤维素酶,而第二种突变改造以C1P329C330表示,简称CPC纤维素酶。
以下将详述本发明改造纤维素酶的方法及其所得到的改良纤维素酶。
本发明运用点突变技术进行突变改造。首先,使用引物一(如图2所示)于纤维素酶N端增加Cysteine之后,再利用引物二(如图3所示)于纤维素酶C端增加Glycine与Cysteine,得到C1G329C330(CGC)的改造基因,接着再运用引物三(如图4所示),将C1G329C330改造基因的第329个氨基酸Glycine点突变为Proline,得到C1P329C330(CPC)的改造基因。图5即显示改造后的CGC纤维素酶的核苷酸序列以及氨基酸序列,其中,CGC纤维素酶基因 包含993个碱基(含终止密码子,核苷酸序列以序列编号3标示)以及330个氨基酸(氨基酸序列以序列编号4标示)。图6则显示改造后的CPC纤维素酶的核苷酸序列以及氨基酸序列,其中,CPC纤维素酶基因包含993个碱基(含终止密码子,核苷酸序列以序列编号5标示)以及330个氨基酸(氨基酸序列以序列编号6标示)。
将两种突变改造的DNA质粒使用Pme I限制酶进行线性化之后,以电转(electroporation)方式送入酵母Pichia pastoris X33,然后将转型后的菌液涂到含有100μg/ml zeocin抗生素的YPD平板上,放置于30℃的培养箱进行两天的培养。之后挑选单一菌落至5ml YPD于30℃培养,再接种到50ml BMGY中30℃培养一天;接下来将菌体换至20ml的BMMY进行四天的诱导蛋白表达。每24小时取样并加0.5%甲醇,菌液以3500rpm转速离心并收取上清液,进行蛋白量测量及纤维素酶活性测定。
纤维素酶的活性测试方式是取1%羧甲基纤维素(Carboxymethyl cellulose,CMC,pH 4.8,0.05M柠檬酸钠)0.2ml与适当浓度的纤维素酶蛋白液(稀释缓冲液为0.05M柠檬酸钠;pH 4.8)0.2ml,混合均匀后在50℃下作用15分钟,接着加入1.2ml的1%DNS并于100℃沸水中煮沸5分钟以停止反应且呈色,然后在冷水中降温10分钟,在OD540波长测定吸光值,再换算成酶活性单位(unit)。其中,酶活性的标准曲线是由葡萄糖标准溶液0-0.35μg/ml之间制定,而1unit的定义为每分钟释放1μmole产物所需的酶蛋白量。
耐温测试则是将适当浓度的纤维素酶蛋白液(稀释缓冲液为0.05M柠檬酸钠;pH 4.8)放置在不同温度下处理2分钟,取出后放置在4℃降温10分钟再放置室温回温10分钟,之后再进行50℃的酶活性检测,以没有经过热处理的酶蛋白样本作为100%对照,分别计算出经过热处理后的相对残留活性百分比。
图7显示WT纤维素酶与CGC纤维素酶及CPC纤维素酶两种突变蛋白的耐温性分析,其中未经热处理的样本的纤维素酶活性设定为100%。由图7结果可知,在75℃、80℃以及85℃处理2分钟后,CPC纤维素酶的相对残留活性为94%、70%以及74%,CGC纤维素酶的相对残留活性为93%、68%以及75%,两者远高于WT纤维素酶的66%、35%以及43%。换言之,CGC纤维素酶及CPC纤维素酶两种突变蛋白在不同温度下处理2分钟后的残留活 性皆高于WT纤维素酶原始蛋白,故具有较高的耐温性,也表示具有较大潜力的工业应用价值。
另一方面,本发明亦针对突变蛋白进行双硫键的评估试验。将适当浓度的CGC纤维素酶及CPC纤维素酶两种突变蛋白以及WT纤维素酶原始蛋白液添加10mM dithiothreitol(DTT),进行12.5%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),初步分析突变蛋白是否具有双硫键接。
图8显示评估双硫键接的SDS-PAGE电泳分析,其是运用DTT使蛋白结构里的双硫键断裂,并观察蛋白在电泳胶体中的移动速度。由图8结果发现,添加DTT后的CGC纤维素酶突变蛋白与添加DTT的WT纤维素酶原始蛋白的分子量与大小相当,而未添加DTT的CGC纤维素酶突变蛋白位置远低于未添加DTT的WT纤维素酶原始蛋白,表示CGC纤维素酶突变蛋白产生较多的双硫键接导致蛋白分子空间缩小,在电泳胶体中的移动速度较没有增加双硫键的原始蛋白来的快。
综上所述,为了增加纤维素酶的工业应用价值,本发明藉由逻辑性的突变设计,使N端与C端产生双硫键稳定蛋白结构来提升纤维素酶的耐温性。在本发明的两种突变设计中,第一种是在WT纤维素酶的N端加上Cysteine及在C端加上Glycine及Cysteine,得到CGC纤维素酶;第二种则是在WT纤维素酶的N端加上Cysteine及在C端加上Proline及Cysteine,得到CPC纤维素酶。根据耐温测试结果可知,CGC纤维素酶及CPC纤维素酶两种突变蛋白相较于WT纤维素酶原始蛋白,对于高温的耐受性更佳,故在面临温度的冲击时能更稳定并能降低其生产成本,可有效增加纤维素酶在工业上应用的产业价值。
纵使本发明已由上述实施例详细叙述而可由熟悉本技艺人士任施匠思而为诸般修饰,然皆不脱如附申请专利范围所欲保护者。
- 还没有人留言评论。精彩留言会获得点赞!